Method Article
עובר עוף כמודל in vivo להחייאת פתוגנים ברי קיימא אך לא ניתנים לתרבות
In This Article
Summary
שיטה זו מציגה את עובר התרנגולת כמודל פשוט וחסכוני in vivo להחייאת הפתוגן החיידקי L. monocytogenes ממצב בר-קיימא אך לא ניתן לתרבות (VBNC) ועם שימושים נוספים פוטנציאליים בהבנת מנגנוני תרדמת חיידקים.
Abstract
עובר התרנגולת התגלה כמודל in vivo פופולרי עם יישום הולך וגובר במחקר ביו-רפואי בשל פשטותו, סבירותו ויכולת ההסתגלות שלו בחקר תופעות ביולוגיות שונות. המודל הזה שימש לחקירת פתוגניות מיקרוביאלית והופך לכלי שימושי לחקר תרדמת חיידקים. מצב בר-קיימא אך לא ניתן לתרבות (VBNC) הוא מצב רדום שבו חיידקים הופכים שקטים מבחינה מטבולית ועמידים לגידול כדי לשמר את כדאיותם בסביבות קשות. בתנאים נוחים, חיידקי VBNC יכולים להתעורר בחזרה למצב פעיל מטבולית וניתן לתרבית. פתוגנים חיידקיים העוברים למצב VBNC, כגון ליסטריה מונוציטוגנס הגורמת לליסטריוזיס הנישאת במזון, מהווים דאגה לבריאות הציבור, מכיוון שהם חומקים מזיהוי בשיטות קונבנציונליות תלויות גדילה ויכולים לשחזר את האלימות שלהם עם התחייה. זה מעודד הבנה טובה יותר של התנאים והמנגנונים המניעים את התחייה של פתוגנים VBNC. השיטה המוצגת כאן מציגה את עובר התרנגולת כמודל יעיל in vivo להחייאת VBNC L. monocytogenes בחזרה למצב תרבותי. כאשר ניסיונות החייאה במבחנה , המבוססים בעיקר על חידוש תזונתי, לא היו פרודוקטיביים, פרוטוקול זה מצליח לקדם הפעלה מחדש של צורות VBNC חסרות דופן התא של L. monocytogenes הנוצרות על ידי רעב במים מינרליים. חשוב לציין, התוצאות שהתקבלו מדגישות את דרישת העובר להחייאת VBNC L. monocytogenes, מה שמעיד על תפקיד חשוב של גורמים הקשורים לעובר בתהליך זה. שימושים פוטנציאליים נוספים לשיטה זו כוללים סינון וזיהוי של גורמים חיידקיים המעורבים במנגנונים של החייאת מצב VBNC. מודל זה יכול לספק תובנה לגבי הפעולה המולקולרית של תרדמת חיידקים, שהידע שלהם קריטי להפחתת הסיכונים לבריאות הציבור הכרוכים בפתוגנים בלתי ניתנים לגילוי.
Introduction
בחיפוש אחר מודלים חלופיים למחקר in vivo, עם עלויות נלוות מופחתות ושיקולים לוגיסטיים ואתיים, עובר התרנגולת הופיע והפך במהירות לאחת ממערכות מודל החולייתנים הישימים, הניתנים לניהול והניתנים לשחזור in vivo 1,2. בהשוואה למודלים אחרים של בעלי חיים, כגון מכרסמים וארנבות, ביצי תרנגולות מופרות אינן זולות להשגה ואינן דורשות לוגיסטיקה מורכבת של דיור לפיתוחן. יתר על כן, גודל ביצת התרנגולת מאפשר טיפול בעוברים רבים במקביל, ותומך במספר רב של תנאים/קבוצות ניסוי וחזרות. משך האמבריוגנזה הקצר (21 יום) והפשטות של גישה והתבוננות בעובר ובמבנים הקשורים אליו בכל נקודה של תקופת ההתפתחות הופכים את המודל הזה לשימושי במגוון תחומים, כגון ביולוגיה התפתחותית (למשל, היווצרות לב ומוח)3,4 ופרמקולוגיה (בדיקת פעילות תרופות, אספקה ורעילות)1,5, 6. בנוסף, מערכת החיסון הלא בשלה של עובר התרנגולת הופכת אותו למערכת מתאימה למחקרים מבוססי חיסון ולגישות הקשורות לחקר הסרטן7. חשוב לציין, בגלל האופי העוברי של מודל זה, שרוכש מערכת נוסיספטיבית בוגרת רק ביום ההתפתחותי 13-148, יישומי מחקר שנערכו במסגרת זמן זו אינם מוגבלים על ידי שיקולים משפטיים ואתיים7.
מודל עוברי התרנגולות נמצא בשימוש נרחב גם לחקר הפתוגניות של חיידקים הגורמים למחלות בבני אדם ויונקים אחרים. ואכן, מחקרים רבים חקרו ואימתו את המודל הזה כדי לחקור את האלימות של פרוטוזואן (למשל, Neospora caninum, Eimeria tenella, Cryptosporidium spp.)9,10,11, פטריות (למשל, קנדידה אלביקנס, אספרגילוס פומיגאטוס)12,13, ומיני חיידקים (למשל, Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22, כמו גם לבדיקת ההשפעה הטיפולית של תרכובות אנטי-מיקרוביאליות 17,23.
מיקרואורגניזמים, כמו אלה שהוזכרו לעיל, חשופים לעתים קרובות לגירויים מלחיצים בסביבתם, ולכן פיתחו אסטרטגיות התמודדות עם לחץ כדי לסבול מצבים שעלולים להיות מזיקים/קטלניים. חלק ממיני החיידקים יכולים לייצר מבנים עמידים מאוד ורדומים מבחינה מטבולית הנקראים אנדוספורים, השומרים על שלמות התאים והגנטיקה תחת אילוצים סביבתיים חמורים. אם נאספים תנאים סביבתיים נוחים, אנדוספורים יכולים להתחדש לתאים פעילים ברי קיימא על ידי נביטה24. עם זאת, חיידקים שאינם נבגים עשויים להיכנס למצב רדום מטבולי חלופי הנקרא בר-קיימא אך לא ניתן לתרבות (VBNC), שתכונתו הפנוטיפית העיקרית היא אובדן יכולת התרבות במצעי גידול שגרתיים25. בהתחשב בכך שחלק גדול מ-> 100 מיני החיידקים שדווחו כנכנסים למצב VBNC הם פתוגניים לבני אדם ובעלי חיים אחרים26, וכי פתוגנים של VBNC עשויים להתעורר בחזרה למצב פעיל ואלים מבחינה מטבולית25,26, כישלונן של שיטות קונבנציונליות מבוססות גדילה לזהות פתוגנים של VBNC הוא נושא מדאיג לבריאות הציבור. הרמזים הסביבתיים והמנגנונים המולקולריים והפיזיולוגיים המניעים את תהליך ההתחדשות הזה עדיין אינם מובנים היטב ועשויים להשתנות בהתאם למיני החיידקים ולמתח הגורם למצב VBNC.
חוקרים ניצלו את הייחודיות של מודל עוברי התרנגולות כדי לחקור את יכולת ההחייאה in vivo של פתוגנים חיידקיים במצב VBNC. C. jejuni מבודדים שמקורם בבני אדם, שנדחפו למצב VBNC על ידי מחסור תזונתי במים, החזירו את יכולת התרבות והאלימות שלהם בתאים אנושיים לאחר מעבר בביצי עוף עובריות27. באופן דומה, ניסיונות מוצלחים להחזיר את מצב ה-VBNC דווחו גם עבור פתוגנים אחרים, כגון Edwardsiella tarda28, Legionella pneumophila29 ו-L. monocytogenes30.
לאחרונה דיווחנו שכאשר L. monocytogenes נדחף למצב VBNC על ידי רעב במים מינרליים, הוא עובר מתא בצורת מוט לתא קוקואידי. גילינו שהטרנספורמציה המורפולוגית הזו נגרמת על ידי נזק מצטבר לדופן התא, מה שמוביל לנשירה מוחלטת שלו על ידי החיידק, שהופך לאחר מכן לתא כדורי חסר דופן התאבצורה 31. הניסיונות הכושלים שלנו להחיות את צורות ה-VBNC L. monocytogenes חסרות הדופן הללו במבחנה, תוך שימוש בגישות לחידוש חומרי מזון, הובילו אותנו לחקור את ההצלה הפוטנציאלית שלהם in vivo. בהתחשב בשימוש המבטיח שלו עם L. monocytogenes30, בחרנו במודל עוברי התרנגולת למשימה זו. התוצאות אישרו את יכולתה של מערכת ביצי התרנגולת העוברית לקדם את שיקום VBNC L. monocytogenes חסרי דופן התא בחזרה למצב פעיל הניתן לתרבית31.
כאן, אנו מספקים פרוטוקול מפורט המאפשר החייאה in vivo של L. monocytogenes ממצב VBNC רדום באמצעות חשיפה לסביבת ביצי התרנגולת העובריות. אנו מתארים את ההכנה והניטור של ביצי תרנגולות וחיידקי VBNC, חיסון ביציות, עיבוד הביציות העובריות והלא עובריות, וניקוד העומס החיידקי הניתן לתרבית כדי להעריך את יעילות החייאת תאי VBNC. התוצאות מאשרות מחדש את עובר התרנגולת כמודל פשוט, חסכוני ומתאים להבנת המנגנונים השולטים בהיבטים שונים של חיים מיקרוביאליים, כגון תרדמת חיידקים. ניתן לחקור את מערכת in vivo זו כדי לחקור את תרומתם של גנים חיידקיים בודדים בתהליך התחייה.
Protocol
פרוטוקול זה עוקב אחר ההנחיות המוסדיות הרלוונטיות בצרפתית (צו מס' 2013-118) והאירופי (הנחיה 2010/63/EU) לשימוש בבעלי חיים במחקר. יתר על כן, על פי החוק הצרפתי (צו מס' 2020-274), פרוטוקול זה אינו עוסק בהגבלות אתיות מכיוון שכל הניסויים בעוברי תרנגולות מבוצעים ומסתיימים לפני התקופה השלישית האחרונה של העובר (כלומר, לפני היום ה-14).
1. הכנת חיידקי VBNC
- פס זני חיידקים ממאגרי גליצרול (המאוחסנים ב-80 מעלות צלזיוס) על מצע אגר עירוי לב מוח (BHI) באמצעות לולאות חיסון. דגירה למשך הלילה ב-37 מעלות צלזיוס כדי להשיג מושבות מבודדות.
הערה: במידת הצורך, יש להשלים את מדיית האגר באנטיביוטיקה שעבורם יש לזנים עמידות (באופן טבעי או על ידי שינוי גנטי). - עבור כל זן, הכינו 2-3 שפופרות עם 5 מ"ל של מרק BHI והשתמשו בלולאת חיסון כדי לחסן ב-2-3 מושבות. דגרו את התרביות למשך הלילה ב-37 מעלות צלזיוס עם תסיסה (200 סל"ד) כדי לגדל חיידקים עד לשלב הנייח. כל אחת מהתרביות הללו תשמש להכנת שכפולים ביולוגיים עצמאיים של תרחיפי חיידקים VBNC.
- יש לדלל כל תרבית ביחס של 1:10 במרק BHI ולמדוד את הצפיפות האופטית בספקטרופוטומטר באורך גל של 600 ננומטר (OD600). ערך OD600 של תרביות פאזה נייחות בגידול אופטימלי של ליסטריה מונוציטוגנס נע בין 2 ל -4. זה שווה לריכוז חיידקים של 2-4 x 109 יחידות יוצרות מושבה (CFU)/מ"ל.
- גלולה 1 מ"ל של תרבית חיידקים במיקרו-צינור של 1.5 מ"ל על ידי צנטריפוגה ב-6,000 x גרם למשך 2 דקות. שאפו את הסופרנטנט באמצעות משאבת ואקום. השעו מחדש את גלולת התא ב-1 מ"ל של מים מינרליים שעברו חיטוי ומסוננים.
- שטפו היטב את החיידקים על ידי חזרה על שלב 1.4 שלוש פעמים. זה מבטיח הסרה מוחלטת של חומרים מזינים מדיום תרבית שאחרת היו מעכבים את היווצרותם של חיידקי VBNC.
- הכן תרחיפי חיידקים בריכוז התחלתי של 106 CFU/mL על ידי הוספת 30 מיקרוליטר של חיידקים שטופים לצלוחיות תרבית תאים T25 המכילות 30 מ"ל מים מינרליים.
- מערבבים את המתלים בעזרת פיפטה סרולוגית. אחסן אותם בטמפרטורת החדר, בתנאי תאורה סטטיים (בקבוק במצב זקוף) ותאורה עמומה.
2. ניטור היווצרות חיידקי VBNC
- קבע את האוכלוסייה הניתנת לתרבות בתרחיפים החיידקייםביום הראשון (מיד לאחר ההכנה) ולאחר מכן על בסיס שבועי, כמתואר להלן.
- הכן דילולים סדרתיים פי 10 של תרחיף חיידקי VBNC במים מינרליים (מ 10-1 עד 10-3 דילול). צלחת 100 מיקרוליטר של תרחיף לא מדולל ושל כל דילול, בשכפול, על אגר BHI ודגירה למשך הלילה ב-37 מעלות צלזיוס.
הערה: כאשר יכולת התרבות מתקרבת <-1 CFU/מ"ל, יש לצפות נפח גדול יותר (0.5-2 מ"ל) של התרחיף הלא מדולל כדי לאשר את נוכחותם/היעדרם של חיידקים הניתנים לתרבות. - חשב את ריכוז החיידקים הניתנים לתרבות באופן הבא:
ריכוז חיידקים הניתנים לתרבות (CFU/mL) = (מספר ממוצע של מושבות x גורם דילול דגימה) / נפח דגימה מצופה (במ"ל).
- הכן דילולים סדרתיים פי 10 של תרחיף חיידקי VBNC במים מינרליים (מ 10-1 עד 10-3 דילול). צלחת 100 מיקרוליטר של תרחיף לא מדולל ושל כל דילול, בשכפול, על אגר BHI ודגירה למשך הלילה ב-37 מעלות צלזיוס.
- קבע את האוכלוסייה בת הקיימא בתרחיפים החיידקייםביום הראשון (מיד לאחר ההכנה) ולאחר מכן על בסיס שבועי, כמתואר להלן.
- דגרו דגימה של תרחיף החיידקים (כלומר, בריכוז של כ-106 תאים/מ"ל) עם צבע הכדאיות 5(6)-carboxyfluorescein diacetate (CFDA) בריכוז סופי של 30 מיקרומטר למשך 30 דקות בחושך. הכן גם דגימה ללא CFDA (בקרה לא מוכתמת) ודגימה שטופלה ב-95 מעלות צלזיוס למשך 30 דקות לפני הדגירה עם CFDA (בקרת תאים מתים/לא קיימא).
- נתח את הדגימות בציטומטר זרימה המצויד בלייזר עירור של 488 ננומטר וגלאי פליטה של 520 ננומטר עבור פלואורסצנטי CFDA. לחוסן סטטיסטי, רכשו כ-1 x 105 אירועי חיידקים לדגימה (זה מתורגם לנפח דגימה נרכש של 10-100 מיקרוליטר) בקצב זרימה של לפחות 30 מיקרוליטר לדקה.
- השתמש בדגימה הלא מוכתמת כדי למצוא ולשער את האירועים הקשורים לחיידקים בתרשים פיזור קדימה בקנה מידה לוגריתמי (FSC) לעומת פיזור צדדי (SSC). שרטט את אירועי החיידקים המגודרים בהיסטוגרמה פלואורסצנטית CFDA בקנה מידה לוגריתמי והשתמש בדגימות התאים הלא מוכתמים והלא ברי קיימא/מתים כדי להבחין בין האוכלוסיות הקיימות (חיוביות ל-CFDA) לבין האוכלוסיות הלא קיימאיות (שליליות ל-CFDA).
- חשב את ריכוז החיידקים בני הקיימא באופן הבא:
ריכוז חיידקים ברי קיימא (תאים/מ"ל) = מספר ממוצע של אירועים חיוביים ל-CFDA בדגימה נרכשת / נפח דגימה נרכשת (במ"ל)
הערה: בהתאם למודל הציטומטר, כימות תאים עשוי לדרוש שימוש בחרוזי ספירת ציטומטריית זרימה.
3. דגירה של ביצים
- עם קבלת הפנים מהספק, אפשר לשכן את הביציות המופרות בטמפרטורת החדר עד למחרת.
- בינתיים, מלאו את מאגר המים של חממת הביצים במים נטולי יונים והפעילו את הכוח. הגדר את הטמפרטורה ל-37.7 מעלות צלזיוס ואת הלחות היחסית המקסימלית ל-47%.
הערה: בידינו, הביצים מודגרות בטווח לחות יחסי של 38%-42%, ללא השפעה נראית לעין על קצב העובריות הצפוי וההצלחה. - העבירו את הביציות לאינקובטור כדי להתחיל אמבריוגנזה. מקם אותם על מגשי החממה כשכיס האוויר פונה כלפי מעלה (כלומר, קצה מחודד פונה כלפי מטה).
- דוגרים על הביצים למשך 6 ימים. לאחר 4 ימים, יש להבחין בין ביציות עובריות חיות לבין ביצים מתות או לא עובריות על ידי קנדינג.
- הניחו את הביצה מתחת/מעל מקור אור חזק (נר) כדי להאיר את הפנים ולהבחין חזותית בתוכנה. לאחר 3 או 4 ימים של דגירה, ביציות עובריות חיות מציגות רשת של כלי דם המתרחבים כלפי מטה מכיס האוויר. רשת זו נראית ממוטטת ולא מאורגנת בביציות עובריות מתות ונעדרת לחלוטין בביציות שלא הצליחו להתחיל את האמבריוגנזה. אם הוא נראה, עובר חי עשוי אפילו להראות תנועת עוויתות (איור 1).
4. הכנת ביצים לחיסון
- ביום החיסון, נר את הביצים כדי לקבוע את המספר הזמין של ביציות עובריות ולא עובריות. זהה את הביציות הלא עובריות (כ-10%-20% מהמספר הכולל) ואת כל הביציות עם עוברים מתים, כמתואר בשלב 3.4. השלך את האחרון על פי ההנחיות המוסדיות לסילוק פסולת ביולוגית.
- סמן את נקודת ההזרקה על קליפת הביצה בגובה 2-5 מ"מ מעל גבול כיס האוויר (איור 2A). חיטוי אזור זה על ידי שפשוף בנייר טישו ספוג באתנול 70% (v/v).
- באמצעות מחט 18G, צרו בזהירות שקע דקירה על הקונכייה במקום ההזרקה מבלי לחדור דרך קרום הקונכייה (איור 2B). חטא את מקום ההזרקה עם נייר טישו ספוג באתנול 70% (v/v).
5. חיסון ביציות
- חבר מחט של 25 גרם (0.5 מ"מ x 16 מ"מ) למזרק של 1 מ"ל ומלא אותה בתרחיף חיידקי VBNC. במידת הצורך, הסר בועות אוויר שנדבקו לדופן הפנימית של המזרק על ידי לחיצה עליו באצבע.
- בצע חיסון במים מינרליים בלבד או בתרחיף של L. monocytogenes (5 x 103 CFU/mL) שגדל במהלך הלילה במרק BHI כתנאי בקרה לסטריליות וצמיחה שמקורם בחיידקים הניתנים לתרבות, בהתאמה.
- הכניסו את המחט דרך הקליפה המנוקבת בנקודת ההזרקה והכניסו אותה עד הסוף, בזווית מאונכת, עד שבסיס המחט נוגע במשטח הקליפה (איור 2C). זה ממקם את קצה המחט כדי להעביר את תכולת המזרק לחלל האלנטואי (בביצים עובריות) או לחלבון (בביציות שאינן עובריות).
- יש להזריק בזהירות ובאיטיות 100 מיקרוליטר מהחיסון. שמור על זווית המחט דוממת ככל האפשר כאשר היא בתוך ביצית עוברית כדי למנוע גרימת פציעות קטלניות לעובר.
- הסר בזהירות ובאטיות את המחט וכסה את מקום ההזרקה במדבקה עגולה כדי לאטום את מקום כניסת החיסון. לנוחות ובהירות, השתמשו במדבקות בצבע שונה לכל מצב/קבוצת ביצים.
- מחזירים את הביצים המחוסנות לחממה למשך יומיים נוספים. ודא שביציות עם עוברים מתפתחים אינן מחוץ לחממה (או בטמפרטורה מתחת ל-37.7 מעלות צלזיוס) במשך יותר מ-30 דקות. בצע את החיסון בקבוצות, במידת הצורך.
6. הערכת נוכחותם של תאים הניתנים לתרבית בדגימות החיסון
- הוצא 100 מיקרוליטר של תרחיף חיידקי VBNC למספר בארות של מיקרופלייט של 96 בארות. חשב את מספר הבארות ≥ פי 2 ממספר הביציות המחוסנות (עובריות + לא עובריות).
- אם אתה משתמש בתנאי הבקרה המוזכרים בשלב 5.2, יש להוציא 100 מיקרוליטר מכל חיסון (כלומר, מים מינרליים או חיידקים הניתנים לתרבות) לשלוש בארות לפחות באותה מיקרופלייט של 96 בארות.
- בעזרת פיפטה רב ערוצית, הוסף 100 מיקרוליטר של מדיום BHI לכל אחת מהבארות שהוכנו בשני השלבים הקודמים.
- דגרו את הצלחת בטמפרטורה של 37 מעלות צלזיוס בתנאים סטטיים כדי לקדם צמיחת חיידקים בבארות המכילות חיידקים הניתנים לתרבות. בהתאם לנוכחותם של חיידקים הניתנים לתרבות וקצב הצמיחה מחדש שלהם בתנאים אלה, ייתכן שיהיה צורך ביום דגירה אחד או יותר כדי לחשוף באופן מלא בארות המכילות חיידקים הניתנים לתרבות.
- עבור כל חיסון, בדוק ויזואלית וספור את מספר הבארות שקיבלו ציון חיובי ושלילי לצמיחת חיידקים.
7. ניטור כדאיות העובר
- למחרת החיסון, נר את הביציות העובריות כדי לבדוק אם קטלניות העובר.
- הניחו בצד ביצים המכילות עוברים מתים והשליכו אותם בהתאם להנחיות המוסדיות לסילוק פסולת ביולוגית נגועה.
8. עיבוד ביציות עובריות
- שחזר את הביציות העובריות מהחממה והנר כדי לבדוק אם יש קטלניות של עוברים. השליכו עוברים מתים ואל תתייחסו אליהם בתוצאות הסופיות.
- מוציאים את המדבקה מהביצה ומחטאים את הקצה העליון של הקליפה (המכסה את כיס האוויר) בנייר טישו ספוג באתנול 70% (v/v).
- בעזרת מספריים נקיים לחיתוך, חותכים את הקליפה מנקודת ההזרקה כדי לחשוף את כיס האוויר. בעזרת פינצטה נקייה קורעים את קרום הקליפה הפנימי המפריד בין כיס האוויר לשאר הביצה.
- רוקנו בזהירות את תכולת הביצה לצלחת פטרי סטרילית. בעזרת זוג פינצטה, בודדו והעבירו את העובר לצלחת פטרי חדשה. שוטפים את העובר עם PBS סטרילי, במידת הצורך.
- העבירו את העובר לצינור צנטריפוגה של 15 מ"ל המכיל 4 מ"ל PBS סטרילי. נתק את העובר באמצעות הומוגנייזר (מהירות: 10,000 סל"ד). נקה את קצה כלי הפיזור בין כל הומוגניזציה על ידי העברתו ברצף ב-PBS סטרילי, 70% (v/v) אתנול, ושוב PBS סטרילי.
- צלחת 500 מיקרוליטר של העובר הומוגנאט על אגר BHI. דגרו את הצלחות בטמפרטורה של 37 מעלות צלזיוס למשך הלילה (או יותר, במידת הצורך).
הערה: לחלופין, ניתן לצפות דילולים סדרתיים של ההומוגנאט למקרה שצפויים מספרי CFU מוגברים (כלומר, > 300) בהומוגנאט הלא מדולל. - עבור כל קבוצת חיסון, ספרו את מספר הביציות שקיבלו ציון חיובי ושלילי לגידול L. monocytogenes על צלחות אגר.
הערה: למרות התנאים האספטיים שבהם מתבצעת מיצוי העובר וההומוגניזציה, השימוש במדיום אגר לא סלקטיבי לציפוי הומוגנטים של עוברים כרוך בסיכון לצמיחת מזהמים. שימוש במצע גידול ספציפי לסוג/מין או תוספת עם אנטיביוטיקה סלקטיבית (שרק זן החיידקים שנבדק עמיד לה) יכולים להפחית או למנוע זיהום כזה.
9. עיבוד ביציות לא עובריות
- שחזר את הביציות הלא עובריות מהחממה. חזור על שלבים 8.2 ו- 8.3 כדי לקבל גישה לחלבון הביצה.
- בעזרת מיקרופיפטה אוספים 500 מיקרוליטר חלבון ומורחים ישירות על אגר BHI. דגרו את הצלחות בטמפרטורה של 37 מעלות צלזיוס למשך הלילה או יותר, במידת הצורך.
- עבור כל קבוצת חיסון, ספרו את מספר הביציות שקיבלו ציון חיובי לגידול L. monocytogenes על צלחות אגר.
תוצאות
כדי לבחון את הפוטנציאל של מודל עוברי התרנגולות להחיות צורות VBNC חסרות דופן תא של L. monocytogenes שנוצרו על ידי רעב במים מינרליים, היה חשוב לבטא את העיתוי של הכנת החיסון החיידקי VBNC (≥ 28 ימים) עם זה של הביציות העובריות (6 ימים). תרחיפי שכפול של L. monocytogenes הוקמו אפוא בריכוז של 1 x 106 CFU/mL במים מינרליים 28 ימים לפני יום חיסון הביצים המתוכנן. הוכח כי ריכוז חיידקים התחלתי זה מביא לתרבית שיורית רצויה של <1 CFU/mL לאחר 28 ימים31. אימות סופי של יכולת התרבות של תאי החיידקים ורמות הכדאיות של התרחיפים הביא לבחירה של חיסון VBNC L. monocytogenes המכיל 1 x 106 תאים ברי קיימא ו-0.5 תאים ניתנים לתרבית למ"ל. לצורך ניסויים, 100 מיקרוליטר של חיסון זה (כלומר, 1 x 105 תאים ברי קיימא ו-< 0.1 CFU) הועברו לקבוצות של ביציות עובריות ולא עובריות. קבוצות הביקורת הוכנו במקביל על ידי הזרקת ביצים עובריות ולא עובריות עם אותו נפח מינון של מים מינרליים או של תרחיף 5 x 103 CFU/mL של L. monocytogenes שגדל בן לילה במרק BHI.
יומיים לאחר החיסון, הביציות עובדו כדי להעריך את נוכחותם של L. monocytogenes הניתנים לתרבות. כצפוי, לא נמצאה גידול חיידקים בביצים של קבוצת הביקורת הסטרילית שהוזרקו למים מינרליים, בעוד ש-100% מהביצים מקבוצת הביקורת שטופלו ב-L. monocytogenes ניתנים לתרבית קיבלו ציון חיובי לגדילה במצע אגר (טבלה 1). חשוב לציין, שכל העוברים שהוחזרו מביציות שחוסנו בחיידקי VBNC הולידו צמיחה של L. monocytogenes בצלחת, בניגוד להיעדרו המוחלט בכל צלחת מפוזרת עם תכולת ביצית לא עוברית שהוזרקה עם אותם חיידקי VBNC (טבלה 1). תוצאה זו מדגישה את הדרישה של עובר התרנגולת לתהליך ההתעוררות של VBNC L. monocytogenes, כפי שדווח בעבר30.
כדי לקבוע את הסבירות שגידול ה-L. monocytogenes שנלקח מביציות עובריות שהוזרקו עם חיידקי VBNC נובע מהתאוששות אמיתית של תאי VBNC, ולא מצמיחה מחודשת של תאים מתמשכים הניתנים לתרבית, יש צורך להשוות את תדירות מינוני החיסון המייצרים צמיחת חיידקים לפני ואחרי מעבר הביציות. כדי להשיג את הראשון, מנות מרובות של 100 מיקרוליטר של החיסון החיידקי VBNC עורבבו עם BHI, מדיום עשיר בחומרים מזינים שאינו תומך בתחיית VBNC L. monocytogenes 32, בצלחת של 96 בארות והודגרו בטמפרטורה של 37 מעלות צלזיוס. שכיחות של 9.5% מבארות BHI מחוסנות חיוביות לגידול חיידקים (8 מתוך 84) הייתה שונה באופן משמעותי (הבדיקה המדויקת של פישר, p = 1.6 × 10-17) מהשכיחות של 100% של ביצים המציגות חיידקים ניתנים לתרבית שהחלימו (טבלה 1). הבדל משמעותי ומובהק סטטיסטית זה מצביע בבירור על כך שגידול ה-L. monocytogenes שהתאושש מביציות עובריות נבע בעיקר מהפעלה מחדש של חיידקי VBNC. בנוסף, בניגוד לצורותיו הווגטטיביות, VBNC L. monocytogenes לא הצליחו להחיות בביציות שאינן עובריות, מה שתומך בכך שהחייאת תאי VBNC בביציות עובריות אינה נובעת משאריות החיידקים הניתנים לתרבית בחיסון.
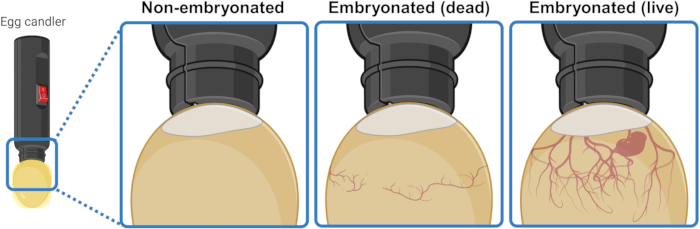
איור 1: הבחנה בין ביצי תרנגולות שאינן עובריות, עובריות מתות ועובריות חיות על ידי קנדלינג. מצב העובר נקבע על ידי הארת הביצה במקור אור (נר ביצה) מטווח קרוב. ביציות המכילות עובר חי מתפתח (גלוי או לא) מציגות רשת חזקה של כלי דם המתרחבים כלפי מטה מכיס האוויר. רשת זו נראית קורסת ולא מאורגנת בביציות עם עוברים מתים ונעדרת לחלוטין בביציות שלא הצליחו להתחיל את העובר. נוצר בשנת BioRender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
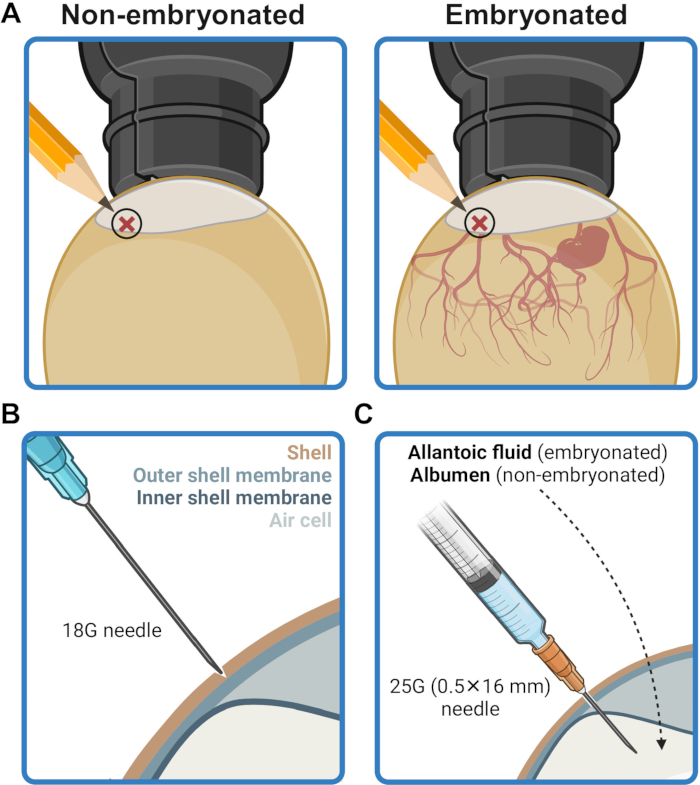
איור 2: הכנת הביצית לחיסון. (A) מקום ההזרקה מסומן במיקום 2-5 מ"מ מעל גבול כיס האוויר, כפי שנראה על ידי מנורות. (B) הקליפה באתר ההזרקה מנוקבת בעזרת קצה מחט 18G מבלי לנקב את קרום המעטפת החיצונית. (C) החיסון מועבר דרך מחט של 25 גרם (0.5 מ"מ x 16 מ"מ) לתוך הנוזל האלנטואי בביציות שעברו עובר או החלבון בביציות שאינן עובריות. נוצר בשנת BioRender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| חיסון | יכולת גידול לפני מעבר ביציתא | יכולת גידול לאחר מעבר ביציתב | |||
| ביציות עובריות | ערך PC | ביציות לא עובריות | ערך PD | ||
| מים מינרליים | 0/3 (0%) | 0/10 (0%) | >0.999 | 0/10 (0%) | >0.999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63ה-17 | 0/18 (0%) | 0.344 |
| Lm מתורבת | 3/3 (100%) | 8/8 (100%) | >0.999 | 2/2 (100%) | >0.999 |
| אמספר בארות BHI עם גידול חיידקים / מספר בארות BHI מחוסנות. | |||||
| במספר הביצים עם גידול חיידקים/מספר הביצים המחוסנות. | |||||
| גהשוואה של יכולת התרבות לפני ואחרי המעבר בביציות עובריות (מבחן פישר המדויק הדו-צדדי). | |||||
| דהשוואה של יכולת התרבות לפני ואחרי המעבר בביציות שאינן עובריות (מבחן פישר המדויק הדו-צדדי). | |||||
טבלה 1: VBNC L. monocytogenes חוזרים למצב מתורבת לאחר מעבר בביצי תרנגולות עובריות. ביצי תרנגולות עובריות ולא עובריות (6 ימים) חוסנו ב-100 מיקרוליטר מים מינרליים בלבד או בתרחיפים של מים מינרליים של VBNC (1 x 104 תאים, 28 ימים) או ניתנים לתרבית (500 תאים) L. monocytogenes. לאחר יומיים, עוברים (או חלבון בביציות לא עובריות) הוחזרו וציפו על אגר BHI כדי להעריך את נוכחותם של L. monocytogenes הניתנים לתרבות. תדירות התאים הניתנים לתרבית הקיימים במינון חיסון לפני מעבר הביציות נקבעה על ידי ערבוב של 100 מיקרוליטר מכל תרחיף עם מרק BHI במספר בארות של מיקרו-צלחת של 96 בארות וציון מספר הבארות עם גידול חיידקים לאחר הדגירה ב-37 מעלות צלזיוס. המובהקות הסטטיסטית חושבה באמצעות מבחן פישר דו-זנבי, כאשר ערכי p ≥ 0.05 נחשבו לא מובהקים. טבלה זו שוכפלהמ-31.
Discussion
הסיכונים לבריאות הציבור והכלכלה הקשורים לצורות ברות קיימא אך לא ניתנות לתרבות (VBNC) של פתוגנים חיידקיים הם תוצאה של יכולתם להתחמק מגילוי בשיטות קונבנציונליות מבוססות גידול מיקרוביאלי כמו גם של הסובלנות/חוסר הרגישות שלהם לרוב האנטי-מיקרוביאלים המשמשים במסגרות קליניות ותעשיית המזון26,33. לכן דחוף למצוא כלי מחקר ומודלים כדי להבין טוב יותר את המנגנונים המניעים את המעבר, התחזוקה וההחייאה של תאי חיידקים במצב VBNC.
בהיבטים רבים, עובר התרנגולת הוא אלטרנטיבה מועילה למודלים קונבנציונליים יותר של מחקר יונקים (למשל, עכבר, חולדה, ארנב). מבחינה טכנית זה מעשי יותר לעבוד עם אורגניזם ביצית, מכיוון שהתפתחותו העוברית מהירה ומתרחשת חיצונית וללא תלות באבותיו. חשוב לציין, הנטל הכספי והלוגיסטי הקשור לייצור, דיור ותחזוקה של ביצי תרנגולות ועוברים נמוך משמעותית. בנוסף, הקלות להשיג מספרים גדולים מאפשרת בדיקה מקבילה של תנאי ניסוי מרובים ו/או שכפולים ויצירת נתונים מקיפים וחזקים סטטיסטית. למרות שמודלים שאינם יונקים, כגון דגים או נמטודות, יכולים לספק יתרונות דומים, עובר התרנגולות, כבעל חוליות בעל דם חם, קרוב יותר מבחינה אבולוציונית לבני אדם ולכן מודל מחקר טוב יותר בתחומים כמו אימונולוגיה, מודלים של מחלות, התפתחות וטוקסיקולוגיה. מודלים עובריים הם גם פשוטים יותר לעבודה מנקודת מבט אתית, במיוחד במהלך שני השלישים הראשונים של ההתפתחות, כאשר מערכת נוסיספטיבית בוגרת עדיין לא מבוססת8. חלון זמן קצר זה נוח ליישומים הדורשים זמני אספקה מהירים (למשל, בדיקת סמים1), אך יכול להוות מגבלות לבדיקות הנמשכות לשלבים מאוחרים יותר של האמבריוגנזה או אפילו לחיים שלאחר הבקיעה (למשל, מחקרים התפתחותיים והתנהגותיים). היעדר מערכת חיסון נרכשת גם הופך את עובר התרנגולת לכלי מחקר שימושי בתחומים כמו אינטראקציות מארח-פתוגן וביולוגיה של סרטן7.
עובר התרנגולת שימש באופן נרחב בחקר האלימות המיקרוביאלית 9,10,11,12,13,14,15,16,17,18, אך במשורה כמודל להחייאת פתוגנים של VBNC 27,28,29,30. כאן, סיפקנו תיאור מתודולוגי מפורט כיצד ניתן להשתמש בהצלחה במערכת in vivo זו להצלת VBNC L. monocytogenes.
נקודה קריטית שיש לקחת בחשבון בשיטה זו היא נושא הנוכחות השיורית של תאים הניתנים לתרבות והפוטנציאל שלהם להתגבר על תחיית תאי VBNC אמיתית. המגבלות של שיטת ייצור תאי VBNC לטיפול בעניין זה (רמות הטוהר של תאי VBNC משולבות עם התחלת ריכוז החיידקים) מעלות את הצורך להשתמש בגישות חלופיות כדי לחסל לחלוטין תאים מזהמים הניתנים לתרבית או להפחיתם לרמה זניחה. גישות כאלה עשויות לכלול, למשל, נטרול/הרג על ידי אנטי-מיקרוביאלים המכוונים אך ורק לתאים הניתנים לתרבית. לחלופין, ניתן להשיג הסרה פיזית של אוכלוסיית התאים הניתנת לתרבות על סמך מאפיינים מורפופיזיולוגיים ייחודיים (למשל, צורת תא, פני השטח או מבנים או מולקולות ציטופלזמיות) על ידי ציטומטריית זרימה. לגישה זו יש יתרון נוסף בכך שהיא מאפשרת בידוד/טיהור של תת-אוכלוסיות תאי VBNC בגילאים שונים (כלומר, נוצרו בנקודות זמן שונות), שניתן לבדוק גם בביציות את יכולת ההחייאה שלהן.
נקודות אחרות בשיטה זו הדורשות תשומת לב כוללות טיפול זהיר בביציות עובריות, במיוחד במהלך ומיד לאחר שלב ההזרקה (כדי למנוע טראומה או קטלניות לא מכוונת הקשורה למחט), ושאיפה להפחית את זמן המניפולציה מחוץ לטמפרטורת הדגירה האופטימלית. בנוסף, למרות התנאים האספטיים שבהם יש לבצע שליפה, עיבוד וציפוי של עוברים, עדיין עלולה להתרחש צמיחה מיקרוביאלית לא רצויה על צלחות אגר. ניתן לפתור זאת על ידי שימוש באמצעי אגר עם פורמולה (הרכב בסיסי ו/או תוספי מזון) סלקטיבית למיני החיידקים המעניינים או על ידי שימוש בזן בעל עמידות לאנטיביוטיקה נתונה.
עבודה זו מציגה את עובר התרנגולת כמודל in vivo פשוט אך חזק וחסכוני לחקירת ההיבטים המכאניסטיים של תרדמת חיידקים. בהקשר זה, ניתן להשתמש בו כדי לזהות גורמים חיידקיים המעורבים בתהליך התעוררות מצב VBNC באמצעות סינון של מוטציות חיידקיות בודדות או בקנה מידה רחב של הגנום על ידי שימוש בספרייה מעורבת (למשל, ספריית מוטנטים של טרנספוזון).
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
עבודה זו נתמכה על ידי מענק ממכון Micalis (AAP Micalis FAMe 2023). F.C. נתמך על ידי מימון מענק פוסט-דוקטורט מהסוכנות הלאומית למחקר (THOR: ANR-20-CE15-0008; פרמלי: ANR-20-CE35-0001).
Materials
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved