Method Article
鸡胚胎作为 体内 模型以恢复活但不可培养的病原体
摘要
该方法将鸡胚胎展示为一种简单且具有成本效益的 体内 模型,以将细菌病原体单核细胞增 生李斯特 菌从可存活但不可培养 (VBNC) 状态中恢复过来,并可能进一步用于了解细菌休眠机制。
摘要
鸡胚胎已成为一种流行的 体内 模型,由于其简单性、可负担性和在各种生物现象研究中的适应性,在生物医学研究中的应用越来越多。该模型已被用于研究微生物致病性,并正在成为研究细菌休眠的有用工具。存活但不可培养 (VBNC) 状态是一种休眠状态,在这种状态下,细菌变得代谢静止并对培养产生抵抗力,以保持它们在恶劣环境中的生存能力。在有利的条件下,VBNC 细菌可以唤醒并重新进入代谢活跃和可培养的状态。转变为 VBNC 状态的细菌病原体,例如导致食源性李斯特菌病的 单核细胞增生李斯特菌,是一个公共卫生问题,因为它们无法通过传统的生长依赖性方法进行检测,并且可以在复活时恢复其毒力。这促使更好地了解驱动 VBNC 病原体复苏的条件和机制。这里介绍的方法将鸡胚胎展示为一种有效的 体内 模型,可将 VBNC 单核细胞增生李斯特 菌恢复到可培养状态。在主要基于营养补充的 体外 复兴尝试没有成效的情况下,该方案成功地促进了矿泉水中饥饿产生的 单核细胞增生李 斯特菌细胞壁缺陷型 VBNC 形式的重新激活。重要的是,获得的结果强调了胚胎对 VBNC 单核细胞增生李斯特菌复苏的要求,表明胚胎相关因素在此过程中起重要作用。该方法的其他潜在用途包括筛选和鉴定与 VBNC 状态复苏机制有关的细菌因子。因此,该模型可以深入了解细菌休眠的分子工作原理,其知识对于降低无法检测的病原体带来的公共卫生风险至关重要。
引言
在寻找替代体内研究模型时,随着相关成本以及物流和伦理考虑的降低,鸡胚胎出现并迅速成为最适用、最可管理和可重复的体内脊椎动物模型系统之一 1,2。与其他动物模型(如啮齿动物和兔子)相比,受精鸡蛋的获得成本低廉,并且不需要复杂的住房物流即可进行开发。此外,鸡蛋大小能够并行处理大量胚胎,支持大量实验测试条件/组和重复。胚胎发生持续时间短(21 天)以及在发育期的任何时间点访问和观察胚胎和相关结构的简单性使其成为各种领域的有用模型,例如发育生物学(例如,心脏和大脑形成)3,4 和药理学(测试药物活性、递送和毒性)1,5,6.此外,鸡胚未成熟的免疫系统使其成为基于免疫的研究和癌症研究相关方法的合适系统7。重要的是,由于该模型的胚胎性质,它只有在发育第 13-14 天8 时才能获得成熟的伤害感受系统,因此在此时间范围内进行的研究应用不受法律和道德问题7 的限制。
鸡胚胎模型也被广泛用于研究导致人类和其他哺乳动物患病的微生物的致病性。事实上,许多研究已经探索并验证了这种模型,以调查原生动物(例如,犬新孢子虫、Eimeria tenella、Cryptosporidium spp.)的毒力。9,10,11、真菌(如白色念珠菌、烟曲霉)12,13 和细菌种类(如肠球菌属、肠道沙门氏菌、弗朗西斯菌属、空肠弯曲杆菌、产气荚膜梭菌、单核细胞增生李斯特菌、淋病奈瑟菌、金黄色葡萄球菌)10, 14,15,16,17,18,19,20,21,22,以及测试抗菌化合物的治疗效果 17,23。
如上所述的微生物,经常暴露在环境中的压力刺激下,因此进化出了应对压力的策略来承受潜在的有害/致命情况。一些细菌种类可以产生称为内生孢子的高弹性和代谢休眠结构,这些结构在严格的环境限制下保持细胞和遗传完整性。如果聚集了有利的环境条件,内生孢子可以通过发芽再生成活的活性细胞24。然而,非孢子细菌可能会进入另一种代谢休眠状态,称为 VIABLE but non-culturable (VBNC),其主要表型特征是在常规生长培养基中丧失可培养性25。鉴于据报道进入 VBNC 状态的 > 100 种细菌物种中很大一部分对人类和其他动物具有致病性26,并且 VBNC 病原体可能会恢复为代谢活跃和毒性状态25,26,传统的基于生长的方法无法检测 VBNC 病原体是一个令人担忧的公共卫生问题。驱动这种复苏过程的环境线索以及分子和生理机制尚不清楚,并且可能因微生物种类和 VBNC 状态诱导应激而异。
研究人员利用鸡胚胎模型的特殊性来研究 VBNC 状态下细菌病原体的体内复活能力。人源性空肠弯曲杆菌分离株因水中营养剥夺而进入 VBNC 状态,在胚胎鸡蛋中传代后恢复了它们在人类细胞中的可培养性和毒力27。同样,也报道了其他病原体成功尝试恢复 VBNC 状态,例如迟发爱德华氏菌28、嗜肺军团菌29 和单核细胞增生李斯特菌 30。
我们最近报道了当单核细胞增生李斯特菌在矿泉水中饥饿而进入 VBNC 状态时,它会从杆状细胞转变为球状细胞。我们揭示了这种形态转变是由细胞壁的累积损伤引起的,导致其被细菌完全脱落,然后变成细胞壁缺陷的球形细胞形式31。我们尝试使用营养补充方法在体外恢复这些无壁的 VBNC 单核细胞增生李斯特菌形式,但没有成功,这促使我们研究了它们在体内的潜在拯救。鉴于它与单核细胞增生李斯特菌 30 的有前途的用途,我们选择了鸡胚胎模型来完成这项任务。结果证实了胚胎鸡蛋系统促进细胞壁缺陷型 VBNC 单核细胞增生李斯特菌恢复到活性可培养状态的能力31。
在这里,我们提供了一个详细的方案,使单核细胞增生李斯特菌能够通过暴露于胚胎化的鸡蛋环境从休眠的 VBNC 状态体内复活。我们描述了鸡蛋和 VBNC 细菌的制备和监测、鸡蛋的接种、胚胎和非胚胎鸡蛋的加工以及可培养细菌负荷的评分,以评估 VBNC 细胞复苏效率。结果再次证实了鸡胚胎是一种简单、经济高效且合适的模型,用于理解控制微生物生命不同方面的机制,例如细菌休眠。可以进一步探索这种体内系统,以研究单个细菌基因在复活过程中的贡献。
研究方案
该协议遵循适用的法国机构(第 2013-118 号法令)和欧洲(指令 2010/63/EU)关于动物在研究中使用的指南。此外,根据法国法律(第 2020-274 号法令),该协议不涉及道德限制,因为所有鸡胚实验都是在胚胎发生的最后第三个时期之前(即第 14 天之前)进行和完成的。
1. VBNC 菌的制备
- 使用接种环将来自甘油原液(储存在 -80 °C)的细菌菌株划线到脑心输注 (BHI) 琼脂培养基上。在 37 °C 下孵育过夜以获得分离的菌落。
注:如果需要,用菌株具有抗性的抗生素(天然或通过基因改造)补充琼脂培养基。 - 对于每个菌株,准备 2-3 管和 5 mL BHI 肉汤,并使用接种环接种 2-3 个菌落。将培养物在 37 °C 下搅拌 (200 rpm) 孵育过夜,以培养细菌直至固定相。这些培养物中的每一种都将用于制备 VBNC 细菌悬浮液的独立生物学重复。
- 在 BHI 肉汤中以 1:10 的比例稀释每种培养物,并在分光光度计中测量波长为 600 nm (OD600) 的光密度。单核细胞增生李斯特菌最佳生长固定相培养物的 OD600 值在 2 到 4 之间。这相当于细菌浓度为 2-4 x 109 菌落形成单位 (CFU)/mL。
- 在 1.5 mL 微管中以 6,000 x g 离心 2 分钟,将 1 mL 细菌培养物沉淀。使用真空泵吸出上清液。将细胞沉淀重悬于 1 mL 高压灭菌和过滤的矿泉水中。
- 通过重复步骤 1.4 3 次彻底清洗细菌。这确保了完全去除培养基营养物质,否则这些营养物质会延迟 VBNC 细菌的形成。
- 将 30 μL 洗涤过的细菌添加到含有 30 mL 矿泉水的 T25 细胞培养瓶中,制备起始浓度为 106 CFU/mL 的细菌悬浮液。
- 使用血清移液管混合悬浮液。将它们储存在室温、静态(培养瓶直立位置)和昏暗的照明条件下。
2. 监测 VBNC 细菌的形成
- 在第 1 天(制备后立即)确定细菌悬浮液中的可培养种群,然后每周测定一次,如下所述。
- 在矿泉水中制备 10 倍连续稀释的 VBNC 细菌悬浮液(从 10-1 到 10-3 稀释)。将 100 μL 未稀释的悬浮液和每种稀释液一式两份接种在 BHI 琼脂上,并在 37 °C 下孵育过夜。
注:当培养性接近 < 1 CFU/mL 时,应接种更大体积 (0.5-2 mL) 的未稀释悬浮液,以确认存在/不存在可培养细菌。 - 按如下方式计算可培养细菌的浓度:
可培养细菌浓度 (CFU/mL) =(平均菌落数 x 样品稀释因子)/铺板样品体积(以 mL 为单位)。
- 在矿泉水中制备 10 倍连续稀释的 VBNC 细菌悬浮液(从 10-1 到 10-3 稀释)。将 100 μL 未稀释的悬浮液和每种稀释液一式两份接种在 BHI 琼脂上,并在 37 °C 下孵育过夜。
- 在第 1 天 (制备后立即) 确定细菌悬浮液中的活种群,然后每周测定一次,如下所述。
- 将细菌悬浮液样品(即浓度约为 106 个细胞/mL)与终浓度为 30 μM 的活力染料 5(6)-羧基荧光素二乙酸酯 (CFDA) 在黑暗中孵育 30 分钟。在与 CFDA(非活细胞/死细胞对照)孵育之前,还应制备不含 CFDA 的样品(未染色对照)和在 95 °C 下处理 30 分钟的样品。
- 在配备 488 nm 激发激光器和 520 nm 发射检测器的流式细胞仪中分析样品,用于 CFDA 荧光。为了提高统计稳定性,以至少 30 μL/min 的流速,每个样品采集约 1 x 105 个细菌事件(这相当于采集的样品量为 10-100 μL)。
- 使用未染色的样品在对数缩放前向散射 (FSC) 与侧向散射 (SSC) 图中查找和设门细菌相关事件。在对数缩放的 CFDA 荧光直方图中绘制门控细菌事件,并使用未染色和不可存活/死细胞样品来区分活细胞(CFDA 阳性)和非活细胞(CFDA 阴性)种群。
- 按如下方式计算活菌的浓度:
活菌浓度 (细胞/mL) = 采集样本中 CFDA 阳性事件的平均数量 / 采集的样本量 (mL)
注:根据细胞仪型号,细胞定量可能需要使用流式细胞术计数微珠。
3. 种蛋孵化
- 收到供应商后,将受精蛋在室温下放置至第二天。
- 同时,用去离子水填充鸡蛋孵化器的水箱并打开电源。将温度设置为 37.7 °C,最大相对湿度为 47%。
注意:在我们手中,种蛋在 38%-42% 的相对湿度范围内孵化,对预期的胚胎发生速度和成功没有明显影响。 - 将鸡蛋转移到培养箱中以启动胚胎发生。将它们放在培养箱托盘上,气穴朝上(即,尖头朝下)。
- 将鸡蛋孵化 6 天。4 天后,通过验蛋区分活的胚胎蛋与死蛋或未胚蛋。
- 将鸡蛋放在强光源 (candler) 下方/上方,以照亮内部并直观地辨别其内容物。孵化 3 或 4 天后,活的胚胎卵显示出从气囊向下扩展的血管网络。这个网络在死亡的胚胎卵子中看起来塌陷和杂乱无章,而在未能开始胚胎发生的鸡蛋中完全不存在。如果可见,活胚胎甚至可能表现出抽搐运动(图 1)。
4. 准备用于接种的卵子
- 在接种当天,用蜡烛照射鸡蛋以确定可用的活胚胎卵和非胚胎卵的数量。如步骤 3.4 所述,确定未胚胎的鸡蛋(约占总数的 10%-20%)和任何具有死胚胎的鸡蛋。根据生物废物处理的机构指南丢弃后者。
- 在气穴边界上方 2-5 毫米处标记蛋壳上的注射点(图 2A)。用浸泡有 70% (v/v) 乙醇的薄纸擦拭该区域。
- 使用 18G 针头,小心地在注射点的外壳上划出一个穿刺凹痕,不要刺穿外壳膜(图 2B)。用浸泡有 70% (v/v) 乙醇的纸巾对注射部位进行消毒。
5. 卵子接种
- 将 25G (0.5 mm x 16 mm) 针头插入 1 mL 注射器中,并填充 VBNC 细菌悬浮液。如有必要,用手指轻弹以去除粘附在注射器内壁上的气泡。
- 单独用矿泉水或在 BHI 肉汤中生长过夜的 单核细胞增生李斯特 菌悬浮液 (5 x 103 CFU/mL) 进行接种,分别作为源自可培养细菌的无菌和生长的控制条件。
- 将针头穿过注射点处的穿孔壳,并以垂直角度将其完全插入,直到针头的底部接触到壳表面(图 2C)。这将针尖定位,将注射器内容物输送到尿囊腔(在胚胎中)或蛋白(在未胚胎中)。
- 小心缓慢地注射 100 μL 接种物。在胚胎卵内时,请尽可能保持针头的角度静止,以避免对胚胎造成致命伤害。
- 小心缓慢地取下针头,并用圆形贴纸覆盖注射点,以密封接种入口部位。为方便和清晰起见,请针对每种状况/鸡蛋组使用不同颜色的贴纸。
- 将接种的鸡蛋放回培养箱再放置 2 天。确保胚胎发育中的种蛋不要离开孵化器(或温度低于 37.7 °C)超过 30 分钟。如有必要,分批进行接种。
6. 评估接种样本中可培养细胞的存在
- 将 100 μL VBNC 细菌悬浮液分配到 96 孔微孔板的多个孔中。计算孔数 ≥ 2 x 接种(胚胎 + 非胚胎)鸡蛋的数量。
- 如果使用步骤 5.2 中提到的对照条件,将 100 μL 的每种接种物(即矿泉水或可培养细菌)分配到同一 96 孔微孔板中的至少三个孔中。
- 使用多通道移液器,将 100 μL BHI 培养基添加到前两个步骤中制备的每个孔中。
- 在静态条件下将板在 37 °C 下孵育,以促进细菌在含有可培养细菌的孔中生长。根据可培养细菌的存在及其在这些条件下的再生速率,可能需要一个或多个孵育日才能完全显示含有可培养细菌的孔。
- 对于每种接种物,目视检查并计算细菌生长评分为阳性和阴性的孔数。
7. 监测胚胎活力
- 接种后第二天,用蜡烛照射胚胎卵子以检查胚胎致死性。
- 将含有死亡胚胎的鸡蛋放在一边,并根据受感染生物废物处理的机构指南丢弃它们。
8. 胚胎蛋的加工
- 从培养箱和蜡烛中回收胚胎卵,以检查胚胎致死性。丢弃死胚胎,不要在最终结果中考虑它们。
- 撕下鸡蛋上的贴纸,用浸泡了 70% (v/v) 乙醇的薄纸对蛋壳的顶端(覆盖气穴)进行消毒。
- 使用一把干净的解剖剪刀,从注射点切开外壳,露出气穴。使用一把干净的解剖镊子撕开将气穴与鸡蛋其余部分隔开的内壳膜。
- 小心地将鸡蛋内容物倒入无菌培养皿中。使用一把镊子,将胚胎分离并转移到新的培养皿上。如有必要,用无菌 PBS 洗涤胚胎。
- 将胚胎转移到含有 4 mL 无菌 PBS 的 15 mL 离心管中。使用匀浆器(速度:10,000 rpm)解离胚胎。通过依次将分散工具的尖端加入无菌 PBS、70% (v/v) 乙醇和无菌 PBS 中,在每次均质之间清洁分散工具的尖端。
- 将 500 μL 胚胎匀浆接种在 BHI 琼脂上。将板在 37 °C 下孵育过夜(如有必要,或更长时间)。
注:或者,如果未稀释的匀浆中预计 CFU 值升高(即 > 300),则可以接种匀浆的连续稀释液。 - 对于每个接种组,计算琼脂平板上单 核细胞增生李斯特 菌生长评分为阳性和阴性的鸡蛋数量。
注意:尽管在无菌条件下进行胚胎提取和匀浆,但使用非选择性琼脂培养基接种胚胎匀浆存在污染物生长的风险。使用属/种特异性生长培养基或补充选择性抗生素(仅测试的细菌菌株具有耐药性)可以减少或防止此类污染。
9. 未胚胎鸡蛋的加工
- 从孵化器中回收未胚胎的鸡蛋。重复步骤 8.2 和 8.3 以获得蛋清。
- 使用微量移液器收集 500 μL 蛋白并直接铺在 BHI 琼脂上。如有必要,将板在 37 °C 下孵育过夜或更长时间。
- 对于每个接种组,计算琼脂平板上单 核细胞增生李斯特 菌生长评分为阳性的鸡蛋数量。
结果
为了测试鸡胚模型恢复因在矿泉水中饥饿而产生的细胞壁缺陷型单核细胞增生李斯特菌 VBNC 形式的潜力,重要的是要阐明 VBNC 细菌接种物的制备时间(≥ 28 天)和胚胎卵的制备时间(6 天)。因此,在计划的卵接种日前 28 天,将单核细胞增生李斯特菌的重复悬浮液设置在矿泉水中,浓度为 1 x 106 CFU/mL。该起始细菌浓度显示,28 天后所需的残留培养率为 <1 CFU/mL31。对悬浮液的细菌细胞培养性和活力水平的最终验证导致选择了每毫升含有 1 x 106 个活细胞和 0.5 个可培养细胞的 VBNC 单核细胞增生李斯特菌接种物。在实验中,将 100 μL 这种接种物(即 1 x 105 个活细胞和 < 0.1 CFU)输送到已发卵和非发卵组。通过向胚胎和非胚胎卵注射相同剂量体积的矿泉水或在 BHI 肉汤中生长过夜的 5 x 103 CFU/mL 单核细胞增生李斯特菌悬浮液,平行制备对照组。
接种后 2 天,对卵子进行处理以评估可培养的 单核细胞增生李斯特菌的存在。正如预期的那样,注射矿泉水的不育对照组鸡蛋没有恢复细菌生长,而用可培养的李 斯特 菌处理的对照组 100% 的鸡蛋在琼脂培养基上的生长评分为阳性(表 1)。重要的是,从接种 VBNC 细菌的鸡蛋中回收的所有胚胎都导致单 核细胞增生李斯特 菌在平板上生长,这与注射相同 VBNC 细菌的非胚胎卵子的内容物在每个平板上完全不存在形成鲜明对比(表 1)。这一结果强调了鸡胚胎对 VBNC 单核细胞增生李斯特菌觉醒过程的要求,如前所述30。
为了确定从注射 VBNC 细菌的胚胎卵中检索到的 单核细胞增生李斯特 菌生长来自真正的 VBNC 细胞恢复的可能性,而不是来自挥之不去的可培养细胞的再生,有必要比较在卵子传代前后产生细菌生长的接种剂量的频率。为了获得前者,将多个 100 μL 剂量的 VBNC 细菌接种物与 BHI(一种营养丰富的培养基,不支持 VBNC 单核细胞增生李斯特 菌32)在 96 孔板中混合,并在 37 °C 下孵育。 9.5% 的接种 BHI 孔细菌生长阳性的频率(84 个中的 8 个)与 100% 的鸡蛋显示可培养细菌的频率显着不同(Fisher 精确检验,p = 1.6 × 10-17)(表 1)。这种显着且具有统计学意义的差异强烈表明,从胚胎卵中恢复的 单核细胞增生李斯特 菌生长主要是由于 VBNC 细菌的再激活。此外,与其营养形式不同, VBNC 单核细胞增生李斯特 菌无法在未胚胎卵中复活,这支持了 VBNC 细胞在胚胎卵中的复活不是由于接种物中残留的可培养细菌。
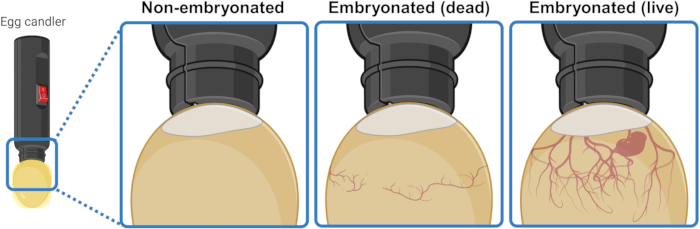
图 1:通过验蛋区分未胚胎、死胚胎和活胚胎鸡蛋。 胚胎发生状态是通过用光源(种蛋烛光机)近距离照射种蛋来确定的。含有发育中的活胚胎(可见或不可见)的卵子显示出从气囊向下扩展的强大血管网络。这种网络在胚胎死亡的种蛋中表现为塌陷和杂乱无章,而在未能开始胚胎发生的种蛋中则完全不存在。创建于 BioRender.com。 请单击此处查看此图的较大版本。
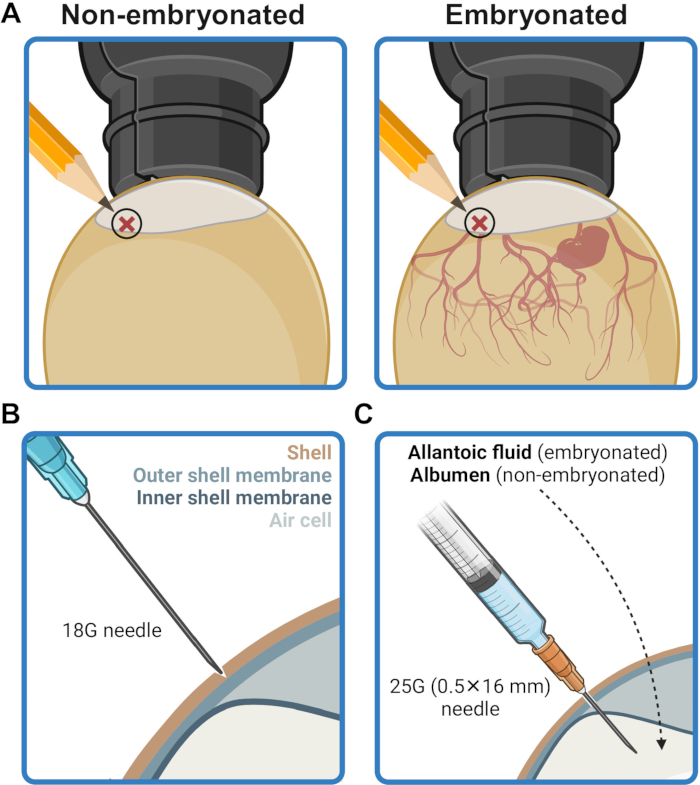
图 2:准备用于接种的卵子。(A) 注射部位标记在气穴边界上方 2-5 mm 的位置,如验蛋所示。 (B) 在 18G 针尖的帮助下,注射部位的外壳被穿刺凹陷,而不会刺穿外壳膜。 (C) 接种物通过 25 克(0.5 毫米 x 16 毫米)针头输送到胚胎卵中的尿囊液或非胚胎卵中的蛋白中。创建于 BioRender.com。 请单击此处查看此图的较大版本。
| 接种 | 卵传代前a 的可培养性 | 卵代b 后的可培养性 | |||
| 胚胎卵 | p 值c | 未胚胎蛋 | p 值d | ||
| 矿泉水 | 0/3 (0%) | 0/10 (0%) | >0.999 | 0/10 (0%) | >0.999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| 可培养的 Lm | 3/3 (100%) | 8/8 (100%) | >0.999 | 2/2 (100%) | >0.999 |
| 一个细菌生长的 BHI 孔数/接种的 BHI 孔数。 | |||||
| 乙细菌生长的卵数/接种的卵数。 | |||||
| c胚胎卵子传代前后的可培养性比较(双侧 Fisher 精确检验)。 | |||||
| d非胚胎种蛋传代前后的可培养性比较(双侧 Fisher 精确检验)。 | |||||
表 1:VBNC 单核细胞增生李斯特菌在胚胎鸡蛋中传代后恢复到可培养状态。仅用 100 μL 矿泉水或可培养(500 个细胞)的矿泉水悬浮液接种胚胎和非胚胎鸡蛋(6 天)单核细胞增生李斯特菌。2 天后,回收胚胎(或非胚胎卵中的蛋白)并接种在 BHI 琼脂上,以评估可培养的单核细胞增生李斯特菌的存在。通过在 96 孔微孔板的多个孔中将 100 μL 每种悬浮液与 BHI 肉汤混合,并对在 37 °C 下孵育后细菌生长的孔数进行评分,确定卵传代前接种剂量中存在的可培养细胞的频率。 使用双尾 Fisher 精确检验计算统计显著性,p 值≥ 0.05 被认为不显著。此表复制自31.
讨论
与活但不可培养 (VBNC) 形式的细菌病原体相关的公共卫生和经济风险是它们逃避常规微生物生长方法检测的能力以及它们对临床和食品工业环境中使用的大多数抗菌剂的耐受性/不敏感性的结果26,33.因此,迫切需要找到研究工具和模型,以更好地了解驱动 VBNC 状态下细菌细胞过渡、维持和复苏的机制。
在许多方面,鸡胚胎是更传统的哺乳动物研究模型(例如,小鼠、大鼠、兔子)的有利替代品。从技术上讲,与卵生生物一起工作更实用,因为它的胚胎发育速度快,并且发生在外部并且独立于其祖先。重要的是,与鸡蛋和胚胎的生产、住房和维护相关的财务和物流负担明显较低。此外,易于获得大量数据,可以并行测试多个实验条件和/或重复,并生成全面且统计稳健的数据。尽管非哺乳动物模型(如鱼类或线虫)可以提供类似的优势,但鸡胚胎作为一种温血脊椎动物,在进化上更接近人类,因此在免疫学、疾病建模、发育和毒理学等领域是更好的研究模型。从道德的角度来看,胚胎模型也更易于使用,尤其是在发育的前三分之二期间,当成熟的伤害感受系统尚未建立时8。这个短时间窗口对于需要快速周转时间的应用(例如,药物测试1)来说很方便,但可能会限制持续到胚胎发生后期甚至孵化后生命的分析(例如,发育和行为研究)。缺乏适应性免疫系统也使鸡胚胎成为宿主-病原体相互作用和癌症生物学等领域的有用研究工具7。
鸡胚已广泛用于微生物毒力的研究 9,10,11,12,13,14,15,16,17,18,但很少作为复活 VBNC 病原体的模型 27,28,29,30.在这里,我们提供了详细的方法学描述,说明该体内系统如何成功用于拯救 VBNC 单核细胞增生李斯特菌。
该方法中要考虑的一个关键点是可培养细胞的残留存在及其压倒真正的 VBNC 细胞复兴的潜力。VBNC 细胞生产方法在解决此问题方面的局限性(VBNC 细胞纯度水平与起始细菌浓度相结合)增加了采用替代方法来完全消除污染性可培养细胞或将其降低到可忽略不计的水平的需求。例如,这些方法可能包括通过专门针对可培养细胞的抗菌剂进行中和/杀灭。或者,可以通过流式细胞术根据独特的形态生理特征(例如,细胞形状、表面或细胞质结构或分子)实现可培养细胞群的物理去除。这种方法具有额外的优势,即允许分离/纯化具有不同年龄(即在不同时间点形成)的 VBNC 细胞亚群,这些亚群也可以在 ovo 中 测试其复苏能力。
该方法需要注意的其他要点包括小心处理胚胎蛋,尤其是在注射步骤期间和之后(以避免意外的与针头相关的创伤或致命),并努力减少最佳孵化温度之外的作时间。此外,尽管应在无菌条件下进行胚胎的取出、处理和铺板,但琼脂平板上仍可能发生不需要的微生物生长。这可以通过使用对感兴趣的细菌物种具有选择性的配方(基础组合物和/或补充剂)的琼脂培养基或使用对给定抗生素具有抗性的菌株来解决。
这项工作将鸡胚胎展示为一种简单但功能强大且具有成本效益的 体内 模型,以研究细菌休眠的机制方面。在这种情况下,它有可能用于通过筛选单个细菌突变体来识别与 VBNC 状态觉醒过程有关的细菌因子,或者通过使用混合文库(例如,转座子突变文库)在全基因组范围内鉴定。
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了 Micalis Institute (AAP Micalis FAMe 2023) 的资助。F.C. 得到了 Agence Nationale de Recherche (THOR: ANR-20-CE15-0008;PERMALI:ANR-20-CE35-0001)。
材料
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
参考文献
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。