Method Article
L’embryon de poulet comme modèle in vivo pour faire revivre des agents pathogènes viables mais non cultivables
Dans cet article
Résumé
Cette méthode présente l’embryon de poulet comme un modèle in vivo simple et rentable pour faire revivre l’agent pathogène bactérien L. monocytogenes à partir d’un état viable mais non cultivable (VBNC) et avec des utilisations potentielles dans la compréhension des mécanismes de dormance bactérienne.
Résumé
L’embryon de poulet est devenu un modèle in vivo populaire avec une application croissante dans la recherche biomédicale en raison de sa simplicité, de son prix abordable et de son adaptabilité dans l’étude de divers phénomènes biologiques. Ce modèle a été utilisé pour étudier la pathogénicité microbienne et devient un outil utile pour étudier la dormance bactérienne. L’état viable mais non cultivable (VBNC) est un état dormant dans lequel les bactéries deviennent métaboliquement quiescentes et résistantes à la culture pour préserver leur viabilité dans des environnements difficiles. Dans des conditions favorables, les bactéries VBNC peuvent se réveiller dans un état métaboliquement actif et cultivable. Les agents pathogènes bactériens qui passent à un état VBNC, comme la listériose d’origine alimentaire Listeria monocytogenes, sont un problème de santé publique, car ils échappent à la détection par les méthodes conventionnelles dépendantes de la croissance et peuvent retrouver leur virulence lors de la réanimation. Cela nécessite une meilleure compréhension des conditions et des mécanismes à l’origine de la renaissance des agents pathogènes VBNC. La méthode présentée ici présente l’embryon de poulet comme un modèle in vivo efficace pour ramener VBNC L. monocytogenes à un état cultivable. Là où les tentatives de réanimation in vitro , largement basées sur la reconstitution nutritionnelle, ont été improductives, ce protocole réussit à promouvoir la réactivation des formes VBNC déficientes en paroi cellulaire de L. monocytogenes générées par la famine dans l’eau minérale. Il est important de noter que les résultats obtenus soulignent la nécessité de l’embryon pour la renaissance de VBNC L. monocytogenes, indiquant un rôle important des facteurs associés à l’embryon dans ce processus. D’autres utilisations potentielles de cette méthode comprennent le dépistage et l’identification des facteurs bactériens impliqués dans les mécanismes de réactivation de l’état VBNC. Ce modèle peut ainsi donner un aperçu du fonctionnement moléculaire de la dormance bactérienne, dont la connaissance est essentielle pour réduire les risques de santé publique liés aux agents pathogènes indétectables.
Introduction
Dans la recherche de modèles de recherche in vivo alternatifs, avec des coûts associés réduits et des considérations logistiques et éthiques, l’embryon de poulet a émergé et est rapidement devenu l’undes systèmes modèles de vertébrés in vivo les plus applicables, gérables et reproductibles 1,2. Comparés à d’autres modèles d’animaux, tels que les rongeurs et les lapins, les œufs de poule fécondés sont peu coûteux à obtenir et ne nécessitent aucune logistique de logement complexe pour leur développement. De plus, la taille de l’œuf de poule permet de manipuler de nombreux embryons en parallèle, ce qui permet de soutenir un grand nombre de conditions/groupes de tests expérimentaux et de répétitions. La courte durée de l’embryogenèse (21 jours) et la simplicité d’accès et d’observation de l’embryon et des structures associées à n’importe quel moment de la période de développement en font un modèle utile dans divers domaines, tels que la biologie du développement (par exemple, la formation du cœur et du cerveau)3,4 et la pharmacologie (test de l’activité, de l’administration et de la toxicité du médicament)1,5, 6. Planche à voile De plus, le système immunitaire immature de l’embryon de poulet en fait un système approprié pour les études immunitaires et les approches liées à la recherche sur le cancer7. Il est important de noter qu’en raison de la nature embryonnaire de ce modèle, qui n’acquiert un système nociceptif mature qu’aux jours de développement 13-148, les applications de recherche menées dans ce délai ne sont pas limitées par des préoccupations juridiques et éthiques7.
Le modèle d’embryon de poulet a également été largement utilisé pour étudier la pathogénicité des microbes causant des maladies chez les humains et d’autres mammifères. En effet, de nombreuses études ont exploré et validé ce modèle pour étudier la virulence des protozoaires (par exemple, Neospora caninum, Eimeria tenella, Cryptosporidium spp.)9,10,11, des espèces fongiques (p. ex., Candida albicans, Aspergillus fumigatus)12,13 et bactériennes (p. ex., Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22, ainsi que pour tester l’effet thérapeutique des composés antimicrobiens 17,23.
Les micro-organismes, comme ceux mentionnés ci-dessus, sont souvent exposés à des stimuli stressants dans leur(s) environnement(s) et ont donc développé des stratégies d’adaptation au stress pour supporter des situations potentiellement nocives/mortelles. Certaines espèces bactériennes peuvent produire des structures très résistantes et métaboliquement dormantes appelées endospores, qui préservent l’intégrité cellulaire et génétique sous de sévères contraintes environnementales. Si des conditions environnementales favorables sont réunies, les endospores peuvent se régénérer en cellules actives viables par germination24. Les bactéries non sporulantes, cependant, peuvent entrer dans un état métaboliquement dormant alternatif appelé viable mais non cultivable (VBNC), dont le principal trait phénotypique est la perte de cultivabilité dans les milieux de croissance habituels25. Étant donné qu’une grande partie des 100 espèces bactériennes > signalées comme entrant dans un état de VBNC sont pathogènes pour les humains et d’autres animaux26, et que les agents pathogènes VBNC peuvent retomber dans un état métaboliquement actif et virulent25,26, l’échec des méthodes conventionnelles basées sur la croissance pour détecter les agents pathogènes VBNC est un problème de santé publique préoccupant. Les signaux environnementaux et les mécanismes moléculaires et physiologiques à l’origine de ce processus de renaissance ne sont pas encore bien compris et peuvent varier selon les espèces microbiennes et le(s) stress(s) induisant(s) de l’état VBNC.
Les chercheurs ont tiré parti des particularités du modèle d’embryon de poulet pour étudier la capacité de réanimation in vivo des pathogènes bactériens dans un état VBNC. Des isolats de C. jejuni d’origine humaine, poussés à un état VBNC par la privation nutritionnelle dans l’eau, ont retrouvé leur cultivabilité et leur virulence dans les cellules humaines après leur passage dans des œufs de poule embryonnés27. De même, des tentatives réussies de retour à l’état VBNC ont également été signalées pour d’autres agents pathogènes, tels que Edwardsiella tarda28, Legionella pneumophila29 et L. monocytogenes30.
Nous avons récemment rapporté que lorsque L. monocytogenes est poussé dans un état VBNC par la famine dans l’eau minérale, il passe d’une cellule en forme de bâtonnet à une cellule coccoïde. Nous avons révélé que cette transformation morphologique est causée par des dommages cumulatifs à la paroi cellulaire, conduisant à son excrétion complète par la bactérie, qui devient alors une forme cellulaire sphérique déficiente en paroi cellulaire31. Nos tentatives infructueuses de faire revivre ces formes VBNC L . monocytogenes sans paroi in vitro, en utilisant des approches de reconstitution des nutriments, nous ont amenés à étudier leur sauvetage potentiel in vivo. Compte tenu de son utilisation prometteuse avec L. monocytogenes30, nous avons sélectionné le modèle d’embryon de poulet pour cette tâche. Les résultats ont confirmé la capacité du système d’œufs de poule embryonnés à favoriser la restauration de VBNC L . monocytogenes déficiente en paroi cellulaire à un état cultivable actif31.
Ici, nous fournissons un protocole détaillé permettant la renaissance in vivo de L. monocytogenes à partir d’un état VBNC dormant par exposition à l’environnement embryonné de l’œuf de poule. Nous décrivons la préparation et la surveillance des œufs de poule et des bactéries VBNC, l’inoculation des œufs, le traitement des œufs embryonnés et non embryonnés, et l’évaluation de la charge bactérienne cultivable pour évaluer l’efficacité de la revitalisation des cellules VBNC. Les résultats réaffirment que l’embryon de poulet est un modèle simple, rentable et adapté pour comprendre les mécanismes régissant différents aspects de la vie microbienne, tels que la dormance bactérienne. Ce système in vivo peut être exploré davantage pour étudier la contribution de gènes bactériens individuels dans le processus de résurrection.
Protocole
Ce protocole suit les lignes directrices institutionnelles françaises (décret n° 2013-118) et européennes (directive 2010/63/UE) applicables à l’utilisation des animaux dans la recherche. De plus, en vertu de la loi française (décret n° 2020-274), ce protocole ne concerne pas les restrictions éthiques car toute expérimentation sur des embryons de poulet est réalisée et terminée avant le dernier tiers de la période d’embryogenèse (c’est-à-dire avant le 14e jour).
1. Préparation de la bactérie VBNC
- Striez des souches bactériennes à partir de stocks de glycérol (stockés à −80 °C) sur un milieu gélosé de perfusion cerveau-cœur (BHI) à l’aide de boucles d’inoculation. Incuber une nuit à 37 °C pour obtenir des colonies isolées.
REMARQUE : Au besoin, compléter le milieu gélosé avec un ou plusieurs antibiotiques auxquels la ou les souches possèdent une résistance (naturellement ou par modification génétique). - Pour chaque souche, préparez 2-3 tubes avec 5 mL de bouillon BHI et utilisez une boucle d’inoculation pour inoculer avec 2-3 colonies. Incuber les cultures pendant la nuit à 37 °C avec agitation (200 tr/min) pour faire pousser les bactéries jusqu’à la phase stationnaire. Chacune de ces cultures sera utilisée pour préparer des réplicats biologiques indépendants de suspensions bactériennes de VBNC.
- Diluer chaque culture 1:10 dans un bouillon BHI et mesurer la densité optique dans un spectrophotomètre à une longueur d’onde de 600 nm (OD600). La valeur OD600 des cultures en phase stationnaire de Listeria monocytogenes cultivées de manière optimale se situe entre 2 et 4. Cela équivaut à une concentration bactérienne de 2 à 4 x 109 unités formant colonies (UFC)/mL.
- Granuler 1 mL de culture bactérienne dans un microtube de 1,5 mL par centrifugation à 6 000 x g pendant 2 min. Aspirer le surnageant à l’aide d’une pompe à vide. Remettre en suspension la pastille cellulaire dans 1 mL d’eau minérale autoclavée et filtrée.
- Lavez soigneusement les bactéries en répétant l’étape 1.4 trois fois. Cela garantit l’élimination complète des nutriments du milieu de culture qui retarderaient autrement la formation des bactéries VBNC.
- Préparer des suspensions bactériennes à une concentration initiale de 10à 6 UFC/mL en ajoutant 30 μL de bactéries lavées dans des flacons de culture cellulaire T25 contenant 30 mL d’eau minérale.
- Mélangez les suspensions à l’aide d’une pipette sérologique. Conservez-les à température ambiante, dans des conditions d’éclairage statique (flacon en position verticale) et tamisées.
2. Surveillance de la formation de la bactérie VBNC
- Déterminer la population cultivable dans les suspensions bactériennes le 1erjour ( immédiatement après la préparation) puis sur une base hebdomadaire, comme décrit ci-dessous.
- Préparer des dilutions en série de 10 fois de la suspension bactérienne VBNC dans l’eau minérale (de 10-1 à 10-3 dilutions). Déposer 100 μL de suspension non diluée et de chaque dilution, en deux exemplaires, sur gélose BHI et incuber pendant une nuit à 37 °C.
REMARQUE : Lorsque la cultivabilité approche < 1 UFC/mL, un volume plus important (0,5 à 2 mL) de la suspension non diluée doit être mis en plaques pour confirmer la présence ou l’absence de bactéries cultivables. - Calculez la concentration de bactéries cultivables comme suit :
concentration de bactéries cultivables (UFC/mL) = (nombre moyen de colonies x facteur de dilution de l’échantillon) / volume de l’échantillon en boîte (en mL).
- Préparer des dilutions en série de 10 fois de la suspension bactérienne VBNC dans l’eau minérale (de 10-1 à 10-3 dilutions). Déposer 100 μL de suspension non diluée et de chaque dilution, en deux exemplaires, sur gélose BHI et incuber pendant une nuit à 37 °C.
- Déterminer la population viable dans les suspensions bactériennes le 1erjour ( immédiatement après la préparation) puis sur une base hebdomadaire, comme décrit ci-dessous.
- Incuber un échantillon de la suspension bactérienne (c.-à-d. à une concentration d’environ 106 cellules/mL) avec le colorant de viabilité 5(6)-carboxyfluorescéine diacétate (CFDA) à une concentration finale de 30 μM pendant 30 min dans l’obscurité. Préparez également un échantillon sans CFDA (contrôle non coloré) et un échantillon traité à 95 °C pendant 30 minutes avant l’incubation avec CFDA (contrôle des cellules mortes non viables).
- Analysez les échantillons à l’aide d’un cytomètre en flux équipé d’un laser d’excitation de 488 nm et d’un détecteur d’émission de 520 nm pour la fluorescence CFDA. Pour la robustesse statistique, acquérir environ 1 x 105 événements bactériens par échantillon (ce qui se traduit par un volume d’échantillon acquis de 10 à 100 μL) à un débit d’au moins 30 μL/min.
- Utilisez l’échantillon non coloré pour trouver et localiser les événements associés aux bactéries dans un graphique de diffusion directe à l’échelle logarithmique (FSC) en fonction de la diffusion latérale (SSC). Tracez les événements bactériens déclenchés dans un histogramme de fluorescence CFDA à l’échelle logarithmique et utilisez les échantillons de cellules non colorées et non viables/mortes pour distinguer les populations viables (CFDA positives) des populations non viables (CFDA négatives).
- Calculez la concentration de bactéries viables comme suit :
concentration de bactéries viables (cellules/mL) = nombre moyen d’événements positifs à la CFDA dans l’échantillon acquis / volume d’échantillon acquis (en mL)
REMARQUE : Selon le modèle de cytomètre, la quantification cellulaire peut nécessiter l’utilisation de billes de comptage par cytométrie en flux.
3. Incubation des œufs
- À la réception du fournisseur, laissez les ovules fécondés être conservés à température ambiante jusqu’au lendemain.
- Pendant ce temps, remplissez le réservoir d’eau de l’incubateur d’œufs avec de l’eau déminéralisée et allumez l’appareil. Réglez la température à 37,7 °C et l’humidité relative maximale à 47 %.
REMARQUE : Dans nos mains, les œufs sont incubés dans une plage d’humidité relative de 38 % à 42 %, sans impact visible sur le taux d’embryogenèse et le succès attendus. - Transférez les ovules dans l’incubateur pour initier l’embryogenèse. Placez-les sur le(s) plateau(s) de l’incubateur avec la poche d’air vers le haut (c’est-à-dire l’extrémité pointue vers le bas).
- Incuber les œufs pendant 6 jours. Après 4 jours, distinguez les œufs embryonnés vivants des œufs morts ou non embryonnés par mirage.
- Placez l’œuf sous/au-dessus d’une source lumineuse puissante (chandelle) pour éclairer l’intérieur et discerner visuellement son contenu. Après 3 ou 4 jours d’incubation, les œufs embryonnés vivants présentent un réseau de vaisseaux sanguins qui s’étendent vers le bas à partir de la poche d’air. Ce réseau semble effondré et désorganisé dans les œufs embryonnés morts et est complètement absent dans les œufs qui n’ont pas réussi à démarrer l’embryogenèse. S’il est visible, un embryon vivant peut même présenter des contractions (Figure 1).
4. Préparation des œufs pour l’inoculation
- Le jour de l’inoculation, mettez les œufs à la bougie pour déterminer le nombre disponible d’œufs germnés et non embryonnés viables. Identifiez les ovules non embryonnés (environ 10 à 20 % du nombre total) et tous les ovules contenant des embryons morts, comme décrit à l’étape 3.4. Jetez ces derniers conformément aux directives institutionnelles pour l’élimination des déchets biologiques.
- Marquez le point d’injection sur la coquille de l’œuf à 2-5 mm au-dessus du bord de la poche d’air (figure 2A). Désinfectez cette zone en frottant avec du papier de soie imbibé d’éthanol à 70 % (v/v).
- À l’aide d’une aiguille 18G, faites soigneusement une entaille perforante sur la coquille au point d’injection sans percer la membrane de la coquille (figure 2B). Désinfectez le point d’injection avec un papier de soie imbibé d’éthanol à 70 % (v/v).
5. Inoculation des œufs
- Branchez une aiguille de 25 g (0,5 mm x 16 mm) dans une seringue de 1 mL et remplissez-la de suspension bactérienne VBNC. Si nécessaire, retirez les bulles d’air collées à la paroi intérieure de la seringue en la tapotant avec un doigt.
- Effectuer l’inoculation avec de l’eau minérale seule ou une suspension de L. monocytogenes (5 x 103 UFC/mL) cultivée pendant la nuit dans un bouillon BHI comme conditions de contrôle de la stérilité et de la croissance dérivée de bactéries cultivables, respectivement.
- Introduisez l’aiguille à travers la coquille perforée au point d’injection et insérez-la tout le long, à un angle perpendiculaire, jusqu’à ce que la base de l’aiguille touche la surface de la coquille (figure 2C). Cela positionne la pointe de l’aiguille pour délivrer le contenu de la seringue dans la cavité allantoïdienne (dans les ovules embryonnés) ou l’albumen (dans les ovules non embryonnés).
- Injectez soigneusement et lentement 100 μL de l’inoculum. Gardez l’angle de l’aiguille aussi immobile que possible à l’intérieur d’un œuf embryonné pour éviter de causer des blessures mortelles à l’embryon.
- Retirez soigneusement et lentement l’aiguille et couvrez le point d’injection avec un autocollant rond pour sceller le site d’entrée de l’inoculation. Pour plus de commodité et de clarté, utilisez des autocollants d’une couleur différente pour chaque condition/groupe d’œufs.
- Remettez les œufs inoculés dans l’incubateur pendant 2 jours supplémentaires. Assurez-vous que les ovules dont les embryons sont en développement ne sont pas hors de l’incubateur (ou à une température inférieure à 37,7 °C) pendant plus de 30 minutes. Effectuez l’inoculation par lots, si nécessaire.
6. Évaluation de la présence de cellules cultivables dans les échantillons d’inoculation
- Distribuer 100 μL de suspension bactérienne VBNC dans plusieurs puits d’une microplaque de 96 puits. Calculez le nombre de puits ≥ 2 x le nombre d’œufs inoculés (embryonnés + non embryonnés).
- Si vous utilisez les conditions de contrôle mentionnées à l’étape 5.2, versez 100 μL de chaque inoculum (c.-à-d. de l’eau minérale ou des bactéries cultivables) dans au moins trois puits dans la même microplaque de 96 puits.
- À l’aide d’une pipette multicanaux, ajoutez 100 μL de milieu BHI dans chacun des puits préparés lors des deux étapes précédentes.
- Incuber la plaque à 37 °C dans des conditions statiques pour favoriser la croissance bactérienne dans les puits contenant des bactéries cultivables. En fonction de la présence de bactéries cultivables et de leur taux de repousse dans ces conditions, un ou plusieurs jours d’incubation peuvent être nécessaires pour révéler complètement les puits contenant des bactéries cultivables.
- Pour chaque inoculum, inspectez visuellement et comptez le nombre de puits ayant obtenu des résultats positifs et négatifs pour la croissance bactérienne.
7. Suivi de la viabilité embryonnaire
- Le lendemain de l’inoculation, mettez les œufs embryonnés à la bougie pour vérifier la létalité de l’embryon.
- Mettez de côté les ovules contenant des embryons morts et jetez-les conformément aux directives institutionnelles pour l’élimination des déchets biologiques infectés.
8. Traitement des ovules embryonnés
- Récupérez les ovules embryonnés de l’incubateur et de la bougie pour vérifier la létalité de l’embryon. Jetez les embryons morts et ne les considérez pas dans les résultats finaux.
- Retirez l’autocollant de l’œuf et désinfectez l’extrémité supérieure de la coquille (en recouvrant la poche d’air) avec du papier de soie imbibé d’éthanol à 70 % (v/v).
- À l’aide d’une paire de ciseaux de dissection propres, ouvrez la coquille à partir du point d’injection pour exposer la poche d’air. À l’aide d’une pince à épiler de dissection propre, déchirez la membrane de la coquille intérieure qui sépare la poche d’air du reste de l’œuf.
- Videz soigneusement le contenu de l’œuf dans une boîte de Pétri stérile. À l’aide d’une pince à épiler, isolez et transférez l’embryon dans une nouvelle boîte de Pétri. Lavez l’embryon avec du PBS stérile, si nécessaire.
- Transférez l’embryon dans un tube à centrifuger de 15 ml contenant 4 ml de PBS stérile. Dissocier l’embryon à l’aide d’un homogénéisateur (vitesse : 10 000 tr/min). Nettoyez l’extrémité de l’outil de dispersion entre chaque homogénéisation en le passant séquentiellement dans du PBS stérile, de l’éthanol à 70 % (v/v), puis à nouveau du PBS stérile.
- Plaque 500 μL de l’homogénat embryonnaire sur gélose BHI. Incuber les plaques à 37 °C pendant la nuit (ou plus, si nécessaire).
REMARQUE : En option, des dilutions en série de l’homogénat peuvent être plaquées dans le cas où des nombres CFU élevés (c’est-à-dire > 300) sont attendus dans l’homogénat non dilué. - Pour chaque groupe d’inoculation, comptez le nombre d’ovules positifs et négatifs pour la croissance de L. monocytogenes sur des plaques de gélose.
REMARQUE : Malgré les conditions aseptiques dans lesquelles l’extraction et l’homogénéisation des embryons sont effectuées, l’utilisation d’un milieu gélosé non sélectif pour le placage des homogénats d’embryons comporte un risque de croissance de contaminants. L’utilisation d’un milieu de croissance spécifique à un genre ou à une espèce ou une supplémentation avec un antibiotique sélectif (auquel seule la souche bactérienne testée est résistante) peut réduire ou prévenir une telle contamination.
9. Traitement des ovules non embryonnés
- Récupérez les ovules non embryonnés de l’incubateur. Répétez les étapes 8.2 et 8.3 pour accéder au blanc d’œuf.
- À l’aide d’une micropipette, prélever 500 μL d’albumen et l’étaler directement sur la gélose BHI. Incuber les plaques à 37 °C pendant la nuit ou plus longtemps, si nécessaire.
- Pour chaque groupe d’inoculation, compter le nombre d’ovules dont la croissance de L. monocytogenes est positive sur des plaques de gélose.
Résultats
Pour tester le potentiel du modèle d’embryon de poulet à raviver les formes VBNC déficientes en paroi cellulaire de L. monocytogenes générées par la famine dans l’eau minérale, il était important d’articuler le moment de la préparation de l’inoculum bactérien VBNC (≥ 28 jours) avec celui des œufs embryonnés (6 jours). Des suspensions répétées de L. monocytogenes ont ainsi été mises en place à une concentration de 1 x 106 UFC/mL dans de l’eau minérale 28 jours avant le jour prévu de l’inoculation des œufs. Il a été démontré que cette concentration bactérienne de départ se traduisait par une cultivabilité résiduelle souhaitée de <1 UFC/mL après 28 jours31. Une vérification finale des niveaux de cultivabilité et de viabilité des cellules bactériennes des suspensions a abouti à la sélection d’un inoculum VBNC L . monocytogenes contenant 1 x 106 cellules viables et 0,5 cellule cultivable par ml. À des fins d’expérimentation, 100 μL de cet inoculum (c.-à-d. 1 x 10 5cellules viables et < 0,1 UFC) ont été administrés dans des groupes d’ovules embryonnés et non embryonnés. Des groupes témoins ont été préparés en parallèle en injectant des œufs embryonnés et non embryonnés avec le même volume de dose d’eau minérale ou d’une suspension de 5 x 103 UFC/mL de L. monocytogenes cultivés pendant la nuit dans un bouillon BHI.
2 jours après l’inoculation, les ovules ont été traités pour évaluer la présence de L. monocytogenes cultivables. Comme prévu, aucune croissance bactérienne n’a été récupérée dans les œufs du groupe témoin de stérilité injectés avec de l’eau minérale, tandis que 100 % des œufs du groupe témoin traités avec L. monocytogenes cultivables ont obtenu des résultats positifs pour la croissance sur milieu gélosé (tableau 1). Il est important de noter que tous les embryons récupérés à partir d’œufs inoculés avec des bactéries VBNC ont donné lieu à une croissance de L. monocytogenes sur la plaque, contrastant avec son absence totale sur chaque plaque étalée avec le contenu d’un œuf non embryonné injecté avec la même bactérie VBNC (tableau 1). Ce résultat souligne la nécessité de l’embryon de poulet pour le processus d’éveil de VBNC L. monocytogenes, comme indiqué précédemment30.
Pour déterminer la probabilité que la croissance de L. monocytogenes récupérée à partir d’œufs embryonnés injectés avec des bactéries VBNC provienne d’une véritable récupération de cellules VBNC, et non de la repousse de cellules cultivables persistantes, il est nécessaire de comparer la fréquence des doses d’inoculum produisant une croissance bactérienne avant et après le passage de l’œuf. Pour obtenir le premier, plusieurs doses de 100 μL de l’inoculum bactérien VBNC ont été mélangées avec du BHI, un milieu riche en nutriments qui ne soutient pas la renaissance de VBNC L. monocytogenes 32, dans une plaque de 96 puits et incubées à 37 °C. La fréquence de 9,5 % des puits BHI inoculés positifs pour la croissance bactérienne (8 sur 84) différait significativement (test exact de Fisher, p = 1,6 × 10−17) de la fréquence de 100 % des œufs montrant des bactéries cultivables récupérées (tableau 1). Cette différence substantielle et statistiquement significative indique fortement que la croissance de L. monocytogenes récupérée à partir d’œufs embryonnés était en grande partie due à la réactivation des bactéries VBNC. De plus, contrairement à ses formes végétatives, VBNC L. monocytogenes n’a pas pu revivre dans les œufs non embryonnés, ce qui soutient que la réanimation des cellules VBNC dans les œufs embryonnés n’est pas due aux bactéries cultivables résiduelles dans l’inoculum.
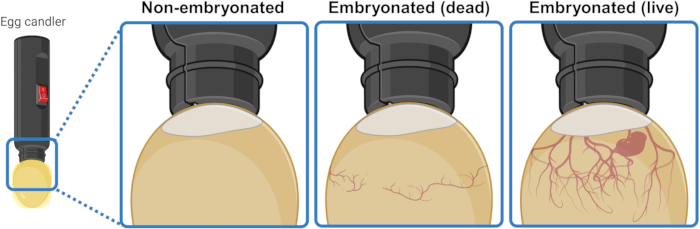
Figure 1 : Distinction entre les œufs de poule non embryonnés, embryonnés morts et embryonnés vivants par mirage. L’état de l’embryogenèse est déterminé en éclairant l’œuf à l’aide d’une source lumineuse (bougie d’œuf) à courte distance. Les ovules contenant un embryon vivant en développement (visible ou non) présentent un fort réseau de vaisseaux sanguins qui s’étendent vers le bas à partir de la poche d’air. Ce réseau apparaît effondré et désorganisé dans les œufs avec des embryons morts et est complètement absent dans les œufs qui n’ont pas réussi à démarrer l’embryogenèse. Créé en BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
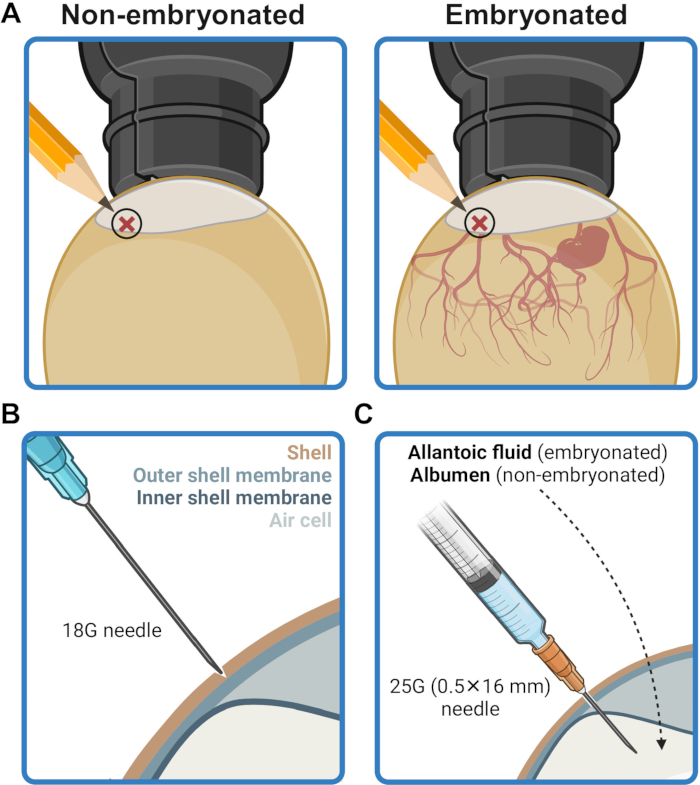
Figure 2 : Préparation de l’œuf pour l’inoculation. (A) Le site d’injection est marqué à une position de 2 à 5 mm au-dessus de la bordure de la poche d’air, comme on peut le voir au mirage. (B) La coquille au site d’injection est perforée à l’aide de la pointe d’une aiguille 18G sans percer la membrane externe de la coquille. (C) L’inoculum est administré à l’aide d’une aiguille de 25 G (0,5 mm x 16 mm) dans le liquide allantoïdien des ovules embryonnés ou dans l’albumen des ovules non embryonnés. Créé en BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Inoculum | Cultivabilité avant le passagede l’œuf a | Culturabilité après le passage de l’œufb | |||
| Ovules embryonnés | Valeur pc | Ovules non embryonnés | Valeur pd | ||
| Eau minérale | 0/3 (0%) | 0/10 (0%) | >0,999 | 0/10 (0%) | >0,999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| Lm cultivable | 3/3 (100%) | 8/8 (100%) | >0,999 | 2/2 (100%) | >0,999 |
| unNombre de puits BHI avec croissance bactérienne/Nombre de puits BHI inoculés. | |||||
| bNombre d’œufs avec croissance bactérienne/Nombre d’œufs inoculés. | |||||
| cComparaison de la culturabilité avant et après le passage dans les œufs embryonnés (test exact de Fisher à deux faces). | |||||
| dComparaison de la culturabilité avant et après le passage dans des œufs non embryonnés (test exact de Fisher à deux faces). | |||||
Tableau 1 : VBNC L. monocytogenes revient à un état cultivable après passage dans des œufs de poule embryonnés. Des œufs de poule embryonnés et non embryonnés (6 jours) ont été inoculés avec 100 μL d’eau minérale uniquement ou avec des suspensions d’eau minérale de VBNC (1 x 104 cellules, 28 jours) ou cultivables (500 cellules) de L. monocytogenes. Après 2 jours, les embryons (ou l’albumen dans les œufs non embryonnés) ont été récupérés et placés sur gélose BHI pour évaluer la présence de L. monocytogenes cultivables. La fréquence des cellules cultivables présentes dans une dose d’inoculation avant le passage de l’œuf a été déterminée en mélangeant 100 μL de chaque suspension avec du bouillon BHI dans plusieurs puits d’une microplaque de 96 puits et en marquant le nombre de puits avec une croissance bactérienne après l’incubation à 37 °C. La signification statistique a été calculée à l’aide d’un test exact de Fisher bilatéral, les valeurs p ≥ 0,05 étant considérées comme non significatives. Ce tableau est reproduit à partir de31.
Discussion
Les risques pour la santé publique et l’économie associés aux formes viables mais non cultivables (VBNC) d’agents pathogènes bactériens sont la conséquence de leur capacité à échapper à la détection par les méthodes conventionnelles basées sur la croissance microbienne ainsi que de leur tolérance/insensibilité à la plupart des antimicrobiens utilisés dans les milieux cliniques et de l’industrie alimentaire26,33. Il devient donc urgent de trouver des outils de recherche et des modèles pour mieux comprendre les mécanismes à l’origine de la transition, du maintien et de la renaissance des cellules bactériennes dans un état VBNC.
À bien des égards, l’embryon de poulet est une alternative avantageuse aux modèles de recherche plus conventionnels sur les mammifères (p. ex., souris, rat, lapin). Il est techniquement plus pratique de travailler avec un organisme ovipare, car son développement embryonnaire est rapide et se produit à l’extérieur et indépendamment de son géniteur. Il est important de noter que les charges financières et logistiques associées à la production, au logement et à l’entretien des œufs de poule et des embryons sont nettement inférieures. De plus, la facilité d’obtenir de grands nombres permet de tester en parallèle plusieurs conditions expérimentales et/ou répétitions et de générer des données complètes et statistiquement robustes. Bien que les modèles non mammifères, tels que les poissons ou les nématodes, puissent offrir des avantages similaires, l’embryon de poulet, en tant que vertébré à sang chaud, est plus proche des humains sur le plan de l’évolution et constitue donc un meilleur modèle de recherche dans des domaines tels que l’immunologie, la modélisation des maladies, le développement et la toxicologie. Les modèles embryonnaires sont également plus simples à travailler d’un point de vue éthique, en particulier pendant les deux premiers tiers du développement, lorsqu’un système nociceptif mature n’est pas encore établi8. Cette courte fenêtre de temps est pratique pour les applications nécessitant des délais d’exécution rapides (par exemple, test de drogue1), mais peut poser des restrictions pour les tests qui durent jusqu’aux stades ultérieurs de l’embryogenèse ou même après l’éclosion (par exemple, les études de développement et de comportement). L’absence d’un système immunitaire adaptatif fait également de l’embryon de poulet un outil de recherche utile dans des domaines tels que les interactions hôte-pathogène et la biologie du cancer7.
L’embryon de poulet a été largement utilisé dans l’étude de la virulence microbienne 9,10,11,12,13,14,15,16,17,18, mais avec parcimonie comme modèle pour raviver les agents pathogènes VBNC 27,28,29,30. Ici, nous avons fourni une description méthodologique détaillée de la façon dont ce système in vivo peut être utilisé avec succès pour le sauvetage de VBNC L. monocytogenes.
Un point critique à considérer dans cette méthode est la question de la présence résiduelle de cellules cultivables et de leur potentiel à dominer la véritable renaissance des cellules VBNC. Les limites de la méthode de production de cellules VBNC pour résoudre ce problème (les niveaux de pureté des cellules VBNC sont associés à la concentration bactérienne initiale) soulèvent la nécessité d’employer des approches alternatives pour éliminer complètement les cellules cultivables contaminantes ou les réduire à un niveau négligeable. Ces approches peuvent inclure, par exemple, la neutralisation/destruction par des antimicrobiens ciblant exclusivement des cellules cultivables. Alternativement, l’élimination physique de la population cellulaire cultivable peut être réalisée sur la base de caractéristiques morphophysiologiques uniques (par exemple, la forme des cellules, les structures ou molécules de surface ou cytoplasmiques) par cytométrie en flux. Cette approche présente l’avantage supplémentaire de permettre l’isolement et la purification de sous-populations de cellules VBNC d’âges différents (c.-à-d. formées à différents moments temporels), qui peuvent également être testées in ovo pour leur capacité de revitalisation.
D’autres points de cette méthode nécessitant une attention particulière comprennent la manipulation soigneuse des ovules embryonnés, en particulier pendant et immédiatement après l’étape d’injection (pour éviter un traumatisme ou une létalité involontaire associée à l’aiguille), et la volonté de réduire le temps de manipulation en dehors de la température d’incubation optimale. De plus, malgré les conditions aseptiques dans lesquelles le prélèvement, le traitement et l’ensemencement des embryons doivent être effectués, une croissance microbienne indésirable sur les plaques de gélose peut toujours se produire. Ce problème peut être résolu par l’utilisation d’un milieu gélosé avec une formulation (composition basale et/ou suppléments) sélective pour l’espèce bactérienne d’intérêt ou par l’utilisation d’une souche résistante à un antibiotique donné.
Ce travail présente l’embryon de poulet comme un modèle in vivo simple, mais puissant et rentable pour étudier les aspects mécanistes de la dormance bactérienne. Dans ce contexte, il peut potentiellement être utilisé pour identifier les facteurs bactériens impliqués dans le processus d’éveil de l’état VBNC par le criblage de mutants bactériens individuels ou à l’échelle du génome en utilisant une bibliothèque mixte (par exemple, une bibliothèque de mutants transposons).
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par une subvention de l’Institut Micalis (AAP Micalis FAMe 2023). F.C. a été soutenu par une bourse postdoctorale de l’Agence Nationale de Recherche (THOR : ANR-20-CE15-0008 ; PERMALI : ANR-20-CE35-0001).
matériels
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
Références
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon