Method Article
Embrião de galinha como modelo in vivo para reviver patógenos viáveis, mas não cultiváveis
Neste Artigo
Resumo
Este método mostra o embrião de galinha como um modelo in vivo simples e econômico para reviver o patógeno bacteriano L. monocytogenes de um estado viável, mas não cultivável (VBNC) e com potenciais usos adicionais na compreensão dos mecanismos de dormência bacteriana.
Resumo
O embrião de galinha emergiu como um modelo popular in vivo com crescente aplicação em pesquisas biomédicas devido à sua simplicidade, acessibilidade e adaptabilidade no estudo de vários fenômenos biológicos. Este modelo tem sido usado para investigar a patogenicidade microbiana e está se tornando uma ferramenta útil para estudar a dormência bacteriana. O estado viável, mas não cultivável (VBNC) é um estado dormente no qual as bactérias se tornam metabolicamente quiescentes e resistentes ao cultivo para preservar sua viabilidade em ambientes hostis. Em condições favoráveis, as bactérias VBNC podem acordar de volta a um estado metabolicamente ativo e cultivável. Patógenos bacterianos que mudam para um estado VBNC, como a Listeria monocytogenes, causadora de listeriose transmitida por alimentos, são um problema de saúde pública, pois evitam a detecção por métodos convencionais dependentes do crescimento e podem recuperar sua virulência após o renascimento. Isso exige uma melhor compreensão das condições e mecanismos que impulsionam o renascimento dos patógenos VBNC. O método apresentado aqui mostra o embrião de galinha como um modelo in vivo eficiente para reviver VBNC L. monocytogenes de volta a um status cultivável. Onde as tentativas de renascimento in vitro , em grande parte baseadas na reposição nutricional, foram improdutivas, este protocolo consegue promover a reativação de formas VBNC deficientes em parede celular de L. monocytogenes geradas pela fome em água mineral. É importante ressaltar que os resultados obtidos destacam a necessidade do embrião para o renascimento de VBNC L. monocytogenes, indicando um papel importante dos fatores associados ao embrião nesse processo. Outros usos potenciais para este método incluem a triagem e identificação de fatores bacterianos implicados nos mecanismos de renascimento do estado VBNC. Este modelo pode, portanto, fornecer informações sobre o funcionamento molecular da dormência bacteriana, cujo conhecimento é fundamental para reduzir os riscos à saúde pública decorrentes de patógenos indetectáveis.
Introdução
Na busca por modelos alternativos de pesquisa in vivo, com custos associados reduzidos e considerações logísticas e éticas, o embrião de galinha emergiu e rapidamente se tornou um dos sistemas modelo de vertebrados in vivo mais aplicáveis, gerenciáveis e reprodutíveis 1,2. Em comparação com outros modelos animais, como roedores e coelhos, os ovos de galinha fertilizados são baratos de obter e não requerem logística de alojamento complexa para seu desenvolvimento. Além disso, o tamanho do ovo de galinha permite o manuseio de vários embriões em paralelo, suportando um número robusto de condições/grupos de teste experimentais e replicações. A curta duração da embriogênese (21 dias) e a simplicidade de acessar e observar o embrião e as estruturas associadas em qualquer ponto do período de desenvolvimento tornam este um modelo útil em uma variedade de campos, como biologia do desenvolvimento (por exemplo, formação do coração e do cérebro) 3 , 4 e farmacologia (teste de atividade de drogas, entrega e toxicidade) 1 , 5 , 6. Além disso, o sistema imunológico imaturo do embrião de galinha o torna um sistema adequado para estudos baseados no sistema imunológico e abordagens relacionadas à pesquisa do câncer7. É importante ressaltar que, devido à natureza embrionária desse modelo, que só adquire um sistema nociceptivo maduro no dia 13-14 do desenvolvimento8, as aplicações de pesquisa conduzidas dentro desse período não são limitadas por preocupações legais e éticas7.
O modelo de embrião de galinha também tem sido amplamente utilizado para estudar a patogenicidade de micróbios que causam doenças em humanos e outros mamíferos. De fato, vários estudos exploraram e validaram esse modelo para investigar a virulência de protozoários (por exemplo, Neospora caninum, Eimeria tenella, Cryptosporidium spp.)9,10,11, espécies fúngicas (por exemplo, Candida albicans, Aspergillus fumigatus)12,13 e bacterianas (por exemplo, Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22, bem como testar o efeito terapêutico de compostos antimicrobianos17,23.
Microrganismos, como os mencionados acima, são frequentemente expostos a estímulos estressantes em seu(s) ambiente(s) e, portanto, desenvolveram estratégias de enfrentamento do estresse para suportar situações potencialmente prejudiciais/letais. Algumas espécies bacterianas podem produzir estruturas altamente resilientes e metabolicamente dormentes chamadas endósporos, que preservam a integridade celular e genética sob severas restrições ambientais. Se condições ambientais favoráveis forem reunidas, os endósporos podem se regenerar em células ativas viáveis pela germinação24. As bactérias não esporulantes, no entanto, podem entrar em um estado metabolicamente dormente alternativo denominado viável, mas não cultivável (VBNC), cuja principal característica fenotípica é a perda de capacidade de cultivo em meios de crescimento de rotina25. Dado que uma grande parte das > 100 espécies bacterianas relatadas para entrar em um estado VBNC são patogênicas para humanos e outros animais26, e que os patógenos VBNC podem reviver de volta a um estado metabolicamente ativo e virulento25,26, o fracasso dos métodos convencionais baseados em crescimento para detectar patógenos VBNC é uma questão preocupante de saúde pública. As pistas ambientais e os mecanismos moleculares e fisiológicos que impulsionam esse processo de renascimento ainda não são bem compreendidos e podem variar com as espécies microbianas e o(s) estresse(s) indutor(es) de estado VBNC.
Os pesquisadores aproveitaram as particularidades do modelo de embrião de galinha para investigar a capacidade de renascimento in vivo de patógenos bacterianos em um estado VBNC. Isolados de C. jejuni de origem humana, levados a um estado VBNC pela privação nutricional em água, recuperaram sua capacidade de cultivo e virulência em células humanas após a passagem em ovos de galinha embrionados27. Da mesma forma, tentativas bem-sucedidas de reverter o estado VBNC também foram relatadas para outros patógenos, como Edwardsiella tarda28, Legionella pneumophila29 e L. monocytogenes30.
Recentemente, relatamos que quando L. monocytogenes é levado a um estado VBNC por fome em água mineral, ele muda de uma célula em forma de bastonete para uma célula cocóide. Revelamos que essa transformação morfológica é causada por danos cumulativos à parede celular, levando à sua eliminação completa pela bactéria, que então se torna uma forma de célula esférica deficiente em parede celular31. Nossas tentativas malsucedidas de reviver essas formas de VBNC L. monocytogenes sem parede in vitro, usando abordagens de reposição de nutrientes, nos levaram a investigar seu potencial resgate in vivo. Dado seu uso promissor com L. monocytogenes30, selecionamos o modelo de embrião de galinha para esta tarefa. Os resultados confirmaram a capacidade do sistema de ovos de galinha embrionados de promover a restauração de VBNC L. monocytogenes deficiente em parede celular de volta a um estado cultivável ativo31.
Aqui, fornecemos um protocolo detalhado que permite o renascimento in vivo de L. monocytogenes de um estado VBNC dormente por meio da exposição ao ambiente embrionado de ovos de galinha. Descrevemos a preparação e monitoramento de ovos de galinha e bactérias VBNC, a inoculação de ovos, o processamento dos ovos embrionados e não embrionados e a pontuação da carga bacteriana cultivável para avaliar a eficiência do renascimento das células VBNC. Os resultados reafirmam o embrião de galinha como um modelo simples, econômico e adequado para entender os mecanismos que governam diferentes aspectos da vida microbiana, como a dormência bacteriana. Este sistema in vivo pode ser mais explorado para investigar a contribuição de genes bacterianos individuais no processo de ressurreição.
Protocolo
Este protocolo segue as diretrizes institucionais francesas (Decreto nº 2013-118) e europeias (Diretiva 2010/63/UE) aplicáveis para o uso de animais em pesquisa. Além disso, de acordo com a lei francesa (Decreto nº 2020-274), este protocolo não se preocupa com restrições éticas porque toda a experimentação com embriões de galinha é realizada e concluída antes do último terceiro período de embriogênese (ou seja, antes do dia 14).
1. Preparação de bactérias VBNC
- Listre cepas bacterianas de estoques de glicerol (armazenados a -80 ° C) em meio de ágar de infusão cérebro-coração (BHI) usando alças de inoculação. Incubar durante a noite a 37 °C para obter colónias isoladas.
NOTA: Se necessário, suplemente o meio de ágar com antibióticos para os quais a(s) estirpe(s) possua(m) resistência (naturalmente, ou por modificação genética). - Para cada cepa, prepare 2-3 tubos com 5 mL de caldo BHI e use um loop de inoculação para inocular com 2-3 colônias. Incubar as culturas durante a noite a 37 °C com agitação (200 rpm) para desenvolver bactérias até à fase estacionária. Cada uma dessas culturas será usada para preparar réplicas biológicas independentes de suspensões bacterianas VBNC.
- Diluir cada cultura 1:10 em caldo BHI e medir a densidade óptica num espectrofotómetro no comprimento de onda de 600 nm (OD600). O valor OD600 de culturas de fase estacionária de Listeria monocytogenes cultivadas de forma ideal varia entre 2 e 4. Isso equivale a uma concentração bacteriana de 2-4 x 109 unidades formadoras de colônias (UFC) / mL.
- Pellet 1 mL de cultura bacteriana em um microtubo de 1,5 mL por centrifugação a 6.000 x g por 2 min. Aspirar o sobrenadante com uma bomba de vácuo. Ressuspenda o pellet celular em 1 mL de água mineral autoclavada e filtrada.
- Lave bem as bactérias repetindo o passo 1.4 três vezes. Isso garante a remoção completa dos nutrientes do meio de cultura que, de outra forma, atrasariam a formação de bactérias VBNC.
- Preparar suspensões bacterianas a uma concentração inicial de 106 UFC/ml adicionando 30 μl de bactérias lavadas a frascos de cultura de células T25 contendo 30 ml de água mineral.
- Misturar as suspensões com uma pipeta serológica. Armazene-os em temperatura ambiente, em condições estáticas (frasco na posição vertical) e com pouca iluminação.
2. Monitoramento da formação de bactérias VBNC
- Determine a população cultivável nas suspensões bacterianas no1º dia (imediatamente após a preparação) e depois semanalmente, conforme descrito abaixo.
- Prepare diluições seriais de 10 vezes da suspensão bacteriana VBNC em água mineral (de 10-1 a 10-3 diluições). Placa 100 μL de suspensão não diluída e de cada diluição, em duplicado, em ágar BHI e incubar durante a noite a 37 °C.
NOTA: Quando a capacidade de cultivo se aproxima < 1 UFC/mL, um volume maior (0,5-2 mL) da suspensão não diluída deve ser semeado para confirmar a presença/ausência de bactérias cultiváveis. - Calcule a concentração de bactérias cultiváveis da seguinte forma:
concentração de bactérias cultiváveis (UFC/mL) = (número médio de colônias x fator de diluição da amostra) / volume da amostra plaqueada (em mL).
- Prepare diluições seriais de 10 vezes da suspensão bacteriana VBNC em água mineral (de 10-1 a 10-3 diluições). Placa 100 μL de suspensão não diluída e de cada diluição, em duplicado, em ágar BHI e incubar durante a noite a 37 °C.
- Determinar a população viável nas suspensões bacterianas no1º dia (imediatamente após a preparação) e depois semanalmente, conforme descrito abaixo.
- Incubar uma amostra da suspensão bacteriana (ou seja, a uma concentração de cerca de 106 células/mL) com o corante de viabilidade 5(6)-carboxifluoresceína diacetato (CFDA) a uma concentração final de 30 μM por 30 min no escuro. Preparar também uma amostra sem CFDA (controlo não corado) e uma amostra tratada a 95 °C durante 30 minutos antes da incubação com CFDA (controlo não viável/células mortas).
- Analisar as amostras num citómetro de fluxo equipado com um laser de excitação de 488 nm e um detector de emissão de 520 nm para fluorescência CFDA. Para robustez estatística, adquira cerca de 1 x 105 eventos bacterianos por amostra (isso se traduz em um volume de amostra adquirido de 10-100 μL) a uma taxa de fluxo de pelo menos 30 μL / min.
- Use a amostra não corada para encontrar e bloquear os eventos associados a bactérias em um gráfico de dispersão direta em escala logarítmica (FSC) versus dispersão lateral (SSC). Plote os eventos bacterianos fechados em um histograma de fluorescência CFDA em escala logarítmica e use as amostras de células não coradas e não viáveis/mortas para distinguir as populações viáveis (CFDA-positivas) das não viáveis (CFDA-negativas).
- Calcule a concentração de bactérias viáveis da seguinte forma:
concentração de bactérias viáveis (células/mL) = número médio de eventos positivos para CFDA na amostra adquirida/volume da amostra adquirida (em mL)
NOTA: Dependendo do modelo do citômetro, a quantificação celular pode exigir o uso de esferas de contagem por citometria de fluxo.
3. Incubação de ovos
- Após o recebimento do fornecedor, deixe os ovos fertilizados serem acomodados em temperatura ambiente até o dia seguinte.
- Enquanto isso, encha o reservatório de água da incubadora de ovos com água deionizada e ligue a energia. Defina a temperatura para 37,7 °C e a umidade relativa máxima para 47%.
NOTA: Em nossas mãos, os ovos são incubados em uma faixa de umidade relativa de 38% a 42%, sem impacto visível na taxa e no sucesso esperados da embriogênese. - Transfira os ovos para a incubadora para iniciar a embriogênese. Posicione-os na(s) bandeja(s) da incubadora com a bolsa de ar voltada para cima (ou seja, a extremidade pontiaguda voltada para baixo).
- Incube os ovos por 6 dias. Após 4 dias, distinguir os ovos embrionados vivos dos ovos mortos ou não embrionados por ovoscopia.
- Coloque o ovo embaixo/sobre uma fonte de luz forte (candler) para iluminar o interior e discernir visualmente seu conteúdo. Após 3 ou 4 dias de incubação, os ovos embrionados vivos exibem uma rede de vasos sanguíneos que se expandem para baixo a partir da bolsa de ar. Essa rede aparece colapsada e desorganizada em ovos embrionados mortos e está completamente ausente em ovos que não conseguiram iniciar a embriogênese. Se visível, um embrião vivo pode até exibir movimentos de contração (Figura 1).
4. Preparação de ovos para inoculação
- No dia da inoculação, vela os ovos para determinar o número disponível de ovos embrionados e não embrionados viáveis. Identifique os óvulos não embrionados (cerca de 10% a 20% do número total) e quaisquer óvulos com embriões mortos, conforme descrito na etapa 3.4. Eliminar estes últimos de acordo com as directrizes institucionais para a eliminação de resíduos biológicos.
- Marque o local de injeção na casca do ovo 2-5 mm acima da borda da bolsa de ar (Figura 2A). Desinfete esta área esfregando com papel de seda embebido em etanol 70% (v/v).
- Usando uma agulha 18G, faça cuidadosamente um amassado na concha no local da injeção sem perfurar a membrana da concha (Figura 2B). Desinfete o local da injeção com um lenço de papel embebido em etanol a 70% (v/v).
5. Inoculação de ovos
- Conecte uma agulha de 25G (0,5 mm x 16 mm) em uma seringa de 1 mL e encha-a com suspensão bacteriana VBNC. Se necessário, remova as bolhas de ar presas à parede interna da seringa sacudindo-a com um dedo.
- Realizar a inoculação apenas com água mineral ou uma suspensão de L. monocytogenes (5 x 103 UFC/mL) cultivada durante a noite em caldo BHI como condições de controle para esterilidade e crescimento derivados de bactérias cultiváveis, respectivamente.
- Introduza a agulha através do invólucro perfurado no local de injeção e insira-a totalmente, em um ângulo perpendicular, até que a base da agulha toque a superfície do invólucro (Figura 2C). Isso posiciona a ponta da agulha para fornecer o conteúdo da seringa na cavidade alantóide (em ovos embrionados) ou no albúmen (em ovos não embrionados).
- Injete cuidadosa e lentamente 100 μL do inóculo. Mantenha o ângulo da agulha o mais imóvel possível quando estiver dentro de um ovo embrionado para evitar causar ferimentos letais ao embrião.
- Remova a agulha com cuidado e lentamente e cubra o local da injeção com um adesivo redondo para selar o local de entrada da inoculação. Para conveniência e clareza, use adesivos com uma cor diferente para cada condição/grupo de ovos.
- Devolva os ovos inoculados à incubadora por mais 2 dias. Certifique-se de que os ovos com embriões em desenvolvimento não estejam fora da incubadora (ou a uma temperatura abaixo de 37,7 °C) por mais de 30 min. Realizar a inoculação em lotes, se necessário.
6. Avaliação da presença de células cultiváveis nas amostras de inoculação
- Dispense 100 μL de suspensão bacteriana VBNC em vários poços de uma microplaca de 96 poços. Calcule o número de poços ≥ 2 x o número de ovos inoculados (embrionados + não embrionados).
- Se estiver usando as condições de controle mencionadas na etapa 5.2, dispense 100 μL de cada inóculo (ou seja, água mineral ou bactérias cultiváveis) em pelo menos três poços na mesma microplaca de 96 poços.
- Usando uma pipeta multicanal, adicione 100 μL de meio BHI a cada um dos poços preparados nas duas etapas anteriores.
- Incubar a placa a 37 °C em condições estáticas para promover o crescimento bacteriano em alvéolos contendo bactérias cultiváveis. Dependendo da presença de bactérias cultiváveis e sua taxa de crescimento nessas condições, um ou mais dias de incubação podem ser necessários para revelar completamente os poços contendo bactérias cultiváveis.
- Para cada inóculo, inspecione visualmente e conte o número de poços com pontuação positiva e negativa para o crescimento bacteriano.
7. Monitorização da viabilidade embrionária
- No dia seguinte à inoculação, vela os ovos embrionados para verificar a letalidade do embrião.
- Separar os ovos que contenham embriões mortos e descartá-los de acordo com as diretrizes institucionais para descarte de resíduos biológicos infectados.
8. Processamento de óvulos embrionados
- Recupere os ovos embrionados da incubadora e da vela para verificar a letalidade do embrião. Descarte os embriões mortos e não os considere nos resultados finais.
- Retire o adesivo do ovo e desinfete a extremidade superior da casca (cobrindo a bolsa de ar) com papel de seda embebido em etanol a 70% (v/v).
- Usando uma tesoura de dissecação limpa, corte a concha aberta do local de injeção para expor a bolsa de ar. Usando uma pinça de dissecação limpa, rasgue a membrana interna da casca que separa a bolsa de ar do resto do ovo.
- Esvazie cuidadosamente o conteúdo do ovo em uma placa de Petri estéril. Usando uma pinça, isole e transfira o embrião para uma nova placa de Petri. Lave o embrião com PBS estéril, se necessário.
- Transfira o embrião para um tubo de centrífuga de 15 mL contendo 4 mL de PBS estéril. Dissocie o embrião usando um homogeneizador (velocidade: 10.000 rpm). Limpe a ponta da ferramenta de dispersão entre cada homogeneização, passando-a sequencialmente em PBS estéril, etanol 70% (v/v) e novamente PBS estéril.
- Placa 500 μL do homogeneizado embrião em ágar BHI. Incubar as placas a 37 °C durante a noite (ou mais, se necessário).
NOTA: Opcionalmente, diluições em série do homogenato podem ser semeadas caso sejam esperados números elevados de UFC (ou seja, > 300) no homogenato não diluído. - Para cada grupo de inoculação, conte o número de ovos com pontuação positiva e negativa para o crescimento de L. monocytogenes em placas de ágar.
NOTA: Apesar das condições assépticas sob as quais a extração e homogeneização de embriões são realizadas, o uso de um meio de ágar não seletivo para o plaqueamento de homogeneizados de embriões acarreta um risco de crescimento de contaminantes. A utilização de um meio de crescimento específico de um género/espécie ou a suplementação com um antibiótico seletivo (para o qual apenas a estirpe bacteriana testada é resistente) pode reduzir ou prevenir essa contaminação.
9. Transformação de óvulos não embrionados
- Recupere os ovos não embrionados da incubadora. Repita as etapas 8.2 e 8.3 para obter acesso à albumina do ovo.
- Usando uma micropipeta, colete 500 μL de albúmen e espalhe diretamente no ágar BHI. Incubar as placas a 37 °C durante a noite ou mais, se necessário.
- Para cada grupo de inoculação, conte o número de ovos com pontuação positiva para o crescimento de L. monocytogenes em placas de ágar.
Resultados
Para testar o potencial do modelo de embrião de galinha para reviver formas VBNC deficientes em parede celular de L. monocytogenes geradas pela fome em água mineral, foi importante articular o momento da preparação do inóculo bacteriano VBNC (≥ 28 dias) com o dos ovos embrionados (6 dias). Suspensões replicadas de L. monocytogenes foram então instaladas em uma concentração de 1 x 106 UFC/mL em água mineral 28 dias antes do dia planejado para a inoculação dos ovos. Esta concentração bacteriana inicial demonstrou resultar em uma cultura residual desejada de <1 UFC/mL após 28 dias31. Uma verificação final da cultura celular bacteriana e dos níveis de viabilidade das suspensões resultou na seleção de um inóculo VBNC L. monocytogenes contendo 1 x 106 células viáveis e 0,5 células cultiváveis por mL. Para experimentação, 100 μL desse inóculo (ou seja, 1 x 105 células viáveis e < 0,1 UFC) foram entregues em grupos de ovos embrionados e não embrionados. Os grupos controle foram preparados em paralelo injetando ovos embrionados e não embrionados com o mesmo volume de dose de água mineral ou de uma suspensão 5 x 103 UFC/mL de L. monocytogenes cultivada durante a noite em caldo BHI.
Aos 2 dias após a inoculação, os ovos foram processados para avaliar a presença de L. monocytogenes cultiváveis. Como esperado, nenhum crescimento bacteriano foi recuperado dos ovos do grupo controle de esterilidade injetados com água mineral, enquanto 100% dos ovos do grupo controle tratados com L. monocytogenes cultivável tiveram pontuação positiva para crescimento em meio de ágar (Tabela 1). É importante ressaltar que todos os embriões recuperados de ovos inoculados com bactérias VBNC deram origem ao crescimento de L. monocytogenes na placa, contrastando com sua completa ausência em todas as placas espalhadas com o conteúdo de um ovo não embrionado injetado com a mesma bactéria VBNC (Tabela 1). Este resultado reforça a necessidade do embrião de galinha para o processo de despertar de VBNC L. monocytogenes, conforme relatado anteriormente30.
Para determinar a probabilidade de que o crescimento de L. monocytogenes recuperado de ovos embrionados injetados com bactérias VBNC venha de uma verdadeira recuperação de células VBNC, não do crescimento de células cultiváveis persistentes, é necessário comparar a frequência de doses de inóculo produzindo crescimento bacteriano antes e depois da passagem do ovo. Para obter o primeiro, várias doses de 100 μL do inóculo bacteriano VBNC foram misturadas com BHI, um meio rico em nutrientes que não suporta VBNC L. monocytogenes revival 32, em uma placa de 96 poços e incubado a 37 ° C. Uma frequência de 9,5% de poços BHI inoculados positivos para crescimento bacteriano (8 em 84) diferiu significativamente (teste exato de Fisher, p = 1,6 × 10−17) da frequência de 100% de ovos mostrando bactérias cultiváveis recuperadas (Tabela 1). Essa diferença substancial e estatisticamente significativa indica fortemente que o crescimento de L. monocytogenes recuperado de ovos embrionados foi em grande parte devido à reativação da bactéria VBNC. Além disso, ao contrário de suas formas vegetativas, VBNC L. monocytogenes foi incapaz de reviver em ovos não embrionados, apoiando que o renascimento das células VBNC em ovos embrionados não se deve às bactérias cultiváveis residuais no inóculo.
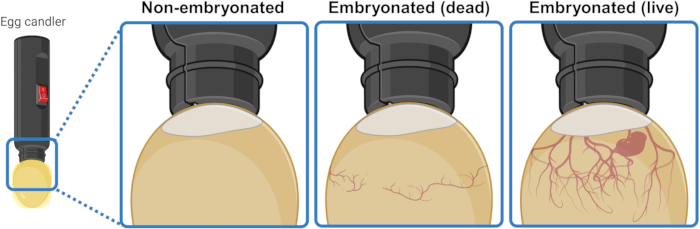
Figura 1: Distinguindo ovos de galinha não embrionados, embrionados mortos e embrionados vivos por ovoscopia. O status de embriogênese é determinado iluminando o ovo com uma fonte de luz (candler de ovo) de perto. Os ovos que contêm um embrião vivo em desenvolvimento (visível ou não) exibem uma forte rede de vasos sanguíneos que se expandem para baixo a partir da bolsa de ar. Essa rede aparece colapsada e desorganizada em ovos com embriões mortos e está completamente ausente em ovos que não conseguiram iniciar a embriogênese. Criado em BioRender.com. Clique aqui para ver uma versão maior desta figura.
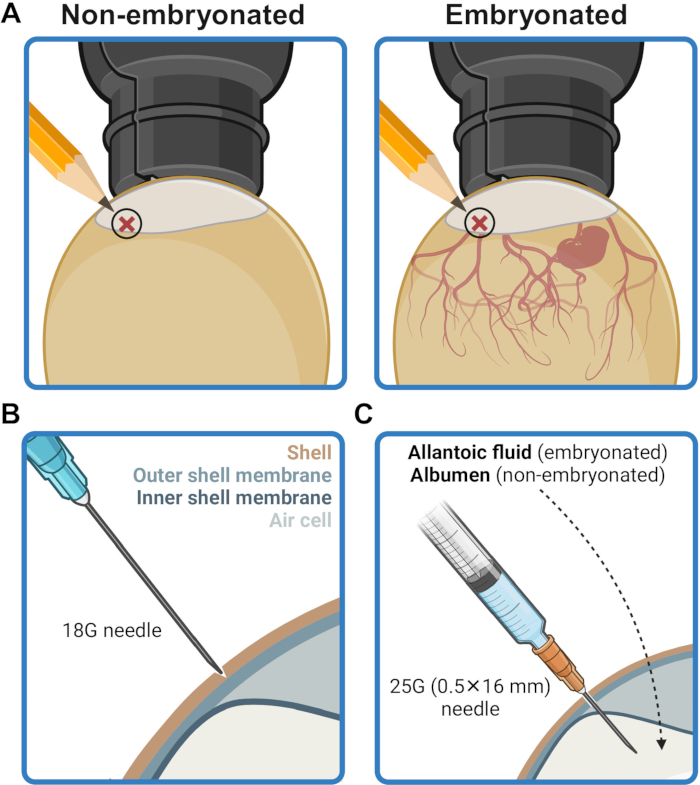
Figura 2: Preparação do ovo para inoculação. (A) O local da injeção é marcado em uma posição 2-5 mm acima da borda da bolsa de ar, conforme visto por ovoscopia. (B) O invólucro no local da injeção é perfurado com a ajuda da ponta de uma agulha 18G sem perfurar a membrana externa do invólucro. (C) O inóculo é administrado através de uma agulha 25G (0,5 mm x 16 mm) no fluido alantóide em ovos embrionados ou no albúmen em ovos não embrionados. Criado em BioRender.com. Clique aqui para ver uma versão maior desta figura.
| Inóculo | Cultivabilidade antes da passagem do ovoa | Cultivabilidade após a passagem dos ovosb | |||
| Ovos embrionados | Valor de pc | Ovos não embrionados | Valor de pd | ||
| Água mineral | 0/3 (0%) | 0/10 (0%) | >0,999 | 0/10 (0%) | >0,999 |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| Cultura Lm | 3/3 (100%) | 8/8 (100%) | >0,999 | 2/2 (100%) | >0,999 |
| umNúmero de poços BHI com crescimento bacteriano/Número de poços BHI inoculados. | |||||
| bNúmero de ovos com crescimento bacteriano/Número de ovos inoculados. | |||||
| cComparação da capacidade de cultura antes e depois da passagem em ovos embrionados (teste exato de Fisher bilateral). | |||||
| dComparação da capacidade de cultura antes e depois da passagem em ovos não embrionados (teste exato de Fisher bilateral). | |||||
Tabela 1: VBNC L. monocytogenes reverte para um estado cultivável após a passagem em ovos de galinha embrionados. Ovos de galinha embrionados e não embrionados (6 dias) foram inoculados apenas com 100 μL de água mineral ou com suspensões de água mineral de VBNC (1 x 104 células, 28 dias) ou cultivável (500 células) L. monocytogenes. Após 2 dias, os embriões (ou albúmen em ovos não embrionados) foram recuperados e plaqueados em ágar BHI para avaliar a presença de L. monocytogenes cultiváveis. A frequência de células cultiváveis presentes em uma dose de inoculação antes da passagem dos ovos foi determinada misturando 100 μL de cada suspensão com caldo BHI em vários poços de uma microplaca de 96 poços e pontuando o número de poços com crescimento bacteriano após incubação a 37 °C. A significância estatística foi calculada por meio do teste exato de Fisher bicaudal, com valores de p ≥ 0,05 considerados não significativos. Esta tabela foi reproduzida a partir de31.
Discussão
Os riscos econômicos e de saúde pública associados às formas viáveis, mas não cultiváveis (VBNC) de patógenos bacterianos são uma consequência de sua capacidade de evitar a detecção por métodos convencionais baseados no crescimento microbiano, bem como de sua tolerância / insensibilidade à maioria dos antimicrobianos usados em ambientes clínicos e da indústria de alimentos26,33. Torna-se, portanto, urgente encontrar ferramentas e modelos de pesquisa para entender melhor os mecanismos que impulsionam a transição, manutenção e renascimento de células bacterianas em um estado VBNC.
Em muitos aspectos, o embrião de galinha é uma alternativa vantajosa aos modelos mais convencionais de pesquisa em mamíferos (por exemplo, camundongo, rato, coelho). É tecnicamente mais prático trabalhar com um organismo ovíparo, pois seu desenvolvimento embrionário é rápido e ocorre externamente e independentemente de seu progenitor. É importante ressaltar que os encargos financeiros e logísticos associados à produção, alojamento e manutenção de ovos e embriões de galinha são significativamente menores. Além disso, a facilidade de obter grandes números permite testes paralelos de múltiplas condições experimentais e/ou réplicas e a geração de dados abrangentes e estatisticamente robustos. Embora modelos não mamíferos, como peixes ou nematóides, possam fornecer vantagens semelhantes, o embrião de galinha, como vertebrado de sangue quente, está evolutivamente mais próximo dos humanos e, portanto, um melhor modelo de pesquisa em áreas como imunologia, modelagem de doenças, desenvolvimento e toxicologia. Os modelos embrionários também são mais simples de trabalhar do ponto de vista ético, particularmente durante os primeiros dois terços do desenvolvimento, quando um sistema nociceptivo maduro ainda não está estabelecido8. Essa janela de tempo curta é conveniente para aplicações que exigem tempos de resposta rápidos (por exemplo, teste de drogas1), mas pode impor restrições para ensaios que duram em estágios posteriores de embriogênese ou mesmo na vida pós-eclosão (por exemplo, estudos comportamentais e de desenvolvimento). A falta de um sistema imunológico adaptativo também torna o embrião de galinha uma ferramenta de pesquisa útil em áreas como interações patógeno-hospedeiro e biologia do câncer7.
O embrião de galinha tem sido amplamente utilizado no estudo da virulência microbiana 9,10,11,12,13,14,15,16,17,18, mas com moderação como modelo para reviver patógenos VBNC 27,28,29,30. Aqui, fornecemos uma descrição metodológica detalhada de como este sistema in vivo pode ser usado com sucesso para o resgate de VBNC L. monocytogenes.
Um ponto crítico a ser considerado neste método é a questão da presença residual de células cultiváveis e seu potencial para dominar o verdadeiro renascimento das células VBNC. As limitações do método de produção de células VBNC para resolver esse assunto (os níveis de pureza das células VBNC são combinados com a concentração bacteriana inicial) aumentam a necessidade de empregar abordagens alternativas para eliminar completamente as células cultiváveis contaminantes ou reduzi-las a um nível insignificante. Tais abordagens podem incluir, por exemplo, neutralização/morte por antimicrobianos direcionados exclusivamente a células cultiváveis. Alternativamente, a remoção física da população de células cultiváveis pode ser alcançada com base em características morfofisiológicas únicas (por exemplo, forma da célula, superfície ou estruturas ou moléculas citoplasmáticas) por citometria de fluxo. Essa abordagem tem a vantagem adicional de permitir o isolamento / purificação de subpopulações de células VBNC com diferentes idades (ou seja, formadas em diferentes pontos de tempo), que também podem ser testadas in ovo quanto à sua capacidade de renascimento.
Outros pontos deste método que requerem atenção incluem o manuseio cuidadoso de óvulos embrionados, particularmente durante e imediatamente após a etapa de injeção (para evitar trauma ou letalidade não intencional associada à agulha) e o esforço para reduzir o tempo de manipulação fora da temperatura ideal de incubação. Além disso, apesar das condições assépticas sob as quais a recuperação, processamento e plaqueamento de embriões devem ser realizados, o crescimento microbiano indesejado em placas de ágar ainda pode ocorrer. Isso pode ser resolvido com o uso de meio de ágar com uma formulação (composição basal e/ou suplementos) seletiva para a espécie bacteriana de interesse ou usando uma cepa que possui resistência a um determinado antibiótico.
Este trabalho mostra o embrião de galinha como um modelo in vivo simples, mas poderoso e econômico para investigar os aspectos mecanicistas da dormência bacteriana. Nesse contexto, ele pode ser potencialmente usado para identificar fatores bacterianos implicados no processo de despertar do estado VBNC por meio da triagem de mutantes bacterianos individuais ou em escala genômica, empregando uma biblioteca mista (por exemplo, biblioteca mutante de transposon).
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por uma bolsa do Instituto Micalis (AAP Micalis FAMe 2023). F.C. foi apoiado por financiamento de pós-doutorado da Agence Nationale de Recherche (THOR: ANR-20-CE15-0008; PERMALI: ANR-20-CE35-0001).
Materiais
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
Referências
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados