Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüzey Suyu ve Çevre Sağlığı Değerlendirmesi için Konvansiyonel Olmayan Bir Biyomonitör Olarak Hellgrammite
Bu Makalede
Özet
Bu protokol, sucul ekosistemlerdeki zararlı etkilerin erken tespiti için biyobelirteçlerin kullanımını açıklar. Biyobelirteçler, sentinel özellikleriyle yakından ilişkilidir ve değişiklikleri, erken uyarı hasarlarının tespit edilmesine yardımcı olur.
Özet
Yaygın olarak Hellgrammites olarak bilinen Corydalus cinsinden dobsonflies larvaları, kayda değer büyüklükleri, geniş oluşum aralığı ve bir yıla kadar sürebilen uzun olgunlaşmamışlık süreleri ile karakterize edilir. Hellgrammitlerin kirliliğe ve habitat yapısı etkilerine karşı hassasiyet gösterdikleri açıkça bilinmektedir. Bu benzersiz özellikler göz önüne alındığında, Corydalus texanus larvalarının kullanılması, sucul ekosistemlerin ekolojik bütünlüğünü değerlendirmek için güvenilir biyoizleme ajanları olarak son derece uygundur. Bu protokol, C. texanus değerlendirmesi için gerekli araçları sağlamayı ve bir vaka çalışması yoluyla etkinliklerini göstermeyi amaçlamaktadır. Araştırma bulgularının, C. texanus larvalarının madencilik kirliliğine erken uyarı tepkileri gösterdiğini ve Zn, Fe ve Al gibi yüksek miktarda ağır metalleri biyolojik olarak biriktirdiğini gösteren pratik çıkarımları vardır. C. texanus popülasyonlarının varlığı veya yokluğu, ekosistem sağlığı ile ilgili potansiyel sorunları belirlemek için yararlı bir gösterge olarak hizmet edebilir. Alışılmadık yaklaşım, madencilikten etkilenen sahalarda erken kirlilik uyarıları göstererek, çevreyi korumak için zamanında harekete geçme ihtiyacını vurguladı. Eşsiz özellikleri göz önüne alındığında, C. texanus larvalarının güvenilir bir geleneksel olmayan biyoindikatör olarak kullanılması şiddetle tavsiye edilir.
Giriş
Hellgramitler, Megaloptera (Latreille, 1802) takımından böcek larvalarıdır ve yetişkinlik dönemlerinde dobsonflies veya balık sinekleri olarak adlandırılırlar. Düşük bir çeşitlilik, ancak yaygın, su ekosistemlerinden gelen bu en iyi yırtıcı böcek larvaları grubunu karakterize eder1. Hellgramit türleri iyi tanımlanmış biyocoğrafik bölgelerde görülür; Bu nedenle, yüksek bir taksonomik bilgi olmadan türleri tanımlamak nispeten kolaydır. Özellikle, Corydalidae larvaları, Megaloptera takımından (20-90 mm vücut uzunluğu) en belirgin türe sahiptir.2 ve hellgramiti çıplak gözle görülebilir hale getirir.
Hellgrammites, etkileyici yırtıcı şekillerini ifade eden büyük çiğnemeler nedeniyle güçlü bir varlığa sahip, avcı olarak su ekosistemlerinde çok önemli bir rol oynar. Dorsoventral olarak düzleştirilmiş bir gövde ayrıca vücut boyunca 7-8 çift filament solungaç ile birleşir ve her iki tarafta altı stemmata bulunan bir kafa kapsülü, hellgrammitleri entomologlar ve hayranlar için büyüleyici organizmalar haline getirir3. Corydalidae erginleri, belirgin boyutları nedeniyle insanları şaşırtır ve bir izlenim imajı oluşturur; Ancak, tamamen zararsızdırlar. Hellgrammitlerin larva evrelerinde su ortamlarında önemli bir süre devam etme yeteneğine sahip olmaları dikkat çekicidir.
Hellgrammitlerin fenotipik özellikleri, su ekosistemlerindeki rollerini vurgulamak için özel bir şans verir; Bununla birlikte, gösterge potansiyelleri su ekolojistleri için en çok aranan özelliktir. Sucul ekosistemlerde biyoindikatör potansiyelleri hakkında geniş bilgi vurgulanmaktadır, çünkü bunların oluşumu, yüzey sularındaki organik kirliliğe karşı toleranssızlıkları nedeniyle habitatlarındaki iyi sağlık koşullarıyla ilgilidir 4,5,6,7,8.
Çoğu Corydalidae megalopteranı, Arnavut kaldırımı ve çakıl taşlarının baskın olduğu oluklar ve alt tabakalar olarak yüksek hızlı akan sularda yaşar, ancak hellgrammitler, budaklar ve kum alt tabakaları olan düşük gradyanlı akarsularda ve ayrıca göller 3,9,10 gibi lentik habitatlarda da görülür. Geniş oluşum yelpazesi, en iyi yırtıcının kritik özelliklerini ve etkili yaşam öyküsü stratejilerinin hedeflediği çeşitli habitatları kolonileştirme yeteneklerini yansıtır11. Hellgramitler, özelliklerini su ekosistemlerinin dinamikleriyle ilişkilendirdi; bu nedenle, spiracles tarafından hava solunumuna adaptasyon gibi stratejiler (trakeal solungaçların ventral tutamlarına ek olarak) Corydalidae stratejilerineuygundur 10.
Hellgrammitler belirli ekosistemlerde yaşar ve yerleşik modellerden sapmalara hızlı tepkiler sergiler, böylece bir erken uyarı sistemi olarak hizmet eder7. Bu yaban hayatı organizmalarının reaksiyonları, özellikle hedef olmayan kirletici karışımlar söz konusu olduğunda, kirliliğin su ekosistemleri üzerindeki etkisini değerlendirmek için değerli bir araç olarak kullanılabilir. Kimyasalların bireysel toksisitesi nedeniyle ekosistemlerde canlı organizmalar üzerindeki bazı zararlı etkiler kabul edilmiştir, ancak kirletici karışımların etkisi tanımlanmalıdır. Hellgrammitlerden gelen erken uyarı yanıtları, bir kirletici karışımının etkilerine referans vererek veya kirleticilerin bireysel etkileri Gözlemlenebilir Etki Konsantrasyonu Yok (NOEC)12 tanıdığında bile zararlı etkilerin belirlenmesini mümkün kılabilir.
Deneysel akut ve kronik testler için çeşitli model organizmalar kullanılmıştır; Bununla birlikte, kontrollü koşullar altında kültürlenir ve korunurlar13. Kontrollü koşullar, maruz kaldıkları çeşitli kirleticilerin hedef olmayan etkilerini belirleyememelerine neden olur. Ayrıca, kirletici karışımının karmaşıklığı nedeniyle NOEC sıklıkla tanınır. Bu nedenle, son on yıllarda, ekotoksikolojik araştırmaların yürütülmesi için gerekli olan tarama sistemlerine, hedef olmayan etkilere sahip model olmayan yerli türlerin tanındığı kabul edilmiştir14. Sonuç olarak, hellgrammitler, su ekosistemlerindeki kirliliğin zararlı etkilerini değerlendirebiliyor gibi görünmektedir. Diğerlerinin yanı sıra biyolojileri, genetikleri ve fizyolojileri gibi özellikler, model olmayan organizmaları ekosistemlerde etki değerlendirmesi için uygun hale getirir14.
Bu protokol, hedef olmayan kirlilik karışımlarına yanıt olarak erken uyarı sinyallerini tespit edebilen model olmayan bir organizma kullanarak yeni bir biyoizleme aracı oluşturmayı amaçlamaktadır. En iyi sonuçları elde etmek için, model tür olan C. texanus'un larvaları tarafından sergilenen özellikler kapsamlı bir şekilde düşünülmüş ve analizedahil edilmiştir 15.
Protokol
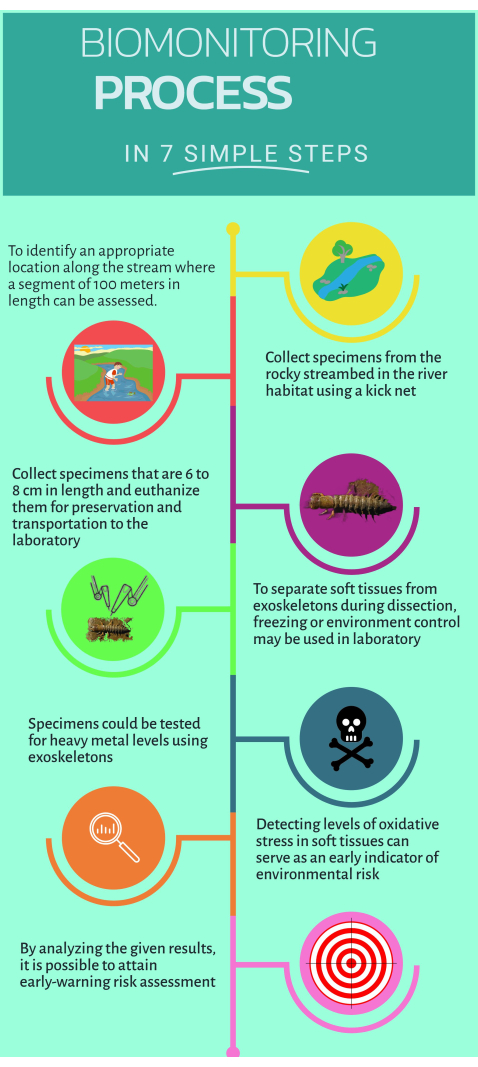
Şekil 1: Sucul ekosistemlerde kullanılmak üzere konvansiyonel olmayan biyomonitör Corydalus texanus'un nasıl kullanılacağına dair adım adım hızlı kılavuz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Saha Çalışması
- Şüpheli veya belirgin etkilerin tanındığı kirlilik kaynağının yukarı ve aşağı akışında bulunan çalışma alanlarını belirleyin (yani, dakik veya yaygın emisyonlar).
NOT: Mevcut protokol dört ana nehirde 15 çalışma alanını içeriyordu: 1) Extoraz Nehri (PB, EZ, RQ, BC siteleri); 2) Escanela-Jalpan Nehri (ES, EN, AH, JL, PI, PA); 3) Ayutla Nehri (AY); ve 4) Santa María Nehri (SM, AT). - En az bir referans sitesini arayın ve bulun (küçük veya etkilerin olmadığı bir yer) ve bunu bir çalışma alanı olarak tanımlayın.
NOT: Mevcut çalışma alanları için BC, ES, SM, AY ve AT referans bölgeleri olarak kabul edilmiştir. - C. texanus bireylerini bulma olasılığını artıran habitatların belirli özelliklerini tanır. Bunlar arasında çakıl substratı, daha dik eğimlere sahip kayalık habitatlar, yüksek hızlı akışlar, iyi oksijenli sular, yüksek gölgelik yoğunluğu ve yaylalar ve ovalardaki habitatlar bulunur.
- Biyolojik izleme için uygun habitatları belirlemek için derenin 100 m'lik bir bölümünü kapatın16.
- Örnekleri toplamak için akışın içine girin.
- En az altı bireyi örnekleyin C. texanus 500 μm ağ boyutuna sahip bir tekme ağı kullanarak oluklar, çakıl taşları, berrak sular ve döküntüler gibi habitatlarda.
- Suyun akış yönündeki kayaları çıkarın ve larvaları ağa aktarın.
- Tekme ağını örneklenmiş larvalarla tutun ve bunları geçici barınma için belirlenmiş şişelere aktarın. Ağı dikkatli tutun ve larva kaybını önlemek için kenarları iç kısma doğru katlayın.
- IX ila XI arasındaki yıldızları (6 mm ila 10 mm aralığında) tanımlamak için bir kumpas kullanarak örneklenen larvaların kafa genişliğini ölçün.
- Larvaları 30 dakika boyunca dere suyu içeren bir şişeye batırarak temizleyin.
- Numuneleri şeffaf etiketli plastik şişelere koyun ve ardından kriyojenik bir tankta sıvı nitrojene (-75 °C) daldırarak ötenazi yapın.
- Numuneleri -45 °C'de laboratuvardaki ultra dondurucuda güvenli bir şekilde taşıyın ve saklayın.
- Bir polietilen şişe kullanarak, 200 mL'lik bir akış suyu numunesi alın, 1 mL nitrik asit ekleyin ve numuneyi laboratuvarda daha sonra ağır metal miktar tayini için 4 °C'de saklayın.
2. Örneklenen larvaların diseksiyonu ve doku ayrılması
- Plastik diseksiyon tepsisini buzun üzerine koyun ve kontrol etmek için bir termometre kullanarak 4 °C'ye ulaşana kadar bekleyin.
- Ultra dondurucudan örnekler alın ve diseksiyona başlamak için diseksiyon tepsisine koyun.
- Hedef dokuları seçin: kas, dallar, nöral tüp ve dış iskelet.
- Kafayı çıkarmak için seramik bir bıçak kullanın ve dokuları dikkatlice ayırın. Vücudu uzunlamasına açın ve her iki taraftaki solungaçları çıkarın.
- Daha küçük bir seramik bıçak kullanarak dış iskeletleri ayırın ve fazla dokuyu temizleyin. Dış iskeletleri bir fırına koyun ve 80 °C'de 48 saat kurutun.
- Zaman geçtikten sonra, daha fazla analiz için kuru dış iskeletleri saklayın.
- Mikrotahlillerle daha fazla analiz için yumuşak dokuları soğuk koşullar altında temizlemeye devam edin.
- Yağdan yumuşak dokuları çıkarmak için küçük bir seramik bıçak kullanın. Her bir hedef dokuyu aynı örnekleme noktasından bireylerden ayırın ve bir araya getirin.
- Her doku tipini 2 mL'lik bir mikrotüpte saklayın ve işlem boyunca soğuk koşulları koruyun.
- Her bir hedef dokuyu hazırlamak için, 100 mg dokuyu tartın ve pH'ı 7.4 olan 1 mL PBS çözeltisi ekleyin. Her dokuyu homojenize etmek için tek elle doku yırtıcı kullanın. Tipik olarak, yumuşak dokular her biri 10 s'lik üç döngü gerektirir.
- Numuneyi 1.000 x g'da 4 °C'de 5 dakika santrifüjleyin. Süpernatanı 1 mL'lik bir mikrotüpe aktarın.
- Biyobelirteç mikro tahlilleri yapın.
3. Ağır metal miktar tayini
- Analitik bir terazi kullanarak belirtilen gelişim aşamasında en az altı örnekten 250 mg kurutulmuş dış iskelet tartın.
- Dış iskeletleri ince toz haline gelene kadar bir cam havanda öğütün. Toz reaksiyon kaplarına 250 mL ultra saf nitrik asit ekleyin.
- Numuneleri sindirmek için, 30-45 dakika boyunca 180 ° C'de bir sindirim mikrodalgasına aktarın.
NOT: Numuneleri güvenli ve etkili bir şekilde ısıtmak için mikrodalga markası için doğru mikrodalgaya uygun kabı kullanın. Doku örnekleri için sindirim süresi mikrodalga markasına göre değişir ve 30-45 dakika sürer. Bazı markalar standartlaştırılmış yöntemler sunar. - Su numuneleri için EPA3015A yöntemi izleyerek, 45 mL su numunesi kullanarak ve 5 mL nitrik asit ekleyerek bir mikrodalga sindirim yöntemi uygulayın.
- Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba ve As dahil olmak üzere endüktif olarak eşleştirilmiş plazma optik emisyon spektroskopisi (ICP-OES) kullanarak sindirilmiş numunelerdeki (su ve dokular) ağır metalleri ve metaloidleri ölçün.
NOT: Bir kalibrasyon eğrisi oluşturmak için argon derece 5 ve her metal ve metaloidin standart çözeltilerini kullanın.
4. Oksidatif stres ve biyobelirteçlerin değerlendirilmesi için mikro testler
- Reaktiflerin hazırlanması
- 50 mM Monobazik Fosfat Tamponu yapmak için 6 g NaH2PO4'ü 1000 mL ultra saf su ile karıştırın. Bir şişede 2-8 °C'de süresiz olarak saklayın.
- % 8.1 SDS yapmak için 450 mg sodyum dodesil sülfatı (SDS) 5 mL ultra saf suda çözün. Kullanmadan hemen önce hazırlayın.
- 2 mL trikloroetanoik asidi (TCA) 8 mL ultra saf su ile seyreltin (gerektiğinde taze reaktif hazırlayın).
- 100 mg tetrabütilamonyumu (TBA) 10 mL ultra saf suda çözün (gerektiğinde taze reaktif hazırlayın).
- 50 mM PBS pH 7.8 yapmak için, 97mgNa2HPO4 ve 59 mg NaH2PO 4'ü 10 mL ultra saf suda çözün. Ardından, artırmak için NaOH veya azaltmak için HCl kullanarak pH'ı 7.8'e ayarlayın.
- 8 mg'ını 40 μL ultra saf suda çözerek 200 μg/mL'lik bir sığır katalaz çözeltisi hazırlayın (gerektiğinde taze reaktif hazırlayın).
- 50 mM TRIS / 5 mM etilendiamintetraasetik asit (EDTA) çözeltisi yapmak için, 45 mL ultra saf suya 6.05 g tris (hidroksimetil) aminometan (TRIS) ve 0.073 g EDTA ekleyin. HCl ile pH'ı 7.6'ya ayarlayın ve kullanana kadar 4 °C'de saklayın.
- 0.1 M glutatyonu azaltılmış (GSH) için (45 çoğaltılmış numune için), 0.0184 g GSH'yi tartın ve 600 μL 10 mM HCl'de çözün.
- 10 mM HCl hazırlamak için, 599,5 μL ultra saf suya 0,5 μL konsantre HCl ekleyin.
- 1.4 mL 0.1 M TRIS / HCl 0.5 mM EDTA pH 8.0'a 28.5 μL glutatyon redüktaz ekleyin.
- pH 8.0'da 0.1 M TRIS / HCl ve 0.5 mM EDTA çözeltisi hazırlamak için 1.211 g TRIS ve 0.0146 g EDTA'yı 90 mL ultra saf su ile karıştırın. Gerekirse pH'ı ayarlamak için HCl ekleyin. Çözelti 2-8 ° C'de süresiz olarak saklanabilir.
- 0.075 g NADPH ağırlığında ve 2.25 mL% 1 NaHCO3 1 mM EDTA'ya ekleyin.
- % 1 NaHCO3 ve 1 mM EDTA çözeltisi hazırlamak için 1 gNaHCO3 ve 0.0282 g EDTA'yı 100 mL ultra saf suda karıştırın. Çözeltiyi belirsiz bir süre boyunca 4-8 ° C'de saklayın.
- 7 mM'lik bir çözelti elde etmek için 2 μL t-bütil hidroperoksiti 2 mL ultra saf su ile karıştırın. Kullanmadan hemen önce karıştırın.
- 1 μg / μL'lik bir stok çözeltisi oluşturmak için 1 g sığır serum albüminini (BSA) 1 mL ultra saf su ile karıştırın.
- Tiyobarbitürik asit reaktif maddeler (TBARS) (lipid peroksidasyonu, LPO)17
- 1 mL'lik bir mikrotüpe 5 μL doku süpernatanı ekleyin. 45 μL 50 mM PBS (taze ve stok çözeltisi) ekleyin.
- 12,5 μL% 8,1 SDS (taze hazırlanmış) ekleyin. 93,5 μL %20 TCA pH 3.5 (taze hazırlanmış) ekleyin.
- 93,5 μL% 1 TBA (taze hazırlanmış) ekleyin. 50,5 μL ultra saf su ekleyerek hacmi tamamlayın. Tüpün kapağını kapatın ve 30 saniye boyunca girdaplayın.
- Mikrotüp kapağını bir iğne ile delin ve 10 dakika kaynar suda inkübe edin.
- Tüpü oda sıcaklığında (RT) soğutun ve ardından 10 dakika boyunca 1000 x g'da santrifüjleyin.
- 96 oyuklu bir mikroplakadaki bir kuyuya 150 μL süpernatan ekleyin ve bir mikroplaka spektrofotometresi kullanarak 530 nm'de absorbansı ölçün.
- Lipid peroksitlerin miktarını belirlemek için, Tablo 8'de açıklandığı gibi malondialdehit bis (dimetil asetal) kullanarak 160 noktalı bir TBARS kalibrasyon eğrisi (1-1 μM) oluşturun. Malondialdehit (MDA) eğrisini doku tipine veya şüphelenilen hasar seviyesine göre ayarlayın.
- Sonuçları nmol MDA eqmg-1 proteini olarak ifade edin.
- Süperoksit dismutaz antioksidan enzim mikroassay (SOD)18
- 96 oyuklu bir plaka kullanın. 147 μL 1 M TRIS/5 mM HCl EDTA pH 8'i iki kuyucuğa boşluk olarak ekleyin. 144 μL 1 M TRIS/5 mM HCl EDTA pH 8'i diğer kuyucuklara iki katına ekleyin.
- Süpernatanttan 3 μL alın ve numune kuyucuklarına ekleyin. Plakadaki içeriği birkaç kez yavaşça karıştırın.
- 30 saniye içinde her kuyucuğa 3 μL 10 mM pirogallik asit ekleyin. Hemen yavaşça karıştırın.
- T0 (zaman = 0 s) ve T10'da (zaman = 10 s), 420 nm ve 25 °C'de absorbansı ölçün.
- Aşağıdaki denklemi kullanarak numunedeki pirogallol inhibisyonu yüzdesini hesaplayarak SOD'yi belirleyin:
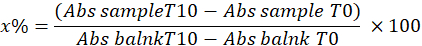
Nerede
x% = numunedeki SOD ile pirogallolün oksidasyon yüzdesi; Bu nedenle, pirogallolün oksidasyonu% 100 - X'e eşittir
NOT: 1 IU dikkate alınarak SOD aktivitesinin hesaplanması, aşağıda açıklandığı gibi pirogallol oksidasyonunun% 50'sini inhibe eden hacimdir:
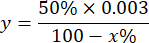
Nerede
y = mililitre cinsinden numune hacmi (pirogalonun %50'sini inhibe eder)
% 50 = pirogallolün inhibisyon yüzdesi 1U SOD'ye eşittir
0.003 = numunenin mililitre cinsinden hacmi
100 - x% = numune tarafından yüzde olarak pirogallolün inhibisyonu - Son olarak, aşağıdaki denklemle SOD aktivitesini belirleyin:
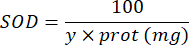
SOD = mikrogram protein başına uluslararası birimler cinsinden SOD aktivitesi
Y = pirogallolün %50'sini inhibe eden numune hacmi
100 = desilitreden mililitreye dönüşüm faktörü.
protein = Bradford'un miktar tayininden elde edilen protein konsantrasyonu mililitre başına mikrogram olarak ifade edilir; Desilitre başına grama dönüştürmek için 10'a bölmek gerekir
- Katalaz antioksidan enzim mikrotesti (CAT)19,20
- 96 oyuklu bir mikroplaka kullanın. Kuyucuklara 20 μL numune süpernatanı ekleyin (iki katına çıkarak).
- Standart olarak kuyucuklara 20 μL taze katalaz (200 μg/mL) ekleyin (iki katına çıkarak). Numuneye 100 μL 50 mM PBS pH 7.8 ekleyin ve kuyucukları boşaltın.
- Reaksiyonu başlatmak için kuyucuklara 100 μL 90 mM (% 30) H2O2 ekleyin. H2O2ekledikten sonra, 240 nm'de 2,5 dakika boyunca her 15 saniyede bir absorbans okuyun.
- Denklemi kullanarak etkinliği hesaplayın:

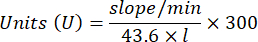
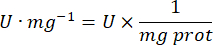
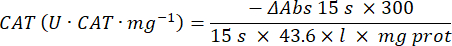
- Glutatyon peroksidaz enzim mikrodeneyi (GPx)21
- 96 oyuklu bir mikroplaka kullanın.
- 240 μL 0.1 M GSH çözeltisi, 1 200 μL 10 U / mL GSH-Rd çözeltisi ve 1 200 μL 4 mM NADPH'yi karıştırın. Çözeltiyi buz üzerinde tutun.
- 100 μL 50 mM TRIS / HCl 5 mM EDTA pH 7.6 kuyucuklarına ekleyin. İki parça halinde 1 μL süpernatan numune ekleyin. Mikroplakaya hafifçe vurun ve hafifçe karıştırın.
- 50 μL karışım çözeltisi ekleyin (adım 4.5.2) ve hafifçe karıştırın.
- Reaksiyonu başlatmak için kuyucuklara 20 μL 7 mM t-bütil hidroperoksit çözeltisi ekleyin (16 çoğaltılmış numunede reaksiyonun başlatılması yaklaşık 15 saniye sürer). Mikroplakayı hızlı bir şekilde karıştırın.
- 340 nm'de 25 ° C'de 5 dakika boyunca her 1 dakikalık aralıklarla absorbansı izleyin.
- GPx aktivitesini aşağıdaki denklemle hesaplayın:
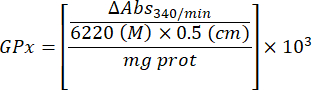
Nerede
GPx = proteinin mikrogramı başına dakikada milimolar cinsinden aktivite
ΔAbs340/dk= Deltada ortalama absorbans
103 = molardan milimolara dönüşüm
- mg prot = Bradford'un belirlemesinden elde edilen protein konsantrasyonu, mikrolitre başına mikrogram olarak ifade edilir
- Bradford'un analizi ile protein miktar tayini22
- Tablo 1'de gösterildiği gibi stok çözeltisi 2 μg / μL'den ayarlanan sığır serum albümini (BSA) çözeltilerinden standart bir eğri gerçekleştirin.
- 96 oyuklu bir mikroplaka kullanın. Numuneye ve standart kuyucuklara 190 μL Bradford reaktifi ekleyin.
- Standart kuyucuklara iki katına 10 μL BSA ekleyin. Numune kuyucuklarına iki katına 10 μL süpernatan ekleyin.
- Pipet ucuyla nazikçe karıştırın.
- 595 nm'de absorbans okuyun. Protein konsantrasyonunu standart eğri ile ölçün.
Sonuçlar
Çalışmanın sonuçları, Şekil 2'de gösterildiği gibi, ağır metallerin, özellikle Alüminyum (Al), Demir (Fe) ve Çinko'nun (Zn) çevre üzerinde zararlı bir etkiye sahip olduğunu ortaya koymaktadır. Tüm bölgelerden toplanan hem doku hem de su örneklerinde yüksek düzeyde ağır metallerin tespit edilmesi olumsuz bir sonuca yol açmıştır. Biyoakümülasyon Faktörü (BAF) 600 olan aykırı değerler, özellikle Extoraz Nehri gibi madencili...
Tartışmalar
Her ne kadar kullanımı C. texanus değerlendirme için en uygun olsa da, kullanımının ve toplanmasının çeşitli yönlerini dikkate almak gerekir. Seçilen bölgelerdeki olumsuz hava koşulları, coğrafi erişilemezlik, yüksek kuraklık seviyeleri veya yetersiz güvenlik protokolleri gibi çeşitli faktörler nedeniyle seçilen çalışma alanları zorlu olmaktadır. Belirtilen kısıtlamalar ve sınırlamalar, saha çalışması yürütülürken genellikle zorluklar or...
Açıklamalar
Yazarlar, çalışmalarında herhangi bir çıkar çatışması bulunmadığını açıkladılar.
Teşekkürler
Yazarlar, araştırma çabalarını büyük ölçüde kolaylaştıran FONINS P 1931 hibesini sağladığı için CONAHCyT'ye içten teşekkürlerini sunarlar. Ayrıca, SIP proje hibesi (20200577) aracılığıyla sağlanan paha biçilmez destek için Instituto Politécnico Nacional'daki Secretaría de Investigación y Posgrado'ya teşekkür edeceklerdir. Buna ek olarak, ilk yazar, ekibin saha gezileri düzenlemesine ve önemli verileri toplamasına olanak tanıyan CONAHCyT tarafından verilen cömert lisansüstü bursunu kabul etmek istiyor. Son olarak, yazarlar, María Teresa García Camacho'nun laboratuvardaki paha biçilmez yardımı için takdirlerini ifade etmek isterler, bu proje olmadan bu proje mümkün olmazdı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Referanslar
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır