このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
地表水および環境健康評価のための非従来型バイオモニターとしてのHellgrammite
要約
このプロトコルは、水生生態系における有害な影響を早期に検出するためのバイオマーカーの使用について説明しています。バイオマーカーはセンチネル形質と密接に関連しており、その変化は早期警告による損傷の検出に役立ちます。
要約
一般にヘルグラマイトとして知られている コリダラス属のドブソンフライの幼虫は、その顕著なサイズ、広範な発生範囲、および最大1年間続く可能性のある長期の未熟さによって特徴付けられます。ヘルグラマイトは、汚染や生息地構造への影響に対して敏感であることが明確に知られています。これらのユニークな特徴を考慮すると、 Corydalus texanus 幼虫を使用することは、水生生態系の生態学的完全性を評価するための信頼性の高いバイオモニタリング剤として非常に適しています。このプロトコルは、 C. texanus の評価に必要なツールを提供し、ケーススタディを通じてその有効性を実証することを目的としています。研究結果は実用的な意味を持ち、 C. texanus の幼虫は鉱業汚染に対して早期警告反応を示し、Zn、Fe、Alなどの重金属を大量に生体内に蓄積することを示しています。 C. texanus の個体群の有無は、生態系の健康に関連する潜在的な問題を特定するための有用な指標として役立つ可能性があります。この型破りなアプローチは、鉱業の影響を受ける場所での汚染の早期警告を示しており、環境を保護するためのタイムリーな行動の必要性を強調しています。そのユニークな特性を考えると、 C. texanus 幼虫の使用は、信頼性の高い非従来型のバイオインディケーターとして強く推奨されています。
概要
ヘルグラマイトは、Megaloptera目(Latreille、1802)の昆虫の幼虫であり、成虫期にはドブソンフライまたはフィッシュフライと名付けられています。多様性は低いが広範囲に広がっていることが、水生生態系1からのこのトップ捕食昆虫の幼虫のグループを特徴付けています。ヘルグラマイト種は、明確に定義された生物地理学的地域で発生します。したがって、分類学的な知識がなくても種を特定することは比較的容易です。特に、Corydalidaeの幼虫はMegaloptera目(体長20-90 mm)2の最も顕著な種を所有しており、ヘルグラマイトを肉眼で見ることができます。
ヘルグラマイトは、捕食者として水生生態系で重要な役割を果たしており、大きな噛み物が印象的な捕食者の形を示すため、強力な存在感を示しています。背腹方向に平らになった体は、体に沿って7〜8対のフィラメントエラと結合し、片側に6つのステムマタを持つヘッドカプセルは、昆虫学者やファンにとってヘルグラマイトを魅力的な生物にしています3。Corydalidaeの成虫は、その目立つサイズのために人々に驚き、印象のイメージを作り出します。ただし、それらは完全に無害です。ヘルグラマイトは、幼虫期の水生環境にかなりの期間持続する能力を持っていることは注目に値します。
ヘルグラマイトの表現型の特徴は、水生生態系における彼らの役割を強調する特別な機会を可能にします。それにもかかわらず、それらの指標の可能性は、水生生態学者にとって最も望まれている特徴です。それらの生物指標の可能性に関する膨大な知識は、それらの発生が地表水4,5,6,7,8の有機汚染に対する不耐性のために彼らの生息地の良好な健康状態に関連しているため、水生生態系で強調されています。
ほとんどのCorydalidaeメガロプテランは、丸石や小石が優勢な小川や基質として高速流域に生息していますが、ヘルグラマイトは、引っ掛かりや砂の基質がある低勾配の小川や、湖などのレンティックな生息地でも発生します3,9,10。彼らの幅広い発生範囲は、トッププレデターの重要な特性と、効果的な生活史戦略によって目指されたいくつかの生息地を植民地化する能力を反映しています11。ヘルグラマイトは、その形質を水生生態系のダイナミクスと関連付けました。したがって、気門による空中呼吸への適応などの戦略(気管鰓の腹側房に加えて)は、Corydalidaeの戦略10の適切です。
ヘルグラマイトは特定の生態系に生息し、確立されたパターンからの逸脱に対して迅速な反応を示すため、早期警告システムとして機能します7。これらの野生生物生物の反応は、特に非標的汚染物質混合物の場合に、汚染が水生生態系に与える影響を評価するための貴重なツールとして利用できます。生物への有害な影響は、化学物質の個々の毒性のために生態系で認識されていますが、汚染物質混合物の影響を特定する必要があります。ヘルグラマイトからの早期警告応答は、汚染物質の混合物の影響を参照することにより、または汚染物質の個々の影響が観察可能な影響濃度(NOEC)を認識しない場合でも、有害な影響を特定することを可能にする可能性があります12。
いくつかのモデル生物が実験的急性および慢性試験に使用されてきました。しかし、それらは管理された条件下で培養され、維持されています13。制御された条件により、彼らはさらされているいくつかの汚染物質の非標的効果を特定することができません。また、NOECは、汚染物質の混合物が複雑なため、頻繁に認識されます。そのため、過去数十年で、非標的効果を持つ非モデル在来種が、生態毒性学研究の実施に不可欠なスクリーニングシステムに認識されました14。その結果、ヘルグラマイトは、水生生態系における汚染の有害な影響を評価できるようです。とりわけ、生物学、遺伝学、生理学などの形質により、非モデル生物は生態系への影響評価に適しています14。
このプロトコルは、非標的汚染混合物に応答して早期警告シグナルを検出できる非モデル生物を使用した新しいバイオモニタリングツールを確立することを目的としています。最良の結果を得るために、モデル種である C.texanusの幼虫が示す形質が包括的に考慮され、分析15に統合されました。
プロトコル
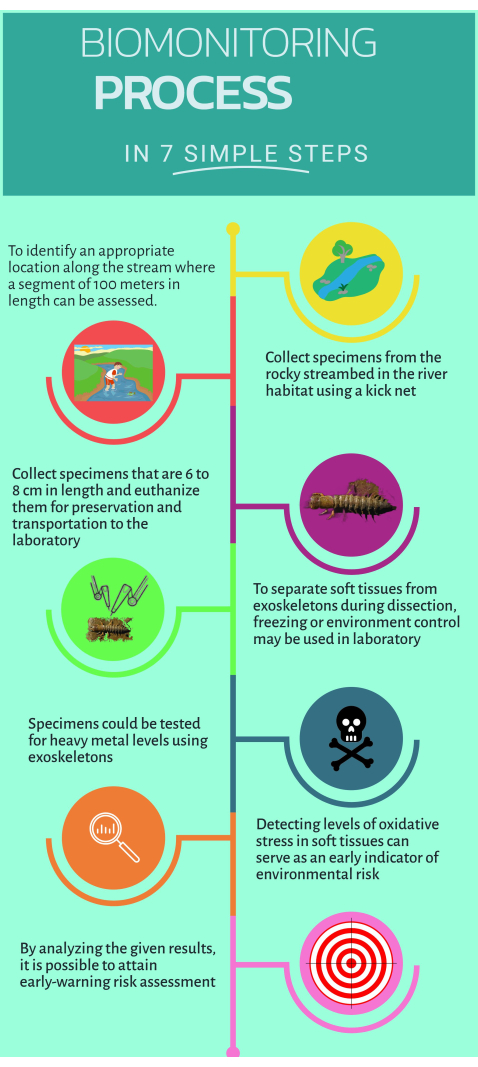
図1:水生生態系での実装のための非従来型バイオ モニターCorydalus texanus の使用方法に関するクイックステップバイステップガイド。 この 図の拡大版を表示するには、ここをクリックしてください。
1. フィールドワーク
- 汚染源の上流および下流に位置し、疑わしいまたは明らかな影響(つまり、時間厳守または拡散放出)が認識される調査サイトを特定します。
注:現在のプロトコルには、4つの主要な川の15の研究サイトが含まれていました:1)エクストラズ川(サイトPB、EZ、RQ、BC);2)エスカネラ-ハルパン川(ES、EN、AH、JL、PI、PA);3)アユトラ川(AY);4)サンタマリア川(SM、AT)。 - 少なくとも 1 つの参照サイト(影響が軽微またはない場所)を検索して特定し、それを研究サイトとして定義します。
注:現在の研究施設では、BC、ES、SM、AY、ATが参照施設として考慮されました。 - C. texanusの個体を見つける可能性を高める生息地の特定の属性を認識します。これらには、砂利の基質、勾配が急な岩だらけの生息地、高速の流れ、十分に酸素化された水、高いキャノピー密度、および高地と低地の生息地が含まれます。
- 小川の100mのセクションを囲んで、バイオモニタリング16の適切な生息地を特定します。
- ストリームの中に入ってサンプルを収集します。
- 500 μmのメッシュサイズのキックネットを使用して、小川、小石、澄んだ水、破片などの生息地で C. texanus の少なくとも6個体をサンプリングします。
- 水流の方向の岩を取り除き、幼虫をネットに移します。
- サンプリングした幼虫でキックネットを取り扱い、仮設住宅用の指定ボトルに移します。ネットの取り扱いには注意し、幼虫の損失を防ぐために端を内側に折ります。
- ノギスを使用してサンプリングした幼虫の頭幅を測定し、インスターズIXからXIを識別します(6mmから10mmの範囲)。
- 幼虫を小川の水が入ったボトルに30分間浸してパージします。
- 明確なラベルを貼ったプラスチックボトルにサンプルを入れ、極低温タンク内の液体窒素(-75°C)に浸して安楽死させます。
- サンプルは、ラボのウルトラフリーザーで-45°Cにしっかりと輸送および保管してください。
- ポリエチレンボトルを使用して、200 mLの河川水サンプルを採取し、1 mLの硝酸を加え、サンプルを4°Cで保存して、その後の実験室での重金属定量を行います。
2.サンプリングされた幼虫の解剖と組織分離
- プラスチック製の解剖トレイを氷の上に置き、温度計を使用して4°Cに達するまで待ちます。
- ウルトラフリーザーからサンプルを採取し、解剖トレイに置いて解剖を開始します。
- ターゲット組織を選択します:筋肉、枝、神経管、外骨格。
- セラミックナイフを使用して頭を取り外し、組織を慎重に分離します。本体を縦に開き、両側のえらを取り除きます。
- 小さなセラミックナイフを使用して外骨格を分離し、余分な組織をきれいにします。外骨格をオーブンに入れ、80°Cで48時間乾燥させます。
- 時間が経ったら、さらなる分析のために乾燥した外骨格を保管してください。
- 低温条件下で軟組織を洗浄し続け、マイクロアッセイによるさらなる分析を行います。
- 小さなセラミックナイフを使用して、脂肪から軟組織を抽出します。同じサンプリングポイントから各ターゲット組織を個体から分離し、プールします。
- 各組織タイプを2 mLのマイクロチューブに保管し、プロセス全体を通して低温状態を維持します。
- 各標的組織を調製するには、組織100 mgを秤量し、pH 7.4のPBS溶液1 mLを加えます。片手ティッシュティアラーを使用して、各組織を均質化します。通常、軟部組織にはそれぞれ10秒のサイクルが3サイクル必要です。
- サンプルを1,000 x g で4°Cで5分間遠心分離します。 上清を1 mLのマイクロチューブに移します。
- バイオマーカーマイクロアッセイを実施します。
3. 重金属の定量
- 分析天びんを使用して、指定された発生段階にある少なくとも6つの標本からの乾燥した外骨格250 mgを秤量します。
- ガラスモルタルで外骨格を微粉末になるまで挽きます。250mLの超高純度硝酸を粉末反応容器に加えます。
- サンプルを分解するには、サンプルを180°Cの分解マイクロ波に30〜45分間移します。
注意: マイクロ波ブランドに適したマイクロ波対応容器を使用して、サンプルを安全かつ効果的に加熱します。組織サンプルの分解時間はマイクロ波ブランドによって異なり、30〜45分かかります。一部のブランドは、標準化された方法を提供しています。 - 水サンプルのマイクロ波分解法は、EPA3015A法に従って、45 mLの水サンプルを使用し、5 mLの硝酸を加えて実施します。
- 誘導結合プラズマ発光分光法(ICP-OES)を使用して、Hg、Cu、Pb、Zn、Fe、Cr、Cd、Mn、Ba、Asなどの分解サンプル(水および組織)中の重金属およびメタロイドを測定します。
注:アルゴングレード5と各金属および半金属の標準溶液を使用して、検量線を作成します。
4. 酸化ストレスとバイオマーカーの評価のためのマイクロアッセイ
- 試薬の調製
- 6 gのNaH2PO4 を1000 mLの超純水と混合して、50 mMのモノ塩基性リン酸バッファーを調製します。2〜8°Cのフラスコに無期限に保管してください。
- 8.1% SDS を調製するには、450 mg のドデシル硫酸ナトリウム (SDS) を 5 mL の超純水に溶解します。使用直前にご用意ください。
- 2 mLのトリクロロエタン酸(TCA)を8 mLの超純水で希釈します(必要に応じて新しい試薬を準備します)。
- 100 mgのテトラブチルアンモニウム(TBA)を10 mLの超純水に溶解します(必要に応じて新しい試薬を準備します)。
- 50 mM PBS pH 7.8 にするには、97 mg の Na2HPO4 と 59 mg の NaH2PO4 を 10 mL の超純水に溶解します。次に、NaOHを使用してpHを7.8に調整して増加させるか、HClを使用して減少させます。
- ウシカタラーゼ8mgを40μLの超純水に溶解して、200μg/mLの溶液を作製します(必要に応じて新しい試薬を調製します)。
- 50 mM TRIS/5 mM エチレンジアミン四酢酸(EDTA)溶液を作るには、45 mL の超純水に 6.05 g のトリス(ヒドロキシメチル)アミノメタン(TRIS)と 0.073 g の EDTA を加えます。HClでpHを7.6に調整し、使用するまで4°Cで保存します。
- 0.1 Mグルタチオン還元(GSH)(45個の重複サンプル)の場合、0.0184 gのGSHを秤量し、600 μLの10 mM HClに溶解します。
- 10 mM HClを調製するには、599.5 μLの超純水に0.5 μLの濃縮HClを加えます。
- 28.5 μL のグルタチオンレダクターゼを 1.4 mL の 0.1 M TRIS/HCl 0.5 mM EDTA pH 8.0 に添加します。
- 1.211 g の TRIS と 0.0146 g の EDTA を 90 mL の超純水と混合し、0.1 M TRIS/HCl と 0.5 mM の EDTA 溶液を pH 8.0 で調製します。必要に応じてHClを添加してpHを調整します。溶液は2〜8°Cで無期限に保存できます。
- 0.075 gのNADPHを重量で量し、2.25 mLの1%NaHCO3 1 mM EDTAに加えます。
- 100 mLの超純水に1 gのNaHCO3 と0.0282 gのEDTAを混合し、1% NaHCO3と1 mM EDTA溶液を調製します。溶液を4〜8°Cで不確定な時間保存します。
- 2 μL の t-ブチルヒドロペルオキシドを 2 mL の超純水と混合して、7 mM 溶液を調製します。使用直前に混ぜてください。
- 1 gのウシ血清アルブミン(BSA)を1 mLの超純水と混合して、1 μg/μLのストック溶液を調製します。
- チオバルビツール酸反応性物質(TBARS)(脂質過酸化、LPO)17
- 5 μLの組織上清を1 mLのマイクロチューブに加えます。50 mM PBS(新鮮溶液およびストック溶液)を45 μL加えます。
- 12.5 μL の 8.1% SDS (調製したばかり) を加えます。20% TCA pH 3.5 (調製したばかり) 93.5 μL を加えます。
- 93.5 μL の 1% TBA (調製したて) を加えます。50.5μLの超純水を加えて容量を完成させます。チューブの蓋を閉じ、30秒間ボルテックスします。
- マイクロチューブの蓋に針で穴を開け、沸騰水で10分間インキュベートします。
- チューブを室温(RT)で冷却し、1000 x g で10分間遠心分離します。
- 96ウェルマイクロプレートのウェルに150μLの上清を加え、マイクロプレート分光光度計を使用して530nmの吸光度を測定します。
- 過酸化脂質を定量するには、 表1に記載されているように、マロンジアルデヒドビス(ジメチルアセタール)を使用して8ポイントTBARS検量線(0〜160μM)を作成します。マロンジアルデヒド(MDA)曲線は、組織の種類または疑わしい損傷レベルに応じて調整します。
- 結果をnmol MDA eq·mg-1 タンパク質として表します。
- スーパーオキシドジスムターゼ抗酸化酵素マイクロアッセイ(SOD)18
- 96ウェルプレートを使用してください。147 μL の 1 M TRIS/5 mM HCl EDTA pH 8 をブランクとして 2 つのウェルに加えます。144 μL の 1 M TRIS/5 mM HCl EDTA pH 8 を他のウェルに複打して加えます。
- 上清から3 μLを取り出し、サンプルウェルに加えます。プレートの中身を数回やさしく混ぜます。
- 30 秒以内に 3 μL の 10 mM ピロガリン酸を各ウェルに加えます。すぐにやさしく混ぜます。
- T0(時間 = 0 秒)と T10(時間 = 10 秒)の 420 nm と 25 °C での吸光度を測定します。
- 次の式を使用してサンプル中のピロガロール阻害率を計算することにより、SODを決定します。
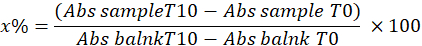
どこ
x%=サンプル中のSODによるピロガロールの酸化の割合。したがって、ピロガロールの酸化は100 - X%に等しい
注:1 IUを考慮したSOD活性の計算は、以下に説明するようにピロガロール酸化の50%を阻害する体積です。
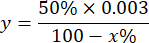
どこ
y = ミリリットル単位のサンプル量 (ピロガロンの 50% を抑制)
50% = ピロガロールの阻害率は SOD の 1U に等しい
0.003 = サンプルのミリリットル単位の体積
100 - x% = サンプルによるピロガロールの阻害率 - 最後に、次の式で SOD アクティビティを決定します。
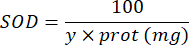
SOD = タンパク質のマイクログラムあたりの国際単位でのSODの活性
Y =サンプル量は、ピロガロールの50 % を阻害します
100 = デシリットルからミリリットルへの変換係数。
タンパク質 =ブラッドフォードの定量から得られるタンパク質濃度は、ミリリットルあたりマイクログラムで表されます。デシリットルあたりのグラムに変換するには、10で割る必要があります
- カタラーゼ抗酸化酵素マイクロアッセイ(CAT)19,20
- 96ウェルマイクロプレートを使用してください。20 μL のサンプル上清をウェルに (重複して) 加えます。
- 20 μLのフレッシュカタラーゼ(200 μg/mL)を標準試料としてウェルに添加します(重複)。pH 7.8の50 mM PBS 100 μLをサンプルウェルとブランクウェルに加えます。
- 90 mM(30%)H2O2 をウェルに100 μL加えて、反応を開始します。H2O2を添加した後、240 nmで15秒ごとに2.5分間吸光度を読み取ります。
- 次の式を使用してアクティビティを計算します。

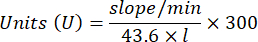
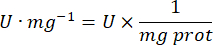
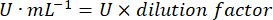
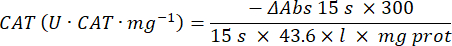
- グルタチオンペルオキシダーゼ酵素マイクロアッセイ(GPx)21
- 96ウェルマイクロプレートを使用してください。
- 240 μL の 0.1 M GSH 溶液、10 U/mL GSH-Rd 溶液 1,200 μL 1,200 μL の 4 mM NADPH 溶液を混合します。溶液を氷の上に保ちます。
- pH 7.6の50 mM TRIS/HCl 5 mM EDTA 100 μLをウェルに加えます。上清サンプル1μLを二重に加えます。マイクロプレートを軽くたたいて、静かに混ぜます。
- 50μLの混合溶液(ステップ4.5.2)を加え、穏やかに混合します。
- 7 mM t-ブチルヒドロペルオキシド溶液を 20 μL ウェルに添加して反応を開始します (16 個の重複サンプルで反応を開始するには約 15 秒かかります)。マイクロプレートをすばやく混合します。
- 1分間隔ごとに5分間、25°C、340nmで吸光度を監視します。
- GPxのアクティビティを次の式で計算します。
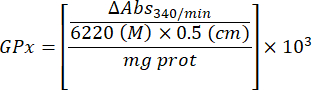
どこ
GPx = タンパク質のマイクログラムあたりの毎分ミリモル単位の活性
ΔAbs340/min= デルタ単位の平均吸光度
103 = モルからミリモルへの変換
- mg prot = ブラッドフォードの決定によるタンパク質濃度(マイクログラム/マイクロリットルで表される)
- Bradfordの分析によるタンパク質の定量22
- 表 2 に示すように、ウシ血清アルブミン(BSA)溶液から標準曲線を 1 μg/μL にセットします。
- 96ウェルマイクロプレートを使用してください。190 μLのBradford試薬をサンプルウェルと標準ウェルに加えます。
- 標準ウェルに10 μLのBSAを二重に添加します。10 μLの上清をサンプルウェルに二重に添加します。
- ピペットチップとやさしく混ぜます。
- 595nmで吸光度を読み取ります。標準曲線でタンパク質濃度を定量します。
結果
この研究の結果は、 図2で証明されているように、重金属、特にアルミニウム(Al)、鉄(Fe)、亜鉛(Zn)が環境に悪影響を及ぼしていることを明らかにしています。すべてのサイトから収集された組織サンプルと水サンプルの両方で高レベルの重金属が検出されることは、好ましくない結果をもたらしました。外れ値は、特にエクストラズ川などの鉱?...
ディスカッション
C. texanusの使用は評価に最適ですが、その使用と収集のいくつかの側面を考慮する必要があります。選択した調査サイトは、不利な気象条件、地理的にアクセスできない、高い乾燥度、選択した地域のセキュリティプロトコルが不十分であるなど、いくつかの要因により困難であることが証明されています。制約や制限が明記されていると、フィールドワーク?...
開示事項
著者らは、彼らの研究に利益相反が存在しないことを明らかにした。
謝辞
著者らは、CONAHCyTがFONINS P 1931助成金を提供してくれたことに心から感謝し、研究活動を大いに促進しました。また、SIPプロジェクト助成金(20200577)を通じて提供された貴重な支援について、Instituto Politécnico NacionalのSecretaría de Investigación y Posgradoにも感謝します。さらに、筆頭著者は、CONAHCyTが授与した寛大な大学院奨学金に感謝し、これによりチームはフィールドトリップを実施し、重要なデータを収集することができました。最後に、著者は、このプロジェクトが不可能だった研究室のマリア・テレサ・ガルシア・カマチョの貴重な支援に感謝の意を表したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
参考文献
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved