Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hellgrammit als unkonventioneller Biomonitor für die Bewertung der Gesundheit von Oberflächengewässern und der Umwelt
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung von Biomarkern zur Früherkennung schädlicher Auswirkungen auf aquatische Ökosysteme. Die Biomarker sind eng mit den Merkmalen der Wächter verwandt, und ihre Veränderungen helfen bei der Erkennung von Frühwarnschäden.
Zusammenfassung
Die Larven der Dobsonfliegen der Gattung Corydalus, allgemein bekannt als Hellgrammiten, zeichnen sich durch ihre bemerkenswerte Größe, ihr umfangreiches Verbreitungsspektrum und ihre lange Unreife aus, die bis zu einem Jahr dauern kann. Hellgrammite sind eindeutig dafür bekannt, dass sie empfindlich auf Verschmutzung und Auswirkungen auf die Lebensraumstruktur reagieren. Angesichts dieser einzigartigen Eigenschaften eignet sich die Verwendung von Corydalus texanus-Larven sehr gut als zuverlässiges Biomonitoring, um die ökologische Integrität aquatischer Ökosysteme zu beurteilen. Dieses Protokoll zielt darauf ab, die notwendigen Werkzeuge für die Bewertung von C. texanus bereitzustellen und ihre Wirksamkeit anhand einer Fallstudie zu demonstrieren. Die Forschungsergebnisse haben praktische Auswirkungen und deuten darauf hin, dass C . texanus-Larven frühzeitig auf die Verschmutzung durch den Bergbau reagieren und große Mengen an Schwermetallen wie Zn, Fe und Al bioakkumulieren. Das Vorhandensein oder Fehlen von C. texanus-Populationen kann als hilfreicher Indikator für die Identifizierung potenzieller Probleme im Zusammenhang mit der Gesundheit des Ökosystems dienen. Der unkonventionelle Ansatz hat gezeigt, dass frühzeitig vor Umweltverschmutzung in den vom Bergbau betroffenen Standorten gewarnt wurde, was die Notwendigkeit rechtzeitiger Maßnahmen zum Schutz der Umwelt unterstreicht. Aufgrund ihrer einzigartigen Eigenschaften wird die Verwendung von C. texanus-Larven als zuverlässiger nicht-konventioneller Bioindikator dringend empfohlen.
Einleitung
Hellgramiten sind Insektenlarven aus der Ordnung Megaloptera (Latreille, 1802), die im Erwachsenenstadium Dobsonfliegen oder Fischfliegen genannt werden. Eine geringe, aber weit verbreitete Diversität kennzeichnet diese Gruppe der Top-Raubinsektenlarven aus aquatischen Ökosystemen1. Hellgramit-Arten kommen in genau definierten biogeographischen Regionen vor; Daher ist es relativ einfach, Arten ohne hohe taxonomische Kenntnisse zu identifizieren. Bemerkenswert ist, dass die Larven der Corydalidae die prominenteste Art aus der Ordnung der Megaloptera (20-90 mm Körperlänge)2 besitzen, wodurch Hellgramite mit bloßem Auge sichtbar wird.
Hellgrammiten spielen in aquatischen Ökosystemen eine entscheidende Rolle als Raubtiere, mit einer starken Präsenz aufgrund von großen Kaubonbons, die auf ihre beeindruckende räuberische Form hinweisen. Ein dorsoventral abgeflachter Körper verbindet sich ebenfalls mit 7-8 Paaren von Filamentkiemen entlang des Körpers, und eine Kopfkapsel mit sechs Stemmata pro Seite macht Hellgrammiten zu faszinierenden Organismen für Entomologen und Fans3. Erwachsene von Corydalidae überraschen und erzeugen aufgrund ihrer auffälligen Größe ein Eindrucksbild für Menschen; Sie sind jedoch völlig harmlos. Es ist bemerkenswert, dass Hellgrammite die Fähigkeit haben, in aquatischen Umgebungen in ihrem Larvenstadium über einen beträchtlichen Zeitraum zu überleben.
Die phänotypischen Merkmale der Hellgrammite bieten eine besondere Gelegenheit, ihre Rolle in aquatischen Ökosystemen hervorzuheben; Nichtsdestotrotz ist ihr Indikatorpotenzial das am meisten gesuchte Merkmal für Aquarienökologen. Das umfangreiche Wissen über ihr Bioindikatorpotenzial in aquatischen Ökosystemen wird hervorgehoben, da ihr Vorkommen mit guten Gesundheitsbedingungen in ihren Lebensräumen zusammenhängt, da sie gegenüber organischer Verschmutzung in Oberflächengewässern unverträglich sind 4,5,6,7,8.
Die meisten Corydalidae megalopteren leben in schnell fließenden Gewässern als Riffe und Substrate, die von Kopfsteinpflaster und Kieselsteinen dominiert werden, aber Hellgrammite kommen auch in Bächen mit niedrigem Gefälle mit Haken und Sandsubstraten sowie in lentischen Lebensräumen wie Seenvor 3,9,10. Ihr breites Verbreitungsspektrum spiegelt die kritischen Eigenschaften eines Top-Raubtiers und seine Fähigkeit wider, mehrere Lebensräume zu besiedeln, die auf seine effektiven Lebensstrategien abzielen11. Hellgramiten verknüpften ihre Eigenschaften mit der Dynamik aquatischer Ökosysteme; Daher sind Strategien wie die Anpassung an die Luftatmung durch Spiracles (zusätzlich zu ihren ventralen Büscheln der Trachealkiemen) für die Corydalidae-Strategien typisch10.
Hellgrammiten bewohnen bestimmte Ökosysteme und zeigen schnelle Reaktionen auf Abweichungen von etablierten Mustern, wodurch sie als Frühwarnsystem dienen7. Die Reaktionen dieser Wildtierorganismen können als wertvolles Instrument zur Abschätzung der Auswirkungen der Verschmutzung auf aquatische Ökosysteme eingesetzt werden, insbesondere im Fall von Nichtziel-Schadstoffgemischen. Einige schädliche Auswirkungen auf lebende Organismen wurden in Ökosystemen aufgrund der individuellen Toxizität von Chemikalien erkannt, aber die Wirkung von Schadstoffgemischen muss identifiziert werden. Die Frühwarnreaktionen von Hellgrammiten können es ermöglichen, schädliche Auswirkungen zu identifizieren, indem sie auf die Auswirkungen eines Schadstoffgemisches verweisen oder sogar, wenn einzelne Wirkungen von Schadstoffen eine NOEC-Konzentration ohne beobachtbare Wirkung (No Observable Effect Concentration) erkennen12.
Mehrere Modellorganismen wurden für experimentelle akute und chronische Tests verwendet; Sie werden jedoch unter kontrollierten Bedingungen kultiviert und gehalten13. Unter kontrollierten Bedingungen sind sie nicht in der Lage, die Nichtzielwirkungen mehrerer Schadstoffe, denen sie ausgesetzt sind, zu identifizieren. Außerdem wird NOEC häufig aufgrund der Komplexität des Schadstoffgemisches erkannt. Aus diesem Grund wurden in den letzten Jahrzehnten nicht modellhafte einheimische Arten mit Nicht-Zieleffekten für Screening-Systeme anerkannt, die für die Durchführung ökotoxikologischer Forschung unerlässlich sind14. Folglich scheinen Hellgrammiten in der Lage zu sein, die schädlichen Auswirkungen der Verschmutzung in aquatischen Ökosystemen zu bewerten. Merkmale wie unter anderem ihre Biologie, Genetik und Physiologie machen Nicht-Modellorganismen für die Folgenabschätzung in Ökosystemen geeignet14.
Dieses Protokoll zielt darauf ab, ein neuartiges Biomonitoring-Instrument unter Verwendung eines Nicht-Modellorganismus zu etablieren, der Frühwarnsignale als Reaktion auf Nichtziel-Schadstoffgemische erkennen kann. Um die besten Ergebnisse zu erzielen, wurden die Merkmale der Larven der Modellart C. texanus umfassend berücksichtigt und in die Analyse integriert15.
Protokoll
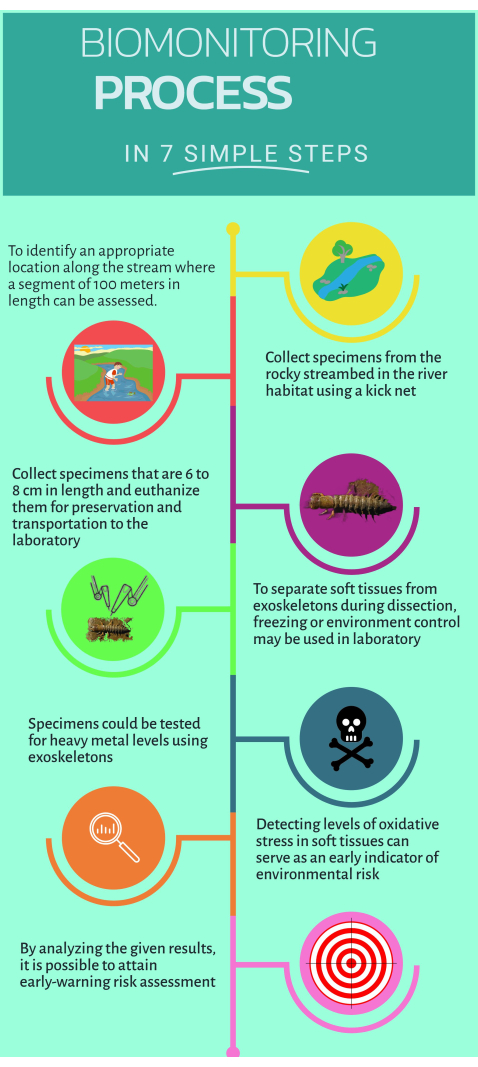
Abbildung 1: Schnelle Schritt-für-Schritt-Anleitung zur Verwendung des unkonventionellen Biomonitors Corydalus texanus für den Einsatz in aquatischen Ökosystemen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Feldforschung
- Identifizierung von Untersuchungsstandorten, die sich flussaufwärts und flussabwärts der Verschmutzungsquelle befinden und an denen vermutete oder offensichtliche Auswirkungen erkannt werden (d. h. punktuelle oder diffuse Emissionen).
ANMERKUNG: Das vorliegende Protokoll umfasste 15 Untersuchungsstandorte in vier Hauptflüssen: 1) Extoraz River (Standorte PB, EZ, RQ, BC); 2) Fluss Escanela-Jalpan (ES, EN, AH, JL, PI, PA); 3) Ayutla Fluss (AY); und 4) Río Santa María (SM, AT). - Suchen und lokalisieren Sie mindestens eine Referenzstelle (einen Ort mit geringen oder keinen Auswirkungen) und definieren Sie sie als Untersuchungsstandort.
HINWEIS: Für die aktuellen Untersuchungszentren wurden BC, ES, SM, AY und AT als Referenzzentren berücksichtigt. - Erkennen Sie bestimmte Attribute von Lebensräumen, die die Wahrscheinlichkeit erhöhen, Individuen von C. texanus zu finden. Dazu gehören Kiessubstrat, felsige Lebensräume mit steileren Gradienten, Hochgeschwindigkeitsströmungen, sauerstoffreiche Gewässer, eine hohe Kronendichte sowie Lebensräume im Hoch- und Tiefland.
- Ein 100 m langer Abschnitt des Baches ist einzuschließen, um geeignete Lebensräume für das Biomonitoringzu ermitteln 16.
- Steigen Sie in den Bach, um Proben zu sammeln.
- Nehmen Sie Proben von mindestens sechs Individuen von C. texanus in Lebensräumen wie Riffeln, Kieselsteinen, klarem Wasser und Geröll mit einem Tretnetz mit einer Maschenweite von 500 μm.
- Entfernen Sie Steine in Richtung des Wasserflusses und setzen Sie die Larven in das Netz um.
- Fassen Sie das Trittnetz mit den beprobten Larven an und füllen Sie sie in dafür vorgesehene Flaschen zur vorübergehenden Unterbringung um. Gehen Sie vorsichtig mit dem Netz um und klappen Sie die Ränder nach innen, um einen Verlust der Larven zu vermeiden.
- Die Kopfbreite der beprobten Larven wird mit einem Messschieber gemessen, um die Stadien IX bis XI (im Bereich von 6 mm bis 10 mm) zu identifizieren.
- Reinigen Sie die Larven, indem Sie sie 30 Minuten lang in eine Flasche mit Bachwasser tauchen.
- Die Proben werden in Plastikflaschen mit klarer Etikettierung abgefüllt und anschließend durch Eintauchen in flüssigen Stickstoff (-75 °C) in einem Kryotank eingeschläfert.
- Transportieren und lagern Sie die Proben sicher bei -45 °C im Ultratiefkühlschrank im Labor.
- Entnehmen Sie mit einer Polyethylenflasche eine Strahlwasserprobe von 200 ml, fügen Sie 1 ml Salpetersäure hinzu und lagern Sie die Probe bei 4 °C für die anschließende Schwermetallquantifizierung im Labor.
2. Zerlegung der beprobten Larven und Gewebetrennung
- Stellen Sie die Sezierschale aus Kunststoff auf Eis und warten Sie, bis sie 4 °C erreicht hat, und überprüfen Sie sie mit einem Thermometer.
- Entnehmen Sie Proben aus dem Ultratiefkühlschrank und legen Sie sie auf das Seziertablett, um mit dem Präparieren zu beginnen.
- Wählen Sie das Zielgewebe aus: Muskeln, Äste, Neuralrohr und Exoskelett.
- Entferne den Kopf mit einem Keramikmesser und trenne die Taschentücher vorsichtig. Öffnen Sie den Körper in Längsrichtung und entfernen Sie die Kiemen auf jeder Seite.
- Trennen Sie die Exoskelette mit einem kleineren Keramikmesser und reinigen Sie das überschüssige Gewebe. Legen Sie die Exoskelette in einen Ofen und trocknen Sie sie bei 80 °C für 48 h.
- Lagern Sie nach Ablauf der Zeit trockene Exoskelette für die weitere Analyse.
- Reinigen Sie das Weichgewebe unter kalten Bedingungen für die weitere Analyse durch Mikroassays.
- Verwenden Sie ein kleines Keramikmesser, um Weichteile aus Fett zu extrahieren. Trennen und poolen Sie jedes Zielgewebe von Individuen aus demselben Probenahmepunkt.
- Lagern Sie jeden Gewebetyp in einem 2-ml-Mikroröhrchen und halten Sie während des gesamten Prozesses kalte Bedingungen aufrecht.
- Um jedes Zielgewebe vorzubereiten, wiegen Sie 100 mg des Gewebes und fügen Sie 1 ml PBS-Lösung mit einem pH-Wert von 7,4 hinzu. Verwenden Sie einen einhändigen Gewebereißer, um jedes Gewebe zu homogenisieren. Typischerweise benötigen Weichteile drei Zyklen von jeweils 10 s.
- Zentrifugieren Sie die Probe bei 1.000 x g für 5 min bei 4 °C. Übertragen Sie den Überstand in ein 1-ml-Mikroröhrchen.
- Führen Sie Biomarker-Mikroassays durch.
3. Quantifizierung von Schwermetallen
- Wiegen Sie 250 mg getrocknete Exoskelette von mindestens sechs Proben des angegebenen Entwicklungsstadiums mit einer Analysenwaage.
- Zermahle Exoskelette in einem Glasmörser, bis sie fein pulverisiert sind. Geben Sie 250 mL hochreine Salpetersäure in die Pulverreaktionsgefäße.
- Um die Proben zu verdauen, werden sie für 30-45 Minuten in eine Aufschlussmikrowelle bei 180 °C gegeben.
HINWEIS: Verwenden Sie den richtigen mikrowellengeeigneten Behälter für die Mikrowellenmarke, um die Proben sicher und effektiv zu erhitzen. Die Aufschlusszeit für Gewebeproben variiert je nach Mikrowellenmarke und dauert 30-45 Minuten. Einige Marken bieten standardisierte Methoden an. - Führen Sie eine Mikrowellenaufschlussmethode für Wasserproben nach der EPA3015A Methode durch, indem Sie 45 ml der Wasserprobe verwenden und 5 ml Salpetersäure hinzufügen.
- Messung von Schwermetallen und Metalloiden in aufgeschlossenen Proben (Wasser und Gewebe) mittels optischer Emissionsspektroskopie mit induktiv gekoppeltem Plasma (ICP-OES), einschließlich Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba und As.
HINWEIS: Verwenden Sie Argon der Güteklasse 5 und Standardlösungen jedes Metalls und Metalloids, um eine Kalibrierkurve zu erstellen.
4. Mikroassays zur Bewertung von oxidativem Stress und Biomarkern
- Vorbereitung von Reagenzien
- Mischen Sie 6 g NaH2PO4 mit 1000 mL Reinstwasser, um einen 50 mM monobasischen Phosphatpuffer herzustellen. In einem Kolben bei 2-8 °C unbegrenzt lagern.
- Um 8,1 % SDS herzustellen, lösen Sie 450 mg Natriumdodecylsulfat (SDS) in 5 ml Reinstwasser. Bereiten Sie sich kurz vor Gebrauch vor.
- 2 ml Trichlorethansäure (TCA) in 8 ml Reinstwasser verdünnen (bei Bedarf frisches Reagenz vorbereiten).
- 100 mg Tetrabutylammonium (TBA) in 10 ml Reinstwasser auflösen (bei Bedarf frisches Reagenz vorbereiten).
- Um 50 mM PBS pH 7,8 herzustellen, lösen Sie 97 mg Na2HPO4 und 59 mg NaH2PO4 in 10 ml Reinstwasser. Stellen Sie dann den pH-Wert auf 7,8 ein, indem Sie NaOH zur Erhöhung oder HCl zur Senkung verwenden.
- Eine Lösung von 200 μg/ml Rinderkatalase herstellen, indem 8 mg davon in 40 μl Reinstwasser gelöst werden (bei Bedarf frisches Reagenz vorbereiten).
- Um eine 50 mM TRIS/5 mM Ethylendiamintetraessigsäure (EDTA)-Lösung herzustellen, fügen Sie 6,05 g Tris (Hydroxymethyl)aminomethan (TRIS) und 0,073 g EDTA zu 45 ml Reinstwasser hinzu. Stellen Sie den pH-Wert mit HCl auf 7,6 ein und lagern Sie ihn bis zur Verwendung bei 4 °C.
- Für 0,1 M reduziertes Glutathion (GSH) (für 45 duplizierte Proben) werden 0,0184 g GSH gewogen und in 600 μl 10 mM HCl gelöst.
- Zur Herstellung von 10 mM HCl fügen Sie 0,5 μl konzentriertes HCl zu 599,5 μl Reinstwasser hinzu.
- Fügen Sie 28,5 μl Glutathionreduktase zu 1,4 mL 0,1 M TRIS/HCl 0,5 mM EDTA pH 8,0 hinzu.
- Mischen Sie 1,211 g TRIS und 0,0146 g EDTA mit 90 mL Reinstwasser, um eine 0,1 M TRIS/HCl und 0,5 mM EDTA-Lösung bei einem pH-Wert von 8,0 herzustellen. Fügen Sie HCl hinzu, um den pH-Wert bei Bedarf anzupassen. Die Lösung kann unbegrenzt bei 2-8 °C gelagert werden.
- Wiegen Sie 0,075 g NADPH und fügen Sie es zu 2,25 mL 1 % NaHCO3 1 mM EDTA hinzu.
- Mischen Sie 1 g NaHCO3 und 0,0282 g EDTA in 100 mL Reinstwasser, um eine 1%ige NaHCO3- und 1 mM EDTA-Lösung herzustellen. Lagern Sie die Lösung auf unbestimmte Zeit bei 4-8 °C.
- Mischen Sie 2 μl t-Butylhydroperoxid mit 2 mL Reinstwasser, um eine 7 mM Lösung herzustellen. Unmittelbar vor Gebrauch mischen.
- Mischen Sie 1 g Rinderserumalbumin (BSA) mit 1 ml Reinstwasser, um eine Stammlösung von 1 μg/μl herzustellen.
- Thiobarbitursäure-reaktive Substanzen (TBARS) (Lipidperoxidation, LPO)17
- Geben Sie 5 μl Gewebeüberstand in ein 1 ml-Mikroröhrchen. 45 μl 50 mM PBS (frische und Stammlösung) zugeben.
- Fügen Sie 12,5 μl 8,1 % SDS (frisch zubereitet) hinzu. 93,5 μl 20 % TCA pH 3,5 (frisch zubereitet) hinzufügen.
- 93,5 μl 1 % TBA (frisch zubereitet) zugeben. Vervollständigen Sie das Volumen durch Zugabe von 50,5 μl Reinstwasser. Schließen Sie den Deckel der Tube und wirbeln Sie sie 30 s lang ein.
- Den Deckel des Mikroröhrchens mit einer Nadel durchstechen und 10 Minuten in kochendem Wasser inkubieren.
- Kühlen Sie das Röhrchen bei Raumtemperatur (RT) ab und zentrifugieren Sie es dann bei 1000 x g für 10 min.
- Geben Sie 150 μl Überstand in eine Vertiefung in einer 96-Well-Mikroplatte und messen Sie die Absorption bei 530 nm mit einem Mikroplatten-Spektralphotometer.
- Zur Quantifizierung von Lipidperoxiden erstellen Sie eine 8-Punkt-TBARS-Kalibrierkurve (0-160 μM) unter Verwendung von Malondialdehyd bis (Dimethylacetal), wie in Tabelle 1 beschrieben. Passen Sie die Malondialdehyd (MDA)-Kurve je nach Gewebetyp oder vermutetem Schadensgrad an.
- Geben Sie die Ergebnisse als nmol MDA eq·mg−1 Protein an.
- Superoxiddismutase Antioxidans-Enzym-Mikroassay (SOD)18
- Verwenden Sie eine 96-Well-Platte. 147 μl 1 M TRIS/5 mM HCl EDTA pH 8 in zwei Vertiefungen als Blindproben geben. 144 μl 1 M TRIS/5 mM HCl EDTA pH 8 durch Duplizieren in andere Vertiefungen geben.
- Entnehmen Sie 3 μl aus dem Überstand und geben Sie es in die Probenvertiefungen. Mischen Sie den Inhalt auf dem Teller mehrmals vorsichtig an.
- Geben Sie innerhalb von 30 s 3 μl 10 mM Pyrogallsäure in jede Vertiefung. Sofort vorsichtig mischen.
- Die Extinktion wird bei T0 (Zeit = 0 s) und T10 (Zeit = 10 s), bei 420 nm und 25 °C gemessen.
- Bestimmen Sie die SOD, indem Sie den Prozentsatz der Pyrogallol-Hemmung in der Probe unter Verwendung der folgenden Gleichung berechnen:
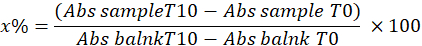
Wo
x% = prozentualer Anteil der Oxidation von Pyrogallol durch SOD in der Probe; Daher beträgt die Oxidation von Pyrogallol 100 - x%
HINWEIS: Die Berechnung der SOD-Aktivität unter Berücksichtigung von 1 IE ist das Volumen, das 50 % der Pyrogalloloxidation hemmt, wie unten beschrieben:
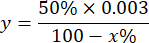
Wo
y = Probenvolumen auf Milliliter (hemmt 50% der PyroGallone)
50% = Prozentsatz der Hemmung von Pyrogallol entspricht 1 HE SOD
0,003 = Volumen in Milliliter der Probe
100 - x% = Hemmung von Pyrogallol in Prozent durch die Probe - Bestimmen Sie abschließend die SOD-Aktivität mit der Gleichung:
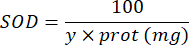
SOD = Aktivität von SOD in internationalen Einheiten pro Mikrogramm Protein
Y = Probenvolumen, das 50 % des Pyrogallols hemmt
100 = Umrechnungsfaktor von Deziliter zu Milliliter.
Protein = die Proteinkonzentration, die sich aus der Bradford-Quantifizierung ergibt, wird in Mikrogramm pro Milliliter ausgedrückt; Es ist notwendig, durch 10 zu dividieren, um in Gramm pro Deziliter umzurechnen
- Katalase-Antioxidans-Enzym-Mikroassay (CAT)19,20
- Verwenden Sie eine 96-Well-Mikrotiterplatte. 20 μl Probenüberstand in die Vertiefungen geben (durch Duplikat).
- Geben Sie standardmäßig 20 μl frische Katalase (200 μg/ml) in die Vertiefungen (durch Duplikat). Geben Sie 100 μl 50 mM PBS pH 7,8 in die Probe und verschließen Sie die Vertiefungen.
- Geben Sie 100 μl 90 mM (30%) H2O2 in die Vertiefungen, um die Reaktion zu starten. Nach Zugabe von H2O2 die Absorption alle 15 s für 2,5 min bei 240 nm ablesen.
- Berechnen Sie die Aktivität anhand der Gleichung:

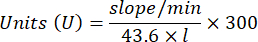
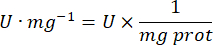
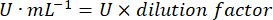
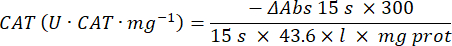
- Glutathionperoxidase-Enzym-Mikroassay (GPx)21
- Verwenden Sie eine 96-Well-Mikrotiterplatte.
- Mischen Sie 240 μl 0,1 M GSH-Lösung, 1 200 μl 10 μl GSH-Rd-Lösung und 1 200 μl 4 mM NADPH. Bewahren Sie die Lösung auf Eis auf.
- 100 μl 50 mM TRIS/HCl 5 mM EDTA pH 7,6 in die Vertiefungen geben. 1 μl der überstehenden Probe in zweifacher Ausführung zugeben. Klopfen Sie auf die Mikroplatte und mischen Sie vorsichtig.
- 50 μl der Mischlösung (Schritt 4.5.2) zugeben und vorsichtig mischen.
- Geben Sie 20 μl der 7 mM t-Butylhydroperoxidlösung in die Vertiefungen, um die Reaktion zu starten (es dauert etwa 15 s, um die Reaktion in 16 duplizierten Proben zu starten). Mischen Sie die Mikroplatte schnell.
- Überwachen Sie die Absorption in einem Intervall von 1 Minute für 5 Minuten bei 25 °C bei 340 nm.
- Berechnen Sie die GPx-Aktivität mit der Gleichung:
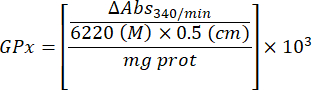
Wo
GPx = Aktivität in Millimolar pro Minute pro Mikrogramm Protein
ΔAbs340/min= Mittlere Extinktion in Delta
103 = Umwandlung von molaren in millimolare
- mg prot = Proteinkonzentration aus der Bradford-Bestimmung, ausgedrückt in Mikrogramm pro Mikroliter
- Proteinquantifizierung durch Bradford-Analyse22
- Es wird eine Standardkurve aus Rinderserumalbuminlösungen (BSA) durchgeführt, die aus Stammlösung von 1 μg/μl eingestellt wird, wie in Tabelle 2 dargestellt.
- Verwenden Sie eine 96-Well-Mikrotiterplatte. Geben Sie 190 μl Bradford-Reagenz in die Probe und die Standard-Wells.
- Fügen Sie 10 μl BSA in Standard-Wells durch Duplizieren hinzu. 10 μl Überstand durch Duplizieren in die Probenvertiefungen geben.
- Vorsichtig mit der Pipettenspitze mischen.
- Extinktion bei 595 nm ablesen. Quantifizieren Sie die Proteinkonzentration mit der Standardkurve.
Ergebnisse
Die Ergebnisse der Studie zeigen, dass Schwermetalle, insbesondere Aluminium (Al), Eisen (Fe) und Zink (Zn), schädliche Auswirkungen auf die Umwelt haben, wie Abbildung 2 zeigt. Der Nachweis hoher Schwermetallgehalte sowohl in Gewebe- als auch in Wasserproben, die an allen Stellen entnommen wurden, hat zu einem ungünstigen Ergebnis geführt. Es wurden Ausreißer mit einem Bioakkumulationsfaktor (BAF) von 600 festgestellt, insbesondere in bergbauintensiven ...
Diskussion
Obwohl die Verwendung von C. texanus für die Bewertung optimal ist, ist es notwendig, mehrere Aspekte seiner Verwendung und Sammlung zu berücksichtigen. Die ausgewählten Untersuchungsstandorte erweisen sich aufgrund mehrerer Faktoren wie ungünstigen Wetterbedingungen, geografischer Unzugänglichkeit, hoher Trockenheit oder unzureichender Sicherheitsprotokolle in ausgewählten Regionen als schwierig. Angegebene Einschränkungen und Einschränkungen können bei der Durchführu...
Offenlegungen
Die Autoren legten keine Interessenkonflikte offen, die in ihrer Arbeit vorhanden waren.
Danksagungen
Die Autoren möchten CONAHCyT ihren aufrichtigen Dank für die Bereitstellung des FONINS P 1931-Stipendiums aussprechen, das ihre Forschungsbemühungen erheblich erleichtert hat. Sie danken auch der Secretaría de Investigación y Posgrado am Instituto Politécnico Nacional für die unschätzbare Unterstützung, die sie durch den SIP-Projektzuschuss (20200577) geleistet hat. Darüber hinaus möchte der Erstautor das großzügige Postgraduiertenstipendium von CONAHCyT würdigen, das es dem Team ermöglichte, Exkursionen durchzuführen und wichtige Daten zu sammeln. Abschließend möchten die Autoren ihre Wertschätzung für die unschätzbare Hilfe von María Teresa García Camacho im Labor zum Ausdruck bringen, ohne die dieses Projekt nicht möglich gewesen wäre.
Materialien
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Referenzen
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten