Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Hellgrammite en tant que biomoniteur non conventionnel pour l’évaluation de la santé des eaux de surface et de l’environnement
Dans cet article
Résumé
Ce protocole décrit l’utilisation de biomarqueurs pour la détection précoce des impacts délétères dans les écosystèmes aquatiques. Les biomarqueurs sont étroitement liés aux traits sentinelles, et leurs changements aident à détecter les dommages d’alerte précoce.
Résumé
Les larves de dobsonflies du genre Corydalus, communément appelées Hellgrammites, se caractérisent par leur taille remarquable, leur vaste aire d’occurrence et leur longue période d’immaturité, qui peut durer jusqu’à un an. Les Hellgrammites sont clairement connus pour montrer une sensibilité à la pollution et aux impacts sur la structure de l’habitat. Compte tenu de ces caractéristiques uniques, l’utilisation de larves de Corydalus texanus est tout à fait appropriée comme agents de biosurveillance fiables pour évaluer l’intégrité écologique des écosystèmes aquatiques. Ce protocole vise à fournir les outils nécessaires à l’évaluation de C. texanus et à démontrer son efficacité à travers une étude de cas. Les résultats de la recherche ont des implications pratiques, indiquant que les larves de C. texanus présentent des réponses d’alerte précoce à la pollution minière, bioaccumulant de grandes quantités de métaux lourds tels que le Zn, le Fe et l’Al. La présence ou l’absence de populations de C. texanus peut servir d’indicateur utile pour cerner les problèmes potentiels liés à la santé de l’écosystème. L’approche non conventionnelle a permis de mettre en évidence des signes précoces de pollution dans les sites miniers, soulignant la nécessité d’agir rapidement pour protéger l’environnement. Compte tenu de leurs caractéristiques uniques, l’utilisation des larves de C. texanus est fortement suggérée comme bioindicateur non conventionnel fiable.
Introduction
Les Hellgramites sont des larves d’insectes de l’ordre des mégaloptères (Latreille, 1802), appelées dobsonflies ou mouches à poisson au stade adulte. Une faible diversité mais répandue caractérise ce groupe de larves d’insectes prédateurs supérieurs des écosystèmes aquatiques1. Les espèces de Hellgramite se trouvent dans des régions biogéographiques bien définies ; Par conséquent, il est relativement facile d’identifier des espèces sans une connaissance taxonomique élevée. Notamment, les larves de Corydalidae possèdent l’espèce la plus importante de l’ordre des mégaloptères (longueur du corps de 20 à 90 mm)2, ce qui rend l’hellgramite visible à l’œil nu.
Les Hellgrammites jouent un rôle crucial dans les écosystèmes aquatiques en tant que prédateurs, avec une présence puissante en raison de grandes mastications dénotant leur impressionnante forme prédatrice. Un corps aplati dorso-ventralement se joint également à 7-8 paires de branchies filamentaires le long du corps, et une capsule cintemporale avec six stemmata par côté fait des hellgrammites des organismes fascinants pour les entomologistes et les fans3. Les adultes de Corydalidae surprennent et créent une image d’impression aux gens en raison de leur taille proéminente ; Cependant, ils sont totalement inoffensifs. Il est à noter que les hellgrammites ont la capacité de persister dans les milieux aquatiques à leur stade larvaire pendant une durée significative.
Les caractéristiques phénotypiques des hellgrammites permettent de mettre en évidence leur rôle dans les écosystèmes aquatiques ; Néanmoins, leur potentiel indicateur est la caractéristique la plus recherchée par les écologistes aquatiques. Une vaste connaissance de leur potentiel bioindicateur est mise en évidence dans les écosystèmes aquatiques car leur présence est liée à de bonnes conditions de santé dans leurs habitats en raison de leur intolérance à la pollution organique dans les eaux de surface 4,5,6,7,8.
La plupart des Corydalidae megalopterans vivent dans des eaux courantes à grande vitesse sous forme de rapides et de substrats prédominés par des galets et des cailloux, mais les hellgrammites se trouvent également dans les cours d’eau à faible pente avec des chicots et des substrats sablonneux, ainsi que dans des habitats lentiques tels que les lacs 3,9,10. Leur large éventail d’occurrences reflète les caractéristiques essentielles d’un prédateur de niveau supérieur et leur capacité à coloniser plusieurs habitats visés par leurs stratégies efficaces de cycle biologique11. Les Hellgramites ont lié leurs traits à la dynamique des écosystèmes aquatiques ; ainsi, des stratégies telles que l’adaptation à la respiration aérienne par les spiracles (en plus de leurs touffes ventrales de branchies trachéales) sont propres aux stratégies des Corydalidae10.
Les Hellgrammites habitent des écosystèmes particuliers et réagissent rapidement aux écarts par rapport aux modèles établis, servant ainsi de système d’alerte précoce7. Les réactions de ces organismes sauvages peuvent être utilisées comme un outil précieux pour évaluer l’impact de la pollution sur les écosystèmes aquatiques, en particulier dans le cas de mélanges de polluants non ciblés. Certains effets délétères sur les organismes vivants ont été reconnus dans les écosystèmes en raison de la toxicité individuelle des produits chimiques, mais l’effet des mélanges de polluants doit être identifié. Les réponses d’alerte précoce des hellgrammites peuvent permettre d’identifier des effets délétères en faisant référence aux impacts d’un mélange de polluants ou encore lorsque les effets individuels des polluants reconnaissent une concentration sans effet observable (CSEO)12.
Plusieurs organismes modèles ont été utilisés pour des essais expérimentaux aigus et chroniques ; Cependant, ils sont cultivés et maintenus dans des conditions contrôlées13. Les conditions contrôlées les rendent incapables d’identifier les effets non cibles de plusieurs polluants auxquels ils sont exposés. De plus, la CSEO est souvent reconnue en raison de la complexité du mélange du polluant. C’est pourquoi, au cours des dernières décennies, des espèces indigènes non modèles ayant des effets non ciblés ont été reconnues pour le dépistage des systèmes, qui sont essentiels à la réalisation de recherches écotoxicologiques14. Par conséquent, les hellgrammites semblent capables d’évaluer les effets délétères de la pollution dans les écosystèmes aquatiques. Des traits tels que leur biologie, leur génétique et leur physiologie, entre autres, rendent les organismes non modèles adaptés à l’évaluation de l’impact dans les écosystèmes14.
Ce protocole vise à mettre en place un nouvel outil de biosurveillance utilisant un organisme non modèle capable de détecter des signaux d’alerte précoce en réponse à des mélanges de pollution non ciblés. Pour obtenir les meilleurs résultats, les caractéristiques présentées par les larves de l’espèce modèle, C. texanus, ont été examinées de manière exhaustive et intégrées dans l’analyse15.
Protocole
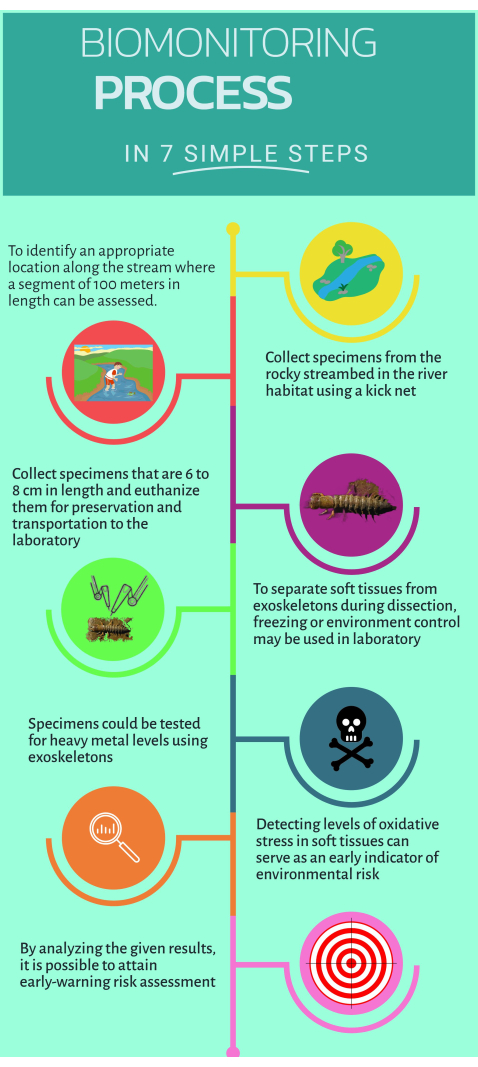
Figure 1 : Guide rapide étape par étape sur la façon d’utiliser le biomoniteur non conventionnel Corydalus texanus pour la mise en œuvre dans les écosystèmes aquatiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Travail sur le terrain
- Identifier les sites d’étude situés en amont et en aval de la source de pollution où les impacts soupçonnés ou évidents sont reconnus (c.-à-d. émissions ponctuelles ou diffuses).
REMARQUE : Le protocole actuel comprenait 15 sites d’étude dans quatre rivières principales : 1) la rivière Extoraz (sites PB, EZ, RQ, BC) ; 2) Rivière Escanela-Jalpan (ES, EN, AH, JL, PI, PA) ; 3) Rivière Ayutla (AY) ; et 4) Rivière Santa María (SM, AT). - Rechercher et localiser au moins un site de référence (un lieu sous impacts mineurs ou absence d’impacts) et le définir comme site d’étude.
REMARQUE : Pour les sites d’étude actuels, BC, ES, SM, AY et AT ont été considérés comme des sites de référence. - Reconnaître certaines caractéristiques de l’habitat qui augmentent la probabilité de trouver des individus de C. texanus. Il s’agit notamment d’un substrat de gravier, d’habitats rocheux avec des pentes plus abruptes, d’écoulements à grande vitesse, d’eaux bien oxygénées, d’une forte densité de canopée et d’habitats dans les hautes terres et les basses terres.
- Clôturer un tronçon de 100 m du cours d’eau afin de désigner les habitats appropriés pour la biosurveillance16.
- Entrez dans le ruisseau pour prélever des échantillons.
- Prélever au moins six individus de C. texanus dans des habitats tels que des rapides, des cailloux, des eaux claires et des débris à l’aide d’une épuisette d’un maillage de 500 μm.
- Retirez les roches dans le sens de l’écoulement de l’eau et transférez les larves dans le filet.
- Manipulez l’épuisette avec les larves échantillonnées et transférez-les dans des bouteilles désignées pour un hébergement temporaire. Manipulez le filet avec précaution et repliez les bords vers l’intérieur pour éviter toute perte de larves.
- Mesurer la largeur de la tête des larves échantillonnées à l’aide d’un pied à coulisse pour identifier les stades IX à XI (dans la plage de 6 mm à 10 mm).
- Purgez les larves en les immergeant dans une bouteille contenant de l’eau de ruisseau pendant 30 min.
- Placez les échantillons dans des bouteilles en plastique avec un étiquetage clair, puis euthanasiez-les par immersion dans de l’azote liquide (-75 °C) dans une cuve cryogénique.
- Transportez et stockez les échantillons en toute sécurité à -45 °C dans l’ultra-congélateur du laboratoire.
- À l’aide d’une bouteille en polyéthylène, prélever un échantillon d’eau de ruisseau de 200 ml, ajouter 1 ml d’acide nitrique et conserver l’échantillon à 4 °C pour une quantification ultérieure des métaux lourds en laboratoire.
2. Dissection des larves échantillonnées et séparation des tissus
- Placez le plateau de dissection en plastique sur de la glace et attendez qu’il atteigne 4 °C, à l’aide d’un thermomètre.
- Prélevez des échantillons de l’ultra-congélateur et placez-les sur le plateau de dissection pour commencer la dissection.
- Sélectionnez les tissus cibles : muscle, branches, tube neural et exosquelette.
- Utilisez un couteau en céramique pour retirer la tête et séparez soigneusement les tissus. Ouvrez le corps longitudinalement et retirez les branchies de chaque côté.
- Séparez les exosquelettes à l’aide d’un couteau en céramique plus petit et nettoyez l’excès de tissu. Placez les exosquelettes dans un four et faites-les sécher à 80 °C pendant 48 h.
- Une fois le temps écoulé, conservez les exosquelettes secs pour une analyse plus approfondie.
- Continuez à nettoyer les tissus mous dans des conditions froides pour une analyse plus approfondie par microessais.
- Utilisez un petit couteau en céramique pour extraire les tissus mous de la graisse. Séparez et regroupez chaque tissu cible des individus du même point d’échantillonnage.
- Conservez chaque type de tissu dans un microtube de 2 ml, en maintenant des conditions froides tout au long du processus.
- Pour préparer chaque tissu cible, pesez 100 mg du tissu et ajoutez 1 mL de solution de PBS avec un pH de 7,4. Utilisez un déchireur de tissu à une main pour homogénéiser chaque tissu. En règle générale, les tissus mous nécessitent trois cycles de 10 secondes chacun.
- Centrifuger l’échantillon à 1 000 x g pendant 5 min à 4 °C. Transvasez le surnageant dans un microtube de 1 mL.
- Effectuer des microdosages de biomarqueurs.
3. Quantification des métaux lourds
- Peser 250 mg d’exosquelettes séchés provenant d’au moins six échantillons au stade de développement spécifié à l’aide d’une balance analytique.
- Broyez les exosquelettes dans un mortier en verre jusqu’à ce qu’ils deviennent finement poudreux. Ajouter 250 ml d’acide nitrique ultrapur dans les récipients de réaction de la poudre.
- Pour digérer les échantillons, transférez-les dans un micro-ondes de digestion à 180 °C pendant 30 à 45 min.
REMARQUE : Utilisez le bon récipient allant au micro-ondes pour la marque de micro-ondes pour chauffer les échantillons en toute sécurité et efficacement. Le temps de digestion des échantillons de tissus varie selon la marque du four à micro-ondes, soit de 30 à 45 minutes. Certaines marques proposent des méthodes standardisées. - Effectuer une digestion par micro-ondes pour les échantillons d’eau en suivant la méthode EPA3015A, en utilisant 45 ml de l’échantillon d’eau et en ajoutant 5 ml d’acide nitrique.
- Mesurez les métaux lourds et les métalloïdes dans des échantillons digérés (eau et tissus) à l’aide de la spectroscopie d’émission optique à plasma à couplage inductif (ICP-OES), y compris Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba et As.
REMARQUE : Utilisez de l’argon de grade 5 et des solutions étalons de chaque métal et métalloïde pour construire une courbe d’étalonnage.
4. Microessais pour l’évaluation du stress oxydatif et des biomarqueurs
- Préparation des réactifs
- Mélangez 6 g de NaH2PO4 avec 1000 mL d’eau ultrapure pour obtenir un tampon de phosphate monobasique de 50 mM. Conserver indéfiniment dans un flacon à une température comprise entre 2 et 8 °C.
- Pour obtenir une quantité de 8,1 % de SDS, dissolvez 450 mg de dodécylsulfate de sodium (SDS) dans 5 ml d’eau ultrapure. Préparez juste avant utilisation.
- Diluez 2 ml d’acide trichloroéthanoïque (TCA) dans 8 ml d’eau ultrapure (préparez un réactif frais au besoin).
- Dissoudre 100 mg de tétrabutylammonium (TBA) dans 10 mL d’eau ultrapure (préparer un réactif frais au besoin).
- Pour obtenir un pH de 7,8 à 50 mM de PBS, dissoudre 97 mg de Na2HPO4 et 59 mg de NaH2PO4 dans 10 ml d’eau ultrapure. Ensuite, ajustez le pH à 7,8 en utilisant du NaOH pour augmenter ou du HCl pour diminuer.
- Préparez une solution de 200 μg/mL de catalase bovine en dissolvant 8 mg dans 40 μL d’eau ultrapure (préparez un réactif frais au besoin).
- Pour préparer une solution de 50 mM de TRIS/5 mM d’acide éthylènediaminetétraacétique (EDTA), ajoutez 6,05 g de tris (hydroxyméthyl)aminométhane (TRIS) et 0,073 g d’EDTA à 45 mL d’eau ultrapure. Ajustez le pH à 7,6 avec du HCl et conservez-le à 4 °C jusqu’à utilisation.
- Pour 0,1 M de glutathion réduit (GSH) (pour 45 échantillons dupliqués), peser 0,0184 g de GSH et le dissoudre dans 600 μL de 10 mM de HCl.
- Pour préparer 10 mM de HCl, ajoutez 0,5 μL de HCl concentré à 599,5 μL d’eau ultrapure.
- Ajouter 28,5 μL de glutathion réductase à 1,4 mL de 0,1 M TRIS/HCl 0,5 mM EDTA pH 8,0.
- Mélangez 1,211 g de TRIS et 0,0146 g d’EDTA avec 90 ml d’eau ultrapure pour préparer une solution de TRIS/HCl de 0,1 M et d’EDTA de 0,5 mM à pH 8,0. Ajoutez du HCl pour ajuster le pH si nécessaire. La solution peut être conservée indéfiniment à une température de 2 à 8 °C.
- Poids 0,075 g de NADPH et l’ajouter à 2,25 mL de 1 % de NaHCO3 1 mM EDTA.
- Mélangez 1 g de NaHCO3 et 0,0282 g d’EDTA dans 100 mL d’eau ultrapure pour préparer une solution de NaHCO3 à 1 % et 1 mM d’EDTA. Conservez la solution à une température de 4 à 8 °C pendant une durée indéterminée.
- Mélangez 2 μL d’hydroperoxyde de t-butyle avec 2 mL d’eau ultrapure pour obtenir une solution de 7 mM. Mélanger immédiatement avant utilisation.
- Mélanger 1 g d’albumine sérique bovine (BSA) avec 1 mL d’eau ultrapure pour créer une solution mère de 1 μg/μL.
- Substances réactives à l’acide thiobarbiturique (TBARS) (peroxydation lipidique, LPO)17
- Ajouter 5 μL de surnageant tissulaire dans un microtube de 1 mL. Ajouter 45 μL de 50 mM de PBS (solution fraîche et mère).
- Ajouter 12,5 μL de FDS à 8,1 % (fraîchement préparé). Ajouter 93,5 μL de TCA à 20 % pH 3,5 (fraîchement préparé).
- Ajouter 93,5 μL de 1 % TBA (fraîchement préparé). Complétez le volume en ajoutant 50,5 μL d’eau ultrapure. Fermez le couvercle du tube et agitez-le pendant 30 s.
- Percez le couvercle du microtube avec une aiguille et incubez dans de l’eau bouillante pendant 10 min.
- Refroidissez le tube à température ambiante (RT), puis centrifugez-le à 1000 x g pendant 10 min.
- Ajouter 150 μL de surnageant dans un puits dans une microplaque de 96 puits et mesurer l’absorbance à 530 nm à l’aide d’un spectrophotomètre de microplaques.
- Pour quantifier les peroxydes lipidiques, créez une courbe d’étalonnage TBARS à 8 points (0-160 μM) à l’aide du malondialdéhyde bis (diméthylacétal) comme décrit dans le tableau 1. Ajustez la courbe du malondialdéhyde (MDA) en fonction du type de tissu ou du niveau de dommage suspecté.
- Exprimer les résultats sous forme de protéine nmol MDA eq·mg−1 .
- Microdosage de l’enzyme antioxydante de la superoxyde dismutase (SOD)18
- Utilisez une plaque à 96 puits. Ajouter 147 μL de 1 M TRIS/5 mM HCl EDTA pH 8 dans deux puits sous forme de blancs. Ajouter 144 μL de 1 M TRIS/5 mM HCl EDTA pH 8 dans d’autres puits en dupliquant.
- Prélever 3 μL du surnageant et l’ajouter dans les puits d’échantillonnage. Mélangez délicatement le contenu sur l’assiette à plusieurs reprises.
- Ajouter 3 μL d’acide pyrogallique 10 mM dans chaque puits dans un délai de 30 s. Mélangez doucement et immédiatement.
- Mesurez l’absorbance à T0 (temps = 0 s) et T10 (temps = 10 s), à 420 nm et 25 °C.
- Déterminer la SOD en calculant le pourcentage d’inhibition du pyrogall dans l’échantillon à l’aide de l’équation suivante :
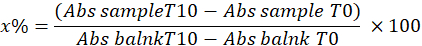
Où
x % = pourcentage d’oxydation du pyrogallol par la SOD dans l’échantillon ; Par conséquent, l’oxydation du pyrogallol est égale à 100 - x %
REMARQUE : Calcul de l’activité SOD en considérant que 1 UI est le volume qui inhibe 50 % de l’oxydation du pyrogallol, comme décrit ci-dessous :
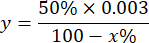
Où
Y = volume de l’échantillon au millilitre (inhibe 50 % du pyrogallon)
50 % = le pourcentage d’inhibition du pyrogallol est égal à 1U de SOD
0,003 = volume en millilitres de l’échantillon
100 - x % = inhibition du pyrogallol en pourcentage par l’échantillon - Enfin, déterminez l’activité SOD avec l’équation :
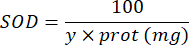
SOD = activité de la SOD en unités internationales par microgramme de protéine
Y = volume de l’échantillon qui inhibe 50 % du pyrogall
100 = facteur de conversion du décilitre en millilitre.
protéine = la concentration en protéines obtenue à partir de la quantification de Bradford est exprimée en microgrammes par millilitre ; Il est nécessaire de diviser par 10 pour convertir en grammes par décilitre
- Microdosage de l’enzyme antioxydante catalase (CAT)19,20
- Utilisez une microplaque à 96 puits. Ajouter 20 μL de surnageant d’échantillon dans les puits (par duplicata).
- Ajouter 20 μL de catalase fraîche (200 μg/mL) dans les puits en standard (par duplicata). Ajouter 100 μL de 50 mM de PBS pH 7,8 à l’échantillon et boucher les puits.
- Ajouter 100 μL de 90 mM (30 %) de H2O2 dans des puits pour démarrer la réaction. Après avoir ajouté H2O2, lire l’absorbance toutes les 15 s pendant 2,5 min à 240 nm.
- Calculez l’activité à l’aide de l’équation :

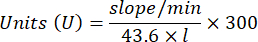
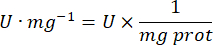
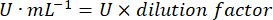
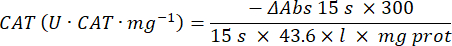
- Microdosage de l’enzyme glutathion peroxydase (GPx)21
- Utilisez une microplaque à 96 puits.
- Mélanger 240 μL de solution de GSH 0,1 M, 1 200 μL de solution de GSH-Rd 10 U/mL et 1 200 μL de NADPH 4 mM. Gardez la solution sur de la glace.
- Ajouter dans les puits 100 μL de 50 mM TRIS/HCl 5 mM EDTA pH 7,6. Ajouter 1 μL d’échantillon surnageant en double. Tapotez la microplaque et mélangez délicatement.
- Ajouter 50 μL de la solution de mélange (étape 4.5.2) et mélanger délicatement.
- Ajouter 20 μL de la solution d’hydroperoxyde de t-butyle de 7 mM dans des puits pour démarrer la réaction (il faut environ 15 s pour démarrer la réaction dans 16 échantillons dupliqués). Mélangez rapidement la microplaque.
- Surveiller l’absorbance toutes les 1 min pendant 5 min à 25 °C à 340 nm.
- Calculez l’activité GPx avec l’équation :
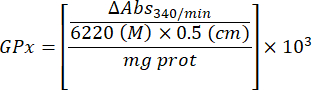
Où
GPx = activité en millimolaires par minute par microgramme de protéine
ΔAbs340/min = Absorbance moyenne en delta
103 = conversion molaire en millimolaire
- mg prot = concentration en protéines d’après la détermination de Bradford, exprimée en microgrammes par microlitre
- Quantification des protéines par l’analyse de Bradford22
- Effectuer une courbe standard à partir de solutions d’albumine sérique bovine (BSA), réglée à partir d’une solution mère de 1 μg/μL, comme indiqué dans le tableau 2.
- Utilisez une microplaque à 96 puits. Ajouter 190 μL de réactif de Bradford dans l’échantillon et les puits standard.
- Ajouter 10 μL de BSA dans les puits standards en double. Ajouter 10 μL de surnageant dans les puits d’échantillonnage par duplicata.
- Mélangez doucement avec la pointe de la pipette.
- Absorbance de lecture à 595 nm. Quantifiez la concentration en protéines à l’aide de la courbe standard.
Résultats
Les résultats de l’étude révèlent que les métaux lourds, en particulier l’aluminium (Al), le fer (Fe) et le zinc (Zn), ont un impact néfaste sur l’environnement, comme en témoigne la figure 2. La détection de niveaux élevés de métaux lourds dans les échantillons de tissus et d’eau prélevés sur tous les sites a conduit à un résultat défavorable. Des valeurs aberrantes ont été détectées, avec un facteur de bioaccumulation (FBA) de ...
Discussion
Bien que l’utilisation de C. texanus soit optimale pour l’évaluation, il est nécessaire de tenir compte de plusieurs aspects de son utilisation et de sa collecte. Les sites d’étude choisis s’avèrent difficiles en raison de plusieurs facteurs tels que des conditions météorologiques défavorables, l’inaccessibilité géographique, des niveaux élevés d’aridité ou des protocoles de sécurité insuffisants dans certaines régions. Les contraintes et les limites ?...
Déclarations de divulgation
Les auteurs n’ont révélé aucun conflit d’intérêts présent dans leur travail.
Remerciements
Les auteurs tiennent à exprimer leur sincère gratitude à CONAHCyT pour avoir fourni la subvention FONINS P 1931, qui a grandement facilité leurs efforts de recherche. Ils remercient également le Secretaría de Investigación y Posgrado de l’Instituto Politécnico Nacional pour le soutien inestimable fourni par le biais de la subvention de projet SIP (20200577). De plus, le premier auteur tient à souligner la généreuse bourse d’études supérieures accordée par le CONAHCyT, qui a permis à l’équipe d’effectuer des excursions sur le terrain et de recueillir des données essentielles. Enfin, les auteurs tiennent à exprimer leur gratitude pour l’aide inestimable de María Teresa García Camacho au laboratoire, sans qui ce projet n’aurait pas été possible.
matériels
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Références
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon