A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Hellgrammite כביו-מוניטור לא קונבנציונלי להערכת מים עיליים ובריאות סביבתית
In This Article
Summary
פרוטוקול זה מתאר את השימוש בסמנים ביולוגיים לזיהוי מוקדם של השפעות מזיקות במערכות אקולוגיות ימיות. הסמנים הביולוגיים קשורים קשר הדוק לתכונות הזקיף, והשינויים שלהם מסייעים באיתור נזקים בהתרעה מוקדמת.
Abstract
הזחלים של זבובי הדובסון מהסוג Corydalus, הידוע בכינויו Hellgrammites, מאופיינים בגודלם הבולט, טווח התרחשות נרחב ותקופת בגרות ממושכת, שיכולה להימשך עד שנה. ידוע בבירור כי הלגרמיטים מפגינים רגישות לזיהום ולהשפעות על מבנה בית הגידול. בהתחשב בתכונות ייחודיות אלה, שימוש בזחלי Corydalus texanus מתאים מאוד כסוכני ניטור ביולוגי אמינים להערכת השלמות האקולוגית של מערכות אקולוגיות ימיות. פרוטוקול זה נועד לספק את הכלים הדרושים להערכת C. texanus ולהדגים את יעילותם באמצעות חקר מקרה. לממצאי המחקר יש השלכות מעשיות, המצביעות על כך שזחלי C. texanus מציגים תגובות אזהרה מוקדמות לזיהום כרייה, וצוברים כמויות גבוהות של מתכות כבדות כגון Zn, Fe ו-Al. נוכחותן או היעדרן של אוכלוסיות C. texanus עשויות לשמש אינדיקטור מועיל לזיהוי בעיות פוטנציאליות הקשורות לבריאות המערכת האקולוגית. הגישה הלא קונבנציונלית הראתה אזהרות מוקדמות על זיהום באתרים המושפעים מכרייה, והדגישה את הצורך בפעולה בזמן כדי להגן על הסביבה. בהתחשב בתכונותיהם הייחודיות, השימוש בזחלי C. texanus מומלץ מאוד כאינדיקטור ביולוגי אמין ולא קונבנציונלי.
Introduction
Hellgramites הם זחלי חרקים מסדרה Megaloptera (Latreille, 1802), הנקראים זבובי דובסון או זבובי דגים בשלב הבוגר שלהם. מגוון נמוך אך נרחב מאפיין קבוצה זו של זחלי חרקים טורפים מובילים ממערכות אקולוגיות מימיות1. מיני הלגרמיט מופיעים באזורים ביוגיאוגרפיים מוגדרים היטב; לכן, קל יחסית לזהות מינים ללא ידע טקסונומי גבוה. יש לציין כי זחלי ה-Corydalidae מכילים את המינים הבולטים ביותר מסדרת Megaloptera (אורך גוף של 20-90 מ"מ)2, מה שהופך את הלגרמיט לגלוי לעין בלתי.
הלגרמיטים ממלאים תפקיד מכריע במערכות אקולוגיות מימיות כטורפים, עם נוכחות עוצמתית בשל לעיסות גדולות המציינות את צורתם הטורפת המרשימה. גוף שטוח גב-וונטרלי מצטרף גם הוא ל-7-8 זוגות של זימים נימה לאורך הגוף, וקפסולת ראש עם שש סטמטות בכל צד הופכת את הלגרמיטים לאורגניזמים מרתקים עבור אנטומולוגים ומעריצים3. בוגרים של Corydalidae מפתיעים ויוצרים תמונת רושם לאנשים בשל גודלם הבולט; עם זאת, הם אינם מזיקים לחלוטין. ראוי לציין כי לגרמיטים יש את היכולת לשרוד בסביבות מימיות בשלב הזחל שלהם למשך זמן משמעותי.
המאפיינים הפנוטיפיים של הלגרמיטים מאפשרים הזדמנות מיוחדת להדגיש את תפקידם במערכות אקולוגיות ימיות; עם זאת, פוטנציאל האינדיקטור שלהם הוא התכונה המבוקשת ביותר עבור אקולוגים מימיים. ידע נרחב על הפוטנציאל הביולוגי שלהם מודגש במערכות אקולוגיות מימיות מכיוון שהתרחשותם מתייחסת לתנאי בריאות טובים בבתי הגידול שלהם עקב חוסר הסובלנות שלהם לזיהום אורגני במים עיליים 4,5,6,7,8.
רוב המגלופטרנים של Corydalidae חיים במים זורמים במהירות גבוהה כסלעים ומצעים הנשלטים על ידי חלוקי נחל וחלוקי נחל, אך הלגרמיטים מופיעים גם בנחלים בעלי שיפוע נמוך עם מכשולים ומצעי חול, כמו גם בבתי גידול לנטיים כמו אגמים 3,9,10. טווח ההופעות הרחב שלהם משקף את התכונות הקריטיות של טורף מוביל ואת יכולתם ליישב מספר בתי גידול המכוונים על ידי אסטרטגיות תולדות החיים היעילות שלהם11. הלגרמיט קישרו את תכונותיהם לדינמיקה של מערכות אקולוגיות ימיות; לפיכך, אסטרטגיות כגון הסתגלות לנשימה אווירית על ידי ספירקלים (בנוסף לציציות הגחון של זימי קנה הנשימה) מתאימות לאסטרטגיות Corydalidae10.
הלגרמיטים מאכלסים מערכות אקולוגיות מסוימות ומציגים תגובות מהירות לסטיות מדפוסים קבועים, ובכך משמשים כמערכת אזהרה מוקדמת7. ניתן להשתמש בתגובות של אורגניזמים אלה של חיות בר ככלי רב ערך להערכת השפעת הזיהום על מערכות אקולוגיות ימיות, במיוחד במקרה של תערובות מזהמים שאינן מטרה. כמה השפעות מזיקות על אורגניזמים חיים הוכרו במערכות אקולוגיות בגלל רעילות אינדיבידואלית של כימיקלים, אך יש לזהות את ההשפעה של תערובות מזהמים. תגובות האזהרה המוקדמות של הלגרמיטים עשויות לאפשר לזהות השפעות מזיקות על ידי מתן התייחסות להשפעות של תערובת של מזהמים או אפילו כאשר השפעות בודדות של מזהמים מכירות בריכוז אפקט ללא נצפים (NOEC)12.
מספר אורגניזמים מודלים שימשו לניסויים אקוטיים וכרוניים; עם זאת, הם מתורבתים ומתוחזקים בתנאים מבוקרים13. תנאים מבוקרים גורמים להם לא לזהות את ההשפעות הלא-ממוקדות של מספר מזהמים שהם נחשפים אליהם. כמו כן, NOEC מוכר לעתים קרובות בשל מורכבות תערובת המזהם. מסיבה זו, בעשורים האחרונים, מינים מקומיים שאינם מודלים עם השפעות שאינן מטרה זוהו למערכות סינון, החיוניות לביצוע מחקר אקוטוקסיקולוגי14. כתוצאה מכך, נראה כי הלגרמיטים מסוגלים להעריך את ההשפעות המזיקות של זיהום במערכות אקולוגיות ימיות. תכונות כמו הביולוגיה, הגנטיקה והפיזיולוגיה שלהם, בין היתר, הופכות אורגניזמים שאינם מודלים למתאימים להערכת השפעה על מערכות אקולוגיות14.
פרוטוקול זה נועד להקים כלי ניטור ביולוגי חדשני באמצעות אורגניזם שאינו מודל שיכול לזהות אותות אזהרה מוקדמים בתגובה לתערובות זיהום שאינן מטרה. כדי להשיג את התוצאות הטובות ביותר, התכונות שהפגינו הזחלים של מין המודל, C. texanus, נלקחו בחשבון באופן מקיף ושולבו בניתוח15.
Protocol
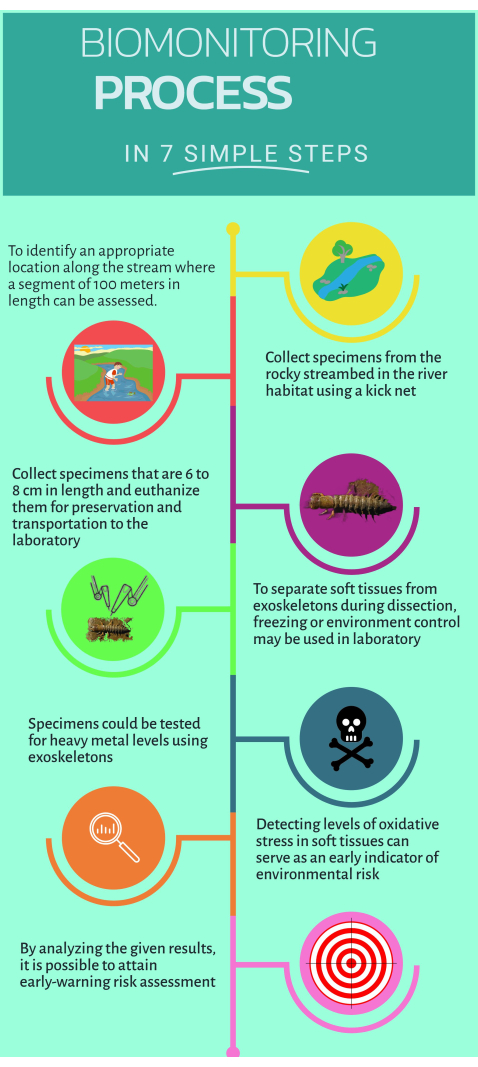
איור 1: מדריך מהיר צעד-אחר-צעד כיצד להשתמש במוניטור הביולוגי הלא-קונבנציונלי Corydalus texanus עבור יישום במערכות אקולוגיות ימיות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של איור זה.
1. עבודת שטח
- זהה אתרי מחקר הממוקמים במעלה הזרם ובמורד הזרם של מקור הזיהום שבהם מזוהות השפעות חשודות או ניכרות (כלומר, פליטות דייקניות או מפוזרות).
הערה: הפרוטוקול הנוכחי כלל 15 אתרי מחקר בארבעה נהרות עיקריים: 1) נהר אקסטורז (אתרים PB, EZ, RQ, BC); 2) נהר אסקנלה-ג'לפן (ES, EN, AH, JL, PI, PA); 3) נהר איוטלה (AY); ו-4) נהר סנטה מריה (SM, AT). - לחפש ולאתר לפחות אתר ייחוס אחד (מקום תחת פגיעות קלות או ללא פגיעות) ולהגדיר אותו כאתר מחקר.
הערה: עבור אתרי המחקר הנוכחיים BC, ES, SM, AY ו-AT נחשבו כאתרי ייחוס. - לזהות תכונות מסוימות של בתי גידול המגדילים את הסבירות למצוא פרטים של C. texanus. אלה כוללים מצע חצץ, בתי גידול סלעיים עם שיפועים תלולים יותר, זרימות במהירות גבוהה, מים מחומצנים היטב, צפיפות חופה גבוהה ובתי גידול ברמות ובשפלה.
- הקיפו קטע של 100 מ' מהנחל כדי לזהות בתי גידול מתאימים לניטור ביולוגי16.
- היכנס לתוך הנחל כדי לאסוף דגימות.
- דגמו לפחות שישה פרטים של C. texanus בבתי גידול כגון ריפלים, חלוקי נחל, מים צלולים ופסולת באמצעות רשת בגודל רשת של 500 מיקרומטר.
- הסר סלעים לכיוון זרימת המים והעביר את הזחלים לרשת.
- טפל ברשת הבעיטה עם זחלים שנדגמו והעביר אותם לבקבוקים ייעודיים לדיור זמני. טפל ברשת בזהירות וקפל את הקצוות לכיוון הפנים כדי למנוע אובדן זחלים.
- מדוד את רוחב הראש של זחלים שנדגמו באמצעות קליפר לזיהוי כוכבי IX עד XI (בטווח של 6 מ"מ עד 10 מ"מ).
- טהר זחלים על ידי טבילתם בבקבוק המכיל מי נחל למשך 30 דקות.
- מניחים דגימות בבקבוקי פלסטיק עם תיוג ברור ולאחר מכן ממתים אותן על ידי טבילה בחנקן נוזלי (-75 מעלות צלזיוס) במיכל קריוגני.
- הובלה ואחסון מאובטח של הדגימות בטמפרטורה של -45 מעלות צלזיוס במקפיא האולטרה במעבדה.
- בעזרת בקבוק פוליאתילן, קח דגימת מי נחל של 200 מ"ל, הוסף 1 מ"ל של חומצה חנקתית ואחסן את הדגימה ב-4 מעלות צלזיוס לכימות מתכות כבדות לאחר מכן במעבדה.
2. דיסקציה של הזחלים שנדגמו והפרדת רקמות
- הניחו את מגש חיתוך הפלסטיק על קרח והמתינו עד שהוא יגיע ל-4 מעלות צלזיוס, בעזרת מדחום לבדיקה.
- קח דגימות מהמקפיא האולטרה-מקפיא והניח אותן על מגש החיתוך כדי להתחיל לנתח.
- בחר רקמות מטרה: שריר, ענפים, צינור עצבי ושלד חיצוני.
- השתמש בסכין קרמיקה כדי להסיר את הראש ולהפריד את הטישו בזהירות. פתח את הגוף לאורך והסר את הזימים מכל צד.
- הפרד את השלדים החיצוניים באמצעות סכין קרמיקה קטנה יותר ונקה את עודפי הרקמה. מכניסים את השלדים החיצוניים לתנור ומייבשים אותם בחום של 80 מעלות למשך 48 שעות.
- לאחר הזמן, אחסן שלדים חיצוניים יבשים להמשך ניתוח.
- המשך לנקות רקמות רכות בתנאים קרים לניתוח נוסף על ידי מיקרו-מבחנים.
- השתמש בסכין קרמיקה קטנה כדי לחלץ רקמות רכות משומן. הפרד ואגד כל רקמת מטרה מאנשים מאותה נקודת דגימה.
- אחסן כל סוג רקמה במיקרו-שפופרת של 2 מ"ל, תוך שמירה על תנאי קור לאורך כל התהליך.
- להכנת כל רקמת מטרה, שקלו 100 מ"ג מהרקמה והוסיפו 1 מ"ל של תמיסת PBS עם pH של 7.4. השתמש בקרע רקמה ביד אחת כדי להומוגניזציה של כל רקמה. בדרך כלל, רקמות רכות דורשות שלושה מחזורים של 10 שניות כל אחד.
- דגימת צנטריפוגה ב-1,000 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. העבירו את הסופרנטנט למיקרו-צינור של 1 מ"ל.
- בצע בדיקות מיקרו-סמנים ביולוגיים.
3. כימות מתכות כבדות
- שקלו 250 מ"ג שלדים חיצוניים מיובשים משש דגימות לפחות בשלב ההתפתחותי שצוין באמצעות איזון אנליטי.
- טוחנים שלדים חיצוניים במכתש זכוכית עד שהם הופכים לאבקה דקה. הוסף 250 מ"ל של חומצה חנקתית טהורה במיוחד לכלי תגובת האבקה.
- כדי לעכל את הדגימות, העבירו אותן למיקרוגל לעיכול בטמפרטורה של 180 מעלות צלזיוס למשך 30-45 דקות.
הערה: השתמש במיכל המתאים למיקרוגל עבור מותג המיקרוגל כדי לחמם דגימות בצורה בטוחה ויעילה. זמן העיכול של דגימות רקמה משתנה בהתאם למותג המיקרוגל, ולוקח 30-45 דקות. מותגים מסוימים מציעים שיטות סטנדרטיות. - בצע שיטת עיכול מיקרוגל לדגימות מים בשיטת EPA3015A, תוך שימוש ב-45 מ"ל מדגימת המים והוספת 5 מ"ל חומצה חנקתית.
- מדוד מתכות כבדות ומתכות בדגימות מעוכלות (מים ורקמות) באמצעות ספקטרוסקופיה של פליטה אופטית של פלזמה בצימוד אינדוקטיבי (ICP-OES), כולל Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba ו-As.
הערה: השתמש בארגון דרגה 5 ובתמיסות סטנדרטיות של כל מתכת ומתכת כדי לבנות עקומת כיול.
4. מיקרו-מבחנים להערכת מתח חמצוני וסמנים ביולוגיים
- הכנת ריאגנטים
- מערבבים 6 גרם NaH2PO4 עם 1000 מ"ל מים טהורים במיוחד ליצירת מאגר פוספט מונו-בסיסי של 50 מ"מ. יש לאחסן בבקבוק בטמפרטורה של 2-8 מעלות צלזיוס ללא הגבלת זמן.
- כדי לייצר 8.1% SDS, יש להמיס 450 מ"ג נתרן דודציל סולפט (SDS) ב-5 מ"ל מים טהורים במיוחד. הכן ממש לפני השימוש.
- לדלל 2 מ"ל של חומצה טריכלורו-אתנואית (TCA) ב-8 מ"ל מים טהורים במיוחד (הכינו מגיב טרי בעת הצורך).
- ממיסים 100 מ"ג טטרה-בוטילאמוניום (TBA) ב-10 מ"ל מים טהורים במיוחד (הכינו מגיב טרי בעת הצורך).
- כדי לייצר 50 מ"מ PBS pH 7.8, יש להמיס 97 מ"ג של Na2HPO4 ו-59 מ"ג של NaH2PO4 ב-10 מ"ל מים טהורים במיוחד. לאחר מכן, התאם את ה-pH ל-7.8 באמצעות NaOH כדי להגדיל או HCl כדי לרדת.
- הכינו תמיסה של 200 מיקרוגרם/מ"ל של קטלאז בקר על ידי המסת 8 מ"ג ממנו ב-40 מיקרוליטר מים טהורים במיוחד (הכינו מגיב טרי בעת הצורך).
- כדי להכין תמיסת 50 מ"מ TRIS/5 מ"מ חומצה אתילנדיאמינטטראצטית (EDTA), הוסף 6.05 גרם טריס (הידרוקסימתיל) אמינומתאן (TRIS) ו-0.073 גרם EDTA ל-45 מ"ל מים טהורים במיוחד. יש להתאים את ה-pH ל-7.6 עם HCl ולאחסן בטמפרטורה של 4 מעלות צלזיוס עד לשימוש.
- עבור 0.1 M גלוטתיון מופחת (GSH) (עבור 45 דגימות משוכפלות), שקלו 0.0184 גרם GSH והמיסו אותו ב-600 מיקרוליטר של 10 מ"מ הידרוכלוריד.
- להכנת 10 מ"מ הידרוכלוריד, הוסיפו 0.5 מיקרוליטר HCl מרוכז ל-599.5 מיקרוליטר מים טהורים במיוחד.
- הוסף 28.5 מיקרוליטר של גלוטתיון רדוקטאז ל-1.4 מ"ל של 0.1 M TRIS/HCl 0.5 מ"מ EDTA pH 8.0.
- מערבבים 1.211 גרם TRIS ו-0.0146 גרם EDTA עם 90 מ"ל מים טהורים במיוחד להכנת תמיסת 0.1 M TRIS/HCl ו-0.5 mM EDTA ב-pH 8.0. הוסיפו HCl כדי להתאים את ה-pH במידת הצורך. ניתן לאחסן את התמיסה ללא הגבלת זמן בטמפרטורה של 2-8 מעלות צלזיוס.
- משקל 0.075 גרם NADPH והוסף אותו ל -2.25 מ"ל של 1% NaHCO3 1 מ"מ EDTA.
- מערבבים 1 גרם NaHCO3 ו-0.0282 גרם EDTA ב-100 מ"ל מים טהורים במיוחד להכנת תמיסת NAHCO3 1% ו-1 מ"מ EDTA. אחסן את התמיסה בטמפרטורה של 4-8 מעלות צלזיוס למשך זמן לא מוגדר.
- מערבבים 2 מיקרוליטר של t-butyl hydroperoxide עם 2 מ"ל מים טהורים במיוחד ליצירת תמיסה של 7 מ"מ. יש לערבב מיד לפני השימוש.
- יש לערבב 1 גרם של אלבומין בסרום בקר (BSA) עם 1 מ"ל מים טהורים במיוחד ליצירת תמיסת מלאי של 1 מיקרוגרם/מיקרוליטר.
- חומרים מגיבים לחומצה תיוברביטורית (TBARS) (חמצון שומנים, LPO)17
- הוסף 5 מיקרוליטר של רקמה למיקרו-צינור של 1 מ"ל. הוסף 45 מיקרוליטר של 50 מ"מ PBS (תמיסה טרייה ומלאי).
- הוסף 12.5 מיקרוליטר של 8.1% SDS (מוכן טרי). הוסף 93.5 מיקרוליטר של 20% TCA pH 3.5 (מוכן טרי).
- הוסף 93.5 מיקרוליטר של 1% TBA (מוכן טרי). השלם את הנפח על ידי הוספת 50.5 מיקרוליטר מים טהורים במיוחד. סוגרים את מכסה הצינור ומערבלים אותו למשך 30 שניות.
- יש לנקב את מכסה המיקרו-צינור בעזרת מחט ולדגור במים רותחים למשך 10 דקות.
- מצננים את הצינור בטמפרטורת החדר (RT), ולאחר מכן צנטריפוגה אותו ב-1000 x גרם למשך 10 דקות.
- הוסף 150 מיקרוליטר של סופרנטנט לבאר במיקרו-פלטת של 96 בארות ומדוד ספיגה ב-530 ננומטר באמצעות ספקטרופוטומטר מיקרו-פלטה.
- כדי לכמת פרוקסידים של שומנים, צור עקומת כיול TBARS של 8 נקודות (0-160 מיקרומטר) באמצעות malondialdehyde bis (דימתיל אצטל) כמתואר בטבלה 1. התאם את עקומת המלונדיאלדהיד (MDA) בהתאם לסוג הרקמה או לרמת הנזק החשודה.
- בטא את התוצאות כחלבון nmol MDA eq·mg−1 .
- מיקרו-בדיקה של אנזים נוגד חמצון סופראוקסיד דיסמוטאז (SOD)18
- השתמש בצלחת של 96 בארות. הוסף 147 מיקרוליטר של 1 M TRIS/5 mM HCl EDTA pH 8 לשתי בארות כחסר. הוסף 144 מיקרוליטר של 1 M TRIS/5 mM HCl EDTA pH 8 לבארות אחרות על ידי שכפול.
- קחו 3 מיקרוליטר מהסופרנטנט והוסיפו אותו לבארות הדגימה. מערבבים בעדינות את התוכן על הצלחת מספר פעמים.
- הוסף 3 מיקרוליטר של 10 מ"מ חומצה פירוגלית לכל באר תוך 30 שניות. ערבבו בעדינות מיד.
- מדוד את הספיגה ב-T0 (זמן = 0 שניות) ו-T10 (זמן = 10 שניות), ב-420 ננומטר ו-25 מעלות צלזיוס.
- קבע SOD על ידי חישוב אחוז עיכוב פירוגלול בדגימה באמצעות המשוואה הבאה:
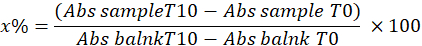
איפה
x% = אחוז החמצון של פירוגלול על ידי SOD בדגימה; לכן, חמצון של פירוגלול שווה ל 100 - x%
הערה: חישוב פעילות ה-SOD בהתחשב ב-1 IU הוא הנפח המעכב 50% מחמצון הפירוגלול כמתואר להלן:
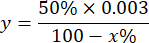
איפה
y = נפח דגימה על מיליליטר (מעכב 50% מהפירוגלון)
50% = אחוז העיכוב של פירוגלול שווה ל-1U של SOD
0.003 = נפח במיליליטר של המדגם
100 - x% = עיכוב של פירוגלול באחוזים על ידי המדגם - לבסוף, קבע את פעילות SOD עם המשוואה:
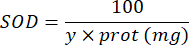
SOD = פעילות SOD ביחידות בינלאומיות למיקרוגרם חלבון
Y = נפח הדגימה בו מעכב 50% מהפירוגלול
100 = גורם ההמרה מדציליטר למיליליטר.
חלבון = ריכוז החלבון המתקבל מהכימות של ברדפורד מבוטא כמיקרוגרם למיליליטר; יש צורך לחלק ב-10 כדי להמיר לגרם לדציליטר
- מיקרו-בדיקת אנזים נוגד חמצון קטלאז (CAT)19,20
- השתמש במיקרופלטה של 96 בארות. הוסף 20 מיקרוליטר של סופרנטנט דגימה לבארות (על ידי שכפול).
- הוסף 20 מיקרוליטר קטלאז טרי (200 מיקרוגרם/מ"ל) לבארות כסטנדרט (על ידי שכפול). הוסף 100 מיקרוליטר של 50 מ"מ PBS pH 7.8 לדגימה ולבארות ריקות.
- הוסף 100 מיקרוליטר של 90 מ"מ (30%) H2O2 לבארות כדי להתחיל את התגובה. לאחר הוספת H2O2, קרא את הספיגה כל 15 שניות למשך 2.5 דקות ב-240 ננומטר.
- חישוב פעילות באמצעות המשוואה:

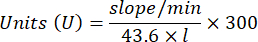
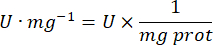
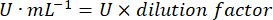
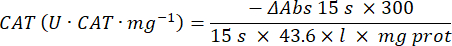
- מיקרו-בדיקת אנזים גלוטתיון פרוקסידאז (GPx)21
- השתמש במיקרופלטה של 96 בארות.
- מערבבים 240 μL של תמיסת 0.1 M GSH, 1 200 μL של תמיסת 10 U/mL GSH-Rd ו-1 200 μL של 4 mM NADPH. שמור את התמיסה על קרח.
- הוסף לבארות 100 מיקרוליטר של 50 מ"מ TRIS/HCl 5 מ"מ EDTA pH 7.6. הוסף 1 מיקרוליטר של דגימת סופרנטנט בשכפול. הקש על המיקרופלייט וערבב בעדינות.
- מוסיפים 50 מיקרוליטר מתמיסת התערובת (שלב 4.5.2) ומערבבים בעדינות.
- הוסף 20 מיקרוליטר מתמיסת t-butyl hydroperoxide של 7 מ"מ לבארות כדי להתחיל את התגובה (לוקח בערך 15 שניות להתחיל את התגובה ב-16 דגימות משוכפלות). מערבבים במהירות את המיקרופלייט.
- עקוב אחר הספיגה בכל מרווח של דקה למשך 5 דקות ב-25 מעלות צלזיוס ב-340 ננומטר.
- חשב את פעילות ה-GPx באמצעות המשוואה:
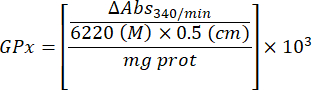
איפה
GPx = פעילות במילימולרית לדקה למיקרוגרם חלבון
ΔAbs340/min= ספיגה ממוצעת בדלתא
103 = המרה טוחנת למילימולרית
- מ"ג פרוט = ריכוז חלבון מהקביעה של ברדפורד מבוטא במיקרוגרם למיקרוליטר
- כימות חלבון על ידי הניתוח של ברדפורד22
- בצע עקומה סטנדרטית מתמיסות אלבומין בסרום בקר (BSA), שנקבעו מתמיסת מלאי 1 μg/μL כפי שמוצג בטבלה 2.
- השתמש במיקרופלטה של 96 בארות. הוסף 190 מיקרוליטר של המגיב של ברדפורד בבארות המדגם והסטנדרטיות.
- הוסף 10 מיקרוליטר BSA בבארות סטנדרטיות על ידי שכפול. הוסף 10 מיקרוליטר של סופרנטנט לבארות הדגימה על ידי שכפול.
- מערבבים בעדינות עם קצה הפיפטה.
- ספיגת קריאה ב-595 ננומטר. כמת את ריכוז החלבון עם העקומה הסטנדרטית.
תוצאות
תוצאות המחקר מגלות כי למתכות כבדות, במיוחד אלומיניום (Al), ברזל (Fe) ואבץ (Zn), יש השפעה מזיקה על הסביבה, כפי שמעיד איור 2. גילוי רמות גבוהות של מתכות כבדות הן בדגימות רקמה והן בדגימות מים שנאספו מכל האתרים הוביל לתוצאה שלילית. זוהו חריגים, עם גורם הצטברות ביולוג?...
Discussion
למרות שהשימוש ב - C. texanus הוא אופטימלי להערכה, יש לקחת בחשבון מספר היבטים של השימוש והאיסוף שלו. אתרי המחקר שנבחרו מתגלים כמאתגרים, בשל מספר גורמים כגון תנאי מזג אוויר לא נוחים, חוסר נגישות גיאוגרפית, רמות יובש גבוהות או פרוטוקולי אבטחה לא מספיקים באזורים נבחרים. אילוצ...
Disclosures
המחברים לא חשפו ניגודי אינטרסים הקיימים בעבודתם.
Acknowledgements
המחברים מבקשים להביע את תודתם הכנה ל-CONAHCyT על מתן מענק FONINS P 1931, שהקל מאוד על מאמצי המחקר שלהם. הם גם יודו למזכירות המחקר והפוסגרדו במכון הפוליטי הלאומי על התמיכה שלא תסולא בפז הניתנת באמצעות מענק פרויקט SIP (20200577). בנוסף, המחבר הראשון מבקש להכיר במלגה הנדיבה לתואר שני שהוענקה על ידי CONAHCyT, שאפשרה לצוות לערוך טיולי שטח ולאסוף נתונים חיוניים. לבסוף, המחברים מבקשים להביע את הערכתם לעזרתה רבת הערך של מריה תרזה גרסיה קמאצ'ו במעבדה, שבלעדיה פרויקט זה לא היה מתאפשר.
Materials
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
References
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved