Method Article
İnsan Mandibulasından Kemik İliği Mezenkimal Kök Hücrelerinin İzolasyonu ve Kültürü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, insan mandibular kemik iliği kaynaklı mezenkimal kök hücrelerin tüm kemik iliği adezyans yöntemi kullanılarak izole edilmesi ve kültürlenmesi için etkili bir prosedürü tanımlamaktadır. Kültürlenmiş hücreler, hücre proliferasyon deneyleri, akış sitometrisi ve çok soylu farklılaşma indüksiyonu ile tanımlandı.
Özet
İnsan mezenkimal kök hücreleri (hMSC'ler), kemik rejenerasyonu, bağışıklık modülasyonu ve refrakter kronik hastalıkların tedavisinde büyük potansiyel göstermiştir. Son zamanlarda hMSC'leri elde etmek için çeşitli kökenler bulunurken, kemik iliği hala ana kaynak olarak kabul edilmektedir. Farklı donör kemik bölgelerinden elde edilen kemik iliği kaynaklı MSC'ler (BMSC'ler), mikroçevresel faktörler nedeniyle farklı özelliklere sahiptir. Çalışmalar, maksillofasiyal kemikten elde edilen BMSC'lerin, uzun kemiklerden veya iliak krestten elde edilen BMSC'lerden daha fazla proliferatif ve osteojenik kapasiteye sahip olabileceğini göstermiştir. Maksillofasiyal BMSC'lerin ise maksillofasiyal dokularda kök hücre tedavisi için daha uygun olduğu düşünülüyordu. Mandibula, özellikle yeterli kemik iliğine sahip yükselen ramal alan, BMSC'lerin toplanması için uygun bir donör bölgeydi. Bu çalışma, insan mandibular kemik iliği türevi MSC'lerin (hmBMSC'ler) hasat edilmesi, izole edilmesi ve kültürlenmesi için bir protokol tanımlamıştır. Ayrıca, kültürlenmiş hücreleri tanımlamak için hmBMSC'lerin immünofenotiplemesi, proliferasyon testleri ve ostejenik, adipojenik ve kondrojenik farklılaşmanın in vitro indüksiyonu gerçekleştirildi. Bu protokolün uygulanması, araştırmacıların biyolojik fonksiyon, mikro-çevresel etkiler ve klinik uygulamalar hakkında daha ileri çalışmalar için gerekli olan yeterli sayıda yüksek kaliteli hmBMSC'yi başarılı bir şekilde elde etmelerine yardımcı olabilir.
Giriş
İnsan mezenkimal kök hücreleri (hMSC'ler), mezodermal soydan osteositler, adipositler ve kondrositler, endodermal soydan hepatositler ve pankreositler ve ektodermal soydannörositler gibi çeşitli hücre tiplerine farklılaşabilen multipotent hücrelerdir 1. Bu nedenle, hMSC'ler doku rejenerasyonunda büyük potansiyel göstermiştir. Ayrıca, hMSC'ler, konakçı dokulardaki mikro çevreyi düzenleyebilen ve kronik refrakter hastalıkları etkili bir şekilde tedavi edebilen güçlü immünomodülatörlerdir2. Bu nedenle, hMSC'ler klinik çalışmaların hücre tedavisinde yaygın olarak kullanılmaktadır. Sonuç olarak, yüksek kalitede yeterli hMSC'leri uygun bir şekilde başarılı bir şekilde elde etmek önemlidir.
HMSC'ler ilk olarak kemik iliğinde bildirildiğinden beri, yağ dokusu, sinovyum sıvısı, iskelet kası, amniyotik sıvı, endometriyum, diş dokuları ve göbek kordonu gibi birçok alternatif MSC kaynağı bulunmuştur 1,3. Bununla birlikte, kemik iliği, çoğu preklinik ve klinik çalışma için hMSC'lerin ana kaynağı olmaya devam etmektedir ve kemik iliği kaynaklı MSC'ler (BMSC'ler), diğer kaynaklardan MSC'leri karşılaştırmak için bir standart olarak alınmaktadır4. Yıllardır, iliak krest veya uzun kemikler (tibia ve femur) kemik iliği elde etmek için en popüler anatomik yerler olmuştur 1,5. Bununla birlikte, iliak kret veya uzun kemikler, maksillofasiyal kemiklere kıyasla farklı embriyonik kökenlere ve gelişim modellerine sahiptir 5,6. Birçok klinik, laboratuvar ve gelişimsel çalışma, farklı kökenlerden gelen BMSC'lerin bölgeye özgü özellikler gösterdiğini ve aşılanmış BMSC'lerin alıcı bölgeyeimplantasyondan sonra donör bölgenin özelliklerini koruduğunu kanıtlamıştır 5,6,7,8,9. Gelişimsel köken açısından bakıldığında, maksilla, mandibula, dentin, alveol kemiği, pulpa ve periodontal ligament gibi maksillofasiyal dokular yalnızca nöral krest hücrelerinden kaynaklanır. Buna karşılık, iliak kret ve uzun kemikler mezoderm tarafından oluşturulur. Ek olarak, mandibulalar intramembranöz ossifikasyon ile oluşturulurken, aksiyel ve apendiküler iskeletler endokondral ossifikasyona uğrar. Ayrıca, iliak kret ve uzun kemiklerle karşılaştırıldığında, bazı klinik çalışmalar maksillofasiyal kemik iliği kaynaklı hMSC'lerin daha iyi hücresel proliferatif aktiviteye ve farklılaşma kabiliyetine sahip olduğunu göstermiştir 6,8. Bu nedenle, maksillofasiyal alanlardan alınan BMSC'lerin maksillofasiyal doku rejenerasyonu ve maksillofasiyal kronik refrakter hastalıklar tedavisi için daha iyi bir seçim olması beklenmektedir.
Mandibula, çiğneme gücünü yükleyebilmesi için aralarında süngerimsi kemik iliği bulunan iki katmanlı kalın kortikal kemiklerden oluşur. Bu nedenle, mandibula, özellikle çıkan ramal alan, kraniyomaksillofasiyal ameliyatlarda otolog kemik greftleri elde etmek için genellikle donör bölge olarak kullanılır10. Mandibular sagital split ramus osteotomisi ve mandibular açı küçültme plastisi gibi ameliyatlarda, hoş bir yüz konturu elde etmek için mandibular kortikal ve süngerimsi kemik parçalarının çıkarılması gerekir. Atılan bu süngerimsi kemikler hMSC'ler için potansiyel bir kaynak olabilir. Bununla birlikte, yayınlanmış az sayıda çalışma, yüksek kaliteli insan mandibular kemik iliği türevli MSC'leri (hmBMSC'ler) hızlı bir şekilde izole etmek ve kültürlemek için protokolü tanımlamıştır.
Bu çalışma, hmBMSC'lerin izolasyonu ve kültürü için güvenilir ve tekrarlanabilir bir protokol sunmak için modifiye edilmiş bir tüm kemik iliği aderans yöntemini kullanmaktadır. Kök hücreler, MSC'lerin akış sitometrik immünofenotiplemesi, proliferasyon testleri ve çok soylu farklılaşma indüksiyonu ile tanımlandı. Bu standart prosedürün uygulanması, araştırmacıların biyolojik fonksiyon, mikroçevresel etkiler ve klinik uygulamalarla ilgili daha ileri çalışmalarda önemli olan yüksek kaliteli insan mandibular kemik iliği türevi MSC'ler elde etmelerine yardımcı olabilir.
Protokol
İnsan mandibular kemik örneklerinin toplanması prosedürü, Dördüncü Askeri Tıp Üniversitesi Stomatoloji Okulu Etik Komitesi tarafından onaylandı. Çalışma, 1975 Helsinki Bildirgesi'nin etik kurallarını takip etti. Bu çalışma için tüm bağışçılar olası riskler ve çalışma hedefleri hakkında bilgilendirildi. Bağışçıların yaşları 18-40 arasında değişmekte olup, cinsiyet yanlılığı yoktu. Tüm insan katılımcılardan yazılı onay alındı.
1. Ameliyat hazırlığı
- Uygun donörü seçin.
- Sagital split ramus osteotomisi ve mandibular açı küçültme plastisi sonrası mandibular gerileme gibi ameliyatlar geçirmeyi planlayan hastaları donör olarak seçin.
- Koruma çözeltisini hazırlayın.
- Ameliyattan bir gün önce steril ve enzim içermeyen 50 mL'lik bir santrifüj tüpünde %1 penisilin ve streptomisin ile 30 mL fosfat tampon salin (1x PBS) takviyesi yapın. Buzdolabında 4 °C'de saklayın.
- Ameliyat günü, koruma solüsyonlu santrifüj tüpünü bir buzluğa koyun ve ameliyattan 1 saat önce ameliyathanede saklayın.
- Ameliyattan bir gün önce kemik iliğini izole etmek için makas, cımbız ve bıçaklar da dahil olmak üzere aletleri 120 ° C'de ve 0,27 MPa basınçta 20 dakika sterilize edin.
- Minimum esansiyel besiyeri alfa (α-MEM)% 10 fetal sığır serumu (FBS) ve% 1 penisilin ve streptomisin ile karıştırarak α-MEM kültür ortamını hazırlayın.
- α-MEM kültür ortamını 50 mM askorbik asit, 10 mM β-gliserol fosfat ve 0.1 mM deksametazon ile karıştırarak bir osteojenik farklılaşma ortamı hazırlayın (bkz.
- α-MEM kültür ortamını 1 mM deksametazon, 0.2 mM indometasin, 10 μg/mL insülin ve 0.5 mM 3-izobutil-1-metilksantin (IBMX) ile karıştırarak adipojenik farklılaşma ortamı A'yı hazırlayın (bkz.
- α-MEM kültür ortamını 10 μg/mL insülin ile karıştırarak adipojenik farklılaşma ortamı B'yi hazırlayın.
- Dulbecco'nun modifiye edilmiş Eagle ortamını yüksek glikoz (HG-DMEM) ve 100 nM deksametazon, 100 g / mL sodyum piruvat, 25 mg / mL C vitamini, 40 mg / mL prolin, 10 ng / mL TGF-β3 ve% 1 ITS ile karıştırarak kondrojenik farklılaşma ortamı hazırlayın (bkz.
NOT: Ostejenik, adipojenik ve kondrojenik farklılaşma ortamı, yukarıda belirtildiği gibi kurum içinde hazırlanabilir. Bununla birlikte, bu çalışmada bunun için ticari olarak temin edilebilen kitler kullanılmıştır (bkz. Malzeme Tablosu).
2. İnsan mandibular kemik örneğinin toplanması
- Ameliyattan önce, üç boyutlu bilgisayarlı tomografik tarama görüntülerini ve donörlerin cerrahi simülasyon planlamasını dikkatlice inceleyin (Şekil 1).
- Donörün ameliyatta çıkarmayı planladığı ve donör bölgesi olarak kemik iliği ile süngerimsi kemik açısından zengin olan mandibular bölgeyi seçin.
- Ameliyattan önce hastayı dezenfekte edin ve örtün.
- Ultrasonik osteotom bıçağını kullanarak mandibulanın seçilen donör bölgesini rezeke edin (bkz . Malzeme Tablosu), inferior alveolar sinir yaralanması ve donör kemik bozukluğundan kaçının.
- Mandibular kemik örneklerini mümkün olan en kısa sürede koruma solüsyonuna (adım 1.2) koyun.
- MSC'lerin izolasyonu laboratuvarda başlayana kadar kemik örnekleriyle birlikte koruma solüsyonunu bir buz kutusuna yerleştirin.
NOT: Hücrelerin canlılığını korumak için MSC'lerin izolasyonunun, hasattan sonra mümkün olan en kısa sürede başlatılması gerekir. MSC'lerin izolasyonu hemen gerçekleştirilemezse, kemik örneklerini içeren koruma çözeltisi bir buzlukta saklanabilir veya en fazla 2 saat boyunca 4 ° C'de buzdolabında saklanabilir.
3. İnsan mBMSC'lerinin izolasyonu ve yetiştirilmesi
- Kemik örneklerini koruma solüsyonundan çıkarın ve laminer akış kabininin temiz bir tezgahında 5 dakika boyunca% 1 penisilin ve streptomisin içeren 1x PBS'ye batırın.
NOT: Bu adım, kan pıhtısını ve artık ağız sıvılarını yıkamayı ve ağız tamamen steril bir ortam olmadığı için mikroorganizmayı daha da ortadan kaldırmayı amaçlar. Hücre izolasyonu ve ekiminden önce ellerinizi alkolle yıkayın ve dezenfekte edin ve tek kullanımlık steril eldivenler ve maskeler kullanın. - Kemik yüzeyindeki yapışık yumuşak dokuyu ve kan lekesini steril ıslak gazlı bez kullanarak temizleyin.
- 6 cm'lik steril bir kültür kabını 5 mL α-MEM kültür ortamı ile doldurun.
- Kemiği steril kültür kabına koyun ve sterilize edilmiş bir bıçak veya makasla küçük parçalar halinde (neredeyse 2-3 mm3 hacim) kesin.
NOT: Parmak kesilmesini önlemek için kemik örneklerini cımbızla tutun. - Kültür kabında α-MEM kültür ortamını 1 mL tek kullanımlık steril şırınga ile aspire edin.
- Şırınga iğnesini, α-MEM kültür ortamı ile süngerimsi kemik örneği parçalarının kemik iliği boşluğunun derinliklerine yerleştirin.
- Kemik iliğini, kemik örneği parçalarının her tarafından, her iki tarafta en az 5-10 kez şırınga ile kültür kabına yıkayın.
- Kültür ortamına mümkün olduğunca çok kemik iliğinin akıtıldığından emin olmak için tüm kemik örneği parçaları saf beyaza dönene kadar 3.5-3.7 adımlarını tekrarlayın.
NOT: Yukarıdaki 3.1-3.8 arasındaki adımların toplam çalışma süresinin buz üzerinde 30 dakika içinde kontrol edilmesi gerekir. - Tüm kemik örneği parçalarını cımbızla çıkarın ve atın. 70 μm gözenek boyutuna sahip bir hücre filtresi kullanarak diğer küçük parçaları çıkarın.
- Yıkanmış hücrelerin eşit şekilde dağılmasını sağlamak için kültür kabını yumuşak bir şekilde çalkalayın.
- Kültür kabını bir hücre inkübatörüne yerleştirin ve hücreleri 37 °C'de% 5 CO2 nemlendirilmiş bir atmosferde kültürleyin.
- Kültürün üçüncü gününde, hücre morfolojisini ve büyüme durumunu ışık mikroskobu altında kontrol edin. Yapışık hücreler ve doku parçası olmadan kültür ortamının yarısını çıkarın; 3 mL taze α-MEM kültür ortamı ekleyin.
- 7. kültür gününde, tüm kültür ortamını çıkarın ve 5 mL taze α-MEM kültür ortamı ekleyin.
- Ardından, α-MEM kültür ortamını her 3 günde bir yenileyin.
- Hücre morfolojisini ve büyümesini her gün kontrol edin.
NOT: Birincil hücre kültürleri (P0) 7-10 günlük kültürden sonra %70-80 birleşmeye ulaştığında, hücre geçişini gerçekleştirin.
4. Hücre geçişi
- % 70 -% 80 birleşimde, P0 hücrelerinin tüm kültür ortamını çıkarın. Kalan kültür ortamını temizlemek için kültür kabını 1x PBS ile iki kez nazikçe yıkayın.
- Hücreleri sindirmek için kültür kabına 1 mL %0.25 EDTA ile %0.02 tripsin ekleyin. Tripsinin eşit şekilde dağıldığından emin olmak için kültür kabını yumuşak bir şekilde çalkalayın. Kültür kabını 37 °C'de 3 dakika bekletin.
- Hücreleri mikroskop altında kontrol edin. Hücrelerin% 70-80'i büzüldüğünde ve yuvarlandığında, sindirim reaksiyonunu durdurmak için 2 mL α-MEM kültür ortamı ekleyin.
- Hücreleri üflemek için bulaşık yüzeyine bir pipetle birkaç kez hafifçe üfleyin.
- Hücre süspansiyonunu 15 mL'lik bir santrifüj tüpüne aktarın. Hücre süspansiyonunu oda sıcaklığında 5 dakika boyunca 200 x g'da santrifüjleyin.
- Süpernatanı atın ve hücreleri α-MEM kültür ortamı ile yeniden süspanse edin. 1:2 bölme oranıyla genişleme için kültür şişelerinde (25 cm) tohum P0 hücreleri. İlk geçiş hücreleri P1 hücreleri olarak adlandırıldı.
- P1 hücreleri %70-80 birleşime ulaştığında, 4.1-4.6 arasındaki adımları izleyerek hücre geçişini tekrarlayın. İkinci nesil hücrelere P2 hücreleri adı verildi.
- Üçüncü nesil hücre geçişinden sonra genleşme bölme oranını 1: 3 olarak değiştirin.
- Tanımlama deneyleri yapmak için P3 ila P5 hücrelerini kullanın.
5. Akış sitometrik analizi
- 4.1-4.5 adımlarını izleyerek% 0.02 EDTA ile% 0.25 tripsin kullanarak P3 ila P5 MSC'leri sindirin.
- Süpernatanı atın ve hücreleri 1 x 106 hücre / mL konsantrasyonda 1x PBS'de yeniden süspanse edin.
- Hücreleri, tüp başına 100 μL hücre süspansiyonu ile mikrosantrifüj tüplerine aktarın.
- Mikrosantrifüj tüplerine immün etiketli fare monoklonal anti-insan antikorları ekleyin.
NOT: Bu çalışma için, CD45'e karşı Fikoeritrin (PE) konjuge antikor, CD90, CD34 ve CD44'e karşı floresein-izotiyosiyanat (FITC) konjuge antikorkullanıldı 4,11 (bkz. Malzeme Tablosu) ve antikorların dilüsyonlarının tümü 1:100 idi. Antikorların seyreltilmesinin üreticinin talimatlarına uyması gerekir. PBS kontrol olarak hizmet verecektir. - Antikorları ve PBS kontrolünü karanlıkta oda sıcaklığında 30 dakika inkübe edin.
- Tüpleri oda sıcaklığında 5 dakika boyunca 800 x g'da santrifüjleyin. Süspansiyonu atın ve hücreleri 0.5 mL 1x PBS'de yeniden süspanse edin. Bu adımı iki kez tekrarlayın.
- Tüpleri akış sitometresine yükleyin (Malzeme Tablosuna bakınız). En az 10.000 olay içeren bir akış sitometresi kullanarak floresan etiketli hücre sayılarını sayın.
NOT: İmmünofloresan etiketleme prosedüründen hemen sonra akış sitometresi hücre sayımı işlemini başlatmak daha iyidir. Aksi takdirde, hücrelerin %1 paraformaldehit içinde sabitlenmesi, karanlıkta 4 °C'de saklanması ve işlemi 24 saat içinde bitirmesi gerekir.
6. Hücre proliferasyon testi
- Hücre proliferasyon testini gerçekleştirmek için P3 hücrelerini kullanın. P3 MSC'leri 4.1-4.5 adımlarını izleyerek %0.25 tripsin ile sindirin.
- Süpernatanı atın ve hücreleri α-MEM kültür ortamı ile yeniden süspanse edin.
- Hücre sayısını bir hemositometre ile sayın ve hücreleri 96 oyuklu kültür plakalarına oyuk başına 3 x 103 hücre yoğunluğunda, toplam 35 kuyucuk, her sayma günü için 5 kuyu (1, 2, 3, 4, 5, 6, 7. günde) tohumlayın. Hücrelerin kültür ortamını her 3 günde bir yenileyin.
- Her sayım gününde, belirli bir sayım günü için belirli beş kuyucuğun α-MEM kültür ortamını atın ve ardından 100 μL kültür ortamı ve 10 μL CCK-8 çözeltisi ekleyin (bkz. Malzeme Tablosu). 37 °C'de 1 saat inkübe edin.
- Kültür plakalarını bir mikroplaka spektrofotometresine yerleştirin (Malzeme Tablosuna bakınız) ve her sayma günü için (toplam 7 sayma günü) 450 nm dalga boyunda beş kuyucuğun optik yoğunluk değerini ölçün. Hücreler olmadan kültür ortamının beş kuyusunu boşluk olarak kullanın.
- Her kuyucuğun optik yoğunluk değerini kaydedin, her sayım günü için beş kuyucuğun ortalama değerini ve standart sapmasını hesaplayın ve hücre büyüme eğrisini 5,12 çizin.
7. Çok soylu farklılaşma
- Aşağıdaki adımları izleyerek osteojenik farklılaşma indüksiyonu gerçekleştirin.
- P3 hücrelerini 4.1-4.5 adımlarını izleyerek tripsin ile sindirin. Hücreleri 6 oyuklu bir plakada 2 x 105 hücre /cm2'de tohumlayın. Kuyucuk başına 2.5 mL α-MEM kültür ortamı ekleyin.
- Hücreler% 60 -% 70 birleşmeye ulaştığında, kültür ortamını osteojenik indüksiyon ortamına değiştirin (adım 1.5). Ardından, indüksiyon ortamını her 3 günde bir değiştirin.
- İndüksiyondan sonra hücreleri her 3 günde bir mikroskop altında kontrol edin. Hücre morfolojisini gözlemleyin ve belirgin mineralizasyon düğümlerini arayın.
- 7 günlük indüksiyondan sonra, hücrelerin kalsifikasyonunu değerlendirmek için alkalin fosfataz (ALP) boyamasını gerçekleştirin.
- Hücreleri iki kez nazikçe yıkamak için 1x PBS kullanın. Hücreleri oda sıcaklığında 30 dakika sabitlemek için% 4 paraformaldehit ekleyin. Ardından, hücreleri iki kez yıkamak için 1x PBS kullanın.
- ALP boyama solüsyonu ekleyin (Malzeme Tablosuna bakınız) ve oda sıcaklığında 10 dakika inkübe edin.
NOT: Farklı türde ALP boyama solüsyonları, hücreleri koyu gri, kırmızı ve mavi gibi farklı renklerle lekeleyebilir. Bu protokolde hücreler mavi renge boyandı. Lekelenme rengi belirgin değilse kuluçka süresi uzayabilir. Bazı ALP solüsyonu boyama kitleri zehirli olabilir; Kullanmadan önce talimatları dikkatlice okuyunuz, deney sırasında eldiven ve maske takın ve kullandıktan sonra ellerinizi dikkatlice yıkayınız. - ALP boyama reaksiyonunu durdurmak için hücreleri suyla yıkayın. Işık mikroskobu altında hücrelerdeki mavi pigmentli granülleri gözlemleyin ve fotoğrafları çekin. Boyama derecesini kantitatif olarak analiz etmek için Image J yazılımını kullanın.
- Hücrelerin mineralizasyon kapasitesini değerlendirmek için alizarin kırmızı boyama yapın ( Malzeme Tablosuna bakınız).
NOT: Farklılaşmış hücrelerin belirgin mineralizasyon düğümleri oluşumu genellikle indüksiyondan 21 gün sonra görülebilir. - Hücreleri iki kez nazikçe yıkamak için 1x PBS kullanın. Ardından, hücreleri oda sıcaklığında 30 dakika sabitlemek için% 4 paraformaldehit ekleyin.
- Hücreleri 1x PBS ile iki kez yıkayın,% 0.1 alizarin kırmızı boyama solüsyonu ekleyin (Malzeme Tablosuna bakınız) ve 20 dakika inkübe edin. Yine, hücreleri 1x PBS ile iki kez yıkayın.
- Işık mikroskobu altında sabit hücreler arasındaki kırmızı nodülleri gözlemleyin, bu da kültürlenmiş hücrelerin osteojenik farklılaşmasının kalsiyum birikintilerini gösterir ve fotoğrafları çeker.
- Alizarin kırmızısı miktarını ölçmek için, alizarin kırmızısı lekeli hücrelere% 10 setilpiridinyum klorür (CPC, Malzeme Tablosuna bakınız) ekleyin ve oda sıcaklığında 30 dakika inkübe edin.
- 50 μL'lik CPC solüsyonunu aspire edin ve bir mikroplaka spektrofotometresi kullanarak 540 nm dalga boyunda optik yoğunluğu (OD) ölçün.
- Adipojenik farklılaşma indüksiyonu gerçekleştirin.
- Yukarıda açıklanan prosedürü kullanarak P3 hücrelerini 6 oyuklu bir plakaya tohumlayın (adım 7.1).
- Hücreler %80-90 oranında birleştiğinde, kültür ortamını adipojenik farklılaşma ortamı A'ya değiştirin (adım 1.6).
- Hücreleri, 3 gün boyunca% 5 CO2 içeren nemlendirilmiş bir atmosferde 37 ° C'de adipojenik farklılaşma ortamı A ile inkübe edin.
- İndüksiyon ortamını adipojenik farklılaşma ortamı B'ye (adım 1.7) değiştirin ve 1 gün inkübe edin.
- Ortamı tekrar adipojenik farklılaşma ortamı A'ya değiştirin ve 3 gün inkübe edin. Ardından, 1 gün boyunca orta B ile değiştirin. Mikroskop altında lipit damlacıkları görülene kadar bu döngüyü 3-5 kez tekrarlayın.
NOT: Lipid damlacıkları indüksiyondan yaklaşık 21 gün sonra görülebilir. - Hücreleri 7 gün daha kültürlemek için adipojenik farklılaşma ortamı B'yi kullanın; Daha sonra mikroskop altında büyük ve yuvarlak lipit damlacıkları görülebilir. Orta B'yi her 3 günde bir yenileyin.
- İndüksiyon ortamını çıkarın ve hücreleri nazikçe yıkamak için 1x PBS kullanın. Ardından, hücreleri oda sıcaklığında 10 dakika sabitlemek için% 4 paraformaldehit ekleyin.
- Hücreleri 1x PBS ile iki kez yıkayın; daha sonra, hücreleri yağ kırmızısı O boyama solüsyonu (kuyu başına 1 mL, Malzeme Tablosuna bakınız) ile 15 dakika inkübe edin. Yine, hücreleri 1x PBS ile iki kez yıkayın.
- Hücreleri mikroskop altına yerleştirin ve farklılaşmış hücrelerin adipogenezini değerlendirmek için kırmızı lipit damlacıklarını gözlemleyin.
- Kondrojenik farklılaşma indüksiyonu gerçekleştirin.
- P3 hücrelerini sindirin ve 5 x 105 hücre sayılarına sahip 15 mL'lik bir santrifüj tüpüne aktarın.
- Tüpü oda sıcaklığında 4 dakika boyunca 250 x g'da santrifüjleyin. Üst çözeltiyi dikkatlice boşaltarak süpernatanı atın.
- Hücreleri yeniden süspanse etmek için tüpe 0.5 mL kondrojenik farklılaşma ortamı (adım 1.8) ekleyin ve tüpü oda sıcaklığında 5 dakika boyunca 150 x g'da tekrar santrifüjleyin. Bu adımı iki kez tekrarlayın.
- Hava değişimini kolaylaştırmak için santrifüj tüpü kapağını gevşetin. Tüpü inkübatöre yerleştirin ve hücreleri% 5 CO2 nemlendirilmiş bir atmosferde 37 ° C'de 0.5 mL kondrojenik farklılaşma ortamı ile indükleyin.
- Santrifüj tüpünü, hücreler peletlenmeye başlayana kadar 24 veya 48 saat içinde çıkarmadan veya sallamadan sabit tutun. Hücre peletini farklılaşma ortamında askıya almak için santrifüj tüpünün altına hafifçe vurun (adım 1.5).
- Kondrojenik farklılaşma ortamını her 3 günde bir pipetle yenileyin. Hücre peletini aspire etmekten kaçının.
- Pelet 2 mm çapa ulaşana kadar hücreleri en az 21 gün boyunca indükleyin.
- Peleti 1x PBS ile yıkayın ve 30 dakika boyunca% 4 paraformaldehit ile sabitleyin. Dehidrasyon ve parafin gömmeişleminden sonra 13, peleti bir mikrotom kullanarak 3 μm kalınlığında bölümlere ayırın (bkz. Malzeme Tablosu).
- Bölümleri cam slaytların üzerine koyun. Slaytları Alcian mavisi solüsyonu ile 37 ° C'de 1 saat boyayın. Lekeli slaytları suyla yıkayın. Slaytları hafif bir mikroskop altına yerleştirin ve kıkırdak dokularını gösteren mavi lekeli asit mukopolisakkaritin fotoğraflarını çekin.
Sonuçlar
Hastadan başarılı bir şekilde mandibular kemik örneği alındı. Ve ultrasonik osteotom bıçağı ile kesmeden kemik parçasının santrifüj tüpüne yerleştirilmesine kadar geçen süre yaklaşık 5 dakikadır. Rezeksiyon prosedürü sırasında ve sonrasında, inferior alveolar sinir veya diş kökü hasarı, enfeksiyon, vasküler rüptür ve kanama, mukozal yaralanma, kazara kemik kırığı vb. dahil olmak üzere potansiyel komplikasyonların hiçbiri meydana gelmedi. hmBMSC'ler kontaminasyon olmadan başarılı bir şekilde kültürlendi, geçildi ve farklılaştırıldı.
Bu çalışmada, ilk kültürden sonraki üçüncü günde mikroskop altında çok sayıda yapışık hücre görüldü. Yedinci günde, yapışık hücrelerin çoğu zaten kültür kabına bağlanmıştı. Normalde, kültürlenmiş hücreler, ilk kültürden 7-9 gün sonra% 70 -% 80 birleşmeye ulaştı. Geçişten sonra, P3 hücrelerinin genellikle iğ şeklinde, plastiğe yapışan ve fibroblast benzeri morfoloji gösteren saflaştırılmış MSC'ler olduğu düşünülüyordu (Şekil 2). Tanımlama deneyleri ise P3 ila P5 hücrelerinde yapıldı. Hücre proliferasyon testi, hücre büyüme hızı kültürün üçüncü gününden itibaren hızla arttı ve artan hız 6. günde yavaşladı (Şekil 2).
Uluslararası Hücresel Terapi Derneği tarafından verilen tanıma göre, MSC'ler belirli yüzey moleküllerinin pozitif ve negatif bir ifadesine sahiptir. Bu çalışmada, kültür hücrelerinin akış sitometrik analizi, tanım 4,11 ile tutarlı olarak CD44, CD90'ın pozitif ekspresyonunu ve CD45, CD34'ün negatif ekspresyonunu göstermiştir (Şekil 3). Çok soylu farklılaşma yeteneği deneylerinde, kültürlenmiş hücreler güçlü ostejenik, adipojenik ve kondrojenik farklılaşma yeteneği gösterdi. 7 günlük osteojenik indüksiyondan sonra, mikroskop altında hücre dışı matriks kalsiyum birikimi ortaya çıktı. 21 günlük osteojenik indüksiyondan sonra, kültürlenen hücreler belirgin mineralizasyon düğümleri gösterdi ve düğümler alizarin kırmızısı boyaması ile kırmızıya boyandı (Şekil 4). Adipogenez için, 21 günlük adipojenik indüksiyondan sonra sitoplazmada Oil-red-O boyaması ile kırmızıya boyanmış çok sayıda birikmiş yuvarlak lipid damlacıkları görülmüştür (Şekil 4). Kondrojenik farklılaşma indüksiyonundan 21 gün sonra, kıkırdak lakunası olan kıkırdak benzeri dokuyu gösteren hücre pelet slaytları maviye boyanabilir (Şekil 4).
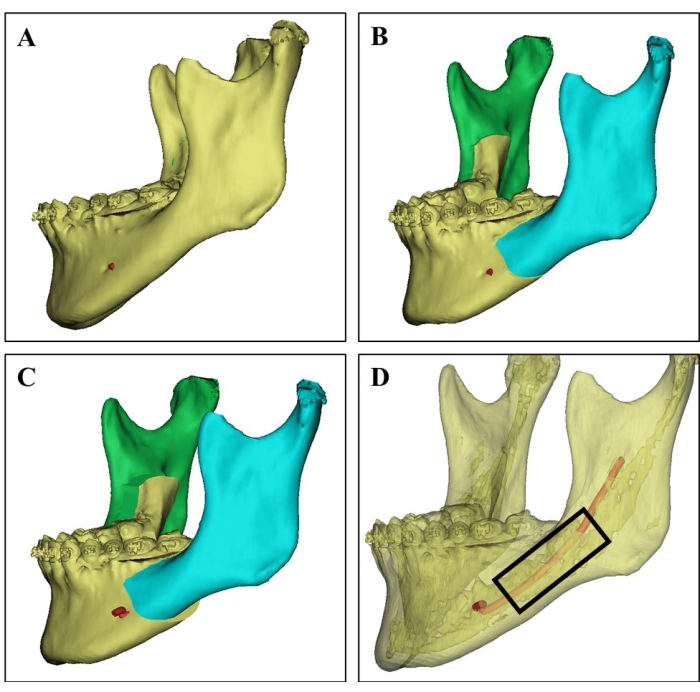
Şekil 1: 3D BT görüntüsünde donör yeri seçimi. (A) 21 yaşında bir kadın hastadan alınan donör mandibulanın 3D BT görüntüsü. (B) Mandibulanın bilateral sagital split ramus osteotomisinin cerrahi simülasyonu. (C) Cerrahi planlama, bölünmüş bir mandibulanın gerilemesini gösterir. (D) Farklı BT değerlerine dayalı olarak kortikal kemiği (yarı saydam kısım), kemik iliği açısından zengin süngerimsi kemiği ve inferior alveolar siniri (kırmızı) gösteren 3D BT görüntüsü, cerrahlara donör bölgeyi seçme ve sinir yaralanmasını önleme konusunda rehberlik edebilir. Siyah dikdörtgen içindeki bölgeden çeşitli kemik parçaları toplanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: P3 insan mandibula kaynaklı kemik iliği kök hücrelerinin (hmBMSC'ler) mikroskobik morfolojisi ve büyüme eğrisi. (AC) P3 hmBMSC'lerin iğ şeklinde, plastiğe yapışan ve fibroblast benzeri morfolojisi (Ölçek çubuğu = A, B, C için sırasıyla 200 μm, 100 μm, 50 μm). (D) Hücre büyüme eğrisi, hmBMSC'lerin büyüme hızının kültürün üçüncü gününden itibaren hızla arttığını ve kültürün altıncı gününde artış hızının yavaşladığını gösterdi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
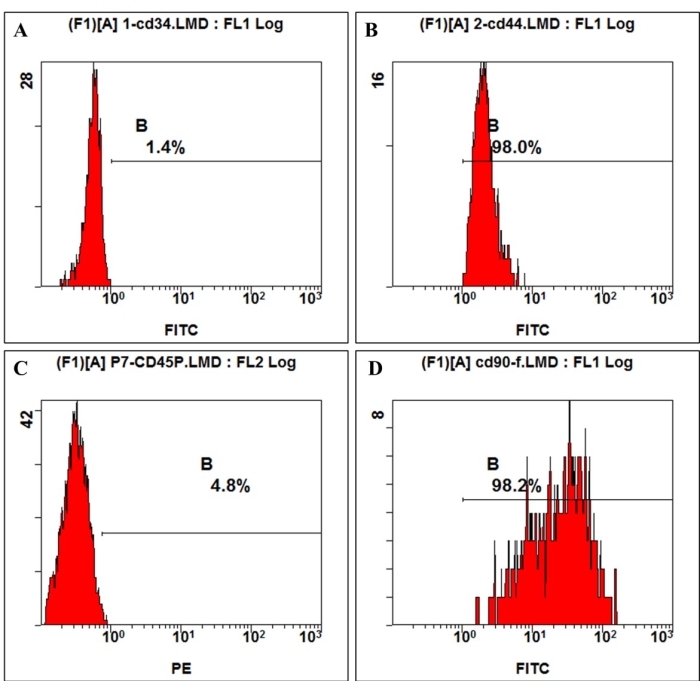
Şekil 3: hmBMSC'lerde hücre yüzeyi antijen ekspresyonu akış sitometrisi ile tespit edildi. Flow sitometri analizi, hmBMSC'lerin CD45 (A) ve CD44 (C) için negatif, CD44 (B) ve CD90 (D) için pozitif olduğunu gösterdi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: hmBMSC'lerin osteojenik, adipojenik ve kondrojenik farklılaşması. (A) Osteojenik farklılaşma indüksiyonu olmadan 7 günlük kültürden sonra hmBMSC'lerin ALP boyaması (Ölçek çubuğu = 100 μm). (B) 7 günlük osteojenik farklılaşma indüksiyonundan sonra hmBMSC'lerin ALP boyaması (Ölçek çubuğu = 100 μm). (C) ALP boyama pozitif alanının kantitatif sonuçları (***P < 0.001). (D) Osteojenik farklılaşma olmadan hmBMSC'lerin alizarin kırmızı boyaması (Ölçek çubuğu = 100 μm). (E) Belirgin mineralizasyon düğümlerinin oluşumu, hmBMSC'lerin osteojenik farklılaşmasından 21 gün sonra görülebilir ve alizarin kırmızısı boyama ile kırmızıya boyanabilir (Ölçek çubuğu = 100 μm). (F) Alizarin kırmızı lekelenmesinin kantitatif sonuçları (***P < 0.001). (G) Adipojenik farklılaşma olmadan hmBMSC'lerin yağ kırmızısı O boyaması (Ölçek çubuğu = 50 μm); (H) HMBMSC'lerin adipojenik farklılaşmasından 21 gün sonra yuvarlak lipid damlacıkları görüldü ve lipid damlacıkları yağ kırmızısı O boyaması ile kırmızıya boyandı (Ölçek çubuğu = 50 μm). (I) Alcian mavisi boyaması, 21 günlük kondrojenik farklılaşma indüksiyonundan sonra pozitifti (Ölçek çubuğu = 50 μm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Son zamanlarda, hMSC tedavisi, doku rejenerasyonunda ve immün disfonksiyon hastalıkları, sistemik hematolojik hastalıklar, kanserler veya travma gibi birçok refrakter hastalığın tedavisinde çok sayıda klinik çalışmada büyük umut vaat etmiştir 1,14,15,16,17. Çeşitli MSC kaynakları arasında, kemik iliği en yaygın kullanılan ve en kolay erişilen kaynak olmaya devam etmektedir. Bu protokolde tarif edilen tüm kemik iliği adezyon yöntemini kullanarak BMSC'leri başarılı bir şekilde kültürlemek için insan mandibular süngerimsi kemik çipleri kullandık. Bugüne kadar, kök hücreleri kemik iliğinden izole etmek için tüm kemik iliği yapışma yöntemi, yoğunluk gradyanlı santrifüjleme yöntemi, floresan hücre sıralama yöntemi ve manyetik ile aktive edilen hücre sıralama yöntemi10 dahil olmak üzere dört ana yaklaşım vardır. Tüm kemik iliği adezyon yöntemi basit, kullanımı kolay, ucuzdur ve büyük miktarlarda yapışık hücre elde edebilir. Bununla birlikte, bu yöntemin sınırlaması, hematopoietik hücreler ve fibroblastlarla karıştırılan primer kültürlenmiş BMSC'lerin düşük saflığıydı. Primer hücrelerin kültür ortamı düzenli olarak yenilendikten sonra, yapışık olmayan hematopoietik hücreler, atılan ortamla birlikte atıldı. Ayrıca, fibroblastlar hücre geçişi yoluyla temizlenebilir ve P3 hücreleri yüksek oranda saflaştırılmış BMSC'lerdir. Bu nedenle, P0 ila P2 hücreleri hücre tedavisi için kullanılamaz, bu da kök hücreleri saflaştırmak için fazladan zamana ihtiyaç duyulduğu anlamına gelir. Floresan hücre sıralama ve manyetik ile aktive edilmiş hücre sıralama yöntemleri kullanılarak, daha saflaştırılmış BMSC'ler elde edilebilirken, iki yöntem pahalıdır ve uzun bir seçim süresi hücre canlılığını bozabilir11. Kültürlenmiş hücrelerin MSC olduğunu kanıtlamak için, Uluslararası Hücresel Tedavi Derneği'nin Mezenkimal ve Doku Kök Hücre Komitesi tarafından önerilen, plastik yapışkan karakteri, CD45, CD90 ve benzeri gibi belirli fenotiplerin pozitif ve negatif ekspresyonunu içeren insan MSC'lerinin tanımına atıfta bulunduk ve çok soylu farklılaşma yeteneği18.
Çoğu çalışmada, femurlar ve iliak kret, mandibula ve maksilla gibi maksillofasiyal kemiklere kıyasla BMSC'lerin ana kaynaklarıydı 9,16. Bununla birlikte, son çalışmalarda hBMSC'lerin bölgeye özgü karakteristik teorisi, farklı kemiklerden gelen hBMSC'lerin farklılaşma yeteneği, proliferatif aktivite, osteogenez ve bağışıklık açısından farklı karakterlere sahip olduğunu göstermiştir 6,8. Bölgeye özgü farklılık, farklı embriyolojik kökenler, her iskelet bölgesindeki fonksiyonel taleplere adaptasyon, mikro çevre, lokal vasküler besleme, hormonal etkiler vb. ile ilişkili olabilir. Ayrıca çalışmalar, greftli iliak kemiğin, kemik greftinden sonraki 6 ay içinde çene kemiğinden daha hızlı dikey kayıp gösterdiğini göstermiştir8. Aksi takdirde, çalışmalar, MSC'lerin mandibular ilikten proliferatif aktivitesinin, iliak ilikten 5,8,19,20 daha üstün olduğunu bulmuştur. Ve bu proliferatif aktivite farkı, mandibulanın ilium 5,6,8'den daha fazla kan kaynağına ve daha hızlı bir kemik devir hızına sahip olduğu karakterlere bağlandı. Çalışmalar ayrıca mandibuladan gelen BMSC'lerin femurlardan daha yüksek bir Runx-2 ve OCN seviyesi ifade ettiğini ve mandibuladan gelen BMSC'lerin osteojenik yeteneğinin femur ve ilium 5,19,21'den olanlara eşit veya daha yüksek olduğunu ortaya koydu. hmBMSC'lerin titanyum yeteneğine bağlılığı da femurlardan alınan BMSC'lerden daha güçlü bulundu, bu da hmBMSC'lerin oral implantolojide kullanılmasının daha uygun olduğunu düşündürdü5. Ek olarak, alveolar defekti yeniden yapılandırmak için yapılan 3 yıllık bir klinik çalışma, diş pulpasından MSC'lerin rejenere kemiğinin, daha yüksek matris yoğunluğuna sahip tamamen kompakt bir kemikten oluştuğunu, hm BMSC'lerin ise normal insan alveolar kemik yapısına benzer şekilde süngerimsi kemiği rejenere ettiğini buldu22. Sonuç olarak, hmBMSC'ler aynı embriyolojik kökene sahip olmaları ve üstün özellikleri nedeniyle maksillofasiyal rejenerasyon ve diğer hastalıklar için ideal terapötik kök hücrelerdi.
Bununla birlikte, mandibula femur ve iliumdan daha az kemik iliğine sahiptir, bu nedenle klinik kullanım için mandibuladan yeterli kemik iliği ve BMSC elde etmek önemlidir. İnsan iliak aspiratları, MSC'leri izole etmek için büyük miktarlarda kemik iliği elde edebilir. Araştırmacılar ayrıca MSC'leri elde etmek için mandibular aspiratları kullanırken, MSC'lerin mandibular aspiratlardan elde edilen ilk verimi, iliak aspiratlarınkinden üç kat daha düşüktü21. Yeterli mandibula iliği aspiratı toplamak için ek insizyonlara ihtiyaç duyuldu ve bu da ek cerrahi travma ekledi. Ayrıca, çalışmalar, MSC'lerin mandibula kemik çiplerinden elde edilen proliferatif potansiyelinin, mandibula iliği aspiratlarından elde edilenlerden daha üstün olabileceğini göstermiştir 8,21. Bu nedenle, bu çalışmada, MSC'leri izole etmek için atılan mandibula süngerimsi kemik çipleri kullanıldı. Mandibulanın her iki tarafı da sagital split ramus osteotomi veya mandibular açı küçültme plastisine dahil edildiğinden, hastalardan ekstra bir zarar vermeden yeterli miktarda mandibula iliği alabiliyoruz. Son zamanlarda, bilgisayar destekli teknoloji, cerrahi etkiyi iyileştirmek ve cerrahi komplikasyonları azaltmak için oral ve maksillofasiyal cerrahide yaygın olarak kullanılmaktadır23. Mandibula kemik iliği alımı sırasında mandibula ve sinirin yaralanmasını önlemek için, donörlerin mandibulasının 3D BT görüntüsü elde edildi ve donör bölgelerine karar vermek ve çalışmada cerrahi simülasyonu uygulamak için donörlerin cerrahi planlaması analiz edildi; Böylece, cerrahi komplikasyonların hiçbiri olmadı. Cerrahların bitişik yumuşak dokuyukorurken hassas osteotomiler yapmasına olanak tanıyan dokuya özgü bir cihaz olan ultrasonik osteotom bıçağı 24, yumuşak doku yaralanmasını önlemek ve elde edilen kemik iliği aktivitesini korumak için de kullanıldı.
Özetle, bu çalışma, diş ve çene dokularının hücre tedavilerinde kullanılabilecek yeterli insan mandibular MSC'lerini izole etmek ve kültürlemek için güvenilir, basit, güvenli ve ucuz bir protokolü tanımlamıştır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Çalışma, Çin Ulusal Doğa Bilimleri Vakfı (No.81903249) ve Shaanxi eyaleti Doğa Bilimleri Temel Araştırma Programı (No.2019JQ-701, No.2022JZ-50) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
Referanslar
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır