Method Article
ヒト下顎骨からの骨髄間葉系幹細胞の単離と培養
* これらの著者は同等に貢献しました
要約
本プロトコルは、全骨髄アドヒアランス法を使用してヒト下顎骨髄由来間葉系幹細胞を単離および培養するための効率的な手順を記載しています。培養細胞は、細胞増殖アッセイ、フローサイトメトリー、および多系統分化誘導によって同定されました。
要約
ヒト間葉系幹細胞(hMSC)は、骨の再生、免疫調節、難治性慢性疾患の治療に大きな可能性を示しています。最近、さまざまな起源がhMSCを取得することがわかりましたが、骨髄は依然として主要な供給源と考えられていました。異なるドナー骨部位由来の骨髄由来MSC(BMSC)は、微小環境要因により明確な特性を持っています。研究によると、顎顔面骨由来のBMSCは、長骨や腸骨稜由来のBMSCよりも増殖能力と骨形成能力が高い可能性があります。また、顎顔面BMSCは、顎顔面組織の幹細胞治療により適していると考えられていました。下顎骨、特に十分な骨髄を持つ上行するラマル領域は、BMSCを採取するための実行可能なドナーサイトでした。この研究では、ヒト下顎骨髄由来MSC(hmBMSC)を採取、分離、および培養するためのプロトコルについて説明しました。さらに、hmBMSCの免疫表現型検査、増殖アッセイ、および骨形成性、脂肪形成性、および軟骨形成性分化の in vitro 誘導を行い、培養細胞を同定した。このプロトコルを適用することで、研究者は、生物学的機能、微小環境への影響、および臨床応用のさらなる研究に必要な、十分な高品質のhmBMSCを成功裏に取得することができます。
概要
ヒト間葉系幹細胞(hMSC)は、中胚葉系の骨細胞、脂肪細胞、軟骨細胞、内胚葉系の肝細胞、膵臓細胞、外胚葉系の神経細胞など、さまざまな細胞種に分化できる多能性細胞です1。このように、hMSCは組織再生に大きな可能性を示しています。さらに、hMSCは、宿主組織内の微小環境を調節し、慢性難治性疾患を効果的に治療できる強力な免疫調節剤です2。したがって、hMSCは臨床研究の細胞治療に広く使用されています。したがって、高品質のhMSCを十分に入手し、便利に入手することが重要です。
hMSCが骨髄で最初に報告されて以来、脂肪組織、滑液、骨格筋、羊水、子宮内膜、歯科組織、臍帯1,3など、多くの代替MSC源が見つかっています。しかし、骨髄は依然としてほとんどの前臨床および臨床研究でhMSCの主要な供給源であり、骨髄由来MSC(BMSC)は他の供給源からのMSCを比較するための標準として採用されています4。何年もの間、腸骨稜または長骨(脛骨と大腿骨)は、骨髄を得るための最も人気のある解剖学的位置でした1,5。しかし、腸骨稜または長骨は、顎顔面骨と比較して異なる胚起源と発生パターンを持っています5,6。多くの臨床研究、実験室研究、および発生研究により、異なる起源のBMSCが部位特異的な特性を示し、移植されたBMSCは、レシピエント部位5,6,7,8,9に移植された後もドナー部位の特性を保持することが証明されました。発生起源の観点からは、上顎骨、下顎骨、象牙質、歯槽骨、歯髄、歯根膜靭帯などの顎顔面組織は、神経堤細胞からのみ発生します。対照的に、腸骨稜と長骨は中胚葉によって形成されます。さらに、下顎骨は膜内骨化によって作成され、軸状および付属肢の骨格は軟骨内骨化を受けます。さらに、腸骨稜や長骨と比較して、いくつかの臨床研究では、顎顔面骨髄由来のhMSCがより優れた細胞増殖活性と分化能力を持っていることが示されています6,8。したがって、顎顔面領域からのBMSCは、顎顔面組織の再生および顎顔面慢性難治性疾患の治療に適した選択肢であることが期待されます。
下顎骨は、咀嚼の力をロードできるように、その間に海綿骨髄がある2層の厚い皮質骨で構成されています。したがって、下顎骨、特に上行枝状領域は、通常、頭蓋顎顔面外科10において自家骨移植を受けるためのドナー部位として使用される。また、下顎矢状分割ラムス骨切り術や下顎角縮小形成術などの手術では、下顎皮質と海綿骨の一部を取り除いて、顔の輪郭を美しくする必要があります。これらの捨てられた海綿骨は、hMSCの潜在的なリソースになる可能性があります。しかし、高品質のヒト下顎骨髄由来MSC(hmBMSC)を迅速に分離し、培養するためのプロトコルについて説明した発表された研究はほとんどありませんでした。
本研究では、修正された全骨髄アドヒアランス法を使用して、hmBMSCの単離と培養のための信頼性と再現性のあるプロトコルを導入します。また、幹細胞は、MSCのフローサイトメトリー免疫表現型、増殖アッセイ、および多系統分化誘導によって同定されました。この標準的な手順を適用すると、研究者は高品質のヒト下顎骨髄由来MSCを得るのに役立つ可能性があり、これは生物学的機能、微小環境への影響、および臨床応用のさらなる研究において重要です。
プロトコル
ヒトの下顎骨標本を採取する手順は、第四軍事医科大学口腔病学部の倫理委員会によって承認されました。この研究は、1975年のヘルシンキ宣言の倫理ガイドラインに従って行われました。本研究のすべてのドナーに、起こりうるリスクと研究の目的について通知されました。ドナーの年齢は18歳から40歳で、性別による偏見はありませんでした。書面による同意は、すべての人間の参加者から得られました。
1. 手術の準備
- 適切な寄付者を選択します。
- 矢状分割後の下顎セットバック、ラムス骨切り術、下顎角縮小形成術などの手術を受ける予定の患者をドナーとして選択します。
- 保存液を調製します。
- 手術の前日に、滅菌済みで酵素を含まない50mLの遠心分離チューブに、1%ペニシリンとストレプトマイシンを含むリン酸緩衝生理食塩水(1x PBS)30mLを補給します。4°Cの冷蔵庫で保存してください。
- 手術当日は、保存液を入れた遠心チューブをアイスボックスに入れ、手術の1時間前に手術室に保管してください。
- 手術前日に、ハサミ、ピンセット、ナイフなどの器具を滅菌して骨髄を分離し、120°C、0.27MPaの圧力で20分間使用します。
- 最小必須培地アルファ(α-MEM)を10%ウシ胎児血清(FBS)および1%ペニシリンおよびストレプトマイシンと混合して、α-MEM培地を調製します。
- α-MEM培地を50 mMアスコルビン酸、10 mM β-グリセロールリン酸、および0.1 mMデキサメタゾンと混合して、骨形成分化培地を調製します(材料の表を参照)。
- α-MEM培地を1 mMデキサメタゾン、0.2 mMインドメタシン、10 μg/mLのインスリン、および0.5 mM 3-イソブチル-1-メチルキサンチン(IBMX)と混合して、脂肪形成分化培地Aを調製します( 材料の表を参照)。
- α-MEM培地と10 μg/mLのインスリンを混合して、脂肪原性分化培地Bを調製します。
- ダルベッコの改変イーグル培地を高グルコース(HG-DMEM)と100 nMのデキサメタゾン、100 g/mLのピルビン酸ナトリウム、25 mg/mLのビタミンC、40 mg/mLのプロリン、10 ng/mLのTGF-β3、および1%のITSと混合して、軟骨原性分化培地を調製します( 材料の表を参照)。
注:骨原性、脂肪原性、および軟骨原性の分化培地は、上記のように社内で調製できます。ただし、本研究では、同じキットの市販のキットが使用されました( 材料の表を参照)。
2.ヒト下顎骨標本の採取
- 手術前に、ドナーの3次元コンピュータ断層撮影スキャン画像と手術シミュレーション計画を慎重に検討してください(図1)。
- ドナーが手術で切除する予定で、ドナー部位として骨髄のある海綿骨が豊富である下顎部位を選択します。
- 手術前に患者を消毒し、ドレープしてください。
- 超音波骨切り刃( 材料の表を参照)を使用して、下歯槽神経損傷やドナー骨障害を回避し、下顎骨の選択されたドナー部位を切除します。
- 下顎骨標本をできるだけ早く保存液(ステップ1.2)に入れます。
- 骨標本を含む保存溶液をアイスボックスに入れ、実験室でMSCの単離が始まるまで待ちます。
注:MSCの単離は、細胞の生存率を維持するために、収穫後できるだけ早く開始する必要があります。MSCの単離がすぐに行えない場合は、骨検体を含む保存液をアイスボックスに保存するか、4°Cで最大2時間冷蔵することができます。
3. ヒトmBMSCの単離と培養
- 骨標本を保存溶液から取り出し、1%ペニシリンとストレプトマイシンを含む1x PBSに5分間、層流キャビネットのクリーンベンチに浸します。
注:このステップは、口が完全に無菌の環境ではないため、血栓と残留口腔液を洗い流し、微生物をさらに排除することを目的としています。細胞の単離と培養の前に、アルコールで手を洗って消毒し、使い捨ての滅菌手袋とマスクを着用してください。 - 滅菌済みの湿ったガーゼを使用して、骨表面の付着した軟部組織と血液のしみを洗浄します。
- 6 cmの滅菌培養皿に5 mLのα-MEM培地を入れます。
- 骨を滅菌培養皿に入れ、滅菌したナイフまたはハサミで小片(約2〜3 mm3 体積)に切ります。
注:指を切らないように、骨標本をピンセットで保持します。 - 1 mLの使い捨て滅菌シリンジを使用して、培養皿内のα-MEM培地を吸引します。
- α-MEM培地を入れたシリンジ針を、海綿骨標本片の骨髄腔の奥深くに挿入します。
- 骨髄を骨標本片のすべての側面から注射器で培養皿に少なくとも5〜10回洗い流します。
- すべての骨標本片が真っ白になるまで手順3.5〜3.7を繰り返して、できるだけ多くの骨髄が培地に洗い流されるようにします。
注意: 上記の3.1〜3.8のステップの合計操作時間は、氷上で30分以内に制御する必要があります。 - ピンセットですべての骨標本片を取り出して廃棄します。他の小さな断片は、孔径70 μmのセルフィルターを使用して除去します。
- 培養皿を柔らかく振って、洗い流した細胞を均一に分散させます。
- 培養皿を細胞インキュベーターに入れ、5% CO2の加湿雰囲気で細胞を37°Cで培養します。
- 培養3日目に、光学顕微鏡で細胞の形態と増殖状況を確認します。付着細胞や組織片のない培地の半分を取り除きます。3 mLの新鮮なα-MEM培地を加えます。
- 培養7日目に、すべての培地を取り出し、新鮮なα-MEM培地5 mLを加えます。
- その後、α-MEM培地を3日ごとにリフレッシュします。
- 細胞の形態や成長を毎日チェックしてください。
注:初代細胞培養物(P0)が70〜80日の培養後に70%〜80%のコンフルエントに達したら、細胞継代を実施します。
4. 細胞継代
- 70%〜80%のコンフルエントで、P0細胞のすべての培地を取り除きます。培養皿を1x PBSで2回優しく洗浄し、残留培地を洗浄します。
- 0.02%EDTAを含む0.25%トリプシン1mLを培養皿に加え、細胞を消化します。トリプシンが均一に分布するように、培養皿を柔らかく振ってください。培養皿を37°Cで3分間置きます。
- 顕微鏡で細胞を確認します。細胞の70%〜80%が収縮して丸くなったら、2 mLのα-MEM培地を追加して消化反応を止めます。
- ピペットで皿の表面を数回そっと吹き飛ばして、細胞を吹き飛ばします。
- 細胞懸濁液を15 mLの遠心チューブに移します。細胞懸濁液を200 x g で室温で5分間遠心分離します。
- 上清を捨て、細胞をα-MEM培地で再懸濁します。P0細胞を培養フラスコ(25 cm)に播種し、1:2の分割比で増殖します。最初の継代細胞はP1細胞と呼ばれた。
- P1細胞が70%〜80%のコンフルエンスに達したら、4.1〜4.6の手順に従って細胞継代を繰り返します。第2世代の細胞はP2細胞と呼ばれていました。
- 第3世代細胞継代後に膨張分割比を1:3に変更します。
- P3からP5の細胞を使用して、同定実験を行います。
5. フローサイトメトリー解析
- ステップ4.1-4.5に従って、0.25%トリプシンと0.02%EDTAを使用してP3からP5MSCを消化します。
- 上清を捨て、細胞を1x PBSに1 x 106 細胞/mLの濃度で再懸濁します。
- 細胞をマイクロ遠心チューブに移し、チューブあたり100 μLの細胞懸濁液を入れます。
- 免疫標識マウスモノクローナル抗ヒト抗体を微量遠心チューブに加えます。
注:本研究では、CD45に対するフィコエリトリン(PE)標識抗体、CD90、CD34、およびCD44に対するフルオレセイン-イソチオシアネート(FITC)標識抗体を使用しました4,11(材料の表を参照)、抗体の希釈はすべて1:100でした。抗体の希釈は、製造元の指示に従う必要があります。PBSはコントロールとして機能します。 - 抗体とPBSコントロールを室温で暗所で30分間インキュベートします。
- チューブを800 x g で室温で5分間遠心分離します。懸濁液を廃棄し、細胞を0.5mLの1x PBSに再懸濁します。この手順を 2 回繰り返します。
- チューブをフローサイトメーターにセットします( 材料の表を参照)。蛍光標識細胞数をフローサイトメーターでカウントし、最低10,000回のイベントを行います。
注:フローサイトメーターの細胞カウントプロセスは、免疫蛍光標識手順の直後に開始することをお勧めします。そうでない場合は、細胞を1%パラホルムアルデヒドに固定し、暗所で4°Cで保存し、24時間以内にプロセスを完了する必要があります。
6. 細胞増殖アッセイ
- P3細胞を使用して細胞増殖アッセイを実施します。ステップ4.1-4.5に従って、0.25%トリプシンでP3 MSCをダイジェストします。
- 上清を捨て、細胞をα-MEM培地で再懸濁します。
- 血球計算盤で細胞数をカウントし、ウェルあたり3 x 103 細胞の密度で96ウェル培養プレートに細胞を播種し、合計35ウェル、各カウント日(1日目、2日目、3列目、4頭、5頭、6日、7日目)に5ウェルにします。細胞の培地を3日ごとに更新します。
- 各計数日で、特定の計数日に特定の5つのウェルのα-MEM培地を廃棄し、100 μLの培地と10 μLのCCK-8溶液を加えます( 材料の表を参照)。37°Cで1時間インキュベートします。
- 培養プレートをマイクロプレート分光光度計( 材料表を参照)に置き、450 nmの波長で各計数日(計数日数7日)の5つのウェルの光学密度値を測定します。細胞を含まない培養培地の5ウェルをブランクとして使用します。
- すべてのウェルの光学密度値を記録し、各カウント日の5つのウェルの平均値と標準偏差を計算し、細胞成長曲線5,12をプロットします。
7.多系統の差別化
- 以下の手順で骨分化誘導を行います。
- 手順4.1-4.5に従って、P3細胞をトリプシンで消化します。6ウェルプレートに2 x 105 細胞/cm2 で細胞を播種します。ウェルあたり2.5 mLのα-MEM培地を添加します。
- 細胞が60%〜70%のコンフルエントに達したら、培養培地を骨形成誘導培地に変更します(ステップ1.5)。その後、誘導媒体を3日ごとに交換します。
- 導入後3日ごとに顕微鏡で細胞を確認します。細胞の形態を観察し、明らかな石灰化ノードを探します。
- 導入から7日後、アルカリホスファターゼ(ALP)染色を行い、細胞の石灰化を評価します。
- 1x PBSを使用して、細胞を2回優しく洗浄します。4%パラホルムアルデヒドを添加して、細胞を室温で30分間固定します。次に、1x PBSを使用して細胞を2回洗浄します。
- ALP染色溶液( 材料表を参照)を添加し、室温で10分間インキュベートします。
注:ALP染色液の種類によって、ダークグレー、レッド、ブルーなど、細胞の色が異なることがあります。このプロトコルでは、細胞を青色に染色しました。染色色が明らかでない場合、インキュベーション時間が長くなる可能性があります。ALP溶液染色キットの中には、有毒なものもあります。使用前に説明書をよく読み、実験中は手袋とマスクを着用し、使用後は手をよく洗ってください。 - 細胞を水で洗浄してALP染色反応を停止します。細胞内の青色の色素沈着顆粒を光学顕微鏡で観察し、写真を撮影します。Image Jソフトウェアを使用して、染色度を定量的に分析します。
- アリザリンレッド染色( 材料の表を参照)を行い、細胞の石灰化能力を評価します。
注:分化した細胞の明らかな石灰化ノードの形成は、通常、誘導の21日後に見ることができます。 - 1x PBSを使用して、細胞を2回優しく洗浄します。次に、4%パラホルムアルデヒドを添加して、細胞を室温で30分間固定します。
- 細胞を1x PBSで2回洗浄し、0.1%アリザリン赤色染色溶液( 材料表を参照)を加えて20分間インキュベートします。再度、細胞を1x PBSで2回洗浄します。
- 固定細胞の赤い結節を光学顕微鏡で観察し、培養細胞の骨形成分化によるカルシウム沈着物を示し、写真を撮影します。
- アリザリンレッドの量を定量するには、アリザリンレッド染色した細胞に10%塩化セチルピリジニウム(CPC、 材料表を参照)を添加し、室温で30分間インキュベートします。
- CPC溶液50μLを吸引し、マイクロプレート分光光度計を使用して540nmの波長で光学密度(OD)を測定します。
- 脂肪分化誘導を行います。
- 上記の手順(ステップ7.1)を使用して、6ウェルプレートにP3細胞を播種します。
- 細胞が80%〜90%のコンフルエントを得たら、培地を脂肪形成分化培地Aに変更します(ステップ1.6)。
- 細胞を脂肪分化培地Aと37°Cで、5%CO2 の加湿雰囲気で3日間インキュベートします。
- 誘導培地を脂肪形成分化培地Bに変更し(ステップ1.7)、1日間インキュベートします。
- 培地を脂肪原性分化培地Aに戻し、3日間インキュベートします。その後、ミディアムBと1日間交換します。顕微鏡で脂肪滴が見えるまで、このサイクルを3〜5回繰り返します。
注:脂質液滴は、誘導後約21日で見ることができます。 - 脂肪分化培地Bを使用して、さらに7日間細胞を培養します。すると、大きくて丸い脂肪滴を顕微鏡で観察することができます。ミディアムBを3日ごとに更新します。
- 誘導培地を取り出し、1x PBSを使用して細胞を優しく洗浄します。次に、4%パラホルムアルデヒドを添加して、細胞を室温で10分間固定します。
- 細胞を1x PBSで2回洗浄します。次に、細胞をオイルレッドO染色溶液(ウェルあたり1 mL、 材料表を参照)で15分間インキュベートします。再度、細胞を1x PBSで2回洗浄します。
- 細胞を顕微鏡下に置き、赤い脂肪滴を観察して、分化した細胞の脂肪形成を評価します。
- 軟骨分化誘導を行います。
- P3細胞を消化し、細胞番号5 x 105の15 mL遠心チューブに移します。
- チューブを250 x g で室温で4分間遠心分離します。上清を捨てるには、上部の溶液を慎重にデカントします。
- 0.5 mLの軟骨原性分化培地(ステップ1.8)をチューブに加えて細胞を再懸濁し、チューブを150 x g で室温で5分間再度遠心分離します。この手順を 2 回繰り返します。
- 遠心分離管のキャップを緩めて、空気交換を容易にします。チューブをインキュベーターに入れ、5% CO2の加湿雰囲気下で37°Cの軟骨形成分化培地0.5 mLで細胞を誘導します。
- 遠心分離管は、細胞がペレット化を開始するまで、24時間または48時間以内に取り外したり振ったりせずに安定させます。遠心分離チューブの底をフリックして、細胞ペレットを分化培地に懸濁します(ステップ1.5)。
- 軟骨形成分化培地を3日ごとにピペットで更新します。細胞ペレットを吸引することは避けてください。
- ペレットが直径2mmに降着するまで、少なくとも21日間細胞を誘導します。
- ペレットを1x PBSで洗浄し、4%パラホルムアルデヒドで30分間固定します。脱水およびパラフィン包埋13の後、ミクロトームを用いてペレットを厚さ3μmで切片化する( 材料表参照)。
- 切片をスライドガラスの上に置きます。スライドをアルシアンブルー溶液( 材料表を参照)で37°Cで1時間染色します。 汚れたスライドを水で洗います。スライドを光学顕微鏡の下に置き、軟骨組織を示す青色に染色された酸性ムコ多糖類の写真を撮ります。
結果
患者から下顎骨標本を無事に採取しました。そして、超音波骨切り刃で切断してから骨片を遠心チューブに入れるまでの時間は約5分です。下歯槽神経や歯根の損傷、感染症、血管破裂や出血、粘膜損傷、偶発的な骨折など、切除術中および切除術後に起こりうる合併症は一切発生しませんでした。hmBMSCは、汚染なしに培養、継代、分化に成功しました。
本研究では、初回培養後3日目に多くの接着細胞を顕微鏡で観察しました。7日目には、接着細胞のほとんどがすでに培養皿に付着していました。通常、培養細胞は、初期培養の7〜9日後に70%〜80%のコンフルエンスに達しました。継代後、P3細胞は通常、精製されたMSCであると考えられ、紡錘形、プラスチック接着性、および線維芽細胞様の形態を示しました(図2)。そして、同定実験はP3からP5の細胞で行いました。細胞増殖アッセイでは、培養3日目から細胞増殖速度が急速に増加し、6日目には増加速度が鈍化しました(図2)。
International Society for Cellular Therapy(国際細胞治療学会)の定義によると、MSCは特定の表面分子を正と負に発現しています。この研究では、培養細胞のフローサイトメトリー解析により、CD44、CD90の陽性発現、およびCD45、CD34の陰性発現が示され、これは定義4,11(図3)と一致しています。Multilineage differentiation ability実験では、培養細胞は強い骨形成能力、脂肪形成能力、軟骨形成能力を示しました。骨形成導入の7日後、顕微鏡下で細胞外マトリックスカルシウム沈着が現れました。骨形成導入の21日後、培養細胞は明らかな石灰化結節を示し、節はアリザリンレッド染色で赤く染色されました(図4)。脂肪形成については、脂肪形成誘導の21日後に、Oil-red-O染色によって赤く染色された丸い脂肪滴が細胞質に大量に蓄積されました(図4)。軟骨形成分化誘導の21日後、軟骨の裂孔を有する軟骨様組織を示す細胞ペレットスライドを青色に染色することができる(図4)。
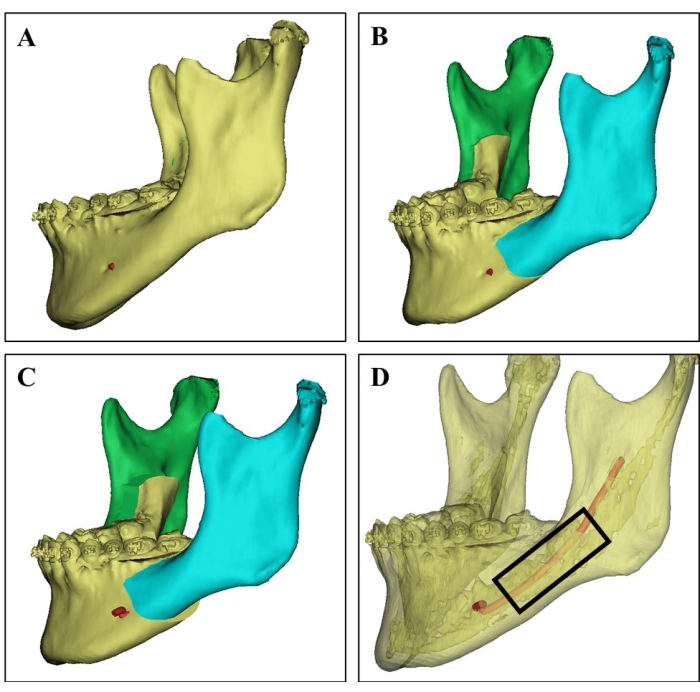
図1:3DCT画像によるドナー部位選択 (A)21歳女性患者からのドナー下顎骨の3DCT画像。(B) 下顎骨の両側矢状分割枝骨切り術の外科的シミュレーション。(C)外科的計画は、下顎骨の分割の後退を示しています。(D)皮質骨(半透明部分)、骨髄が豊富な海綿骨、下歯槽神経(赤)を示す3DCT画像 異なるCT値に基づいて、外科医がドナー部位を選択し、神経損傷を回避するように導くことができます。海綿骨チップは、黒い長方形の領域から採取されました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:P3ヒト下顎骨由来骨髄幹細胞(hmBMSC)の顕微鏡的形態と成長曲線 (A-C) P3 hmBMSCの紡錘形、可塑性接着性、および線維芽細胞様の形態(スケールバー=A、B、Cでそれぞれ200μm、100μm、50μm)。(D)細胞増殖曲線は、hmBMSCの増殖速度が培養3日目から急速に増加し、培養6日目に増加速度が鈍化したことを示した。この図の拡大版を表示するには、ここをクリックしてください。
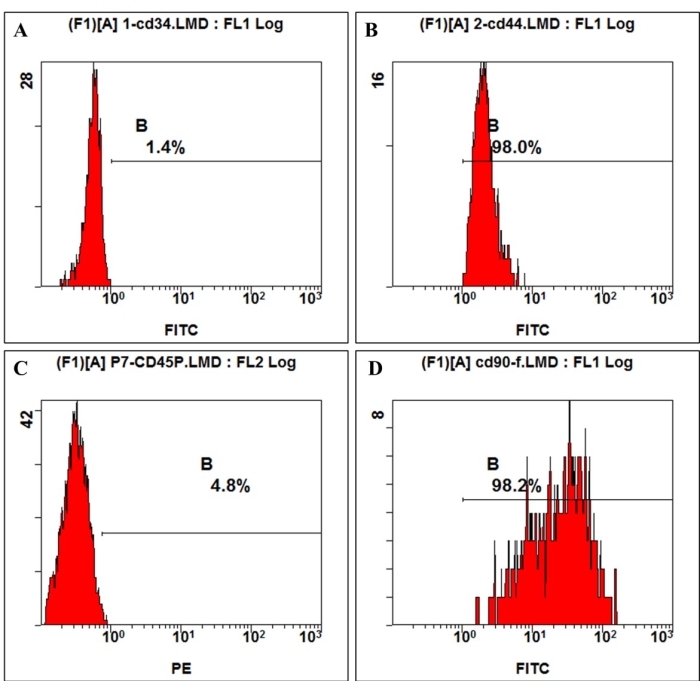
図3:hmBMSC上の細胞表面抗原発現は、フローサイトメトリーによって検出されました。 フローサイトメトリー解析の結果、hmBMSCはCD45(A)およびCD44(C)が陰性、CD44(B)およびCD90(D)が陽性であることが示されました。 この図の拡大版を表示するには、ここをクリックしてください。

図4:hmBMSCの骨形成性、脂肪形成性、および軟骨形成性の分化 (A)骨形成分化誘導なしの7日間の培養後のhmBMSCのALP染色(スケールバー= 100 μm)。(B)骨形成分化誘導の7日後のhmBMSCのALP染色(スケールバー= 100μm)。(C)ALP染色陽性領域(***P < 0.001)の定量結果。(D)骨形成分化を伴わないhmBMSCのアリザリン赤色染色(スケールバー= 100μm)。(E)明らかな石灰化結節の形成は、hmBMSCの骨形成分化の21日後に見られ、アリザリンレッド染色(スケールバー= 100μm)で赤く染色できます。(F)アリザリンレッド染色の定量的結果(***P < 0.001)。(G)脂肪原性分化のないhmBMSCのオイルレッドO染色(スケールバー= 50μm);(H)hmBMSCの脂肪分化の21日後に丸い脂肪滴が見られ、油性赤色O染色(スケールバー=50μm)で脂肪滴を赤く染色した。(I)アルシアンブルー染色は、軟骨形成分化誘導の21日後に陽性であった(スケールバー= 50μm)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
最近、hMSC療法は、多数の臨床試験で、組織再生および免疫機能障害疾患、全身性血液疾患、癌、または外傷などの多くの難治性疾患の治療において大きな有望性を示しています1,14,15,16,17。MSCのさまざまな供給源の中で、骨髄は依然として最も広く使用され、簡単にアクセスできる供給源です。我々は、ヒト下顎海綿骨チップを用いて、本プロトコールに記載の全骨髄付着法を用いてBMSCの培養に成功しました。現在までに、骨髄から幹細胞を単離するためのアプローチは、全骨髄アドヒアランス法、密度勾配遠心分離法、蛍光細胞選別法、磁気活性化細胞選別法10の4つの主要なアプローチがあります。全骨髄アドヒアランス法は、シンプルで操作が簡単で、安価で、大量の接着細胞を得ることができます。しかし、この方法の限界は、造血細胞や線維芽細胞と混合された初代培養BMSCの純度が低いことでした。初代細胞の培養液を定期的にリフレッシュした後、非接着性造血細胞を廃棄培地とともに廃棄した。また、線維芽細胞は細胞継代によって除去することができ、P3細胞は高度に精製されたBMSCでした。そのため、P0からP2の細胞は細胞治療に使うことができず、幹細胞の精製に余分な時間が必要でした。蛍光細胞選別法および磁気活性化細胞選別法を使用すると、より精製されたBMSCを得ることができるが、2つの方法は高価であり、選択時間が長いと細胞生存率が損なわれる可能性がある11。培養細胞がMSCであることを証明するために、我々は、国際細胞治療学会のMesenchymal and Tissue Stem Cell Committeeによって提案されたヒトMSCの定義を参照したが、これには可塑性接着性、CD45、CD90などの特定の表現型の陽性および陰性の発現、および多系統分化能力が含まれていた18。
ほとんどの研究では、大腿骨と腸骨稜がBMSCの主な供給源であり、下顎骨や上顎骨などの顎顔面骨と比較して9,16。しかし、最近の研究におけるhBMSCの部位特異的特性理論は、異なる骨由来のhBMSCが分化能、増殖活性、骨形成、および免疫において異なる特性を持っていることを示しました6,8。部位特異的な違いは、異なる発生学的起源、各骨格部位での機能的要求への適応、微小環境、局所的な血管供給、ホルモンの影響などに関連している可能性があります。さらに、研究によると、移植された腸骨は、骨移植後6か月以内に顎骨よりも急速な垂直損失を示しました8。それ以外の場合、研究によると、下顎骨髄からのMSCの増殖活性は、腸骨骨髄5,8,19,20からの増殖活性よりも優れていることがわかっています。そして、この増殖活動の違いは、下顎骨が腸骨5,6,8よりも血液供給が多く、骨代謝回転率が速いという特徴に起因していました。また、下顎骨のBMSCは大腿骨のBMSCよりもRunx-2およびOCNを発現し、下顎骨のBMSCの骨形成能力は大腿骨および腸骨のBMSCと同等またはそれ以上であることも明らかになりました5,19,21。また、hmBMSCのチタン能力への付着は、大腿骨のBMSCよりも強いことがわかり、hmBMSCが口腔インプラント学での使用により適していることが示唆されました5。さらに、歯槽欠損を再建するための3年間の臨床研究では、歯髄からのMSCの再生骨は、より高いマトリックス密度の完全にコンパクトな骨で構成されていたのに対し、hm BMSCsは正常なヒト肺胞骨構造体と同様に海綿状骨を再生したことがわかりました22。結論として、hmBMSCは、同じ発生学的起源とその優れた特性により、顎顔面再生やその他の疾患にとって理想的な治療用幹細胞でした。
しかし、下顎骨は大腿骨や腸骨に比べて骨髄が少ないため、臨床使用のためには下顎骨から十分な骨髄とBMSCを得ることが重要です。研究者はまた、下顎吸引物を使用してMSCを得たが、下顎吸引物からのMSCの初期収量は腸骨吸引物のそれよりも3倍低かった21。十分な下顎骨髄吸引物を採取するためには、追加の切開が必要であり、追加の外科的外傷が追加された。さらに、研究は、下顎骨チップからのMSCの増殖能力が下顎骨髄吸引物からのものよりも優れている可能性があることを示しています8,21。そこで、本研究では、廃棄された下顎骨の海綿骨チップを用いてMSCを単離した。下顎骨の両側が矢状分割枝骨切り術または下顎角縮小形成術に含まれていたため、患者から余分な害を及ぼすことなく十分な下顎骨髄を得ることができます。最近、コンピューター支援技術は、外科的効果を改善し、外科的合併症を減らすために、口腔外科および顎顔面外科で広く使用されています23。下顎骨骨髄採取中の下顎骨と神経の損傷を避けるために、ドナーの下顎骨の3DCT画像を取得し、ドナーの手術計画を分析してドナー部位を決定し、研究に外科的シミュレーションを実装しました。したがって、外科的合併症は一切発生しませんでした。超音波骨切り刃は、外科医が隣接する軟組織を保護しながら正確な骨切り術を行うことを可能にする組織特異的な装置であり、また、軟部組織の損傷を回避し、得られた骨髄活性を維持するためにも使用された。
要約すると、この研究では、歯科および顎顔面組織の細胞療法に使用できる適切なヒト下顎MSCを分離および培養するための、信頼性が高く、シンプルで、安全で、安価なプロトコルについて説明しました。
開示事項
著者は何も開示していません。
謝辞
本研究は、中国国家自然科学基金会(No.81903249)および陝西省自然科学基礎研究プログラム(No.2019JQ-701、No.2022JZ-50)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
参考文献
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved