Method Article
בידוד ותרבית של תאי גזע מזנכימליים של מח עצם מהלסת התחתונה האנושית
* These authors contributed equally
In This Article
Summary
הפרוטוקול הנוכחי מתאר הליך יעיל לבידוד ותרבות של תאי גזע מזנכימליים שמקורם במח עצם הלסת התחתונה האנושית בשיטת היצמדות מח העצם השלם. התאים המתורבתים זוהו על ידי מבחני התפשטות תאים, ציטומטריית זרימה ואינדוקציה של התמיינות רב-שושלתית.
Abstract
תאי גזע מזנכימליים אנושיים (hMSCs) הראו פוטנציאל גדול בהתחדשות עצם, אפנון חיסוני וטיפול במחלות כרוניות עמידות. מקורות שונים נמצאו להשגת hMSCs לאחרונה, בעוד שמח עצם עדיין נחשב למקור העיקרי. ל-MSCs שמקורם במח עצם (BMSCs) מאתרי עצמות תורמים שונים יש מאפיינים מובהקים עקב גורמים מיקרו-סביבתיים. מחקרים הראו כי BMSCs מעצם הלסת עשויים להיות בעלי יכולות שגשוג ואוסטאוגניות גדולות יותר מאשר BMSCs מעצמות ארוכות או מסמל הכסל. ו-BMSCs פנים ולסתות נחשבו מתאימים יותר לטיפול בתאי גזע ברקמות הלסת. הלסת התחתונה, במיוחד אזור הרמאל העולה עם מח מספיק, הייתה אתר תורם אפשרי לקטיף BMSCs. מחקר זה תיאר פרוטוקול לקציר, בידוד ותרבות MSCs שמקורם במח עצם הלסת התחתונה האנושית (hmBMSCs). יתר על כן, בוצע אימונופנוטיפ של hmBMSCs, מבחני שגשוג ואינדוקציה חוץ גופית של התמיינות אוסטאוגנית, אדיפוגנית וכונדרוגנית כדי לזהות את התאים המתורבתים. יישום פרוטוקול זה יכול לעזור לחוקרים להשיג בהצלחה מספיק hmBMSCs באיכות גבוהה, הנחוצים למחקרים נוספים של התפקוד הביולוגי, ההשפעות המיקרו-סביבתיות והיישומים הקליניים.
Introduction
תאי גזע מזנכימליים אנושיים (hMSCs) הם תאים מולטיפוטנטיים שניתן להתמיין לסוגי תאים שונים, כגון אוסטאוציטים, אדיפוציטים וכונדרוציטים משושלת מזודרמלית, הפטוציטים ולבלב משושלת אנדודרמלית, ונוירוקיטים משושלת אקטודרמלית1. לפיכך, hMSCs הראו פוטנציאל גדול בהתחדשות רקמות. יתר על כן, hMSCs הם אימונומודולטורים רבי עוצמה שיכולים לווסת את המיקרו-סביבה ברקמות המארח ולטפל ביעילות במחלות עקשן כרוניות2. לכן, hMSCs היו בשימוש נרחב בטיפול תאי במחקרים קליניים. כתוצאה מכך, חשוב להשיג מספיק hMSCs באיכות גבוהה בצורה נוחה בהצלחה.
מאז שדווח לראשונה על hMSCs במח העצם, נמצאו מקורות MSCs חלופיים רבים, כגון רקמת שומן, נוזל סינוביום, שריר השלד, מי שפיר, רירית הרחם, רקמות שיניים וחבל הטבור 1,3. עם זאת, מח עצם נותר המקור העיקרי ל-hMSCs ברוב המחקרים הפרה-קליניים והקליניים, ו-MSCs שמקורם במח עצם (BMSCs) נלקחים כסטנדרט להשוואה בין MSCs ממקורות אחרים4. במשך שנים, פסגת הכסל או העצמות הארוכות (השוקה ועצם הירך) היו המיקומים האנטומיים הפופולריים ביותר להשגת מח עצם 1,5. עם זאת, לפסגת הכסל או לעצמות הארוכות יש מקורות עובריים ודפוסי התפתחות שונים בהשוואה לעצמות הלסת 5,6. מחקרים קליניים, מעבדתיים והתפתחותיים רבים הוכיחו כי BMSCs ממקורות שונים הראו תכונות ספציפיות לאתר, וה-BMSCs המושתלים שומרים על תכונות אתר התורם לאחר ההשתלה באתר המקבל 5,6,7,8,9. מנקודת מבט של מוצא התפתחותי, רקמות הלסת והלסת, כגון הלסת העליונה, הלסת התחתונה, הדנטין, עצם המכתשית, מוך השן והרצועה החניכיים, נובעות אך ורק מתאי הפסגה העצבית. לעומת זאת, פסגת הכסל והעצמות הארוכות נוצרות על ידי מזודרם. בנוסף, הלסתות התחתונות נוצרות על ידי התעצמות פנימית, בעוד שלדים ציריים ותוספתנים עוברים אוסיפיקציה אנדוכונדרלית. יתר על כן, בהשוואה לפסגת הכסל והעצמות הארוכות, כמה מחקרים קליניים הראו כי ל-hMSCs שמקורם במח הלסת הייתה פעילות שגשוג תאית טובה יותר ויכולת התמיינות 6,8. לכן, BMSCs מאזורי הלסתות צפויים להיות בחירה טובה יותר עבור התחדשות רקמת הלסת וטיפול במחלות כרוניות עמידות ללסתות ולסתות.
הלסת התחתונה מורכבת מעצמות קליפת המוח העבות בשתי שכבות וביניהן מח עצם מבטל כך שהיא יכולה להעמיס את כוח הלעיסה. לכן, הלסת התחתונה, במיוחד אזור הרמל העולה, משמשת בדרך כלל כאתר תורם להשגת השתלות עצם אוטולוגיות בניתוחי גולגולת ולסת10. ובניתוחים כמו אוסטאוטומיה של ראמוס מפוצל סגיטלי ופלסטיקה להפחתת זווית הלסת התחתונה, יש להסיר חלקים מקליפת המוח של הלסת התחתונה ועצם מבטלת כדי להשיג מתאר פנים נעים. העצמות המבטלות שהושלכו יכולות להיות משאב פוטנציאלי עבור hMSCs. עם זאת, מעט מחקרים שפורסמו תיארו את הפרוטוקול לבידוד מהיר ולתרבית MSCs באיכות גבוהה שמקורם במח עצם הלסת התחתונה האנושית (hmBMSCs).
המחקר הנוכחי משתמש בשיטת היצמדות שונה של מח עצם שלם כדי להציג פרוטוקול אמין וניתן לשחזור לבידוד ותרבית של hmBMSCs. ותאי הגזע זוהו על ידי אימונופנוטיפ ציטומטרי זרימה של MSCs, מבחני התפשטות ואינדוקציה של התמיינות רב-שושלתית. יישום הליך סטנדרטי זה עשוי לעזור לחוקרים להשיג MSCs איכותיים שמקורם במח עצם הלסת התחתונה, דבר חשוב במחקרים נוספים על התפקוד הביולוגי, ההשפעות המיקרו-סביבתיות והיישומים הקליניים.
Protocol
הנוהל לקצירת דגימות עצם לסת תחתונה אנושית אושר על ידי ועדת האתיקה של בית הספר לסטומטולוגיה, האוניברסיטה הצבאית הרביעית לרפואה המחקר עקב אחר הקווים המנחים האתיים של הצהרת הלסינקי משנת 1975. כל התורמים למחקר הנוכחי קיבלו מידע על הסיכונים האפשריים ועל מטרות המחקר. גיל התורמים נע בין 18-40 שנים, ולא הייתה הטיה מגדרית. הסכמה בכתב התקבלה מכל המשתתפים האנושיים.
1. הכנה לניתוח
- בחר את התורם המתאים.
- בחר את המטופלים כתורמים המתכננים לעבור ניתוחים כגון נסיגה בלסת התחתונה בעקבות אוסטאוטומיה של ראמוס מפוצל סגיטלי ופלסטיקה להפחתת זווית הלסת התחתונה.
- הכן את תמיסת השימור.
- תוסף 30 מ"ל של מי מלח פוספט (1x PBS) עם 1% פניצילין וסטרפטומיצין בצינור צנטריפוגה סטרילי ונטול אנזימים של 50 מ"ל ביום שלפני הניתוח. אחסן אותו במקרר בחום של 4 מעלות צלזיוס.
- ביום הניתוח, הכניסו את צינור הצנטריפוגה עם תמיסת השימור לקופסת קרח ושמרו אותה בחדר הניתוח שעה לפני הניתוח.
- עקר את המכשירים כדי לבודד את מח העצם ביום שלפני הניתוח, כולל מספריים, פינצטה וסכינים ב-120 מעלות צלזיוס ולחץ של 0.27 מגה פיקסל למשך 20 דקות.
- הכן מדיום תרבית α-MEM על ידי ערבוב של מדיום אלפא חיוני מינימלי (α-MEM) עם 10% סרום בקר עוברי (FBS) ו-1% פניצילין וסטרפטומיצין.
- הכן מדיום התמיינות אוסטאוגני על ידי ערבוב מדיום תרבית α-MEM עם 50 מ"מ חומצה אסקורבית, 10 מ"מ β-גליצרול פוספט ו-0.1 מ"מ דקסמתזון (ראה טבלת חומרים).
- הכן מדיום התמיינות אדיפוגני A על ידי ערבוב מדיום תרבית α-MEM עם 1 מ"מ דקסמתזון, 0.2 מ"מ אינדומתצין, 10 מיקרוגרם/מ"ל אינסולין ו-0.5 מ"מ 3-איזובוטיל-1-מתילקסנטין (IBMX) (ראה טבלת חומרים).
- הכן מדיום התמיינות אדיפוגני B על ידי ערבוב מדיום תרבית α-MEM עם 10 מיקרוגרם/מ"ל אינסולין.
- הכן מדיום התמיינות כונדרוגני על ידי ערבוב מדיום הנשר השונה של Dulbecco עם גלוקוז גבוה (HG-DMEM) ו-100 ננומטר של דקסמתזון, 100 גרם/מ"ל של נתרן פירובט, 25 מ"ג/מ"ל של ויטמין C, 40 מ"ג/מ"ל של פרולין, 10 ננוגרם/מ"ל של TGF-β3 ו-1% של ITS (ראה טבלת חומרים).
הערה: ניתן להכין את מדיום ההתמיינות האוסטיאוגני, האדיפוגני והכונדרוגני בבית, כפי שהוזכר לעיל. עם זאת, נעשה שימוש בערכות זמינות מסחרית לאותו הדבר (ראה טבלת חומרים) במחקר הנוכחי.
2. קצירת דגימת עצם לסת תחתונה אנושית
- לפני הניתוח, למד בקפידה את תמונות הסריקה הטומוגרפית הממוחשבת התלת מימדית ואת תכנון הסימולציה הכירורגית של התורמים (איור 1).
- בחר את אתר הלסת התחתונה שהתורם מתכנן להסיר בניתוח והוא עשיר בעצם מבטלת עם מח עצם כאתר התורם.
- יש לחטא ולעטוף את המטופל לפני הניתוח.
- כריתה של אתר התורם הנבחר של הלסת התחתונה באמצעות להב האוסטאוטום האולטראסוני (ראה טבלת חומרים), הימנעות מפגיעה בעצב המכתשית התחתונה ופגיעה בעצם התורם.
- הכניסו את דגימות עצם הלסת התחתונה לתמיסת השימור (שלב 1.2) בהקדם האפשרי.
- הניחו את תמיסת השימור עם דגימות עצם בקופסת קרח עד לתחילת הבידוד של MSCs במעבדה.
הערה: יש להתחיל בבידוד של MSCs בהקדם האפשרי לאחר הקציר כדי לשמר את כדאיות התאים. אם לא ניתן לבצע את הבידוד של MSCs באופן מיידי, ניתן לאחסן את תמיסת השימור עם דגימות העצם בקופסת קרח או בקירור בטמפרטורה של 4 מעלות צלזיוס למשך שעתיים לכל היותר.
3. בידוד וטיפוח של mBMSCs אנושיים
- הוציאו את דגימות העצם מתמיסת השימור וטבלו אותן ב-1x PBS עם 1% פניצילין וסטרפטומיצין למשך 5 דקות על ספסל נקי של ארון הזרימה הלמינרית.
הערה: שלב זה נועד לשטוף את קריש הדם ושאריות נוזלי הפה ולחסל עוד יותר את המיקרואורגניזם מכיוון שהפה אינו סביבה סטרילית לחלוטין. לפני בידוד התאים וגידולם, יש לשטוף ולחטא ידיים באלכוהול וללבוש כפפות ומסכות סטריליות חד פעמיות. - נקה את הרקמה הרכה והדם הדביקים על פני העצם באמצעות גזה רטובה סטרילית.
- ממלאים צלחת תרבות סטרילית בגודל 6 ס"מ ב -5 מ"ל מדיום תרבות α-MEM.
- הכניסו את העצם לתבנית התרבות הסטרילית וחתכו אותה לחתיכות קטנות (כמעט 2-3 מ"מ3 נפח) בעזרת סכין מעוקרת או מספריים.
הערה: החזק את דגימות העצם בפינצטה כדי למנוע חתך באצבע. - שאפו מדיום תרבית α-MEM בצלחת התרבות עם מזרק סטרילי חד פעמי בנפח 1 מ"ל.
- הכנס את מחט המזרק עם מדיום תרבית α-MEM עמוק לתוך חלל מח העצם של חלקי דגימת העצם המבטלים.
- שטפו את מח העצם לתוך צלחת התרבות עם המזרק מכל צידי חתיכות דגימת העצם, לפחות 5-10 פעמים לכל צד.
- חזור על שלבים 3.5-3.7 עד שכל חלקי דגימת העצם הופכים ללבנים טהורים כדי להבטיח שכמה שיותר מח עצם נשטף למדיום התרבית.
הערה: יש לשלוט על זמן הפעולה הכולל של השלבים לעיל בין 3.1-3.8 תוך 30 דקות על קרח. - הסר והשליך את כל חלקי דגימת העצם בעזרת פינצטה. הסר שברים קטנים אחרים באמצעות מסנן תאים בגודל נקבוביות של 70 מיקרומטר.
- נענע את צלחת התרבות ברכות כדי שהתאים הסמוקים יתפזרו באופן שווה.
- מניחים את צלחת התרבות בחממת תאים ומרפסים את התאים בטמפרטורה של 37 מעלות צלזיוס באווירה לחה של 5% CO2.
- ביום השלישי לתרבית, בדוק את מורפולוגיה התא ומצב הצמיחה במיקרוסקופ אור. הסר מחצית ממדיום התרבות ללא תאים דבקים ושבר רקמה; הוסף 3 מ"ל של מדיום תרבית α-MEM טרי.
- ביום התרבות 7, הסר את כל מדיום התרבות והוסף 5 מ"ל של מדיום תרבית α-MEM טרי.
- לאחר מכן, רענן את מדיום תרבית α-MEM כל 3 ימים.
- בדוק את המורפולוגיה והצמיחה של התא מדי יום.
הערה: כאשר תרביות התאים הראשוניות (P0) מגיעות למפגש של 70%-80% לאחר 7-10 ימי תרבית, בצע את מעבר התאים.
4. מעבר תאים
- במפגש של 70%-80%, הסר את כל מדיום התרבות של תאי P0. שטפו את כלי התרבות בעדינות עם 1x PBS פעמיים כדי לנקות את מדיום התרבות הנותר.
- הוסף 1 מ"ל של 0.25% טריפסין עם 0.02% EDTA לצלחת התרבית כדי לעכל את התאים. מנערים את צלחת התרבות ברכות כדי להבטיח שהטריפסין יתפזר באופן שווה. מניחים את צלחת התרבות בחום של 37 מעלות צלזיוס למשך 3 דקות.
- בדוק את התאים מתחת למיקרוסקופ. כאשר 70%-80% מהתאים מתכווצים ומתעגלים, הוסיפו 2 מ"ל של מדיום תרבית α-MEM כדי לעצור את תגובת העיכול.
- נשפו בעדינות את משטח הכלים מספר פעמים בעזרת פיפטה כדי לפוצץ את התאים.
- העבירו את מתלה התא לצינור צנטריפוגה של 15 מ"ל. צנטריפוגה את מתלה התא ב -200 x גרם למשך 5 דקות בטמפרטורת החדר.
- השליכו את הסופרנטנט והשעו מחדש את התאים עם מדיום תרבית α-MEM. תאי זרע P0 בצלוחיות תרבית (25 ס"מ) להרחבה עם יחס פיצול של 1:2. תאי המעבר הראשונים נקראו תאי P1.
- כאשר תאי P1 מגיעים למפגש של 70%-80%, חזור על מעבר התאים לפי השלבים מ-4.1-4.6. תאי הדור השני נקראו תאי P2.
- שנה את יחס פיצול ההרחבה ל-1:3 לאחר מעבר התא מהדור השלישי.
- השתמש בתאי P3 עד P5 לביצוע ניסויי זיהוי.
5. אנליזה ציטומטרית של זרימה
- עכל MSCs P3 עד P5 באמצעות 0.25% טריפסין עם 0.02% EDTA, בצע את שלבים 4.1-4.5.
- השליכו את הסופרנטנט והשעו מחדש את התאים ב-1x PBS בריכוז של 1 x 106 תאים/מ"ל.
- העבירו את התאים לצינורות מיקרו-צנטריפוגה עם 100 מיקרוליטר של תרחיף התא לכל צינור.
- הוסף נוגדנים חד-שבטיים אנטי-אנושיים של עכברים עם תווית חיסונית לתוך צינורות המיקרו-צנטריפוגה.
הערה: במחקר הנוכחי, נעשה שימוש בנוגדנים מצומדים של Phycoerythrin (PE) כנגד CD45, נוגדן מצומד פלואורסצאין-איזותיוציאנט (FITC) כנגד CD90, CD34 ו-CD44 4,11 (ראה טבלת חומרים), והדילולים של הנוגדנים היו כולם 1:100. דילול הנוגדנים צריך לעקוב אחר הוראות היצרן. PBS תשמש כבקרה. - דגרו על הנוגדנים ובקרת PBS בטמפרטורת החדר בחושך למשך 30 דקות.
- צנטריפוגה את הצינורות ב 800 x גרם למשך 5 דקות בטמפרטורת החדר. השלך את המתלה והשהה מחדש את התאים ב-0.5 מ"ל של 1x PBS. חזור על שלב זה פעמיים.
- טען את הצינורות לתוך ציטומטר הזרימה (ראה טבלת חומרים). ספור את מספרי התאים המסומנים בקרינה באמצעות ציטומטר זרימה עם מינימום של 10,000 אירועים.
הערה: עדיף להתחיל בתהליך ספירת התאים של ציטומטר הזרימה מיד לאחר הליך תיוג האימונופלואורסצנטי. אם לא, יש לקבע את התאים ב-1% פרפורמלדהיד, לאחסן ב-4 מעלות צלזיוס בחושך, ולסיים את התהליך תוך 24 שעות.
6. בדיקת התפשטות תאים
- השתמש בתאי P3 כדי לבצע את בדיקת התפשטות התאים. יש לעכל תרופות P3 MSC עם 0.25% טריפסין, לפי שלבים 4.1-4.5.
- השליכו את הסופרנטנט והשעו מחדש את התאים עם מדיום תרבית α-MEM.
- ספרו את מספר התאים בעזרת המוציטומטר, וזרעו את התאים על צלחות תרבית של 96 בארות בצפיפות של 3 x 103 תאים לבאר, סה"כ 35 בארות, 5 בארות לכל יום ספירה (ביום 1, 2, 3, 4, 5, 6, 7). רענן את מדיום התרבות של התאים כל 3 ימים.
- בכל יום ספירה, השליכו את מדיום התרבית α-MEM של חמש הבארות המסוימות ליום הספירה המסוים, ולאחר מכן הוסיפו 100 מיקרוליטר של מדיום תרבית ו-10 מיקרוליטר של תמיסת CCK-8 (ראה טבלת חומרים). יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- הנח את לוחות התרבות בספקטרופוטומטר מיקרו-פלטות (ראה טבלת חומרים) ומדוד את ערך הצפיפות האופטית של חמש בארות לכל יום ספירה (סה"כ 7 ימי ספירה) באורך גל של 450 ננומטר. השתמש בחמש בארות של מדיום התרבות ללא תאים כחסר.
- רשום את ערך הצפיפות האופטית של כל באר, חשב את הערך הממוצע וסטיית התקן של חמש בארות עבור כל יום ספירה, ושרטט את עקומת צמיחת התאים 5,12.
7. בידול רב שושלות
- בצע אינדוקציה של התמיינות אוסטאוגנית לפי השלבים הבאים.
- עכל את תאי P3 עם טריפסין לפי שלבים 4.1-4.5. זרעו את התאים בגודל 2 x 105 תאים / ס"מ2 בצלחת של 6 בארות. הוסף 2.5 מ"ל מדיום תרבית α-MEM לבאר.
- כאשר התאים מגיעים למפגש של 60%-70%, שנה את מדיום התרבות למדיום האינדוקציה האוסטיאוגני (שלב 1.5). לאחר מכן, החלף את אמצעי האינדוקציה כל 3 ימים.
- בדוק את התאים במיקרוסקופ כל 3 ימים לאחר הזירוז. התבונן במורפולוגיה של התא וחפש צמתי מינרליזציה ברורים.
- לאחר 7 ימים של אינדוקציה, בצע את צביעת הפוספטאז האלקליין (ALP) כדי להעריך את הסתיידות התאים.
- השתמש ב-1x PBS כדי לשטוף את התאים פעמיים בעדינות. הוסף 4% פרפורמלדהיד כדי לתקן את התאים בטמפרטורת החדר למשך 30 דקות. לאחר מכן, השתמש ב-PBS 1x כדי לשטוף את התאים פעמיים.
- הוסף תמיסת צביעה ALP (ראה טבלת חומרים) ודגירה בטמפרטורת החדר למשך 10 דקות.
הערה: סוגים שונים של תמיסת צביעה ALP יכולים להכתים את התאים בצבעים שונים, כגון אפור כהה, אדום וכחול. בפרוטוקול זה, התאים נצבעו בכחול. ניתן להאריך את זמן הדגירה אם צבע הצביעה אינו ברור. חלק מערכות הצביעה של תמיסת ALP עשויות להיות רעילות; קרא בעיון את ההוראות לפני השימוש, ללבוש כפפות ומסכה במהלך הניסוי ולשטוף ידיים בזהירות לאחר השימוש. - שטפו את התאים במים כדי לעצור את תגובת הצביעה של ALP. התבונן בגרגירים פיגמנטיים כחולים בתאים תחת מיקרוסקופ אור וצלם את התמונות. השתמש בתוכנת Image J כדי לנתח כמותית את דרגת הצביעה.
- בצע צביעה אדומה של אליזרין (ראה טבלת חומרים) כדי להעריך את יכולת המינרליזציה של התאים.
הערה: ניתן לראות היווצרות בולטת של בלוטות מינרליזציה של התאים הממוינים בדרך כלל לאחר 21 יום של אינדוקציה. - השתמש ב-1x PBS כדי לשטוף את התאים פעמיים בעדינות. לאחר מכן, הוסף 4% פרפורמלדהיד כדי לתקן את התאים בטמפרטורת החדר למשך 30 דקות.
- שטפו את התאים עם 1x PBS פעמיים, הוסיפו תמיסת צביעה אדומה של 0.1% אליזרין (ראו טבלת חומרים) ודגרו למשך 20 דקות. שוב, שטפו את התאים עם 1x PBS פעמיים.
- התבונן בגושים האדומים בין תאים קבועים תחת מיקרוסקופ אור, המעיד על מרבצי סידן של התמיינות אוסטאוגנית של תאים מתורבתים, וצלם את התמונות.
- כדי לכמת את כמות האליזרין האדום, הוסף 10% צטילפירידיניום כלוריד (CPC, ראה טבלת חומרים) לתאים המוכתמים באדום אליזרין ודגר בטמפרטורת החדר למשך 30 דקות.
- שאפו 50 מיקרוליטר מתמיסת ה-CPC ומדדו את הצפיפות האופטית (OD) באורך גל של 540 ננומטר באמצעות ספקטרופוטומטר מיקרו-פלטה.
- בצע אינדוקציה של התמיינות אדיפוגנית.
- זרעו את תאי ה-P3 בצלחת של 6 בארות באמצעות ההליך המתואר לעיל (שלב 7.1).
- כאשר התאים מקבלים מפגש של 80%-90%, שנה את מדיום התרבית למדיום התמיינות אדיפוגני A (שלב 1.6).
- דגרו את התאים עם מדיום התמיינות אדיפוגני A בטמפרטורה של 37 מעלות צלזיוס באווירה לחה של 5% CO2 למשך 3 ימים.
- שנה את מדיום האינדוקציה למדיום התמיינות אדיפוגני B (שלב 1.7), ודגר למשך יום אחד.
- שנה את המדיום בחזרה למדיום התמיינות אדיפוגני A ודגר למשך 3 ימים. לאחר מכן, החלף ב-B בינוני למשך יום אחד. חזור על מחזור זה 3-5 פעמים עד שניתן לראות טיפות שומן במיקרוסקופ.
הערה: ניתן לראות את טיפות השומנים כ-21 יום לאחר האינדוקציה. - השתמש במדיום ההתמיינות האדיפוגני B כדי לתרבית התאים למשך 7 ימים נוספים; לאחר מכן, ניתן לראות טיפות שומן גדולות ועגולות מתחת למיקרוסקופ. רענן את ה-B הבינוני כל 3 ימים.
- הסר את מדיום האינדוקציה והשתמש ב-1x PBS כדי לשטוף את התאים בעדינות. לאחר מכן, הוסף 4% פרפורמלדהיד כדי לתקן את התאים בטמפרטורת החדר למשך 10 דקות.
- שוטפים את התאים עם 1x PBS פעמיים; לאחר מכן, דגרו את התאים בתמיסת צביעה O אדומה בשמן (1 מ"ל לבאר, ראה טבלת חומרים) למשך 15 דקות. שוב, שטפו את התאים עם 1x PBS פעמיים.
- הניחו את התאים מתחת למיקרוסקופ, והתבוננו בטיפות השומנים האדומות כדי להעריך את האדיפוגנזה של תאים מובחנים.
- בצע אינדוקציה של התמיינות כונדרוגנית.
- עכל והעביר את תאי P3 לצינור צנטריפוגה של 15 מ"ל עם מספר תאים של 5 x 105.
- צנטריפוגה את הצינור ב-250 x גרם למשך 4 דקות בטמפרטורת החדר. השליכו את הסופרנטנט על ידי סילוק בזהירות של התמיסה העליונה.
- הוסף 0.5 מ"ל של מדיום התמיינות כונדרוגני (שלב 1.8) לתוך הצינור כדי להשעות מחדש את התאים, וצנטריפוגה את הצינור שוב ב-150 x גרם למשך 5 דקות בטמפרטורת החדר. חזור על שלב זה פעמיים.
- שחרר את מכסה צינור הצנטריפוגה כדי להקל על חילופי האוויר. הנח את הצינור לתוך החממה וגרם לתאים עם 0.5 מ"ל של מדיום התמיינות כונדרוגני ב-37 מעלות צלזיוס באווירה לחה של 5% CO2.
- שמור על צינור הצנטריפוגה יציב מבלי להסיר או לנער אותו תוך 24 או 48 שעות, עד שהתאים מתחילים לגלול. החלק את תחתית צינור הצנטריפוגה כדי לתלות את כדור התא בתווך ההתמיינות (שלב 1.5).
- חדש את מדיום ההתמיינות הכונדרוגני עם פיפטה כל 3 ימים. הימנע משאיפת כדור התא.
- השרה את התאים לפחות למשך 21 יום עד שהגלולה מצטברת לקוטר של 2 מ"מ.
- שטפו את הגלולה עם 1x PBS, וקבעו אותה עם 4% פרפורמלדהיד למשך 30 דקות. לאחר התייבשות והטמעת פרפין13, חתכו את הגלולה בעובי של 3 מיקרומטר באמצעות מיקרוטום (ראו טבלת חומרים).
- שים את החלקים על שקופיות זכוכית. צבעו את השקופיות בתמיסה כחולה אלצ'יאנית (ראה טבלת חומרים) למשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס. שוטפים את השקופיות המוכתמות במים. הנח את השקופיות מתחת למיקרוסקופ אור וצלם תמונות של רירית החומצה המוכתמת בכחול המציינת רקמות סחוס.
תוצאות
דגימת עצם לסת תחתונה נאספה בהצלחה מהמטופל. והזמן מהחיתוך עם להב האוסטאוטום האולטראסוני ועד להכנסת שבר העצם לתוך צינור הצנטריפוגה הוא כ -5 דקות. אף אחד מהסיבוכים הפוטנציאליים לא התרחש בהליך הכריתה ולאחריו, כולל נזק לעצב המכתשית התחתון או לשורש השיניים, זיהום, קרע ודימום בכלי הדם, פגיעה ברירית, שבר בעצם בשוגג וכו'. ה-hmBMSCs תורבתו, עברו והתמיינו בהצלחה ללא זיהום.
במחקר הנוכחי, תאים דבוקים רבים נראו תחת המיקרוסקופ ביום השלישי לאחר התרבית הראשונית. ביום השביעי, רוב התאים הדבקים כבר היו מחוברים לצלחת התרבות. בדרך כלל, התאים המתורבתים הגיעו למפגש של 70%-80% לאחר 7-9 ימים של תרבית ראשונית. אחרי המעבר, תאי P3 בדרך כלל נחשבו ל-MSCs מטוהרים, שהראו מורפולוגיה בצורת ציר, דבוקה לפלסטיק ודמוית פיברובלסטים (איור 2). וניסויי הזיהוי נערכו בתאי P3 עד P5. מבחן התפשטות תאים, קצב גדילת התאים גדל במהירות מהיום השלישי של התרבית, והקצב המוגבר הואט ביום השישי (איור 2).
על פי ההגדרה שניתנה על ידי האגודה הבינלאומית לטיפול תאי, ל-MSCs יש ביטוי חיובי ושלילי של מולקולות שטח מסוימות. במחקר זה, ניתוח הזרימה הציטומטרית של תאי תרבית הראה ביטוי חיובי של CD44, CD90 וביטוי שלילי של CD45, CD34, התואם את ההגדרה 4,11 (איור 3). בניסויי יכולת ההתמיינות הרב-שושלתית, התאים המתורבתים הראו יכולת התמיינות אוסטאוגנית, אדיפוגנית וכונדרוגנית חזקה. לאחר 7 ימים של אינדוקציה אוסטאוגנית, תצהיר הסידן החוץ-תאי הופיע תחת המיקרוסקופ. לאחר 21 ימים של אינדוקציה אוסטאוגנית, התאים המתורבתים הראו בלוטות מינרליזציה ברורות, והצמתים נצבעו באדום עם צביעה אדומה של אליזרין (איור 4). עבור אדיפוגנזה, הרבה טיפות שומן עגולות שהצטברו באדום על ידי צביעת שמן-אדום-O נצפו בציטופלזמה לאחר 21 ימים של אינדוקציה אדיפוגנית (איור 4). אחרי 21 ימים של אינדוקציה של התמיינות כונדרוגנית, שקופיות כדורי התא שמציגות רקמה דמוית סחוס עם לקונת סחוס יכולות להיות מוכתמות בכחול (איור 4).
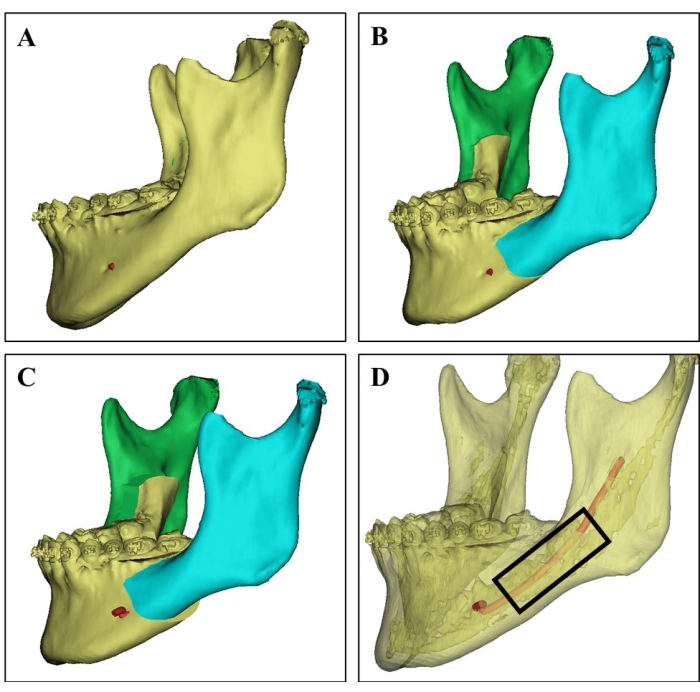
איור 1: בחירת אתר התורם בתמונת CT תלת-ממדית. (A) תמונת CT תלת-ממדית של הלסת התחתונה של התורם ממטופלת בת 21. (B) סימולציה כירורגית של אוסטאוטומיה של הלסת התחתונה. (ג) תכנון כירורגי מראה נסיגה של לסת תחתונה מפוצלת. (D) תמונת CT תלת-ממדית שמראה את העצם בקליפת המוח (החלק השקוף), את העצם המבטלת העשירה במח העצם, ואת העצב המכתשית התחתונה (אדום) בהתבסס על ערכי CT שונים, מה שיכול להנחות את המנתחים לבחור את אתר התורם ולהימנע מפגיעה עצבית. שבבי עצם קנצליים נאספו מהאזור במלבן השחור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מורפולוגיה מיקרוסקופית ועקומת גדילה של תאי גזע מח עצם אנושיים שמקורם בלסת התחתונה (hmBMSCs) P3. (A-C) מורפולוגיה דמוית ציר, דבקה בפלסטיק ודמוית פיברובלסטים של P3 hmBMSCs (סרגל קנה מידה = 200 מיקרומטר, 100 מיקרומטר, 50 מיקרומטר עבור A, B, C, בהתאמה). (D) עקומת גדילת התאים הראתה שקצב הגדילה של hmBMSCs גדל במהירות מהיום השלישי של התרבית, וקצב הגידול הואט ביום השישי של התרבית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
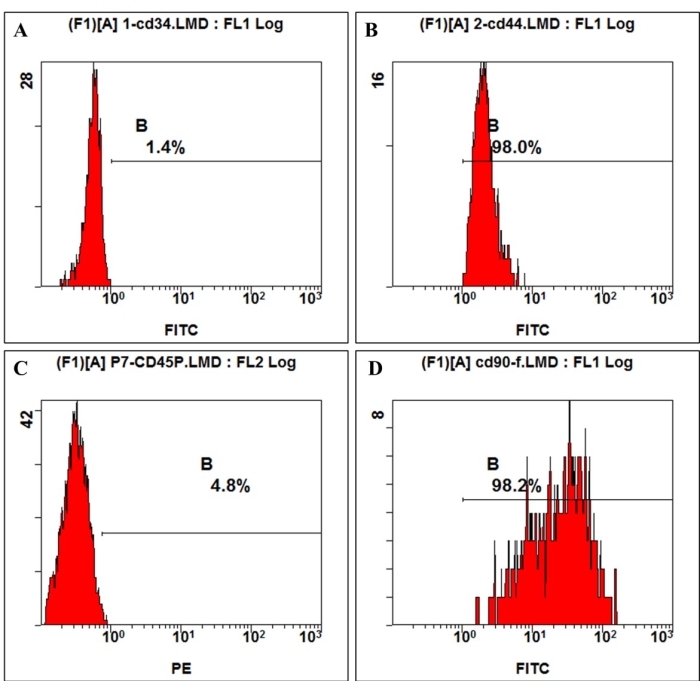
איור 3: ביטוי אנטיגן פני התא ב-hmBMSCs זוהה על ידי ציטומטריית זרימה. ניתוח ציטומטריית זרימה הראה כי hmBMSCs היו שליליים ל-CD45 (A) ו-CD44 (C), חיוביים ל-CD44 (B) ו-CD90 (D). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: התמיינות אוסטאוגנית, אדיפוגנית וכונדרוגנית של hmBMSCs. (A) צביעת ALP של hmBMSCs לאחר 7 ימים של תרבית ללא אינדוקציה של התמיינות אוסטאוגנית (סרגל קנה מידה = 100 מיקרומטר). (B) צביעת ALP של hmBMSCs לאחר 7 ימים של אינדוקציה של התמיינות אוסטאוגנית (סרגל קנה מידה = 100 מיקרומטר). (C) תוצאות כמותיות של אזור חיובי לצביעה של ALP (***P < 0.001). (D) צביעה אדומה של אליזרין של hmBMSCs ללא התמיינות אוסטאוגנית (סרגל קנה מידה = 100 מיקרומטר). (E) ניתן לראות היווצרות של בלוטות מינרליזציה ברורות לאחר 21 ימים של התמיינות אוסטאוגנית של hmBMSCs, וניתן לצבוע אותה באדום עם צביעה אדומה של אליזרין (סרגל קנה מידה = 100 מיקרומטר). (F) תוצאות כמותיות של צביעה אדומה של אליזרין (***P < 0.001). (G) צביעת O בצבע אדום שמן של hmBMSCs ללא התמיינות אדיפוגנית (סרגל קנה מידה = 50 מיקרומטר); (H) טיפות שומן עגולות נצפו אחרי 21 ימים של התמיינות אדיפוגנית של hmBMSCs, וטיפות השומן נצבעו באדום עם צביעת O בצבע אדום שמן (סרגל קנה מידה = 50 מיקרומטר). (I) צביעה כחולה אלציאנית הייתה חיובית לאחר 21 ימים של אינדוקציה כונדרוגנית (סרגל קנה מידה = 50 מיקרומטר). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
לאחרונה, הטיפול ב-hMSCs הראה הבטחה גדולה בהתחדשות רקמות ובטיפול במחלות עמידות רבות, כגון מחלות תפקוד לקוי של מערכת החיסון, מחלות המטולוגיות מערכתיות, סרטן או טראומה, בניסויים קליניים רבים 1,14,15,16,17. מבין המקורות השונים של MSCs, מח העצם נותר המקור הנפוץ ביותר והנגיש ביותר. השתמשנו בשבבי עצם מבטלים של הלסת התחתונה האנושית כדי לתרבית בהצלחה BMSCs באמצעות שיטת היצמדות מח העצם השלמה המתוארת בפרוטוקול הנוכחי. נכון להיום, ישנן ארבע גישות עיקריות לבידוד תאי גזע ממח העצם, כולל שיטת היצמדות מח העצם השלם, שיטת צנטריפוגה בשיפוע צפיפות, שיטת מיון תאים פלואורסצנטיים ושיטת מיון תאים מופעלים מגנטית10. כל שיטת ההיצמדות למח העצם היא פשוטה, קלה לתפעול, זולה ויכולה לקבל כמויות גדולות של תאים נצמדים. עם זאת, המגבלה של שיטה זו הייתה הטוהר הנמוך של BMSCs מתורבתים ראשוניים, אשר עורבבו עם תאים המטופויאטיים ופיברובלסטים. לאחר רענון מדיום התרבית של תאים ראשוניים באופן קבוע, התאים ההמטופויאטיים שאינם נדבקים הושלכו יחד עם המדיום שהושלך. כמו כן, ניתן לנקות את הפיברובלסטים דרך מעבר התאים, ותאי P3 היו BMSCs מטוהרים מאוד. כך שלא ניתן להשתמש בתאי P0 עד P2 לטיפול תאי, מה שאומר שהיה צורך בזמן נוסף כדי לטהר את תאי הגזע. באמצעות מיון תאים פלואורסצנטיים ומיון תאים המופעלים על ידי מגנטים, ניתן להשיג BMSCs מטוהרים יותר, בעוד ששתי השיטות יקרות, וזמן בחירה ארוך יכול לפגוע בכדאיות התא11. כדי להוכיח שהתאים המתורבתים היו MSCs, התייחסנו להגדרה של MSCs אנושיים שהוצעה על ידי ועדת תאי גזע מזנכימליים ורקמות של האגודה הבינלאומית לטיפול תאי, שכללה אופי דבק פלסטי, ביטוי חיובי ושלילי של פנוטיפים מסוימים, כגון CD45, CD90 וכן הלאה, ויכולת התמיינות רב-שושלת18.
ברוב המחקרים, עצם הירך ופסגת הכסל היו המקורות העיקריים ל-BMSCs, בהשוואה לעצמות הלסת התחתונה, כגון הלסת התחתונה והלסתהעליונה 9,16. עם זאת, התיאוריה האופיינית הספציפית לאתר של hBMSCs במחקרים אחרונים הראתה כי ל-hBMSCs מעצמות שונות יש מאפיינים שונים ביכולת התמיינות, פעילות שגשוג, אוסטאוגנזה וחסינות 6,8. ההבדל הספציפי לאתר עשוי להיות קשור למקורות עובריים שונים, הסתגלות לדרישות תפקודיות בכל אתר שלד, מיקרו-סביבה, אספקת כלי דם מקומית, השפעות הורמונליות וכו'. יתר על כן, מחקרים הראו כי עצם כסל מושתלת הראתה אובדן אנכי מהיר יותר מעצם הלסת תוך 6 חודשים לאחר השתלת העצם8. מלבד זאת, מחקרים מצאו כי הפעילות הפרופרטיבית של MSCs ממח הלסת התחתונה הייתה עדיפה על זו של מח הכסל 5,8,19,20. והבדל זה בפעילות שגשוג יוחס למאפיינים שללסת התחתונה יש יותר אספקת דם וקצב תחלופת עצם מהיר יותר מאשר האיליום 5,6,8. מחקרים גילו גם כי BMSCs מהלסת התחתונה ביטאו רמה גבוהה יותר של Runx-2 ו-OCN מאשר אלה מעצם הירך, והיכולת האוסטיאוגנית של BMSCs מהלסת התחתונה הייתה שווה או גבוהה יותר מאלו של עצם הירך והאיליום 5,19,21. ההיצמדות ליכולת הטיטניום של hmBMSCs נמצאה גם חזקה יותר מ-BMSCs מעצם הירך, מה שהצביע על כך ש-hmBMSCs מתאימים יותר לשימוש בהשתלות אוראליות5. בנוסף, מחקר קליני בן 3 שנים לשחזור הפגם המכתשית מצא כי העצם המחודשת של MSCs ממוך השן הייתה מורכבת מעצם קומפקטית לחלוטין עם צפיפות מטריצה גבוהה יותר, בעוד שה-BMSCs חידשו עצם ספוגית בדומה למבנה עצם מכתשית אנושית רגילה22. לסיכום, hmBMSCs היו תאי גזע טיפוליים אידיאליים להתחדשות פנים ולסתות ומחלות אחרות בשל אותו מקור עוברי ומאפייניהם המעולים.
עם זאת, בלסת התחתונה יש פחות מח עצם מאשר עצם הירך והאיליום, ולכן חשוב להשיג מספיק מח עצם ו-BMSCs מהלסת התחתונה לשימוש קליני. שואבי כסל אנושי יכולים להשיג כמויות גדולות של מח עצם כדי לבודד MSCs. החוקרים השתמשו גם בשאיפות הלסת התחתונה כדי להשיג MSCs, בעוד שהתשואה הראשונית של MSCs משאיבות הלסת התחתונה הייתה נמוכה פי שלושה מזו של שאיפות כסל21. היה צורך בחתכים נוספים כדי לאסוף מספיק מח לסת תחתונה, מה שהוסיף טראומה כירורגית נוספת. יתר על כן, מחקרים הראו כי פוטנציאל ההתפשטות של MSCs משבבי עצם הלסת התחתונה עשוי להיות עדיף על אלה של שאיבת מח הלסת התחתונה 8,21. לכן, במחקר זה, שבבי העצם המבטלים של הלסת התחתונה שהושלכו שימשו לבידוד MSCs. מכיוון ששני צידי הלסת התחתונה נכללו באוסטאוטומיה של ראמוס מפוצל סגיטלי או בפלסטיקה להפחתת זווית הלסת התחתונה, אנו יכולים לקבל מספיק מח לסת תחתונה מהמטופלים ללא כל נזק נוסף. לאחרונה, נעשה שימוש נרחב בטכנולוגיה בעזרת מחשב בניתוחי פה ולסת כדי לשפר את האפקט הכירורגי ולהפחית סיבוכים כירורגיים23. כדי למנוע פגיעה בלסת התחתונה ובעצב במהלך קצירת מח העצם של הלסת התחתונה, התקבלה תמונת CT תלת מימדית של הלסת התחתונה של התורמים, ונותח תכנון כירורגי של התורמים כדי להחליט על אתרי התורמים וליישם סימולציה כירורגית במחקר; לפיכך, אף אחד מהסיבוכים הניתוחיים לא קרה. להב האוסטאוטום האולטראסוני, מכשיר ספציפי לרקמות המאפשר למנתחים לבצע אוסטאוטומיות מדויקות תוך הגנה על רקמות רכות סמוכות24, שימש גם כדי למנוע פגיעה ברקמות רכות ולשמר את פעילות מח העצם המתקבלת.
לסיכום, מחקר זה תיאר פרוטוקול אמין, פשוט, בטוח וזול לבידוד ותרבית MSCs מנדיבולריים אנושיים נאותים, שניתן להשתמש בהם בטיפולים תאיים ברקמות שיניים ולסתות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחקר נתמך על ידי הקרן הלאומית למדעי הטבע של סין (מס' 81903249) ותוכנית המחקר הבסיסי למדעי הטבע של מחוז שאאנשי (מס' 2019JQ-701, מס' 2022JZ-50).
Materials
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
References
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532(2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708(2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476(2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002(2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114(2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved