Method Article
인간 하악골에서 골수 중간엽 줄기세포의 분리 및 배양
* 이 저자들은 동등하게 기여했습니다
요약
본 프로토콜은 whole bone bone adherence method를 사용하여 인간 하악 골수 유래 중간엽 줄기 세포를 분리 및 배양하기 위한 효율적인 절차를 설명합니다. 배양된 세포는 세포 증식 분석법(cell proliferation assay), 유세포 분석법(flow cytometry) 및 다계통 분화 유도(multilineage differentiation induction)에 의해 확인되었습니다.
초록
인간 중간엽 줄기세포(hMSC)는 뼈 재생, 면역 조절 및 난치성 만성 질환 치료에 큰 잠재력을 보여주었습니다. 최근에는 hMSC를 얻기 위해 다양한 기원이 발견되었지만, 골수는 여전히 주요 공급원으로 간주되고 있습니다. 서로 다른 기증자 뼈 부위의 골수 유래 MSC(BMSC)는 미세환경적 요인으로 인해 뚜렷한 특성을 가지고 있습니다. 연구에 따르면 악안면뼈의 BMSC는 긴 뼈나 장골능선의 BMSC보다 증식 및 골형성 능력이 더 클 수 있습니다. 그리고 악안면 BMSC는 악안면 조직의 줄기세포 치료에 더 적합한 것으로 간주되었습니다. 하악골, 특히 골수가 충분한 상승 라말 지역은 BMSC를 수확하기 위한 실현 가능한 기증자 부위였습니다. 이 연구는 인간 하악 골수 유래 MSC(hmBMSC)를 수확, 분리 및 배양하기 위한 프로토콜을 설명했습니다. 또한, 배양된 세포를 확인하기 위해 hmBMSC의 면역표현형, 증식 분석 및 골형성, 지방형성 및 연골형성 분화의 체외 유도를 수행했습니다. 이 프로토콜을 적용하면 연구원들이 생물학적 기능, 미세환경 영향 및 임상 적용에 대한 추가 연구에 필요한 충분한 고품질 hmBMSC를 성공적으로 얻을 수 있습니다.
서문
인간 중간엽 줄기세포(human mesenchymal stem cell, hMSC)는 중배엽 계통의 골세포(osteocyte), 지방세포(adipocyte), 연골세포(chondrocyte), 중배엽 계통(endodermal lineage)의 간세포(hepatocyte) 및 췌구(pancreocytes), 외배엽 계통(ectodermal lineage1)의 신경세포(neurocyte) 등 다양한 세포 유형으로 분화할 수 있는 다분화능 세포입니다. 따라서 hMSC는 조직 재생에 큰 잠재력을 보여주었습니다. 또한, hMSC는 숙주 조직의 미세환경을 조절하고 만성 난치성 질환을 효과적으로 치료할 수 있는 강력한 면역조절제입니다2. 따라서 hMSC는 임상 연구의 세포 치료에 널리 사용되어 왔습니다. 따라서 편리한 방법으로 고품질의 충분한 hMSC를 성공적으로 확보하는 것이 중요합니다.
hMSC가 골수에서 처음 보고된 이래로 지방 조직, 활액, 골격근, 양수, 자궁내막, 치아 조직 및 탯줄과 같은 많은 대체 MSC 공급원이 발견되었습니다 1,3. 그러나 골수는 대부분의 전임상 및 임상 연구에서 hMSC의 주요 공급원으로 남아 있으며, 골수 유래 MSC(BMSC)는 다른 출처의 MSC를 비교하기 위한 표준으로 사용됩니다4. 수년 동안 장골능 또는 긴 뼈(경골 및 대퇴골)는 골수를 얻기 위한 가장 인기 있는 해부학적 위치였습니다 1,5. 그러나 장골능(iliac crest) 또는 장골(long bones)은 악안면뼈(maxillofacial bones)와 비교하여 배아의 기원과 발달 패턴이 다르다 5,6. 많은 임상, 실험실 및 개발 연구에서 서로 다른 기원의 BMSC가 부위 특이적 특성을 보였으며 이식된 BMSC는 수용 부위에 이식 후 기증자 부위의 특성을 유지한다는 것이 입증되었습니다 5,6,7,8,9. 발달 기원의 관점에서 볼 때, 상악골, 하악골, 상아질, 치조골, 치주인대와 같은 악안면 조직은 신경능선세포에서만 발생합니다. 대조적으로, 장골능과 긴 뼈는 중배엽에 의해 형성됩니다. 또한, 하악골은 막내 골화에 의해 생성되며, 축 골격 및 부속 골격은 내연골 골화를 겪습니다. 더욱이, 장골능선(iliac crest)과 긴 뼈(long bones)에 비해 일부 임상 연구에서는 악안면 골수 유래 hMSC가 세포 증식 활성과 분화 능력이 더 우수하다는 사실이 밝혀졌다 6,8. 따라서 악안면 부위의 BMSC는 악안면 조직 재생 및 악안면 만성 난치성 질환 치료에 더 나은 선택이 될 것으로 예상됩니다.
하악골은 2층 두께의 피질 뼈로 구성되어 있으며 그 사이에 해면 골수가 있어 씹는 힘을 발휘할 수 있습니다. 그러므로, 하악골, 특히 상행 라말 부위는 일반적으로 두개악안면 수술에서 자가 뼈 이식편을 얻기 위한 기증자 부위로 사용된다10. 그리고 하악 시상골, 분열, 골절개술 및 하악각 축소 성형술과 같은 수술에서는 하악 피질 및 해면골의 일부를 제거하여 만족스러운 얼굴 윤곽을 얻어야 합니다. 이렇게 버려진 해면골은 hMSC의 잠재적인 자원이 될 수 있습니다. 그러나 발표된 연구에서는 고품질 인간 하악골수 유래 MSC(hmBMSC)를 신속하게 분리하고 배양하는 프로토콜을 설명했습니다.
본 연구는 hmBMSC의 분리 및 배양을 위한 신뢰할 수 있고 재현 가능한 프로토콜을 도입하기 위해 변형된 전체 골수 순응 방법을 사용합니다. 그리고 줄기세포는 MSC의 유세포 측정 면역표현형, 증식 분석 및 다계통 분화 유도에 의해 확인되었습니다. 이 표준 절차를 적용하면 연구자들이 생물학적 기능, 미세환경 영향 및 임상 적용에 대한 추가 연구에서 중요한 고품질 인간 하악 골수 유래 MSC를 얻는 데 도움이 될 수 있습니다.
프로토콜
인간 하악골 표본을 채취하는 절차는 제4 군사 의과 대학인 구강학 대학의 윤리 위원회의 승인을 받았습니다. 이 연구는 1975년 헬싱키 선언의 윤리 지침을 따랐다. 본 연구의 모든 기증자는 가능한 위험과 연구 목적에 대해 알렸습니다. 기증자의 연령은 18세에서 40세 사이였으며 성별에 대한 편견은 없었다. 모든 인간 참가자로부터 서면 동의를 얻었습니다.
1. 수술 준비
- 적절한 기부자를 선택합니다.
- 시상분리골절개술에 따른 하악골후퇴, 골절개술, 하악각도축소성형술 등의 수술을 받을 예정인 환자를 기증자로 선정한다.
- 보존 용액을 준비합니다.
- 수술 전날 멸균 및 효소가 없는 50mL 원심분리 튜브에 1% 페니실린과 스트렙토마이신이 함유된 인산염 완충액 식염수(PBS 1개) 30mL를 보충합니다. 4°C의 냉장고에 보관하십시오.
- 수술 당일, 보존액이 든 원심분리기 튜브를 아이스박스에 넣고 수술 1시간 전까지 수술실에 보관합니다.
- 수술 전날 골수를 분리하기 위한 가위, 핀셋, 칼 등을 120°C, 0.27MPa 압력에서 20분 동안 소독합니다.
- 최소 필수 배지 알파(α-MEM)와 10% 소 태아 혈청(FBS) 및 1% 페니실린 및 스트렙토마이신을 혼합하여 α-MEM 배양 배지를 준비합니다.
- α-MEM 배양 배지를 50mM 아스코르브산, 10mM β-글리세롤 포스페이트 및 0.1mM 덱사메타손과 혼합하여 골형성 분화 배지를 준비합니다(재료 표 참조).
- α-MEM 배양 배지를 1mM 덱사메타손, 0.2mM 인도메타신, 10μg/mL의 인슐린 및 0.5mM 3-이소부틸-1-메틸크산틴(IBMX)과 혼합하여 지방생성 분화 배지 A를 준비합니다( 재료 표 참조).
- α-MEM 배양 배지와 10μg/mL의 인슐린을 혼합하여 지방생성 분화 배지 B를 준비합니다.
- Dulbecco's modified Eagle's 배지를 고포도당(HG-DMEM) 및 덱사메타손 100nM, 피루브산나트륨 100g/mL, 비타민 C 25mg/mL, 프롤린 40mg/mL, TGF-β3 10ng/mL 및 ITS 1%와 혼합하여 연골 생성 분화 배지를 준비합니다( 재료 표 참조).
참고: 골형성(osteogenic), 지방형성(addipogenic) 및 연골형성(chondrogenic) 분화 배지는 위에서 언급한 바와 같이 사내에서 준비할 수 있습니다. 그러나, 본 연구에서는 동일한 것에 대해 상업적으로 이용 가능한 키트가 사용되었다( 재료 표 참조).
2. 인간 하악골 표본 수확
- 수술 전에 3차원 컴퓨터 단층 촬영 스캔 이미지와 기증자의 수술 시뮬레이션 계획을 주의 깊게 연구하십시오(그림 1).
- 기증자가 수술 시 제거하고자 하는 하악 부위를 선택하며, 기증자 부위로 골수가 있는 해면골이 풍부한 부위를 선택합니다.
- 수술하기 전에 환자를 소독하고 드레이프하십시오.
- 초음파 골절기( Table of Materials) 를 사용하여 하악골의 선택된 기증자 부위를 절제하여 하부 폐포 신경 손상 및 기증자 뼈 손상을 방지합니다.
- 가능한 한 빨리 하악골 표본을 보존 용액에 넣습니다(1.2단계).
- 실험실에서 MSC 분리가 시작될 때까지 뼈 표본과 함께 보존 용액을 아이스박스에 넣습니다.
참고: MSC의 분리는 세포의 생존력을 보존하기 위해 수확 후 가능한 한 빨리 시작해야 합니다. MSC의 분리를 즉시 수행할 수 없는 경우, 뼈 표본이 포함된 보존 용액을 아이스박스에 보관하거나 4°C에서 최대 2시간 동안 냉장 보관할 수 있습니다.
3. 인간 mBMSC의 격리 및 배양
- 보존 용액에서 뼈 표본을 꺼내 1% 페니실린과 스트렙토마이신이 함유된 1x PBS에 5분 동안 층류 캐비닛의 깨끗한 벤치에 담급니다.
참고: 이 단계는 구강이 완전히 멸균된 환경이 아니기 때문에 혈전과 잔류 구강액을 씻어내고 미생물을 더 제거하는 것을 목표로 합니다. 세포 격리 및 배양 전에 알코올로 손을 씻고 소독하고 일회용 멸균 장갑과 마스크를 착용하십시오. - 멸균 젖은 거즈를 사용하여 뼈 표면의 접착된 연조직과 핏자국을 청소합니다.
- 6cm 멸균 배양 접시에 5mL의 α-MEM 배양 배지를 채웁니다.
- 멸균 배양 접시에 뼈를 넣고 멸균 된 칼이나 가위로 작은 조각 (거의 2-3mm,3 볼륨)으로 자릅니다.
알림: 손가락이 베이지 않도록 핀셋으로 뼈 표본을 잡습니다. - 1mL 일회용 멸균 주사기를 사용하여 배양 접시에서 α-MEM 배양 배지를 흡입합니다.
- α-MEM 배양 배지가 있는 주사기 바늘을 해면골 표본 조각의 골수강 깊숙이 삽입합니다.
- 뼈 표본 조각의 모든 면에서 주사기를 사용하여 골수를 배양 접시에 넣고, 한 면당 최소 5-10회 씻어냅니다.
- 모든 뼈 표본 조각이 순백색으로 변할 때까지 3.5-3.7단계를 반복하여 최대한 많은 골수가 배양 배지로 플러시되도록 합니다.
알림: 3.1-3.8에서 위 단계의 총 작동 시간은 얼음 위에서 30분 이내에 제어해야 합니다. - 핀셋으로 모든 뼈 표본 조각을 제거하고 버립니다. 70μm 공극 크기의 셀 필터를 사용하여 다른 작은 조각을 제거합니다.
- 배양 접시를 부드럽게 흔들어 플러시된 세포가 고르게 분포되도록 합니다.
- 배양 접시를 세포 배양기에 넣고 5 %CO2의 가습 분위기에서 37 ° C에서 세포를 배양하십시오.
- 배양 3일차에는 광학 현미경으로 세포 형태와 성장 상태를 확인합니다. 부착 세포와 조직 조각이 없는 배양 배지의 절반을 제거합니다. 신선한 α-MEM 배양 배지 3mL를 추가합니다.
- 배양 7일차에 모든 배양 배지를 제거하고 신선한 α-MEM 배양 배지 5mL를 추가합니다.
- 그런 다음 3일마다 α-MEM 배양 배지를 새로 고칩니다.
- 매일 세포의 형태와 성장을 확인하십시오.
참고: 배양 7-10일 후 1차 세포 배양(P0)이 70%-80% 합류점에 도달하면 세포 계대를 수행합니다.
4. 세포 통로
- 70%-80% 합류점에서 P0 세포의 모든 배양 배지를 제거합니다. 배양 접시를 1x PBS로 두 번 부드럽게 세척하여 잔류 배양 배지를 청소합니다.
- 배양 접시에 0.02% EDTA가 함유된 0.25% 트립신 1mL를 첨가하여 세포를 소화합니다. 트립신이 고르게 분포되도록 배양 접시를 부드럽게 흔듭니다. 배양 접시를 37°C에서 3분 동안 놓습니다.
- 현미경으로 세포를 확인하십시오. 세포의 70%-80%가 수축하고 둥글어지면 α-MEM 배양 배지 2mL를 추가하여 소화 반응을 멈춥니다.
- 피펫으로 접시 표면을 여러 번 부드럽게 불어 세포를 불어냅니다.
- 세포 현탁액을 15mL 원심분리 튜브로 옮깁니다. 실온에서 200 x g 의 세포 현탁액을 5분 동안 원심분리합니다.
- 상층액을 버리고 α-MEM 배양 배지로 세포를 재현탁합니다. P0 세포를 배양 플라스크(25cm)에 1:2 분할 비율로 파종하여 증식시킵니다. 첫 번째 계대 세포는 P1 세포라고 불렸습니다.
- P1 세포가 70%-80% 합류점에 도달하면 4.1-4.6의 단계에 따라 세포 통로를 반복합니다. 2세대 세포는 P2 세포라고 불렸습니다.
- 3세대 세포 계대 후 확장 분할 비율을 1:3으로 변경합니다.
- P3 - P5 세포를 사용하여 식별 실험을 수행합니다.
5. 유세포 분석
- 4.1-4.5 단계에 따라 0.25% EDTA와 0.25% 트립신을 사용하여 P3에서 P5 MSC로 분해합니다.
- 상등액을 버리고 1 x 106 cells/mL 농도로 1x PBS의 세포를 재현탁합니다.
- 튜브당 100 μL의 세포 현탁액이 있는 마이크로 원심분리 튜브로 세포를 옮깁니다.
- 면역 표지된 마우스 단클론 항인간 항체를 마이크로 원심분리기 튜브에 추가합니다.
참고 : 본 연구를 위해 CD45에 대한 Phycoerythrin (PE) 결합 항체, CD90, CD34 및 CD44에 대한 fluorescein-isothiocyanate (FITC) 결합 항체가 4,11 (재료 표 참조)을 사용했으며 항체의 희석은 모두 1:100이었습니다. 항체 희석은 제조업체의 지침을 따라야 합니다. PBS는 통제 역할을 합니다. - 항체와 PBS 대조군을 실온에서 30분 동안 배양합니다.
- 실온에서 800 x g 으로 튜브를 5분 동안 원심분리합니다. 현탁액을 버리고 0.5mL의 1x PBS에 세포를 재현탁합니다. 이 단계를 두 번 반복합니다.
- 튜브를 유세포 분석기에 로드합니다( Table of Materials(재료표 참조). 최소 10,000개의 이벤트가 있는 유세포 분석기를 사용하여 형광 표지된 세포 수를 계산합니다.
참고: 유세포분석기 세포 계수 프로세스는 면역형광 라벨링 절차 직후에 시작하는 것이 좋습니다. 그렇지 않은 경우 셀을 1% 파라포름알데히드로 고정하고 어두운 곳에서 4°C에서 보관하고 24시간 이내에 공정을 완료해야 합니다.
6. 세포 증식 분석
- P3 세포를 사용하여 세포 증식 분석을 수행합니다. 4.1-4.5 단계에 따라 0.25% 트립신으로 P3 MSC를 분해합니다.
- 상층액을 버리고 α-MEM 배양 배지로 세포를 재현탁합니다.
- 혈구계로 세포 수를 계수하고 웰당 3 x 103 개의 세포, 총 35개의 웰, 각 계수일(1일, 2일, 3일, 4일, 5일, 6일, 7일)에 대해 5개의 웰의 밀도로 96웰 배양 플레이트에 세포를 파종합니다. 3일마다 세포의 배양 배지를 새로 고칩니다.
- 각 계수일에서 특정 계수일 동안 특정 5개의 웰의 α-MEM 배양 배지를 폐기한 다음 100μL의 배양 배지와 10μL의 CCK-8 용액을 추가합니다( 재료 표 참조). 37 ° C에서 1 시간 동안 배양하십시오.
- 배양 플레이트를 마이크로플레이트 분광 광도계( 재료 표 참조)에 놓고 450nm의 파장에서 각 계수일(총 7회 계수일)에 대해 5개의 웰의 광학 밀도 값을 측정합니다. 세포가 없는 배양 배지의 5개 웰을 블랭크로 사용합니다.
- 모든 웰의 광학 밀도 값을 기록하고, 각 계수일에 대해 5개의 웰의 평균값과 표준 편차를 계산하고, 세포 성장 곡선 5,12를 플로팅합니다.
7. 다계통 차별화
- 아래 단계에 따라 골형성 분화 유도를 수행합니다.
- 4.1-4.5단계에 따라 트립신으로 P3 세포를 분해합니다. 6웰 플레이트에 2 x 105 cells/cm2 세포를 파종합니다. 웰당 2.5mL의 α-MEM 배양 배지를 추가합니다.
- 세포가 60%-70% 합류점에 도달하면 배양 배지를 골형성 유도 배지로 변경합니다(1.5단계). 그런 다음 3일마다 유도 매체를 교체하십시오.
- 유도 후 3일마다 현미경으로 세포를 확인하십시오. 세포 형태를 관찰하고 명백한 광물화 노드를 찾습니다.
- 유도 7일 후 알칼리성 인산가수분해효소(ALP) 염색을 수행하여 세포의 석회화를 평가합니다.
- 1x PBS를 사용하여 세포를 두 번 부드럽게 세척하십시오. 4% 파라포름알데히드를 첨가하여 30분 동안 실온에서 세포를 고정합니다. 그런 다음 1x PBS를 사용하여 세포를 두 번 세척합니다.
- ALP 염색 용액( 재료 표 참조)을 추가하고 실온에서 10분 동안 배양합니다.
참고 : 다양한 종류의 ALP 염색 용액은 짙은 회색, 빨간색 및 파란색과 같은 다양한 색상으로 세포를 염색 할 수 있습니다. 이 프로토콜에서는 세포가 파란색으로 염색되었습니다. 염색 색상이 명확하지 않은 경우 배양 시간이 연장될 수 있습니다. 일부 ALP 용액 염색 키트는 유독 할 수 있습니다. 사용하기 전에 지침을 주의 깊게 읽고, 실험 중에는 장갑과 마스크를 착용하고, 사용 후에는 손을 조심스럽게 씻으십시오. - ALP 염색 반응을 멈추기 위해 세포를 물로 씻으십시오. 광학 현미경으로 세포의 파란색 색소 과립을 관찰하고 사진을 캡처합니다. Image J 소프트웨어를 사용하여 염색 정도를 정량적으로 분석합니다.
- 알리자린 레드 염색( 재료 표 참조)을 수행하여 세포의 광물화 능력을 평가합니다.
참고: 분화된 세포의 명백한 광물화 노드 형성은 일반적으로 유도 후 21일 후에 볼 수 있습니다. - 1x PBS를 사용하여 세포를 두 번 부드럽게 세척하십시오. 그런 다음 4% 파라포름알데히드를 첨가하여 실온에서 30분 동안 세포를 고정합니다.
- 1x PBS로 세포를 두 번 세척하고 0.1% 알리자린 레드 염색 용액( 재료 표 참조)을 첨가하고 20분 동안 배양합니다. 다시 말하지만, 1x PBS로 세포를 두 번 세척합니다.
- 광학 현미경으로 고정된 세포 사이의 붉은 결절(red nodules)을 관찰하여 배양된 세포의 골형성 분화에 따른 칼슘 침전물을 나타내고 사진을 캡처합니다.
- 알리자린 레드의 양을 정량화하려면 알리자린 레드 염색 세포에 10% 세틸피리디늄 클로라이드(CPC, 재료 표 참조)를 추가하고 실온에서 30분 동안 배양합니다.
- CPC 용액의 50μL를 흡입하고 마이크로플레이트 분광 광도계를 사용하여 540nm의 파장에서 광학 밀도(OD)를 측정합니다.
- 지방생성 분화 유도를 수행합니다.
- 위에서 설명한 절차를 사용하여 6-well 플레이트에 P3 세포를 시딩합니다(7.1단계).
- 세포가 80%-90% 합류하면 배양 배지를 지방 생성 분화 배지 A로 변경합니다(1.6단계).
- 37°C에서 5%CO2 의 가습된 분위기에서 3일 동안 지방생성 분화 배지 A로 세포를 배양합니다.
- 유도 배지를 지방생성 분화 배지 B로 변경하고(1.7단계) 1일 동안 배양합니다.
- 배지를 다시 addipogenic 분화 배지 A로 변경하고 3일 동안 배양합니다. 그런 다음 1일 동안 중간 B로 교체하십시오. 현미경으로 지질 방울이 보일 때까지 이 과정을 3-5회 반복합니다.
참고: 지질 방울은 유도 후 약 21일 후에 볼 수 있습니다. - 지방생성 분화 배지 B를 사용하여 추가로 7일 동안 세포를 배양합니다. 그런 다음 크고 둥근 지질 방울을 현미경으로 볼 수 있습니다. 3일마다 매체 B를 새로 고칩니다.
- 유도 매체를 제거하고 1x PBS를 사용하여 세포를 부드럽게 세척합니다. 그런 다음 4% 파라포름알데히드를 첨가하여 실온에서 10분 동안 세포를 고정합니다.
- 1x PBS로 세포를 두 번 세척하십시오. 그런 다음 오일레드 O 염색 용액(웰당 1mL, 재료 표 참조)으로 세포를 15분 동안 배양합니다. 다시 말하지만, 1x PBS로 세포를 두 번 세척합니다.
- 세포를 현미경으로 관찰하고 적색 지질 방울을 관찰하여 분화된 세포의 지방 형성을 평가합니다.
- 연골 생성 분화 유도를 수행합니다.
- P3 세포를 분해하여 세포 번호가 5 x 10인 15mL 원심분리 튜브로 옮깁니다5.
- 실온에서 250 x g 으로 튜브를 4분 동안 원심분리합니다. 상부 용액을 조심스럽게 디캔팅하여 상등액을 폐기합니다.
- 0.5mL의 연골형성 분화 배지(step 1.8)를 튜브에 추가하여 세포를 재현탁시키고 실온에서 5분 동안 150 x g 에서 튜브를 다시 원심분리합니다. 이 단계를 두 번 반복합니다.
- 공기 교환을 용이하게 하기 위해 원심분리기 튜브 캡을 풉니다. 튜브를 인큐베이터에 넣고 5%CO2의 가습 분위기에서 37°C에서 0.5mL의 연골 생성 분화 배지로 세포를 유도합니다.
- 세포가 펠릿화되기 시작할 때까지 24시간 또는 48시간 이내에 원심분리기 튜브를 제거하거나 흔들지 않고 원심분리기 튜브를 안정적으로 유지하십시오. 원심분리기 튜브 바닥을 튕겨 세포 펠릿을 분화 배지에 현탁시킵니다(단계 1.5).
- 연골형성 분화 배지를 3일마다 피펫으로 갱신합니다. 세포 펠릿을 흡입하지 마십시오.
- 펠릿이 2mm 직경으로 부착될 때까지 최소 21일 동안 세포를 유도합니다.
- 펠릿을 1x PBS로 세척하고 4% 파라포름알데히드로 30분 동안 고정합니다. 탈수 및 파라핀 임베딩13 후, 마이크로톰을 사용하여 3μm 두께의 펠릿을 절단합니다( 재료 표 참조).
- 유리 슬라이드에 섹션을 놓습니다. Alcian blue 용액( 재료 표 참조)으로 37°C에서 1시간 동안 슬라이드를 염색합니다. 얼룩진 슬라이드를 물로 씻으십시오. 슬라이드를 광학 현미경 아래에 놓고 연골 조직을 나타내는 파란색 염색 산 점액다당류의 사진을 캡처합니다.
결과
환자로부터 하악골 표본을 성공적으로 채취했습니다. 그리고 초음파 절골 블레이드로 절단한 후 뼈 조각을 원심분리기 튜브에 넣는 데 걸리는 시간은 약 5분입니다. 절제 시술 안팎으로 하치조신경 또는 치아근의 손상, 감염, 혈관 파열 및 출혈, 점막 손상, 우발적인 골절 등을 포함한 잠재적인 합병증은 발생하지 않았습니다. hmBMSC는 오염 없이 성공적으로 배양, 계대 분석 및 분화되었습니다.
본 연구에서는 초기 배양 후 3일째에 많은 부착 세포를 현미경으로 관찰했습니다. 7일째 되는 날, 대부분의 부착 세포는 이미 배양 접시에 부착되어 있었습니다. 일반적으로 배양된 세포는 초기 배양 7-9일 후에 70%-80% 합류점에 도달했습니다. 계대 후, P3 세포는 일반적으로 방추형, 소성 접착성 및 섬유아세포와 같은 형태를 보이는 정제된 MSC로 생각되었습니다(그림 2). 그리고 동정실험은 P3 내지 P5 세포에서 실시하였다. 세포 증식 분석에서 세포 성장률은 배양 3일째부터 급격히 증가했으며 증가된 속도는 6일째에 느려졌습니다(그림 2).
국제 세포 치료 학회(International Society for Cellular Therapy)에서 제시한 정의에 따르면 MSC는 특정 표면 분자의 긍정적 및 부정적 발현을 가지고 있습니다. 본 연구에서 배양 세포의 유세포 분석은 CD44, CD90의 양성 발현과 CD45, CD34의 음성 발현을 보여주었으며, 이는 정의 4,11과 일치합니다(그림 3). 다계통 분화 능력 실험에서 배양된 세포는 강력한 골형성, 지방형성, 연골형성 분화 능력을 보였다. 골형성 유도 7일 후, 현미경 아래에서 세포외 기질 칼슘 침착이 나타났습니다. 골형성 유도 21일 후, 배양된 세포는 명백한 광물화 노드를 보였고 노드는 알리자린 적색 염색으로 빨간색으로 염색되었습니다(그림 4). 지방 형성의 경우, 지방형성 유도 21일 후 세포질에서 Oil-red-O 염색에 의해 빨간색으로 염색된 축적된 둥근 지질 방울이 많이 관찰되었습니다(그림 4). 연골형성 분화 유도 21일 후, 연골 틈새가 있는 연골 유사 조직을 보여주는 세포 펠릿 슬라이드를 파란색으로 염색할 수 있습니다(그림 4).
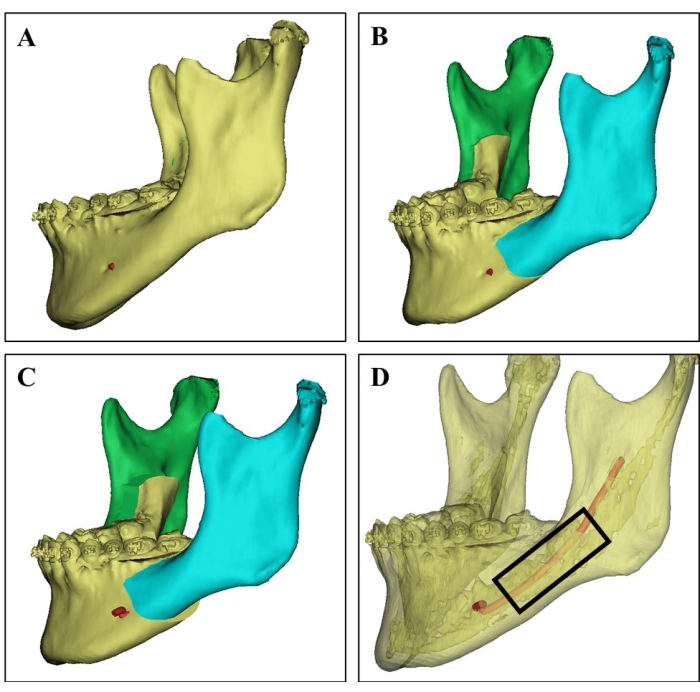
그림 1: 3D CT 이미지에서 기증자 부위 선택. (A) 21세 여성 환자의 기증자 하악골의 3D CT 이미지. (B) 하악골의 양측 시상 분할 골절개술의 외과적 시뮬레이션. (C) 수술 계획은 하악골 분할의 후퇴를 보여줍니다. (D) 서로 다른 CT 값을 기반으로 피질골(반투명 부분), 골수가 풍부한 해면골, 하치조신경(빨간색)을 보여주는 3D CT 영상으로, 외과의가 기증자 부위를 선택하고 신경 손상을 방지할 수 있도록 안내할 수 있습니다. 구강 뼈 조각은 검은 직사각형의 지역에서 수확되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: P3 인간 하악골 유래 골수 줄기세포(hmBMSC)의 미세한 형태 및 성장 곡선.(A-C) P3 hmBMSC의 방추형, 소성 접착성 및 섬유아세포 유사 형태(스케일 바 = A, B, C의 경우 각각 200μm, 100μm, 50μm). (D) 세포 성장 곡선은 hmBMSCs의 성장률이 배양 3일째부터 급격히 증가하고, 배양 6일째부터 증가율이 둔화되는 것을 보여주었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
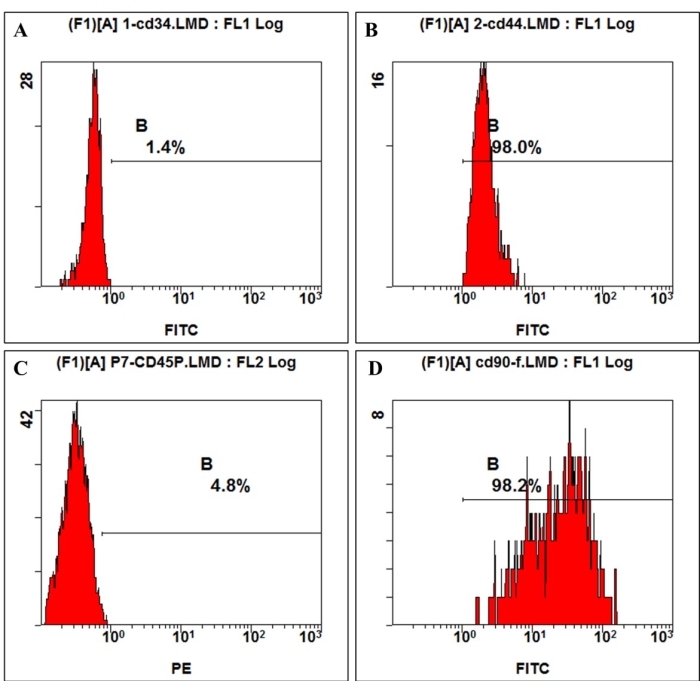
그림 3: hmBMSC의 세포 표면 항원 발현은 유세포 분석으로 검출되었습니다. 유세포 분석 결과, hmBMSC는 CD45(A) 및 CD44(C)에 대해 음성, CD44(B) 및 CD90(D)에 대해 양성인 것으로 나타났습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: hmBMSC의 골형성, 지방형성 및 연골형성 분화. (A) 골형성 분화 유도 없이 배양 7일 후 hmBMSC의 ALP 염색(스케일 바 = 100μm). (B) 골형성 분화 유도 7일 후 hmBMSC의 ALP 염색(스케일 바 = 100μm). (C) ALP 염색 양성 영역(***P < 0.001)의 정량적 결과. (D) 골형성 분화가 없는 hmBMSC의 알리자린 적색 염색(스케일 바 = 100μm). (E) hmBMSC의 골형성 분화 21일 후에 명백한 광물화 노드의 형성을 볼 수 있으며, 알리자린 적색 염색(스케일 바 = 100μm)으로 빨간색으로 염색할 수 있습니다. (F) 알리자린 레드 염색의 정량적 결과(***P < 0.001). (G) 지방생성 분화가 없는 hmBMSC의 오일 레드 O 염색(스케일 바 = 50μm); (H) hmBMSC의 지방형성 분화 21일 후에 둥근 지질 방울을 관찰하고, 지질 방울을 오일 레드 O 염색(스케일 바 = 50μm)으로 빨간색으로 염색했습니다. (I) Alcian blue staining은 연골형성 분화 유도 21일 후 양성이었습니다(스케일 바 = 50μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
최근 hMSC 요법은 수많은 임상 시험에서 조직 재생 및 면역 기능 장애 질환, 전신 혈액 질환, 암 또는 외상과 같은 많은 난치 질환의 치료에 큰 가능성을 보여주었습니다 1,14,15,16,17. MSC의 다양한 공급원 중에서 골수는 여전히 가장 널리 사용되며 쉽게 접근할 수 있는 공급원입니다. 우리는 인간 하악 해면골 칩을 사용하여 본 프로토콜에 설명된 전체 골수 순응 방법을 사용하여 BMSC를 성공적으로 배양했습니다. 현재까지 줄기세포를 골수에서 분리하는 방법은 전장골수 순응법(whole bone donhorence method), 밀도 구배 원심분리법(density gradient centrifugation method), 형광 세포 분류법(personality activated cell sorting method), 자기 활성화 세포 분류법(magnetic-activated cell sorting method) 등 4가지 주요 접근법이 있습니다10. 전체 골수 부착 방법은 간단하고 조작하기 쉽고 저렴하며 많은 양의 부착 세포를 얻을 수 있습니다. 그러나 이 방법의 한계는 조혈 세포 및 섬유아세포와 혼합된 1차 배양된 BMSC의 순도가 낮다는 것이었습니다. 일차 세포의 배양 배지를 정기적으로 새로 고친 후, 비부착성 조혈 세포를 폐기된 배지와 함께 폐기했습니다. 또한, 섬유아세포는 세포 통로를 통해 제거될 수 있으며, P3 세포는 고도로 정제된 BMSC였습니다. 따라서 P0 내지 P2 세포는 세포 치료에 사용할 수 없으며, 이는 줄기 세포를 정제하는 데 추가 시간이 필요함을 의미합니다. 형광 세포 분류와 자기 활성화 세포 분류 방법을 사용하면 더 정제된 BMSC를 얻을 수 있는 반면, 두 가지 방법은 비용이 많이 들고 선택 시간이 길면 세포 생존율이 손상될 수 있습니다11. 배양된 세포가 MSC임을 증명하기 위해 국제세포치료학회(International Society for Cellular Therapy)의 중간엽 및 조직 줄기세포 위원회(Mesenchymal and Tissue Stem Cell Committee)에서 제안한 인간 MSC의 정의를 참조했는데, 여기에는 소성 부착 특성, CD45, CD90 등과 같은 특정 표현형의 양성 및 음성 발현, 다계통 분화 능력18이 포함되었습니다.
대부분의 연구에서 대퇴골과 장골능은 BMSC의 주요 원인이었으며, 하악골 및 상악골과 같은 악안면뼈에 비해 9,16. 그러나 최근 연구에서 hBMSC의 부위 특이적 특성 이론은 서로 다른 뼈의 hBMSC가 분화 능력, 증식 활성, 골형성 및 면역에서 다른 특성을 가지고 있음을 보여주었습니다 6,8. 부위별 차이는 서로 다른 발생학적 기원, 각 골격 부위의 기능적 요구에 대한 적응, 미세환경, 국소 혈관 공급, 호르몬 효과 등과 관련이 있을 수 있습니다. 또한, 연구에 따르면 이식된 장골뼈는 뼈 이식 후 6개월 이내에 턱뼈보다 더 빠른 수직 손실을 보였다8. 그렇지 않은 경우, 연구에 따르면 하악 골수에서 추출한 MSC의 증식 활성이 장골 골수에서 추출한 MSC보다 우수했습니다 5,8,19,20. 그리고 이러한 증식 활동의 차이는 하악골이 장골 5,6,8보다 혈액 공급이 더 많고 뼈 회전율이 더 빠르다는 특성에 기인합니다. 연구에 따르면 하악골의 BMSC는 대퇴골의 BMSC보다 더 높은 수준의 Runx-2 및 OCN을 발현했으며, 하악골의 골형성 능력은 대퇴골 및 장골의 골형성 능력과 같거나 높았습니다 5,19,21. 또한 hmBMSC의 티타늄 능력에 대한 부착력이 대퇴골의 BMSC보다 더 강한 것으로 밝혀졌는데, 이는 hmBMSC가 구강 임플란트학에 사용하기에 더 적합하다는 것을 시사한다5. 또한, 치조 결손을 재건하기 위한 3년간의 임상 연구에서 치수에서 재생된 MSC의 뼈는 더 높은 매트릭스 밀도를 가진 완전히 조밀한 뼈로 구성되어 있는 반면, hm BMSC는 정상 인간 폐포 뼈와 유사한 재생 해면골로 구성되어 있음을 발견했습니다22. 결론적으로, hmBMSC는 동일한 발생학적 기원과 우수한 특성으로 인해 악안면 재생 및 기타 질병에 이상적인 치료 줄기세포였습니다.
그러나 하악골은 대퇴골과 장골보다 골수가 적기 때문에 임상적으로 사용할 수 있도록 하악골에서 충분한 골수와 BMSC를 확보하는 것이 중요합니다. 인간 장골 흡인은 MSC를 분리하기 위해 많은 양의 골수를 얻을 수 있습니다. 연구자들은 또한 MSC를 얻기 위해 하악 흡인을 사용했으며, 하악 흡인에서 MSC의 초기 수율은 장골 흡인보다 3배 낮았습니다21. 하악골 흡인을 충분히 채취하기 위해 추가 절개가 필요했기 때문에 외과적 외상이 추가되었습니다. 또한, 연구에 따르면 하악골 칩에서 추출한 MSC의 증식 잠재력이 하악골 흡인에서 추출한 MSC보다 우수할 수 있습니다 8,21. 따라서 본 연구에서는 MSC를 분리하기 위해 폐기된 하악골 해면골 칩을 사용했습니다. 하악골의 양쪽이 시상골 분할 골절개술 또는 하악각 축소 성형술에 포함되었기 때문에 추가 손상 없이 환자로부터 충분한 하악골을 얻을 수 있습니다. 최근에는 컴퓨터 보조 기술이 구강 및 악안면 수술에서 수술 효과를 개선하고 수술 합병증을 줄이기 위해 널리 사용되고 있다23. 하악골 적출 중 하악골 및 신경의 손상을 방지하기 위해 기증자의 하악골에 대한 3D CT 이미지를 획득하고 기증자의 수술 계획을 분석하여 기증자 부위를 결정하고 연구에서 수술 시뮬레이션을 구현했습니다. 따라서 수술 합병증은 전혀 발생하지 않았습니다. 외과의가 인접한 연조직을 보호하면서 정확한 절골술을 할 수 있도록 하는 조직 특이적 장치인 초음파 절골 블레이드(Ultrasonic osteotome blade)도 연조직 손상을 방지하고 얻어진 골수 활동을 보존하는 데 사용되었습니다.
요약하면, 이 연구는 치아 및 악안면 조직의 세포 치료에 사용할 수 있는 적절한 인간 하악 MSC를 분리하고 배양하기 위한 신뢰할 수 있고 간단하며 안전하고 저렴한 프로토콜을 설명했습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 중국 국가자연과학재단(No.81903249)과 산시성 자연과학 기초 연구 프로그램(No.2019JQ-701, No.2022JZ-50)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
참고문헌
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유