Method Article
从人下颌骨中分离和培养骨髓间充质干细胞
* 这些作者具有相同的贡献
摘要
本方案描述了一种使用全骨髓粘附法分离和培养人下颌骨髓来源的间充质干细胞的有效程序。通过细胞增殖测定、流式细胞术和多系分化诱导鉴定培养的细胞。
摘要
人间充质干细胞 (hMSC) 在骨再生、免疫调节和治疗难治性慢性疾病方面显示出巨大潜力。最近发现各种来源都可以获得 hMSC,而骨髓仍被认为是主要来源。由于微环境因素,来自不同供体骨部位的骨髓来源的 MSC (BMSC) 具有不同的特征。研究表明,来自颌面骨的 BMSCs 可能比来自长骨或髂嵴的 BMSCs 具有更强的增殖和成骨能力。颌面 BMSCs 被认为更适合颌面部组织的干细胞治疗。下颌骨,尤其是骨髓充足的升支区域,是收获 BMSCs 的可行供体部位。本研究描述了一种收获、分离和培养人下颌骨髓来源的 MSC (hmBMSC) 的方案。此外,进行 hmBMSCs 的免疫表型分析、增殖试验以及 体外 诱导成骨、成脂和成软骨分化以鉴定培养的细胞。应用该方案可以帮助研究人员成功获得足够的高质量 hmBMSC,这对于进一步研究生物学功能、微环境效应和临床应用是必要的。
引言
人间充质干细胞 (hMSC) 是多能细胞,可分化为各种细胞类型,例如中胚层谱系的骨细胞、脂肪细胞和软骨细胞,内胚层谱系的肝细胞和胰细胞,以及外胚层谱系的神经细胞1。因此,hMSC 在组织再生中显示出巨大的潜力。此外,hMSC 是强大的免疫调节剂,可以调节宿主组织中的微环境并有效治疗慢性难治性疾病2。因此,hMSCs 已被广泛用于临床研究的细胞治疗。因此,以方便的方式成功获得足够的高质量 hMSC 非常重要。
自从 hMSC 首次在骨髓中报道以来,已经发现了许多替代的 MSC 来源,例如脂肪组织、滑液、骨骼肌、羊水、子宫内膜、牙齿组织和脐带 1,3。然而,在大多数临床前和临床研究中,骨髓仍然是 hMSC 的主要来源,骨髓来源的 MSC (BMSC) 被用作比较其他来源的 MSC 的标准4。多年来,髂嵴或长骨(胫骨和股骨)一直是获得骨髓的最常用解剖位置 1,5。然而,与颌面骨相比,髂嵴或长骨具有不同的胚胎起源和发育模式 5,6。许多临床、实验室和发育研究证明,来自不同来源的 BMSCs 表现出位点特异性,并且移植的 BMSCs 在植入受体部位后保留了供体部位的特性 5,6,7,8,9。从发育起源的角度来看,上颌面组织,如上颌骨、下颌骨、牙本质、牙槽骨、牙髓和牙周韧带,完全起源于神经嵴细胞。相比之下,髂嵴和长骨是由中胚层形成的。此外,下颌骨是通过膜内骨化形成的,而轴向和附肢骨骼则经历软骨内骨化。此外,与髂嵴和长骨相比,一些临床研究表明,颌面骨髓来源的 hMSC 具有更好的细胞增殖活性和分化能力 6,8。因此,来自颌面部区域的 BMSCs 有望成为颌面部组织再生和颌面慢性难治性疾病治疗的更好选择。
下颌骨由两层厚的皮质骨组成,中间有松质骨髓,因此它可以加载咀嚼的力量。因此,下颌骨,尤其是升支区域,通常用作颅颌面手术中获取自体骨移植物的供体部位10。在下颌矢状劈开支截骨术和下颌角缩小成形术等手术中,必须切除部分下颌皮质和松质骨,以获得令人愉悦的面部轮廓。那些丢弃的松质骨可能是 hMSC 的潜在资源。然而,很少有已发表的研究描述了快速分离和培养高质量人下颌骨髓来源的 MSC (hmBMSC) 的方案。
本研究使用改进的全骨髓依从性方法引入了一种可靠且可重复的 hmBMSC 分离和培养方案。并通过 MSCs 的流式细胞术免疫表型、增殖测定和多系分化诱导来鉴定干细胞。应用该标准程序可能有助于研究人员获得高质量的人下颌骨髓来源的 MSC,这对于进一步研究生物学功能、微环境效应和临床应用非常重要。
研究方案
采集人类下颌骨标本的程序得到了第四军医大学口腔医学院伦理委员会的批准。该研究遵循 1975 年《赫尔辛基宣言》的道德准则。本研究的所有供体都被告知可能的风险和研究目标。捐献者的年龄在 18-40 岁之间,没有性别偏倚。已获得所有人类参与者的书面同意。
1. 手术准备
- 选择合适的供体。
- 选择计划接受矢状劈开后下颌屈退、截骨术和下颌角缩小成形术等手术的患者作为供体。
- 准备保存溶液。
- 手术前一天,在无菌且无酶的 50 mL 离心管中补充 30 mL 磷酸盐缓冲盐水 (1x PBS) 和 1% 青霉素和链霉素。将其存放在 4 °C 的冰箱中。
- 手术当天,将装有保存液的离心管放入冰箱中,并在手术前 1 小时将其保存在手术室中。
- 手术前一天对器械进行消毒以分离骨髓,包括剪刀、镊子和刀,在 120 °C 和 0.27 MPa 压力下 20 分钟。
- 通过将最低必需培养基 α (α-MEM) 与 10% 胎牛血清 (FBS) 和 1% 青霉素和链霉素混合来制备 α-MEM 培养基。
- 通过将 α-MEM 培养基与 50 mM 抗坏血酸、10 mM β-甘油磷酸酯和 0.1 mM 地塞米松混合来制备成骨分化培养基(参见材料表)。
- 通过将 α-MEM 培养基与 1 mM 地塞米松、0.2 mM 吲哚美辛、10 μg/mL 胰岛素和 0.5 mM 3-异丁基-1-甲基黄嘌呤 (IBMX) 混合来制备成脂分化培养基 A(参见 材料表)。
- 通过将 α-MEM 培养基与 10 μg/mL 胰岛素混合来制备成脂分化培养基 B。
- 通过将 Dulbecco 改良的 Eagle 培养基与高葡萄糖 (HG-DMEM) 和 100 nM 地塞米松、100 g/mL 丙酮酸钠、25 mg/mL 维生素 C、40 mg/mL 脯氨酸、10 ng/mL TGF-β 3 和 1% ITS 混合来制备软骨形成分化培养基(参见 材料表)。
注:如上所述,成骨、成骨和成软骨分化培养基可以在内部制备。然而,在本研究中使用了相同的市售试剂盒(参见 材料表)。
2. 采集人类下颌骨标本
- 手术前,仔细研究供体的三维计算机断层扫描图像和手术模拟计划(图 1)。
- 选择供体计划手术切除且富含松质骨且以骨髓为供体部位的下颌骨部位。
- 手术前对患者进行消毒和覆盖。
- 使用超声截骨器刀片切除选定的下颌骨供体部位(见 材料表),避免下牙槽神经损伤和供体骨损伤。
- 尽快将下颌骨标本放入保存液中(步骤 1.2)。
- 将带有骨标本的保存溶液放入冰箱中,直到实验室开始分离 MSC。
注意:收获后需要尽快开始 MSC 的分离,以保持细胞的活力。如果不能立即进行MSC的分离,则可以将带有骨标本的保存液储存在冰箱中或在4°C下冷藏最多2小时。
3. 人 mBMSCs 的分离和培养
- 从保存溶液中取出骨标本,并将其浸入含有 1% 青霉素和链霉素的 1x PBS 中,在层流柜的干净工作台上浸泡 5 分钟。
注意:此步骤旨在洗去血凝块和残留的口腔液,并进一步消除微生物,因为口腔不是一个完全无菌的环境。在细胞分离和培养之前,用酒精洗手和消毒双手,并佩戴一次性无菌手套和口罩。 - 使用无菌湿纱布清洁骨表面粘附的软组织和血迹。
- 用 5 mL α-MEM 培养基填充 6 cm 无菌培养皿。
- 将骨头放入无菌培养皿中,用消毒过的刀或剪刀将其切成小块(几乎 2-3 毫米3 体积)。
注意:用镊子夹住骨标本,以免割伤手指。 - 用 1 mL 一次性无菌注射器吸出培养皿中的 α-MEM 培养基。
- 将装有 α-MEM 培养基的注射器针头插入松质骨标本块的骨髓腔深处。
- 用注射器从骨标本块的所有侧面将骨髓冲洗到培养皿中,每侧至少 5-10 次。
- 重复步骤 3.5-3.7,直到所有骨标本碎片都变成纯白色,以确保将尽可能多的骨髓冲洗到培养基中。
注意:上述步骤 3.1-3.8 的总作时间需要在冰上控制在 30 分钟内。 - 用镊子取出并丢弃所有骨标本块。使用孔径为 70 μm 的细胞过滤器去除其他小片段。
- 轻轻摇动培养皿,使冲洗的细胞均匀分布。
- 将培养皿放入细胞培养箱中,并在 37 °C 和 5% CO2 的潮湿气氛中培养细胞。
- 在培养的第三天,在光学显微镜下检查细胞形态和生长状态。去除一半没有贴壁细胞和组织片段的培养基;加入 3 mL 新鲜的 α-MEM 培养基。
- 在培养第 7 天,去除所有培养基并加入 5 mL 新鲜的 α-MEM 培养基。
- 然后,每 3 天刷新一次 α-MEM 培养基。
- 每天检查细胞形态和生长情况。
注意:当原代细胞培养物 (P0) 在培养 7-10 天后达到 70%-80% 汇合时,进行细胞传代。
4. 细胞传代
- 在 70%-80% 汇合时,去除 P0 细胞的所有培养基。用 1x PBS 轻轻洗涤培养皿两次,以清洁残留的培养基。
- 向培养皿中加入 1 mL 含 0.02% EDTA 的 0.25% 胰蛋白酶以消化细胞。轻轻摇动培养皿,确保胰蛋白酶分布均匀。将培养皿在 37 °C 下放置 3 分钟。
- 在显微镜下检查细胞。当 70%-80% 的细胞收缩和变圆时,加入 2 mL α-MEM 培养基以停止消化反应。
- 用移液管轻轻吹扫培养皿表面数次,以吹落细胞。
- 将细胞悬液转移至 15 mL 离心管中。在室温下以 200 x g 离心细胞悬液 5 分钟。
- 弃去上清液,用 α-MEM 培养基重悬细胞。将 P0 细胞接种在培养瓶 (25 cm) 中,以 1:2 的分流比扩增。第一代细胞称为 P1 细胞。
- 当 P1 细胞达到 70%-80% 汇合时,按照 4.1-4.6 的步骤重复细胞传代。第二代细胞称为 P2 细胞。
- 在第三代细胞传代后,将扩增分裂比更改为 1:3。
- 使用 P3 至 P5 细胞进行鉴定实验。
5. 流式细胞术分析
- 按照步骤 4.1-4.5,使用 0.25% 胰蛋白酶和 0.02% EDTA 消化 P3 至 P5 MSC。
- 弃去上清液,将细胞重悬于 1x PBS 中,浓度为 1 x 106 个细胞/mL。
- 将细胞转移到微量离心管中,每管含有 100 μL 细胞悬液。
- 将免疫标记的小鼠单克隆抗人抗体添加到微量离心管中。
注:在本研究中,使用针对 CD45 的藻红蛋白 (PE) 偶联抗体,针对 CD90、CD34 和 CD44 的荧光素-异硫氰酸酯 (FITC) 偶联抗体 4,11(参见材料表),抗体的稀释度均为 1:100。抗体的稀释度需要遵循制造商的说明。PBS 将作为对照。 - 将抗体和 PBS 对照在室温下避光孵育 30 分钟。
- 在室温下以 800 x g 离心试管 5 分钟。丢弃悬浮液,将细胞重悬于 0.5 mL 的 1x PBS 中。重复此步骤两次。
- 将试管装入流式细胞仪(参见 材料表)。使用流式细胞仪对荧光标记的细胞数进行计数,最少 10,000 个事件。
注意:最好在免疫荧光标记程序后立即开始流式细胞仪细胞计数过程。如果没有,则需要将细胞固定在 1% 多聚甲醛中,在 4 °C 避光中储存,并在 24 小时内完成该过程。
6. 细胞增殖测定
- 使用 P3 细胞进行细胞增殖测定。按照步骤 4.1-4.5 用 0.25% 胰蛋白酶消化 P3 MSC。
- 弃去上清液,用 α-MEM 培养基重悬细胞。
- 用血细胞计数器计数细胞数,并以 3 x 103 个细胞/孔的密度将细胞接种在 96 孔培养板上,总共 35 个孔,每个计数日(第 1、2、3、4、5、6、7 天)5 个孔。每 3 天刷新一次细胞培养基。
- 在每个计数日,丢弃特定计数日某些 5 个孔的 α-MEM 培养基,然后加入 100 μL 培养基和 10 μL CCK-8 溶液(参见 材料表)。在 37 °C 孵育 1 小时。
- 将培养板放入微孔板分光光度计中(参见 材料表),并在 450 nm 波长下测量每个计数日(总共 7 个计数日)五个孔的光密度值。使用不含细胞的培养基的 5 个孔作为空白。
- 记录每个孔的光密度值,计算每个计数日五个孔的平均值和标准偏差,并绘制细胞生长曲线 5,12。
7. 多谱系分化
- 按照以下步骤进行成骨分化诱导。
- 按照步骤 4.1-4.5 用胰蛋白酶消化 P3 细胞。在 6 孔板中以 2 x 105 个细胞/cm2 的浓度接种细胞。每孔添加 2.5 mL α-MEM 培养基。
- 当细胞达到 60%-70% 汇合时,将培养基换成骨诱导培养基(步骤 1.5)。然后,每 3 天更换一次诱导培养基。
- 诱导后每 3 天在显微镜下检查一次细胞。观察细胞形态并寻找明显的矿化节点。
- 诱导 7 天后,进行碱性磷酸酶 (ALP) 染色以评估细胞的钙化。
- 使用 1x PBS 轻轻洗涤细胞两次。加入 4% 多聚甲醛,在室温下固定细胞 30 分钟。然后,使用 1x PBS 洗涤细胞两次。
- 加入 ALP 染色溶液(参见 材料表)并在室温下孵育 10 分钟。
注:不同种类的 ALP 染色液可以用不同的颜色对细胞进行染色,例如深灰色、红色和蓝色。在该方案中,细胞被染成蓝色。如果染色颜色不明显,可以延长孵育时间。一些 ALP 溶液染色试剂盒可能有毒;使用前请仔细阅读说明书,实验时戴手套和口罩,使用后请仔细洗手。 - 用水洗涤细胞以停止 ALP 染色反应。在光学显微镜下观察细胞中的蓝色色素颗粒并捕获照片。使用 Image J 软件定量分析染色程度。
- 进行茜素红染色(参见 材料表)以评估细胞的矿化能力。
注意:通常在诱导 21 天后可以看到分化细胞的明显矿化节点形成。 - 使用 1x PBS 轻轻洗涤细胞两次。然后,加入 4% 多聚甲醛,在室温下固定细胞 30 分钟。
- 用 1x PBS 洗涤细胞两次,加入 0.1% 茜素红染色溶液(参见 材料表)并孵育 20 分钟。再次,用 1x PBS 洗涤细胞两次。
- 在光学显微镜下观察固定细胞中的红色结节,表明培养细胞成骨分化的钙沉积,并捕获照片。
- 为了定量茜素红的量,向茜素红染色的细胞中加入 10% 十六烷基氯化铵(CPC,参见 材料表),并在室温下孵育 30 分钟。
- 吸出 50 μL CPC 溶液,并使用微孔板分光光度计测量 540 nm 波长下的光密度 (OD)。
- 进行成脂分化诱导。
- 使用上述程序将 P3 细胞接种在 6 孔板中(步骤 7.1)。
- 当细胞汇合 80%-90% 时,将培养基更换为成脂分化培养基 A(步骤 1.6)。
- 将细胞与成脂分化培养基 A 于 37 °C 在 5% CO2 的潮湿气氛中孵育 3 天。
- 将诱导培养基更换为成脂分化培养基 B(步骤 1.7),并孵育 1 天。
- 将培养基改回成脂分化培养基 A 并孵育 3 天。然后,用培养基 B 替换 1 天。重复此循环 3-5 次,直到在显微镜下可以看到脂滴。
注意:诱导后约 21 天可以看到脂滴。 - 使用成脂分化培养基 B 将细胞再培养 7 天;然后,在显微镜下可以看到大而圆的脂滴。每 3 天刷新一次培养基 B。
- 取出诱导培养基,并使用 1x PBS 轻轻洗涤细胞。然后,加入 4% 多聚甲醛,在室温下固定细胞 10 分钟。
- 用 1x PBS 洗涤细胞两次;然后,将细胞与油红 O 染色溶液(每孔 1 mL,参见 材料表)孵育 15 分钟。再次,用 1x PBS 洗涤细胞两次。
- 将细胞置于显微镜下,观察红色脂滴以评估分化细胞的脂肪生成。
- 进行软骨形成分化诱导。
- 消化 P3 细胞并将其转移到细胞数为 5 x 105 的 15 mL 离心管中。
- 在室温下以 250 x g 离心管 4 分钟。小心地倾析顶部溶液,弃去上清液。
- 向试管中加入 0.5 mL 软骨形成分化培养基(步骤 1.8)以重悬细胞,并在室温下以 150 x g 的离心力再次离心试管 5 分钟。重复此步骤两次。
- 松开离心管盖以促进空气交换。将试管放入培养箱中,并在 37 °C 和 5% CO2 的潮湿气氛中用 0.5 mL 软骨形成分化培养基诱导细胞。
- 在 24 或 48 小时内保持离心管稳定,不要取出或摇晃,直到细胞开始沉淀。轻弹离心管底部,将细胞沉淀悬浮在分化培养基中(步骤 1.5)。
- 每 3 天用移液管更新一次软骨形成分化培养基。避免吸走细胞沉淀。
- 诱导细胞至少 21 天,直到沉淀增加至 2 mm 直径。
- 用 1x PBS 洗涤沉淀,并用 4% 多聚甲醛固定 30 分钟。脱水和石蜡包埋13 后,使用切片机将颗粒切成 3 μm 厚的切片(参见 材料表)。
- 将切片放在载玻片上。用阿尔新蓝溶液(参见 材料表)在 37 °C 下染色载玻片 1 小时。 用水清洗染色的载玻片。将载玻片置于光学显微镜下,并捕获指示软骨组织的蓝色染色酸性粘多糖的照片。
结果
成功从患者身上采集了下颌骨标本。从用超声截骨器刀片切割到将骨碎片放入离心管的时间约为 5 分钟。切除手术期间和手术后均未发生任何潜在并发症,包括下牙槽神经或牙根损伤、感染、血管破裂和出血、粘膜损伤、意外骨折等。hmBMSCs 成功培养、传代和分化,无污染。
在本研究中,初始培养后的第 3 天在显微镜下观察到许多贴壁细胞。第 7 天,大多数贴壁细胞已经附着在培养皿上。正常情况下,培养的细胞在初始培养 7-9 天后达到 70%-80% 汇合度。传代后,P3 细胞通常被认为是纯化的 MSC,其表现出纺锤形、塑料粘附和成纤维细胞样形态(图 2)。鉴定实验在 P3 至 P5 细胞中进行。细胞增殖试验,细胞生长速率从培养第 3 天开始迅速增加,第 6 天增加速率减慢(图 2)。
根据国际细胞治疗学会给出的定义,MSC 具有特定表面分子的阳性和阴性表达。在这项研究中,培养细胞的流式细胞术分析显示 CD44、CD90 的阳性表达和 CD45、CD34 的阴性表达,这与定义 4,11 一致(图 3)。在多系分化能力实验中,培养的细胞表现出很强的成骨、成脂和软骨形成分化能力。成骨诱导 7 天后,细胞外基质钙沉积在显微镜下出现。成骨诱导 21 天后,培养细胞显示明显的矿化淋巴结,淋巴结用茜素红染色呈红色(图 4)。对于脂肪生成,在成脂诱导 21 天后,在细胞质中可以看到大量积累的圆形脂滴,这些脂滴被 Oil-red-O 染色染成红色(图 4)。经过 21 天的软骨形成分化诱导后,显示软骨样组织和软骨空隙的细胞沉淀载玻片可以染成蓝色(图 4)。
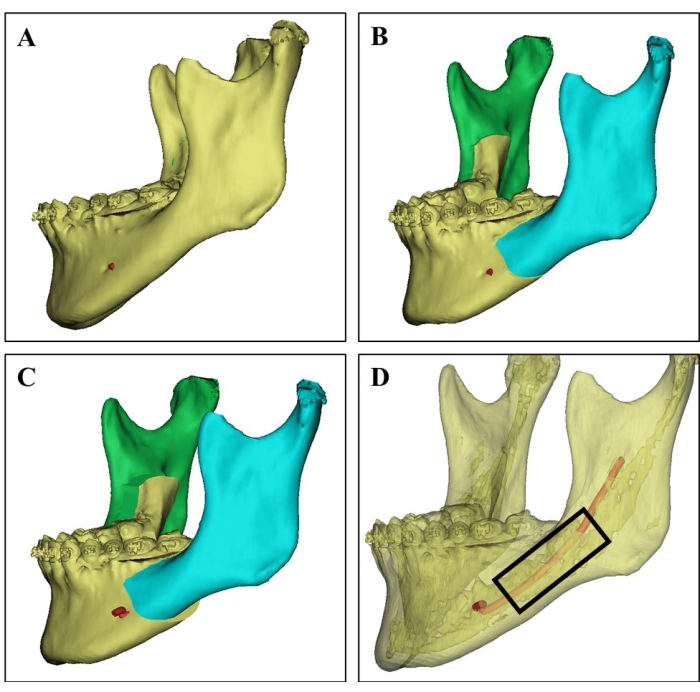
图 1:3D CT 图像上的供体部位选择。 (A) 一名 21 岁女性患者供体下颌骨的 3D CT 图像。(B) 下颌骨双侧矢状劈开支截骨术的手术模拟。(C) 手术计划显示下颌骨劈开的挫折。(D) 基于不同 CT 值的 3D CT 图像显示皮质骨(半透明部分)、富含骨髓的松质骨和下牙槽神经(红色),可指导外科医生选择供体部位,避免神经损伤。松质骨片是从黑色矩形的区域收获的。 请单击此处查看此图的较大版本。

图 2:P3 人下颌骨来源的骨髓干细胞 (hmBMSC) 的微观形态和生长曲线。(A-C) P3 hmBMSCs 的纺锤形、塑料粘附和成纤维细胞样形态(比例尺 = A、B、C 分别为 200 μm、100 μm、50 μm)。(D) 细胞生长曲线显示,hmBMSCs 的生长速率从培养第 3 天开始迅速增加,而在培养第 6 天增加速率减慢。请单击此处查看此图的较大版本。
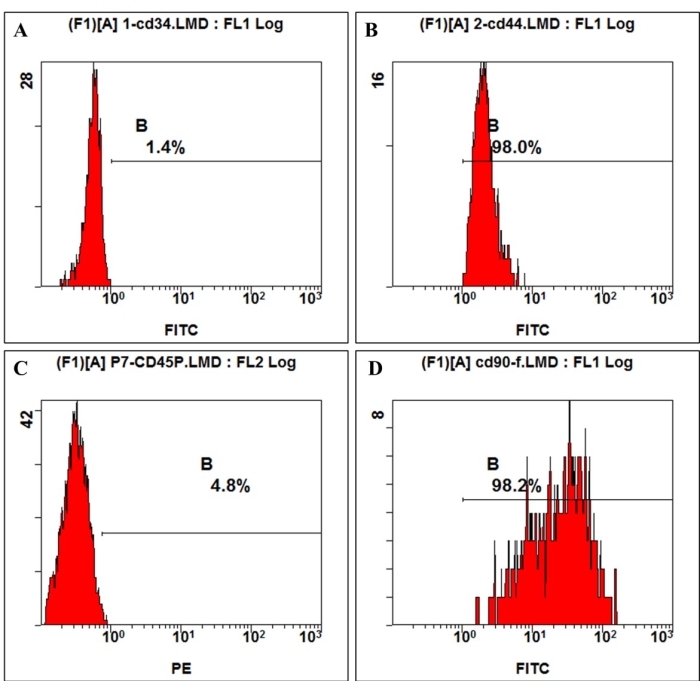
图 3:通过流式细胞术检测 hmBMSCs 上的细胞表面抗原表达。 流式细胞术分析显示,hmBMSCs CD45 (A) 和 CD44 (C) 阴性,CD44 (B) 和 CD90 (D) 阳性。 请单击此处查看此图的较大版本。

图 4:hmBMSC 的成骨、成骨和软骨形成分化。 (A) 无成骨分化诱导培养 7 天后 hmBMSC 的 ALP 染色(比例尺 = 100 μm)。(B) 成骨分化诱导 7 天后 hmBMSC 的 ALP 染色 (比例尺 = 100 μm)。(C) ALP 染色阳性面积的定量结果 (***P < 0.001)。(D) 无成骨分化的 hmBMSCs 的茜素红染色(比例尺 = 100 μm)。(E) hmBMSCs 成骨分化 21 天后可见明显矿化结节的形成,可用茜素红染色染成红色(比例尺 = 100 μm)。(F) 茜素红染色的定量结果 (***P < 0.001)。(G) 无成脂分化的 hmBMSCs 的油红 O 染色(比例尺 = 50 μm);(H) hmBMSCs 成脂分化 21 天后可见圆形脂滴,脂滴用油红 O 染色染成红色 (比例尺 = 50 μm)。(I) 软骨形成分化诱导 21 天后 Alcian 蓝染色呈阳性 (比例尺 = 50 μm)。 请单击此处查看此图的较大版本。
讨论
最近,hMSCs 疗法在组织再生和治疗许多难治性疾病方面显示出巨大的前景,例如免疫功能障碍疾病、系统性血液病、癌症或创伤,在众多临床试验中 1,14,15,16,17。在各种 MSC 来源中,骨髓仍然是使用最广泛和最容易获得的来源。我们使用人下颌松质骨芯片使用本方案中描述的全骨髓粘附方法成功培养 BMSC。迄今为止,从骨髓中分离干细胞的方法主要有四种,包括全骨髓粘附法、密度梯度离心法、荧光细胞分选法和磁激活细胞分选法10。全骨髓贴壁法简单、易作、价格便宜,可得到大量的贴壁细胞。然而,该方法的局限性是原代培养的 BMSC 纯度低,它与造血细胞和成纤维细胞混合。定期刷新原代细胞的培养基后,将非贴壁造血细胞与丢弃的培养基一起丢弃。此外,成纤维细胞可以通过细胞传代清除,P3 细胞是高度纯化的 BMSC。因此,P0 至 P2 细胞不能用于细胞治疗,这意味着需要额外的时间来纯化干细胞。使用荧光细胞分选和磁激活细胞分选方法,可以获得更多纯化的 BMSC,而这两种方法都很昂贵,而且选择时间长会损害细胞活力11。为了证明培养的细胞是 MSCs,我们参考了国际细胞治疗学会间充质和组织干细胞委员会提出的人 MSCs 定义,其中包括可塑性粘附特性、某些表型的阳性和阴性表达,如 CD45、CD90 等,以及多系分化能力18。
在大多数研究中,与颌面骨(如下颌骨和上颌骨)相比,股骨和髂嵴是 BMSC 的主要来源 9,16。然而,近年来研究中 hBMSCs 的位点特异性特征理论表明,来自不同骨骼的 hBMSCs 在分化能力、增殖活性、成骨和免疫方面具有不同的特性 6,8。位点特异性差异可能与不同的胚胎起源、对每个骨骼部位功能需求的适应、微环境、局部血管供应、荷尔蒙效应等有关。此外,研究表明,在骨移植后 6 个月内,移植的髂骨比颌骨表现出更快的垂直损失8。否则,研究发现下颌骨髓 MSC 的增殖活性优于髂骨髓 5,8,19,20。而这种增殖活动差异归因于下颌骨比髂骨有更多的血液供应和更快的骨转换率 5,6,8。研究还显示,来自下颌骨的 BMSCs 表达比来自股骨的 Runx-2 和 OCN 水平更高,并且来自下颌骨的 BMSCs 的成骨能力等于或高于来自股骨和髂骨的成骨能力 5,19,21。还发现 hmBMSCs 对钛能力的依从性比股骨 BMSC 强,这表明 hmBMSCs 更适合用于口腔种植学5。此外,一项为期 3 年的重建牙槽缺损的临床研究发现,牙髓中 MSCs 的再生骨由具有较高基质密度的完全致密骨组成,而 hm BMSCs 再生的海绵骨类似于正常人牙槽骨结构22。综上所述,hmBMSCs 是颌面再生等疾病的理想治疗性干细胞,因为具有相同的胚胎起源及其优越的特性。
然而,下颌骨的骨髓比股骨和髂骨少,因此从下颌骨获得足够的骨髓和 BMSCs 以供临床使用很重要。人髂骨抽吸物可以获得大量的骨髓来分离 MSC。研究人员还使用下颌骨抽吸物获得 MSCs,而下颌骨抽吸物的 MSCs 初始产量比髂骨抽吸物低三倍21。需要额外的切口来收集足够的下颌骨髓抽吸物,这增加了额外的手术创伤。此外,研究表明,来自下颌骨芯片的 MSC 的增殖潜力可能优于来自下颌骨骨髓抽吸物的增殖潜力 8,21。因此,在本研究中,丢弃的下颌骨松质骨芯片用于分离 MSCs。由于矢状劈开支截骨术或下颌角缩小成形术包括下颌骨的两侧,我们可以从患者那里获得足够的下颌骨骨髓,而不会造成任何额外的伤害。近年来,计算机辅助技术已广泛应用于口腔颌面外科手术,以改善手术效果并减少手术并发症23。为避免下颌骨骨髓采集过程中损伤下颌骨和神经,获取供者下颌骨 3D CT 图像,分析供者手术方案,确定供者部位,并在研究中实施手术模拟;因此,没有发生任何手术并发症。超声截骨刀片是一种组织特异性装置,允许外科医生在保护相邻软组织24 的同时进行精确的截骨术,也用于避免软组织损伤并保持获得的骨髓活性。
总之,本研究描述了一种可靠、简单、安全且廉价的方案来分离和培养足够的人下颌 MSC,可用于牙齿颌面部组织的细胞治疗。
披露声明
作者没有什么可披露的。
致谢
该研究得到了国家自然科学基金(No.81903249)和陕西省自然科学基础研究计划(No.2019JQ-701, No.2022JZ-50)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | PlantChemMed | PC-00005 | |
| Adipogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90031 | |
| Alcian blue solution | OriCell, Cyagen Biosciences | ALCB-10001 | |
| Alcohol | Macklin | e809056 | |
| Alizarin red staining solution | Solarbio | G1452 | |
| ALP staining solution | Beijing ComWin Biotech Co.,Ltd. | CW0051S | |
| Autoclave | ALP Co., Ltd., Japan | CL-40L | |
| CCK-8 solution | Yeasen Biotech Co., Ltd. | 40203ES80 | |
| Cell filter (70 μm pore size) | BD Biosciences | 352350 | |
| Cell incubator | Thermo Fisher Scientific | 41334177 | |
| Centrifuge | Eppendorf | 5805ZP761456 | |
| Centrifuge tube (50 mL, 15 mL) | Sangon Biotech | F600888-9001 | |
| Cetylpyridinium chloride | Aladdin | H108696 | |
| Chondrogenesis differentiation medium | OriCell, Cyagen Biosciences | HUXMX-90041 | |
| Clean bench/Laminar flow cabinet | BIOBASE | BBS-DDS00030 | |
| Culture dish (6 cm) | Thermo | 150462 | |
| Culture flasks (25 cm) | Thermo | 156367 | |
| Culture plates (96-well, 6-well) | Corning-Costar | 352350 | |
| Disposable sterile gloves and masks | Sangon Biotech | F516018-9001;F516038-9001 | |
| Disposable sterile syringe (1 mL) | Shaanxi longkangxin Medical Instrument Co., Ltd | 1.00009E+11 | |
| Dulbecco's modified Eagle's medium with high glucose (HG-DMEM) | Hyclone | SH30022.01B | |
| EDTA | Solarbio | E8040-500g | |
| Fetal bovine serum (FBS) | PlantChemMed | PC-00001 | |
| Flow cytometer | Beckman Coulter | EPICS XL | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD34 | Biolegend | 343503 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD44 | Biolegend | 338804 | |
| Fluorescein-isothiocyanate (FITC)-conjugated mouse monoclonal anti-human antibody against CD90 | Biolegend | 328108 | |
| Hemocytometer | Koraba | 30119480698 | |
| Icebox | Sangon Biotech | F615002-0001 | |
| Image J software | National Institute of Mental Health | ||
| Light microscope | OLYMPUS | IX71-2L20944 | |
| Microcentrifuge tubes | Sangon Biotech | F601620-0010 | |
| Microplate spectrophotometer | BioTek-EPOCH | 259091 | |
| Microtome | Feica | 1003001 | |
| Mimics software | Materialise | ||
| Minimum essential medium alpha (α-MEM) | Hyclone | SH30265.01 | |
| Oil red O staining solution | Solarbio | G1261 | |
| Osteogenic differentiation medium | OriCell, Cyagen Biosciences | HUXMA-90021 | |
| Penicillin and streptomycin | PlantChemMed | PC-86115 | |
| Phosphate buffer saline (PBS) | PlantChemMed | PC-00003 | |
| Phycoerythrin (PE)-conjugated mouse monoclonal anti-human antibody against CD45 | Biolegend | 304008 | |
| Pipette | SORFA | 320511 | |
| ProPlan CMF 3.0 | Materialise | ||
| Scissors, tweezers and knives | Shanghai Jinzhong Surgical instrument Co., Ltd | ZJA030,YAA110,J11010 | |
| Sterile wet gauze | HENAN PIAOAN GROUP Co., Ltd | ||
| Trypsin | Gibco | 17075029 | |
| Ultrasonic osteotome blade | Stryker Instruments | 5450-815-107 |
参考文献
- Ullah, I., Subbarao, R. B., Rho, G. J. Human mesenchymal stem cells - current trends and future prospective. Bioscience Reports. 35 (2), 1-8 (2015).
- Brown, C., et al. Mesenchymal stem cells: Cell therapy and regeneration potential. Journal of Tissue Engineering and Regenerative Medicine. 13 (9), 1738-1755 (2019).
- Trohatou, O., Maria, G. R. Mesenchymal stem/stromal cells in regenerative medicine: Past, present, and future. Cellular Reprogramming. 19 (4), 217-224 (2017).
- Heo, J. S., Choi, Y., Kim, H. S., Kim, H. O. Comparison of molecular profiles of human mesenchymal stem cells derived from bone marrow, umbilical cord blood, placenta and adipose tissue. International Journal of Molecular Medicine. 37 (1), 115-125 (2016).
- Li, C. J., Wang, F. F., Zhang, R., Qiao, P. Y., Liu, H. C. Comparison of proliferation and osteogenic differentiation potential of rat mandibular and femoral bone marrow mesenchymal stem cells in vitro. Stem Cells and Development. 29 (11), 728-736 (2020).
- Lloyd, B., et al. Similarities and differences between porcine mandibular and limb bone marrow mesenchymal stem cells. Archives of Oral Biology. 77 (5), 1-11 (2017).
- Yamaza, T., et al. Mouse mandible contains distinctive mesenchymal stem cells. Journal of Dental Research. 90 (3), 317-324 (2011).
- Akintoye, S. O., et al. Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals. Bone. 38 (6), 758-768 (2006).
- Mendi, A., Ulutürk, H., Ataç, M. S., Stem Yılmaz, D. cells for the oromaxillofacial area: Could they be a promising source for regeneration in dentistry. Advances in Experimental Medicine and Biology. 11 (44), 101-121 (2019).
- Hong, Y. Y., et al. Isolation and cultivation of mandibular bone marrow mesenchymal stem cells in rats. Journal of Visualized Experiments. (162), e61532 (2020).
- Chu, D. T., et al. An update on the progress of isolation, culture, storage, and clinical application of human bone marrow mesenchymal stem/stromal cells. International Journal of Molecular Sciences. 21 (3), 708 (2020).
- Yu, Y. J., et al. Activation of mesenchymal stem cells promotes new bone formation within dentigerous cyst. Stem Cell Research & Therapy. 11 (1), 476 (2020).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin embedded blocks. Methods in Molecular Biology. 1897, 253-268 (2019).
- Mathiasen, A. B., et al. marrow-derived mesenchymal stromal cell treatment in patients with ischaemic heart failure: final 4-year follow-up of the MSC-HF trial. European Journal of Heart Failure. 22 (5), 884-892 (2020).
- Maqsood, M., et al. Adult mesenchymal stem cells and their exosomes: Sources, characteristics, and application in regenerative medicine. Life Sciences. 01 (256), 118002 (2020).
- Reinders, M. J., et al. Autologous bone marrow-derived mesenchymal stromal cell therapy with early tacrolimus withdrawal: The randomized prospective, single-center, open-label TRITON study. American Journal of Transplantation: Official Journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 21 (9), 3055-3065 (2021).
- Shi, H. Y., et al. marrow-derived mesenchymal stem cells promote Helicobacter pylori-associated gastric cancer progression by secreting thrombospondin-2. Cell Proliferation. 54 (10), 13114 (2021).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8 (4), 315-317 (2006).
- Aghaloo, T. L., et al. Osteogenic potential of mandibular vs. long-bone marrow stromal cells. Journal of Dental Research. 89 (11), 1293-1298 (2010).
- Dong, W. J., et al. Phenotypic characterization of craniofacial bone marrow stromal cells: unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance. Cell and Tissue Research. 358 (1), 165-175 (2014).
- Lee, B. K., Choi, S. J., Mack, D., Oh, S. H. Isolation of mesenchymal stem cells from the mandibular marrow aspirates. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 112 (6), 86-93 (2011).
- Giuliani, A., et al. Three years after transplants in human mandibles, histological and in-line holotomography revealed that stem cells regenerated a compact rather than a spongy bone: biological and clinical implications. Stem Cells Translational Medicine. 2 (4), 316-324 (2013).
- Chen, Y. W., et al. Computer-assisted surgery in medical and dental applications. Expert Review of Medical Devices. 18 (7), 669-696 (2021).
- Gilles, R., Couvreur, T., Dammous, S. Ultrasonic orthognathic surgery: enhancements to established osteotomies. International Journal of Oral and Maxillofacial Surgery. 42 (8), 981-987 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。