Method Article
Визуализация и количественная оценка морфологии митохондрий у C. elegans в период старения
В этой статье
Резюме
Этот протокол обеспечивает стандартизированный подход к визуализации морфологии митохондрий в нескольких тканях C. elegans во время старения.
Аннотация
Митохондрии, важные клеточные органеллы, обнаруженные в большинстве эукариотических клеток, являются основными местами производства энергии посредством аэробного дыхания. Помимо этой хорошо известной роли «клеточной электростанции», митохондрии также участвуют во многих других важных клеточных процессах, включая регуляцию клеточного метаболизма, пролиферацию, иммунную сигнализацию и гормональную сигнализацию. Ухудшение функции митохондрий во время старения или при митохондриальном стрессе часто характеризуется отчетливыми изменениями морфологии и объема митохондрий. Нематода C. elegans является идеальной моделью для изучения этих изменений благодаря своему прозрачному телу и короткой продолжительности жизни, что облегчает микроскопию в реальном времени на протяжении всей ее жизни. Тем не менее, даже в области C. elegans доступны многочисленные трансгенные конструкции и методы митохондриальной визуализации, каждый из которых имеет свои ограничения. Здесь однокопийные, локализованные в матрице конструкции GFP представлены как надежный и надежный метод визуализации морфологии митохондрий у C. elegans. В этом исследовании особое внимание уделяется экспериментально контролируемым факторам для минимизации ошибок и уменьшения вариабельности между репликациями и между исследованиями при выполнении митохондриальной визуализации в процессе старения. Кроме того, mitoMAPR рекомендуется в качестве надежного метода количественной оценки изменений морфологии митохондрий по типам тканей в процессе старения.
Введение
Митохондрии представляют собой клеточные органеллы, окруженные двойной фосфолипидной мембраной, и играют важную роль в поддержании клеточной биоэнергетики как ключевого места для метаболизма и производства энергии1. Большое количество митохондрий непрерывно генерирует энергию в форме АТФ дляудовлетворения потребностей клеток. В дополнение к этим важным ролям, митохондрии также участвуют в сложных клеточных процессах, таких как передача сигналов, аутофагия, врожденный иммунитет, клеточный цикл и пути клеточной смерти 2,3. Митохондрии демонстрируют разнообразную морфологию, начиная от небольших отдельных органелл и заканчивая обширными взаимосвязанными трубчатыми сетями, в зависимости от различных энергетических потребностейи здоровья митохондрий.
Ключевой особенностью митохондрий является их динамическая природа, благодаря которой они могут чередоваться между этими различными формами посредством строго скоординированной и непрерывной последовательности событий деления и синтеза. Точный баланс между этими противоположными процессами регулирует морфологию, количество, размер и расположение митохондрий в цитоплазме. Кроме того, эти процессы синтеза и деления важны для поддержания контроля качества митохондрий5. Например, деление митохондрий является важным компонентом удаления поврежденных митохондрий с помощью митофагии и селективного удаления митохондрий с помощью аутофагии2. Митохондриальная динамика также играет важную роль в делении клеток, развитии, устойчивости к различным стрессорам и поддержании клеточного метаболизма6.
Нарушение митохондриальной динамики связано с многочисленными заболеваниями, включая нейродегенеративные расстройства, метаболические заболевания, сердечно-сосудистые заболевания и рак4. Кроме того, старение связано с резким ремоделированием митохондрий, в основном из-за изменений в динамике слияния-деления7. Таким образом, визуализация и мониторинг изменений в морфологии митохондрий при различных стрессовых или болезненных условиях и на протяжении всего процесса старения дает ценную информацию для понимания клеточной функции, механизма заболевания и потенциальных терапевтических стратегий.
Как и многие молекулярные пути, митохондриальная динамика и функция также высоко консервативны у эукариот, включая модельные организмы, такие как нематода Caenorhabditis elegans. Подобно клеткам человека, слияние митохондрий у C. elegans достигается за счет функции белков гуанинтрифосфатазы (ГТФазы), связанных с динамином, включая FZO-1 (ортолог Mfn1/2 млекопитающих) и EAT-3 (ортолог Opa1 млекопитающих), которые контролируют слияние внешней митохондриальной мембраны (ОММ) и внутренней митохондриальной мембраны (ВММ) соответственно8. Деление митохондрий регулируется динаминовым белком (DRP-1, ортолог Drp1 человека), который способствует делению митохондрий путем образования кольцеобразных комплексов вокруг внешней мембраны митохондрий, которые сужают и в конечном итоге разделяютмембраны митохондрий. Слияние митохондрий играет ключевую роль в контроле качества митохондрий, позволяя смешивать содержимое митохондрий, включая митохондриальную ДНК, белки и липиды, что позволяет дополнять частично поврежденные митохондрии содержимым здоровых митохондрий9. С другой стороны, деление митохондрий позволяет митохондриям делиться, создавая новые митохондрии и способствуя их распределению не только внутри цитоплазмы, но и дочерним клеткам во время деления клеток, обеспечивая надлежащее наследованиеи функцию митохондрий. Это событие также необходимо для сегрегации поврежденных или дисфункциональных митохондриальных сегментов, которые затем могут быть нацелены на деградацию посредством митофагии9.
C. elegans долгое время считался одной из самых мощных генетических модельных систем благодаря полному геному и наличию различных генетических инструментов, включая CRISPR/Cas9, который облегчает генетическиемодификации10, многочисленные методы сверхэкспрессии генов и бактериальный пищевой метод для РНК-интерференции (РНК-интерференции)11. Кроме того, их прозрачная анатомия позволяет получать микроскопические изображения у живых организмов12. Наконец, их относительно короткий срок службы, низкие затраты на обслуживание и простота производства большого количества животных соответствующего возраста делают их отличной модельной системой для биологии старения. Эти преимущества, в сочетании с известным сохранением основных митохондриальных регуляторных путей, делают C. elegans очень привлекательной модельной системой для изучения митохондриальной динамики во время старения.
Флуоресцентные маркеры широко используются в биологических исследованиях для визуализации и изучения клеточных компонентов, в том числе митохондрий. Существуют специфические клеточно-проницаемые красители, такие как MitoTracker и этиловый эфир тетраметилродамина (TMRE), которые обычно используются14. Первый используется для окрашивания общего отрицательно заряженного митохондриального матрикса15, тогда как второй используется для оценки относительного потенциала митохондриальной мембраны через положительно заряженный ион трифенилфосфония16. Несмотря на то, что они не требуют трансгенных веществ, толстая кутикула червей, которая изменяется в структуре и проницаемости с возрастом, а также изменчивость инфильтрации красителей в различных тканях затрудняют применение красителей у C. elegans17. Кроме того, оценка морфологии митохондрий осложняется потенциальными нецелевыми эффектами красителей, такими как агрегация красителей17. Вместо этого в модели червей обычно используются генетические методы экспрессии локализованных в митохондриях флуорофоров.
В данном исследовании основное внимание уделяется выделению штаммов, экспрессирующих локализованный в митохондриальном матриксе GFP (далее MLS::GFP) под промоторами, специфичными для клеточного типа. Важно отметить, что эти трансгенные линии были созданы с использованием метода MosSCI для обеспечения экспрессии репортера в одной копии в известном геномном локусе, что позволяет избежать проблем с другими доступными штаммами. Например, высокая экспрессия копий некоторых белков, нацеленных на митохондрии, приводит к вариабельности уровней экспрессии из-за интеграции экстрахромосомных плазмидных массивов в случайный локус с неизвестной копией под номером18. Кроме того, ранее было показано, что они вызывают повреждение митохондрий, поскольку это большая нагрузка на клетки, чтобы правильно локализовать сверхэкспрессированные митохондриальные белки. Таким образом, точность, стабильность и низкая экспрессия генов, а также легкость скрещивания с известными локусами делают эти трансгенные MosSCI предпочтительным методом. Используя эти штаммы, данное исследование стандартизирует методы визуализации митохондрий в мышцах, кишечнике и гиподерме C. elegans. Кроме того, в нем освещаются важные технические приложения и методы устранения неполадок, которые важно учитывать и обеспечивать воспроизводимый экспериментальный анализ митохондрий во время старения у C. elegans.
протокол
Подробная информация о реагентах и оборудовании, использованных в данном исследовании, приведена в Таблице материалов.
1. Рост и содержание C. elegans
- Подготовка тарелок для питательных сред нематод (NGM)
- Для культивирования C. elegans используют стандартные 2% агаровые планшеты с NGM, содержащие 1 мМ CaCl2, 12,93 мкМ (5 мкг/мл) холестерина, 25 мМ KPO4 (pH 6,0), 1 мМ MgSO4, 2,5 мМ (0,25% w/v) пептона и 51,3 мМ NaCl. Смотрите подробный метод заливки пластин NGM, описанный в Castro Torres et al.20.
ПРИМЕЧАНИЕ: Для экспериментов с РНК-интерференцией (РНК-интерференция) добавьте 1 мл 1 М IPTG и 1 мл 100 мг/мл карбенициллина на 1 л NGM-агаровых планшетов. - После того как планшеты NGM затвердеют, выращивают культуру OP50 в лизогенном бульоне (LB) в течение 24-48 ч при комнатной температуре или выращивают культуру HT115, несущую пустую векторную плазмиду pL4440 в LB с антибиотиками (ампициллин/карбенициллин 100 мкг/мл + тетрациклин 5 мкг/мл) при встряхивании при 37 °С в течение 12-16 ч.
ПРИМЕЧАНИЕ: Эта плазмида доступна из коммерческих источников (см. Таблицу материалов). - Высейте 200 μл культуры OP50 или HT115 на планшеты 60 мм или 1 мл на планшеты 100 мм.
- Высушите пластины до тех пор, пока они не перестанут быть влажными, и храните их в герметичных контейнерах при температуре 4 °C до 2 месяцев.
- Необязательно: Добавьте 100 мкл 10 мг/мл 5-фтор-2'-дезоксиуридина (FUDR) непосредственно на планшеты NGM-агара, которые засеяны бактериями, для химической стерилизации L4/взрослых червей и предотвращения развития молодых червей.
ПРИМЕЧАНИЕ: Штаммы, разработанные и использованные в этом исследовании:
(1) RHS191 - uthSi17[myo3p::MLS::GFP::unc-54 3'UTR::cb-unc-119(+)] I
(2) RHS192 - uthSi83[col19p:: MLS::GFP::unc-54 3'UTR::cb-unc-119(+)]I
(3) RHS193 - uthSi80[vha-6p:: MLS::GFP::unc-54 3'UTR::cb-unc-119(+)] IV
- Для культивирования C. elegans используют стандартные 2% агаровые планшеты с NGM, содержащие 1 мМ CaCl2, 12,93 мкМ (5 мкг/мл) холестерина, 25 мМ KPO4 (pH 6,0), 1 мМ MgSO4, 2,5 мМ (0,25% w/v) пептона и 51,3 мМ NaCl. Смотрите подробный метод заливки пластин NGM, описанный в Castro Torres et al.20.
- Синхронизация C. elegans путем отбеливания
- Для крупномасштабного анализа, требующего большого количества нематод, разрежьте 60-миллиметровую пластину NGM-агара, заполненную животными, на мелкие кусочки и нарежьте их на 100-миллиметровые пластины, которые засеяны бактериями для расширения. Подождите 2-3 дня, чтобы 100-миллиметровые пластины наполнились червями при выращивании при температуре 20 °C после измельчения. Более подробные рекомендации по выращиванию животных см. в Castro Torres et al.20.
- Для сбора червей для синхронизации вылейте 5-10 мл раствора М9 (22 мМ KH2PO4 моноосновного, 42,3 мМ Na2HPO4, 85,6 мМ NaCl, 1 мМ MgSO4) на 100 мм NGM-агаровые пластины с червями, и аккуратно взболтайте раствор М9, чтобы развязать червей с бактериальных газонов.
- Соберите червей с помощью серологической пипетки и переложите их в конические пробирки объемом 15 мл.
ПРИМЕЧАНИЕ: Рекомендуется использовать стеклянные серологические пипетки, так как пластиковые серологические пипетки имеют тенденцию вызывать прилипание червей к внутренней стенке пластиковых пипеток. - Центрифугируйте в течение 30 с при давлении 1 100 x g при комнатной температуре, чтобы гранулировать черви и аспирировать надосадочную жидкость с помощью вакуумного насоса.
- Приготовьте 5 мл отбеливающего раствора, содержащего 1,5 мл 6% гипохлорита натрия, 0,75 мл 5 М NaOH или KOH и 2,75 мл dH2O. Влейте 5 мл отбеливающего раствора в гранулу червя.
ВНИМАНИЕ: На этом этапе рекомендуется надеть перчатки и лабораторный халат, так как растворы гипохлорита и гидроксида натрия вызывают коррозию. - Инкубируйте смесь червь + отбеливающий раствор в течение ~4-6 минут до полного растворения всех тел животных и только яиц. Энергично встряхните смесь, чтобы ускорить процесс растворения.
ПРИМЕЧАНИЕ: Проверяйте червей каждую минуту под микроскопом. Сократите или продлите время отбеливания в зависимости от того, насколько растворены тела взрослых червей. Оставление яиц в отбеливающем растворе на длительный период времени приведет к повреждению яиц и повлияет на жизнеспособность нематод. - Центрифугируйте смесь яиц и отбеливающего раствора в течение 30 с при 1 100 x g при комнатной температуре, чтобы гранулировать яйца, а затем осторожно отсасывайте надосадочную жидкость с помощью вакуумного насоса, следя за тем, чтобы яичные гранулы не аспирировались.
ПРИМЕЧАНИЕ: Рекомендуется проводить промывки быстро, чтобы предотвратить длительное воздействие отбеливающего раствора на яйца. - Яйца промыть 5-10 мл раствора М9 4 раза.
- Ресуспендируйте яйца в небольшом объеме раствора М9 и положите их на планшеты NGM, засеянные бактериями, путем пипетирования до 50 μл. Рассчитайте приблизительную оценку количества яиц путем пипетирования 3-5 μЛ яичной смеси на планшет и подсчета количества яиц в этом объеме. Добавьте М9, чтобы развести яичную смесь до счетного количества яиц в этом объеме.
ПРИМЕЧАНИЕ: Рекомендуется закладывать менее 100 червей на тарелку, так как черви могут голодать до 1-го дня взрослой жизни, когда на них наносится слишком много животных. Более подробные рекомендации по нанесению гальванических покрытий животным см. в Castro Torres et al.20. - В качестве альтернативы, L1-арест нематод для более тесной синхронизации возраста. Для L1-задержания добавьте соответствующий объем раствора М9 в яичную гранулу в коническую пробирку объемом 15 мл до объема 10-12 мл. Дайте червям вращаться во вращателе в течение 16-24 часов при температуре 20 °C. Центрифугируйте (как на шаге 1.2.7) и аспирируйте надосадочную жидкость. Рассчитайте концентрацию L1 у животных и поместите их на планшеты NGM, как описано для яиц на шаге 1.2.9.
- Состарьте популяцию C. elegans до желаемого возраста: Переведите L4/взрослых животных на планшеты, содержащие 5-фтор-2'-дезоксиуридин (FUDR), как описано в шаге 1.1.6, чтобы предотвратить потомство и уничтожить любое уже произведенное потомство. Альтернативные методы выведения червей без FUDR см. в Castro Torres et al.20.
ПРИМЕЧАНИЕ: Необходимо учитывать некоторые важные факторы, прежде чем выбрать отбеливание в качестве метода синхронизации червей на их первой личиночной стадии. Как подчеркивалось ранее, чрезмерное воздействие отбеливателя может повредить эмбрионы, снизить скорость вывода и создать давление отбора для устойчивых к обесцвечиванию штаммов, потенциально изменяя генетику популяции. Кроме того, если эмбрионы остаются без питания в течение длительного периода времени, истощение питательных веществ может нарушить метаболизм и развитие. Поэтому в качестве альтернативы методам отбеливания можно использовать методы яйцекладки или NemaSync. Метод процедуры откладывания яиц поэтапно описан в упомянутом исследовании Castro Torres et al.20. NemaSync является более новым и более дорогим коммерческим методом, при котором для синхронизации червей без использованияхимических реагентов используется ручной синхронизатор червей.
2. Визуализация митохондрий у C. elegans
- Подготовка предметных стекол для визуализации C. elegans
- Добавьте 10-20 мкл раствора М9 на предметное стекло и перенесите нужное количество взрослых червей в определенном возрасте в раствор на предметном стекле. Рекомендуется примерно 25 червей.
ПРИМЕЧАНИЕ: Использование традиционных методов паралича у червей (например, тетрамизола или азида натрия) может вызвать фрагментацию митохондрий при определенных условиях (см. ниже). Вместо этого рекомендуется использовать слайды HistoBond, которые имеют поверхность с постоянным положительным поверхностным зарядом, что позволит уменьшить движение червей без использования препаратов, которые могут вносить артефакты. Важно установить соответствующее соотношение червей и раствора M9, так как малые объемы могут привести к тому, что животные будут раздавлены между предметным стеклом и покровным стеклом, в то время как большие объемы приведут к тому, что животные будут двигаться во время получения изображения. С рекомендациями можно ознакомиться в таблице 1. - В качестве альтернативы, для использования препаратов, парализующих гельминтов, обратитесь к репрезентативным результатам этой рукописи для диапазона концентраций и временных точек, которые могут быть использованы при ограниченной фрагментации митохондрий.
Примечание: Несмотря на то, что у здоровых животных дикого типа не было значительной фрагментации, важно помнить, что некоторые мутанты или состояния могут испытывать митохондриальную фрагментацию при той же концентрации этих препаратов, поэтому при использовании этих препаратов требуется некоторое тестирование. - Накройте червей раствором М9 на предметном стекле с помощью покровного стекла и используйте лак для ногтей, чтобы запечатать боковые стороны и предотвратить испарение раствора М9.
- Дополнительно: Для визуализации мышц скатайте червей, осторожно подталкивая покровное стекло. Это позволяет мышцам стенки тела по бокам червей быть лучше выровнены с фокальной плоскостью для получения более качественных изображений.
- Добавьте 10-20 мкл раствора М9 на предметное стекло и перенесите нужное количество взрослых червей в определенном возрасте в раствор на предметном стекле. Рекомендуется примерно 25 червей.
- Визуализация митохондрий с помощью сложного микроскопа
- Используйте стандартный широкоугольный микроскоп для мышечных и подкожных митохондрий (myo-3p::MLS::GFP и col-19p::MLS::GFP).
ПРИМЕЧАНИЕ: Был использован коммерчески доступный тепловизор, оснащенный объективом 63x/1.4 Plan Aprochromat, фильтром GFP (11525314), камерой DFC9000 GT и источником света LED5, а также совместимое программное обеспечение для микроскопа. - Оптимизируйте настройки визуализации для каждого микроскопа и экспериментальной установки.
ПРИМЕЧАНИЕ: Однако, в качестве отправной точки, параметры для визуализации с помощью тепловизора, используемого в этой рукописи, следующие: Размеры составляют 2048 (x) * 2048 (y) пикселей с шагом 0,50 мкм для подкожных митохондрий и "System Optimized", автоматически рассчитанный программным обеспечением для мышечных митохондрий. Время экспозиции составляет 50 мс для мышечных митохондрий и 50 мс для подкожных митохондрий. Светодиод с длиной волны 475 нм был настроен на 50% мощности, а фильтр нейтральной плотности был установлен на 30% для мышц и 17% для подкожных митохондрий. Z-диапазон начинается от того места, где виден сигнал GFP, и заканчивается там, где он заканчивается. Чтобы свести к минимуму шум в максимальной проекции, можно уменьшить количество z-плоскостей, используемых для максимальной проекции. - Для визуализации кишечных митохондрий (vha-6p::MLS::GFP) используйте конфокальный микроскоп.
ПРИМЕЧАНИЕ: Визуализация проводилась на коммерчески доступном конфокальном микроскопе, оснащенном объективом 63x/1.4 Plan ApoChromat, лазером белого света (WLL), акустооптическим светоделителем, детекторами HyD S и работающей на программном обеспечении микроскопа. Как уже упоминалось ранее, необходимо оптимизировать каждую отдельную экспериментальную установку, но в качестве отправной точки для визуализации с помощью Stellaris, использованных в этом исследовании, следующие параметры: WLL был установлен на максимальную мощность 85,00 % и с лазерной линией 485 нм с интенсивностью 3,00 %. Детектор HyD S был настроен на 490-590 нм с коэффициентом усиления 25 в аналоговом режиме. Мы отсканировали в одном направлении область размером 1024 (x) * 1024 (y) или 82,01 мкм (x) * 82,01 мкм (y) с 5 (z) пикселями с шагом 0,495 мкм (размер z варьируется в зависимости от размера червей или тканей) со скоростью сканирования 1000 Гц, зумом 2,25, средним значением линии 2 и отверстием 1 а.е. (95,5 мкм). Z-диапазон начинается от того места, где виден сигнал GFP, и заканчивается там, где он заканчивается. Чтобы свести к минимуму шум в максимальной проекции, можно уменьшить количество z-плоскостей, используемых для максимальной проекции.
- Используйте стандартный широкоугольный микроскоп для мышечных и подкожных митохондрий (myo-3p::MLS::GFP и col-19p::MLS::GFP).
- Количественная оценка морфологии митохондрий
ПРИМЕЧАНИЕ: Для получения подробной информации обратитесь к Schindelin et al.22 и см. дополнительный рисунок 1A-D.- Загрузите и установите программное обеспечение FIJI (Fiji - это просто ImageJ, https://fiji.sc/). Затем откройте FIJI.
- Чтобы скачать и установить макрос MitoMAPR, скачайте исходный код 1 с https://doi.org/10.7554/eLife.49158.033. Затем скопируйте весь код, указанный в разделе "A.). Код IJM для MitoMAPR-1.0." Далее откройте Fiji, перейдите в раздел Плагины > Новый макрос > и вставьте ранее скопированный код в окно макроса. Перейдите в раздел «Файл» > опцию «Сохранить как» и сохраните макрос для использования в будущем.
- Откройте 3D-микроскопическое изображение с Z-стеками в FIJI, перетащив файлы на панель инструментов Fiji или перейдя в раздел «Файл > открыть».
- Чтобы создать максимальную проекцию изображения, перейдите в раздел «Изображение» > «Стопки» > «Проект Z», затем выберите диапазон срезов с изображениями в фокусе, которые должны быть максимально спроецированы, и выбрав «Максимальная интенсивность » в качестве типа проекции.
- Сохраните изображение в формате TIFF, перейдя в Файл > Сохранить как > Tiff.
- Обрезайте области интереса (ROI) из полных изображений с помощью инструмента «Прямоугольник», нарисуйте ROI, а затем перейдите к разделу «Изображение > обрезке».
- Сохраните изображение в формате TIFF, перейдя в Файл > Сохранить как > Tiff.
- Запустите ранее сохраненный макрос MitoMAPR, перетащив файл макроса на панель инструментов Fiji, затем нажмите « Выполнить». В новом окне будет предложено выбрать папку, в которой был сохранен файл Tiff в версии 2.3.6.
- В новом окне появится предложение выбрать область; Создайте прямоугольник на изображении с помощью инструмента «Прямоугольник», как упоминалось ранее в шаге 2.3.4, и нажмите Ok.
ПРИМЕЧАНИЕ: Можно выбрать все изображение, если оно было обрезано ранее, как описано в шаге 2.3.6. Сохраните окно «Данные» со всеми значениями, относящимися к морфологии митохондрий, в виде файла Excel, перейдя в раздел «Файл» > «Сохранить как > «Сохранить».
- Пакетная обработка образцов с использованием макросов FIJI
- Создание макроса для указания области анализируемых изображений. Откройте Fiji и перейдите в раздел «Плагины» > «Новый макрос >». Вставьте следующий код в текстовое поле и сохраните макрос, как описано в версии 2.3.2 (дополнительный рисунок 1E-H).
ПРИМЕЧАНИЕ: Создайте прямоугольник (100, 100, 200, 200); run (Укажите..., ширина = 100, высота = 100, x = 100, y = 100 в масштабе). - Создайте макрос для сохранения всех открытых изображений в виде файлов TIFF. В окне макроса перейдите в раздел Файл > Создать и вставьте следующий код в текстовое поле. Сохраните макрос, как описано в версии 2.3.2.
ПРИМЕЧАНИЕ: dir = getDirectory(" Выберите папку"); ids=newArray(nImages); для (i=0; i - Создадим макрос для пакета MitoMAPR. Перейдите https://doi.org/10.7554/eLife.49158.033 исходный код 1 и скопируйте все коды, указанные в разделе B.). Код IJM для MitoMAPR-1.0_Batch". В окне макроса перейдите в раздел Файл > Создать, вставьте код из исходного кода 1 в текстовое поле и сохраните макрос, как описано в шаге 2.3.2.
- Создайте макрос для итеративной обрезки. Перейдите в https://doi.org/10.7554/eLife.49158.033 исходный код 1 и скопируйте все коды, упомянутые в разделе C.) IJM-код для CropR". В окне макроса перейдите в раздел Файл > Новый, вставьте код из исходного кода 1 в текстовое поле и сохраните макрос, как описано в шаге 2.3.2.
- Чтобы начать пакетную обработку, сначала сохраните все изображения для обработки в формате TIFF, открыв все изображения и запустив макрос, сохраненный на шаге 2.4.2. Все изображения будут сохранены в формате TIFF в указанной папке. Закройте все изображения после сохранения.
- Если изображения, сохраненные на шаге 2.4.5, являются 3D-изображениями (изображениями, содержащими z-стеки), преобразуйте их в 2D-изображения, сделав их Z-проекциями. Чтобы выполнить пакетный Z-проект изображений, откройте окно пакетной обработки, перейдя в раздел «Обработать > пакетной > макрос » в главном окне FIJI.
- В поле "Ввод" выберите расположение папки, содержащей все обрабатываемые 3D-изображения начиная с версии 2.4.5. В поле "Вывод" выберите нужное место для сохраненных изображений после обработки. Выберите формат вывода TIFF. Вставьте следующий код в большое текстовое поле в окне и нажмите кнопку процесса : run("Z Project...", "projection=[Max Intensity]").
- Обрезка ROI с идентичными размерами из всех обрабатываемых 2D-изображений с помощью итеративного макроса обрезки из шага 2.4.4 в сочетании с макросом указания региона из шага 2.4.3. Запустите итеративный макрос обрезки из шага 2.4.4. Появится окно с запросом на создание каталога.
- Выберите папку, содержащую только 2D-изображения из шага 2.4.5 или 2D-Z-проекционные изображения из шага 2.4.6 и нажмите кнопку Выбрать . Макрос откроет одно из изображений в выбранной папке, и появится окно с надписью «сделать выбор» с двумя кнопками.
- Запустите указанный макрос выделения из шага 2.4.3. Измените значения ширины и высоты в текстовом поле макроса по мере необходимости, чтобы изменить размер выборки, и нажмите кнопку «Выполнить », чтобы просмотреть новую выборку. Изменение значений X и Y в макросе приведет к изменению положения выделения в верхнем левом углу.
- Как только размеры выделения будут удовлетворительными, перетащите прямоугольник в нужную область, а затем нажмите кнопку OK в окне «сделать выбор». Обрезанный регион будет сохранен в папке, выбранной на шаге 2.4.7.
- Макрос переборет все оставшиеся изображения в папке. Для каждого изображения запустите макрос, начиная с шага 2.4.8, не изменяя значения размеров, чтобы обеспечить обрезку одинаковых размеров для всех изображений. Для каждого изображения перетащите прямоугольник выделения в нужное место и нажмите кнопку «ОК » в окне «сделать выделение».
- Откройте папку с обрезанными изображениями из шагов 2.4.8-2.4.9 и переместите все обрезанные изображения в новую папку.
- Проанализируйте все обрезанные изображения, запустив пакетный макрос MitoMAPR из шага 2.4.3. В новом окне вам будет предложено выбрать каталог. Выберите папку со всеми обрезанными изображениями из шага 2.4.10. После завершения появится окно с именем «Данные» со всеми значениями, относящимися к морфологии митохондрий. Сохраните все данные в виде файла Excel, как описано в шаге 2.3.9.
- Создание макроса для указания области анализируемых изображений. Откройте Fiji и перейдите в раздел «Плагины» > «Новый макрос >». Вставьте следующий код в текстовое поле и сохраните макрос, как описано в версии 2.3.2 (дополнительный рисунок 1E-H).
Результаты
C. elegans является отличной моделью для митохондриальной визуализации благодаря своему прозрачному телу, которое позволяет легко визуализировать живых животных цельного червя без чрезмерной подготовки образцов. Кроме того, морфологию митохондрий в различных тканях можно легко визуализировать с помощью тканеспецифических промоторов для экспрессии митохондриальных флуоресцентных белков. Здесь myo-3p (для мышечных митохондрий), vha-6p (для кишечных митохондрий) и col-19p (для подкожных митохондрий) были использованы для стимуляции митохондриальной GFP (митохондриальной локализации белка ATP-1). Митохондрии мышц стенки тела C. elegans демонстрируют трубчатую морфологию, выравнивающуюся вдоль мышечных волокон (миофибрилл) (рис. 1A); кишечные митохондрии показали высоковзаимосвязанные, паутинистые структуры с менее равномерным выравниванием (рисунок 1B); а гиподерма имеет трубчатые митохондрии, которые кажутся более округлыми или овальной формы по сравнению с кишечником или мышцами (рисунок 1C). Морфология митохондрий в целом одинакова по всей длине червя в мышцах и кишечнике, но гиподерма демонстрирует некоторые незначительные различия во взаимосвязи митохондрий между проксимальным и дистальным концами червя. Таким образом, для достижения воспроизводимых экспериментальных результатов рекомендуется ориентироваться на конкретную область своего тела. Здесь последовательно визуализируется область между глоткой и вульвой на ~100-200 мкм ниже глотки.
Для мышечных и гиподермальных митохондрий их визуализация под сложным микроскопом обеспечивает достаточное разрешение из-за плоского расположения клеток и низкого уровня расфокусированного света. Тем не менее, кишечные митохондрии трудно наблюдать с помощью сложного микроскопа, так как большой объем кишечника ограничивает разрешение из-за большого количества расфокусированного света от других отделов кишечника (рис. 2). Поэтому рекомендуется визуализировать кишечные митохондрии под конфокальным микроскопом, чтобы уменьшить количество расфокусированного света и визуализировать правильную морфологию митохондрий.
Форма митохондрий очень динамична и изменяется в зависимости от метаболической среды животныхили даже из-за воздействия переменной жесткости субстрата24. Таким образом, оставление животных на предметных стеклах микроскопа в течение длительных периодов времени в отсутствие источника пищи и на жесткой стеклянной подложке может потенциально повлиять на морфологию митохондрий. В этом исследовании было обнаружено, что митохондрии червей фрагментируются примерно через 30 минут на предметном стекле в растворе М9, причем наиболее фрагментированную демонстрацию наблюдаются в подкожных митохондриях (рис. 3). Поэтому визуализация митохондрий должна быть выполнена быстро после подготовки образца.
Химические вещества, ограничивающие подвижность червей, в том числе азид натрия и тетрамизол, обычно используются для визуализации C. elegans в реальном времени, поскольку неподвижные черви необходимы для захвата нескольких z-срезов животных для 3D-визуализации. Предыдущие исследования показали, что воздействие азида натрия или тетрамизола может привести к фрагментации митохондрий25. Удивительно, но было обнаружено, что азид натрия - даже в высоких концентрациях - оказывает ограниченное влияние на морфологию митохондрий в мышцах или кишечнике. Тем не менее, в гиподерме митохондриальная фрагментация наблюдалась раньше, чем в контрольной группе M9 (рис. 3). Важно отметить, что высокие концентрации тетрамизола (100 мМ) приводили к значительной фрагментации митохондрий сразу после воздействия во всех типах клеток. Для сравнения, средние концентрации (10 мМ) приводили к более быстрой фрагментации по сравнению с контролем M9. Низкие концентрации (1 мМ) оказывали ограниченное влияние на морфологию митохондрий. Эти данные свидетельствуют о том, что использование азида натрия может быть жизнеспособным вариантом для быстрой визуализации митохондрий, в то время как тетрамизола в целом следует избегать.
Как и ожидалось, митохондрии всех тканей C. elegans демонстрируют фрагментацию в ходе естественного процесса старения (рис. 4A). Фрагментацию можно визуализировать в виде митохондрий, представляющих собой более усеченные и сферические структуры, которые резко отличаются от линейных трубчатых митохондрий, проявляющихся у молодых животных. Важно отметить, что в более позднем возрасте в кишечнике увеличивается количество сферических аутофлуоресцентных структур, поэтому необходимо соблюдать осторожность, чтобы не перепутать аутофлуоресценцию с реальными митохондриальными структурами. Поскольку изменения в структуре митохондрий у червей могут различаться, важно проводить количественную оценку морфологии митохондрий на выборке значительного размера, а не просто визуализировать несколько червей. Здесь был использован mitoMAPR, который позволяет проводить автоматическую количественную оценку морфологии митохондрий с использованием разнообразного набора метрик, включая объекты, сети, соединения на сеть, точки соединения, длину объекта, митохондриальный след, митохондриальное покрытие и площадь объекта (Дополнительная таблица 1 и Дополнительная таблица 2). Автоматизация устраняет субъективную предвзятость у пользователя. Здесь мы сообщаем, что метрика длины объекта является оптимальной для количественного измерения изменений морфологии мышц и кишечных митохондрий во время старения, а метрика точек соединения — для измерения изменений морфологии митохондрий гиподермальных клеток во время старения (рис. 4B).
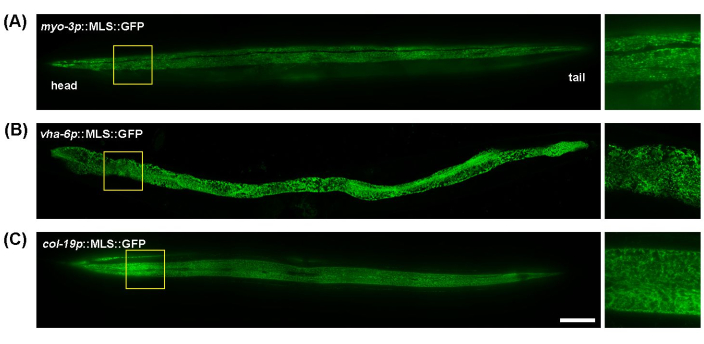
Рисунок 1: Изображения митохондрий по всему телу C. elegans. Митохондриальную визуализацию проводили на протяжении всего 5-го дня взрослых животных, выращенных на EV со стадии L1 у трансгенных животных с экспрессией MLS::GFP в мышцах (А), кишечнике (В) и гиподерме (С). Масштабная линейка: 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Сравнение митохондриальной визуализации между сложным микроскопом и конфокальным микроскопом. Митохондриальная визуализация проводилась на 1-й день взрослых животных, выращенных на EV со стадии L1 у трансгенных животных с экспрессией MLS::GFP в мышцах (А), кишечнике (В) и гиподерме (С). Масштабная линейка: 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Оценка фрагментации митохондрий различных тканей после лечения М9, азидом натрия и тетрамизолом. Митохондриальная визуализация проводилась у взрослых животных 1-го дня с экспрессией MLS::GFP в мышцах, кишечнике и гиподерме. Животных выращивали на EV со стадии L1. Животных помещали на предметные стекла, содержащие М9, азид натрия (1 мМ, 10 мМ и 100 мМ) или тетрамизол (1 мМ, 10 мМ и 100 мМ), и визуализацию проводили сразу после подготовки предметного стекла (0 минут) или через 15 минут или 30 минут после подготовки предметного стекла. Репрезентативные изображения показаны для n > 5 животных на штамм для 2 биологических реплик. Масштабные линейки: 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Митохондриальная визуализация C. elegans во время старения в различных тканях и количественная оценка морфологии митохондрий с помощью MitoMAPR. (А) Митохондриальная визуализация проводилась у взрослых животных на 1, 5, 9, 13 и 15 день взрослого возраста с экспрессией MLS::GFP в мышцах, кишечнике и гиподерме. Животных выращивали на EV со стадии L1 и переводили на планшеты EV, содержащие FUDR, с 1-го дня взрослой стадии. Изображения репрезентативны для n ≥ 5 животных на штамм для ≥ 3 биологических репликатов. Масштабная линейка: 5 мкм. (B) Количественная оценка длины объекта мышечных митохондрий и кишечных митохондрий червей в дни 1, 5, 9, 13 и 15, а также количественная оценка точек соединения подкожных митохондрий червей в дни 1, 5, 9, 13 и 15. Все отдельные точки данных в сочетании со средним значением ± SD. Графики были построены и статистически проанализированы с использованием t-критерия Стьюдента. ns = не значимо, *p < 0,03; **p < 0,002; р < 0,0002; p < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Дни глистов | Количество червей | Объем буфера (мл) |
| 1 | 25 | 13 |
| 5 | 25 | 14 |
| 9 | 20 | 15 |
| 13 | 20 | 15 |
Таблица 1: Рекомендуемое количество червей и объемы буфера при подготовке слайдов.
Дополнительный рисунок 1: Рабочие процессы применения количественной оценки одного изображения с использованием MitoMAPR и пакетной обработки для нескольких изображений. (A) Рабочий процесс количественной оценки морфологии митохондрий по одному изображению с использованием макроса MitoMAPR. (B) Z-проекция необработанного файла 3D-изображения с использованием Фиджи (максимальная проекция). (C) Обрезка области интереса из спроецированного изображения Z. (D) Изображения скелетов, полученные с помощью макроса MitoMAPR. Масштабные линейки: 5 мкм. (E) Рабочий процесс количественной оценки морфологии митохондрий по нескольким изображениям с использованием пакетного процесса с использованием макроса MitoMAPR. (F) Скриншот макроса обрезки. (G) Скриншот пакетного процесса для проекции Z. (H) Скриншот окна подтверждения выбора макроса пакетной обрезки. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 1: Количественный анализ показателей митохондриальной морфологии в мышечной ткани C. elegans . Регистрируемые метрики включают объекты, сети, соединения в сети, точки соединения, длину объекта, митохондриальный след, площадь объекта и митохондриальное покрытие, измеренное в разные дни. Полученные данные обеспечивают основу для оценки изменений морфологии митохондрий с возрастом. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 2: Влияние иммобилизующих химических веществ на морфологию митохондрий у C. elegans. Данные включают в себя такие измерения, как объекты, сети, соединения на сеть, точки соединения, длина объекта, митохондриальный след, площадь объекта и покрытие митохондрий в различных концентрациях и временных точках после подготовки образца с помощью буфера M9 или различных концентраций тетрамизола и азида натрия. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Флуоресцентная визуализация морфологии митохондрий является наиболее распространенным способом определения изменений в митохондриях. В то время как передовые методы микроскопии, такие как просвечивающая электронная микроскопия (ПЭМ), атомно-силовая микроскопия и криоэлектронная микроскопия, обеспечивают более высокое разрешение, флуоресцентная микроскопия остается более доступной и доступной для большинства исследователей. Кроме того, флуоресцентная микроскопия может быть выполнена на живых клетках, а на прозрачных модельных организмах, таких как C. elegans, визуализация может быть выполнена на целых животных26,27. Визуализация трансгенных C. elegans довольно проста, а генетически кодируемые флуоресцентные маркеры позволяют получить более надежную и надежную визуализацию митохондрий, поскольку они не требуют сложной обработки образцов и не страдают от вариабельного окрашивания в зависимости от типов клеток или состояний от обычных митохондриальных красителей, таких как MitoTracker или TMRE 28,29,30. Генетически кодируемые флуоресцентные маркеры обычно включают прямое мечение митохондриальных белков флуорофорами или конъюгацию флуорофоров с минимальной последовательностью митохондриальной локализации. Эти конструкции часто управляются тканеспецифичными промоторами, что позволяет визуализировать митохондрии в различных тканях, таких как мышцы, кишечник или ткани гиподермы. Как правило, эти флуоресцентно меченые белки чрезмерно экспрессируются, что может иметь потенциально нежелательные физиологические эффекты, если полноразмерные митохондриальные белки чрезмерно экспрессируются; таким образом, оптимальным вариантом являются минимальные последовательности MLS32. Тем не менее, даже при сверхэкспрессии минимальных слияний MLS и флуоресцентных белков следует избегать высокой сверхэкспрессии, так как импорт большого количества белка в митохондрии может разрушить потенциал митохондриальной мембраны и повлиятьна здоровье животных. В то время как исчерпывающая характеристика всех доступных в настоящее время штаммов C. elegans выходит за рамки данной рукописи, подробный сравнительный анализ многочисленных митохондриальных репортеров, а также плюсы и минусы каждого из них можно найти здесь31.
Для визуализации митохондрий на живых клетках у C. elegans стандартная комбинированная или широкопольная микроскопия может быть предпочтительным вариантом из-за высокой скорости и простоты этих методов по сравнению с конфокальной микроскопией. В этом исследовании показано, что плоские клетки, такие как мышцы и гиподерма, получают минимальную пользу от конфокальной микроскопии, а комплексная микроскопия позволяет получить данные с достаточным разрешением для визуализации правильной морфологии митохондрий. Более крупные клетки, такие как кишечник, затрудняют комплексную микроскопию из-за расфокусированного света. Таким образом, конфокальная микроскопия необходима для надежной визуализации морфологии кишечных митохондрий.
Важным фактором для 3D-визуализации по всей толщине ткани у живых животных является предотвращение движения червей во время получения изображения. Исследователи часто используют методы паралича червей, такие как тетрамизол или азид натрия34. Азид натрия ингибирует цитохром соксидазу (комплекс IV), критически важный фермент в цепи переноса электронов митохондрий, что приводит к общему параличу из-за недостатка АТФ, необходимого для мышечных сокращений и других клеточных функций34,35. Тетрамизол действует, имитируя ацетилхолин в нервно-мышечных соединениях, вызывая стойкую деполяризацию и сокращение мышц36. Однако воздействие этих препаратов может вызвать фрагментацию митохондрий, вызывая окислительный стресс23. В этом исследовании было установлено, что тетрамизол очень быстро индуцировал фрагментацию митохондрий, но азид натрия оказывал гораздо более ограниченное действие.
C. elegans предлагает очень простой и легкий способ изучения влияния старения на морфологию митохондрий из-за его короткой продолжительности жизни и легкости старения животных. В данном случае мы решили использовать воздействие FUDR, который является надежным методом химической стерилизации животных путем предотвращения репликации ДНК 20,37,38. Тем не менее, FUDR может оказывать нежелательное воздействие на определенные параметры старения, и для тех, кто обеспокоен нецелевыми эффектами FUDR,можно использовать другие стратегии удаления потомства. Например, существуют стерильные мутанты, в том числе чувствительный к температуре мутант зародышевой линии glp-4, или мутанты с дефицитом сперматозоидов, такие как CF512 40,41,42. В качестве альтернативы, животных также можно естественным образом состарить, вручную выбирая взрослых особей из их потомства.
Количественная оценка изменений в морфологии митохондрий также является очень важным фактором, поскольку может наблюдаться значительная вариабельность морфологии митохондрий у разных животных. Таким образом, проведение количественного анализа и статистики на выборке достаточного размера имеет важное значение для того, чтобы сделать значимые выводы об изменениях в морфологии митохондрий. Тем не менее, анализ изображений и количественная оценка могут сильно страдать от субъективной предвзятости и проблем, связанных с визуализацией очень сложных структур, таких как взаимосвязанные митохондрии. С этой целью вот краткое изложение автоматизированного метода количественной оценки морфологии митохондрий с использованием многочисленных метрик, разработанных лабораторией Мэйра. MitoMAPR позволяет объективно и автоматически количественно оценивать морфологию митохондрий, измеряя различные аспекты митохондрий, включая митохондриальную сеть, длину объекта, распределение, покрытие сети и митохондриальный след. MitoMAPR является бесплатным макросом для ImageJ и поэтому доступен для всех лабораторий с функциональным компьютером. Одним из важных аспектов использования MitoMAPR является проведение количественной оценки на большой выборке для определения того, какая метрика морфологии митохондрий является наиболее надежной для определения изменений в тестируемых экспериментальных условиях43,44. Здесь было обнаружено, что длина объекта и точки соединения являются лучшими показателями для определения изменений во время старения в мышцах, кишечнике и гиподерме. Альтернативным подходом к анализу изменений в морфологии митохондрий является генерация 3D-представлений митохондрий на основе изображений z-стека с последующим 3D-анализом16,45. Это может быть достигнуто с помощью коммерчески доступного программного обеспечения, такого как Image-Pro Plus с модулями SharpStack Total Deconvolution и 3D Constructor. Было показано, что количественная оценка трехмерных митохондриальных представлений обеспечивает более точное понимание формы митохондрий и свойств сети46. Тем не менее, этот метод технически более сложен и дорогостоящ по сравнению с полутрехмерным подходом, который включает в себя сворачивание нескольких участков изображения из широкоугольного или конфокального z-стека в одну 2D-проекцию и их анализ с помощью таких инструментов, как mitoMAPR. В этом исследовании обобщено использование экспрессии митохондриального матрикса, нацеленного на GFP, в одной копии и подробно описаны некоторые подводные камни, которых следует избегать во время визуализации.
Ограничения и временные соображения
Хотя конфокальная микроскопия рекомендуется для больших и толстых тканей, таких как кишечная ткань, стандартные методы конфокальной микроскопии с линейным сканированием могут быть слишком медленными для выполнения быстрой визуализации митохондрий. Это особенно верно, учитывая наши данные, которые показывают, что длительное хранение червей на предметных стеклах может привести к фрагментации митохондрий. Несмотря на то, что технология конфокальной микроскопии значительно продвинулась вперед, микроскопы, которые могут выполнять быструю визуализацию, такие как вращающийся диск, Airyscan, или тот, который использовался в этом исследовании, могут быть непомерно дорогими для некоторых лабораторий. В этих случаях комплексная микроскопия может быть объединена с вычислительными методами клиренса для удаления расфокусированного света, такими как деконволюция47.
Кроме того, как уже было описано, MitoMAPR является мощным автоматизированным макросом для количественного измерения длины митохондрий и взаимосвязи митохондриальной сети. Тем не менее, его следует использовать с осторожностью, учитывая перечисленные здесь ограничения. Во-первых, использование GFP, нацеленного на матрицу, наблюдает только митохондриальную фрагментацию внутренней мембраны, которая может не полностью повторять митохондриальную морфологию внешней мембраны, поскольку события деления внутренней мембраны могут происходить при отсутствии деления внешней мембраны. Таким образом, для более точной визуализации обеих мембран следует использовать как матрично-таргетный, так и митохондриальный флуорофор, нацеленный на внешнюю мембрану. Поскольку маркеры наружных митохондриальных мембран могут страдать от тех же последствий, что и матрично-локализованные белки, при высокой гиперэкспрессии рекомендуется использовать маркеры с одной копией, особенно те, которые используют последовательности минимальной митохондриальной локализации вместо полных белков, таких как те, которые используются здесь31.
Как показано на рисунке 3, митохондрии могут быстро фрагментироваться под микроскопом, и различные методы подготовки предметных стекол могут в значительной степени влиять на морфологию в зависимости от используемого буфера. Репрезентативные данные, описанные в данной рукописи, показывают, что митохондрии червей подвергаются минимальной фрагментации под действием M9 и низких концентраций азида натрия. Тетрамизол, еще одно широко используемое химическое вещество для паралича червей, быстро фрагментирует митохондрии, что указывает на то, что его использования следует в целом избегать. Хотя M9 и азид натрия не показали значительной фрагментации митохондрий, важно отметить, что разные штаммы могут реагировать иначе, чем показано здесь. В то время как другие исследования показали, что азид натрия может фрагментировать митохондрии, возможно, что наши штаммы не демонстрируют значительной фрагментации митохондрий при воздействии азида натрия из-за низкого уровня экспрессии наших конструкций. Высокая экспрессия локализованных в митохондриях белков может привести к коллапсу мембранного потенциала, и, таким образом, различные штаммы, использованные в других исследованиях, могут сделать митохондрии более восприимчивыми к фрагментации от тех же концентраций азида натрия, которые использовались в этом исследовании. Несмотря на это, следует позаботиться о том, чтобы химические вещества, парализующие червей, не вызывали фрагментацию митохондрий в определенных условиях, которые должны быть протестированы перед использованием во всех исследованиях, поскольку конкретные мутанты или состояния могут быть более восприимчивы к медикаментозной митохондриальной фрагментации. Кроме того, даже удержание червей в M9 может привести к изменениям их естественной митохондриальной морфологии и активности, поскольку ранее было показано, что их плавательная активность в буфере M9 влияет на динамику митохондриального деления и слияния. Кроме того, оставление червей в М9 в течение длительных периодов времени может активировать реакции гипоксии, которые существенно влияют на митохондрии, вызывая нарушения митохондриального протеостаза48,49.
Наконец, еще одно важное соображение заключается в том, что, хотя изменения в морфологии митохондрий часто коррелируют с изменениями в функции митохондрий, между ними не всегда существует прямая корреляция. Таким образом, рекомендуется провести более тщательный анализ функции митохондрий. Например, скорость потребления кислорода может быть измерена с помощью прибора Seahorse50, потенциал митохондриальной мембраны может быть измерен с помощью красителей мембранного потенциала, таких как JC9 или TMRE51, митохондриальное окислительное состояние может быть измерено с помощью окислительно-восстановительных красителей, таких как roGFP52, а устойчивость митохондрий к стрессу может быть измерена с помощью чувствительности к стрессорам, таким как ротенон53. Поскольку визуализация митохондрий может быть довольно быстрой, мы предлагаем эти методы в качестве простого первого шага для определения того, влияют ли экспериментальные условия на морфологию митохондрий. Эти методы поддаются даже крупномасштабному скринингу лекарств или генов, при этом рекомендуется последующий более тщательный митохондриальный анализ с использованием дополнительных метрик. В целом, здесь мы рассматриваем то, что считается простейшими методами визуализации морфологии митохондрий у C. elegans с минимальными экспериментальными ошибками.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Джей Кей получает поддержку от стипендии провоста Университета Южной Калифорнии; M.A. и G.G. поддерживаются T32AG052374; M.V. поддерживается 1R25AG076400; и R.H.S. поддерживается R01AG079806 от Национального института по проблемам старения и 2022-A-010-SUP от Фонда Ларри Л. Хиллблома. Некоторые штаммы были предоставлены CGC, который финансируется грантом P40 OD010440 Управления исследовательской инфраструктуры NIH. Некоторый генетический анализ был проведен с помощью Wormbase, который финансируется за счет гранта U41 HG002223.
Материалы
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2'-deoxyuridine (FUDR) | Spectrum Chemical | F2026-10GMBL | for proliferation inhibition |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| Confocal microscope | Stellaris 5 | ||
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| HistoBond microscope slides | VWR | 16005-110 | for slides preparation |
| LB Broth | VWR | 95020-778 | for LB |
| LEICA S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| LEICA STELLARIS 5 | Leica | 158101100 | Confocal Microscope |
| LEICA THUNDER | Leica | 11525679 | Compound Microscope |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| pL4440 empty vector plasmid | addgene | plasmid #1654 | for empty vector plasmid |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| Sodium azide | VWR | 97064-646 | for paralyzing worms |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| WOB-L® Dry Vacuum Pumps, Standard-Duty, Welch® | VWR | 80077-612 | for aspiration |
Ссылки
- Protasoni, M., Zeviani, M. Mitochondrial structure and bioenergetics in normal and disease conditions. Int J Mol Sci. 22 (2), 586 (2021).
- Wang, Y., et al. The role of mitochondrial dynamics in disease. MedComm. 4 (6), e462 (2023).
- Kamer, K. J., Mootha, V. K. The molecular era of the mitochondrial calcium uniporter. Nat Rev Mol Cell Biol. 16 (9), 545-553 (2015).
- Chen, W., Zhao, H., Li, Y. Mitochondrial dynamics in health and disease: mechanisms and potential targets. Signal Transduct Target Ther. 8 (1), 333 (2023).
- Adebayo, M., Singh, S., Singh, A. P., Dasgupta, S. Mitochondrial fusion and fission: The fine-tune balance for cellular homeostasis. FASEB J. 35 (6), e21620 (2021).
- Madan, S., Uttekar, B., Chowdhary, S., Rikhy, R. Mitochondria lead the way: mitochondrial dynamics and function in cellular movements in development and disease. Front Cell Dev Biol. 9, 781933 (2021).
- Sharma, A., Smith, H. J., Yao, P., Mair, W. B. Causal roles of mitochondrial dynamics in longevity and healthy aging. EMBO Rep. 20 (12), e48395 (2019).
- Rolland, S. G., Lu, Y., David, C. N., Conradt, B. The BCL-2-like protein CED-9 of C. elegans promotes FZO-1/Mfn1,2- and EAT-3/Opa1-dependent mitochondrial fusion. J Cell Biol. 186 (4), 525-540 (2009).
- Labrousse, A. M., Zappaterra, M. D., Rube, D. A., van der Bliek, A. M. C. elegans dynamin-related protein DRP-1 controls severing of the mitochondrial outer membrane. Mol Cell. 4 (5), 815-826 (1999).
- Dickinson, D. J., Pani, A. M., Heppert, J. K., Higgins, C. D., Goldstein, B. Streamlined genome engineering with a self-excising drug selection cassette. Genetics. 200 (4), 1035-1049 (2015).
- Bosher, J. M., Labouesse, M. RNA interference: Genetic wand and genetic watchdog. Nat Cell Biol. 2 (2), E31-E36 (2000).
- Yu, C. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249 (2020).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Front Endocrinol. 11, 554994 (2020).
- Dingley, S., et al. Mitochondrial respiratory chain dysfunction variably increases oxidant stress in Caenorhabditis elegans. Mitochondrion. 10 (2), 125-136 (2010).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. J Chromatogr B Anal Technol Biomed Life Sci. 793 (1), 141-150 (2003).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Curr Protoc Cell Biol. Chapter 4, Unit 4.25.1-Unit 4.25.21 (2010).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. Novel imaging tools to study mitochondrial morphology in Caenorhabditis elegans. Life Sci Alliance. 7 (11), e202402918 (2024).
- Benedetti, C., Haynes, C. M., Yang, Y., Harding, H. P., Ron, D. Ubiquitin-like protein 5 positively regulates chaperone gene expression in the mitochondrial unfolded protein response. Genetics. 174 (1), 229-239 (2006).
- Begelman, D. V., et al. An aco-2::gfp knock-in enables the monitoring of mitochondrial morphology throughout C. elegans lifespan. microPublication Biol. 2022, (2022).
- Castro Torres, T., et al. Surveying low-cost methods to measure lifespan and healthspan in Caenorhabditis elegans. J Vis Exp. 183, e64091 (2022).
- Rasmussen, N. R., Reiner, D. J. Nuclear translocation of the tagged endogenous MAPK MPK-1 denotes a subset of activation events in C. elegans development. J Cell Sci. 134 (17), jcs258456 (2021).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Luz, A. L., et al. Mitochondrial morphology and fundamental parameters of the mitochondrial respiratory chain are altered in Caenorhabditis elegans strains deficient in mitochondrial dynamics and homeostasis processes. PLoS One. 10 (6), e0130940 (2015).
- Oorloff, M., et al. Mechanical stress through growth on stiffer substrates impacts animal health and longevity in C. elegans. bioRxiv. , (2024).
- Chu, X., Wu, S., Raju, R. NLRX1 regulation following acute mitochondrial injury. Front Immunol. 10, 2431 (2019).
- Shah, P., Bao, Z., Zaidel-Bar, R. Visualizing and quantifying molecular and cellular processes in Caenorhabditis elegans using light microscopy. Genetics. 221 (4), iyac068 (2022).
- Wang, Y., Wang, P., Li, C. Fluorescence microscopic platforms imaging mitochondrial abnormalities in neurodegenerative diseases. Adv Drug Deliv Rev. 197, 114841 (2023).
- Ding, J., et al. An expanded GCaMP reporter toolkit for functional imaging in Caenorhabditis elegans. G3 (Bethesda, Md). 13 (10), jkad183 (2023).
- Sarasija, S., Norman, K. R. Analysis of mitochondrial structure in the body wall muscle of Caenorhabditis elegans. Bio-Protocol. 8 (7), e2801 (2018).
- Chaweeborisuit, P., Suriyonplengsaeng, C., Suphamungmee, W., Sobhon, P., Meemon, K. Nematicidal effect of plumbagin on Caenorhabditis elegans: A model for testing a nematicidal drug. Z Naturforsch C J Biosci. 71 (5-6), 121-131 (2016).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. . Novel imaging tools to study mitochondrial dynamics in Caenorhabditis elegans. 7, 11 (2024).
- Bolognesi, B., Lehner, B. Reaching the limit. eLife. 7, e39804 (2018).
- Jishi, A., Qi, X. Altered mitochondrial protein homeostasis and proteinopathies. Front Mol Neurosci. 15, 867935 (2022).
- Morton, K. S., Wahl, A. K., Meyer, J. N. The effect of common paralytic agents used for fluorescence imaging on redox tone and ATP levels in Caenorhabditis elegans. PLoS One. 19 (4), e0292415 (2024).
- Noumi, T., Maeda, M., Futai, M. Mode of inhibition of sodium azide on H+-ATPase of Escherichia coli. FEBS Lett. 213 (2), 381-384 (1987).
- Siete, C., Xiong, R., Khalid, A., Hsieh, Y. -. W., Chuang, C. -. F. Immobilization of C. elegans with different concentrations of an anesthetic for time-lapse imaging of dynamic protein trafficking in neurons. microPublication Biology. 2024, (2024).
- Mitchell, D. H., Stiles, J. W., Santelli, J., Sanadi, D. R. Synchronous growth and aging of Caenorhabditis elegans in the presence of fluorodeoxyuridine. J Gerontol. 34 (1), 28-36 (1979).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2'-deoxyuridylate: covalent complex with thymidylate synthetase. Proc Natl Acad Sci U S A. 69 (7), 1855-1857 (1972).
- Wang, H., Zhao, Y., Zhang, Z. Age-dependent effects of floxuridine (FUdR) on senescent pathology and mortality in the nematode Caenorhabditis elegans. Biochem Biophys Res Commun. 509 (3), 694-699 (2019).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development (Cambridge, England). 116 (3), 755-766 (1992).
- Austin, J., Kimble, J. glp-1 is required in the germ line for regulation of the decision between mitosis and meiosis in C. elegans. Cell. 51 (4), 589-599 (1987).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Zhang, Y., et al. Neuronal TORC1 modulates longevity via AMPK and cell nonautonomous regulation of mitochondrial dynamics in C. elegans. eLife. 8, e49158 (2019).
- Dutta, N., et al. Investigating impacts of the mycothiazole chemotype as a chemical probe for the study of mitochondrial function and aging. GeroScience. 46 (6), 6009-6028 (2024).
- Tronstad, K., et al. Regulation and quantification of cellular mitochondrial morphology and content. Curr Pharm Des. 20 (35), 5634-5652 (2014).
- Nikolaisen, J., et al. Automated quantification and integrative analysis of 2D and 3D mitochondrial shape and network properties. PLoS One. 9 (7), e101365 (2014).
- Lee, J. S., Wee, T. L. E., Brown, C. M. Calibration of wide-field deconvolution microscopy for quantitative fluorescence imaging. J Biomol Tech. 25 (1), 31-40 (2014).
- Hong, M., Kwon, J. Y., Shim, J., Lee, J. Differential hypoxia response of hsp-16 genes in the nematode. J Mol Biol. 344 (2), 369-381 (2004).
- Yan, J., Sun, C. L., Shin, S., Van Gilst, M., Crowder, C. M. Effect of the mitochondrial unfolded protein response on hypoxic death and mitochondrial protein aggregation. Cell Death Dis. 12 (7), 711 (2021).
- Koopman, M., et al. A screening-based platform for the assessment of cellular respiration in Caenorhabditis elegans. Nat Protoc. 11 (10), 1798-1816 (2016).
- Shpilka, T., et al. UPRmt scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nat Comm. 12 (1), 479 (2021).
- Braeckman, B. P., Smolders, A., Back, P., De Henau, S. In vivo detection of reactive oxygen species and redox status in Caenorhabditis elegans. antioxidants & redox signaling. 25 (10), 577-592 (2016).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. elegans. J Vis Exp. 159, e61001 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены