Method Article
Entrega terapêutica ocular e recuperação avançada de tecidos em ratos adultos
Neste Artigo
Resumo
Este estudo apresenta uma metodologia para a administração de terapêutica na retina e nos nervos ópticos do rato adulto. Além disso, um método exclusivo de recuperação de tecido é introduzido para uma coleção em bloco de cima para baixo do nervo óptico e da retina em um rato adulto.
Resumo
A administração terapêutica no segmento posterior do olho, incluindo a retina e o nervo óptico, é complicada pela presença de barreiras hematoencefálicas e hematorretinianas. Modelos de pequenos animais, como ratos, são utilizados para estudar várias patologias oculares. Embora a entrega terapêutica no olho posterior seja desafiadora, alcançá-la é essencial para o tratamento de distúrbios oculares, muitos dos quais requerem validação em modelos de pequenos animais para relevância translacional. Portanto, duas técnicas de administração terapêutica posterior são apresentadas: injeção intravítrea (IVI) e injeção retrobulbar (RBI) para uso em ratos adultos. Além disso, um método para a remoção em bloco dos olhos e nervos ópticos é introduzido para várias técnicas de análise histológica e molecular. O protocolo de dissecção permite a observação completa do sistema neurovisual, minimizando a lesão post-mortem nos tecidos da retina e do nervo óptico. A entrega bem-sucedida da ciclosporina terapêutica na retina e no nervo óptico foi alcançada, com concentrações detectáveis observadas vinte e quatro horas após a injeção usando IVI e RBI. Além disso, amostras de retina e nervos em bloco foram extraídas com sucesso para análise histológica completa do tecido ocular, facilitando a observação abrangente da retina e do sistema neurovisual mais amplo.
Introdução
A administração terapêutica na retina e no nervo óptico é incrivelmente difícil devido à complexa anatomia do olho 1,2, especificamente a presença da barreira hemato-retiniana (BRB) 3 , 4 , 5 . O BRB serve para proteger a retina da invasão da circulação sistêmica, mas é um oponente desafiador da administração terapêutica, pois a circulação terapêutica sistêmica é frequentemente bloqueada pelo BRB 6,7. Pequenas moléculas lipofílicas podem se difundir facilmente através do BRB, mas moléculas maiores e hidrofílicas têm mais dificuldade em obter acesso à retina6. As injeções intravítreas (IVI) e retrobulbares (RBI) permitem a administração de fármacos aos tecidos oculares, superando as limitações impostas pelo BRB. O IVI serve como um compromisso promissor ao administrar terapêutica no ambiente interno do olho 8,9. Esse método requer que a droga atravesse o vítreo, contornando o BRB e difundindo-se pela retina e coroide para atingir o nervo óptico7. O RBI é entregue atrás do olho no espaço retrobulbar10. A terapêutica pode ser administrada por difusão através dos tecidos e glândulas no espaço retrobulbar, afetando o nervo óptico e as estruturas circundantes sem entrar diretamente na retina, o que mantém a integridade do BRB. Ao administrar medicamentos direta ou indiretamente no olho, tanto as injeções intravítreas quanto as retrobulbares podem atingir concentrações locais mais altas do medicamento terapêutico, o que aumenta sua eficácia em comparação com a administração tópica ou sistêmica (oral ou intravenosa)2. Isso é particularmente importante para tratamentos que requerem ação rápida ou alta potência, como visto em muitas doenças oculares. A administração direcionada também limita a exposição do resto do corpo ao medicamento, o que reduz o risco de efeitos fora do alvo e ajuda a minimizar possíveis efeitos adversos que podem ocorrer quando os medicamentos são administrados topicamente, por via oral ou intravenosa11.
Outras injeções perioculares, como subconjuntival, subtenon posterior e sub-retiniana, têm seus próprios benefícios e limitações 2,5. Observou-se que as injeções de subtenon posterior fornecem altas concentrações de drogas aos tecidos oculares; no entanto, a injeção subtenoniana está mais próxima da esclera do que da vasculatura orbitária 5,12. Em contraste, o RBI coloca o terapêutico mais próximo do nervo óptico do que o subtenon posterior ou subconjuntival13. Isso pode significar que as patologias do nervo óptico favorecem a terapêutica administrada pelo RBI em relação a outros tipos de injeção periocular. As injeções de subtenon posterior têm riscos associados, incluindo estrabismo, hifema e pressão intraocular elevada5. A pressão intraocular elevada também é um fator de risco relatado em injeções de IVI, subconjuntival e sub-retiniana2. Esses tipos de injeção geralmente requerem doses repetitivas para alcançar o efeito terapêutico desejado2. Outros fatores de risco associados a injeções sub-retinianas, injeções subconjuntivais e IVI incluem formação de catarata, hemorragia retiniana, descolamento de retina e inflamação2. Essas injeções de IVI, sub-retinianas e subconjuntivais são mais invasivas do que as injeções de RBI, pois essas injeções são intraoculares2. O RBI pode ser considerado menos invasivo, pois coloca o terapêutico no espaço retrobulbar, sem entrar diretamente na agulha no globo ocular. Outras estratégias terapêuticas menos invasivas, como a administração tópica, ficam aquém da entrega suficiente do medicamento, com menos de 5% do medicamento retido na superfície ocular 2,5.
A IVI é uma técnica proeminente em modelos pré-clínicos que é usada por sua capacidade de fornecer agentes terapêuticos diretamente no segmento posterior do olho. A IVI entrega o medicamento diretamente no humor vítreo, tornando-se uma técnica de entrega preferida para tratamento localizado14. A técnica IVI permite que a terapêutica contorne a barreira hematorretiniana, que é um obstáculo comum à penetração da droga na retina14. O IVI introduz a oportunidade de inflamação e danos às estruturas oculares, portanto, a adesão meticulosa ao procedimento deve ser empregada14. Para minimizar o descolamento de retina e a formação de catarata, Chiu et al. descrevem uma abordagem IVI que enfatiza uma inserção e injeção chanfrada de 45 graus no nível da par plana, evitando o cristalino, a retina, o músculo ocular e os vasos15. Nessa técnica, uma agulha de 30 G é inserida na esclera nasal para administração terapêutica15. O IVI ainda está associado a riscos devido à sua natureza invasiva. Os riscos potenciais incluem descolamento de retina, formação de catarata, endoftalmite ou hemorragia16. A natureza invasiva das técnicas de IVI também aumenta a pressão intraocular, como mostrado em um experimento com olhos suínos realizado por Ikjong Park et al.16. O estudo mostra mudanças na pressão intraocular durante diferentes estágios de inserção da agulha e injeção de fluido. Eles relatam variação substancial na pressão intraocular durante o procedimento16.
Os RBIs foram utilizados com sucesso em estudos anteriores como meio de entrega terapêutica a roedores. Um desses estudos comparou os efeitos de vários análogos da prostaglandina administrados via RBI17. Os ratos albinos receberam um RBI com uma agulha 26 G de 0,1 mL injetado inserida através da área lateral do fórnice inferior em um ângulo de 45 graus17. O protocolo utilizado neste estudo foi adaptado de um método previamente descrito, no qual os ratos foram anestesiados por injeção intraperitoneal (IP) de cloralite18. Outro estudo realizado em ratos comparou gotas tópicas com injeções retrobulbares19. Os ratos foram anestesiados por meio de injeção IP de cetamina/xilazina, e o RBI foi administrado por agulha 30 G19. Em contraste com os métodos de sedação discutidos anteriormente, um estudo que observou os efeitos do RBI na gordura orbital usou isoflurano inalatório para sedar os ratos antes do RBI20. Embora esses estudos forneçam informações sobre quais anestésicos e especificações de agulhas podem ser bem-sucedidos, o posicionamento e o manuseio dos animais durante o procedimento não são discutidos.
Vários estudos em camundongos também conduzem RBIs para métodos de entrega terapêutica. Um estudo comparou RBI com injeção de veia caudal lateral para induzir com sucesso a síndrome nefrótica21. Um segundo estudo também comparou as mesmas duas técnicas de injeção na administração de meios de contraste para imagenscardíacas 22. Os camundongos foram anestesiados com isoflurano inalatório e injetados no lado medial do olho22. Ambos os estudos adaptaram seu método RBI de um protocolo escrito anteriormente. É importante notar que este protocolo nomeou sua injeção como retro-orbital, mas descreveu o local da injeção como o espaço retrobulbar atrás do olho. Os autores desse protocolo utilizaram o isoflurano inalatório como método de sedação preferido, observando o rápido tempo de ativação e recuperação dos camundongos23. Para um RBI, o olho foi parcialmente projetado da órbita aplicando pressão na pele ao redor do olho23. Em seguida, a agulha foi introduzida no chanfro medial com o lado chanfrado para baixo em um ângulo de 30 graus e foi inserida até atingir a base do olho23. Deve-se ter cuidado ao aplicar pressão no animal, pois pode ocorrer bloqueio acidental do fluxo sanguíneo ou colapso traqueal23. O injetor também é cego para a ponta da agulha após a inserção e, portanto, danificar o olho é um risco associado. 23 Danificar o olho após a administração terapêutica é um risco crítico neste experimento, pois causar lesões adicionais prejudica diretamente os resultados do estudo. Deve-se notar também que a técnica de posicionamento e manuseio descrita anteriormente foi realizada em camundongos e não incluiu comentários sobre a aplicabilidade em ratos.
Existem muitas maneiras pelas quais a remoção do nervo óptico e da retina foi tentada. Um desses métodos explorou a remoção de nervos ópticos e olhos em bloco, preservando um quiasma óptico intacto24. Este método é o mais comparável ao estudo atual, pois os olhos individuais e os nervos ópticos também são preservados para remoção em bloco; no entanto, o quiasma óptico é separado. Ter cautela neste procedimento seria de extrema importância devido à complexidade do procedimento. No método atual, iniciamos a dissecção através do crânio caudal e trabalhamos rostralmente para fornecer acesso de uma forma que limite os danos aos nervos ópticos e permita que todo o nervo permaneça intacto. Além disso, manter o nervo intacto e ligado ao olho é crucial para o processo de incorporação, pois o dano a cada parte do nervo pode corresponder a uma observação patológica diferente24. É importante considerar a orientação do nervo óptico, pois a forma como ele está embutido permite diferentes seções transversais, o que pode ser importante para a análise histológica.
Um dispositivo feito sob medida conhecido como mesa cirúrgica oftálmica de laboratório de pequenos animais (SALOOT, uma plataforma de cirurgia oftálmica) é composto por uma série de materiais impressos em 3D para fornecer anestesia e manter o animal em uma posição estável para injeções terapêuticas oculares. O design SALOOT permite a estabilidade da cabeça e das estruturas oculares para procedimentos oftálmicos, o que melhora a velocidade e a reprodutibilidade das operações, ao mesmo tempo em que permite a administração de anestesia com gás e a eliminação de partículas de expiração. O SALOOT é um bloco impresso tridimensional com uma redução côncava para segurar o corpo do rato com uma região mais estreita na frente para segurar a cabeça do animal em um cone de nariz com uma entrada de isoflurano. Abaixo do cone do nariz há um pequeno reservatório e uma saída de exaustão. Os seguintes métodos foram desenvolvidos para entrega ocular terapêutica e recuperação precisa do tecido ocular; Eles foram projetados para estudar tecidos após trauma ocular, por isso é crucial delinear os efeitos do trauma, injeção, tratamento e dissecção para evitar interpretações confusas dos achados.
Este artigo apresenta dois métodos de injeção terapêutica ocular, as injeções intravítreas e retrobulbares, para uso em ratos adultos. Além disso, um método de recuperação de tecido é apresentado para a remoção em bloco do nervo óptico e da retina intactos de um rato adulto. Essas técnicas permitem a investigação dos efeitos oculares e peri-oculares da patologia induzida e do tratamento.
Protocolo
Todos os experimentos foram conduzidos de acordo com a Declaração ARVO para o Uso de Animais em Pesquisa Oftálmica e Visual e aprovados pelo comitê institucional de cuidados e uso de animais da Ohio State University. Ratos machos da raça Sprague Dawley pesando ~200 g e com cerca de 2 meses de idade foram utilizados para este estudo25. Os detalhes dos reagentes e do equipamento utilizado estão listados na Tabela de Materiais.
1. Injeção intravítrea (IVI)
- Conecte o isoflurano e os cabos residuais às portas de fixação SALOOT. Anestesie o animal usando procedimentos padrão de isoflurano seguindo a Declaração ARVO para o Uso de Animais em Pesquisa Oftálmica e Visual e o protocolo IACUC aprovado.
NOTA: Alternativamente, se o animal já estava sob anestesia de outra sessão de teste oftálmico (ou seja, mistura de cetamina / xilazina; 90 mg / kg de cetamina e 10 mg / kg de xilazina), transfira o animal para a plataforma de cirurgia oftálmica e titule a anestesia com isoflurano (relação 3 oxigênio: 3 isoflurano) para garantir que a profundidade adequada da anestesia seja mantida. - Coloque a plataforma de cirurgia oftálmica com o animal anestesiado sob um microscópio cirúrgico ao vivo. Avalie a profundidade do anestésico por meio do reflexo de retirada do pedal.
- Coloque uma a duas gotas de solução oftálmica de cloridrato de tetracaína a 0,5% no olho ou olhos que estão sendo operados. Aplique pomada oftálmica tópica lubrificante, como hipromelose 0,3%, no olho contralateral, se nenhuma manipulação for realizada.
- Em seguida, use uma a duas gotas de iodopovidona a 5% na superfície ocular e, usando um cotonete, aplique iodopovidona na pele ao redor do olho.
- Use uma seringa de 10 μL com uma agulha de 33 G com uma ponta estilo 4 com um comprimento de 10 mm e ângulo de 15 graus e retire cloreto de sódio bacteriostático a 0,9%. Lave a seringa e a agulha com a solução salina antes de mergulhar a agulha em um esterilizador de esferas quente.
- Deixe esfriar antes de prosseguir. Depois que a agulha esfriar, elabore a terapêutica de interesse na quantidade desejada (4 μL).
NOTA: Para estudos de prova de conceito, tinta de tatuagem não diluída e corante azul de Evan em solução salina tamponada com fosfato (PBS) foram utilizados. O pó azul de Evan foi misturado com PBS até ficar opaco. Para estudos terapêuticos de prova de conceito, foram utilizadas as seguintes concentrações: ibudilast a 1 mg/mL, ácido taurosodesoxicólico (TUDCA) 5 mg/mL, injeção de ciclosporina, 250 mg/mL e anacinra 100 mg/0,67 mL. Os pós terapêuticos foram diluídos em solução salina bacteriostática a 0,9%.
- Deixe esfriar antes de prosseguir. Depois que a agulha esfriar, elabore a terapêutica de interesse na quantidade desejada (4 μL).
- Usando uma pinça oftálmica fina com dentes, segure suavemente o tecido escleral no limbo para estabilizar. Haverá um anel vermelho fraco ao redor da íris. Use este anel como um ponto de referência, insira a agulha, com o lado chanfrado voltado para baixo, e injete-o no olho posterior.
NOTA: Certifique-se de inclinar a agulha em direção à retina e insira a agulha apenas 2/3 do caminho (Figura 1). Certifique-se de que a agulha não risque a lente, pois isso levará à formação de catarata. - Após a injeção terapêutica, remova lentamente a agulha. Feche o olho e mantenha a pressão por pelo menos 10-15 s antes de lavar com solução salina.
- Interrompa o animal do isoflurano e remova-o da plataforma de cirurgia oftálmica. Coloque uma gota de hipromelose 0,3% em cada olho e deixe o animal se recuperar em uma almofada de aquecimento.
2. Injeção retrobulbar (RBI)
- Conecte o isoflurano e os cabos residuais às portas de fixação SALOOT. Anestesiar o animal usando procedimentos padrão de isoflurano.
NOTA: Alternativamente, se o animal já estava sob anestesia de outra sessão de teste oftálmico (ou seja, mistura de cetamina / xilazina; 90 mg / kg de cetamina e 10 mg / kg de xilazina), transfira o animal para a plataforma de cirurgia oftálmica e titule a anestesia com isoflurano (relação 3 oxigênio: 3 isoflurano) para garantir que a profundidade adequada da anestesia seja mantida. - Coloque a plataforma de cirurgia oftálmica com o animal anestesiado sob um microscópio cirúrgico ao vivo. Avalie a profundidade do anestésico por meio do reflexo de retirada do pedal.
- Coloque uma a duas gotas de solução oftálmica de cloridrato de tetracaína a 0,5% no olho ou olhos que estão sendo operados. Aplique pomada oftálmica tópica lubrificante (hipromelose 0,3%) no olho contralateral se nenhuma manipulação for realizada.
- Em seguida, use uma a duas gotas de iodopovidona a 5% na superfície ocular e, usando uma lança ocular, aplique iodopovidona na pele ao redor do olho.
- Obtenha uma seringa de insulina de 0,5 ml com uma agulha de 28 G. Elabore a terapêutica de interesse na quantidade desejada (100 μL).
NOTA: Para estudos de prova de conceito, tinta de tatuagem não diluída e corante azul de Evan em solução salina tamponada com fosfato (PBS) foram utilizados. O pó azul de Evan foi misturado com PBS até ficar opaco. Para estudos de prova de conceito terapêutico, foram utilizadas as seguintes concentrações: ibudilast a 10 mg/mL, TUDCA a 50 mg/mL, injeção de ciclosporina 250 mg/mL e anakinra a 100 mg/0,67 mL. Os pós terapêuticos foram diluídos em solução salina bacteriostática a 0,9%. - Usando uma pinça oftálmica fina com dentes, segure suavemente a pálpebra inferior para estabilizar. Insira a agulha, com o lado chanfrado para baixo, em um ângulo a meio caminho entre 6 e 7 horas ao longo da borda orbital inferior até que a parte de trás da cavidade ocular seja sentida. Puxe a agulha ligeiramente para trás e, em seguida, injete lentamente a terapêutica (Figura 2).
- Remova a agulha com cuidado e lentamente. Em seguida, feche o olho e mantenha a pressão por pelo menos 10-15 s antes de lavar com solução salina.
- Interrompa o animal do isoflurano e remova-o da plataforma de cirurgia oftálmica. Coloque uma gota de hipromelose 0,3% em cada olho e deixe o animal se recuperar em uma almofada de aquecimento.
3. Dissecção de isolamento de tecido ocular
- Depois que o animal tiver sido sacrificado por asfixia por CO2 ou conforme declarado no protocolo IACUC aprovado, coloque o animal em decúbito esternal. Utilize uma incisão transversal na pele sobre o dorso do pescoço, estendendo-se até o nível do pavilhão auricular.
- Dissecar a musculatura dorsal para expor a articulação atlanto-occipital. Use uma tesoura de maionese para fazer uma incisão na articulação atlanto-occipital, separando a cabeça do corpo (Figura 3). Usando dissecção romba, remova suavemente a pele do crânio dorsal do nível do nariz até o dorso do pescoço, deixando a pele ao redor de ambos os olhos intacta.
- Insira um par de hemostáticos retos médios ou chaves de agulha no forame magno na base do crânio. Use os hemostáticos para romper suavemente o crânio lateral que se estende do forame magno até a região temporal em ambos os lados (Figura 3).
- Ao remover a parte superior do crânio, mantenha os hemostáticos paralelos ao lado dorsal do cérebro. Isso garantirá que o cérebro permaneça intacto e não seja cortado no processo de remoção óssea.
- Usando uma espátula plana, reflita suavemente o cérebro rostralmente para expor os nervos ópticos. Deve-se tomar cuidado para que a tensão do peso do cérebro não seja aplicada aos nervos ópticos.
- Com os nervos expostos, pegue uma microtesoura média e faça uma pequena incisão no quiasma óptico, cortando os dois nervos do cérebro. Nesse ponto, o cérebro pode ser descartado ou colocado em paraformaldeído em PBS (4% PFA) por 24 h a 4 ° C para avaliação histológica.
- Usando uma tesoura de íris pequena e um par de micropinças oftálmicas dentadas, remova cuidadosamente o excesso de tecido (ou seja, pálpebras, tecido conjuntivo, etc.) ao redor do olho. Uma vez concluído, o olho deve estar situado na cavidade ocular, mas com apenas o músculo extraocular e as glândulas ainda presentes.
- Usando os hemostáticos em conjunto com a pequena tesoura de íris, corte a órbita ocular, tomando muito cuidado para não cortar o nervo óptico ao passar pelo canal óptico. Quebre cuidadosamente o osso na parte de trás da cavidade ocular com os hemostáticos e, para um controle mais preciso, utilize a pequena tesoura de dissecção.
- Depois que o osso for removido, corte delicadamente ao redor da órbita ocular com uma microtesoura e uma pinça fina para remover as almofadas de gordura, glândulas e músculos extraoculares. Certifique-se de estar atento aos nervos ópticos durante este processo.
- O olho deve ser capaz de ser refletido suavemente caudalmente em direção ao interior do crânio. Neste ponto, use pequenas microtesouras e pinças finas para remover o tecido conjuntivo ao redor do nervo na crista inferior do crânio.
- Uma vez que esse tecido tenha sido removido, o olho e o nervo óptico completo devem poder ser retirados do crânio em bloco. Repita essas etapas para o olho e nervo contralaterais.
- Além disso, limpe o nervo óptico e o olho do excesso de tecido, como a bainha dural. Se os tecidos não precisarem ser preservados para análise histológica, congele rapidamente usando gelo seco ou nitrogênio líquido antes de serem armazenados a -80 °C.
- Para espectrometria de massa, a retina precisa ser isolada da região interna do globo e o nervo óptico precisa ser isolado. Separe o nervo óptico do globo no ponto externo mais próximo. Coloque o nervo em um criotubo no gelo antes de ser transferido para -80 °C.
- Coloque o globo ocular em uma placa de Petri sob um microscópio cirúrgico. Use um par de pinças curvas para manter o olho firme antes de fazer uma incisão no limbo com uma pequena microtesoura.
- Estenda o corte para abranger toda a circunferência do globo. O globo deve ser dividido ao meio e a porção anterior pode ser descartada.
- Coloque a seção posterior com o lado interno voltado para cima e, usando uma pinça oftálmica fina, remova o tecido fino de cor creme. Pode parecer que gruda no disco óptico. Se isso ocorrer, use a microtesoura para cortar a retina do disco.
NOTA: O tecido da retina pode então ser colocado em um criotubo no gelo antes de ser transferido para -80 °C. Os tecidos podem então ser transferidos para a instalação de espectrometria de massa para avaliação.
- Para coloração imuno-histológica usando perfusão parcial, coloque o olho intacto em uma placa de Petri. Use um par de pinças curvas para manter o olho firme antes de pegar uma seringa de insulina com uma agulha de 28 G e inseri-la no limbo, com a agulha inclinada em direção à retina. Repita esta etapa em outros dois pontos ao longo do limbo. A punção do globo ajuda a garantir a perfusão adequada e auxilia na fixação adequada.
NOTA: O globo deve ser fixado em PFA a 4% por pelo menos 40 minutos antes de fazer a transição para um agitador e agitar em baixa velocidade por mais 20 minutos para facilitar o movimento do fluido. - Quando a etapa de fixação estiver concluída, remova o PFA e substitua-o por PBS. Coloque os frascos para injetáveis em agitação suave por 15 min e, em seguida, repita esta etapa para um segundo enxágue PBS de 15 min.
- Após o ciclo final de enxágue do PBS, aspire o PBS e substitua-o por solução de sacarose a 30% em PBS e leve à geladeira por 24 h. Após a etapa de incubação da sacarose, incorporar tecido na OCT para avaliação histológica26.
Resultados
Experimentos piloto preliminares foram realizados em animais cadáveres usando corante de injeção (corante Evans Blue) e tinta de tatuagem (Figura 2B) para otimizar a colocação e o tamanho da agulha para RBI e IVI. A tinta da tatuagem não era diluída e, em seguida, o pó Evans Blue foi misturado em PBS até que o fluido se tornasse opaco. Concluímos que o RBI ideal apresentava uma agulha de 28 G inserida em um ângulo intermediário entre 6 e 7 horas ao longo da borda orbital inferior até que a parte de trás da cavidade ocular fosse sentida. Isso entregou os corantes na parte de trás da órbita, perto do nervo, sem perfurar o nervo óptico. Da mesma forma, este teste piloto de corante de cadáver foi seguido com a injeção IVI, mas apenas o corante Evans Blue foi usado, pois a tinta da tatuagem era muito viscosa em conjunto com a agulha 33 G. Uma vez que os protocolos de injeção foram determinados, estudos terapêuticos de prova de conceito in vivo foram realizados utilizando ratos Long-Evans pigmentados machos a 200 g (n = 18). Além disso, potenciais evocados visuais de flash adaptados à luz (fVEPs) foram conduzidos utilizando ratos Long-Evans machos (n = 2) para determinar a segurança do RBI. Os valores basais de fVEP foram registrados e, 7 dias após a injeção de solução salina (100 μL) no olho direito (OD), os fVEPs foram novamente realizados. Os olhos esquerdos (OS) não receberam injeção. Os fVEPs foram conduzidos seguindo protocolos pré-existentes, nos quais os sinais foram obtidos contra um fundo de 30 cd/m2 utilizando um flash branco (200 cd.s/m2) e um intervalo interestímulo de 1000ms26. As amplitudes do fVEP não mostraram alterações significativas entre os olhos ou pontos de tempo (Figura 4). A análise estatística foi realizada por meio de uma ANOVA de duas ondas com intervalo de confiança de 95%. Os testes de comparações múltiplas de Tukey foram realizados no GraphPad Prism para determinar as interações do grupo26.
Para determinar a eficácia da administração terapêutica ocular, foram obtidas as seguintes terapêuticas neuroprotetoras de interesse: ibudilaste a 10 mg/mL (RBI) e 1 mg/mL (IVI), ácido taurosodesoxicólico (TUDCA) 50 mg/mL (RBI) e 5 mg/mL (IVI), injeção de ciclosporina, 250 mg/mL, ciclosporina tópica, 0,05% e anacinra 100 mg/0,67 mL. A ciclosporina foi administrada via RBI (n = 2), IVI (n = 2) e topicamente (n = 3). Anakinra, ibudilast e TUDCA foram administrados via RBI (n = 2) e IVI (n = 2). Os medicamentos foram selecionados por seu potencial como terapêutica neuroprotetora para uso em um modelo de neuropatia óptica traumática em ratos. A ciclosporina foi usada em particular por ser altamente viscosa e, portanto, difícil de injetar em relação a outras terapêuticas. Os tecidos foram obtidos 24 h após a injeção, seguindo o método previamente indicado. Os tecidos foram analisados por espectrometria de massa (TUDCA, ibudilast e ciclosporina) ou análise proteômica (anakinra) (OSU's Pharmacoanaytic Shared Resource CORE). As retinas e nervos de controle foram coletados e avaliados por meio de espectrometria de massas e análise proteômica. As amostras tratadas com terapêutica foram então avaliadas e comparadas com os controles para determinar os níveis relativos do medicamento encontrado em cada um dos tecidos de interesse. As amostras de Anakinra RBI foram removidas da análise devido à resposta do animal durante a injeção, mesmo sob anestesia profunda. Devido a essa resposta à dor, a administração de RBI Anakinra pode não ser uma abordagem terapêutica ideal.
A ciclosporina foi detectada na retina e no nervo óptico 24 horas depois por meio de ambos os mecanismos de injeção; no entanto, a entrega tópica não foi detectada em nenhum dos tipos de tecido. No grupo de injeção IV, a retina tinha uma concentração de 383 ppb e o nervo óptico tinha <5 ppb. A via de injeção de RB observou 16 ppb na retina e 49 ppb no nervo óptico (Tabela 1). O TUDCA não foi detectado na retina ou no nervo óptico 24 horas após a injeção para nenhuma das vias de injeção. O ibudilast foi detectado no tecido do nervo óptico de apenas um animal após a injeção de RB (<5 ppb). O estudo de injeção piloto terapêutico indicou que ambos os protocolos de injeção são capazes de administrar medicamentos à retina e ao nervo óptico, como evidenciado pela presença de ciclosporina em ambos os tipos de tecido após ambos os métodos de injeção. Este estudo também indica que a ciclosporina produziu altas concentrações nos tecidos-alvo de interesse. Uma hipótese é que o ibudilast e o TUDCA podem ter atingido a retina e o nervo óptico, mas sua meia-vida no ambiente ocular pode ter sido muito curta para ser detectada 24 horas após a injeção. Pode ser que as drogas tenham um impacto neuroprotetor neste momento; no entanto, mais estudos seriam necessários para confirmar a farmacocinética desses medicamentos tanto na região interna (IVI) quanto na extraocular (RBI).
Este estudo piloto também apoiou o protocolo de isolamento do tecido ocular por meio da remoção bem-sucedida do nervo óptico completo e dos olhos. Retinas e nervos ópticos foram obtidos com sucesso para análise no estudo piloto de entrega terapêutica (Tabela 1). Além disso, com a utilização dessa dissecção de isolamento do tecido ocular, os olhos e os nervos ópticos em bloco puderam ser coletados para imuno-histoquímica (Figura 5). Amostras em bloco foram coletadas de dois ratos Sprague Dawley machos, conforme descrito acima. As amostras foram incluídas em OCT e seccionadas longitudinalmente em um criostato com 10 μm de espessura. As amostras foram incubadas em PBS para remover a OCT e, em seguida, incubadas em soro de burro normal 1:20 em PBS mais Triton-X-100 (PBT) em temperatura ambiente por 2 h. Os cortes foram então incubados com os seguintes anticorpos: anti-β-tubulina (1:1000; MAB5564; Millipore, Burlington, MA) e proteína ácida fibrilar glial (GFAP; 1:50; Z0334; DAKO, Santa Clara, CA) em PBT durante a noite a 4 ° C, enxaguado com PBS e incubado em burro anti-rato Alexa 488 e burro anti-coelho Alexa 594 (1:200) em PBT durante a noite a 4 ° C. As seções foram enxaguadas e montadas em um meio de montagem mais DAPI. As amostras foram fotografadas em um microscópio de fluorescência de campo amplo ou microscópio confocal usando configurações consistentes26. A cabeça intacta do nervo óptico pôde ser visualizada (Figura 5A, B) e corada com sucesso para os seguintes marcadores de interesse: β-tubulina (verde), proteína ácida fibrilar glial (GFAP; vermelho) e marcador nuclear DAPI (azul). Esse método de dissecção permitiu a obtenção de amostras completas do nervo óptico, como visto na Figura 5C.
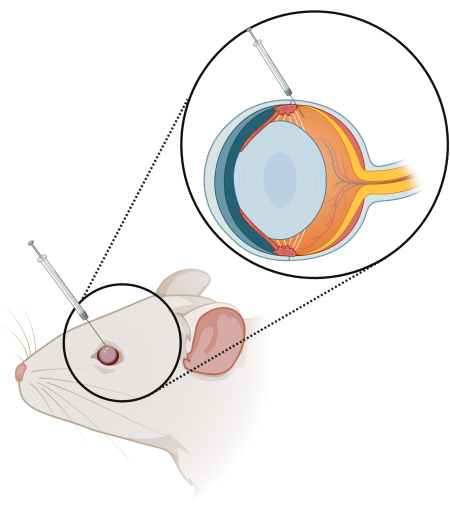
Figura 1: Esquema da técnica de injeção intravítrea (IV). Uma seringa de 10 μL com uma agulha de 33 G, comprimento de 10 mm e ângulo de 15 graus é inserida 2/3 do caminho no olho no limbo. Clique aqui para ver uma versão maior desta figura.
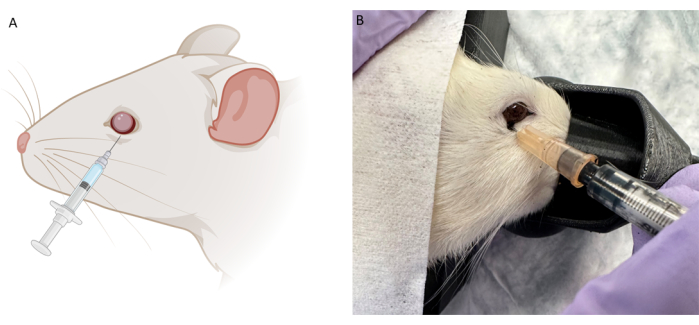
Figura 2: Imagem esquemática e representativa da técnica de injeção retrobulbar (RB). (A) Imagem esquemática da injeção de RB. Uma seringa de insulina de 0,5 mL com agulha de 28 G é inserida ao longo da borda orbital inferior em um ângulo entre 6 e 7 horas. A agulha é avançada até que a parte de trás da cavidade ocular seja sentida e, em seguida, puxada ligeiramente para trás antes da injeção. (B) Imagem representativa da técnica de injeção de RB usando a mesma agulha com tinta de tatuagem preta durante os testes piloto. Clique aqui para ver uma versão maior desta figura.
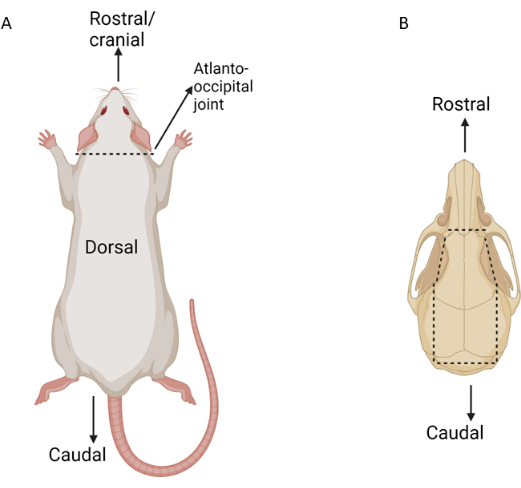
Figura 3: Esquema dos principais pontos de dissecção durante o isolamento do tecido ocular. As linhas pontilhadas indicam pontos de incisão. (A) Rato exibido dorsalmente com a articulação atlanto-occipital marcada. (B) Crânio de rato exibido dorsalmente com importantes marcas de incisão observadas. Clique aqui para ver uma versão maior desta figura.
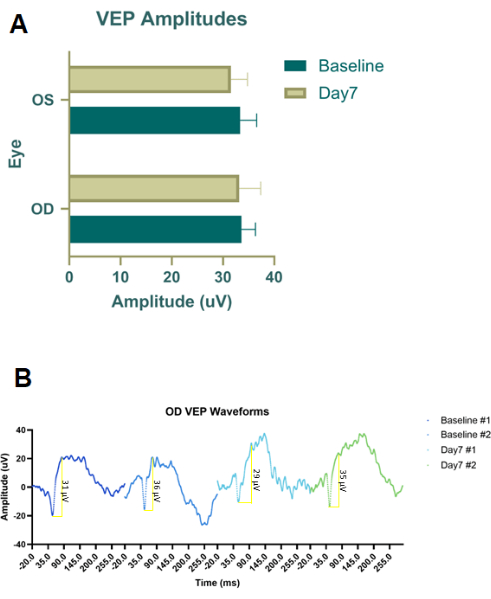
Figura 4: Potenciais evocados visuais flash (fVEPs) de coortes tratadas com solução salina RBI. (A) Amplitudes médias de fVEP de olhos direitos (OD) tratados com RBI salino e olhos esquerdos (OS) de controle/não tratados. Não foram detectadas diferenças significativas na amplitude das formas de onda do fVEP entre os grupos ou entre os olhos. (B) Formas de onda fVEP dos olhos direitos (OD) de RBI salino tratados com olhos no início e sete dias após a injeção (n = 2 amostras de animais). Clique aqui para ver uma versão maior desta figura.

Figura 5: Micrografias epifluorescentes da cabeça do nervo óptico (A,B) e amostra de olho em bloco (C) de roedores coletados após a Dissecção de Isolamento do Tecido Ocular. (A, B) Cabeças intactas do nervo óptico foram coletadas dos animais e coradas com marcadores para β-tubulina (verde), proteína glial fibrilar ácida (GFAP; vermelho) e marcador nuclear DAPI (azul) com aumento de 20x. (C) Amostra de olho em bloco mostrando o globo intacto e o nervo óptico completo. Clique aqui para ver uma versão maior desta figura.
| Agente | Rota | Retina | Nervo óptico |
| Ciclosporina | IVI | 383 | <5 |
| Ciclosporina | RBI | 16 | 49 |
| Ciclosporina | Tópico | ND | ND |
| TUDCA | IVI | ND | ND |
| TUDCA | RBI | ND | ND |
| Ibudilast | IVI | ND | ND |
| Ibudilast | RBI | ND | <5 |
| Anakinra | IVI | D | ND |
| Anakinra | RBI | NA | NA |
| ND: Não detectado | |||
| D: Detectado, mas não pôde ser quantificado | |||
| NA: Não disponível | |||
Tabela 1: Injeções piloto terapêuticas. Os seguintes agentes terapêuticos foram investigados quanto à sua presença na retina e no nervo óptico 24 h após a administração: ciclosporina (tópica, IVI, RB), TUDCA (RB e IVI), ibudilast (RB e IVI) e Anakinra (RB e IVI). A ciclosporina foi detectada na retina e no nervo óptico após ambas as vias de injeção, indicando que nossos protocolos de injeção RB e IV são capazes de administrar medicamentos oculares na retina e no nervo óptico.
Discussão
Os intrincados desafios associados à administração terapêutica da retina e do nervo óptico, principalmente devido à barreira impermeável imposta pelo BRB, ressaltam a importância deste estudo 3,4. A exploração das técnicas de IVI e RBI não apenas destaca abordagens inovadoras para superar esses obstáculos, mas também enfatiza as implicações mais amplas para os cuidados oculares e o desenvolvimento terapêutico. Esses achados demonstram que tanto o IVI quanto o RBI podem facilitar a administração direcionada de terapias diretamente aos tecidos oculares afetados. Essa abordagem direcionada é vital para alcançar concentrações terapêuticas que muitas vezes são inatingíveis por meio de vias de administração sistêmicas ou tópicas 2,11, aumentando assim a eficácia dos tratamentos para várias doenças oculares.
A análise comparativa dessas técnicas de injeção revela seus benefícios únicos: o IVI fornece acesso direto às camadas vítrea e interna da retina27, enquanto o RBI permite a difusão para o nervo óptico sem comprometer a integridade do BRB28. Esses insights contribuem para uma compreensão mais sutil da melhor forma de fornecer agentes terapêuticos específicos, melhorando os resultados do tratamento para pacientes que sofrem de doenças oculares. Os métodos de entrega de IVI e RBI descritos aqui forneceram com sucesso terapêuticas, como a ciclosporina, a tecidos críticos, destacando o potencial para o desenvolvimento de terapias oculares eficazes.
Além disso, por meio do processo de desenvolvimento desse método terapêutico, o isoflurano inalatório foi escolhido como método de sedação para esse protocolo RBI e IVI, por ser de ação rápida tanto na ativação quanto na recuperação. O SALOOT fornece suporte e estabilização cruciais para o roedor, ao mesmo tempo em que permite uma taxa uniforme de anestésico inalado. Conforme discutido anteriormente, alguns riscos associados ao RBI incluem possíveis danos ao olho devido à inserção cega da agulha, bem como bloqueio do fluxo sanguíneo ou colapso traqueal devido à técnica de pressão descrita no protocolo de injeção retrobulbar para camundongos23. Para ajudar a mitigar esses riscos, este protocolo utiliza pinças oftálmicas para agarrar a pálpebra inferior do animal para estabilização, renunciando assim à técnica de pressão e eliminando o bloqueio do fluxo sanguíneo ou o colapso traqueal. Essa técnica também oferece melhor controle sobre o animal enquanto a agulha está sendo inserida. O uso de fórceps combinado com o uso do microscópio de operação ao vivo ajuda a minimizar o risco de inserção cega, proporcionando ao operador uma melhor visualização da localização da agulha. Além disso, a plataforma de cirurgia fornece suporte crucial para a cabeça, o que evita que o crânio se mova durante a inserção da agulha. A plataforma cirúrgica também proporciona uma elevação da cabeça em relação ao resto do corpo, o que permite que a cabeça fique em uma posição mais nivelada e, como a plataforma possui conexões de isoflurano e oxigênio, o nível de anestesia nunca é comprometido durante o posicionamento. A técnica IVI foi adotada por sua capacidade única de contornar o BRB, injetando terapêutica diretamente no humor vítreo. A técnica apresenta a oportunidade de danos oculares devido à sua natureza invasiva, mas o risco é minimizado garantindo cuidadosamente que a agulha não arranhe a lente, removendo lentamente a agulha e aplicando pressão no olho por 10 a 15 s após a injeção.
A remoção e análise bem-sucedidas de amostras de retina e nervo óptico em bloco foram possíveis por meio desse método exclusivo de recuperação de tecidos. O isolamento do olho e do nervo em bloco foi alcançado, o que ajuda a avaliar todo o sistema visual, como evidenciado pela coloração da cabeça do nervo óptico e da imunofluorescência ocular completa (Figura 5). Este método permite uma visualização de cima para baixo do cérebro, nervos ópticos e globos, o que permite uma preservação mais fácil da estrutura geral e integridade de nossos tecidos.
Este estudo tem limitações potenciais, incluindo o uso de apenas um sexo animal e um tamanho de amostra relativamente pequeno. As injeções de RB também estão associadas à limitação inerente do vazamento terapêutico. Após a injeção de RB, a terapêutica pode migrar do espaço retrobulbar para a frente do globo. Essa técnica teve como objetivo minimizar essa limitação inerente, alterando o ângulo de inserção e mantendo a agulha o mais próximo possível da parte posterior da órbita. Além disso, foi determinado que manter uma leve pressão após a administração terapêutica por 10-15 s ajudou a evitar que a terapêutica migrasse para fora do espaço retrobulbar.
Esses métodos serão utilizados em trabalhos futuros para intervenção terapêutica em um modelo de lesão ocular traumática em pequenos animais. Os métodos IVI foram expandidos para uso em pintinhos e camundongos; no entanto, o tamanho da agulha e os volumes terapêuticos devem ser ajustados. Para os pintinhos, uma agulha de insulina de 28-29 G e 20 μL de volume terapêutico foram considerados ideais29, mas com camundongos, foi determinado que uma agulha de 31 G e 2 μL de volume terapêutico eram ideais. A técnica IVI mudou minimamente com a tradução para outros animais. Para a tradução do RBI para outras espécies, o tamanho e o volume da agulha precisariam ser adaptados, mas a técnica geral deve permanecer traduzível, desde que as diferenças anatômicas inerentes entre as espécies sejam consideradas.
Os insights obtidos com modelos de pequenos animais são inestimáveis para avançar na compreensão dos mecanismos de administração de medicamentos e otimizar os protocolos de tratamento. Em última análise, esta pesquisa estabelece as bases para terapias mais eficazes que podem melhorar significativamente a qualidade do atendimento óptico, avançando para preservar a visão e melhorar os resultados na prática clínica.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Este trabalho foi parcialmente financiado pelos prêmios W81XWH-15-1-0074 e W81XWH-22-1-0989 do Programa de Pesquisa de Visão do Departamento de Defesa dos EUA. As opiniões ou afirmações aqui contidas são opiniões privadas dos autores e não devem ser interpretadas como oficiais ou como refletindo as opiniões do Departamento do Exército ou do Departamento de Defesa. Esta bolsa de pesquisa foi apoiada em parte pela afiliada de Ohio do Prêmio de Bolsa de Estudo para Jovens Investigadores da Prevent Blindness para Females Scholars in Vision Research. Reconhecemos com gratidão o apoio da Fundação Ross. Os serviços foram realizados no Programa Principal de Pesquisa em Ciências da Visão da OSU sob P30EY032857. Gostaríamos de agradecer ao Laboratório e Recursos Animais da Universidade Estadual de Ohio (ULAR). Além disso, gostaríamos de agradecer aos membros do laboratório de graduação da Reilly, Michelle Mosko, Emma Lally, Sam Duckworth e Eve Howard. Também gostaríamos de agradecer a Bongsu Kim por contribuir para o design do SALOOT, bem como a Elizabeth Urbanski e Ryan Webb. A Figura 1, a Figura 2A e a Figura 3 foram criadas com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
Referências
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados