Method Article
Somministrazione terapeutica oculare e recupero avanzato dei tessuti nei ratti adulti
In questo articolo
Riepilogo
Questo studio presenta una metodologia per la somministrazione di terapie nella retina e nei nervi ottici del ratto adulto. Inoltre, viene introdotto un metodo unico di recupero dei tessuti per una raccolta in blocco top-down del nervo ottico e della retina in un ratto adulto.
Abstract
La somministrazione terapeutica al segmento posteriore dell'occhio, compresa la retina e il nervo ottico, è complicata dalla presenza di barriere emato-encefaliche e emato-retiniche. Piccoli modelli animali, come i ratti, sono utilizzati per lo studio di varie patologie oculari. Sebbene la somministrazione terapeutica all'occhio posteriore sia impegnativa, raggiungerla è essenziale per il trattamento dei disturbi oculari, molti dei quali richiedono la convalida in piccoli modelli animali per la rilevanza traslazionale. Pertanto, vengono presentate due tecniche di somministrazione terapeutica posteriore: l'iniezione intravitreale (IVI) e l'iniezione retrobulbare (RBI) per l'uso nei ratti adulti. Inoltre, viene introdotto un metodo per la rimozione in blocco degli occhi e dei nervi ottici per varie tecniche di analisi istologica e molecolare. Il protocollo di dissezione consente l'osservazione completa del sistema neuro-visivo, riducendo al minimo le lesioni post-mortem ai tessuti retinici e dei nervi ottici. La somministrazione terapeutica della ciclosporina terapeutica alla retina e al nervo ottico è stata raggiunta, con concentrazioni rilevabili osservate ventiquattro ore dopo l'iniezione utilizzando sia IVI che RBI. Inoltre, sono stati estratti con successo campioni di retina e nervosi in blocco per l'analisi istologica completa del tessuto oculare, facilitando l'osservazione completa della retina e del sistema neurovisivo in generale.
Introduzione
La somministrazione di terapie alla retina e al nervo ottico è incredibilmente difficile a causa della complessa anatomia dell'occhio 1,2, in particolare della presenza della barriera emato-retinica (BRB)3,4,5. Il BRB serve a proteggere la retina dall'invasione della circolazione sistemica, ma è un avversario impegnativo per la somministrazione terapeutica poiché la circolazione terapeutica sistemica è spesso bloccata dal BRB 6,7. Piccole molecole lipofile possono facilmente diffondersi attraverso il BRB, ma le molecole più grandi e idrofile hanno più difficoltà ad accedere alla retina6. Le iniezioni intravitreali (IVI) e retrobulbari (RBI) consentono la somministrazione di farmaci ai tessuti oculari, superando le limitazioni imposte dal BRB. L'IVI rappresenta un compromesso promettente somministrando terapie nell'ambiente interno dell'occhio 8,9. Questo metodo richiede che il farmaco attraversi il vitreo, bypassando così il BRB, e diffondendosi attraverso la retina e la coroide per raggiungere il nervo ottico7. L'RBI viene erogato dietro l'occhio nello spazio retrobulbare10. Le terapie possono essere somministrate per diffusione attraverso i tessuti e le ghiandole nello spazio retrobulbare, interessando il nervo ottico e le strutture circostanti senza entrare direttamente nella retina, che mantiene l'integrità del BRB. Somministrando farmaci direttamente o indirettamente nell'occhio, sia le iniezioni intravitreali che quelle retrobulbari possono raggiungere concentrazioni locali più elevate del farmaco terapeutico, il che ne migliora l'efficacia rispetto alla somministrazione topica o sistemica (orale o endovenosa)2. Ciò è particolarmente importante per i trattamenti che richiedono un'azione rapida o un'elevata potenza, come si vede in molte malattie oculari. La somministrazione mirata limita anche l'esposizione del resto del corpo al farmaco, il che riduce il rischio di effetti fuori bersaglio e aiuta a ridurre al minimo i potenziali effetti avversi che possono verificarsi quando i farmaci vengono somministrati per via topica, orale o endovenosa11.
Altre iniezioni perioculari, come quelle sottocongiuntivali, subtenali posteriori e sottoretiniche, hanno i loro benefici e limiti 2,5. È stato osservato che le iniezioni posteriori di sottotenone forniscono alte concentrazioni di farmaco ai tessuti oculari; Tuttavia, l'iniezione subtenone è più vicina alla sclerale rispetto alla vasscularatura orbitale 5,12. Al contrario, l'RBI posiziona il terapeutico più vicino al nervo ottico rispetto al sottotenone posteriore o al sottocongiuntivale13. Ciò può significare che le patologie del nervo ottico favoriscono le terapie somministrate da RBI rispetto ad altri tipi di iniezione perioculare. Le iniezioni posteriori di sottotenone hanno rischi associati, tra cui strabismo, ifemo e pressione intraoculare elevata5. L'elevata pressione intraoculare è anche un fattore di rischio segnalato nelle iniezioni IVI, sottocongiuntivali e sottoretiniche2. Questi tipi di iniezione spesso richiedono un dosaggio ripetuto per ottenere l'effetto terapeutico desiderato2. Altri fattori di rischio associati alle iniezioni sottoretiniche, alle iniezioni sottocongiuntivali e all'IVI includono la formazione di cataratta, l'emorragia retinica, il distacco di retina e l'infiammazione2. Queste IVI, iniezioni sottoretiniche e iniezioni sottocongiuntivali sono più invasive delle iniezioni RBI, poiché queste iniezioni sono intraoculari2. L'RBI può essere considerato meno invasivo in quanto colloca la terapia nello spazio retrobulbare, senza inserire direttamente l'ago nel globo dell'occhio. Altre strategie di somministrazione terapeutica meno invasive, come la somministrazione topica, non sono in grado di fornire un farmaco sufficiente, con meno del 5% del farmaco trattenuto sulla superficie oculare 2,5.
L'IVI è una tecnica importante nei modelli preclinici che viene utilizzata per la sua capacità di somministrare agenti terapeutici direttamente nel segmento posteriore dell'occhio. L'IVI somministra il farmaco direttamente all'umor vitreo, rendendolo una tecnica di somministrazione preferita per il trattamento localizzato14. La tecnica IVI consente al terapeutico di aggirare la barriera emato-retinica, che è un ostacolo comune alla penetrazione del farmaco nella retina14. L'IVI introduce l'opportunità di infiammazione e danno alle strutture oculari, quindi è necessario impiegare un'aderenza meticolosa alla procedura14. Per ridurre al minimo il distacco della retina e la formazione di cataratta, Chiu et al. descrivono un approccio IVI che enfatizza l'inserimento e l'iniezione di uno smusso di 45 gradi a livello della par plana, evitando il cristallino, la retina, il muscolo oculare e i vasi15. In questa tecnica, un ago da 30 G viene inserito nella sclera nasale per la somministrazione terapeutica15. L'IVI è ancora associato a rischi a causa della sua natura invasiva. I potenziali rischi includono il distacco della retina, la formazione di cataratta, l'endoftalmite o l'emorragia16. La natura invasiva delle tecniche IVI aumenta anche la pressione intraoculare, come dimostrato in un esperimento sugli occhi suini eseguito da Ikjong Park et al.16. Lo studio mostra cambiamenti nella pressione intraoculare durante le diverse fasi dell'inserimento dell'ago e dell'iniezione di fluidi. Essi riportano variazioni sostanziali della pressione intraoculare durante la procedura16.
Gli RBI sono stati utilizzati con successo in studi precedenti come mezzo di somministrazione terapeutica ai roditori. Uno di questi studi ha confrontato gli effetti di vari analoghi delle prostaglandine somministrati tramite RBI17. Ai ratti albini è stato somministrato un RBI con un ago da 26 G di iniettato da 0,1 mL inserito attraverso l'area laterale del fornice inferiore con un angolo di 45 gradi17. Il protocollo utilizzato in questo studio è stato adattato da un metodo precedentemente descritto in cui i ratti sono stati anestetizzati tramite iniezione intraperitoneale (IP) di cloralidrato18. Un altro studio condotto sui ratti ha confrontato le gocce topiche con le iniezioni retrobulbari19. I ratti sono stati anestetizzati tramite un'iniezione IP di ketamina/xilazina e l'RBI è stato somministrato tramite un ago da 30 G19. In contrasto con i metodi di sedazione precedentemente discussi, uno studio che osservava gli effetti dell'RBI sul grasso orbitale ha utilizzato l'isoflurano per inalazione per sedare i ratti prima dell'RBI20. Sebbene questi studi forniscano informazioni su quali anestetici e specifiche dell'ago potrebbero avere successo, il posizionamento e la manipolazione degli animali durante la procedura non vengono discussi.
Vari studi sui topi conducono anche RBI per metodi di somministrazione terapeutica. Uno studio ha confrontato l'RBI con l'iniezione laterale della vena caudale per indurre con successo la sindrome nefrosica21. Un secondo studio ha anche confrontato le stesse due tecniche di iniezione nella somministrazione di mezzi di contrasto per l'imaging cardiaco22. I topi sono stati anestetizzati con isoflurano per inalazione e iniettati nella parte mediale dell'occhio22. Entrambi gli studi hanno adattato il loro metodo RBI da un protocollo precedentemente scritto. È importante notare che questo protocollo ha chiamato la loro iniezione come retro-orbitale, ma ha descritto la posizione dell'iniezione come lo spazio retrobulbare dietro l'occhio. Gli autori di questo protocollo hanno utilizzato l'isoflurano per via inalatoria come metodo di sedazione preferito, notando la rapida attivazione e il tempo di recupero dei topi23. Per un RBI, l'occhio è stato parzialmente sporgente dall'orbita applicando pressione sulla pelle intorno all'occhio23. Quindi, l'ago è stato introdotto dal canto mediale con il lato smussato rivolto verso il basso con un angolo di 30 gradi ed è stato inserito fino a raggiungere la base dell'occhio23. È necessario prestare attenzione quando si applica pressione all'animale, poiché può verificarsi un blocco accidentale del flusso sanguigno o un collasso tracheale23. L'iniettore è anche cieco alla punta dell'ago al momento dell'inserimento e, pertanto, danneggiare l'occhio è un rischio associato. 23 Danneggiare l'occhio durante la somministrazione terapeutica è un rischio critico in questo esperimento, poiché causare ulteriori lesioni mina direttamente i risultati dello studio. Va inoltre notato che la tecnica di posizionamento e manipolazione precedentemente descritta è stata condotta su topi e non includeva commenti sull'applicabilità ai ratti.
Ci sono molti modi in cui è stata tentata la rimozione del nervo ottico e della retina. Uno di questi metodi ha esplorato la rimozione dei nervi ottici e degli occhi in blocco, preservando un chiasma ottico intatto24. Questo metodo è il più paragonabile allo studio attuale in quanto anche i singoli occhi e nervi ottici sono preservati per la rimozione in blocco; Tuttavia, il chiasma ottico è separato. Esercitare cautela in questa procedura sarebbe della massima importanza a causa della complessità della procedura. Nel metodo attuale, iniziamo la dissezione attraverso il cranio caudale e lavoriamo rostralmente per fornire l'accesso in modo da limitare i danni ai nervi ottici e consentire all'intero nervo di rimanere intatto. Inoltre, mantenere il nervo intatto e attaccato all'occhio è fondamentale per il processo di inclusione, poiché il danno a ciascuna parte del nervo può corrispondere a una diversa osservazione patologica24. L'orientamento del nervo ottico è importante da considerare in quanto il modo in cui è incorporato consente diverse sezioni trasversali, che possono essere importanti per l'analisi istologica.
Un dispositivo su misura noto come tavolo operatorio oftalmico da laboratorio per piccoli animali (SALOOT, una piattaforma di chirurgia oftalmica) è composto da una serie di materiali stampati in 3D per fornire l'anestesia e mantenere l'animale in una posizione stabile per le iniezioni terapeutiche oculari. Il design SALOOT consente la stabilità della testa e delle strutture oculari per le procedure oftalmiche, migliorando la velocità e la riproducibilità delle operazioni, consentendo al contempo l'erogazione di anestesia gassosa e l'evacuazione del particolato di espirazione. Il SALOOT è un blocco stampato tridimensionale caratterizzato da una riduzione concava per sostenere il corpo del ratto con una regione più stretta nella parte anteriore per tenere la testa dell'animale in un cono nasale con un ingresso di isoflurano. Sotto il cono anteriore c'è un piccolo serbatoio e un'uscita di scarico. I seguenti metodi sono stati sviluppati per la somministrazione oculare terapeutica e il recupero preciso del tessuto oculare; Sono stati progettati per studiare i tessuti dopo un trauma oculare, quindi è fondamentale delineare gli effetti del trauma, dell'iniezione, del trattamento e della dissezione per evitare un'interpretazione confusa dei risultati.
Questo articolo presenta due metodi di iniezione terapeutica oculare, l'iniezione intravitreale e retrobulbare, per l'uso in ratti adulti. Inoltre, viene presentato un metodo di recupero dei tessuti per la rimozione in blocco del nervo ottico intatto e della retina da un ratto adulto. Queste tecniche consentono lo studio degli effetti oculari e peri-oculari della patologia indotta e del trattamento.
Protocollo
Tutti gli esperimenti sono stati condotti in conformità con la Dichiarazione ARVO per l'uso degli animali nella ricerca oftalmica e visiva e approvati dal comitato istituzionale per la cura e l'uso degli animali presso l'Ohio State University. Per questo studio sono stati utilizzati ratti maschi Sprague Dawley del peso di ~ 200 g e di circa 2 mesi di età25. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Iniezione intravitreale (IVI)
- Collegare l'isoflurano e i cavi di scarto alle porte di attacco SALOOT. Anestetizzare l'animale utilizzando le procedure standard di isoflurano seguendo la dichiarazione ARVO per l'uso degli animali nella ricerca oftalmica e visiva e il protocollo IACUC approvato.
NOTA: In alternativa, se l'animale era già sotto anestesia da un'altra sessione di test oftalmici (ad esempio, miscela ketamina/xilazina; 90 mg/kg di ketamina e 10 mg/kg di xilazina), trasferire l'animale sulla piattaforma di chirurgia oftalmica e titolare l'anestesia con isoflurano (rapporto 3 ossigeno: 3 isoflurano) per garantire il mantenimento di un'adeguata profondità di anestesia. - Posizionare la piattaforma di chirurgia oftalmica con l'animale anestetizzato sotto un microscopio operatorio dal vivo. Valutare la profondità dell'anestetico tramite il riflesso di ritiro del pedale.
- Mettere una o due gocce di soluzione oftalmica di tetracaina cloridrato allo 0,5% nell'occhio o negli occhi da operare. Applicare un unguento oftalmico topico lubrificante come l'ipromellosa 0,3% sull'occhio controlaterale se non deve essere eseguita alcuna manipolazione.
- Quindi, utilizzare una o due gocce di iodio povidone al 5% sulla superficie oculare e, utilizzando un batuffolo di cotone, applicare lo iodio povidone sulla pelle che circonda l'occhio.
- Utilizzare una siringa da 10 μl con un ago da 33 G con una punta stilo 4 a una lunghezza di 10 mm e un angolo di 15 gradi e aspirare cloruro di sodio batteriostatico allo 0,9%. Sciacquare la siringa e l'ago con la soluzione fisiologica prima di immergere l'ago in uno sterilizzatore a microsfere caldo.
- Lasciar raffreddare prima di procedere. Dopo che l'ago si è raffreddato, aspirare la terapia di interesse alla quantità desiderata (4 μL).
NOTA: Per gli studi di prova del concetto, sono stati utilizzati inchiostro per tatuaggi non diluito e colorante Evan's Blue in soluzione salina tamponata con fosfato (PBS). La polvere blu di Evan è stata mescolata con PBS fino a quando non è opaca. Per gli studi terapeutici proof of concept, sono state utilizzate le seguenti concentrazioni: ibudilast a 1 mg/mL, acido tauroursodesossicolico (TUDCA) 5 mg/mL, ciclosporina iniettabile, 250 mg/mL e anakinra 100 mg/0,67 mL. Le polveri terapeutiche sono state diluite in soluzione salina batteriostatica allo 0,9%.
- Lasciar raffreddare prima di procedere. Dopo che l'ago si è raffreddato, aspirare la terapia di interesse alla quantità desiderata (4 μL).
- Usando una pinza oftalmica sottile con i denti, afferrare delicatamente il tessuto sclerale al limbus per stabilizzarlo. Ci sarà un debole anello rosso attorno all'iride. Usa questo anello come punto di riferimento, inserisci l'ago, smussandolo con il lato rivolto verso il basso e iniettalo nell'occhio posteriore.
NOTA: Assicurarsi di inclinare l'ago verso la retina e inserire l'ago solo a 2/3 (Figura 1). Assicurarsi che l'ago non graffi la lente, poiché ciò porterà alla formazione di cataratta. - Dopo che la terapia è stata iniettata, rimuovere lentamente l'ago. Chiudere l'occhio e mantenere la pressione per almeno 10-15 s prima di sciacquare con soluzione fisiologica.
- Interrompere l'uso dell'isoflurano nell'animale e rimuoverlo dalla piattaforma di chirurgia oftalmica. Metti una goccia di ipromellosa allo 0,3% in ciascun occhio e poi lascia che l'animale si riprenda su un termoforo.
2. Iniezione retrobulbare (RBI)
- Collegare l'isoflurano e i cavi di scarto alle porte di attacco SALOOT. Anestetizzare l'animale utilizzando le procedure standard di isoflurano.
NOTA: In alternativa, se l'animale era già sotto anestesia da un'altra sessione di test oftalmici (ad esempio, miscela ketamina/xilazina; 90 mg/kg di ketamina e 10 mg/kg di xilazina), trasferire l'animale sulla piattaforma di chirurgia oftalmica e titolare l'anestesia con isoflurano (rapporto 3 ossigeno: 3 isoflurano) per garantire il mantenimento di un'adeguata profondità di anestesia. - Posizionare la piattaforma di chirurgia oftalmica con l'animale anestetizzato sotto un microscopio operatorio dal vivo. Valutare la profondità dell'anestetico tramite il riflesso di ritiro del pedale.
- Mettere una o due gocce di soluzione oftalmica di tetracaina cloridrato allo 0,5% nell'occhio o negli occhi da operare. Applicare unguento oftalmico topico lubrificante (ipromellosa 0,3%) sull'occhio controlaterale se non è necessario eseguire alcuna manipolazione.
- Quindi, utilizzare una o due gocce di iodio povidone al 5% sulla superficie oculare e, utilizzando una lancia per occhi, applicare lo iodio povidone sulla pelle che circonda l'occhio.
- Procurarsi una siringa da insulina da 0,5 ml con un ago da 28 G. Elaborare il terapeutico di interesse alla quantità desiderata (100 μL).
NOTA: Per gli studi di prova del concetto, sono stati utilizzati inchiostro per tatuaggi non diluito e colorante Evan's Blue in soluzione salina tamponata con fosfato (PBS). La polvere blu di Evan è stata mescolata con PBS fino a quando non è opaca. Per gli studi terapeutici proof of concept, sono state utilizzate le seguenti concentrazioni: ibudilast a 10 mg/mL, TUDCA a 50 mg/mL, ciclosporina iniettabile a 250 mg/mL e anakinra a 100 mg/0,67 mL. Le polveri terapeutiche sono state diluite in soluzione salina batteriostatica allo 0,9%. - Usando una pinza oftalmica sottile con i denti, afferrare delicatamente la palpebra inferiore per stabilizzarla. Inserire l'ago, con il lato smussato rivolto verso il basso, con un angolo a metà tra le ore 6 e le ore 7 lungo il bordo orbitale inferiore fino a quando non si avverte la parte posteriore dell'alveolo oculare. Tirare leggermente indietro l'ago e poi iniettare lentamente la terapia (Figura 2).
- Rimuovere delicatamente e lentamente l'ago. Quindi, chiudere l'occhio e mantenere la pressione per almeno 10-15 s prima di sciacquare con soluzione fisiologica.
- Interrompere l'uso dell'isoflurano nell'animale e rimuoverlo dalla piattaforma di chirurgia oftalmica. Metti una goccia di ipromellosa allo 0,3% in ciascun occhio e poi lascia che l'animale si riprenda su un termoforo.
3. Dissezione con isolamento del tessuto oculare
- Dopo che l'animale è stato soppresso per asfissia da CO2 o come altrimenti indicato nel protocollo IACUC approvato, porre l'animale in decubito sternale. Utilizzare un'incisione cutanea trasversale sul collo dorsale, che si estende fino al livello del padiglione auricolare.
- Sezionare la muscolatura dorsale per esporre l'articolazione atlanto-occipitale. Usa le forbici per maionese per incidere l'articolazione atlanto-occipitale, separando la testa dal corpo (Figura 3). Utilizzando la dissezione smussata, rimuovere delicatamente la pelle dal cranio dorsale dal livello del naso al collo dorsale, lasciando intatta la pelle intorno a entrambi gli occhi.
- Inserire un paio di emostatici medi-dritti o trascinatori d'ago nel forame magno alla base del cranio. Utilizzare gli emostatici per sfondare delicatamente il cranio laterale che si estende dal forame magno alla regione temporale su entrambi i lati (Figura 3).
- Quando si rimuove la parte superiore del cranio, mantenere gli emostatici paralleli al lato dorsale del cervello. Ciò garantirà che il cervello rimanga intatto e non venga intaccato nel processo di rimozione dell'osso.
- Usando una spatola piatta, rifletti delicatamente il cervello rostralmente per esporre i nervi ottici. Bisogna fare attenzione affinché la tensione del peso del cervello non venga applicata ai nervi ottici.
- Con i nervi esposti, prendi un paio di microforbici medie e fai una piccola incisione attraverso il chiasma ottico, recidendo entrambi i nervi dal cervello. A questo punto, il cervello può essere scartato o posto in paraformaldeide in PBS (4% PFA) per 24 ore a 4 °C per la valutazione istologica.
- Usando un paio di piccole forbici per l'iride e un paio di micro pinze oftalmiche dentate, rimuovi con cura il tessuto in eccesso (cioè palpebre, tessuto connettivo, ecc.) intorno all'occhio. Una volta completato, l'occhio dovrebbe essere situato nell'orbita oculare ma con solo il muscolo extraoculare e le ghiandole ancora presenti.
- Utilizzando gli emostatici in combinazione con le piccole forbici dell'iride, tagliare l'orbita oculare, facendo molta attenzione a non tagliare il nervo ottico mentre passa attraverso il canale ottico. Staccare con cautela l'osso nella parte posteriore dell'alveolo oculare con gli emostatici e, per un controllo più preciso, utilizzare le piccole forbici da dissezione.
- Dopo che l'osso è stato rimosso, tagliare delicatamente intorno all'orbita oculare con un paio di microforbici e una pinza fine per rimuovere i cuscinetti adiposi, le ghiandole e i muscoli extraoculari. Assicurati di prestare attenzione ai nervi ottici durante questo processo.
- L'occhio dovrebbe poter essere riflesso delicatamente caudalmente verso l'interno del cranio. A questo punto, usa piccole microforbici e pinze fini per rimuovere il tessuto connettivo che circonda il nervo sulla cresta cranica inferiore.
- Una volta che questo tessuto è stato rimosso, l'occhio e l'intero nervo ottico dovrebbero poter essere sollevati dal cranio in blocco. Ripeti questi passaggi per l'occhio e il nervo controlaterale.
- Inoltre, pulire il nervo ottico e l'occhio dal tessuto in eccesso come la guaina durale. Se non è necessario conservare i tessuti per l'analisi istologica, eseguire il congelamento rapido con ghiaccio secco o azoto liquido prima di essere conservati a -80 °C.
- Per la spettrometria di massa, la retina deve essere isolata dalla regione interna del globo e il nervo ottico deve essere isolato. Separare il nervo ottico dal globo nel punto esterno più vicino. Posizionare il nervo in una crioprovetta su ghiaccio prima di essere trasferito a -80 °C.
- Posizionare il globo oculare su una capsula di Petri al microscopio operatorio. Usa un paio di pinze curve per tenere fermo l'occhio prima di praticare un'incisione al limbus con un paio di piccole microforbici.
- Estendere il taglio fino a comprendere l'intera circonferenza del globo. Il globo deve essere diviso in due e la parte anteriore può essere scartata.
- Posiziona la sezione posteriore con l'interno rivolto verso l'alto e, utilizzando un paio di pinzette oftalmiche sottili, rimuovi il sottile tessuto color crema. Potrebbe sembrare che si attacchi al disco ottico. In tal caso, utilizzare le microforbici per tagliare la retina dal disco.
NOTA: Il tessuto retinico può quindi essere posizionato in una crioprovetta su ghiaccio prima di essere trasferito a -80 °C. I tessuti possono quindi essere trasferiti all'impianto di spettrometria di massa per la valutazione.
- Per la colorazione immunoistologica mediante perfusione parziale, posizionare l'occhio intatto su una capsula di Petri. Utilizzare un paio di pinze curve per tenere fermo l'occhio prima di prendere una siringa da insulina con un ago da 28 G e inserirla nel limbus, con l'ago angolato verso la retina. Ripeti questo passaggio in altri due punti lungo il limbus. La puntura del globo aiuta a garantire un'adeguata perfusione e aiuta a fissare in modo appropriato.
NOTA: Il globo deve essere fissato in PFA al 4% per almeno 40 minuti prima di passare a un agitatore e agitare a bassa velocità per altri 20 minuti per facilitare il movimento del fluido. - Una volta completata la fase di fissaggio, rimuovere il PFA e sostituirlo con PBS. Posizionare le fiale su un leggero agitare per 15 minuti, quindi ripetere questo passaggio per un secondo risciacquo PBS di 15 minuti.
- Dopo l'ultimo ciclo di risciacquo PBS, aspirare il PBS e sostituirlo con una soluzione di saccarosio al 30% in PBS, quindi conservare in frigorifero per 24 ore. Dopo la fase di incubazione del saccarosio, incorporare il tessuto nell'OCT per la valutazione istologica26.
Risultati
Gli esperimenti pilota preliminari sono stati eseguiti su animali cadaveri utilizzando colorante per iniezione (colorante Evans Blue) e inchiostro per tatuaggi (Figura 2B) per ottimizzare il posizionamento e le dimensioni dell'ago sia per RBI che per IVI. L'inchiostro del tatuaggio non era diluito, quindi la polvere di Evans Blue veniva mescolata in PBS fino a quando il fluido non diventava opaco. Abbiamo concluso che l'RBI ideale prevedeva un ago da 28 G inserito con un angolo a metà strada tra le 6 e le 7 lungo il bordo orbitale inferiore fino a quando non si sentiva la parte posteriore dell'incavo oculare. Questo consegnava i coloranti nella parte posteriore dell'orbita, vicino al nervo, senza perforare il nervo ottico. Allo stesso modo, questa prova pilota di tintura su cadavere è stata seguita con l'iniezione IVI, ma è stato utilizzato solo il colorante Evans Blue poiché l'inchiostro del tatuaggio era troppo viscoso in combinazione con l'ago da 33 G. Una volta determinati i protocolli di iniezione, sono stati eseguiti studi terapeutici in vivo utilizzando ratti Long-Evans maschi pigmentati a 200 g (n = 18). Inoltre, i potenziali evocati visivi del flash adattati alla luce (fVEP) sono stati condotti utilizzando ratti Long-Evans maschi (n = 2) per determinare la sicurezza RBI. Sono stati registrati i valori basali di fVEP e quindi 7 giorni dopo l'iniezione di soluzione salina (100 μL) nell'occhio destro (OD), sono stati nuovamente condotti gli fVEP. Gli occhi sinistri (OS) non hanno ricevuto iniezione. I fVEP sono stati condotti seguendo protocolli preesistenti, in cui i segnali sono stati ottenuti su uno sfondo di 30 cd/m2 utilizzando un flash bianco (200 cd.s/m2) e un intervallo interstimolo di 1000 ms26. Le ampiezze fVEP non hanno mostrato cambiamenti significativi tra gli occhi o i punti temporali (Figura 4). L'analisi statistica è stata eseguita utilizzando un'ANOVA a due onde con un intervallo di confidenza del 95%. I test di confronto multiplo di Tukey sono stati condotti in GraphPad Prism per determinare le interazioni di gruppo26.
Per determinare l'efficacia della somministrazione terapeutica oculare, sono state ottenute le seguenti terapie neuroprotettive di interesse: ibudilast a 10 mg/mL (RBI) e 1 mg/mL (IVI), acido tauroursodesossicolico (TUDCA) 50 mg/mL (RBI) e 5 mg/mL (IVI), ciclosporina iniettabile, 250 mg/mL, ciclosporina topica, 0,05% e anakinra 100 mg/0,67 mL. La ciclosporina è stata somministrata tramite RBI (n = 2), IVI (n = 2) e per via topica (n = 3). Anakinra, ibudilast e TUDCA sono stati somministrati tramite RBI (n = 2) e IVI (n = 2). I farmaci sono stati selezionati per il loro potenziale come terapie neuroprotettive per l'uso in un modello di ratto di neuropatia ottica traumatica. La ciclosporina è stata utilizzata in particolare in quanto era altamente viscosa e, quindi, difficile da iniettare rispetto ad altre terapie. I tessuti sono stati prelevati 24 ore dopo l'iniezione seguendo il metodo precedentemente indicato. I tessuti sono stati analizzati tramite spettrometria di massa (TUDCA, ibudilast e ciclosporina) o analisi proteomica (anakinra) (OSU's Pharmacoanaytic Shared Resource CORE). Le retine e i nervi di controllo sono stati raccolti e valutati tramite spettrometria di massa e analisi proteomica. I campioni trattati con la terapia sono stati quindi valutati e confrontati con i controlli per determinare i livelli relativi di farmaco trovati in ciascuno dei tessuti di interesse. I campioni di Anakinra RBI sono stati rimossi dall'analisi a causa della risposta del sussulto dell'animale durante l'iniezione, anche in anestesia profonda. A causa di questa risposta al dolore, la somministrazione di RBI Anakinra potrebbe non essere un approccio terapeutico ottimale.
La ciclosporina è stata rilevata sia nella retina che nel nervo ottico 24 ore dopo attraverso entrambi i meccanismi di iniezione; Tuttavia, la somministrazione topica non è stata rilevata in nessuno dei due tipi di tessuto. Nel gruppo di iniezione endovenosa, la retina aveva una concentrazione di 383 ppb e il nervo ottico aveva <5 ppb. La via di iniezione di RB ha osservato 16 ppb nella retina e 49 ppb nel nervo ottico (Tabella 1). TUDCA non è stato rilevato né nella retina né nel nervo ottico 24 ore dopo l'iniezione per entrambe le vie di iniezione. Ibudilast è stato rilevato nel tessuto del nervo ottico di un solo animale dopo iniezione di RB (<5 ppb). Lo studio pilota terapeutico sull'iniezione ha indicato che entrambi i protocolli di iniezione sono in grado di somministrare farmaci alla retina e al nervo ottico, come evidenziato dalla presenza di ciclosporina in entrambi i tipi di tessuto dopo entrambi i metodi di iniezione. Questo studio indica anche che la ciclosporina ha prodotto alte concentrazioni all'interno dei tessuti bersaglio di interesse. Un'ipotesi è che ibudilast e TUDCA possano aver raggiunto la retina e il nervo ottico, ma la loro emivita nell'ambiente oculare potrebbe essere stata troppo breve per essere rilevata 24 ore dopo l'iniezione. Può darsi che i farmaci abbiano un impatto neuroprotettivo in questo momento; tuttavia, sarebbero necessari ulteriori studi per confermare la farmacocinetica di questi farmaci sia nella regione interna (IVI) che in quella extraoculare (RBI).
Questo studio pilota ha anche supportato il protocollo di isolamento del tessuto oculare attraverso la rimozione di successo dell'intero nervo ottico e degli occhi. Le retine e i nervi ottici sono stati ottenuti con successo per l'analisi nello studio pilota di somministrazione terapeutica (Tabella 1). Inoltre, utilizzando questa dissezione di isolamento del tessuto oculare, è stato possibile raccogliere in blocco gli occhi e i nervi ottici per l'immunoistochimica (Figura 5). I campioni in blocco sono stati raccolti da due ratti maschi di Sprague Dawley, come descritto sopra. I campioni sono stati incorporati in OCT e sezionati longitudinalmente su un criostato a 10 μm di spessore. I campioni sono stati incubati in PBS per rimuovere l'OCT e quindi incubati in 1:20 siero d'asino normale in PBS più Triton-X-100 (PBT) a temperatura ambiente per 2 ore. Le sezioni sono state quindi incubate con i seguenti anticorpi: anti-β-tubulina (1:1000; MAB5564; Millipore, Burlington, MA) e la proteina acida fibrillare anti-gliale (GFAP; 1:50; Z0334; DAKO, Santa Clara, CA) in PBT per una notte a 4°C, risciacquato con PBS e incubato in asino anti-topo Alexa 488 e asino anti-coniglio Alexa 594 (1:200) in PBT per una notte a 4°C. Le sezioni sono state risciacquate e montate in un supporto di montaggio più DAPI. I campioni sono stati ripresi con un microscopio a fluorescenza ad ampio campo o un microscopio confocale utilizzando impostazioni coerenti26. È stato possibile visualizzare la testa del nervo ottico intatta (Figura 5A, B) e colorarla con successo per i seguenti marcatori di interesse: β-tubulina (verde), proteina acida fibrillare gliale (GFAP; rosso) e marcatore nucleare DAPI (blu). Questo metodo di dissezione ha permesso di ottenere campioni completi del nervo ottico, come mostrato nella Figura 5C.
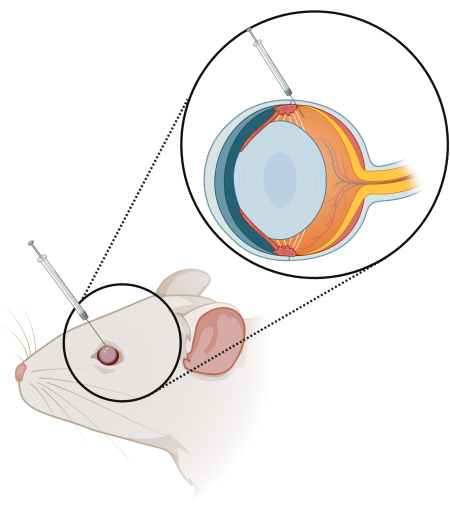
Figura 1: Schema della tecnica di iniezione intravitreale (IV). Una siringa da 10 μl con un ago da 33 G, lunghezza di 10 mm e angolo di 15 gradi viene inserita per 2/3 nell'occhio in corrispondenza del limbus. Clicca qui per visualizzare una versione più grande di questa figura.
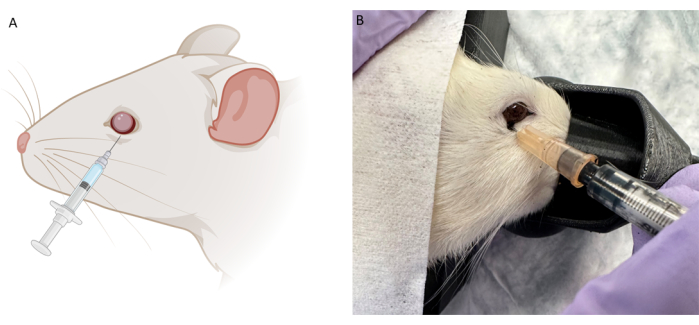
Figura 2: Immagine schematica e rappresentativa della tecnica di iniezione retrobulbare (RB). (A) Immagine schematica dell'iniezione di RB. Una siringa da insulina da 0,5 ml con un ago da 28 G viene inserita lungo il bordo orbitale inferiore con un angolo compreso tra le 6 e le 7. L'ago viene fatto avanzare fino a quando non si avverte la parte posteriore dell'alveolo oculare e quindi tirato leggermente indietro prima dell'iniezione. (B) Immagine rappresentativa della tecnica di iniezione RB utilizzando lo stesso ago con inchiostro nero per tatuaggi durante le prove pilota. Clicca qui per visualizzare una versione più grande di questa figura.
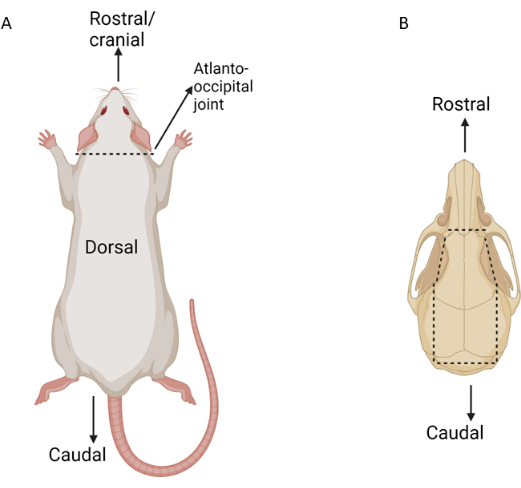
Figura 3: Schema dei principali punti di dissezione durante l'isolamento del tessuto oculare. Le linee tratteggiate indicano i punti di incisione. (A) Ratto mostrato dorsalmente con articolazione atlanto-occipitale marcata. (B) Cranio di ratto mostrato dorsalmente con importanti segni di incisione notati. Clicca qui per visualizzare una versione più grande di questa figura.
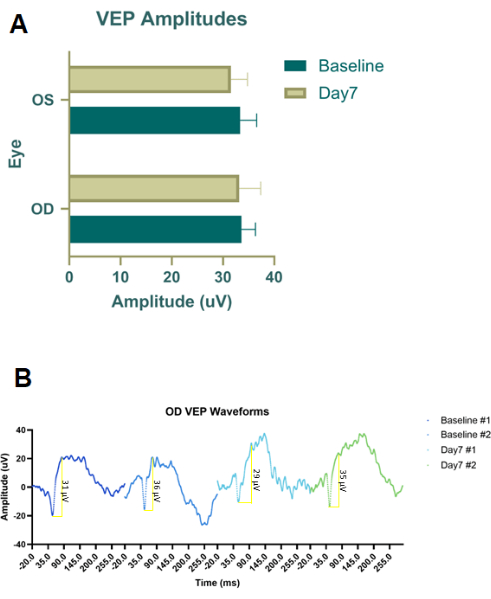
Figura 4: Potenziali evocati visivi flash (fPEP) di coorti trattate con soluzione salina RBI. (A) Ampiezze medie di fVEP da occhi destri (OD) trattati con soluzione salina RBI e occhi sinistri di controllo/non trattati (OS). Non sono state rilevate differenze significative nell'ampiezza delle forme d'onda fVEP tra i gruppi o tra gli occhi. (B) Occhi destri (OD) Forme d'onda fVEP di occhi trattati con soluzione fisiologica RBI al basale e poi a sette giorni dopo l'iniezione (n = 2 campioni animali). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Micrografie epifluorescenti della testa del nervo ottico (A,B) e del campione oculare in blocco (C) dei roditori raccolti dopo la dissezione di isolamento del tessuto oculare. (A,B) Le teste del nervo ottico intatte sono state raccolte dagli animali e sono state colorate con marcatori per la β-tubulina (verde), la proteina acida fibrillare gliale (GFAP; rosso) e il marcatore nucleare DAPI (blu) con un ingrandimento di 20x. (C) Campione oculare in blocco che mostra il globo intatto e il nervo ottico completo. Clicca qui per visualizzare una versione più grande di questa figura.
| Agente | Rotta | Retina | Nervo ottico |
| Ciclosporina | IVI | 383 | <5 |
| Ciclosporina | RBI | 16 | 49 |
| Ciclosporina | Topico | ND | ND |
| TUDCA | IVI | ND | ND |
| TUDCA | RBI | ND | ND |
| Ibudilast | IVI | ND | ND |
| Ibudilast | RBI | ND | <5 |
| Anakinra | IVI | D | ND |
| Anakinra | RBI | NA | NA |
| ND: Non rilevato | |||
| D: Rilevato ma non quantificato | |||
| NA: Non disponibile | |||
Tabella 1: Iniezioni pilota terapeutiche. I seguenti agenti terapeutici sono stati studiati per la loro presenza nella retina e nel nervo ottico 24 ore dopo la somministrazione: ciclosporina (topica, IVI, RB), TUDCA (RB e IVI), ibudilast (RB e IVI) e Anakinra (RB e IVI). La ciclosporina è stata rilevata sia nella retina che nel nervo ottico dopo entrambe le vie di iniezione, indicando che i nostri protocolli di iniezione RB e IV sono in grado di somministrare farmaci per via oculare alla retina e al nervo ottico.
Discussione
Le intricate sfide associate alla somministrazione di terapie alla retina e al nervo ottico, principalmente a causa della barriera impermeabile posta dal BRB, sottolineano l'importanza di questo studio 3,4. L'esplorazione delle tecniche IVI e RBI non solo evidenzia approcci innovativi per superare questi ostacoli, ma sottolinea anche le implicazioni più ampie per la cura oculare e lo sviluppo terapeutico. Questi risultati dimostrano che sia l'IVI che l'RBI possono facilitare la somministrazione mirata di terapie direttamente ai tessuti oculari interessati. Questo approccio mirato è fondamentale per raggiungere concentrazioni terapeutiche spesso irraggiungibili attraverso vie di somministrazione sistemica o topica 2,11, migliorando così l'efficacia dei trattamenti per varie malattie oculari.
L'analisi comparativa di queste tecniche di iniezione rivela i loro vantaggi unici: l'IVI fornisce l'accesso diretto agli strati del vitreo e della retina interna27, mentre l'RBI consente la diffusione al nervo ottico senza compromettere l'integrità del BRB28. Queste intuizioni contribuiscono a una comprensione più sfumata di come fornire al meglio agenti terapeutici specifici, migliorando in ultima analisi i risultati del trattamento per i pazienti affetti da malattie oculari. I metodi di somministrazione IVI e RBI qui descritti hanno fornito con successo terapie, come la ciclosporina, ai tessuti critici, evidenziando il potenziale per lo sviluppo di terapie oculari efficaci.
Inoltre, attraverso questo processo di sviluppo del metodo terapeutico, l'isoflurano per via inalatoria è stato scelto come metodo di sedazione per questo protocollo RBI e IVI, poiché agisce rapidamente sia nell'attivazione che nel recupero. Il SALOOT fornisce un supporto e una stabilizzazione cruciali al roditore, consentendo al contempo un tasso uniforme di anestetico inalato. Come discusso in precedenza, alcuni rischi associati all'RBI includono possibili danni all'occhio dovuti all'inserimento dell'ago cieco, nonché il blocco del flusso sanguigno o il collasso tracheale a causa della tecnica di pressione delineata nel protocollo di iniezione retrobulbare per i topi23. Per aiutare a mitigare questi rischi, questo protocollo utilizza una pinza oftalmica per afferrare la palpebra inferiore dell'animale per la stabilizzazione, rinunciando quindi alla tecnica della pressione ed eliminando il blocco del flusso sanguigno o il collasso tracheale. Questa tecnica offre anche un migliore controllo sull'animale durante l'inserimento dell'ago. L'uso di pinze combinato con l'uso del microscopio operatorio dal vivo aiuta a ridurre al minimo il rischio di inserimento alla cieca, offrendo all'operatore una migliore visualizzazione della posizione dell'ago. Inoltre, la piattaforma chirurgica fornisce un supporto fondamentale per la testa, che impedisce al cranio di muoversi durante l'inserimento dell'ago. La piattaforma chirurgica fornisce anche un'elevazione della testa rispetto al resto del corpo, che consente alla testa di essere in una posizione più livellata e, poiché la piattaforma è dotata di collegamenti per isoflurano e ossigeno, il livello di anestesia non viene mai compromesso durante il posizionamento. La tecnica IVI è stata adottata per la sua capacità unica di bypassare il BRB iniettando terapie direttamente nell'umor vitreo. La tecnica introduce l'opportunità di danni oculari a causa della sua natura invasiva, ma il rischio è ridotto al minimo assicurandosi attentamente che l'ago non graffi la lente, rimuovendo lentamente l'ago e applicando pressione sull'occhio per 10-15 secondi dopo l'iniezione.
Grazie a questo metodo unico di recupero dei tessuti, è stato possibile rimuovere e analizzare con successo campioni di retina e nervo ottico in blocco. È stato ottenuto l'isolamento dell'occhio e del nervo in blocco, che aiuta a valutare l'intero sistema visivo, come evidenziato dalla testa del nervo ottico e dalla colorazione a immunofluorescenza completa dell'occhio (Figura 5). Questo metodo consente una visualizzazione dall'alto verso il basso del cervello, dei nervi ottici e dei globi, che consente una più facile conservazione della struttura complessiva e dell'integrità dei nostri tessuti.
Questo studio ha potenziali limitazioni, tra cui l'uso di un solo sesso animale e una dimensione del campione relativamente piccola. Le iniezioni di RB sono anche associate alla limitazione intrinseca della perdita terapeutica. Dopo l'iniezione di RB, le terapie possono migrare dallo spazio retrobulbare alla parte anteriore del globo. Questa tecnica mirava a ridurre al minimo questa limitazione intrinseca modificando l'angolo di inserimento e mantenendo l'ago il più vicino possibile alla parte posteriore dell'orbita. Inoltre, è stato determinato che il mantenimento di una leggera pressione dopo la somministrazione terapeutica per 10-15 secondi ha contribuito a impedire alla terapia di migrare fuori dallo spazio retrobulbare.
Questi metodi saranno utilizzati in futuri lavori per l'intervento terapeutico in un modello di lesione oculare traumatica di piccoli animali. I metodi IVI sono stati ampliati per l'uso in pulcini e topi; Tuttavia, la dimensione dell'ago e i volumi terapeutici devono essere regolati. Per i pulcini, un ago da insulina da 28-29 G e 20 μL di volume terapeutico sono risultati ottimali29, ma con i topi è stato determinato che un ago da 31 G e 2 μL di volume terapeutico erano l'ideale. La tecnica IVI è cambiata minimamente con la traslazione in altri animali. Per la traduzione dell'RBI in altre specie, le dimensioni e il volume dell'ago dovrebbero essere adattati, ma la tecnica complessiva dovrebbe rimanere traducibile fintanto che si considerano le differenze anatomiche intrinseche tra le specie.
Le informazioni ottenute dai modelli di piccoli animali sono preziose per far progredire la comprensione dei meccanismi di somministrazione dei farmaci e ottimizzare i protocolli di trattamento. In definitiva, questa ricerca getta le basi per terapie più efficaci che potrebbero migliorare significativamente la qualità delle cure oculistiche, facendo passi avanti verso la conservazione della vista e il miglioramento dei risultati nella pratica clinica.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Questo lavoro è stato parzialmente finanziato dal programma di ricerca sulla vista del Dipartimento della Difesa degli Stati Uniti W81XWH-15-1-0074 e W81XWH-22-1-0989. Le opinioni o le affermazioni contenute nel presente documento sono opinioni private degli autori e non devono essere interpretate come ufficiali o come riflettenti le opinioni del Dipartimento dell'Esercito o del Dipartimento della Difesa. Questa borsa di ricerca è stata supportata in parte dall'Ohio Affiliate of Prevent Blindness Young Investigator Student Fellowship Award for Females Scholars in Vision Research. Riconosciamo con gratitudine il sostegno della Ross Foundation. I servizi sono stati eseguiti presso il programma di ricerca di ricerca sulle scienze della visione dell'OSU nell'ambito P30EY032857. Vorremmo ringraziare il Laboratorio e le Risorse Animali dell'Ohio State University (ULAR). Inoltre, vorremmo ringraziare i membri del laboratorio universitario Reilly Michelle Mosko, Emma Lally, Sam Duckworth ed Eve Howard. Vorremmo anche ringraziare Bongsu Kim per aver contribuito al design di SALOOT, così come Elizabeth Urbanski e Ryan Webb. La Figura 1, la Figura 2A e la Figura 3 sono state create con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
Riferimenti
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon