Method Article
Okuläre therapeutische Verabreichung und fortgeschrittene Gewebeentnahme bei erwachsenen Ratten
In diesem Artikel
Zusammenfassung
Diese Studie stellt eine Methodik für die Verabreichung von Therapeutika in die Netzhaut und die Sehnerven der erwachsenen Ratte vor. Darüber hinaus wird eine einzigartige Gewebeentnahmemethode für eine Top-Down-Entnahme des Sehnervs und der Netzhaut bei einer erwachsenen Ratte eingeführt.
Zusammenfassung
Die therapeutische Verabreichung an den hinteren Augenabschnitt, einschließlich der Netzhaut und des Sehnervs, wird durch das Vorhandensein von Blut-Hirn- und Blut-Netzhaut-Schranken erschwert. Kleintiermodelle, wie z. B. Ratten, werden zur Untersuchung verschiedener Augenerkrankungen verwendet. Während die therapeutische Verabreichung an das hintere Auge eine Herausforderung darstellt, ist dies für die Behandlung von Augenerkrankungen unerlässlich, von denen viele eine Validierung in Kleintiermodellen erfordern, um ihre translationale Relevanz zu gewährleisten. Daher werden zwei posteriore therapeutische Verabreichungstechniken vorgestellt: die intravitreale Injektion (IVI) und die retrobulbäre Injektion (RBI) zur Anwendung bei erwachsenen Ratten. Zusätzlich wird ein Verfahren zur en bloc Entfernung der Augen und Sehnerven für verschiedene histologische und molekulare Analysetechniken vorgestellt. Das Dissektionsprotokoll ermöglicht eine vollständige Beobachtung des neurovisuellen Systems bei gleichzeitiger Minimierung der postmortalen Verletzungen des Netzhaut- und Sehnervengewebes. Die erfolgreiche Verabreichung des therapeutischen Cyclosporins an die Netzhaut und den Sehnerv wurde erreicht, wobei vierundzwanzig Stunden nach der Injektion sowohl mit IVI als auch mit RBI nachweisbare Konzentrationen beobachtet wurden. Darüber hinaus wurden erfolgreich En-bloc-Netzhaut- und Nervenproben für die vollständige histologische Gewebeanalyse des Auges extrahiert, was eine umfassende Beobachtung der Netzhaut und des weiteren neurovisuellen Systems ermöglicht.
Einleitung
Die Verabreichung von Therapeutika an die Netzhaut und den Sehnerv ist aufgrund der komplexen Anatomie des Auges 1,2, insbesondere des Vorhandenseins der Blut-Netzhaut-Schranke (BRB)3,4,5, unglaublich schwierig. Der BRB dient dem Schutz der Netzhaut vor einer systemischen Durchblutungsinvasion, ist aber ein schwieriger Gegner der therapeutischen Verabreichung, da der systemische therapeutische Kreislauf häufig durch den BRB blockiert wird 6,7. Kleine lipophile Moleküle können leicht durch das BRB diffundieren, aber größere und hydrophile Moleküle haben es schwerer, Zugang zur Netzhaut zu erhalten6. Intravitreale (IVI) und retrobulbäre (RBI) Injektionen ermöglichen die Verabreichung von Arzneimitteln an das Augengewebe und überwinden die durch die BRB auferlegten Einschränkungen. Die IVI stellt einen vielversprechenden Kompromiss dar, indem sie Therapeutika in die innere Umgebung des Auges verabreicht 8,9. Bei dieser Methode muss das Medikament den Glaskörper passieren, wodurch das BRB umgangen wird, und durch die Netzhaut und die Aderhaut diffundieren, um den Sehnerv zu erreichen7. Die RBI wird hinter dem Auge in den retrobulbären Raum10 abgegeben. Therapeutika können durch Diffusion durch die Gewebe und Drüsen im retrobulbären Raum verabreicht werden, wobei der Sehnerv und die umgebenden Strukturen beeinflusst werden, ohne direkt in die Netzhaut einzudringen, wodurch die Integrität des BRB erhalten bleibt. Durch die direkte oder indirekte Verabreichung von Arzneimitteln in das Auge können sowohl intravitreale als auch retrobulbäre Injektionen höhere lokale Konzentrationen des Therapeutikums erreichen, was seine Wirksamkeit im Vergleich zur topischen oder systemischen Verabreichung (oral oder intravenös) erhöht2. Dies ist besonders wichtig für Behandlungen, die eine schnelle Wirkung oder eine hohe Wirksamkeit erfordern, wie sie bei vielen Augenerkrankungen zu beobachten ist. Die gezielte Verabreichung begrenzt auch die Exposition des restlichen Körpers gegenüber dem Medikament, was das Risiko von Off-Target-Effekten verringert und dazu beiträgt, potenzielle Nebenwirkungen zu minimieren, die auftreten können, wenn Medikamente topisch, oral oder intravenös verabreicht werden11.
Andere periokulare Injektionen, wie z. B. subkonjunktivale, posteriore subtenon und subretinale Injektionen, haben ihre eigenen Vorteile und Einschränkungen 2,5. Es wurde beobachtet, dass posteriore Subtenon-Injektionen hohe Wirkstoffkonzentrationen an das Augengewebe abgeben; Die Subtenoninjektion liegt jedoch näher an der Sklera als an der orbitalen Gefäßstruktur 5,12. Im Gegensatz dazu platziert die RBI das Therapeutikum näher am Sehnerv als am hinteren Subtenon oder Subkonjunktival13. Dies kann bedeuten, dass Erkrankungen des Sehnervs von der RBI verabreichte Therapeutika gegenüber anderen periokularen Injektionsarten bevorzugen. Posteriore Subtenon-Injektionen sind mit Risiken verbunden, einschließlich Schielen, Hyphäma und erhöhtem Augeninnendruck5. Erhöhter Augeninnendruck ist auch ein berichteter Risikofaktor bei IVI-, subkonjunktivalen und subretinalen Injektionen2. Diese Injektionsarten erfordern oft eine wiederholte Dosierung, um die gewünschte therapeutische Wirkung zu erzielen2. Weitere Risikofaktoren im Zusammenhang mit subretinalen Injektionen, subkonjunktivalen Injektionen und IVI sind Kataraktbildung, Netzhautblutung, Netzhautablösung und Entzündungen2. Diese IVI, subretinalen Injektionen und subkonjunktivalen Injektionen sind invasiver als die RBI-Injektionen, da diese Injektionen intraokularsind 2. Die RBI kann als weniger invasiv angesehen werden, da sie das Therapeutikum in den retrobulbären Raum platziert, ohne die Nadel direkt in den Augenball einzuführen. Andere weniger invasive therapeutische Verabreichungsstrategien, wie z. B. die topische Verabreichung, reichen nicht aus, da weniger als 5 % des Arzneimittels auf der Augenoberfläche verbleiben 2,5.
IVI ist eine prominente Technik in präklinischen Modellen, die wegen ihrer Fähigkeit verwendet wird, Therapeutika direkt in den hinteren Augenabschnitt zu verabreichen. IVI gibt das Medikament direkt an den Glaskörper ab, was es zu einer bevorzugten Verabreichungstechnik für die lokalisierte Behandlungmacht 14. Die IVI-Technik ermöglicht es dem Therapeutikum, die Blut-Netzhaut-Schranke zu umgehen, die ein häufiges Hindernis für das Eindringen von Arzneimitteln in die Netzhaut darstellt14. IVI birgt die Möglichkeit von Entzündungen und Schädigungen der Augenstrukturen, so dass eine sorgfältige Einhaltung des Verfahrens erforderlich ist14. Um die Netzhautablösung und Kataraktbildung zu minimieren, beschreiben Chiu et al. einen IVI-Ansatz, der eine 45-Grad-Abschrägung und -injektion auf Höhe der Par plana betont, wobei die Linse, die Netzhaut, der Augenmuskel und die Gefäße vermiedenwerden 15. Bei dieser Technik wird eine 30-G-Nadel zur therapeutischen Verabreichung in die Nasensklera eingeführt15. IVI ist aufgrund seines invasiven Charakters nach wie vor mit Risiken verbunden. Zu den möglichen Risiken gehören Netzhautablösung, Kataraktbildung, Endophthalmitis oder Blutungen16. Der invasive Charakter von IVI-Techniken erhöht auch den Augeninnendruck, wie ein Experiment an Schweineaugen zeigte, das von Ikjong Park et al. durchgeführt wurde16. Die Studie zeigt Veränderungen des Augeninnendrucks in verschiedenen Stadien des Einführens der Nadel und der Flüssigkeitsinjektion. Sie berichten von erheblichen Schwankungen des Augeninnendrucks während des Eingriffs16.
RBIs wurden in früheren Studien erfolgreich als Mittel zur therapeutischen Verabreichung an Nagetiere eingesetzt. Eine dieser Studien verglich die Wirkungen verschiedener Prostaglandin-Analoga, die über RBIverabreicht wurden 17. Albino-Ratten erhielten eine RBI mit einer 26-G-Nadel mit 0,1 ml Injektion, die in einem 45-Grad-Winkel durch den lateralen Bereich des Fornix inferior eingeführt wurde17. Das in dieser Studie verwendete Protokoll wurde von einer zuvor beschriebenen Methode angepasst, bei der die Ratten durch intraperitoneale (IP) Injektion von Chloralhydrat18 anästhesiert wurden. Eine andere Studie, die an Ratten durchgeführt wurde, verglich topische Tropfen mit retrobulbären Injektionen19. Die Ratten wurden über eine IP-Injektion von Ketamin/Xylazin anästhesiert, und die RBI wurde über eine 30-G-Nadel verabreicht19. Im Gegensatz zu den zuvor diskutierten Sedierungsmethoden wurde in einer Studie, die die Auswirkungen von RBI auf das Orbitalfett beobachtete, inhalatives Isofluran verwendet, um die Ratten vor RBI zu sedieren20. Während diese Studien Aufschluss darüber geben, welche Anästhetika und Nadelspezifikationen erfolgreich sein könnten, werden die Positionierung und Handhabung der Tiere während des Eingriffs nicht diskutiert.
Verschiedene Studien an Mäusen führen auch RBIs für therapeutische Verabreichungsmethoden durch. Eine Studie verglich RBI mit der lateralen Schwanzveneninjektion zur erfolgreichen Induktion des nephrotischen Syndroms21. In einer zweiten Studie wurden die gleichen beiden Injektionstechniken bei der Verabreichung von Kontrastmitteln für die kardiale Bildgebung ebenfalls verglichen22. Die Mäuse wurden mit inhalativem Isofluran betäubt und in die mediale Seite des Auges injiziert22. Beide Studien adaptierten ihre RBI-Methode von einem zuvor geschriebenen Protokoll. Es ist wichtig zu beachten, dass dieses Protokoll die Injektion als retroorbital bezeichnete, die Injektionsstelle jedoch als retrobulbären Raum hinter dem Auge beschrieb. Die Autoren dieses Protokolls verwendeten inhalatives Isofluran als bevorzugte Sedierungsmethode und stellten die schnelle Aktivierungs- und Erholungszeit der Mäuse fest23. Bei einer RBI wurde das Auge teilweise aus der Augenhöhle herausragend gemacht, indem Druck auf die Haut um das Auge ausgeübt wurde23. Dann wurde die Nadel an der medialen Canthus-Abschrägungsseite in einem Winkel von 30 Grad eingeführt und bis zur Basis des Auges23 eingeführt. Bei der Ausübung von Druck auf das Tier ist Vorsicht geboten, da es zu einer versehentlichen Verstopfung des Blutflusses oder einem Trachealkollaps kommen kann23. Der Injektor ist auch beim Einführen blind für die Nadelspitze, so dass eine Beschädigung des Auges ein damit verbundenes Risiko darstellt. 23 Die Schädigung des Auges bei der Verabreichung eines Therapeutikums ist ein kritisches Risiko in diesem Experiment, da das Verursachen zusätzlicher Verletzungen die Ergebnisse der Studie direkt untergräbt. Es muss auch beachtet werden, dass die zuvor beschriebene Positionierungs- und Handhabungstechnik an Mäusen durchgeführt wurde und keine Kommentare zur Anwendbarkeit auf Ratten enthielt.
Es gibt viele Arten, auf welche Weise die Entfernung des Sehnervs und der Netzhaut versucht wurde. Eine dieser Methoden untersuchte die Entfernung von Sehnerven und Augen en bloc, wobei ein intaktes Chiasma opticus erhalten blieb24. Diese Methode ist am ehesten mit der aktuellen Studie vergleichbar, da die einzelnen Augen und Sehnerven auch für die Entnahme en bloc erhalten bleiben; Das Chiasma opticum ist jedoch getrennt. Aufgrund der Komplexität des Verfahrens wäre es äußerst wichtig, bei diesem Verfahren Vorsicht walten zu lassen. Bei der aktuellen Methode beginnen wir die Dissektion über den Schwanzschädel und arbeiten rostral, um den Zugang so zu ermöglichen, dass die Schädigung der Sehnerven begrenzt wird und der gesamte Nerv intakt bleibt. Darüber hinaus ist es für den Einbettungsprozess von entscheidender Bedeutung, den Nerv intakt und mit dem Auge verbunden zu halten, da eine Schädigung jedes Teils des Nervs einer anderen pathologischen Beobachtung entsprechen kann24. Die Ausrichtung des Sehnervs ist wichtig zu berücksichtigen, da die Art und Weise, wie er eingebettet ist, unterschiedliche Querschnitte ermöglicht, was für die histologische Analyse wichtig sein kann.
Ein speziell angefertigtes Gerät, das als ophthalmologischer Operationstisch für Kleintierlabore (SALOOT, eine Plattform für Augenchirurgie) bekannt ist, besteht aus einer Reihe von 3D-gedruckten Materialien, um eine Anästhesie zu ermöglichen und das Tier in einer stabilen Position für okuläre therapeutische Injektionen zu halten. Das SALOOT-Design ermöglicht die Stabilität der Kopf- und Augenstrukturen bei ophthalmologischen Eingriffen, was die Geschwindigkeit und Reproduzierbarkeit von Operationen verbessert und gleichzeitig die Gasanästhesieabgabe und das Abfangen von Ausatempartikeln ermöglicht. Der SALOOT ist ein dreidimensional bedruckter Block mit einer konkaven Reduktion, um den Rattenkörper zu halten, mit einer schmaleren Region an der Vorderseite, um den Kopf des Tieres in einem Nasenkegel mit einem Isofluran-Einlass zu halten. Unter dem Nasenkonus befindet sich ein kleiner Ausgleichsbehälter und ein Auslass. Die folgenden Methoden wurden für die therapeutische Augenentnahme und die präzise Entnahme von Augengewebe entwickelt: Sie wurden für die Untersuchung von Geweben nach einem Augentrauma entwickelt, daher ist es wichtig, die Auswirkungen des Traumas, der Injektion, der Behandlung und der Dissektion abzugrenzen, um eine verwirrende Interpretation der Befunde zu vermeiden.
In diesem Artikel werden zwei okuläre therapeutische Injektionsmethoden, die intravitreale und retrobulbäre Injektion, zur Anwendung bei erwachsenen Ratten vorgestellt. Darüber hinaus wird ein Gewebeentnahmeverfahren für die en bloc Entfernung des intakten Sehnervs und der Netzhaut bei einer erwachsenen Ratte vorgestellt. Diese Techniken ermöglichen die Untersuchung der okulären und periokularen Auswirkungen der induzierten Pathologie und Behandlung.
Protokoll
Alle Versuche wurden in Übereinstimmung mit der ARVO-Erklärung für die Verwendung von Tieren in der ophthalmischen und visuellen Forschung durchgeführt und vom institutionellen Ausschuss für Tierpflege und -verwendung an der Ohio State University genehmigt. Für diese Studie wurden männliche Sprague Dawley-Ratten mit einem Gewicht von ~200 g und einem Alter von etwa 2 Monaten verwendet25. Einzelheiten zu den verwendeten Reagenzien und den verwendeten Geräten sind in der Materialtabelle aufgeführt.
1. Intravitreale Injektion (IVI)
- Befestigen Sie das Isofluran und die Abfallleitungen an den SALOOT-Befestigungsanschlüssen. Betäuben Sie das Tier mit Standard-Isofluran-Verfahren gemäß der ARVO-Erklärung für die Verwendung von Tieren in der ophthalmologischen und visuellen Forschung und dem genehmigten IACUC-Protokoll.
HINWEIS: Wenn das Tier bereits aus einer anderen ophthalmologischen Testsitzung unter Narkose stand (d. h. Ketamin/Xylazin-Mischung; 90 mg/kg Ketamin und 10 mg/kg Xylazin), übertragen Sie das Tier auf die Plattform für ophthalmologische Chirurgie und titrieren Sie die Anästhesie mit Isofluran (3 Sauerstoff: 3 Isofluran-Verhältnis), um sicherzustellen, dass eine ausreichende Anästhesietiefe aufrechterhalten wird. - Platzieren Sie die ophthalmochirurgische Plattform mit dem anästhesierten Tier unter einem lebenden Operationsmikroskop. Beurteilen Sie die Narkosetiefe über den Pedalentzugsreflex.
- Geben Sie ein bis zwei Tropfen 0,5%ige Tetracainhydrochlorid-Augenlösung in das Auge oder die Augen, die operiert werden. Tragen Sie eine befeuchtende topische Augensalbe wie Hypromellose 0,3% auf das kontralaterale Auge auf, wenn keine Manipulation durchgeführt werden soll.
- Verwenden Sie dann ein bis zwei Tropfen 5% Povidon-Jod auf die Augenoberfläche und tragen Sie mit einem Wattestäbchen Povidon-Jod auf die Haut um das Auge herum auf.
- Verwenden Sie eine 10-μl-Spritze mit einer 33-g-Nadel mit einer Spitze der Ausführung 4 bei einer Länge von 10 mm und einem Winkel von 15 Grad und ziehen Sie 0,9 % bakteriostatisches Natriumchlorid auf. Spülen Sie die Spritze und die Nadel mit der Kochsalzlösung, bevor Sie die Nadel in einen Heißperlensterilisator tauchen.
- Lassen Sie es abkühlen, bevor Sie fortfahren. Nachdem die Nadel abgekühlt ist, ziehen Sie das gewünschte Therapeutikum auf die gewünschte Menge (4 μl) auf.
HINWEIS: Für Proof-of-Concept-Studien wurden unverdünnte Tätowierfarbe und Evan's Blue Farbstoff in phosphatgepufferter Kochsalzlösung (PBS) verwendet. Evan's Blue Pulver wurde mit PBS gemischt, bis es undurchsichtig war. Für therapeutische Proof-of-Concept-Studien wurden die folgenden Konzentrationen verwendet: Ibudilast mit 1 mg/ml, Tauroursodeoxycholsäure (TUDCA) 5 mg/ml, Cyclosporin-Injektion mit 250 mg/ml und Anakinra mit 100 mg/0,67 ml. Therapeutische Pulver wurden in 0,9 % bakteriostatischer Kochsalzlösung verdünnt.
- Lassen Sie es abkühlen, bevor Sie fortfahren. Nachdem die Nadel abgekühlt ist, ziehen Sie das gewünschte Therapeutikum auf die gewünschte Menge (4 μl) auf.
- Fassen Sie mit einer feinen Augenzange mit den Zähnen vorsichtig das Skleragewebe am Limbus, um es zu stabilisieren. Um die Iris herum befindet sich ein schwacher roter Ring. Verwenden Sie diesen Ring als Orientierungspunkt, führen Sie die Nadel mit der abgeschrägten Seite nach unten ein und injizieren Sie sie in das hintere Auge.
HINWEIS: Achten Sie darauf, die Nadel in Richtung Netzhaut zu winkeln und die Nadel nur zu 2/3 einzuführen (Abbildung 1). Achten Sie darauf, dass die Nadel die Linse nicht zerkratzt, da dies zur Bildung des Grauen Stars führt. - Nachdem das Therapeutikum injiziert wurde, entfernen Sie langsam die Nadel. Schließen Sie das Auge und halten Sie den Druck mindestens 10-15 s lang, bevor Sie mit Kochsalzlösung spülen.
- Setzen Sie das Tier von Isofluran ab und entfernen Sie es von der Plattform für die Augenchirurgie. Geben Sie einen Tropfen Hypromellose 0,3 % in jedes Auge und lassen Sie das Tier dann auf einem Heizkissen erholen.
2. Retrobulbäre Injektion (RBI)
- Befestigen Sie das Isofluran und die Abfallleitungen an den SALOOT-Befestigungsanschlüssen. Betäuben Sie das Tier mit Standard-Isofluran-Verfahren.
HINWEIS: Wenn das Tier bereits aus einer anderen ophthalmologischen Testsitzung unter Narkose stand (d. h. Ketamin/Xylazin-Mischung; 90 mg/kg Ketamin und 10 mg/kg Xylazin), übertragen Sie das Tier auf die Plattform für ophthalmologische Chirurgie und titrieren Sie die Anästhesie mit Isofluran (3 Sauerstoff: 3 Isofluran-Verhältnis), um sicherzustellen, dass eine ausreichende Anästhesietiefe aufrechterhalten wird. - Platzieren Sie die ophthalmochirurgische Plattform mit dem anästhesierten Tier unter einem lebenden Operationsmikroskop. Beurteilen Sie die Narkosetiefe über den Pedalentzugsreflex.
- Geben Sie ein bis zwei Tropfen 0,5%ige Tetracainhydrochlorid-Augenlösung in das Auge oder die Augen, die operiert werden. Tragen Sie eine befeuchtende topische Augensalbe (Hypromellose 0,3%) auf das kontralaterale Auge auf, wenn keine Manipulation durchgeführt werden soll.
- Verwenden Sie dann ein bis zwei Tropfen 5% Povidon-Jod auf die Augenoberfläche und tragen Sie mit einem Augenspeer Povidon-Jod auf die Haut um das Auge herum auf.
- Besorgen Sie sich eine 0,5-ml-Insulinspritze mit einer 28-g-Nadel. Erstellen Sie das gewünschte Therapeutikum in der gewünschten Menge (100 μL).
HINWEIS: Für Proof-of-Concept-Studien wurden unverdünnte Tätowierfarbe und Evan's Blue Farbstoff in phosphatgepufferter Kochsalzlösung (PBS) verwendet. Evan's Blue Pulver wurde mit PBS gemischt, bis es undurchsichtig war. Für therapeutische Proof-of-Concept-Studien wurden die folgenden Konzentrationen verwendet: Ibudilast mit 10 mg/ml, TUDCA mit 50 mg/ml, Cyclosporin-Injektion mit 250 mg/ml und Anakinra mit 100 mg/0,67 ml. Therapeutische Pulver wurden in 0,9 % bakteriostatischer Kochsalzlösung verdünnt. - Fassen Sie mit einer feinen Augenzange mit Zähnen vorsichtig das untere Augenlid, um es zu stabilisieren. Führen Sie die Nadel mit der abgeschrägten Seite nach unten in einem Winkel auf halber Höhe zwischen 6 und 7 Uhr entlang des unteren Augenhöhlenrandes ein, bis die Rückseite der Augenhöhle zu spüren ist. Ziehen Sie die Nadel leicht zurück und injizieren Sie dann langsam das Therapeutikum (Abbildung 2).
- Entfernen Sie vorsichtig und langsam die Nadel. Schließen Sie dann das Auge und halten Sie den Druck mindestens 10-15 s lang, bevor Sie mit Kochsalzlösung spülen.
- Setzen Sie das Tier von Isofluran ab und entfernen Sie es von der Plattform für die Augenchirurgie. Geben Sie einen Tropfen Hypromellose 0,3 % in jedes Auge und lassen Sie das Tier dann auf einem Heizkissen erholen.
3. Dissektion der Isolierung des Augengewebes
- Nachdem das Tier durch CO2 -Erstickung eingeschläfert wurde oder wie im genehmigten IACUC-Protokoll anders angegeben, legen Sie das Tier in sternale Liege. Verwenden Sie einen quer verlaufenden Hautschnitt über dem dorsalen Hals, der sich bis zur Höhe der Ohrmuschel erstreckt.
- Präparieren Sie die Rückenmuskulatur, um das Atlanto-Occipitalgelenk freizulegen. Verwenden Sie eine Mayo-Schere, um das Atlanto-Hinterhaupts-Gelenk zu durchschneiden und den Kopf vom Körper zu trennen (Abbildung 3). Entfernen Sie mit einer stumpfen Dissektion vorsichtig die Haut vom dorsalen Schädel von der Höhe der Nase bis zum dorsalen Hals, wobei die Haut um beide Augen intakt bleibt.
- Führen Sie ein Paar mittelgerade Hämostaten oder Nadeltreiber in das Foramen magnum an der Schädelbasis ein. Mit den Hämostatika wird der laterale Schädel, der sich vom Foramen magnum bis zur Schläfenregion erstreckt, beidseitig sanft durchbrochen (Abbildung 3).
- Wenn Sie die Oberseite des Schädels entfernen, halten Sie die Hämostaten parallel zur dorsalen Seite des Gehirns. Dadurch wird sichergestellt, dass das Gehirn intakt bleibt und bei der Knochenentfernung nicht eingekerbt wird.
- Reflektieren Sie mit einem flachen Spatel vorsichtig das Gehirn rostral, um die Sehnerven freizulegen. Es muss darauf geachtet werden, dass keine Spannung durch das Gewicht des Gehirns auf die Sehnerven ausgeübt wird.
- Wenn die Nerven freiliegen, nehmen Sie eine mittelgroße Mikroschere und machen Sie einen kleinen Schnitt durch das Chiasma opticum, wodurch beide Nerven vom Gehirn getrennt werden. Zu diesem Zeitpunkt kann das Gehirn verworfen oder für 24 Stunden bei 4 °C in Paraformaldehyd in PBS (4% PFA) zur histologischen Beurteilung gelegt werden.
- Entfernen Sie mit einer kleinen Irisschere und einer gezahnten ophthalmischen Mikrozange vorsichtig das überschüssige Gewebe (z. B. Augenlider, Bindegewebe usw.) aus der Augenpartie. Nach Fertigstellung sollte sich das Auge in der Augenhöhle befinden, aber nur der extraokuläre Muskel und die Drüsen sind noch vorhanden.
- Schneiden Sie mit den Blutstillern in Verbindung mit der kleinen Irisschere durch die Augenhöhle und achten Sie darauf, dass der Sehnerv beim Passieren des Sehkanals nicht eingeschnitten wird. Brechen Sie den Knochen an der Rückseite der Augenhöhle vorsichtig mit den Hämostaten ab und verwenden Sie für eine genauere Kontrolle die kleine Dissektionsschere.
- Nachdem der Knochen entfernt wurde, schneiden Sie mit einer Mikroschere und einer feinen Pinzette vorsichtig um die Augenhöhle herum, um die Fettpolster, Drüsen und extraokularen Muskeln zu entfernen. Achten Sie während dieses Prozesses auf die Sehnerven.
- Das Auge sollte sanft kaudal in Richtung Schädelinnere reflektiert werden können. Entfernen Sie an dieser Stelle mit einer kleinen Mikroschere und einer feinen Pinzette das Bindegewebe, das den Nerv am unteren Schädelkamm umgibt.
- Sobald dieses Gewebe entfernt wurde, sollten das Auge und der gesamte Sehnerv en bloc vom Schädel angehoben werden können. Wiederholen Sie diese Schritte für das kontralaterale Auge und den Nerv.
- Reinigen Sie außerdem den Sehnerv und das Auge von überschüssigem Gewebe wie der Duralscheide. Wenn Gewebe für die histologische Analyse nicht konserviert werden müssen, dann schockfrosten mit Trockeneis oder flüssigem Stickstoff, bevor es bei -80 °C gelagert wird.
- Für die Massenspektrometrie muss die Netzhaut vom inneren Bereich des Globus isoliert werden, und der Sehnerv muss isoliert werden. Trennen Sie den Sehnerv von der Kugel an der nächstgelegenen äußeren Stelle. Legen Sie den Nerv in ein Kryoröhrchen auf Eis, bevor er auf -80 °C übertragen wird.
- Platzieren Sie den Globus des Auges auf einer Petrischale unter einem Operationsmikroskop. Verwenden Sie eine gebogene Pinzette, um das Auge ruhig zu halten, bevor Sie mit einer kleinen Mikroschere einen Schnitt am Limbus vornehmen.
- Verlängern Sie den Schnitt so, dass er den gesamten Umfang des Globus umfasst. Der Globus sollte halbiert werden, und der vordere Teil kann verworfen werden.
- Legen Sie die Innenseite des hinteren Abschnitts nach oben und entfernen Sie mit einer feinen Augenpinzette das dünne cremefarbene Gewebe. Es kann den Anschein haben, dass es an der Papille klebt. Schneiden Sie in diesem Fall mit der Mikroschere die Netzhaut von der Scheibe ab.
HINWEIS: Das Netzhautgewebe kann dann in ein Kryoröhrchen auf Eis gelegt werden, bevor es auf -80 °C übertragen wird. Das Gewebe kann dann zur Auswertung in die Massenspektrometrie überführt werden.
- Für die immunhistologische Färbung mittels Teilperfusion legen Sie das intakte Auge auf eine Petrischale. Verwenden Sie eine gebogene Pinzette, um das Auge ruhig zu halten, bevor Sie eine Insulinspritze mit einer 28-G-Nadel nehmen und sie am Limbus einführen, wobei die Nadel zur Netzhaut hin abgewinkelt ist. Wiederholen Sie diesen Schritt an zwei weiteren Punkten entlang des Limbus. Die Punktion des Globus trägt dazu bei, eine ausreichende Durchblutung zu gewährleisten und hilft bei der richtigen Fixierung.
HINWEIS: Der Globus sollte vor dem Übergang zu einem Schüttler mindestens 40 Minuten lang in 4 % PFA fixiert und weitere 20 Minuten lang mit niedriger Drehzahl gerührt werden, um die Flüssigkeitsbewegung zu erleichtern. - Sobald der Fixierungsschritt abgeschlossen ist, entfernen Sie das PFA und ersetzen Sie es durch PBS. Stellen Sie die Fläschchen 15 Minuten lang auf sanftes Schütteln und wiederholen Sie diesen Schritt für eine zweite 15-minütige PBS-Spülung.
- Nach dem letzten PBS-Spülzyklus das PBS absaugen und durch 30%ige Saccharoselösung in PBS ersetzen und dann 24 Stunden lang in den Kühlschrank stellen. Nach dem Schritt der Saccharose-Inkubation ist das Gewebe für die histologische Beurteilung in die OCT einzubetten26.
Ergebnisse
Vorläufige Pilotversuche wurden an Leichentieren mit Injektionsfarbstoff (Evans Blue Farbstoff) und Tätowierfarbe (Abbildung 2B) durchgeführt, um die Platzierung und Größe der Nadel sowohl für RBI als auch für IVI zu optimieren. Tätowierfarbe war unverdünnt, und dann wurde Evans Blue Pulver in PBS gemischt, bis die Flüssigkeit undurchsichtig wurde. Wir kamen zu dem Schluss, dass die ideale RBI aus einer 28-G-Nadel bestand, die in einem Winkel auf halbem Weg zwischen 6 und 7 Uhr entlang des unteren Orbitalrandes eingeführt wurde, bis die Rückseite der Augenhöhle zu spüren war. Dadurch wurden die Farbstoffe in den hinteren Teil der Augenhöhle in der Nähe des Nervs abgegeben, ohne den Sehnerv zu punktieren. In ähnlicher Weise wurde dieser Pilotversuch mit Leichenfärbung mit der IVI-Injektion durchgeführt, aber es wurde nur Evans Blue Farbstoff verwendet, da die Tätowierfarbe in Verbindung mit der 33 G Nadel zu viskos war. Nachdem die Injektionsprotokolle festgelegt waren, wurden in vivo therapeutische Proof-of-Concept-Studien mit männlichen pigmentierten Long-Evans-Ratten bei 200 g (n = 18) durchgeführt. Darüber hinaus wurden lichtadaptierte visuell evozierte Potentiale (fVEPs) mit männlichen Long-Evans-Ratten (n = 2) durchgeführt, um die RBI-Sicherheit zu bestimmen. Die fVEP-Ausgangswerte wurden aufgezeichnet, und 7 Tage nach der Injektion von Kochsalzlösung (100 μl) in das rechte Auge (OD) wurden erneut fVEPs durchgeführt. Das linke Auge (OS) erhielt keine Injektion. fVEPs wurden nach bereits bestehenden Protokollen durchgeführt, bei denen Signale vor einem Hintergrund von 30 cd/m2 unter Verwendung eines weißen Blitzes (200 cd.s/m2) und eines Interstimulus-Intervalls von 1000 ms26 erhalten wurden. Die fVEP-Amplituden zeigten keine signifikanten Veränderungen zwischen den Augen oder Zeitpunkten (Abbildung 4). Die statistische Analyse wurde unter Verwendung einer zweiwelligen ANOVA mit einem Konfidenzintervall von 95 % durchgeführt. Die mehrfachen Vergleichstests von Tukey wurden in GraphPad Prism durchgeführt, um Gruppeninteraktionenzu bestimmen 26.
Um die Wirksamkeit der okulären therapeutischen Verabreichung zu bestimmen, wurden die folgenden neuroprotektiven Therapeutika von Interesse erhalten: Ibudilast in einer Dosis von 10 mg/ml (RBI) und 1 mg/ml (IVI), Tauroursodeoxycholsäure (TUDCA) 50 mg/ml (RBI) und 5 mg/ml (IVI), Cyclosporin-Injektion 250 mg/ml, Cyclosporin topisch 0,05% und Anakinra 100 mg/0,67 ml. Cyclosporin wurde über RBI (n = 2), IVI (n = 2) und topisch (n = 3) verabreicht. Anakinra, Ibudilast und TUDCA wurden über RBI (n = 2) und IVI (n = 2) verabreicht. Die Medikamente wurden aufgrund ihres Potenzials als neuroprotektive Therapeutika für den Einsatz in einem Rattenmodell der traumatischen Optikusneuropathie ausgewählt. Cyclosporin wurde insbesondere verwendet, da es hochviskos und daher im Vergleich zu anderen Therapeutika schwer zu injizieren war. Das Gewebe wurde 24 Stunden nach der Injektion nach der zuvor genannten Methode entnommen. Die Gewebe wurden mittels Massenspektrometrie (TUDCA, Ibudilast und Cyclosporin) oder proteomischer Analyse (Anakinra) (OSU's Pharmacoanaytic Shared Resource CORE) analysiert. Kontrollnetzhäute und Nerven wurden gesammelt und mittels Massenspektrometrie und Proteomanalyse bewertet. Die therapeutisch behandelten Proben wurden dann bewertet und mit Kontrollen verglichen, um die relativen Konzentrationen des Medikaments zu bestimmen, die in jedem der interessierenden Gewebe gefunden wurden. Anakinra RBI-Proben wurden aus der Analyse entfernt, da die Tiere während der Injektion selbst unter tiefer Narkose zusammenzuckten. Aufgrund dieser Schmerzreaktion ist die Verabreichung von RBI Anakinra möglicherweise kein optimaler therapeutischer Ansatz.
Cyclosporin wurde 24 Stunden später sowohl in der Netzhaut als auch im Sehnerv über beide Injektionsmechanismen nachgewiesen; Die topische Verabreichung wurde jedoch bei keinem der Gewebetypen nachgewiesen. In der IV-Injektionsgruppe hatte die Netzhaut eine Konzentration von 383 ppb und der Sehnerv <5 ppb. Bei der RB-Injektion wurden 16 ppb in der Netzhaut und 49 ppb im Sehnerv beobachtet (Tabelle 1). TUDCA wurde weder in der Netzhaut noch im Sehnerv 24 h nach der Injektion für beide Injektionswege nachgewiesen. Ibudilast wurde nur bei einem Tier nach RB-Injektion im Sehnervengewebe nachgewiesen (<5 ppb). Die therapeutische Pilot-Injektionsstudie zeigte, dass beide Injektionsprotokolle in der Lage sind, Medikamente an die Netzhaut und den Sehnerv zu verabreichen, was durch das Vorhandensein von Cyclosporin in beiden Gewebetypen nach beiden Injektionsmethoden belegt wird. Diese Studie zeigt auch, dass Cyclosporin hohe Konzentrationen in den Zielgeweben von Interesse ergab. Eine Hypothese besagt, dass Ibudilast und TUDCA die Netzhaut und den Sehnerv erreicht haben könnten, aber ihre Halbwertszeit im okulären Milieu zu kurz gewesen sein könnte, um 24 Stunden nach der Injektion nachgewiesen zu werden. Es kann sein, dass die Medikamente zu diesem Zeitpunkt eine neuroprotektive Wirkung haben; Es wären jedoch weitere Studien erforderlich, um die Pharmakokinetik dieser Arzneimittel sowohl im internen (IVI) als auch im extraokulären (RBI) Bereich zu bestätigen.
Diese Pilotstudie unterstützte auch das Protokoll der Isolierung des Augengewebes durch die erfolgreiche Entfernung des gesamten Sehnervs und der Augen. Netzhäute und Sehnerven wurden erfolgreich für die Analyse in der Pilotstudie zur therapeutischen Verabreichung gewonnen (Tabelle 1). Darüber hinaus konnten durch die Verwendung dieser Isolationsdissektion des Augengewebes Augen und Sehnerven en bloc für die Immunhistochemie entnommen werden (Abbildung 5). En-bloc-Proben wurden von zwei männlichen Sprague-Dawley-Ratten entnommen, wie oben beschrieben. Die Proben wurden in OCT eingebettet und auf einem Kryostaten mit einer Dicke von 10 μm in Längsrichtung geschnitten. Die Proben wurden in PBS inkubiert, um das OCT zu entfernen, und dann in 1:20 normalem Eselsserum in PBS plus Triton-X-100 (PBT) bei Raumtemperatur für 2 Stunden inkubiert. Die Schnitte wurden dann mit den folgenden Antikörpern inkubiert: Anti-β-Tubulin (1:1000; MAB5564; Millipore, Burlington, MA) und saures Protein (GFAP; 1:50; Nr. Z0334; DAKO, Santa Clara, CA) in PBT über Nacht bei 4 °C, gespült mit PBS und inkubiert in Esel-Anti-Maus Alexa 488 und Esel-Anti-Kaninchen Alexa 594 (1:200) in PBT über Nacht bei 4 °C. Die Profile wurden gespült und in ein Einbettmedium plus DAPI montiert. Die Proben wurden auf einem Weitfeld-Fluoreszenzmikroskop oder einem Konfokalmikroskop unter Verwendung konsistenter Einstellungenabgebildet 26. Der intakte Sehnervenkopf konnte sichtbar gemacht werden (Abbildung 5A,B) und erfolgreich auf die folgenden Marker von Interesse gefärbt werden: β-Tubulin (grün), saures Gliafibrilläres Protein (GFAP; rot) und nukleärer Marker DAPI (blau). Diese Dissektionsmethode ermöglichte die Gewinnung vollständiger Sehnervenproben, wie in Abbildung 5C zu sehen ist.
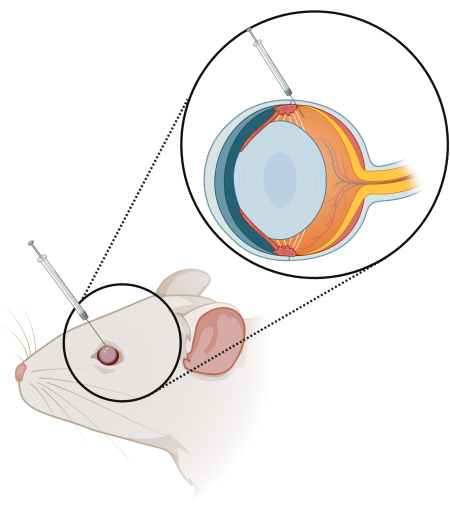
Abbildung 1: Schematische Darstellung der intravitrealen (IV) Injektionstechnik. Eine 10-μl-Spritze mit einer 33-G-Nadel mit einer Länge von 10 mm und einem Winkel von 15 Grad wird zu 2/3 in das Auge am Limbus eingeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
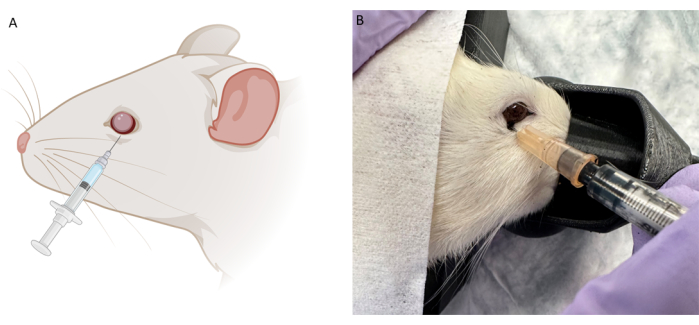
Abbildung 2: Schematische und repräsentative Darstellung der retrobulbären (RB) Injektionstechnik. (A) Schematische Darstellung der RB-Injektion. Eine 0,5 mL Insulinspritze mit einer 28 G Nadel wird entlang des unteren Augenhöhlenrandes in einem Winkel zwischen 6 und 7 Uhr eingeführt. Die Nadel wird vorgeschoben, bis die Rückseite der Augenhöhle ertastet wird, und dann vor der Injektion leicht zurückgezogen. (B) Repräsentatives Bild der RB-Injektionstechnik mit derselben Nadel mit schwarzer Tätowierfarbe während der Pilotversuche. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
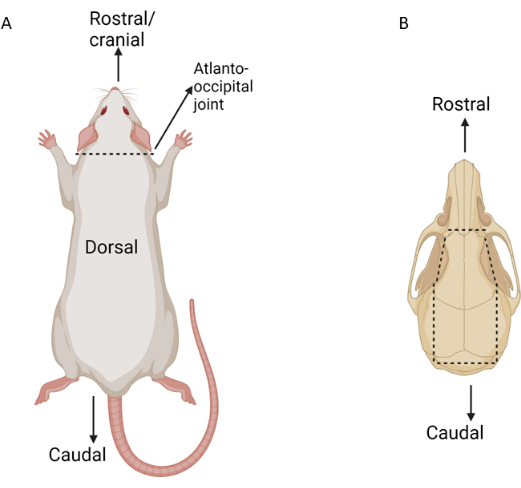
Abbildung 3: Schematische Darstellung der wichtigsten Dissektionspunkte während der Isolierung des Augengewebes. Die gestrichelten Linien zeigen Schnittpunkte an. (A) Ratte dorsal mit ausgeprägtem Atlanto-Occipitalgelenk. (B) Rattenschädel dorsal mit wichtigen Schnittspuren versehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
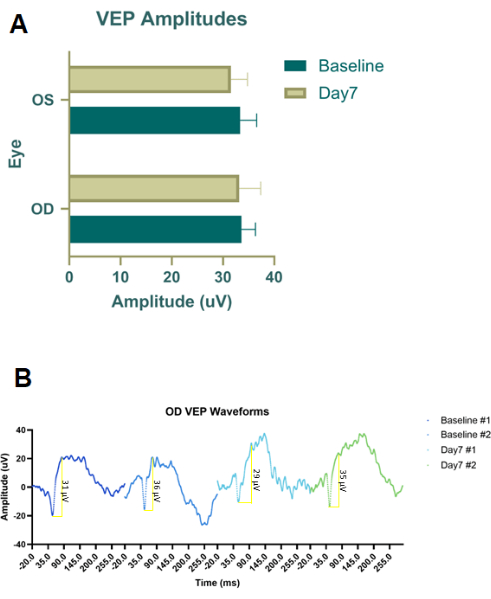
Abbildung 4: Visuell evozierte Flash-Potentiale (fVEPs) von mit RBI-Kochsalzlösung behandelten Kohorten. (A) Gemittelte fVEP-Amplituden von mit Kochsalzlösung RBI-behandelten rechten Augen (OD) und Kontroll-/unbehandelten linken Augen (OS). Es wurden keine signifikanten Unterschiede in der Amplitude der fVEP-Wellenformen zwischen Gruppen oder zwischen den Augen festgestellt. (B) Rechte Augen (OD) fVEP-Wellenformen von mit Kochsalzlösung behandelten Augen RBI zu Studienbeginn und dann sieben Tage nach der Injektion (n = 2 Tierproben). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Epifluoreszierende Mikroaufnahmen des Sehnervenkopfes (A,B) und der En-bloc-Augenprobe (C) von Nagetieren, die nach der Isolierung des Augengewebes entnommen wurden. (A,B) Intakte Sehnervenköpfe wurden von den Tieren entnommen und mit Markern für β-Tubulin (grün), Gliafibrilläres saures Protein (GFAP; rot) und Kernmarker DAPI (blau) bei 20-facher Vergrößerung gefärbt. (C) En-bloc-Augenprobe, die den intakten Globus und den vollständigen Sehnerv zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Agent | Route | Netzhaut | Sehnerv |
| Cyclosporin | IVI | 383 | <5 |
| Cyclosporin | RBI | 16 | 49 |
| Cyclosporin | Aktuell | ND | ND |
| TUDCA | IVI | ND | ND |
| TUDCA | RBI | ND | ND |
| Ibudilast | IVI | ND | ND |
| Ibudilast | RBI | ND | <5 |
| Anakinra | IVI | D | ND |
| Anakinra | RBI | NA | NA |
| ND: Nicht erkannt | |||
| D: Nachgewiesen, aber nicht quantifizierbar | |||
| NA: Nicht verfügbar | |||
Tabelle 1: Therapeutische Pilotinjektionen. Die folgenden Therapeutika wurden auf ihr Vorhandensein in der Netzhaut und im Sehnerv 24 Stunden nach der Verabreichung untersucht: Cyclosporin (topisch, IVI, RB), TUDCA (RB und IVI), Ibudilast (RB und IVI) und Anakinra (RB und IVI). Cyclosporin wurde sowohl in der Netzhaut als auch im Sehnerv nach beiden Injektionswegen nachgewiesen, was darauf hindeutet, dass unsere RB- und IV-Injektionsprotokolle in der Lage sind, das okuläre Medikament an die Netzhaut und den Sehnerv zu verabreichen.
Diskussion
Die komplizierten Herausforderungen, die mit der Verabreichung von Therapeutika an die Netzhaut und den Sehnerv verbunden sind, vor allem aufgrund der undurchlässigen Barriere, die von der BRB ausgeht, unterstreichen die Bedeutung dieser Studie 3,4. Die Erforschung von IVI- und RBI-Techniken zeigt nicht nur innovative Ansätze zur Überwindung dieser Hindernisse auf, sondern unterstreicht auch die breiteren Auswirkungen auf die Augenversorgung und die therapeutische Entwicklung. Diese Ergebnisse zeigen, dass sowohl IVI als auch RBI eine gezielte Verabreichung von Therapeutika direkt an das betroffene Augengewebe ermöglichen können. Dieser zielgerichtete Ansatz ist von entscheidender Bedeutung, um therapeutische Konzentrationen zu erreichen, die durch systemische oder topische Verabreichungswege oft nicht erreichbar sind 2,11, wodurch die Wirksamkeit von Behandlungen für verschiedene Augenerkrankungen verbessert wird.
Die vergleichende Analyse dieser Injektionstechniken zeigt ihre einzigartigen Vorteile: IVI bietet direkten Zugang zu den Glaskörper- und inneren Netzhautschichten27, während RBI eine Diffusion zum Sehnerv ermöglicht, ohne die Integrität des BRB zu beeinträchtigen28. Diese Erkenntnisse tragen zu einem differenzierteren Verständnis darüber bei, wie bestimmte Therapeutika am besten verabreicht werden können, um letztendlich die Behandlungsergebnisse für Patienten mit Augenerkrankungen zu verbessern. Die hier beschriebenen IVI- und RBI-Verabreichungsmethoden lieferten erfolgreich Therapeutika wie Cyclosporin an kritische Gewebe, was das Potenzial für die Entwicklung wirksamer Augentherapien unterstreicht.
Darüber hinaus wurde durch diesen Entwicklungsprozess der therapeutischen Methode inhalatives Isofluran als Sedierungsmethode für dieses RBI- und IVI-Protokoll ausgewählt, da es sowohl bei der Aktivierung als auch bei der Genesung schnell wirkt. Der SALOOT bietet dem Nagetier entscheidende Unterstützung und Stabilisierung und ermöglicht gleichzeitig eine gleichmäßige Rate des Inhalationsanästhetikums. Wie bereits erwähnt, umfassen einige Risiken im Zusammenhang mit RBI mögliche Schäden am Auge durch das Einführen der Blindnadel sowie eine Blutflussblockade oder einen Trachealkollaps aufgrund der Drucktechnik, die im retrobulbären Injektionsprotokoll für Mäuse beschrieben ist23. Um diese Risiken zu mindern, wird bei diesem Protokoll eine Augenzange verwendet, um das untere Lid des Tieres zur Stabilisierung zu greifen, wodurch auf die Drucktechnik verzichtet wird und entweder eine Durchblutungsblockade oder ein Trachealkollaps vermieden wird. Diese Technik ermöglicht auch eine bessere Kontrolle über das Tier, während die Nadel eingeführt wird. Die Verwendung einer Pinzette in Kombination mit dem Einsatz des Live-Operationsmikroskops trägt dazu bei, das Risiko eines blinden Einführens zu minimieren und dem Bediener eine bessere Visualisierung der Nadelposition zu ermöglichen. Darüber hinaus bietet die Operationsplattform eine wichtige Kopfstütze, die verhindert, dass sich der Schädel während des Einführens der Nadel bewegt. Die Operationsplattform bietet auch eine Anhebung des Kopfes in Bezug auf den Rest des Körpers, was es ermöglicht, den Kopf in einer waagerechteren Position zu halten, und da die Plattform über Isofluran- und Sauerstoffanschlüsse verfügt, wird das Anästhesieniveau während der Positionierung nie beeinträchtigt. Die IVI-Technik wurde wegen ihrer einzigartigen Fähigkeit übernommen, die BRB zu umgehen, indem Therapeutika direkt in den Glaskörper injiziert werden. Die Technik birgt aufgrund ihres invasiven Charakters die Möglichkeit von Augenschäden, aber das Risiko wird minimiert, indem sorgfältig darauf geachtet wird, dass die Nadel nicht die Linse zerkratzt, die Nadel langsam entfernt und 10-15 Sekunden nach der Injektion Druck auf das Auge ausgeübt wird.
Die erfolgreiche Entnahme und Analyse von en bloc Proben der Netzhaut und des Sehnervs war durch diese einzigartige Gewebegewinnungsmethode möglich. Es wurde eine Isolierung des Auges und des Nervs en bloc erreicht, was dazu beiträgt, das gesamte visuelle System beurteilen zu können, wie die Immunfluoreszenzfärbung des Sehnervenkopfes und des gesamten Auges zeigt (Abbildung 5). Diese Methode ermöglicht eine Top-Down-Visualisierung des Gehirns, der Sehnerven und der Kugeln, was eine einfachere Erhaltung der Gesamtstruktur und Integrität unseres Gewebes ermöglicht.
Diese Studie hat potenzielle Einschränkungen, einschließlich der Verwendung von nur einem Tiergeschlecht und einer relativ kleinen Stichprobengröße. RB-Injektionen sind auch mit der inhärenten Begrenzung des therapeutischen Lecks verbunden. Nach der RB-Injektion können Therapeutika aus dem retrobulbären Raum an die Vorderseite des Globus wandern. Diese Technik zielte darauf ab, diese inhärente Einschränkung zu minimieren, indem der Einstichwinkel geändert und die Nadel so nah wie möglich an der Rückseite der Orbita gehalten wurde. Darüber hinaus wurde festgestellt, dass die Aufrechterhaltung des Lichtdrucks nach therapeutischer Verabreichung für 10-15 s dazu beitrug, die Therapeutika daran zu hindern, aus dem retrobulbären Raum zu migrieren.
Diese Methoden werden in zukünftigen Arbeiten zur therapeutischen Intervention in einem Modell für traumatische Augenverletzungen bei Kleintieren eingesetzt. Die IVI-Methoden wurden für den Einsatz bei Küken und Mäusen erweitert; Die Nadelgröße und das therapeutische Volumen müssen jedoch angepasst werden. Für Küken erwiesen sich eine 28-29 g Insulinnadel und 20 μl therapeutisches Volumen als optimal29, aber bei Mäusen wurde festgestellt, dass eine 31 g Nadel und 2 μl therapeutisches Volumen ideal waren. Die IVI-Technik änderte sich mit der Translation auf andere Tiere minimal. Für die Übertragung des RBI auf andere Spezies müssten die Nadelgröße und das Volumen angepasst werden, aber die Gesamttechnik sollte translatierbar bleiben, solange inhärente anatomische Unterschiede zwischen den Spezies berücksichtigt werden.
Die Erkenntnisse aus Kleintiermodellen sind von unschätzbarem Wert, um das Verständnis der Mechanismen der Arzneimittelverabreichung zu verbessern und Behandlungsprotokolle zu optimieren. Letztendlich legt diese Forschung den Grundstein für wirksamere Therapien, die die Qualität der optischen Versorgung erheblich verbessern und Fortschritte bei der Erhaltung des Sehvermögens und der Verbesserung der Ergebnisse in der klinischen Praxis machen könnten.
Offenlegungen
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Arbeit wurde teilweise durch die Vision Research Program Awards W81XWH-15-1-0074 und W81XWH-22-1-0989 des US-Verteidigungsministeriums finanziert. Die hierin enthaltenen Meinungen oder Behauptungen sind die privaten Ansichten der Autoren und sind nicht als offiziell auszulegen oder als Ausdruck der Ansichten des Armeeministeriums oder des Verteidigungsministeriums auszulegen. Dieses Forschungsstipendium wurde teilweise von der Ohio Affiliate of Prevent Blindness Young Investigator Student Fellowship Award for Females Scholars in Vision Research unterstützt. Wir danken der Ross Foundation für die Unterstützung. Die Dienstleistungen wurden im Rahmen des OSU Vision Sciences Research Core Program im Rahmen von P30EY032857 erbracht. Wir möchten uns bei The Ohio State University Laboratory and Animal Resources (ULAR) bedanken. Darüber hinaus möchten wir uns bei den Reilly-Labormitgliedern Michelle Mosko, Emma Lally, Sam Duckworth und Eve Howard bedanken. Wir möchten uns auch bei Bongsu Kim für ihren Beitrag zum SALOOT-Design sowie bei Elizabeth Urbanski und Ryan Webb bedanken. Abbildung 1, Abbildung 2A und Abbildung 3 wurden mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
Referenzen
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten