Method Article
التوصيل العلاجي للعين واسترجاع الأنسجة المتقدم في الفئران البالغة
In This Article
Summary
تقدم هذه الدراسة منهجية لتوصيل العلاجات إلى شبكية العين والأعصاب البصرية للفئران البالغة. بالإضافة إلى ذلك ، يتم تقديم طريقة فريدة لاسترجاع الأنسجة لمجموعة من أعلى إلى أسفل من العصب البصري وشبكية العين في الفئران البالغة.
Abstract
إن التوصيل العلاجي إلى الجزء الخلفي من العين ، بما في ذلك شبكية العين والعصب البصري ، معقد بسبب وجود حواجز دموية في الدماغ والدم والشبكية. تستخدم نماذج الصغيرة ، مثل الفئران ، لدراسة أمراض العين المختلفة. في حين أن التوصيل العلاجي للعين الخلفية يمثل تحديا ، إلا أن تحقيقه ضروري لعلاج اضطرابات العين ، والتي يتطلب الكثير منها التحقق من الصحة في نماذج الصغيرة من أجل الأهمية الانتقالية. لذلك ، يتم تقديم تقنيتين للتوصيل العلاجي الخلفي: الحقن داخل الجسم الزجاجي (IVI) والحقن خلف البصيلة (RBI) للاستخدام في الفئران البالغة. بالإضافة إلى ذلك ، يتم تقديم طريقة لإزالة الكتلة المختلطة للعيون والأعصاب البصرية لمختلف تقنيات التحليل النسيجي والجزيئي. يتيح بروتوكول التشريح المراقبة الكاملة للنظام العصبي البصري مع تقليل إصابة ما بعد الوفاة لأنسجة الشبكية والعصب البصري. تم تحقيق التوصيل الناجح للسيكلوسبورين العلاجي إلى شبكية العين والعصب البصري ، مع ملاحظة تركيزات يمكن اكتشافها بعد أربع وعشرين ساعة من الحقن باستخدام كل من IVI و RBI. علاوة على ذلك ، تم استخراج عينات الشبكية والأعصاب بنجاح لتحليل الأنسجة النسيجية للعين بالكامل ، مما يسهل المراقبة الشاملة لشبكية العين والنظام العصبي البصري الأوسع.
Introduction
يعد توصيل العلاجات إلى شبكية العين والعصب البصري أمرا صعبا للغاية بسبب التشريح المعقد للعين1،2 ، وتحديدا وجود حاجز الدم والشبكية (BRB) 3،4،5. يعمل BRB على حماية شبكية العين من غزو الدورة الدموية الجهازية ، ولكنه يمثل معارضا صعبا للإدارة العلاجية حيث غالبا ما يتم حظر الدورة العلاجية الجهازية بواسطة BRB6،7. يمكن أن تنتشر الجزيئات الصغيرة المحبة للدهون بسهولة من خلال BRB ، لكن الجزيئات الأكبر والمحبة للماء تواجه صعوبة في الوصول إلى شبكيةالعين 6. تتيح الحقن داخل الجسم الزجاجي (IVI) وخلف البصيلة (RBI) توصيل الأدوية إلى أنسجة العين ، والتغلب على القيود التي يفرضها BRB. يعمل IVI كحل وسط واعد من خلال إعطاء العلاجات في البيئة الداخلية للعين8،9. تتطلب هذه الطريقة عبور الدواء عبر الجسم الزجاجي ، وبالتالي تجاوز BRB ، والانتشار عبر شبكية العين والمشيمية من أجل الوصول إلى العصب البصري7. يتم تسليم بنك الاحتياطي الهندي خلف العين في الفضاء retrobulbar10. يمكن تقديم العلاجات عن طريق الانتشار عبر الأنسجة والغدد في الفضاء خلف البصلي ، مما يؤثر على العصب البصري والهياكل المحيطة به دون الدخول مباشرة إلى شبكية العين ، مما يحافظ على سلامة BRB. من خلال توصيل الأدوية مباشرة أو غير مباشرة إلى العين ، يمكن لكل من الحقن داخل الجسم الزجاجي وخلف البصيلة تحقيق تركيزات موضعية أعلى من الدواء العلاجي ، مما يعزز فعاليته مقارنة بالإعطاء الموضعي أو الجهازي (عن طريق الفم أو الوريد)2. هذا مهم بشكل خاص للعلاجات التي تتطلب عملا سريعا أو فاعلية عالية ، كما هو موضح في العديد من أمراض العين. يحد التسليم المستهدف أيضا من تعرض بقية الجسم للدواء ، مما يقلل من خطر الآثار غير المستهدفة ويساعد على تقليل الآثار الضارة المحتملة التي يمكن أن تحدث عند إعطاء الأدوية موضعيا أو شفويا أو عن طريق الوريد11.
الحقن الأخرى حول العين ، مثل تحت الملتحمة ، والوتر الخلفي ، وتحت الشبكية ، لها فوائدها وقيودهاالخاصة 2،5. وقد لوحظ أن حقن subtenon الخلفي لتقديم تركيزات عالية من المخدرات إلى أنسجة العين; ومع ذلك ، فإن حقن subtenon أقرب إلى الصلبة من الأوعية الدموية المدارية5،12. في المقابل ، يضع RBI العلاج بالقرب من العصب البصري من الوتر السفلي الخلفي أو تحتالملتحمة 13. قد يعني هذا أن أمراض العصب البصري تفضل العلاجات التي يقدمها RBI على أنواع الحقن الأخرى حول العين. الحقن السفلية الخلفية لها مخاطر مرتبطة ، بما في ذلك الحول والخيمة وارتفاع ضغط العين5. يعد ارتفاع ضغط العين أيضا عامل خطر تم الإبلاغ عنه في حقن IVI وتحت الملتحمة وتحت الشبكية2. غالبا ما تتطلب أنواع الحقن هذه جرعات متكررة من أجل تحقيق التأثير العلاجي المطلوب2. تشمل عوامل الخطر الأخرى المرتبطة بالحقن تحت الشبكية والحقن تحت الملتحمة و IVI تكوين إعتام عدسة العين ونزيف الشبكية وانفصال الشبكية والالتهاب2. تعتبر حقن IVI وتحت الشبكية والحقن تحت الملتحمة أكثر توغلا من حقن RBI ، حيث أن هذه الحقن تتم داخل العين2. يمكن اعتبار RBI أقل توغلا لأنه يضع العلاج في الفضاء خلف البصيلة ، دون إدخال الإبرة مباشرة في كرة العين. استراتيجيات التوصيل العلاجي الأخرى الأقل توغلا ، مثل الإعطاء الموضعي ، لا ترقى إلى مستوى توصيل الدواء الكافي ، حيث يتم الاحتفاظ بأقل من 5٪ من الدواء على سطح العين2،5.
IVI هي تقنية بارزة في النماذج قبل السريرية تستخدم لقدرتها على توصيل العوامل العلاجية مباشرة إلى الجزء الخلفي من العين. يقوم IVI بتوصيل الدواء مباشرة إلى الخلط الزجاجي ، مما يجعله تقنية توصيل مفضلة للعلاج الموضعي14. تسمح تقنية IVI للعلاج بتجاوز حاجز الشبكية الدموي ، وهو عائق شائع أمام اختراق الدواء في شبكيةالعين 14. يقدم IVI فرصة للالتهاب وتلف هياكل العين ، لذلك يجب استخدام الالتزام الدقيق بالإجراء14. لتقليل انفصال الشبكية وتكوين إعتام عدسة العين ، Chiu et al. يصف نهج IVI الذي يؤكد على إدخال وحقن شطبة بزاوية 45 درجة على مستوى المستوى المسطح ، وتجنب العدسة وشبكية العين وعضلات العين والأوعيةالدموية 15. في هذه التقنية ، يتم إدخال إبرة 30 جم في صلبة الأنف للتوصيل العلاجي15. لا يزال IVI مرتبطا بالمخاطر بسبب طبيعته الغازية. تشمل المخاطر المحتملة انفصال الشبكية أو تكوين إعتام عدسة العين أو التهاب باطن المقلة أو النزيف16. تزيد الطبيعة الغازية لتقنيات IVI أيضا من ضغط العين ، كما هو موضح في تجربة أجراها Ikjong Park et al.16 على عيون الخنازير. تظهر الدراسة تغيرات في ضغط العين خلال مراحل مختلفة من إدخال الإبرة وحقن السوائل. أبلغوا عن تباين كبير في ضغط العين أثناء الإجراء16.
تم استخدام RBIs بنجاح في الدراسات السابقة كوسيلة للتوصيل العلاجي للقوارض. قارنت إحدى هذه الدراسات تأثيرات نظائر البروستاجلاندين المختلفة المعطاة عبر RBI17. تم إعطاء الفئران البيضاء RBI بإبرة 26 جم من 0.1 مل يتم إدخالها من خلال المنطقة الجانبية للقبوب السفلي بزاوية 45 درجة17. تم تكييف البروتوكول المستخدم في هذه الدراسة من طريقة موصوفة سابقا حيث تم تخدير الفئران عن طريق حقن الكلورالهيدرات18 داخل الصفاق (IP). قارنت دراسة أخرى أجريت على الفئران القطرات الموضعية مع الحقنretrobulbar 19. تم تخدير الفئران عن طريق حقن IP من الكيتامين / الزيلازين ، وتم إعطاء RBI عن طريق إبرة 30 جم19. على عكس طرق التخدير التي تمت مناقشتها سابقا ، استخدمت إحدى الدراسات التي لاحظت تأثيرات RBI على الدهون المدارية الأيزوفلوران الاستنشاقي لتخدير الفئران قبل RBI20. في حين أن هذه الدراسات توفر نظرة ثاقبة حول التخدير ومواصفات الإبرة التي يمكن أن تكون ناجحة ، إلا أن وضع والتعامل معها أثناء العملية لم تتم مناقشتها.
تجري دراسات مختلفة أجريت على الفئران أيضا RBIs لطرق التوصيل العلاجي. قارنت إحدى الدراسات RBI بحقن وريد الذيل الجانبي لإحداث متلازمة كلويةبنجاح 21. قارنت دراسة ثانية أيضا نفس تقنيتي الحقن في إدارة وسائط التباين لتصوير القلب22. تم تخدير الفئران بالأيزوفلوران الاستنشاقي وحقنها في الجانب الإنسي من العين22. قامت كلتا الدراستين بتكييف طريقة RBI الخاصة بهما من بروتوكول مكتوب مسبقا. من المهم ملاحظة أن هذا البروتوكول أطلق على حقنهم اسم الحجنة على أنها مدارية رجعية ولكنه وصف موقع الحقن بأنه الفضاء خلف البصيلة خلف العين. استخدم مؤلفو هذا البروتوكول الأيزوفلوران الاستنشاقي كطريقة تخدير مفضلة ، مشيرين إلى وقت التنشيط السريع والتعافي للفئران23. بالنسبة ل RBI ، كانت العين بارزة جزئيا من التجويف عن طريق الضغط على الجلد حول العين23. بعد ذلك ، تم إدخال الإبرة في الجانب المائل للمكنة الإنسية لأسفل بزاوية 30 درجة وتم إدخالها حتى وصلت إلى قاعدة العين23. يجب توخي الحذر عند الضغط على ، حيث قد يحدث انسداد عرضي لتدفق الدم أو انهيار القصبةالهوائية 23. الحاقن أعمى أيضا عن طرف الإبرة عند إدخاله ، وبالتالي فإن إتلاف العين يمثل خطرا مرتبطا به. 23 يعد إلحاق الضرر بالعين عند الإعطاء العلاجي خطرا بالغ الأهمية في هذه التجربة ، لأن التسبب في إصابة إضافية يقوض نتائج الدراسة بشكل مباشر. وتجدر الإشارة أيضا إلى أن تقنية تحديد المواقع والمناولة الموصوفة سابقا أجريت على الفئران ولم تتضمن تعليقات على قابلية التطبيق على الفئران.
هناك العديد من الطرق التي تمت من خلالها محاولة إزالة العصب البصري والشبكية. استكشفت إحدى هذه الطرق إزالة الأعصاب البصرية والعينين في كتلة ، مع الحفاظ على chiasm البصريالسليم 24. هذه الطريقة هي الأكثر قابلية للمقارنة مع الدراسة الحالية حيث يتم أيضا الحفاظ على العيون الفردية والأعصاب البصرية لإزالة الكتلة. ومع ذلك ، يتم فصل chiasm البصري. سيكون توخي الحذر في هذا الإجراء ذا أهمية قصوى نظرا لتعقيد الإجراء. في الطريقة الحالية ، نبدأ التشريح عبر الجمجمة الذيلية ونعمل بشكل منحرف من أجل توفير الوصول بطريقة تحد من تلف الأعصاب البصرية وتسمح للعصب بأكمله بالبقاء سليما. علاوة على ذلك ، فإن الحفاظ على العصب سليما ومتصلة بالعين أمر بالغ الأهمية لعملية التضمين ، حيث يمكن أن يتوافق تلف كل جزء من العصب مع ملاحظة مرضية مختلفة24. من المهم مراعاة اتجاه العصب البصري لأن كيفية تضمينه تسمح بمقاطع عرضية مختلفة ، والتي قد تكون مهمة للتحليل النسيجي.
يتكون جهاز مصنوع حسب الطلب يعرف باسم طاولة عمليات العيون في مختبر الصغيرة (SALOOT ، منصة جراحة العيون) من سلسلة من المواد المطبوعة ثلاثية الأبعاد لتوفير التخدير وتثبيت في وضع مستقر للحقن العلاجية للعين. يسمح تصميم SALOOT باستقرار الرأس وهياكل العين لإجراءات طب العيون ، مما يحسن سرعة العمليات وقابليتها للتكرار مع السماح بتوصيل التخدير بالغاز ومسح جزيئات الزفير. SALOOT عبارة عن كتلة مطبوعة ثلاثية الأبعاد تتميز بتخفيض مقعر لتثبيت جسم الفئران بمنطقة أضيق في المقدمة لتثبيت رأس في مخروط الأنف مع مدخل الأيزوفلوران. يوجد تحت مخروط الأنف خزان صغير ومخرج عادم. تم تطوير الطرق التالية لتوصيل العين العلاجي واسترجاع أنسجة العين بدقة. تم تصميمها لدراسة الأنسجة بعد صدمة العين ، لذلك من الأهمية بمكان تحديد آثار الصدمة والحقن والعلاج والتشريح لتجنب التفسير المربك للنتائج.
تقدم هذه المقالة طريقتين للحقن العلاجي للعين ، الحقن داخل الجسم الزجاجي والحقن خلف البصيلة ، للاستخدام في الفئران البالغة. بالإضافة إلى ذلك ، يتم تقديم طريقة استرجاع الأنسجة لإزالة العصب البصري السليم وشبكية العين من فأر بالغ. تتيح هذه التقنيات التحقيق في آثار العين وحول العين لعلم الأمراض والعلاج المستحث.
Protocol
أجريت جميع التجارب وفقا لبيان ARVO لاستخدام في أبحاث طب العيون والبصرية وتمت الموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدامها في جامعة ولاية أوهايو. ذكور Sprague Dawley الفئران التي تزن ~ 200 غرام وحوالي شهرين من العمر تم استخدامها لهذه الدراسة25. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. الحقن داخل الجسم الزجاجي (IVI)
- قم بتوصيل الأيزوفلوران ويؤدي النفايات إلى منافذ تثبيت SALOOT. تخدير باستخدام إجراءات الأيزوفلوران القياسية باتباع بيان ARVO لاستخدام في أبحاث العيون والبصر وبروتوكول IACUC المعتمد.
ملاحظة: بدلا من ذلك ، إذا كان بالفعل تحت التخدير من جلسة اختبار أخرى للعيون (على سبيل المثال ، مزيج الكيتامين / الزيلازين ؛ 90 مجم / كجم من الكيتامين و 10 مجم / كجم زيلازين) ، انقل إلى منصة جراحة العيون وقم بمعايرة التخدير بالأيزوفلوران (نسبة 3 أكسجين: 3 إيزوفلوران) لضمان الحفاظ على عمق التخدير الكافي. - ضع منصة جراحة العيون مع المخدر تحت مجهر التشغيل الحي. تقييم عمق التخدير عن طريق منعكس سحب الدواسة.
- ضع قطرة أو قطرتين من محلول العيون 0.5٪ رباعي الكلائين هيدروكلوريد في العين أو العينين اللواتي يتم إجراء عملية جراحية. ضع مرهم العين الموضعي المزلق مثل الهيبروميلوز 0.3٪ على العين المقابلة إذا لم يتم إجراء أي تلاعب.
- بعد ذلك ، استخدم قطرة أو قطرتين من 5٪ بوفيدون اليود على سطح العين ، وباستخدام قطعة قطن ، ضع بوفيدون اليود على الجلد المحيط بالعين.
- استخدم حقنة سعة 10 ميكرولتر بإبرة 33 جم بطرف نمط 4 بطول 10 مم وزاوية 15 درجة واسحب 0.9٪ كلوريد الصوديوم المضاد للجراثيم. اغسل المحقنة والإبرة بالمحلول الملحي قبل غمس الإبرة في معقم الخرز الساخن.
- اتركه ليبرد قبل المتابعة. بعد أن تبرد الإبرة ، قم بوضع العلاج ذي الأهمية إلى الكمية المطلوبة (4 ميكرولتر).
ملاحظة: لإثبات دراسات المفهوم ، تم استخدام حبر الوشم غير المخفف وصبغة إيفان الزرقاء في محلول ملحي مخزن بالفوسفات (PBS). تم خلط مسحوق إيفان الأزرق مع PBS حتى يصبح معتما. لدراسات الإثبات العلاجي للمفهوم ، تم استخدام التركيزات التالية: ibudilast عند 1 مجم / مل ، حمض tauroursodeoxycholic (TUDCA) 5 مجم / مل ، حقن السيكلوسبورين ، 250 مجم / مل ، وأناكينرا 100 مجم / 0.67 مل. تم تخفيف المساحيق العلاجية في محلول ملحي مضاد للجراثيم بنسبة 0.9٪.
- اتركه ليبرد قبل المتابعة. بعد أن تبرد الإبرة ، قم بوضع العلاج ذي الأهمية إلى الكمية المطلوبة (4 ميكرولتر).
- باستخدام ملقط العين الناعم مع الأسنان ، أمسك الأنسجة الصلبة برفق في الأطراف لتحقيق الاستقرار. سيكون هناك حلقة حمراء باهتة حول القزحية. استخدم هذه الحلقة كمعلم ، وأدخل الإبرة ، والجانب المائل لأسفل ، وحقنها في العين الخلفية.
ملاحظة: تأكد من توجيه الإبرة نحو شبكية العين وأدخل الإبرة فقط 2/3 من الطريق (الشكل 1). تأكد من أن الإبرة لا تخدش العدسة ، لأن ذلك سيؤدي إلى تكوين إعتام عدسة العين. - بعد حقن العلاج ، قم بإزالة الإبرة ببطء. أغلق العين واستمر في الضغط لمدة 10-15 ثانية على الأقل قبل التنظيف بالمحلول الملحي.
- توقف عن تناول من الأيزوفلوران وإزالته من منصة جراحة العيون. ضع قطرة من hypromellose 0.3٪ في كل عين ثم اسمح للحيوان بالتعافي على وسادة تدفئة.
2. حقن Retrobulbar (RBI)
- قم بتوصيل الأيزوفلوران ويؤدي النفايات إلى منافذ تثبيت SALOOT. تخدير باستخدام إجراءات الأيزوفلوران القياسية.
ملاحظة: بدلا من ذلك ، إذا كان بالفعل تحت التخدير من جلسة اختبار أخرى للعيون (على سبيل المثال ، مزيج الكيتامين / الزيلازين ؛ 90 مجم / كجم من الكيتامين و 10 مجم / كجم زيلازين) ، انقل إلى منصة جراحة العيون وقم بمعايرة التخدير بالأيزوفلوران (نسبة 3 أكسجين: 3 إيزوفلوران) لضمان الحفاظ على عمق التخدير الكافي. - ضع منصة جراحة العيون مع المخدر تحت مجهر التشغيل الحي. تقييم عمق التخدير عن طريق منعكس سحب الدواسة.
- ضع قطرة أو قطرتين من محلول العيون 0.5٪ رباعي الكلائين هيدروكلوريد في العين أو العينين اللواتي يتم إجراء عملية جراحية. ضع مرهم العين الموضعي المزلق (هيبروميلوز 0.3٪) على العين المقابلة إذا لم يتم إجراء أي تلاعب.
- بعد ذلك ، استخدم قطرة إلى قطرتين من 5٪ من بوفيدون اليود على سطح العين وباستخدام رمح العين ، ضع بوفيدون اليود على الجلد المحيط بالعين.
- احصل على حقنة أنسولين 0.5 مل بإبرة 28 جرام. ضع العلاج المطلوب للكمية المطلوبة (100 ميكرولتر).
ملاحظة: لإثبات دراسات المفهوم ، تم استخدام حبر الوشم غير المخفف وصبغة إيفان الزرقاء في محلول ملحي مخزن بالفوسفات (PBS). تم خلط مسحوق إيفان الأزرق مع PBS حتى يصبح معتما. لدراسات الإثبات العلاجي للمفهوم ، تم استخدام التركيزات التالية: ibudilast عند 10 مجم / مل ، TUDCA عند 50 مجم / مل ، حقن السيكلوسبورين 250 مجم / مل ، وأناكينرا عند 100 مجم / 0.67 مل. تم تخفيف المساحيق العلاجية في محلول ملحي مضاد للجراثيم بنسبة 0.9٪. - باستخدام ملقط العين الناعم مع الأسنان ، أمسك الجفن السفلي برفق لتحقيق الاستقرار. أدخل الإبرة، بحيث يكون الجانب المائل لأسفل، بزاوية منتصف الطريق بين الساعة 6 و7 على طول الحافة المدارية السفلية حتى يتم الشعور بالجزء الخلفي من تجويف العين. اسحب الإبرة للخلف قليلا ثم حقن العلاج ببطء (الشكل 2).
- قم بإزالة الإبرة برفق وببطء. ثم أغلق العين واستمر في الضغط لمدة 10-15 ثانية على الأقل قبل التنظيف بالمحلول الملحي.
- توقف عن تناول من الأيزوفلوران وإزالته من منصة جراحة العيون. ضع قطرة من hypromellose 0.3٪ في كل عين ثم اسمح للحيوان بالتعافي على وسادة تدفئة.
3. تشريح عزل أنسجة العين
- بعد القتل الرحيم للحيوان عن طريق اختناق ثاني أكسيد الكربون2 أو كما هو مذكور في بروتوكول IACUC المعتمد ، ضع في الاستلقاء القصي. استخدم شقا عرضيا في الجلد فوق الرقبة الظهرية ، ويمتد إلى مستوى صيوان الأذن.
- تشريح العضلات الظهرية لفضح المفصل الأطلسي القذالي. استخدم مقص المايونيز لشق المفصل القذالي الأطلسي ، وفصل الرأس عن الجسم (الشكل 3). باستخدام تشريح حاد ، قم بإزالة الجلد برفق من الجمجمة الظهرية من مستوى الأنف إلى الرقبة الظهرية ، مع ترك الجلد حول كلتا العينين سليما.
- أدخل زوجا من مرقئ الدم المستقيم المتوسط أو محركات الإبر في الثقبة الماغنوم عند قاعدة الجمجمة. استخدم المرقئ لاختراق الجمجمة الجانبية الممتدة برفق من الثقبة إلى المنطقة الصدغية على كلا الجانبين (الشكل 3).
- عند إزالة الجزء العلوي من الجمجمة ، حافظ على المرقئ موازيا للجانب الظهري من الدماغ. سيضمن ذلك بقاء الدماغ سليما وعدم تعرضه للكسر في عملية إزالة العظام.
- باستخدام ملعقة مسطحة ، اعكس الدماغ برفق لكشف الأعصاب البصرية. يجب توخي الحذر حتى لا يتم تطبيق التوتر الناتج عن وزن الدماغ على الأعصاب البصرية.
- مع تعرض الأعصاب ، خذ زوجا من المقصات الدقيقة المتوسطة وقم بعمل شق صغير عبر التصلب البصري ، مما يؤدي إلى قطع كلا العصبين عن الدماغ. في هذه المرحلة ، يمكن التخلص من الدماغ أو وضعه في بارافورمالدهيد في PBS (4٪ PFA) لمدة 24 ساعة عند 4 درجات مئوية للتقييم النسيجي.
- باستخدام زوج من مقص القزحية الصغير وزوج من ملقط العين الدقيق المسنن ، قم بإزالة الأنسجة الزائدة بعناية (مثل الجفون والأنسجة الضامة وما إلى ذلك) من حول العين. بمجرد الانتهاء ، يجب وضع العين في تجويف العين ولكن مع بقاء العضلات والغدد خارج العين فقط.
- باستخدام مرقئ الدم جنبا إلى جنب مع مقص القزحية الصغير ، قم بقطع مدار العين ، مع الحرص الشديد على عدم قطع العصب البصري أثناء مروره عبر القناة البصرية. قم بتقطيع العظم الموجود في الجزء الخلفي من تجويف العين بعناية باستخدام مرقئ الدم ، وللتحكم بشكل أكثر دقة ، استخدم مقص التشريح الصغير.
- بعد إزالة العظم ، قم بقص المدار العيني بدقة باستخدام مقص دقيق وملقط دقيق لإزالة الضمادات الدهنية والغدد والعضلات خارج العين. تأكد من مراقبة الأعصاب البصرية أثناء هذه العملية.
- يجب أن تكون العين قادرة على الانعكاس بلطف باتجاه الجزء الداخلي من الجمجمة. في هذه المرحلة ، استخدم مقصا صغيرا وملقطا دقيقا لإزالة النسيج الضام المحيط بالعصب الموجود في حافة الجمجمة السفلية.
- بمجرد إزالة هذا النسيج ، يجب أن تكون العين والعصب البصري الكامل قابلين للرفع من الجمجمة في كتلة. كرر هذه الخطوات للعين والعصب المقابل.
- علاوة على ذلك ، قم بتنظيف العصب البصري والعين من الأنسجة الزائدة مثل غمد الجافية. إذا لم تكن الأنسجة بحاجة إلى الحفاظ عليها للتحليل النسيجي ، فقم بالتجميد السريع باستخدام الثلج الجاف أو النيتروجين السائل قبل تخزينها عند -80 درجة مئوية.
- بالنسبة لقياس الطيف الكتلي ، يجب عزل شبكية العين عن المنطقة الداخلية من الكرة الأرضية ، ويجب عزل العصب البصري. افصل العصب البصري عن الكرة الأرضية عند أقرب نقطة خارجية. ضع العصب في أنبوب التبريد على الجليد قبل نقله إلى -80 درجة مئوية.
- ضع كرة العين على طبق بتري تحت مجهر التشغيل. استخدم زوجا من الملقط المنحني لتثبيت العين قبل إجراء شق في الأطراف باستخدام مقص صغير.
- قم بتمديد القطع ليشمل محيط الكرة الأرضية بالكامل. يجب تقسيم الكرة الأرضية إلى قسمين ، ويمكن التخلص من الجزء الأمامي.
- ضع الجانب الداخلي للجزء الخلفي لأعلى ، وباستخدام زوج من ملاقط العين الدقيقة ، قم بإزالة الأنسجة الرقيقة ذات اللون الكريمي. قد يبدو أنه يلتصق بالقرص البصري. إذا حدث هذا ، استخدم المقص الدقيق لقطع شبكية العين بعيدا عن القرص.
ملاحظة: يمكن بعد ذلك وضع أنسجة الشبكية في أنبوب تبريد على الجليد قبل نقله إلى -80 درجة مئوية. يمكن بعد ذلك نقل الأنسجة إلى منشأة قياس الطيف الكتلي للتقييم.
- لتلوين الأنسجة المناعية باستخدام التروية الجزئية ، ضع العين السليمة على طبق بتري. استخدم زوجا من الملقط المنحني لتثبيت العين قبل أخذ حقنة الأنسولين بإبرة 28 جم وإدخالها في الليمفا، مع وضع الإبرة بزاوية نحو شبكية العين. كرر هذه الخطوة عند نقطتين أخريين على طول الطرف. يساعد ثقب الكرة الأرضية على ضمان التروية الكافية ويساعد في التثبيت المناسب.
ملاحظة: يجب تثبيت الكرة الأرضية بنسبة 4٪ PFA لمدة 40 دقيقة على الأقل قبل الانتقال إلى شاكر والتقليب بسرعة منخفضة لمدة 20 دقيقة إضافية لتسهيل حركة السوائل. - بمجرد اكتمال خطوة التثبيت ، قم بإزالة PFA واستبدله ب PBS. ضع القوارير على رج لطيف لمدة 15 دقيقة ، ثم كرر هذه الخطوة لمدة 15 دقيقة من شطف PBS.
- بعد دورة شطف PBS النهائية ، قم بشفط PBS واستبدله بمحلول سكروز بنسبة 30٪ في PBS ، ثم ضعه في الثلاجة لمدة 24 ساعة. بعد خطوة حضانة السكروز ، قم بتضمين الأنسجة في OCT للتقييم النسيجي26.
النتائج
تم إجراء تجارب تجريبية أولية على الجثث باستخدام صبغة الحقن (صبغة إيفانز الزرقاء) وحبر الوشم (الشكل 2 ب) لتحسين وضع وحجم الإبرة لكل من RBI و IVI. كان حبر الوشم غير مخفف ، ثم تم خلط مسحوق إيفانز الأزرق في PBS حتى أصبح السائل معتما. خلصنا إلى أن RBI المثالي يتميز بإبرة 28 جيجا تم إدخالها بزاوية في منتصف الطريق بين الساعة 6 و 7 على طول الحافة المدارية السفلية حتى يتم الشعور بالجزء الخلفي من تجويف العين. أدى هذا إلى توصيل الأصباغ إلى الجزء الخلفي من المدار ، بالقرب من العصب ، دون ثقب العصب البصري. وبالمثل ، تمت متابعة تجربة صبغة الجثث التجريبية هذه بحقن IVI ، ولكن تم استخدام صبغة Evans Blue فقط لأن حبر الوشم كان لزجا جدا بالتزامن مع إبرة 33 G. بمجرد تحديد بروتوكولات الحقن ، تم إجراء دراسات علاجية لإثبات المفهوم في الجسم الحي باستخدام ذكور فئران Long Evans المصطبغة عند 200 جم (ن = 18). بالإضافة إلى ذلك ، تم إجراء إمكانات الفلاش البصري المتكيفة مع الضوء (fVEPs) باستخدام ذكور فئران Long-Evans (ن = 2) لتحديد سلامة RBI. تم تسجيل قيم fVEP الأساسية ، ثم بعد 7 أيام من الحقن الملحي (100 ميكرولتر) في العين اليمنى (OD) ، تم إجراء fVEPs مرة أخرى. لم تتلق العين اليسرى (OS) أي حقنة. وأجريت fVEPs باتباع بروتوكولات موجودة مسبقا، حيث تم الحصول على الإشارات على خلفية 30 cd/m2 باستخدام وميض أبيض (200 cd.s/m2) وفاصل محفز قدره ms 1000 ms26. لم تظهر سعة fVEP أي تغييرات كبيرة بين العينين أو النقاط الزمنية (الشكل 4). تم إجراء التحليل الإحصائي باستخدام ANOVA ثنائي الموجة مع فاصل ثقة 95٪. تم إجراء اختبارات المقارنات المتعددة ل Tukey في GraphPad Prism لتحديد تفاعلات المجموعة26.
لتحديد فعالية الإعطاء العلاجي للعين ، تم الحصول على العلاجات العصبية التالية ذات الأهمية: ibudilast عند 10 مجم / مل (RBI) و 1 مجم / مل (IVI) ، حمض tauroursodeoxycholic (TUDCA) 50 مجم / مل (RBI) و 5 مجم / مل (IVI) ، حقن السيكلوسبورين ، 250 مجم / مل ، السيكلوسبورين الموضعي ، 0.05٪ ، وأناكينرا 100 مجم / 0.67 مل. تم إعطاء السيكلوسبورين عن طريق RBI (ن = 2) ، IVI (ن = 2) ، وموضعيا (ن = 3). تم إعطاء Anakinra و ibudilast و TUDCA عبر RBI (ن = 2) و IVI (ن = 2). تم اختيار الأدوية لإمكاناتها كعلاجات وقائية للأعصاب لاستخدامها في نموذج الفئران للاعتلال العصبي البصري الرضحي. تم استخدام السيكلوسبورين على وجه الخصوص لأنه كان شديد اللزوجة ، وبالتالي يصعب حقنه بالنسبة للعلاجات الأخرى. تم الحصول على الأنسجة بعد 24 ساعة من الحقن باتباع الطريقة المذكورة سابقا. تم تحليل الأنسجة عن طريق قياس الطيف الكتلي (TUDCA و ibudilast و cyclosporine) أو التحليل البروتيني (anakinra) (OSU's Pharmacoanaytic Shared Resource CORE). تم جمع الشبكية والأعصاب الضابطة وتقييمها عن طريق قياس الطيف الكتلي والتحليل البروتيني. ثم تم تقييم العينات المعالجة علاجيا ومقارنتها بالضوابط لتحديد المستويات النسبية للدواء الموجودة في كل من الأنسجة ذات الأهمية. تمت إزالة عينات Anakinra RBI من التحليل بسبب استجابة أثناء الحقن ، حتى تحت التخدير العميق. بسبب استجابة الألم هذه ، قد لا تكون إدارة RBI Anakinra نهجا علاجيا مثاليا.
تم الكشف عن السيكلوسبورين في كل من شبكية العين والعصب البصري بعد 24 ساعة عبر آليتي الحقن. ومع ذلك ، لم يتم الكشف عن التوصيل الموضعي في أي من أنواع الأنسجة. في مجموعة الحقن الوريدي ، كان تركيز شبكية العين 383 جزء في البليون ، وكان العصب البصري <5 جزء في المليار. لاحظ مسار حقن RB 16 جزء في البليون في شبكية العين و 49 جزء في البليون في العصب البصري (الجدول 1). لم يتم الكشف عن TUDCA في شبكية العين أو العصب البصري بعد 24 ساعة من الحقن لأي من طريقي الحقن. تم الكشف عن Ibudilast في أنسجة العصب البصري لحيوان واحد فقط بعد حقن RB (<5 جزء في الملكون). أشارت دراسة الحقن التجريبية العلاجية إلى أن كلا بروتوكولي الحقن قادران على توصيل الدواء إلى شبكية العين والعصب البصري ، كما يتضح من وجود السيكلوسبورين في كلا النوعين من الأنسجة بعد طريقتي الحقن. تشير هذه الدراسة أيضا إلى أن السيكلوسبورين أسفر عن تركيزات عالية داخل الأنسجة المستهدفة ذات الأهمية. تتمثل إحدى الفرضيات في أن ibudilast و TUDCA ربما وصلوا إلى شبكية العين والعصب البصري ، لكن عمر النصف في بيئة العين ربما كان أقصر من أن يتم اكتشافهما بعد 24 ساعة من الحقن. قد يكون أن الأدوية لها تأثير وقائي الأعصاب في هذا الوقت; ومع ذلك ، ستكون هناك حاجة إلى مزيد من الدراسات لتأكيد الحرائك الدوائية لهذه الأدوية في كل من المناطق الداخلية (IVI) وخارج العين (RBI).
دعمت هذه الدراسة التجريبية أيضا بروتوكول عزل أنسجة العين من خلال الإزالة الناجحة للعصب البصري الكامل والعينين. تم الحصول على شبكية العين والأعصاب البصرية بنجاح لتحليلها في الدراسة التجريبية للتوصيل العلاجي (الجدول 1). بالإضافة إلى ذلك ، من خلال استخدام تشريح عزل أنسجة العين هذا ، تمكنت العيون والأعصاب البصرية من الكتلة من أجل الكيمياء المناعية (الشكل 5). تم جمع عينات En-bloc من اثنين من ذكور Sprague Dawley ، كما هو موضح أعلاه. تم تضمين العينات في OCT وتم تقطيعها طوليا على ناظم البرد بسمك 10 ميكرومتر. تم تحضين العينات في PBS لإزالة OCT ثم تم تحضينها في مصل حمار عادي 1:20 في PBS بالإضافة إلى Triton-X-100 (PBT) في درجة حرارة الغرفة لمدة ساعتين. ثم تم تحضين الأقسام بالأجسام المضادة التالية: مضاد β-توبولين (1: 1000; MAB5564. ميليبور ، برلنغتون ، ماساتشوستس) والبروتين الحمضي الليفي الدبقي المضاد للدهق (GFAP ؛ 1:50 ؛ Z0334; DAKO ، سانتا كلارا ، كاليفورنيا) في PBT بين عشية وضحاها عند 4 درجات مئوية ، وشطفها باستخدام PBS ، وتحضنها في الحمار المضاد للفأر Alexa 488 والحمار المضاد للأرانب Alexa 594 (1: 200) في PBT بين عشية وضحاها عند 4 درجات مئوية. تم شطف الأقسام وتركيبها في وسائط تركيب بالإضافة إلى DAPI. تم تصوير العينات على مجهر مضان واسع المجال أو مجهر متحد البؤر باستخدام إعدادات متسقة26. كان من الممكن تصور رأس العصب البصري السليم (الشكل 5 أ ، ب) وتلطيخه بنجاح لعلامات الاهتمام التالية: β-توبولين (أخضر) ، والبروتين الحمضي الليفي الدبقي (GFAP ؛ أحمر) ، والعلامة النووية DAPI (أزرق). سمحت طريقة التشريح هذه بالحصول على عينات كاملة من العصب البصري ، كما هو موضح في الشكل 5C.
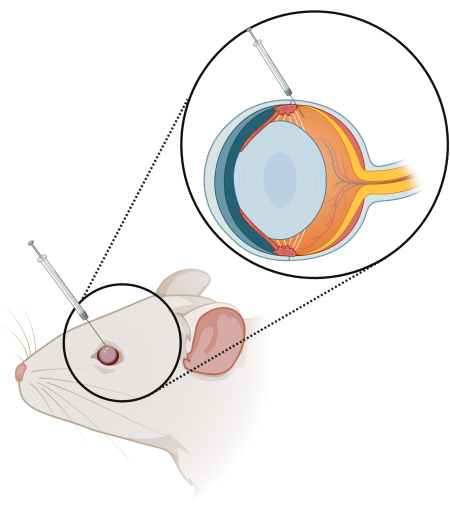
الشكل 1: تخطيطي لتقنية الحقن داخل الجسم الزجاجي (IV). يتم إدخال حقنة 10 ميكرولتر بإبرة 33 جم ، طولها 10 مم ، وزاوية 15 درجة 2/3 من الطريق إلى العين عند الطرف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
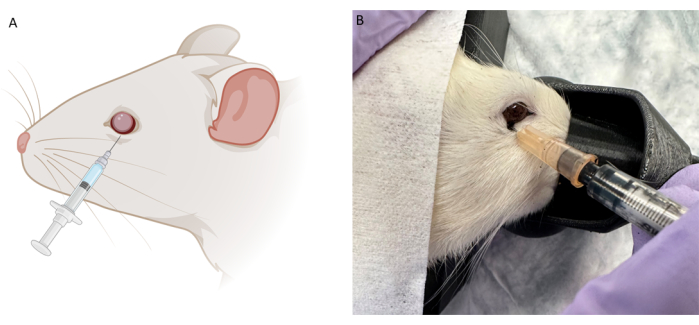
الشكل 2: صورة تخطيطية وتمثيلية لتقنية الحقن خلف البصيلة (RB). (أ) صورة تخطيطية لحقن RB. يتم إدخال حقنة أنسولين 0.5 مل بإبرة 28 جم على طول الحافة المدارية السفلية بزاوية بين موضع الساعة 6 و 7. يتم تقدم الإبرة حتى يتم الشعور بالجزء الخلفي من تجويف العين ثم يتم سحبها للخلف قليلا قبل الحقن. (ب) صورة تمثيلية لتقنية حقن RB باستخدام نفس الإبرة بحبر الوشم الأسود أثناء التجارب التجريبية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
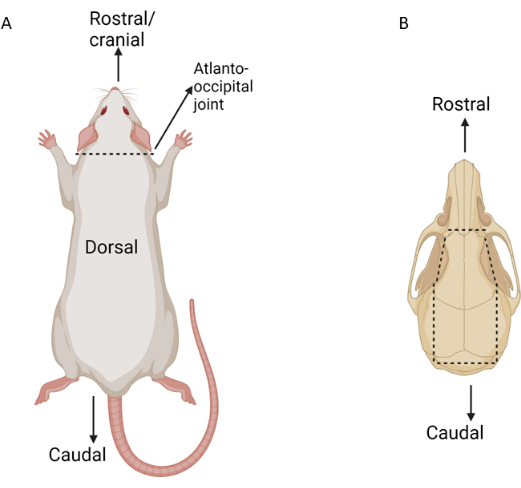
الشكل 3: تخطيطي لنقاط التشريح الرئيسية أثناء عزل أنسجة العين. تشير الخطوط المنقطة إلى نقاط الشق. (أ) الجرذ معروض ظهريا مع وضع علامة على المفصل الأطلسي القذالي. (ب) جمجمة الفئران معروضة ظهريا مع ملاحظة علامات شق مهمة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
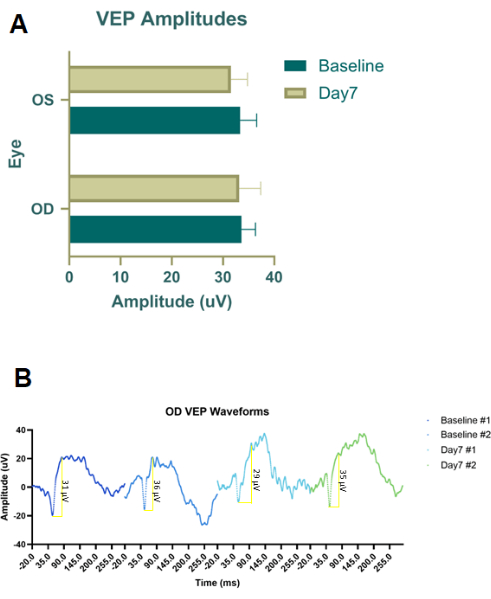
الشكل 4: إمكانات الفلاش البصرية (fVEPs) للأفواج المعالجة بالمحلول الملحي RBI. (أ) متوسط اتساع fVEP من العين اليمنى المعالجة بالمحلول الملحي (OD) والعين اليسرى (OS) الضابطة / غير المعالجة. لم يتم الكشف عن فروق ذات دلالة إحصائية في اتساع الأشكال الموجية fVEP بين المجموعات أو بين العينين. (ب) العين اليمنى (OD) fVEP الأشكال الموجية للعيون المالحة RBI المعالجة في خط الأساس ثم بعد سبعة أيام من الحقن (ن = 2 عينة حيوانية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: صور مجهرية epifluorescent لرأس العصب البصري (A ، B) وعينة عين الكتلة (C) للقوارض التي تم جمعها بعد تشريح عزل أنسجة العين. (أ ، ب) تم جمع رؤوس الأعصاب البصرية السليمة من وتم تلطيخها بعلامات β-tubulin (أخضر) ، والبروتين الحمضي الليفي الدبقي (GFAP ؛ أحمر) ، والعلامة النووية DAPI (الأزرق) بتكبير 20x. (ج) عينة عين من الكتلة تظهر الكرة الأرضية السليمة والعصب البصري الكامل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| عامل | مسار | الشبكيه | العصب |
| السيكلوسبورين | IVI | 383 | <5 |
| السيكلوسبورين | بنك الاحتياطي الهندي | 16 | 49 |
| السيكلوسبورين | الموضعيه | د | د |
| تودكا | IVI | د | د |
| تودكا | بنك الاحتياطي الهندي | د | د |
| إيبوديلاست | IVI | د | د |
| إيبوديلاست | بنك الاحتياطي الهندي | د | <5 |
| أناكينرا | IVI | D | د |
| أناكينرا | بنك الاحتياطي الهندي | غير أ | غير أ |
| ND: لم يتم اكتشافه | |||
| د: تم اكتشافه ولكن لا يمكن قياسه كميا | |||
| NA: غير متوفر | |||
الجدول 1: الحقن التجريبية العلاجية. تم التحقيق في العوامل العلاجية التالية لوجودها في شبكية العين والعصب البصري بعد 24 ساعة من تناولها: السيكلوسبورين (الموضعي ، IVI ، RB) ، TUDCA (RB و IVI) ، ibudilast (RB و IVI) ، و Anakinra (RB و IVI). تم اكتشاف السيكلوسبورين في كل من شبكية العين والعصب البصري بعد طريقي الحقن ، مما يشير إلى أن بروتوكولات الحقن RB و IV قادرة على توصيل الدواء العيني إلى شبكية العين والعصب البصري.
Discussion
تؤكد التحديات المعقدة المرتبطة بتوصيل العلاجات إلى شبكية العين والعصب البصري ، ويرجع ذلك أساسا إلى الحاجز غير المنفذ الذي يفرضه BRB ، على أهمية هذه الدراسة3،4. لا يسلط استكشاف تقنيات IVI و RBI الضوء على الأساليب المبتكرة للتغلب على هذه العقبات فحسب ، بل يؤكد أيضا على الآثار الأوسع نطاقا على رعاية العين والتطوير العلاجي. توضح هذه النتائج أن كلا من IVI و RBI يمكن أن يسهلا التوصيل المستهدف للعلاجات مباشرة إلى أنسجة العين المصابة. هذا النهج المستهدف حيوي لتحقيق تركيزات علاجية غالبا ما تكون بعيدة المنال من خلال طرق الإدارة الجهازية أو الموضعية2،11 ، وبالتالي تعزيز فعالية العلاجات لأمراض العين المختلفة.
يكشف التحليل المقارن لتقنيات الحقن هذه عن فوائدها الفريدة: يوفر IVI وصولا مباشرا إلى طبقات الجسم الزجاجي والشبكية الداخلية27 ، بينما يسمح RBI بالانتشار في العصب البصري دون المساس بسلامة BRB28. تساهم هذه الأفكار في فهم أكثر دقة لأفضل السبل لتقديم عوامل علاجية محددة ، مما يؤدي في النهاية إلى تحسين نتائج العلاج للمرضى الذين يعانون من أمراض العين. نجحت طرق توصيل IVI و RBI الموضحة هنا في تقديم العلاجات ، مثل السيكلوسبورين ، إلى الأنسجة الحرجة ، مما يسلط الضوء على إمكانية تطوير علاجات فعالة للعين.
علاوة على ذلك ، من خلال هذه الطريقة العلاجية عملية التطوير ، تم اختيار الأيزوفلوران الاستنشاقي كطريقة تخدير لبروتوكول RBI و IVI ، لأنه سريع المفعول في كل من التنشيط والتعافي. يوفر SALOOT دعما حاسما واستقرارا للقوارض ، مع السماح بمعدل موحد من التخدير المستنشق. كما تمت مناقشته سابقا ، تشمل بعض المخاطر المرتبطة ب RBI الضرر المحتمل للعين بسبب إدخال الإبرة العمياء ، بالإضافة إلى انسداد تدفق الدم أو انهيار القصبة الهوائية بسبب تقنية الضغط الموضحة في بروتوكول الحقن خلف البصيلة للفئران23. للمساعدة في التخفيف من هذه المخاطر ، يستخدم هذا البروتوكول ملقط العين للإمساك بالجفن السفلي للحيوان لتحقيق الاستقرار ، وبالتالي التخلي عن تقنية الضغط والقضاء على انسداد تدفق الدم أو انهيار القصبة الهوائية. توفر هذه التقنية أيضا تحكما أفضل في أثناء إدخال الإبرة. يساعد استخدام الملقط جنبا إلى جنب مع استخدام مجهر التشغيل الحي على تقليل مخاطر الإدخال الأعمى ، مما يمنح المشغل تصورا أفضل لموقع الإبرة. بالإضافة إلى ذلك ، توفر منصة الجراحة دعما مهما للرأس ، مما يمنع الجمجمة من الحركة أثناء إدخال الإبرة. توفر منصة الجراحة أيضا ارتفاعا للرأس فيما يتعلق ببقية الجسم ، مما يسمح للرأس بأن يكون في وضع أكثر استواء ، وبما أن المنصة تحتوي على وصلات الأيزوفلوران والأكسجين ، فإن مستوى التخدير لا يتعرض للخطر أبدا أثناء التوضع. تم اعتماد تقنية IVI لقدرتها الفريدة على تجاوز BRB عن طريق حقن العلاجات مباشرة في الخلط الزجاجي. تقدم هذه التقنية فرصة لتلف العين بسبب طبيعتها الغازية ، ولكن يتم تقليل المخاطر من خلال التأكد بعناية من أن الإبرة لا تخدش العدسة ، وإزالة الإبرة ببطء ، والضغط على العين لمدة 10-15 ثانية بعد الحقن.
كان من الممكن إزالة وتحليل عينات الشبكية والأعصاب البصرية بنجاح من خلال طريقة استرجاع الأنسجة الفريدة هذه. تم تحقيق عزل العين والأعصاب في كتلة ، مما يساعد على القدرة على تقييم النظام البصري الكامل ، كما يتضح من رأس العصب البصري وتلوين التألق المناعي الكامل للعين (الشكل 5). تسمح هذه الطريقة بالتصور من أعلى إلى أسفل للدماغ والأعصاب البصرية والكرات الأرضية ، مما يسمح بالحفاظ على الهيكل العام وسلامة أنسجتنا بشكل أسهل.
هذه الدراسة لها قيود محتملة ، بما في ذلك استخدام جنس واحد فقط وحجم عينة صغير نسبيا. ترتبط حقن RB أيضا بالقيود المتأصلة في التسرب العلاجي. بعد حقن RB ، يمكن أن تنتقل العلاجات من الفضاء البصلي إلى مقدمة الكرة الأرضية. تهدف هذه التقنية إلى تقليل هذا القيد المتأصل عن طريق تغيير زاوية الإدخال وإبقاء الإبرة قريبة من الجزء الخلفي من المدار قدر الإمكان. بالإضافة إلى ذلك ، تم تحديد أن الحفاظ على الضغط الخفيف بعد الإعطاء العلاجي لمدة 10-15 ثانية ساعد في منع العلاجات من الهجرة خارج الفضاء خلف البصلة.
سيتم استخدام هذه الأساليب في العمل المستقبلي للتدخل العلاجي في نموذج إصابة العين الرضحية للحيوانات الصغيرة. تم توسيع طرق IVI لاستخدامها في الكتاكيت والفئران. ومع ذلك ، يجب تعديل حجم الإبرة والأحجام العلاجية. بالنسبة للكتاكيت ، تم العثور على إبرة الأنسولين 28-29 جم و 20 ميكرولتر من الحجم العلاجي لتكون مثالية29 ، ولكن مع الفئران ، تم تحديد أن إبرة 31 جم و 2 ميكرولتر من الحجم العلاجي مثالية. تغيرت تقنية IVI بشكل طفيف مع الترجمة إلى أخرى. لترجمة RBI إلى أنواع أخرى ، يجب تكييف حجم الإبرة وحجمها ، ولكن يجب أن تظل التقنية الشاملة قابلة للترجمة طالما تم النظر في الاختلافات التشريحية المتأصلة بين الأنواع.
الرؤى المكتسبة من نماذج الصغيرة لا تقدر بثمن لتعزيز فهم آليات توصيل الأدوية وتحسين بروتوكولات العلاج. في النهاية ، يضع هذا البحث الأساس لعلاجات أكثر فعالية يمكن أن تعزز بشكل كبير جودة الرعاية البصرية ، وتخطو خطوات كبيرة نحو الحفاظ على الرؤية وتحسين النتائج في الممارسة السريرية.
Disclosures
ويعلن المؤلفون أن البحث أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
تم تمويل هذا العمل جزئيا من قبل جوائز برنامج أبحاث الرؤية التابع لوزارة الدفاع الأمريكية W81XWH-15-1-0074 و W81XWH-22-1-0989. الآراء أو التأكيدات الواردة هنا هي آراء خاصة لأصحاب البلاغ ولا ينبغي تفسيرها على أنها رسمية أو تعكس وجهات نظر وزارة الجيش أو وزارة الدفاع. تم دعم هذه المنحة البحثية جزئيا من قبل شركة أوهايو التابعة لجائزة زمالة الطالب الباحث الشاب لمنع العمى للباحثات الإناث في أبحاث الرؤية. نحن ممتنون للدعم المقدم من مؤسسة روس. تم تقديم الخدمات في البرنامج الأساسي لأبحاث علوم الرؤية في جامعة ولاية أوهايو تحت P30EY032857. نود أن نشكر مختبر جامعة ولاية أوهايو والموارد الحيوانية (ULAR). بالإضافة إلى ذلك ، نود أن نشكر أعضاء مختبر رايلي الجامعيين ميشيل موسكو وإيما لالي وسام داكوورث وإيف هوارد. نود أيضا أن نشكر Bongsu Kim على مساهمته في تصميم SALOOT ، وكذلك إليزابيث أوربانسكي وريان ويب. تم إنشاء الشكل 1 والشكل 2 أ والشكل 3 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
References
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved