Method Article
成体ラットにおける眼治療送達と高度な組織回収
要約
この研究は、成体ラットの網膜および視神経に治療薬を送達するための方法論を示しています。さらに、成体ラットの視神経と網膜のトップダウンの一括コレクションに対して、独自の組織賦活化法が導入されています。
要約
網膜や視神経を含む眼の後部への治療送達は、血液脳関門と血液網膜関門の存在によって複雑になります。ラットなどの小動物モデルは、さまざまな眼の病状を研究するために利用されています。後眼への治療送達は困難ですが、眼疾患の治療にはそれを達成することが不可欠であり、その多くは翻訳関連性について小動物モデルでの検証が必要です。したがって、2つの後方治療送達技術が提示されます:硝子体内注射(IVI)と成体ラットで使用するための球後注射(RBI)。さらに、眼と視神経を一括して除去する方法が、さまざまな組織学的および分子分析技術に導入されています。解剖プロトコルは、網膜および視神経組織への死後の損傷を最小限に抑えながら、神経視覚系の完全な観察を可能にします。治療用シクロスポリンの網膜および視神経への送達に成功し、IVIとRBIの両方を使用して注射の24時間後に検出可能な濃度が観察されました。さらに、網膜と神経のサンプルをまとめて抽出し、眼全体の組織学的組織分析に成功し、網膜とより広範な神経視覚系の包括的な観察を容易にしました。
概要
網膜および視神経に治療薬を送達することは、眼の複雑な解剖学的構造1,2、特に血液網膜関門(BRB)3,4,5の存在のために非常に困難である。BRBは、網膜を全身循環の侵入から保護するのに役立ちますが、全身の治療循環はBRBによってしばしばブロックされるため、治療的投与の挑戦的な相手です6,7。小さな親油性分子はBRBを介して容易に拡散できますが、大きくて親水性の分子は網膜へのアクセスを得るのが困難です6。硝子体内注射(IVI)および眼球後注射(RBI)は、眼組織への薬物の送達を可能にし、BRBによって課せられる制限を克服する。IVIは、治療薬を眼の内部環境に投与することにより、有望な妥協点として機能します8,9。この方法では、薬物が硝子体を横切ってBRBを迂回し、視神経7に到達するために網膜と脈絡膜を介して拡散することが必要である。打点は、眼球後腔10に眼球の後ろに送達されます。治療薬は、球後腔の組織や腺を介した拡散によって送達され、網膜に直接入ることなく視神経や周囲の構造に影響を与えるため、BRBの完全性が維持されます。硝子体内注射と眼球後注射の両方で、薬物を直接または間接的に眼に送達することにより、治療薬の局所濃度を高めることができ、局所投与または全身投与(経口または静脈内)と比較してその有効性を高めることができます2。これは、多くの眼疾患に見られるように、迅速な作用や高い効力を必要とする治療にとって特に重要です。また、標的を絞った送達は、薬物への体の残りの部分の曝露を制限するため、オフターゲット効果のリスクが軽減され、薬物が局所、経口、または静脈内投与されるときに発生する可能性のある潜在的な副作用を最小限に抑えるのに役立つ11。
結膜下注射、後眼下注射、網膜下注射など、他の眼周囲注射には、それぞれの利点と限界があります2,5。後部テノンサブノン注射は、高濃度の薬物を眼組織に送達することが観察されています。ただし、テノン下管注入は眼窩血管5,12よりも強膜に近いです。対照的に、RBIは、治療薬を後テノンまたは結膜下13よりも視神経に近づけます。これは、視神経の病状が他の眼周囲注射タイプよりもRBI送達治療を好むことを意味する可能性があります。テノン後部注射には、斜視、前立腺、眼圧上昇などのリスクが伴います5。眼圧の上昇は、IVI、結膜下、および網膜下注射でも報告されている危険因子です2。これらの注射タイプは、所望の治療効果を達成するために、しばしば反復投与を必要とする2。網膜下注射、結膜下注射、およびIVIに関連する他の危険因子には、白内障形成、網膜出血、網膜剥離、および炎症2が含まれます。これらのIVI、網膜下注射、および結膜下注射は、眼内注射であるため、RBI 注射よりも侵襲的です2。RBIは、針を直接眼球に入力することなく、治療薬を球後腔に配置するため、侵襲性が低いと考えられる場合があります。局所投与などの他の低侵襲治療送達戦略は、十分な薬物送達には不十分であり、眼表面に保持される薬物は5%未満である2,5。
IVIは、治療薬を眼の後部に直接送達する能力のために使用される、前臨床モデルにおける著名な技術です。IVIは、薬物を硝子体液に直接送達するため、局所治療に適した送達技術となっています14。IVI技術は、治療薬が網膜への薬物浸透に対する一般的な障害である血液網膜関門を迂回することを可能にする14。IVIは炎症や眼の構造の損傷の機会をもたらすため、手順を細心の注意を払って遵守する必要があります14。網膜剥離と白内障の形成を最小限に抑えるために、Chiuらは、水晶体、網膜、眼筋、および血管15を避けて、扁平部のレベルでの45度の斜角挿入と注入を強調するIVIアプローチについて説明しています。この技術では、30Gの針が治療送達15のために鼻強膜に挿入される。IVIは、その侵襲性により、依然としてリスクと関連しています。潜在的なリスクには、網膜剥離、白内障形成、眼内炎、または出血が含まれます16。IVI技術の侵襲性は、Ikjong Parkらが行ったブタの眼に関する実験で示されているように、眼圧も増加させます16。この研究では、針の挿入と輸液注入のさまざまな段階での眼圧の変化が示されています。彼らは、処置中の眼圧の大幅な変動を報告しています16。
RBIは、げっ歯類への治療送達の手段として、以前の研究で成功裏に利用されています。そのような研究の1つは、RBI17を介して投与されるさまざまなプロスタグランジン類似体の効果を比較しました。アルビノラットに、0.1mLの注射液の26G針を下円蓋の外側領域に45度の角度で挿入した打点を与えた17。この研究で使用されたプロトコルは、ラットがクロラレヒドレート18の腹腔内(IP)注射によって麻酔された以前に説明した方法から適応されました。ラットで行われた別の研究では、局所点眼薬と球後注射を比較しました19。ラットは、ケタミン/キシラジンのIP注射によって麻酔され、打点は30G針19を介して与えられた。以前に議論された鎮静法とは対照的に、眼窩脂肪に対するRBIの影響を観察した1つの研究では、RBI20の前にラットを鎮静するために吸入イソフルランを使用しました。これらの研究は、どのような麻酔薬と針の仕様が成功するかについての洞察を提供しますが、処置中の動物の位置決めと取り扱いについては説明されていません。
マウスを用いた様々な研究でも、治療送達方法の打点が認められています。ある研究では、ネフローゼ症候群の誘発に成功したために、RBIと側尾静脈注射を比較しました21。2番目の研究では、心臓画像診断のための造影剤の投与における同じ2つの注射技術も比較されました22。マウスを吸入イソフルランで麻酔し、眼の内側に注射した22。どちらの研究も、以前に書かれたプロトコルからRBI法を適応させました。このプロトコルでは、注射を後眼窩と名付けましたが、注射位置を眼球後腔と説明していることに注意することが重要です。このプロトコルの著者らは、好ましい鎮静法として吸入イソフルランを利用し、マウスの迅速な活性化および回復時間に注目した23。打点については、眼の周りの皮膚に圧力を加えることにより、眼が眼窩から部分的に突出していた23。次いで、針を内側眼砦面下方に30度の角度で導入し、眼の基部23に達するまで挿入した。動物に圧力をかけるときは、偶発的な血流の閉塞や気管の虚脱が発生する可能性があるため、注意が必要です23。また、インジェクターは挿入時に針先が見えないため、眼を損傷するリスクがあります。23 治療投与時に眼に損傷を与えることは、この実験では重大なリスクであり、追加の損傷を引き起こすことは研究の結果を直接損なうためです。また、前述の位置決めおよび取り扱い技術がマウスで実施され、ラットへの適用性に関するコメントが含まれていなかったことにも留意しなければならない。
視神経と網膜の除去が試みられた多くの方法があります。そのような方法の1つは、視神経と眼を一括して除去し、無傷の視交叉を保存することを探求した24。この方法は、個々の目と視神経も一括除去のために保存されているため、現在の研究に最も匹敵します。ただし、視交叉は分離しています。この手順では、手順が複雑なため、注意を払うことが最も重要になります。現在の方法では、尾側頭蓋骨 から 解剖を開始し、視神経への損傷を制限し、神経全体が無傷のままでいることができるようにアクセスを提供するために、吻側で作業します。さらに、神経を無傷で眼に付着させておくことは、神経の各部分への損傷が異なる病理学的観察に対応する可能性があるため、埋め込みプロセスにとって重要である24。視神経の向きは、視神経がどのように埋め込まれているかによってさまざまな断面が可能になるため、考慮することが重要です。これは組織学的分析にとって重要である可能性があります。
Small Animal Laboratory Ophthalmic Operating Table(SALOOT、眼科手術プラットフォーム)として知られるカスタムメイドのデバイスは、麻酔を提供し、眼科治療注射のために動物を安定した位置に保持するための一連の3Dプリント材料で構成されています。SALOOTの設計により、眼科手術のための頭部と眼の構造の安定性が可能になり、手術のスピードと再現性が向上し、ガス麻酔の送達や呼気微粒子の除去が可能になります。SALOOTは、ラットの体を保持するための凹面の縮小を特徴とする3次元プリントブロックで、動物の頭部をイソフルラン入口のあるノーズコーンに保持するために、前面の狭い領域があります。ノーズコーンの下には小さなリザーバーと排気口があります。以下の方法は、治療用眼球送達および正確な眼組織回収のために開発されました。これらは眼の外傷後の組織を研究するために設計されているため、所見の混乱した解釈を避けるために、外傷、注射、治療、および解剖の影響を描写することが重要です。
この記事では、成体ラットで使用するための2つの眼科治療用注射法、硝子体内注射と球後注射について説明します。さらに、成体ラットから無傷の視神経および網膜を一括して除去するための組織賦活化方法が提示されている。これらの技術により、誘発された病状と治療の眼および眼周囲への影響の調査が可能になります。
プロトコル
すべての実験は、眼科および視覚研究における動物の使用に関するARVO声明に従って実施され、オハイオ州立大学の施設動物管理および使用委員会によって承認されました。この研究では、体重~200g、生後約2ヶ月の雄のSprague Dawleyラットを用いた25。試薬および使用した機器の詳細は 、材料表に記載されています。
1. 硝子体内注射(IVI)
- イソフルランと廃棄物のリード線をSALOOTの取り付けポートに取り付けます。眼科および視覚研究における動物の使用に関する ARVO ステートメントおよび承認された IACUC プロトコルに従って、標準的なイソフルラン手順を使用して動物を麻酔します。
注:あるいは、動物がすでに別の眼科検査セッションから麻酔を受けていた場合(すなわち、ケタミン/キシラジンミックス;90 mg / kgケタミンと10 mg / kgキシラジン)、動物を眼科手術プラットフォームに移し、イソフルラン(3酸素:3イソフルラン比)で麻酔を滴定して、麻酔の適切な深さが維持されるようにします。. - 麻酔をかけた動物と一緒に眼科手術プラットフォームをライブ手術顕微鏡の下に置きます。ペダル離脱反射 を介して 麻酔の深さを評価します。
- 0.5%テトラカイン塩酸塩点眼液を1〜2滴、手術中の目に入れます。.操作を行わない場合は、ヒプロメロース0.3%などの潤滑性局所眼科用軟膏を反対側の眼に塗布します。.
- 次に、眼球表面に5%ポビドンヨードを1〜2滴使用し、綿棒を使用して、目の周囲の皮膚にポビドンヨードを塗布します。
- 長さ 10 mm、角度 15 度のスタイル 4 チップの 33 G 針付き 10 μL シリンジを使用し、0.9% 静菌性塩化ナトリウムを吸い上げます。注射器と針を生理食塩水で洗い流してから、針を熱いビーズ滅菌器に浸します。
- 先に進む前に、冷ましてください。針が冷えた後、目的の治療薬を所望の量(4μL)まで引き上げます。
注:概念実証研究では、非希釈タトゥーインクとリン酸緩衝生理食塩水(PBS)中のEvan's Blue染料を使用しました。エヴァンズブルーパウダーを不透明になるまでPBSと混合しました。治療の概念実証研究では、次の濃度を利用しました:1 mg / mLのイブジラスト、5 mg / mLのタウロウソデオキシコール酸(TUDCA)、250 mg / mLのシクロスポリン注射、および100 mg / 0.67 mLのアナキンラ。治療用粉末を0.9%静菌生理食塩水で希釈しました。
- 先に進む前に、冷ましてください。針が冷えた後、目的の治療薬を所望の量(4μL)まで引き上げます。
- 歯付きの細い眼科用鉗子を使用して、輪部の強膜組織を優しくつかみ、安定させます。虹彩の周りにかすかな赤いリングがあります。このリングを目印に、針を斜めにして挿入し、後眼部に注入します。
注意: 針を網膜に向けて傾け、針を2/3だけ挿入するようにしてください(図1)。針がレンズを傷つけないように注意してください、これは白内障の形成につながるからです。 - 治療薬が注射された後、ゆっくりと針を取り外してください。.目を閉じ、生理食塩水で洗い流す前に少なくとも10〜15秒間圧力を保持します。
- 動物をイソフルランから中止し、眼科手術プラットフォームから取り出します。.各眼にヒプロメロース0.3%を一滴垂らし、動物を加熱パッドで回復させます。
2.球後バー注射(RBI)
- イソフルランと廃棄物のリード線をSALOOTの取り付けポートに取り付けます。標準的なイソフルラン手順を使用して動物に麻酔をかけます。
注:あるいは、動物がすでに別の眼科検査セッションから麻酔を受けていた場合(すなわち、ケタミン/キシラジンミックス;90 mg / kgケタミンと10 mg / kgキシラジン)、動物を眼科手術プラットフォームに移し、イソフルラン(3酸素:3イソフルラン比)で麻酔を滴定して、麻酔の適切な深さが維持されるようにします。. - 麻酔をかけた動物と一緒に眼科手術プラットフォームをライブ手術顕微鏡の下に置きます。ペダル離脱反射 を介して 麻酔の深さを評価します。
- 0.5%テトラカイン塩酸塩点眼液を1〜2滴、手術中の目に入れます。.操作を行わない場合は、潤滑性の局所眼科用軟膏(ヒプロメロース0.3%)を反対側の眼に塗布します。.
- 次に、眼球表面に5%ポビドンヨードを1〜2滴使用し、アイスピアを使用して、目の周囲の皮膚にポビドンヨードを塗布します。
- 28Gの針が付いた0.5mLのインスリン注射器を入手します。目的の治療薬を所望の量(100μL)まで引き上げます。
注:概念実証研究では、非希釈タトゥーインクとリン酸緩衝生理食塩水(PBS)中のEvan's Blue染料を使用しました。エヴァンズブルーパウダーを不透明になるまでPBSと混合しました。治療の概念実証研究では、次の濃度を利用しました:10 mg / mLのイブジラスト、50 mg / mLのTUDCA、250 mg / mLのシクロスポリン注射、および100 mg / 0.67 mLのアナキンラ。.治療用粉末を0.9%静菌生理食塩水で希釈しました。 - 歯付きの細い眼科用鉗子を使用し、下まぶたを優しくつかんで安定させます。針を斜角を下にして、眼窩下部縁に沿って6時と7時の中間の角度で、眼球ソケットの背面が感じられるまで挿入します。針を少し後ろに引いてから、治療薬をゆっくりと注入します(図2)。
- 針をそっとゆっくりと取り外します。次に、目を閉じて、生理食塩水で洗い流す前に、少なくとも10〜15秒間圧力を保持します。
- 動物をイソフルランから中止し、眼科手術プラットフォームから取り出します。.各眼にヒプロメロース0.3%を一滴垂らし、動物を加熱パッドで回復させます。
3. 眼組織分離解剖
- 動物がCO2窒息によって、または承認されたIACUCプロトコルに別途記載されているように安楽死させた後、動物を胸骨横臥に置きます。背側の首の上の横方向の皮膚切開を利用し、耳の耳介のレベルまで伸びます。
- 背側の筋肉組織を解剖して、環状後頭関節を露出させます。マヨハサミを使用して、環状後頭関節を切開し、頭を体から分離します(図3)。鈍い解剖を使用して、鼻の高さから背側首までの背側頭蓋骨から皮膚を優しく取り除き、両目の周りの皮膚を無傷のままにします。
- 一対の中ストレート止血剤またはニードルドライバーを頭蓋骨の基部にある大孔に挿入します。止血剤を使用して、大孔から両側の側頭領域まで伸びる外側頭蓋骨を穏やかに突破します(図3)。
- 頭蓋骨の上部を取り外すときは、止血剤を脳の背側と平行に保ちます。これにより、脳が無傷のままで、骨の除去プロセスで傷がつかないようにすることができます。
- 平らなヘラを使って、脳を吻側に優しく反射させ、視神経を露出させます。脳の重さによる緊張が視神経にかからないように注意が必要です。
- 神経を露出させた状態で、中型のマイクロハサミを取り、視交叉を横切って小さな切開を行い、両方の神経を脳から切断します。この時点で、脳を廃棄するか、組織学的評価のためにPBS(4%PFA)のパラホルムアルデヒドに4°Cで24時間置くことができます。
- 小さな虹彩ハサミと歯付き眼科用マイクロ鉗子を使用して、目の周りの余分な組織(まぶた、結合組織など)を慎重に取り除きます。完了したら、目は眼窩に位置する必要がありますが、眼球外筋と眼球腺のみが存在しています。
- 止血剤と小さな虹彩ハサミを組み合わせて使用し、視神経が視神経を通過するときに視神経に切らないように細心の注意を払いながら、眼窩を切り抜きます。止血剤で眼窩の後ろにある骨を慎重に取り除き、より正確に制御するために、小さな解剖ハサミを利用します。
- 骨を切除した後、マイクロハサミと細い鉗子で眼窩の周りを繊細に切り取り、脂肪パッド、腺、眼球外筋を取り除きます。このプロセス中は、視神経を観察するようにしてください。
- 目は、頭蓋骨の内部に向かって尾側に穏やかに反射できる必要があります。この時点で、小さなマイクロハサミと細い鉗子を使用して、頭蓋骨下部の隆起の神経を囲む結合組織を取り除きます。
- この組織を取り除けば、目と視神経全体を頭蓋骨から一斉に持ち上げることができるはずです。反対側の目と神経についてこれらの手順を繰り返します。
- さらに、視神経と眼の硬膜鞘などの余分な組織をきれいにします。組織学的分析のために組織を保存する必要がない場合は、ドライアイスまたは液体窒素を使用して急速凍結してから-80°Cで保存してください。
- 質量分析では、網膜を地球の内部領域から分離し、視神経を分離する必要があります。最も近い外部ポイントで視神経を球から分離します。神経を氷上のクライオチューブに入れてから、-80°Cに移します。
- 眼球を手術用顕微鏡下のペトリ皿に置きます。湾曲した鉗子を使用して目を安定させ、小さなマイクロハサミで輪部を切開します。
- 地球の全周を囲むようにカットを伸ばします。球体は二等分し、前部は廃棄できます。
- 後部を内側を上にして置き、細い眼科用ピンセットを使用して、薄いクリーム色のティッシュを取り除きます。光ディスクにくっついているように見える場合があります。これが発生した場合は、マイクロハサミを使用して網膜を椎間板から切り取ります。
注:その後、網膜組織を氷上のクライオチューブに入れてから、-80°Cに移すことができます。 その後、組織を質量分析施設に移して評価することができます。
- 部分灌流を用いた免疫組織学染色では、無傷の眼をペトリ皿の上に置きます。湾曲した鉗子を使用して目を安定させた後、28Gの針でインスリン注射器を取り、針を網膜に向けて角を付けた状態で輪部に挿入します。リンバスに沿った別の2つのポイントでこの手順を繰り返します。グローブの穿刺は、適切な灌流を確保し、適切な固定を支援します。
注:グローブは、シェーカーに移行し、流体の動きを容易にするためにさらに20分間低速で攪拌する前に、少なくとも40分間4%PFAに固定する必要があります。 - 固定手順が完了したら、PFAを取り外し、PBSと交換します。バイアルを15分間静かに振ってから、この手順を2回目の15分間PBSすすぎます。
- 最終的なPBSすすぎサイクルの後、PBSを吸引し、PBSの30%ショ糖溶液と交換し、24時間冷蔵します。スクロースインキュベーションステップに続いて、組織学的評価のために組織をOCTに埋め込みます26。
結果
予備的なパイロット実験は、RBIとIVIの両方に対して針の配置とサイズを最適化するために、注射染料(Evans Blue染料)とタトゥーインク(図2B)を使用して死体動物で行われました。タトゥーインクは非希釈であり、その後、エバンスブルーパウダーをPBSに混合して、液体が不透明になるまで使用しました。理想的なRBIは、眼窩の裏側が感じられるまで、眼窩下部縁に沿って6時と7時の中間の角度で挿入された28Gの針を特徴とすると結論付けました。これにより、視神経に穴を開けることなく、神経に近い眼窩の後ろに染料が送達されました。同様に、このパイロット死体染料の試験に続いてIVI注射が行われましたが、タトゥーインクが33G針と併用すると粘性が高すぎたため、エバンスブルー染料のみが使用されました。注射プロトコルが決定されると、概念実証のin vivo治療研究が、200g(n = 18)の雄の色素沈着Long-Evansラットを用いて行われました。さらに、光適応閃光視覚誘発電位(fVEP)を雄のLong-Evansラット(n = 2)を用いて実施し、RBIの安全性を決定しました。ベースラインのfVEP値を記録し、その後、生理食塩水(100μL)を右眼(OD)に注射(100μL)してから7日後に、fVEPを再度実施しました。左目(OS)は注射を受けませんでした。fVEPは、白色フラッシュ(200 cd.s/m2)および1000 ms26の刺激間間隔を利用して30 cd/m2の背景に対して信号が取得された既存のプロトコルに従って実施された。fVEPの振幅は、眼間または時点間で有意な変化を示さなかった(図4)。統計分析は、95%信頼区間の2因子ANOVAを用いて行った。テューキーの多重比較検定は、グループの相互作用を決定するためにGraphPad Prismで実施されました26。
眼治療薬投与の有効性を判断するために、次の目的の神経保護治療薬が得られました:10 mg / mL(RBI)および1 mg / mL(IVI)、タウロウソデオキシコール酸(TUDCA)50 mg / mL(RBI)および5 mg / mL(IVI)、シクロスポリン注射、250 mg / mL、シクロスポリン局所、0.05%、およびアナキンラ100 mg / 0.67 mL。.シクロスポリンは、RBI(n = 2)、IVI(n = 2)、および局所(n = 3) で 投与されました。.アナキンラ、イブジラスト、およびTUDCAは、RBI(n = 2)およびIVI(n = 2) を介して 投与されました。薬剤は、外傷性視神経障害のラットモデルで使用するための神経保護治療薬としての可能性を考慮して選択されました。シクロスポリンは粘性が高く、他の治療薬に比べて注射が困難であったため、特に使用されました。組織は、前述の方法に従って注射の24時間後に取得されました。.組織は、質量分析法(TUDCA、イブジラスト、およびシクロスポリン)またはプロテオミクス分析(アナキンラ)(OSUのPharmacoanaytic Shared Resource CORE) によって 分析されました。コントロール網膜と神経を採取し、質量分析とプロテオミクス分析 によって 評価しました。次に、治療処理されたサンプルを評価し、対照と比較して、目的の各組織に見つかった薬物の相対レベルを決定しました。Anakinra RBIサンプルは、深い麻酔下でも注射中の動物のひるみ反応により分析から除外されました。この疼痛反応のため、RBI Anakinra 投与は最適な治療アプローチではない可能性があります。
シクロスポリンは、両方の注射メカニズム を介して 24時間後に網膜と視神経の両方で検出されました。ただし、局所送達はどちらの組織タイプでも検出されませんでした。.IV注射群では、網膜の濃度は383ppb、視神経の濃度は<5ppbでした。RB注入経路では、網膜で16ppb、視神経で49ppbが観察されました(表1)。TUDCA は、どちらの注射経路でも、注射の 24 時間後に網膜神経または視神経のいずれにも検出されませんでした。イブジラストは、RB注射後(<5 ppb)に1匹の動物のみの視神経組織で検出されました。治療パイロット注射研究では、両方の注射方法の後に両方の組織タイプにシクロスポリンが存在することから明らかなように、両方の注射プロトコルが網膜と視神経への薬物送達が可能であることが示されました。また、この研究では、シクロスポリンが目的の標的組織内で高濃度であることも示されています。1つの仮説は、イブジラストとTUDCAが網膜と視神経に到達した可能性があるが、眼環境での半減期が短すぎて注射後24時間で検出できなかった可能性があるというものです。現時点では、薬が神経保護的な影響を与えている可能性があります。ただし、内部領域(IVI)と眼外領域(RBI)の両方でこれらの薬物の薬物動態を確認するには、さらなる研究が必要になります。.
このパイロット研究では、視神経と眼球全体の切除を成功させることにより、眼組織分離のプロトコルもサポートしました。網膜と視神経は、治療送達パイロット研究での分析のために成功裏に取得されました(表1)。また、この眼組織単離解剖を利用することで、眼球と視神経をまとめて採取し、免疫組織化学を行うことができました(図5)。En-blocサンプルは、上記のように2匹の雄のSprague Dawleyラットから収集されました。サンプルをOCTに包埋し、厚さ10 μmのクライオスタットで縦方向に切片化しました。サンプルをPBSでインキュベートしてOCTを除去した後、PBSとTriton-X-100(PBT)を併用した1:20の正常ロバ血清に室温で2時間インキュベートしました。次に、切片を以下の抗体とインキュベートしました:抗β-チューブリン(1:1000;MAB5564;Millipore, Burlington, MA) および抗グリア線維性酸性タンパク質 (GFAP; 1:50;Z0334;DAKO, Santa Clara, CA)をPBTで4°Cで一晩中、PBSですすぎ、ロバ抗マウスAlexa 488およびロバ抗ウサギAlexa 594(1:200)でPBT中4°Cで一晩インキュベートしました。 切片をすすぎ、封入剤とDAPIに封入しました。サンプルは、広視野蛍光顕微鏡または共焦点顕微鏡で一貫した設定を使用して画像化した26。無傷の視神経乳頭を可視化し(図5A、B)、β-チューブリン(緑)、グリア線維性酸性タンパク質(GFAP;赤)、核マーカーDAPI(青)の目的のマーカーについて染色に成功しました。この解剖方法により、 図5Cに示すように、完全な視神経サンプルを得ることができました。
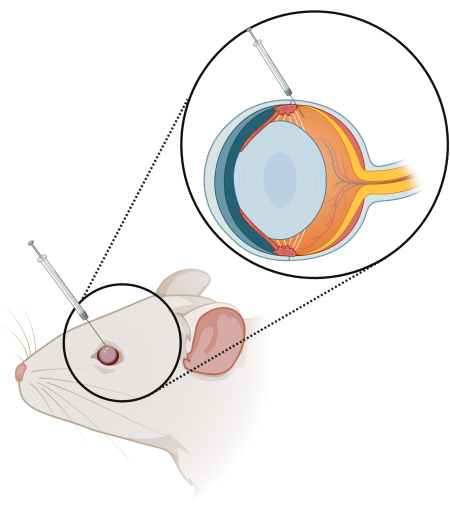
図1:硝子体内(IV)注射技術の概略図。 長さ 10 mm、角度 15 度の 33 G 針を備えた 10 μL シリンジを、眼辺部の 2/3 の方向に挿入します。 この図の拡大版を表示するには、ここをクリックしてください。
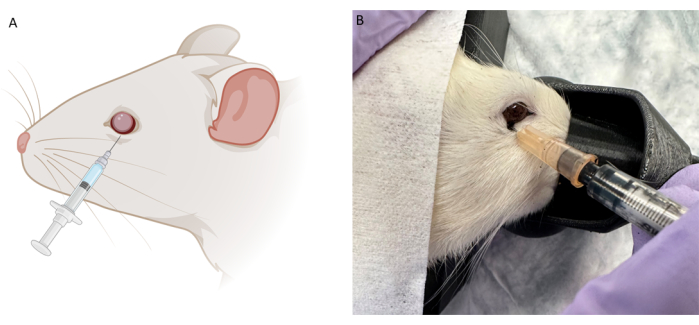
図2:球後(RB)注入技術の概略図と代表画像(A)RB注入の概略図。28Gの針が付いた0.5mLのインスリン注射器を眼窩下部縁に沿って6時から7時の角度で挿入します。針は眼球ソケットの後ろが感じられるまで進められ、注射前にわずかに引き戻されます。(B)パイロット試験中に同じ針とブラックタトゥーインクを使用したRBインジェクション技術の代表的な画像。この図の拡大版を表示するには、ここをクリックしてください。
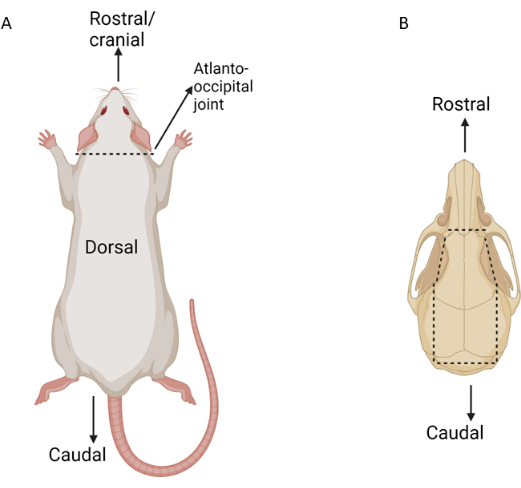
図3:眼組織分離中の主要な解剖点の概略図。 点線は切開点を示しています。(A)ラットは背側に表示され、環状後頭部の関節がマークされています。(B)背側に表示されたラットの頭蓋骨で、重要な切開痕が記載されています。 この図の拡大版を表示するには、ここをクリックしてください。
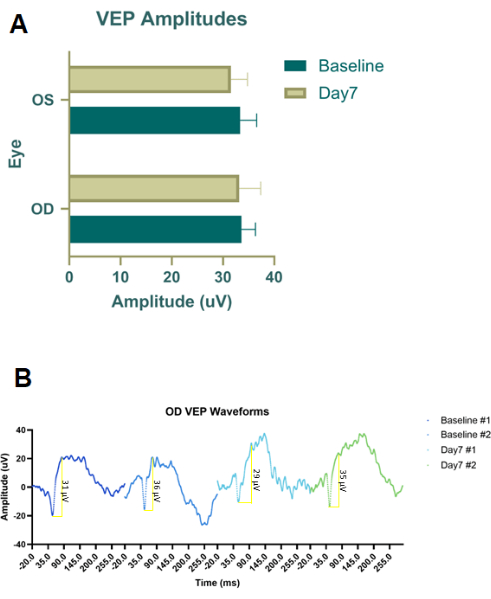
図4:RBI生理食塩水治療コホートの閃光視覚誘発電位(fVEP)。 (A)生理食塩水でRBI処理された右目(OD)およびコントロール/未治療の左目(OS)からの平均fVEP振幅。fVEP波形の振幅には、群間または眼間で有意差は認められませんでした。(B)ベースライン時および注射後7日目の生理食塩水RBI治療眼の右目(OD)fVEP波形(n = 2動物サンプル)。 この図の拡大版を表示するには、ここをクリックしてください。

図5:眼組織分離解剖後に収集されたげっ歯類の視神経乳頭(A、B)および一括眼サンプル(C)のエピ蛍光顕微鏡写真。 (A,B)無傷の視神経乳頭を動物から採取し、β-チューブリン(緑)、グリア線維性酸性タンパク質(GFAP;赤)、および核マーカーDAPI(青)のマーカーで20倍の倍率で染色しました。(C)無傷の球体と完全な視神経を示す一括眼球サンプル。 この図の拡大版を表示するには、ここをクリックしてください。
| エージェント | ルート | 網膜 | 視神経 |
| シクロスポリン | IVIの | 383 | <5 |
| シクロスポリン | 打点 | 16 | 49 |
| シクロスポリン | 局所 | NDの | NDの |
| TUDCAの | IVIの | NDの | NDの |
| TUDCAの | 打点 | NDの | NDの |
| イブディラスト | IVIの | NDの | NDの |
| イブディラスト | 打点 | NDの | <5 |
| アナキンラ | IVIの | D | NDの |
| アナキンラ | 打点 | NAの | NAの |
| ND: 検出されません | |||
| D:検出されたが定量化できなかった | |||
| NA: 利用不可 | |||
表1:治療用パイロット注射。 次の治療薬は、投与後24時間で網膜と視神経に存在するかどうか調査されました:シクロスポリン(局所、IVI、RB)、TUDCA(RBおよびIVI)、イブジラスト(RBおよびIVI)、およびアナキンラ(RBおよびIVI)。.シクロスポリンは、両方の注射経路の後に網膜と視神経の両方で検出され、RBおよびIV注射プロトコルが網膜と視神経への眼薬送達が可能であることを示しています。
ディスカッション
網膜と視神経に治療薬を送達することに関連する複雑な課題は、主にBRBによってもたらされる不透過性の障壁によるもので、この研究の重要性を強調しています3,4。IVIおよびRBI技術の探求は、これらの障害を克服するための革新的なアプローチを強調するだけでなく、眼科医療と治療法開発に対するより広範な影響も強調します。これらの知見は、IVIとRBIの両方が、罹患した眼組織に直接治療薬の標的を絞った送達を促進できることを示しています。この標的を絞ったアプローチは、全身または局所投与経路2,11では達成できないことが多い治療濃度を達成するために不可欠であり、それによってさまざまな眼疾患の治療の有効性を高めます。
これらの注射技術の比較分析は、それらのユニークな利点を明らかにします:IVIは硝子体および内側の網膜層27への直接アクセスを提供しますが、RBIはBRBの完全性を損なうことなく視神経への拡散を可能にします28。これらの洞察は、特定の治療薬を送達する最善の方法についてのより微妙な理解に貢献し、最終的には眼疾患に苦しむ患者の治療結果を改善します。ここで説明したIVIおよびRBI送達方法は、シクロスポリンなどの治療薬を重要な組織にうまく送達し、効果的な眼科治療を開発する可能性を強調しています。
さらに、この治療法の開発過程を通じて、このRBIおよびIVIプロトコルの鎮静法として吸入イソフルランが選ばれました。SALOOTは、げっ歯類に重要なサポートと安定化を提供すると同時に、吸入麻酔薬の均一な速度を可能にします。前に論じたように、RBIに関連するいくつかのリスクには、ブラインド針の挿入による眼への損傷の可能性、ならびにマウス23の眼球後注射プロトコルで概説されている圧力技術による血流の閉塞または気管虚脱が含まれる。これらのリスクを軽減するために、このプロトコルでは、眼科用鉗子を使用して動物の下まぶたをつかみ、安定化を図り、圧力技術を省略し、血流の閉塞や気管虚脱の発生を排除します。この技術はまた、針が挿入されている間、動物をよりよく制御することができます。鉗子の使用とライブ手術用顕微鏡の使用を組み合わせることで、盲目の挿入のリスクを最小限に抑えることができ、オペレーターは針の位置をよりよく視覚化できます。さらに、手術プラットフォームは重要な頭部サポートを提供し、針の挿入中に頭蓋骨が動かないようにします。また、手術用プラットフォームは、体の他の部分に対して頭部を上昇させることができるため、頭部をより水平な位置に置くことができ、また、イソフルランと酸素のフックアップを備えているため、ポジショニング中に麻酔のレベルが損なわれることはありません。IVI技術は、治療薬を硝子体液に直接注入することによりBRBを回避する独自の能力のために採用されました。この技術は、その侵襲的な性質のために眼の損傷の機会をもたらしますが、針がレンズを傷つけないように注意深く確認し、針をゆっくりと取り外し、注射後10〜15秒間眼に圧力を加えることにより、リスクは最小限に抑えられます。
このユニークな組織賦活化法により、網膜および視神経サンプルの一括除去と分析に成功しました。眼球と神経の分離が同時に達成され、視神経乳頭と全眼免疫蛍光染色によって証明されるように、視覚系全体を評価できるようになりました(図5)。この方法により、脳、視神経、球体をトップダウンで視覚化できるため、組織の全体的な構造と完全性の保存が容易になります。
この研究には、1匹の動物の性別のみの使用や比較的小さなサンプルサイズなど、潜在的な制限があります。RB注射は、治療漏れの固有の制限にも関連しています。RB注射後、治療薬は球後腔から球体の前面に移動することができます。この手法は、挿入角度を変更し、針を軌道の後ろにできるだけ近づけることにより、この固有の制限を最小限に抑えることを目的としていました。さらに、治療投与後に10〜15秒間軽い圧力を維持することが、治療薬が球後腔から移動するのを防ぐのに役立つと判断されました。
これらの方法は、小動物の外傷性眼損傷モデルにおける治療的介入のための将来の研究に利用されます。IVI法は、ニワトリやマウスで使用するために拡張されました。ただし、針のサイズと治療量を調整する必要があります。ニワトリについては、28〜29Gのインスリン針と20μLの治療量が最適であることがわかりました29が、マウスでは、31Gの針と2μLの治療容量が理想的であると判断されました。IVI技術は、他の動物への翻訳によって最小限の変更が加えられました。RBIを他の種に翻訳するには、針のサイズと量を適合させる必要がありますが、種間の固有の解剖学的違いが考慮される限り、全体的な技術は翻訳可能なままである必要があります。
小動物モデルから得られる知見は、薬物送達メカニズムの理解を深め、治療プロトコルを最適化するために非常に貴重です。最終的に、この研究は、光学治療の質を大幅に向上させる可能性のあるより効果的な治療法の基礎を築き、視力の維持と臨床診療における結果の改善に向けて前進します。
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言します。
謝辞
この研究は、米国国防総省ビジョン研究プログラム賞W81XWH-15-1-0074およびW81XWH-22-1-0989によって部分的に資金提供されました。ここに含まれる意見または主張は、著者の個人的な見解であり、公式のものとして解釈されるべきではなく、陸軍省または国防総省の見解を反映しているものとして解釈されるべきではありません。この研究助成金は、Prevent Blindness Young Investigator Student Fellowship Award for Females Scholars in Vision Researchのオハイオ支部によって部分的に支援されました。ロス財団からのご支援に感謝いたします。サービスは、P30EY032857の下でOSUビジョンサイエンスリサーチコアプログラムで行われました。オハイオ州立大学研究所および動物資源(ULAR)に感謝します。さらに、Reillyの学部生ラボのメンバーであるMichelle Mosko、Emma Lally、Sam Duckworth、Eve Howardに感謝します。また、SALOOTのデザインに貢献してくれたキム・ボンス氏、エリザベス・アーバンスキー氏、ライアン・ウェッブ氏にも感謝します。図 1、図 2A、および図 3 は BioRender.com を使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
参考文献
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved