Research Article
Desenvolvimento de modelos de camundongos para a doença de Ménétrier
Neste Artigo
Resumo
O presente estudo demonstra que camundongos MT-TGFα exibem metaplasia espasmolítica que expressa polipeptídeos (SPEM) no estômago. O vazamento do promotor impediu a demonstração de que as principais linhagens celulares são rastreadas até o SPEM. Assim, desenvolvemos adicionalmente um modelo de camundongo induzível por doxiciclina (Doxi-TGFα) e confirmamos que o SPEM é derivado de células principais.
Resumo
A doença de Ménétrier (DM) é um distúrbio gástrico pré-maligno adquirido raro caracterizado por dobras rugais gigantes, diminuição da secreção ácida e perda de proteínas. Pacientes com DM apresentam aumento da expressão de um ligante do receptor EGF (EGFR), transformando o fator de crescimento α (TGFα) no estômago. O anticorpo neutralizante do EGFR, cetuximabe, resulta em rápida melhora clínica e remissão histológica. Além desses achados, a etiologia e os mecanismos moleculares subjacentes não são bem compreendidos. A linha de camundongos transgênicos Metalotioneína (MT)-TGFα é o primeiro modelo de camundongo MD que recapitula as características histopatológicas da DM, incluindo hiperplasia foveolar e perda de células parietais. Neste modelo de camundongo, o TGFα é acionado pelo intensificador/promotor de MT induzível por metais pesados. Estudos anteriores usaram sulfato de zinco (ZnSO4) na água potável ou injeções intraperitoneais de sulfato de cádmio (CdSO4) para induzir TGFα. No entanto, descobrimos que camundongos MT-TGFα desenvolvem fenótipos sem tratamento com metais pesados, indicando vazamento do promotor. Também descobrimos que a superexpressão de TGFα suprime a expressão de Mist1, um fator de transcrição importante para a diferenciação das células principais, dificultando assim a manipulação genética nas células principais usando a linha de camundongos Mist1-CreERT2. Para superar isso, desenvolvemos um modelo de camundongo induzível (Doxi-TGFα) no qual o TGFα é induzido pelo tratamento com doxiciclina (CMV-rtTA; TetO-TGFα). Embora o modelo de camundongo Doxi-TGFα desenvolva fenótipos mais leves do que o modelo MT-TGFα, ele recapitulou características da DM, incluindo hiperplasia foveolar e perda de células parietais. Usando o modelo de camundongo Doxi-TGFα, descobrimos que a metaplasia espasmolítica que expressa polipeptídeos (SPEM) é induzida na DM, e o SPEM é derivado das células principais pelo rastreamento da linhagem usando a linha de camundongo Mist1-CreERT2. Os modelos de camundongos MT-TGFα e Doxi-TGFα oferecem modelos in vivo de DM e são úteis para investigar os mecanismos moleculares subjacentes à patogênese da DM e as opções de tratamento para a doença. Os camundongos Doxi-TGFα também serão um modelo útil para estudar os efeitos da superexpressão de TGFα em outros tecidos.
Introdução
A doença de Ménétrier (DM), também conhecida como gastropatia hipertrófica perdedora de proteínas, é uma condição pré-maligna gástrica rara. Os estômagos de pacientes com DM apresentam hiperplasia foveolar maciça, que leva ao aumento da secreção de muco gástrico, e a uma diminuição do número de células parietais, o que leva à diminuição da secreção de ácido gástrico. Além disso, a proteína é perdida seletivamente através da mucosa gástrica, o que leva à hipoalbuminemia e edema periférico 1,2,3. A patogênese da DM não era conhecida até que foi relatado que camundongos transgênicos superexpressando TGFα sob o controle do intensificador / promotor do gene da metalotioneína (MT) recapitularam os fenótipos da DM no estômago 4,5. Estômagos de pacientes com DM também mostraram expressão aumentada de TGFα, um ligante do receptor EGF (EGFR). O cetuximabe, um anticorpo anti-EGFR, foi relatado como o primeiro tratamento médico eficaz para DM, que confirmou que a ativação do EGFR pela superexpressão de TGFα contribui para a patogênese da DM 6,7.
Desde então, a linha de camundongos MT-TGFα tem sido usada como modelo de camundongo para MD. Como a expressão de TGFα é regulada pelo gene de resposta a metais pesados, intensificador / promotor de metalotioneína, sulfato de zinco (ZnSO4) na água potável ou injeções intraperitoneais de sulfato de cádmio (CdSO4) têm sido usados para induzir a expressão de TGFα 5,8. O modelo de camundongo MT-TGFα foi ainda mais caracterizado para os fenótipos de DM. Usando este modelo de camundongo, foi demonstrado que o TGFα induz a diferenciação de células foveolares de superfície secretoras de mucina enquanto inibe a diferenciação em células parietais secretoras de ácido e linhagens de células principais secretoras de pepsinogênio 9,10. Também foi demonstrado que o corpo gástrico/mucosa fúndica torna-se antralizado e que células positivas para o fator 2 do trevo (TFF2) estão presentes na base das glândulas gástricas, sugerindo que a metaplasia espasmolítica que expressa polipeptídeos (SPEM) ocorre no DM 8,11.
No estudo atual, mostramos que camundongos MT-TGFα desenvolvem características de DM sem tratamento com metais pesados. Esses fenótipos incluem perda de expressão de Mist1, um fator de transcrição que é essencial para a diferenciação das células principais e é perdido no SPEM. Devido à perda de Mist1, a linha de camundongos Mist1-CreERT212 não pôde ser utilizada junto com a linha de camundongos MT-TGFα para examinar se o SPEM em MD surge das células principais por traçado de linhagem. Com o objetivo de superar o vazamento do modelo de camundongo MT-TGFα, desenvolvemos um novo modelo de camundongo MD (CMV-rtTA13; TetO-TGFα14) onde o TGFα é induzido pelo tratamento com doxiciclina (Doxi-TGFα). Confirmamos que este modelo de mouse também exibe recursos do MD. Usando o modelo de camundongo Doxi-TGFα, mostramos que o SPEM surge das células principais por rastreamento de linhagem usando a linha de camundongo Mist1-CreERT2. Apresentamos dois modelos de camundongos MD no estudo atual. Ambos os modelos podem ser usados para investigar a patogênese e procurar potenciais alvos terapêuticos. O novo camundongo Doxi-TGFα será especialmente valioso quando a iniciação dos fenótipos de MD precisar ser controlada com precisão ou quando a modificação genética nas células principais for necessária usando a linha de camundongos Mist1-CreERT2.
Protocolo
Todos os procedimentos e criação de animais foram aprovados pelos Comitês Institucionais de Cuidados e Uso de Animais da Universidade de Yale e de acordo com os Princípios do Governo dos EUA para a Utilização e Cuidado de Animais Usados em Pesquisa, Ensino e Testes.
1. Experimentos com camundongos
- Tratamentos com camundongos
- Trate camundongos MT-TGFα (machos e fêmeas com idades entre 2 e 4 meses) com 25 mM de ZnSO4 em água potável por 2 semanas para induzir a superexpressão de TGFα.
- Tratar CMV-rtTA/+; Camundongos TetO-TGFα/+ (Doxi-TGFα) (machos e fêmeas com idades entre 2 e 4 meses) com 2 mg/mL de doxiciclina na água potável por 2 semanas para induzir a superexpressão de TGFα.
- Adicione um Mist1-CreERT2/+; R26-LSL-mTmG/+ camundongo macho ou fêmea e adicionar um camundongo Doxi-TGFα do sexo oposto na gaiola de reprodução para o rastreamento da linhagem das células principais em modelos de camundongos MD.
- Injetar Mist1-CreERT2/+; R26-LSL-mTmG/+; CMV-rtTA/+; Camundongos TetO-TGFα/+ (machos e fêmeas com idades entre 2 e 4 meses) com tamoxifeno (37,5 mg/kg) por via intraperitoneal. Injetar por 7 dias consecutivos, alternando entre os quadrantes inferiores direito e esquerdo do abdômen e evitando atingir os órgãos internos. Induza a expressão de TGFα por tratamento com doxiciclina (2 mg / mL) na água potável por 2 semanas.
NOTA: Verifique se não há lesão induzida por tamoxifeno no estômago15,16, como feito aqui contando as células parietais em camundongos selvagens com e sem tratamento com tamoxifeno (Figura Suplementar 1).
- Fixação do tecido estomacal
- Eutanásia de camundongos por overdose de isoflurano após 2 semanas de superexpressão de TGFα. Usando um frasco dessecador em uma capela de exaustão química, coloque os ratos em uma plataforma perfurada que impeça o contato direto com o anestésico líquido. Feche a tampa e monitore os camundongos até que eles não tenham respiração por mais de 60 segundos, seguido de luxação cervical.
- Dissecar o estômago cortando a junção gastroesofágica, cortando o duodeno com duodeno de 5 mm preso ao estômago e removendo todos os ligamentos peritoneais ao redor do estômago usando tesoura e fórceps (Figura 1A).
- Instilar solução salina tamponada com fosfato (PBS) usando uma seringa de 10 mL com uma ponta de pipeta presa ao lado duodenal. Aperte-o com os dedos para remover o conteúdo luminal. Repita 3x (Figura 1B).
- Encha o estômago com 2 mL de formalina a 10% usando outra seringa de 10 mL com uma ponta de pipeta acoplada. Prenda firmemente com uma pinça na junção gastroduodenal por 5-10 s enquanto remove a ponta do estômago ( Figura 1C ).
- Mergulhe o estômago inflado em formalina a 10% durante a noite a 4 °C com agitação (Figura 1D).
CUIDADO: Use equipamento de proteção adequado ao trabalhar com substâncias tóxicas, como formalina.
- Preparação do estômago para incorporação de parafina
- Corte o duodeno e o anteestômago usando uma lâmina de barbear (Figura 1E). Enxágue o tecido do estômago com PBS por 5 min, 3x com agitação.
- Corte o estômago em 3-4 anéis com a mesma espessura (3-5 mm) usando uma lâmina de barbear. Incorpore os anéis estomacais em agarose a 2% para manter a orientação. Coloque os anéis estomacais sequencialmente dos proximais para os distais, posicionando o lado da curvatura menor na mesma direção (Figura 1F).
- Coloque os anéis estomacais embebidos em agaroses em um de tecido (Figura 1G) e envie as amostras para o núcleo de histologia para inclusão em parafina17.
2. Coloração imunofluorescente
- Preparação de slides
- Aquecer as lâminas com secções de parafina num forno seco ou num bloco de calor regulado para 60 °C durante um mínimo de 1 h durante a noite. Deixe esfriar até a temperatura ambiente e coloque em uma gradinha.
- Desparafinização, reidratação e recuperação de antígenos
- Rotule dois potes de lâminas, A e B, e preencha cada um com solução Trilogy suficiente para submergir totalmente o tecido.
- Coloque o rack deslizante no frasco A e coloque os dois potes em uma panela de pressão. Coloque a panela de pressão em alta pressão por 15 min. Deixe a panela de pressão esfriar antes de abrir e recuperar as lâminas.
- Coloque imediatamente o suporte de lâminas do Frasco A no Frasco B por 2 min para garantir que a parafina seja removida das lâminas. Remova as lâminas do frasco B e coloque-as em água deionizada (DI).
NOTA: O frasco A pode ser preenchido com Trilogia usada uma vez. A Nova Trilogia deve sempre ser usada no Jar B. - Coloque as lâminas em solução salina tamponada com Tris (TBS) por 5 min antes de prosseguir com o bloqueio.
- Bloqueando coloração de fundo inespecífica
- Remova as lâminas do suporte de lâminas e bata-as lateralmente para remover o excesso de TBS.
- Desenhe uma caixa ao redor do tecido usando um marcador hidrofóbico. Aplique tampão de bloqueio para cobrir totalmente o tecido e incube por 30-60 min em uma câmara umidificada em temperatura ambiente.
- Incubação com anticorpos primários
- Selecione anticorpos primários de proteínas-alvo criadas em diferentes espécies hospedeiras e dilua em diluente de anticorpos de acordo com a recomendação do fabricante. Para este estudo, foram utilizados os seguintes anticorpos: H+/K+-ATPase, GIF, Mist118,19 e CD44v920,21. Informações detalhadas sobre os anticorpos primários podem ser encontradas na Tabela de Materiais.
- Remova o tampão de bloqueio, aplique anticorpos diluídos e coloque as lâminas de volta na câmara umidificada. Incubar durante a noite a 4 °C.
- Remova os anticorpos primários e lave as lâminas 3x em TBS por 5 min para cada lavagem.
- Anticorpos secundários e lectinas
- Escolha anticorpos secundários de acordo com a espécie hospedeira dos anticorpos primários. As lectinas podem ser misturadas com anticorpos secundários e aplicadas ao mesmo tempo.
- Diluir os anticorpos secundários e as lectinas de acordo com as recomendações do fabricante em diluente de anticorpos. Informações detalhadas de anticorpos secundários e lectinas usadas neste estudo podem ser encontradas na Tabela de Materiais.
- Aplique anticorpos secundários, lectinas e DAPI (1 μg/mL) e coloque as lâminas de volta na câmara umidificada. Incubar durante 1 h à temperatura ambiente, longe da luz.
- Remova as lâminas da câmara umidificada e enxágue 3x com TBS por 5 min para cada lavagem.
- Montagem e preparação microscópica
- Remova uma lâmina do TBS e remova o excesso de fluido batendo lateralmente na lâmina em uma toalha de papel.
- Adicione 15-20 μL de meio de montagem. Segure uma lamínula limpa pelas bordas e coloque uma borda oposta ao tecido com o meio de montagem entre elas.
- Abaixe lentamente a lamínula para que o meio seja espalhado uniformemente sobre o tecido, tomando cuidado para evitar bolhas de retenção.
- Use um lenço de limpeza de tarefas para absorver o meio de montagem excessivo nas bordas. Seque a lâmina acabada no escuro à temperatura ambiente antes de prosseguir para a microscopia. Repita esse processo para os slides restantes.
Resultados
Camundongos adultos do tipo selvagem (WT) e MT-TGFα receberam sulfato de zinco (25 mM ZnSO4) na água de beber por 2 semanas antes do sacrifício. Os estômagos dos camundongos WT pareciam normais, grosseiramente e histologicamente. Em contraste marcante, os estômagos de MT-TGFα estavam grosseiramente espessados (Figura 2A). Microscopicamente, esses estômagos mostraram hiperplasia foveolar maciça com perda de células parietais e principais (Figura 2B-D), recapitulando as características histológicas da doença de Ménétrier (DM). A perda de células principais pode ocorrer de duas maneiras diferentes: morte de células principais ou metaplasia expressadora de polipeptídeos espasmolíticos (SPEM) decorrente das células principais. Para distinguir essas duas possibilidades, realizamos o rastreamento da linhagem das células principais pelo cruzamento de Mist1-CreERT2; Camundongos R26-LSL-mTmG com camundongos MT-TGFα. Esses camundongos foram tratados primeiro com tamoxifeno em baixa dose (37,5 mg / kg por via intraperitoneal por 7 dias consecutivos) para marcar as células principais com GFP e, em seguida, com ZnSO4 na água potável para induzir a superexpressão de TGFα. Observamos células raras marcadas com GFP nos camundongos MT-TGFα (dados não mostrados). Além disso, não houve diferenças macroscópicas e histológicas nos camundongos MT-TGFα na presença ou ausência de ZnSO4 (Figura 3A-C). Uma possível explicação para esse achado foi que o TGFα pode ter reduzido a expressão de Mist1, um fator de transcrição essencial para as células principais18, e subvertido a utilidade do alelo Mist1-CreERT2. De fato, a coloração imuno-histoquímica para Mist1 foi perdida em camundongos MT-TGFα sem tratamento com ZnSO4 (Figura 3D).
Para superar o vazamento do modelo de camundongo MT-TGFα, recorremos a um modelo transgênico Doxi-TGFa induzível por doxiciclina. Isso foi conseguido cruzando camundongos TetO-TGFα14 com uma linha de camundongo CMV-rtTA13; foi relatado anteriormente que o rtTA é expresso no estômago. Confirmamos que 2 semanas de tratamento com doxiciclina induzem hiperplasia foveolar e diminuem o número de células parietais e principais neste novo modelo de camundongo MD (Figura 4A-C). Em comparação com as características histomorfológicas em camundongos MT-TGFα, os camundongos Doxi-TGFα mostraram espessura da mucosa menos grave e hiperplasia foveolar, bem como menor diminuição nas células parietais (Figura Suplementar 2). No entanto, fomos capazes de rastrear a linhagem das células principais usando a linha de camundongos Mist1-CreERT2 e confirmamos que as linhagens das células principais também são marcadas com GSII e CD44v9 20,21, confirmando que a superexpressão de TGFα induz SPEM das células principais (Figura 4D).
O presente estudo mostra que o modelo de camundongo MT-TGFα fenocopia as características histopatológicas da DM na ausência de tratamento com metais pesados, provavelmente devido ao vazamento intrínseco do promotor / intensificador e / ou à incapacidade de evitar a exposição a metais pesados (Figura 3 e Figura Suplementar 2). Como o TGFα suprime a expressão de Mist1, a linha de camundongo Mist1-CreERT2 não pode ser usada no modelo de camundongo MT-TGFα. Geramos um novo modelo de camundongo MD no qual a expressão de TGFα pode ser induzida pelo tratamento com doxiciclina. Usando este novo modelo de camundongo Doxi-TGFα MD, pudemos confirmar que a superexpressão de TGFα induz SPEM derivada de células principais. O modelo de camundongo Doxi-TGFα MD será útil quando o controle preciso da expressão de TGFα for necessário e também quando a alteração genética nas células principais for necessária usando a linha de camundongos Mist1-CreERT2.
Disponibilidade de dados:
Todos os dados brutos estão disponíveis como arquivos suplementares.
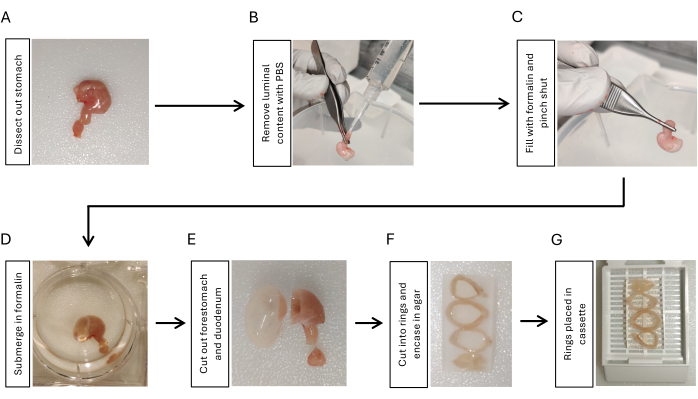
Figura 1: Fluxo de trabalho para fixação e preparação da inclusão de tecido gástrico. (A) Dissecar o estômago junto com um segmento curto (3-5 mm) do duodeno. (B) Remova o conteúdo luminal instilando PBS do duodeno usando uma seringa com uma ponta de pipeta e apertando-o com os dedos 3x. (C) Infle o estômago com formalina do duodeno usando uma seringa e aperte a junção gastroduodenal para reter a formalina. (D) Mergulhe o estômago em formalina e fixe durante a noite a 4 ° C com agitação. (E) Remova o estômago anterior e o duodeno com uma lâmina de barbear e enxágue com PBS. (F) Corte o corpo gástrico e o antro em 3-4 anéis de maneira transversal e incorpore-os em agarose a 2% para manter a orientação dos anéis de tecido estomacal. (G) Coloque o tecido embebido em agarose em. Clique aqui para ver uma versão maior desta figura.
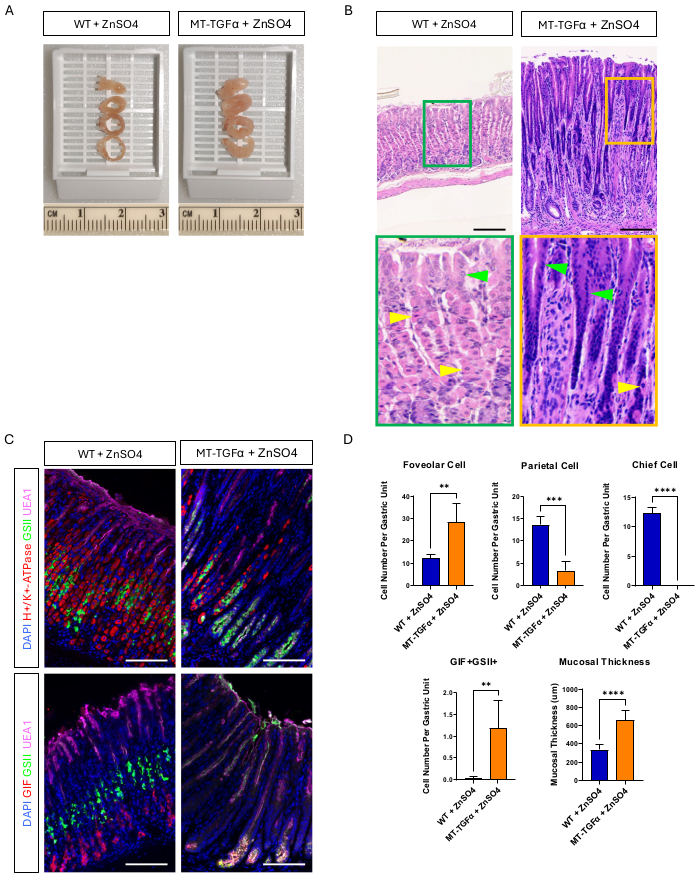
Figura 2: Fenótipos macroscópicos e microscópicos de camundongos MT-TGFα tratados com metais pesados ZnSO4. (A) A parede gástrica é mais espessa nos camundongos MT-TGFα (direita) em comparação com os camundongos controle (esquerda). (B) O estômago de camundongos MT-TGFα (à direita) mostra hiperplasia foveolar maciça e perda de células parietais. As setas amarelas indicam células parietais e as setas verdes indicam células foveolares. As barras de escala representam 100 μm. (C) A coloração imunofluorescente confirma que o estômago de camundongo MT-TGFα (direita) mostra aumento do número de células foveolares (UEA1 positivo) e células SPEM (GIF e GSII duplo positivo) e diminuição do número de células parietais (H + / K +-ATPase positiva) e células principais (GIF único positivo) em comparação com o estômago de camundongo controle (esquerda). As barras de escala representam 100 μm. (D) Quantificação de diferentes tipos de células epiteliais e espessura da mucosa em camundongos do tipo selvagem (WT) tratados com ZnSO4 (n = 5) e camundongos MT-TGFα com ZnSO4 (n = 3). As barras de erro indicam desvio padrão (**p < 0,01, ***p < 0,001, ****p < 0,0001). Clique aqui para ver uma versão maior desta figura.
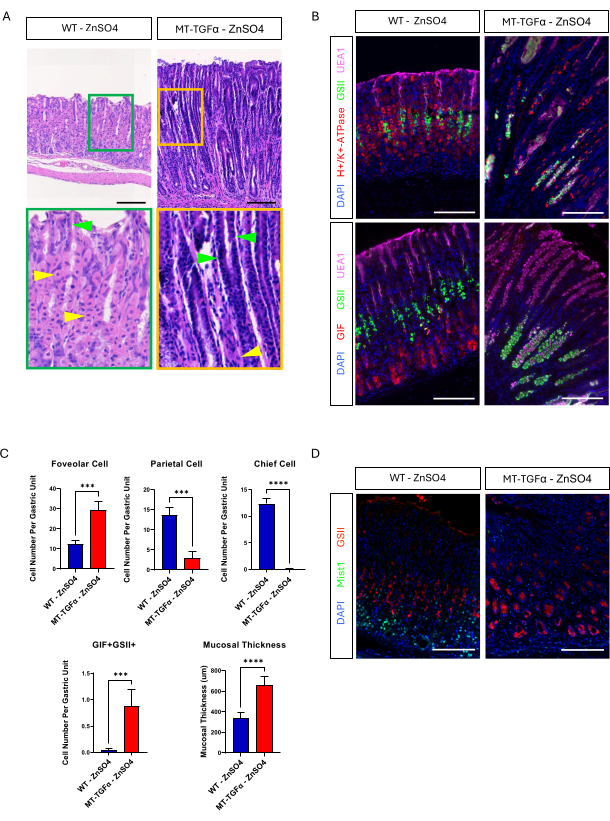
Figura 3: Camundongos MT-TGFα desenvolvem fenótipos gástricos sem tratamento com metais pesados. (A) O estômago de camundongos MT-TGFα (à direita) mostra hiperplasia foveolar maciça e perda de células parietais sem tratamento com metais pesados. As setas amarelas indicam células parietais e as setas verdes indicam células foveolares. As barras de escala representam 100 μm. (B) A coloração imunofluorescente confirma que o estômago de camundongo MT-TGFα (direita) sem tratamento com metais pesados mostra aumento do número de células foveolares (UEA1 positivo) e células SPEM (GIF e GSII duplo positivo) e diminuição do número de células parietais (H + / K +-ATPase positiva) e células principais (GIF único positivo) em comparação com o estômago de camundongo controle (esquerda). As barras de escala representam 100 μm. (C) Quantificação de diferentes tipos de células epiteliais e espessura da mucosa em camundongos WT sem ZnSO4 (n = 5) e camundongos MT-TGFα ZnSO4 (n = 3). As barras de erro indicam desvio padrão (***p < 0,001, ****p < 0,0001). (D) O estômago de camundongos MT-TGFα (direita) mostra perda da expressão de Mist1, que normalmente é expressa nas células principais (esquerda). GSII é um marcador para células mucosas do pescoço. As barras de escala representam 100 μm. Clique aqui para ver uma versão maior desta figura.
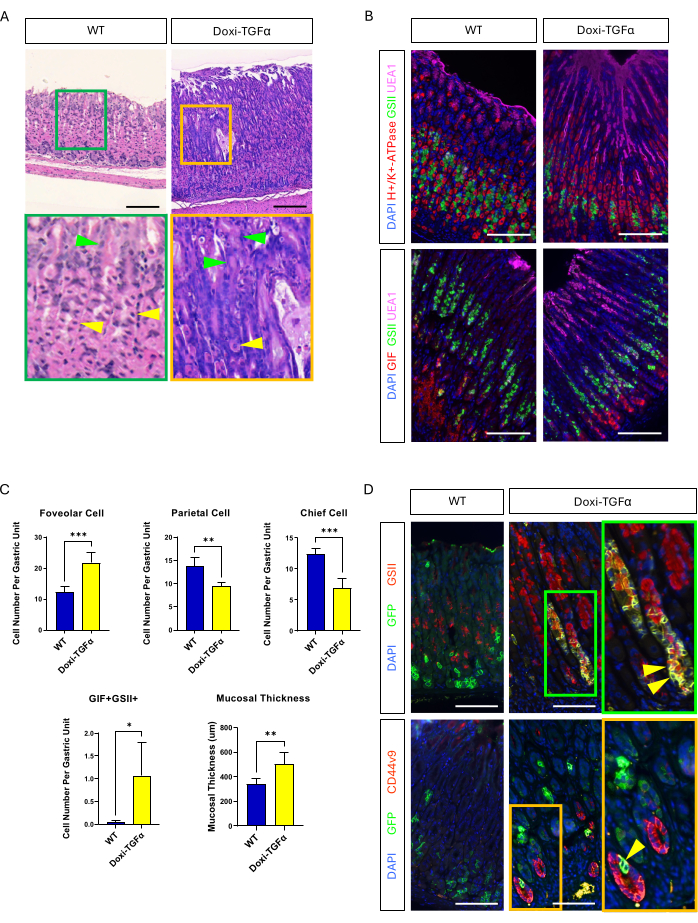
Figura 4: Modelo de camundongo TGFα induzível por doxiciclina (Doxi-TGFα) recapitula os fenótipos da doença de Ménétrier, e a formação de SPEM é confirmada neste modelo de camundongo. (A) Estômago de CMV-rtTA; Camundongos TetO-TGFα (Doxi-TGFα; direita) apresentam hiperplasia foveolar maciça e diminuição do número de células parietais. As setas amarelas indicam células parietais e as setas verdes indicam células foveolares. As barras de escala representam 100 μm. (B) A coloração imunofluorescente confirma que o estômago de camundongo Doxi-TGFα (direita) mostra aumento do número de células foveolares (UEA1 positivo) e células SPEM (GIF e GSII duplo positivo) e diminuição do número de células parietais (H + / K +-ATPase positiva) e células principais (GIF único positivo) em comparação com o estômago de camundongo controle (esquerda). As barras de escala representam 100 μm. (C) Quantificação de diferentes tipos de células epiteliais e espessura da mucosa em camundongos WT (n = 5) e camundongos Doxi-TGFα (n = 5). As barras de erro indicam desvio padrão (*p < 0,05, **p < 0,01, *** p < 0,001). (D) Rastreamento de linhagem de células principais (GFP positivo) usando Mist1-CreERT2; A linha de camundongos R26-LSL-mTmG revela que as células GFP positivas também são positivas para GSII e CD44v9 no estômago do camundongo Doxi-TGFα, confirmando a formação de SPEM derivada das células principais, enquanto o estômago de controle (à esquerda) mostra que quase nenhuma célula GFP positiva também é positiva para GSII ou CD44v9. As barras de escala representam 100 μm. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: O tratamento com tamoxifeno em baixas doses (TMX) não induz lesão da mucosa gástrica. Sete dias consecutivos de tratamento com TMX em baixas doses (37,5 mg/kg) não induzem lesão da mucosa gástrica, exemplificada pela manutenção do número de células parietais. (A) Imagens representativas de H&E sem tratamento TMX (painel esquerdo) e com tratamento TMX (painel direito). As barras de escala representam 100 μm. (B) Quantificação do número de células parietais por unidade gástrica em camundongos WT (n = 5) e WT com tratamento TMX (n = 5). Clique aqui para baixar este arquivo.
Figura suplementar 2: Comparação de fenótipos entre diferentes modelos de camundongos com doença de Ménétrier (DM). (A) Os modelos de camundongos MT-TGFα com tratamento com ZnSO4, MT-TGFα sem tratamento com ZnSO4 e Doxi-TGFα MD mostram hiperplasia foveolar, perda de células parietais e principais, aumento de células metaplasia espasmolíticas que expressam polipeptídeos (SPEM) (células co-localizadas GIF e GSII) e mucosa espessada. Não há diferenças fenotípicas entre os grupos de tratamento com MT-TGFα com e sem ZnSO4. O modelo de camundongo Doxi-TGFα mostra fenótipos menos graves do que o modelo de camundongo MT-TGFα. Clique aqui para baixar este arquivo.
Discussão
A doença de Ménétrier (DM) é um distúrbio gástrico pré-maligno raro causado pela superexpressão de TGFα 1,2,3. Camundongos transgênicos que superexpressam TGFα sob o controle do intensificador/promotor do gene metalotioneína (MT-TGFα) foram o único modelo de camundongo para DM até o momento 4,5. Como o gene da metalotioneína é responsivo a metais pesados, o sulfato de zinco é adicionado à água potável ou o sulfato de cádmio é injetado para induzir TGFα neste modelo de camundongo 5,8. Um dos fenótipos característicos da DM é a substituição das células principais na base das glândulas gástricas por células mucinosas positivas para marcadores presentes tanto nas células mucosas do pescoço quanto nas células mucinas antrais. Isso pode ocorrer pela morte das células principais ou pela reprogramação das células principais para metaplasia espasmolítica que expressa polipeptídeos (SPEM) 8 , 11 . Isso pode ser testado pelo rastreamento de linhagem de células principais em um modelo de camundongo MD. Tentamos traçar a linhagem das células principais usando o Mist1-CreERT2; Camundongos R26-LSL-mTmG nos quais as células principais positivas para Mist1 são marcadas com GFP direcionada à membrana. No entanto, observamos apenas um número limitado de células marcadas com GFP nos camundongos MT-TGFα. Isso sugere que a maioria das células principais marcadas com GFP morreu devido à superexpressão de TGFα ou a eficiência da marcação de GFP nas células principais foi muito baixa. Como foi relatado que não houve aumento na morte celular por superexpressão de TGFα8, examinamos a possibilidade de perda de expressão de Mist1 avaliando camundongos MT-TGFα sem tratamento com metais pesados. Ficamos surpresos com os fenótipos completos em camundongos MT-TGFα sem tratamento com metais pesados, incluindo hiperplasia foveolar e perda de células parietais e principais. Também confirmamos que a expressão de Mist1 é perdida em camundongos MT-TGFα, mesmo sem tratamento com metais pesados. Foi relatado anteriormente que a expressão de TGFα não foi rigorosamente controlada em camundongos MT-TGFα devido à incapacidade de eliminar a exposição a metais pesados; no entanto, a expressão de TGFα foi significativamente aumentada pelo tratamento com metais pesados8. A avaliação fenotípica abrangente não foi feita anteriormente em camundongos MT-TGFα sem tratamento com metais pesados. O estudo atual mostra que camundongos MT-TGFα desenvolvem manifestação fenotípica completa sem tratamento com metais pesados.
Como a expressão de Mist1 foi perdida nos camundongos MT-TGFα mesmo antes do tratamento com metais pesados, permaneceu a necessidade de outro modelo de camundongo no qual a expressão de TGFα é especificamente controlada para que os fenótipos não se desenvolvam sem indução de superexpressão de TGFα. Geramos um novo modelo de camundongo MD no qual a expressão de TGFα é induzida pelo tratamento com doxiciclina (Doxi-TGFα). Confirmamos que este modelo de camundongo induz hiperplasia foveolar e perda de células parietais e principais, que são os principais fenótipos de DM. Fomos capazes de rastrear a linhagem das células principais usando o Mist1-CreERT2; Camundongos R26-LSL-mTmG neste modelo de camundongo e encontraram algumas células marcadas com GFP também foram marcadas com GSII e CD44v9, confirmando que o SPEM ocorre neste novo modelo de camundongo MD. É o primeiro relato confirmando que o SPEM se desenvolve no estômago com superexpressão de TGFα. A SPEM é uma condição gástrica pré-maligna mais comum, que pode ser a razão pela qual o câncer gástrico está aumentado em pacientes com DM22,23.
Uma ressalva do uso da linha de camundongos Mist1-CreERT2 é que foi relatado que Mist1 também pode ser expresso nas células-tronco gástricas24. Descobrimos que uma dose baixa (37,5 mg/kg) de tratamento com tamoxifeno induz a ativação de Cre, mais especificamente nas células principais, com ativação mínima na região do istmo, mesmo em momentos anteriores ao tratamento com doxiciclina. Achados semelhantes foram relatados anteriormente25. Traçado de linhagem utilizando o Mist1-CreERT2; Camundongos R26-LSL-mTmG mostram células GFP positivas próximas ao marcador GFP e SPEM (GSII e CD44v9) As células duplamente positivas estão localizadas principalmente na base onde as células principais estão localizadas ( Figura 4C ). Se as células duplamente positivas do marcador GFP e SPEM forem rastreadas a partir das células-tronco, deveria haver mais células GFP-positivas em direção ao istmo onde as células-tronco estão localizadas. Alternativamente, a linha26 de camundongos GIF-rtTA induzíveis por doxiciclina ou a linha27 de camundongos GPR30-rtTA podem ser usados junto com camundongos MT-TGFα para modificações genéticas ou rastreamento de linhagem das células principais. No entanto, as células positivas para GIF são diminuídas em camundongos MT-TGFα sem tratamento com ZnSO4 ( Figura 3B, C ), e as células positivas para GPR30 são perdidas em SPEM, o que ocorre em camundongos MT-TGFα sem tratamento com ZnSO4. Portanto, eles serão menos eficientes em comparação com camundongos Doxi-TGFα cruzados com a linha de camundongos Mist1-CreERT2.
O estudo atual mostra que camundongos MT-TGFα desenvolvem alterações fenotípicas completas no estômago sem tratamento com metais pesados. Também mostramos que um dos fenótipos é a perda da expressão de Mist1 e isso impede o uso do Mist1-CreERT2; Linha de camundongo R26-LSL-mTmG para células principais de rastreamento de linhagem. Geramos um novo modelo de camundongo MD, Doxi-TGFα, e confirmamos pela primeira vez que o SPEM se desenvolve em MD usando esse modelo de camundongo. Este novo modelo de camundongo MD será útil quando o controle preciso do desenvolvimento dos fenótipos MD for necessário e quando forem necessárias modificações genéticas nas células principais usando a linha de camundongos Mist1-CreERT2. Os fenótipos de MD são induzidos pela ativação da sinalização EGFR pela superexpressão de TGFα. No entanto, não se sabe a ativação do EGFR em quais tipos celulares são responsáveis pelos fenótipos observados. Usando o modelo de camundongo Doxi-TGFα, estamos atualmente investigando o papel da sinalização EGFR em diferentes tipos de células, incluindo células principais utilizando a linha de camundongos Mist1-CreERT2.
Divulgações
Todos os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Diabetes e Doenças Digestivas e Renais (K08 DK124686 para WJH). Agradecemos a Gina Della Porta e Sarah E. Glass pela edição do manuscrito.
Contribuição do autor:
O TTG realizou experimentos, gerou figuras, escreveu o manuscrito e editou o manuscrito. JDP realizou experimentos, gerou figuras, escreveu o manuscrito e editou o manuscrito. A SKM forneceu a linha de camundongos TetO-TGFα e editou o manuscrito. RJC concebeu experimentos e editou o manuscrito. WJH concebeu experimentos, realizou experimentos, interpretou dados, pesquisou a literatura, escreveu o manuscrito e editou o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Referências
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados