Research Article
Développement de modèles murins pour la maladie de Ménétrier
Dans cet article
Résumé
L’étude actuelle démontre que les souris MT-TGFα présentent une métaplasie exprimant le polypeptide spasmolytique (SPEM) dans l’estomac. La fuite du promoteur a empêché de démontrer que les principales lignées cellulaires sont retracées jusqu’à SPEM. Ainsi, nous avons également développé un modèle de souris inductible par la doxycycline (Doxi-TGFα) et confirmé que SPEM est dérivé des cellules principales.
Résumé
La maladie de Ménétrier (DM) est une maladie gastrique précancéreuse acquise rare caractérisée par des plis rugaux géants, une diminution de la sécrétion d’acide et une perte de protéines. Les patients atteints de DM présentent une expression accrue d’un ligand du récepteur EGF (EGFR), transformant le facteur de croissance α (TGFα) dans l’estomac. L’anticorps neutralisant l’EGFR, le cetuximab, entraîne une amélioration clinique rapide et une rémission histologique. Au-delà de ces résultats, l’étiologie et les mécanismes moléculaires sous-jacents ne sont pas bien compris. La lignée de souris transgéniques Metallothionein (MT)-TGFα est le premier modèle de souris MD qui récapitule les caractéristiques histopathologiques de la MD, y compris l’hyperplasie fovéolaire et la perte de cellules pariétales. Dans ce modèle murin, le TGFα est piloté par l’amplificateur/promoteur MT inductible par les métaux lourds. Des études antérieures ont utilisé du sulfate de zinc (ZnSO4) dans l’eau potable ou des injections intrapéritonéales de sulfate de cadmium (CdSO4) pour induire le TGFα. Cependant, nous avons constaté que les souris MT-TGFα développent des phénotypes sans traitement aux métaux lourds, indiquant une fuite du promoteur. Nous avons également constaté que la surexpression de TGFα supprime l’expression de Mist1, un facteur de transcription important pour la différenciation des cellules principales, entravant ainsi la manipulation génétique dans les cellules principales à l’aide de la lignée de souris Mist1-CreERT2. Pour pallier à cela, nous avons développé un modèle murin inductible (Doxi-TGFα) dans lequel le TGFα est induit par le traitement à la doxycycline (CMV-rtTA ; TetO-TGFα). Bien que le modèle murin Doxi-TGFα développe des phénotypes plus légers que le modèle MT-TGFα, il a récapitulé les caractéristiques de la DM, notamment l’hyperplasie fovéolaire et la perte de cellules pariétales. En utilisant le modèle murin Doxi-TGFα, nous avons constaté que la métaplasie exprimant le polypeptide spasmolytique (SPEM) est induite dans la DM, et que la SPEM est dérivée des cellules principales par traçage de lignée à l’aide de la lignée de souris Mist1-CreERT2. Les modèles murins MT-TGFα et Doxi-TGFα offrent des modèles in vivo de la DM et sont utiles pour étudier les mécanismes moléculaires sous-jacents à la pathogenèse de la MD et les options de traitement de la maladie. Les souris Doxi-TGFα seront également un modèle utile pour étudier les effets de la surexpression de TGFα dans d’autres tissus.
Introduction
La maladie de Ménétrier (DM), également connue sous le nom de gastropathie hypertrophique perdant des protéines, est une maladie précancéreuse gastrique rare. L’estomac des patients atteints de DM présente une hyperplasie fovéolaire massive, qui entraîne une augmentation de la sécrétion de mucus gastrique, et une diminution du nombre de cellules pariétales, ce qui entraîne une diminution de la sécrétion d’acide gastrique. De plus, les protéines sont perdues de manière sélective à travers la muqueuse gastrique, ce qui entraîne une hypoalbuminémie et un œdème périphérique 1,2,3. La pathogenèse de la DM n’était pas connue jusqu’à ce qu’il soit rapporté que des souris transgéniques surexprimant le TGFα sous le contrôle de l’amplificateur/promoteur du gène de la métallothionéine (MT) récapitulaient les phénotypes de la DM dans l’estomac 4,5. Les estomacs de patients atteints de DM ont également montré une expression accrue du TGFα, un ligand du récepteur de l’EGF (EGFR). Le cetuximab, un anticorps anti-EGFR, a été signalé comme le premier traitement médical efficace pour la DM, ce qui a confirmé que l’activation de l’EGFR par la surexpression du TGFα contribue à la pathogenèse de la MD 6,7.
Depuis lors, la gamme de souris MT-TGFα a été utilisée comme modèle de souris pour la DM. Parce que l’expression du TGFα est régulée par le gène de la réponse aux métaux lourds, l’amplificateur/promoteur de la métallothionéine, le sulfate de zinc (ZnSO4) dans l’eau potable ou des injections intrapéritonéales de sulfate de cadmium (CdSO4) ont été utilisés pour induire l’expression du TGFα 5,8. Le modèle murin MT-TGFα a été caractérisé pour les phénotypes de la DM. En utilisant ce modèle murin, il a été démontré que le TGFα induit la différenciation des cellules fovéolaires de surface sécrétant de la mucine tandis qu’il inhibe la différenciation en cellules pariétales sécrétant de l’acide et en lignées cellulaires principales sécrétant du pepsinogène 9,10. Il a également été démontré que le corps gastrique/muqueuse fundique devient antralisé et que des cellules positives au facteur de trèfle 2 (TFF2) sont présentes à la base des glandes gastriques, ce qui suggère qu’une métaplasie spasmolytique exprimant des polypeptides (SPEM) se produit dans la DM 8,11.
Dans la présente étude, nous montrons que des souris MT-TGFα développent des caractéristiques de la DM sans traitement aux métaux lourds. Ces phénotypes comprennent la perte d’expression de Mist1, un facteur de transcription essentiel à la différenciation cellulaire principale et qui est perdu dans SPEM. En raison de la perte de Mist1, la lignée de souris Mist1-CreERT212 n’a pas pu être utilisée avec la lignée de souris MT-TGFα pour examiner si SPEM dans MD provient des cellules principales par traçage de lignée. Dans le but de surmonter la fuite du modèle murin MT-TGFα, nous avons développé un nouveau modèle murin MD (CMV-rtTA13 ; TetO-TGFα14) où le TGFα est induit par le traitement à la doxycycline (Doxi-TGFα). Nous avons confirmé que ce modèle de souris affiche également les fonctionnalités de MD. En utilisant le modèle murin Doxi-TGFα, nous montrons que SPEM provient des cellules principales par traçage de lignée en utilisant la lignée de souris Mist1-CreERT2. Nous introduisons deux modèles de souris DM dans l’étude actuelle. Les deux modèles peuvent être utilisés pour étudier la pathogenèse et pour rechercher des cibles thérapeutiques potentielles. La nouvelle souris Doxi-TGFα sera particulièrement précieuse lorsque l’initiation des phénotypes MD doit être contrôlée avec précision ou lorsque la modification génétique des cellules principales est nécessaire à l’aide de la lignée de souris Mist1-CreERT2.
Protocole
Tous les élevages et procédures ont été approuvés par les comités institutionnels de protection et d’utilisation des animaux de l’Université Yale et conformément aux principes du gouvernement américain pour l’utilisation et le soin des animaux utilisés dans la recherche, l’enseignement et les tests.
1. Expériences sur des souris
- Traitements chez la souris
- Traiter les souris MT-TGFα (mâles et femelles âgées de 2 à 4 mois) avec 25 mM de ZnSO4 dans l’eau potable pendant 2 semaines pour induire la surexpression du TGFα.
- Traiter le CMV-rtTA/+ ; Souris TetO-TGFα/+ (Doxi-TGFα) (mâles et femelles âgées de 2 à 4 mois) avec 2 mg/mL de doxycycline dans l’eau potable pendant 2 semaines pour induire une surexpression du TGFα.
- Ajouter un Mist1-CreERT2/+ ; souris mâle ou femelle R26-LSL-mTmG/+ et ajouter une souris Doxi-TGFα du sexe opposé dans la cage d’élevage pour le traçage de la lignée des cellules principales dans les modèles de souris MD.
- Injecter Mist1-CreERT2/+ ; R26-LSL-mTmG/+ ; CMV-rtTA/+ ; Souris TetO-TGFα/+ (mâles et femelles âgées de 2 à 4 mois) avec du tamoxifène (37,5 mg/kg) par voie intrapéritonéale. Injectez pendant 7 jours consécutifs, en alternant entre les quadrants inférieurs droit et gauche de l’abdomen et en évitant de toucher les organes internes. Induire l’expression du TGFα par un traitement à la doxycycline (2 mg/mL) dans l’eau potable pendant 2 semaines.
REMARQUE :Vérifiez qu’il n’y a pas de lésion induite par le tamoxifène dans l’estomac15,16, comme cela est fait ici en comptant les cellules pariétales chez les souris de type sauvage avec et sans traitement au tamoxifène (Figure supplémentaire 1).
- Fixation des tissus de l’estomac
- Euthanasier des souris par surdosage d’isoflurane après 2 semaines de surexpression du TGFα. À l’aide d’un bocal de dessiccateur dans une hotte chimique, placez les souris sur une plate-forme perforée qui empêche tout contact direct avec l’anesthésique liquide. Fermez le couvercle et surveillez les souris jusqu’à ce qu’elles ne puissent plus respirer pendant plus de 60 secondes, suivi d’une luxation cervicale.
- Disséquez l’estomac en coupant à la jonction gastro-œsophagienne, en coupant le duodénum avec un duodénum de 5 mm attaché à l’estomac et en enlevant tous les ligaments péritonéaux autour de l’estomac à l’aide de ciseaux et de pinces (Figure 1A).
- Instiller une solution saline tamponnée au phosphate (PBS) à l’aide d’une seringue de 10 mL avec une pointe de pipette fixée sur le côté duodénal. Pressez-le avec les doigts pour éliminer le contenu luminal. Répétez l’opération 3 fois (Figure 1B).
- Gonflez l’estomac avec 2 ml de formol à 10 % à l’aide d’une autre seringue de 10 ml munie d’un embout de pipette. Clamper fermement avec une pince au niveau de la jonction gastroduodénale pendant 5 à 10 s tout en retirant l’extrémité de l’estomac (Figure 1C).
- Immerger l’estomac gonflé dans du formol à 10 % pendant la nuit à 4 °C en agitant (figure 1D).
ATTENTION : Utilisez un équipement de protection approprié lorsque vous travaillez avec des substances toxiques telles que le formol.
- Préparation de l’estomac pour l’enrobage de paraffine
- Découpez le duodénum et le préestomac à l’aide d’une lame de rasoir (Figure 1E). Rincez les tissus de l’estomac avec du PBS pendant 5 min, 3x en secouant.
- Coupez l’estomac en 3-4 anneaux de la même épaisseur (3-5 mm) à l’aide d’une lame de rasoir. Intégrez les anneaux abdominaux dans de l’agarose à 2 % pour maintenir l’orientation. Placez les anneaux abdominaux séquentiellement de l’anneau proximal à l’anneau distal en positionnant le côté de la petite courbure dans la même direction (Figure 1F).
- Placez les anneaux gastriques intégrés dans les agaroses dans une cassette de tissus (figure 1G) et soumettez les échantillons à la plateforme d’histologie pour l’incorporation de paraffine17.
2. Coloration immunofluorescente
- Préparation des lames
- Chauffez des lames avec des sections de paraffine dans un four sec ou sur un bloc de chaleur réglé à 60 °C pendant au moins 1 h à toute la nuit. Laisser refroidir à température ambiante et placer dans une grille à glissières.
- Déparaffinisation, réhydratation et récupération d’antigènes
- Étiquetez deux bocaux de diapositives, A et B, et remplissez chacun d’eux avec suffisamment de solution Trilogy pour immerger complètement les tissus.
- Placez la grille coulissante dans le bocal A et mettez les deux bocaux dans un autocuiseur. Réglez l’autocuiseur à haute pression pendant 15 min. Laissez l’autocuiseur refroidir avant d’ouvrir et de récupérer les lames.
- Placez immédiatement la grille à lames du pot A dans le pot B pendant 2 minutes pour vous assurer que la paraffine est retirée des lames. Retirez les lames du bocal B et placez-les dans de l’eau déminéralisée (DI).
REMARQUE : Le pot A peut être rempli de Trilogy utilisé une fois. La nouvelle trilogie doit toujours être utilisée dans le bocal B. - Placez les lames dans une solution saline tamponnée en Tris (TBS) pendant 5 min avant de procéder au blocage.
- Blocage des taches de fond non spécifiques
- Retirez les diapositives du support de diapositives et tapotez-les latéralement pour éliminer l’excès de TBS.
- Dessinez une boîte autour du tissu à l’aide d’un marqueur hydrophobe. Appliquez un tampon de blocage pour couvrir complètement le tissu et incubez pendant 30 à 60 minutes dans une chambre humidifiée à température ambiante.
- Incubation avec des anticorps primaires
- Sélectionner les anticorps primaires des protéines cibles élevées chez différentes espèces hôtes et les diluer dans un diluant d’anticorps selon les recommandations du fabricant. Pour cette étude, les anticorps suivants ont été utilisés : H+/K+-ATPase, GIF, Mist118,19 et CD44v920,21. Des informations détaillées sur les anticorps primaires se trouvent dans le tableau des matières.
- Retirez le tampon de blocage, appliquez des anticorps dilués et remettez les lames dans la chambre humidifiée. Incuber toute la nuit à 4 °C.
- Retirez les anticorps primaires et lavez les lames 3 fois dans TBS pendant 5 minutes à chaque lavage.
- Anticorps secondaires et lectines
- Choisissez des anticorps secondaires en fonction de l’espèce hôte des anticorps primaires. Les lectines peuvent être mélangées avec des anticorps secondaires et appliquées en même temps.
- Diluer les anticorps secondaires et les lectines selon les recommandations du fabricant dans un diluant d’anticorps. Des informations détaillées sur les anticorps secondaires et les lectines utilisés dans cette étude se trouvent dans la table des matières.
- Appliquez des anticorps secondaires, des lectines et du DAPI (1 μg/mL) et replacez les lames dans la chambre humidifiée. Incuber 1 h à température ambiante à l’abri de la lumière.
- Retirez les lames de la chambre humidifiée et rincez-les 3 fois avec du TBS pendant 5 minutes à chaque lavage.
- Montage et préparation de la microscopie
- Retirez une diapositive du TBS et retirez l’excès de liquide en tapotant la diapositive sur le côté sur une serviette en papier.
- Ajouter 15-20 μL de support de montage. Tenez une lamelle propre par les bords et placez un bord opposé au mouchoir avec le support de montage entre les deux.
- Abaissez lentement la lamelle de manière à ce que le milieu soit réparti uniformément sur le tissu, en prenant soin d’éviter de piéger les bulles.
- Utilisez une lingette de travail pour absorber l’excès de support de montage sur les bords. Séchez la lame finie à l’obscurité à température ambiante avant de passer à la microscopie. Répétez ce processus pour les autres diapositives.
Résultats
Des souris adultes de type sauvage (WT) et MT-TGFα ont reçu du sulfate de zinc (25 mM ZnSO4) dans l’eau de boisson pendant 2 semaines avant le sacrifice. L’estomac des souris WT semblait normal, grossièrement et histologiquement. En contraste marqué, les estomacs de MT-TGFα étaient grossièrement épaissis (Figure 2A). Au microscope, ces estomacs présentaient une hyperplasie fovéolaire massive avec perte des cellules pariétales et principales (Figure 2B-D), récapitulant les caractéristiques histologiques de la maladie de Ménétrier (DM). La perte des cellules principales peut se produire de deux manières différentes : la mort des cellules principales ou la métaplasie spasmolytique exprimant des polypeptides (SPEM) résultant des cellules principales. Pour distinguer ces deux possibilités, nous avons effectué un traçage de lignée des cellules principales en croisant Mist1-CreERT2 ; Souris R26-LSL-mTmG avec souris MT-TGFα. Ces souris ont d’abord été traitées avec du tamoxifène à faible dose (37,5 mg/kg par voie intrapéritonéale pendant 7 jours consécutifs) pour marquer les cellules principales avec la GFP, puis avec du ZnSO4 dans l’eau de boisson pour induire la surexpression du TGFα. Nous avons observé de rares cellules marquées à la GFP chez les souris MT-TGFα (données non présentées). De plus, il n’y avait pas de différences macroscopiques et histologiques chez les souris MT-TGFα en présence ou en absence de ZnSO4 (figure 3A-C). Une explication possible de cette découverte est que le TGFα pourrait avoir réduit l’expression de Mist1, un facteur de transcription essentiel pour les cellules principales18, et subverti l’utilité de l’allèle Mist1-CreERT2. En fait, la coloration immunohistochimique de Mist1 a été perdue chez les souris MT-TGFα sans traitement au ZnSO4 (Figure 3D).
Pour surmonter la fuite du modèle murin MT-TGFα, nous nous sommes tournés vers un modèle transgénique Doxi-TGFa inductible par la doxycycline. Ceci a été réalisé en croisant des souris TetO-TGFα14 avec une souris CMV-rtTA lignée13 ; il a été rapporté précédemment que le RTTA est exprimé dans l’estomac. Nous avons confirmé que 2 semaines de traitement à la doxycycline induisent une hyperplasie fovéolaire et une diminution du nombre de cellules pariétales et principales dans ce nouveau modèle murin de DM (Figure 4A-C). Par rapport aux caractéristiques histomorphologiques chez les souris MT-TGFα, les souris Doxi-TGFα ont montré une épaisseur muqueuse et une hyperplasie fovéolaire moins sévères, ainsi qu’une diminution moins importante des cellules pariétales (Figure supplémentaire 2). Néanmoins, nous avons été en mesure de tracer la lignée des cellules principales en utilisant la lignée de souris Mist1-CreERT2 et avons confirmé que les lignées cellulaires principales sont également marquées avec GSII et CD44v920,21, confirmant que la surexpression de TGFα induit SPEM à partir des cellules principales (Figure 4D).
La présente étude montre que le modèle murin MT-TGFα phénocopie les caractéristiques histopathologiques de la DM en l’absence de traitement aux métaux lourds, probablement en raison de la fuite intrinsèque du promoteur/activateur et/ou de l’incapacité d’éviter l’exposition aux métaux lourds (Figure 3 et Figure supplémentaire 2). Étant donné que TGFα supprime l’expression de Mist1, la lignée de souris Mist1-CreERT2 ne peut pas être utilisée dans le modèle de souris MT-TGFα. Nous avons généré un nouveau modèle murin MD dans lequel l’expression du TGFα peut être induite par le traitement à la doxycycline. En utilisant ce nouveau modèle murin Doxi-TGFα MD, nous avons pu confirmer que la surexpression de TGFα induit des SPEM dérivés des cellules principales. Le modèle murin Doxi-TGFα MD sera utile lorsqu’un contrôle précis de l’expression de TGFα est nécessaire et également lorsqu’une altération génétique dans les cellules principales est nécessaire à l’aide de la lignée de souris Mist1-CreERT2.
Disponibilité des données :
Toutes les données brutes sont disponibles sous forme de fichiers supplémentaires.
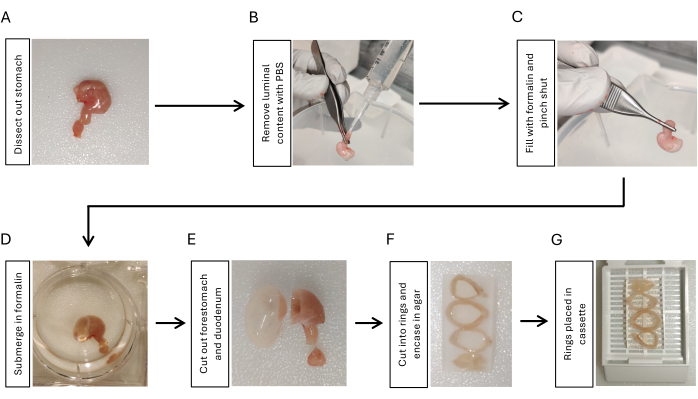
Figure 1 : Déroulement de la fixation et de la préparation de l’enrobage du tissu gastrique. (A) Disséquer l’estomac avec un court segment (3-5 mm) du duodénum. (B) Éliminez le contenu luminal en instillant du PBS du duodénum à l’aide d’une seringue avec une pointe de pipette et en le pressant avec les doigts 3x. (C) Gonflez l’estomac avec du formol du duodénum à l’aide d’une seringue et pincez la jonction gastroduodénale pour retenir le formol. (D) Immerger l’estomac dans du formol et fixer pendant la nuit à 4 °C en agitant. (E) Retirez le préestomac et le duodénum avec une lame de rasoir et rincez avec du PBS. (F) Coupez le corps gastrique et l’antre en 3-4 anneaux de manière transversale et intégrez-les dans de l’agarose à 2 % pour maintenir l’orientation des anneaux de tissu gastrique. (G) Placez le tissu incrusté d’agarose dans des cassettes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
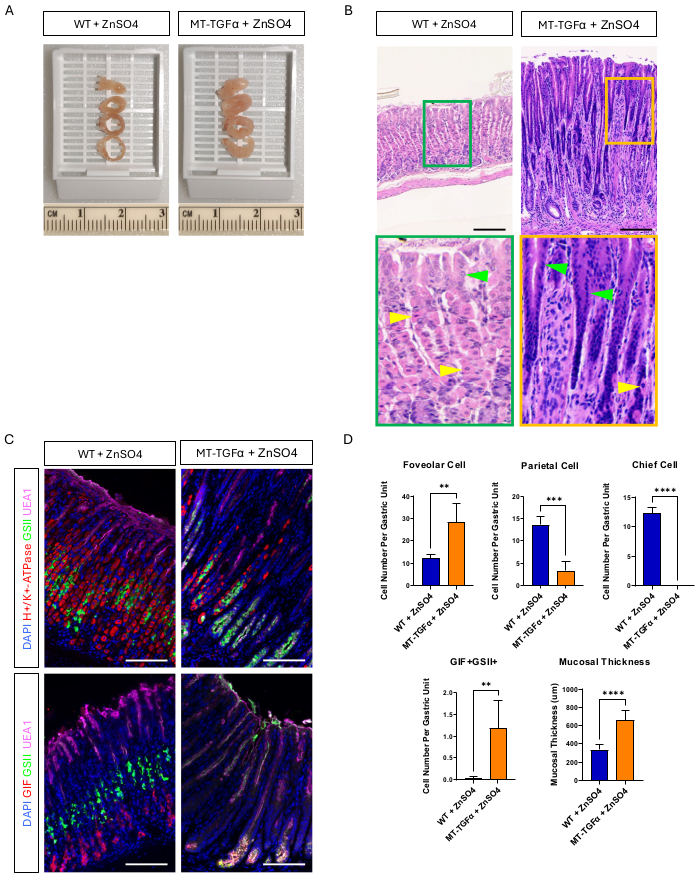
Figure 2 : Phénotypes macroscopiques et microscopiques de souris MT-TGFα traitées avec du ZnSO4, un métal lourd. (A) La paroi gastrique est plus épaisse chez les souris MT-TGFα (à droite) par rapport aux souris témoins (à gauche). (B) L’estomac de souris MT-TGFα (à droite) montre une hyperplasie fovéolaire massive et une perte de cellules pariétales. Les pointes de flèches jaunes indiquent les cellules pariétales et les pointes de flèches vertes indiquent les cellules fovéolaires. Les barres d’échelle représentent 100 μm. (C) La coloration immunofluorescente confirme que l’estomac de souris MT-TGFα (à droite) présente un nombre accru de cellules fovéolaires (UEA1 positives) et de cellules SPEM (GIF et GSII double positifs) et une diminution du nombre de cellules pariétales (H+/K+-ATPase positives) et de cellules principales (GIF simple positif) par rapport à l’estomac de souris témoins (à gauche). Les barres d’échelle représentent 100 μm. (D) Quantification de différents types de cellules épithéliales et de l’épaisseur de la muqueuse chez des souris de type sauvage (WT) traitées avec du ZnSO4 (n = 5) et des souris MT-TGFα avec du ZnSO4 (n = 3). Les barres d’erreur indiquent l’écart-type (**p < 0,01, ***p < 0,001, ****p < 0,0001). Veuillez cliquer ici pour voir une version agrandie de cette figure.
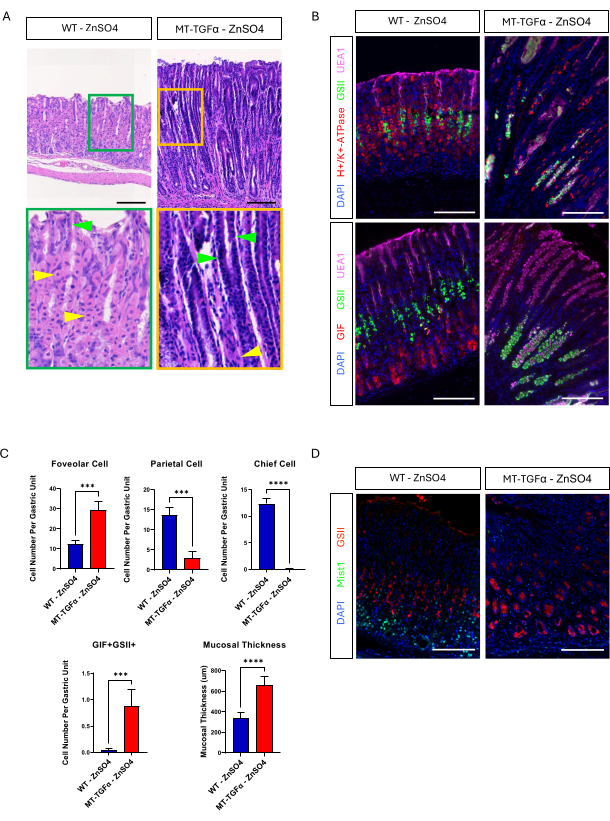
Figure 3 : Les souris MT-TGFα développent des phénotypes gastriques sans traitement aux métaux lourds. (A) L’estomac de souris MT-TGFα (à droite) montre une hyperplasie fovéolaire massive et une perte de cellules pariétales sans traitement aux métaux lourds. Les pointes de flèches jaunes indiquent les cellules pariétales et les pointes de flèches vertes indiquent les cellules fovéolaires. Les barres d’échelle représentent 100 μm. (B) La coloration immunofluorescente confirme que l’estomac de souris MT-TGFα (à droite) sans traitement aux métaux lourds montre une augmentation du nombre de cellules fovéolaires (UEA1 positive) et de cellules SPEM (GIF et GSII double positif), et une diminution du nombre de cellules pariétales (H+/K+-ATPase positive) et de cellules principales (GIF simple positif) par rapport à l’estomac de souris témoin (à gauche). Les barres d’échelle représentent 100 μm. (C) Quantification de différents types de cellules épithéliales et de l’épaisseur de la muqueuse chez des souris WT sans ZnSO4 (n = 5) et des souris MT-TGFα ZnSO4 (n = 3). Les barres d’erreur indiquent l’écart-type (***p < 0,001, ****p < 0,0001). (D) L’estomac de souris MT-TGFα (à droite) montre une perte d’expression de Mist1, qui est normalement exprimée dans les cellules principales (à gauche). GSII est un marqueur des cellules muqueuses du cou. Les barres d’échelle représentent 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
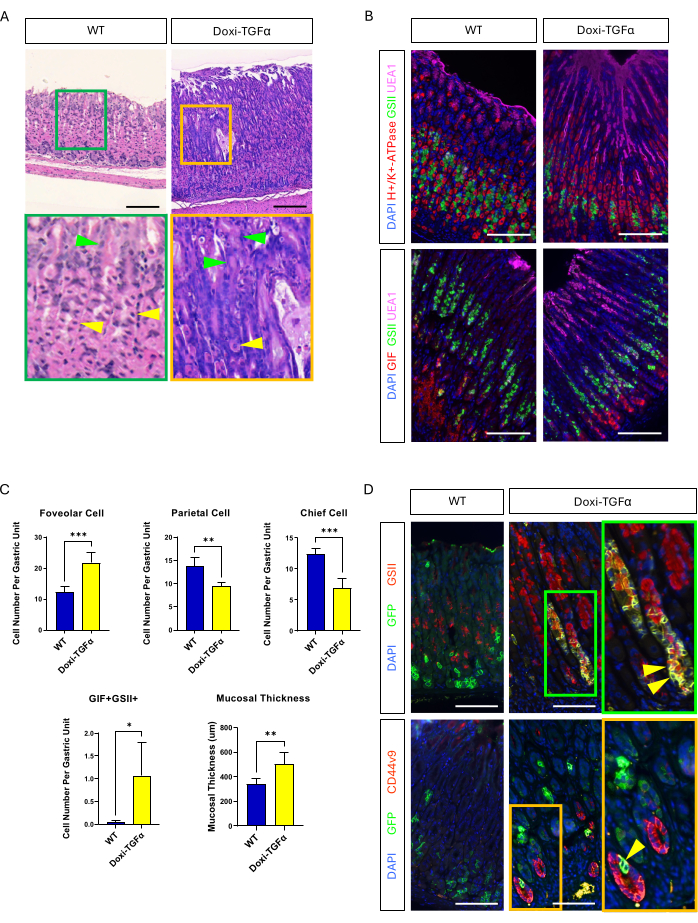
Figure 4 : Le modèle murin de TGFα inductible par la doxycycline (Doxi-TGFα) récapitule les phénotypes de la maladie de Ménétrier, et la formation de SPEM est confirmée dans ce modèle murin. (A) Estomac de CMV-rtTA ; Les souris TetO-TGFα (Doxi-TGFα ; à droite) présentent une hyperplasie fovéolaire massive et une diminution du nombre de cellules pariétales. Les pointes de flèches jaunes indiquent les cellules pariétales et les pointes de flèches vertes indiquent les cellules fovéolaires. Les barres d’échelle représentent 100 μm. (B) La coloration immunofluorescente confirme que l’estomac de souris Doxi-TGFα (à droite) montre une augmentation du nombre de cellules fovéolaires (UEA1 positive) et de cellules SPEM (GIF et GSII double positif), et une diminution du nombre de cellules pariétales (H+/K+-ATPase positive) et de cellules principales (GIF simple positif) par rapport à l’estomac de souris témoin (à gauche). Les barres d’échelle représentent 100 μm. (C) Quantification de différents types de cellules épithéliales et de l’épaisseur de la muqueuse chez les souris WT (n = 5) et les souris Doxi-TGFα (n = 5). Les barres d’erreur indiquent l’écart-type (*p < 0,05, **p < 0,01, ***p < 0,001). (D) Traçage de la lignée des cellules principales (GFP positive) à l’aide de Mist1-CreERT2 ; La lignée de souris R26-LSL-mTmG révèle que les cellules GFP positives sont également positives pour GSII et CD44v9 dans l’estomac de souris Doxi-TGFα, confirmant la formation de SPEM dérivée des cellules principales, tandis que l’estomac témoin (à gauche) montre presque aucune cellule GFP positive également positive pour GSII ou CD44v9. Les barres d’échelle représentent 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Le traitement à faible dose de tamoxifène (TMX) n’induit pas de lésions de la muqueuse gastrique. Sept jours consécutifs de traitement par TMX à faible dose (37,5 mg/kg) n’induisent pas de lésions de la muqueuse gastrique, comme en témoigne le maintien du nombre de cellules pariétales. (A) Images H&E représentatives sans traitement TMX (panneau de gauche) et avec traitement TMX (panneau de droite). Les barres d’échelle représentent 100 μm. (B) Quantification du nombre de cellules pariétales par unité gastrique chez les souris WT (n = 5) et WT avec traitement TMX (n = 5). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Comparaison des phénotypes entre différents modèles murins de la maladie de Ménétrier (DM). (A) Les modèles murins MT-TGFα avec traitement au ZnSO4, MT-TGFα sans traitement au ZnSO4 et Doxi-TGFα MD présentent une hyperplasie fovéolaire, une perte de cellules pariétales et principales, une augmentation des cellules de métaplasie exprimant des polypeptides spasmolytiques (cellules co-localisées GIF et GSII) et une muqueuse épaissie. Il n’y a pas de différences phénotypiques entre les groupes MT-TGFα avec et sans traitement au ZnSO4. Le modèle murin Doxi-TGFα présente des phénotypes moins sévères que le modèle murin MT-TGFα. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La maladie de Ménétrier (DM) est une maladie gastrique précancéreuse rare causée par une surexpression 1,2,3 du TGFα. Les souris transgéniques surexprimant le TGFα sous le contrôle de l’amplificateur/promoteur du gène de la métallothionéine (MT-TGFα) ont été le seul modèle murin de DM à ce jour 4,5. Parce que le gène de la métallothionéine est sensible aux métaux lourds, du sulfate de zinc est ajouté à l’eau potable, ou du sulfate de cadmium est injecté pour induire le TGFα dans ce modèle de souris 5,8. L’un des phénotypes caractéristiques de la MD est le remplacement des cellules principales à la base des glandes gastriques par des cellules mucineuses positives pour les marqueurs présents à la fois dans les cellules muqueuses du cou et les cellules de mucine antrale. Cela peut se produire soit par la mort des cellules principales, soit par la reprogrammation des cellules principales en métaplasie exprimant les polypeptides spasmolytiques (SPEM)8,11. Cela peut être testé par le traçage de la lignée des cellules principales dans un modèle de souris MD. Nous avons essayé de tracer la lignée des cellules principales à l’aide du Mist1-CreERT2 ; Souris R26-LSL-mTmG chez lesquelles les cellules principales positives à Mist1 sont marquées avec une GFP ciblée sur la membrane. Cependant, nous n’avons observé qu’un nombre limité de cellules marquées à la GFP chez les souris MT-TGFα. Cela suggère soit que la plupart des cellules principales marquées à la GFP sont mortes en raison d’une surexpression de TGFα, soit que l’efficacité du marquage de la GFP dans les cellules principales était trop faible. Parce qu’il a été rapporté qu’il n’y avait pas d’augmentation de la mort cellulaire par la surexpression8 de TGFα, nous avons examiné la possibilité d’une perte d’expression de Mist1 en évaluant des souris MT-TGFα sans traitement aux métaux lourds. Nous avons été surpris par les phénotypes complets chez les souris MT-TGFα sans traitement aux métaux lourds, y compris l’hyperplasie fovéolaire et la perte de cellules pariétales et principales. Nous avons également confirmé que l’expression de Mist1 est perdue chez les souris MT-TGFα même sans traitement aux métaux lourds. Il a déjà été signalé que l’expression du TGFα n’était pas rigoureusement contrôlée chez les souris MT-TGFα en raison d’une incapacité à éliminer l’exposition aux métaux lourds ; cependant, l’expression du TGFα a été significativement augmentée par le traitement aux métaux lourds8. Une évaluation phénotypique complète n’a pas été effectuée auparavant chez les souris MT-TGFα sans traitement aux métaux lourds. L’étude actuelle montre que les souris MT-TGFα développent une manifestation phénotypique complète sans traitement aux métaux lourds.
Étant donné que l’expression de Mist1 a été perdue chez les souris MT-TGFα avant même le traitement aux métaux lourds, il restait nécessaire de disposer d’un autre modèle de souris dans lequel l’expression de TGFα est spécifiquement contrôlée afin que les phénotypes ne se développent pas sans induction d’une surexpression de TGFα. Nous avons généré un nouveau modèle murin de DM dans lequel l’expression du TGFα est induite par le traitement à la doxycycline (Doxi-TGFα). Nous avons confirmé que ce modèle murin induit une hyperplasie fovéolaire et une perte de cellules pariétales et principales, qui sont les principaux phénotypes de la DM. Nous avons pu tracer la lignée des cellules principales à l’aide du Mist1-CreERT2 ; Les souris R26-LSL-mTmG dans ce modèle de souris ont découvert que certaines cellules marquées par la GFP étaient également marquées avec GSII et CD44v9, confirmant que SPEM se produit dans ce nouveau modèle de souris MD. C’est le premier rapport confirmant que SPEM se développe dans l’estomac avec une surexpression de TGFα. SPEM est une affection gastrique précancéreuse plus fréquente, ce qui peut être la raison pour laquelle le cancer gastrique est augmenté chez les patients atteints de DM22,23.
Une mise en garde de l’utilisation de la lignée de souris Mist1-CreERT2 est qu’il a été rapporté que Mist1 peut également être exprimé dans les cellules souches gastriques24. Nous avons constaté qu’une faible dose (37,5 mg/kg) de traitement au tamoxifène induit l’activation de Cre, plus spécifiquement dans les cellules principales, avec une activation minimale dans la région de l’isthme, même à des moments antérieurs au traitement à la doxycycline. Des résultats similaires ont déjà été signalés25. Traçage de la lignée à l’aide du Mist1-CreERT2 ; Les souris R26-LSL-mTmG présentent des cellules positives à la GFP près de la GFP et le marqueur SPEM (GSII et CD44v9) Les cellules doublement positives sont principalement localisées à la base où se trouvent les cellules principales (Figure 4C). Si les cellules doublement positives des marqueurs GFP et SPEM sont tracées à partir des cellules souches, il aurait dû y avoir plus de cellules GFP positives vers l’isthme où se trouvent les cellules souches. Alternativement, la lignée de souris GIF-rtTA inductible par la doxycycline26 ou la lignée de souris GPR30-rtTA27 pourraient être utilisées avec des souris MT-TGFα pour des modifications génétiques ou le traçage de la lignée des cellules principales. Cependant, les cellules positives au GIF sont diminuées chez les souris MT-TGFα sans traitement au ZnSO4 (Figure 3B, C), et les cellules positives au GPR30 sont perdues chez les souris MT-TGFα sans traitement au ZnSO4. Par conséquent, elles seront moins efficaces par rapport aux souris Doxi-TGFα croisées avec la lignée de souris Mist1-CreERT2.
L’étude actuelle montre que les souris MT-TGFα développent des changements phénotypiques complets dans l’estomac sans traitement aux métaux lourds. Nous montrons également que l’un des phénotypes est la perte d’expression de Mist1, ce qui exclut l’utilisation de Mist1-CreERT2 ; R26-LSL-mTmG souris de la lignée des cellules principales de trace. Nous avons généré un nouveau modèle murin de DM, Doxi-TGFα, et confirmé pour la première fois que SPEM se développe dans la MD en utilisant ce modèle de souris. Ce nouveau modèle de souris MD sera utile lorsqu’un contrôle précis du développement des phénotypes MD sera nécessaire et lorsque des modifications génétiques dans les cellules principales seront nécessaires à l’aide de la lignée de souris Mist1-CreERT2. Les phénotypes MD sont induits par l’activation de la signalisation EGFR par la surexpression de TGFα. Cependant, on ne connaît pas l’activation de l’EGFR dans laquelle les types de cellules sont responsables des phénotypes observés. À l’aide du modèle murin Doxi-TGFα, nous étudions actuellement le rôle de la signalisation EGFR dans différents types de cellules, y compris les cellules principales, en utilisant la lignée de souris Mist1-CreERT2.
Déclarations de divulgation
Tous les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ces travaux ont été soutenus par l’Institut national du diabète et des maladies digestives et rénales (K08 DK124686 à WJH). Nous remercions Gina Della Porta et Sarah E. Glass pour l’édition du manuscrit.
Contribution de l’auteur :
TTG a mené des expériences, généré des figures, écrit le manuscrit et édité le manuscrit. JDP a mené des expériences, généré des figures, écrit le manuscrit et édité le manuscrit. SKM a fourni la lignée de souris TetO-TGFα et a édité le manuscrit. RJC a conçu des expériences et édité le manuscrit. WJH a conçu des expériences, mené des expériences, interprété des données, recherché dans la littérature, écrit le manuscrit et édité le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Références
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon