Research Article
تطوير نماذج الفئران لمرض Ménétrier
In This Article
Summary
توضح الدراسة الحالية أن الفئران MT-TGFα تظهر حؤول متعدد الببتيد المحلل للتشنج (SPEM) في المعدة. منع هشاشة المروج إثبات أن سلالات الخلايا الرئيسية ترتسب إلى SPEM. وبالتالي ، قمنا أيضا بتطوير نموذج فأر محفز للدوكسيسيكلين (Doxi-TGFα) وأكدنا أن SPEM مشتق من الخلايا الرئيسية.
Abstract
مرض Ménétrier (MD) هو اضطراب خبيث نادر المكتسب المكتسب يتميز بطيات الوعرة العملاقة ، وانخفاض إفراز الحمض ، وفقدان البروتين. يظهر مرضى MD زيادة في التعبير عن ترابط مستقبلات EGF (EGFR) ، مما يؤدي إلى تحويل عامل النمو α (TGFα) في المعدة. ينتج عن الجسم المضاد المحايد EGFR ، سيتوكسيماب ، تحسن سريري سريع ومغفرة نسيجية. بالإضافة إلى هذه النتائج ، فإن المسببات والآليات الجزيئية الأساسية ليست مفهومة جيدا. يعد خط الفأر المعدل وراثيا Metallothionein (MT) -TGFα أول نموذج فأر MD يلخص السمات النسيجية المرضية ل MD ، بما في ذلك تضخم النقرات وفقدان الخلايا الجدارية. في طراز الماوس هذا ، يتم تشغيل TGFα بواسطة محسن / مروج MT المحفز للمعادن الثقيلة. استخدمت الدراسات السابقة كبريتات الزنك (ZnSO4) في مياه الشرب أو الحقن داخل الصفاق لكبريتات الكادميوم (CdSO4) للحث على TGFα. ومع ذلك ، وجدنا أن الفئران MT-TGFα تطور أنماطا ظاهرية دون معالجة المعادن الثقيلة ، مما يشير إلى تسرب المروج. وجدنا أيضا أن الإفراط في التعبير عن TGFα يثبط تعبير Mist1 ، وهو عامل نسخ مهم لتمايز الخلية الرئيسية ، وبالتالي يعيق التلاعب الجيني في الخلايا الرئيسية باستخدام خط الفأر Mist1-CreERT2. للتغلب على هذا ، قمنا بتطوير نموذج فأر محفز (Doxi-TGFα) يتم فيه تحفيز TGFα عن طريق علاج الدوكسيسيكلين (CMV-rtTA ؛ TetO-TGFα). على الرغم من أن نموذج الفأر Doxi-TGFα يطور أنماطا ظاهرية أكثر اعتدالا من نموذج MT-TGFα ، إلا أنه لخص ميزات MD ، بما في ذلك تضخم النقرة وفقدان الخلايا الجدارية. باستخدام نموذج الفأر Doxi-TGFα ، وجدنا أن حؤول عديد الببتيد المحلل للتشنج (SPEM) يتم إحداثه في MD ، ويتم اشتقاق SPEM من الخلايا الرئيسية عن طريق تتبع النسب باستخدام خط الفأر Mist1-CreERT2. يقدم كل من طرازي الفأر MT-TGFα و Doxi-TGFα نماذج في الجسم الحي من MD وهي مفيدة للتحقيق في الآليات الجزيئية الكامنة وراء التسبب في مرض MD وخيارات العلاج للمرض. ستكون فئران Doxi-TGFα أيضا نموذجا مفيدا لدراسة آثار الإفراط في التعبير عن TGFα في الأنسجة الأخرى.
Introduction
مرض Ménétrier (MD) ، المعروف أيضا باسم اعتلال المعدة الضخامي المفقود للبروتين ، هو حالة نادرة قبل خبيثة في المعدة. تظهر معدة مرضى MD تضخم فورفيولا هائل ، مما يؤدي إلى زيادة إفراز مخاط المعدة ، وانخفاض عدد الخلايا الجدارية ، مما يؤدي إلى انخفاض إفراز حمض المعدة. بالإضافة إلى ذلك ، يتم فقدان البروتين بشكل انتقائي عبر الغشاء المخاطي في المعدة ، مما يؤدي إلى نقص ألبومين الدم والوذمة المحيطية1،2،3. لم يكن التسبب في MD معروفا حتى تم الإبلاغ عن أن الفئران المعدلة وراثيا تفرط في التعبير عن TGFα تحت سيطرة محسن / محفز جين ميتالوثيونين (MT) يلخص الأنماط الظاهرية ل MD في المعدة4،5. أظهرت المعدة من مرضى MD أيضا زيادة في التعبير عن TGFα ، وهو رابط مستقبلات EGF (EGFR). تم الإبلاغ عن أن Cetuximab ، وهو جسم مضاد مضاد ل EGFR ، هو أول علاج طبي فعال ل MD ، مما أكد أن تنشيط EGFR عن طريق الإفراط في التعبير TGFα يساهم في التسبب في MD6،7.
منذ ذلك الحين ، تم استخدام خط الماوس MT-TGFα كنموذج ماوس ل MD. نظرا لأن تعبير TGFα يتم تنظيمه بواسطة جين استجابة المعادن الثقيلة ، فقد تم استخدام محسن / محفز الميتالوثيونين ، وكبريتات الزنك (ZnSO4) في مياه الشرب أو الحقن داخل الصفاق لكبريتات الكادميوم (CdSO4) للحث على تعبير TGFα5،8. تم تمييز نموذج الماوس MT-TGFα بشكل أكبر للأنماط الظاهرية ل MD. باستخدام نموذج الفأر هذا ، فقد ثبت أن TGFα يحفز تمايز الخلايا السطحية التي تفرز الميوسين بينما يمنع التمايز إلى خلية جدارية تفرز الحمض وسلالات الخلايا الرئيسية التي تفرز البيبسينوجين9،10. لقد ثبت أيضا أن الغشاء المخاطي لجسم المعدة / القاع يصبح متصلا وأن الخلايا الإيجابية لعامل ثلاثي الفصوص 2 (TFF2) موجودة في قاعدة الغدد المعدية ، مما يشير إلى حدوث حؤول متعدد الببتيد المتشنح (SPEM) في MD8،11.
في الدراسة الحالية ، نظهر أن الفئران MT-TGFα تطور سمات MD دون معالجة المعادن الثقيلة. تشمل هذه الأنماط الظاهرية فقدان تعبير Mist1 ، وهو عامل نسخ ضروري لتمايز الخلية الرئيسية ويضيع في SPEM. بسبب فقدان الضباب 1 ، لا يمكن استخدام خط الفأر Mist1-CreERT212 جنبا إلى جنب مع خط الماوس MT-TGFα لفحص ما إذا كان SPEM في MD ينشأ من الخلايا الرئيسية عن طريق تتبع النسب. بهدف التغلب على تسرب نموذج الماوس MT-TGFα ، قمنا بتطوير نموذج ماوس MD جديد (CMV-rtTA13; TetO-TGFα14) حيث يتم تحفيز TGFα عن طريق علاج الدوكسيسيكلين (Doxi-TGFα). لقد أكدنا أن طراز الماوس هذا يعرض أيضا ميزات MD. باستخدام نموذج الماوس Doxi-TGFα ، نوضح أن SPEM ينشأ من الخلايا الرئيسية عن طريق تتبع النسب باستخدام خط الماوس Mist1-CreERT2. نقدم نموذجين من ماوس MD في الدراسة الحالية. يمكن استخدام كلا النموذجين للتحقيق في التسبب في المرض والبحث عن أهداف علاجية محتملة. سيكون فأر Doxi-TGFα الجديد ذا قيمة خاصة عندما يحتاج بدء الأنماط الظاهرية MD إلى التحكم بدقة أو عندما يكون التعديل الجيني في الخلايا الرئيسية مطلوبا باستخدام خط الماوس Mist1-CreERT2.
Protocol
تمت الموافقة على جميع تربية وإجراءاتها من قبل اللجان المؤسسية لرعاية واستخدامها في جامعة ييل ووفقا لمبادئ حكومة الولايات المتحدة لاستخدام ورعاية المستخدمة في البحث والتدريس والاختبار.
1. تجارب الفئران
- علاجات الفئران
- عالج الفئران MT-TGFα (من الذكور والإناث في سن 2-4 أشهر) ب 25 ملي ZnSO4 في مياه الشرب لمدة أسبوعين للحث على الإفراط في التعبير عن TGFα.
- علاج CMV-rtTA / + ؛ الفئران TetO-TGFα / + (Doxi-TGFα) (ذكور وإناث في سن 2-4 أشهر) مع 2 مجم / مل دوكسيسيكلين في مياه الشرب لمدة أسبوعين للحث على الإفراط في التعبير عن TGFα.
- أضف ضبابية واحدة 1-CreERT2 / + ؛ R26-LSL-mTmG / + فأر ذكر أو أنثى وأضف فأر Doxi-TGFα من الجنس الآخر في قفص التكاثر لتتبع نسب الخلايا الرئيسية في نماذج الفئران MD.
- حقن الضباب 1-CreERT2 / + ؛ R26-LSL-mTmG /+; CMV-rtTA / + ؛ الفئران TetO-TGFα / + (ذكور وإناث في سن 2-4 أشهر) مع تاموكسيفين (37.5 مجم / كجم) داخل الصفاق. الحقن لمدة 7 أيام متتالية بالتناوب بين الربعين السفليين الأيمن والأيسر من البطن وتجنب ضرب الأعضاء الداخلية. تحفيز التعبير TGFα عن طريق العلاج بالدوكسيسيكلين (2 مجم / مل) في مياه الشرب لمدة أسبوعين.
ملاحظة: تحقق من عدم وجود إصابة ناجمة عن عقار تاموكسيفين في المعدة15،16 ، كما هو الحال هنا عن طريق حساب الخلايا الجدارية في الفئران البرية مع وبدون علاج تاموكسيفين (الشكل التكميلي 1).
- تثبيت أنسجة المعدة
- القتل الرحيم للفئران عن طريق جرعة زائدة من الأيزوفلوران بعد أسبوعين من الإفراط في التعبير عن TGFα. باستخدام برطمان مجفف في غطاء دخان كيميائي ، ضع الفئران على منصة مثقبة تمنع الاتصال المباشر بالتخدير السائل. أغلق الغطاء وراقب الفئران حتى تفتقر إلى التنفس لأكثر من 60 ثانية ، متبوعا بخلع عنق الرحم.
- قم بتشريح المعدة عن طريق القطع عند التقاطع المعدي المريئي ، وقطع الاثني عشر مع الاثني عشر 5 مم متصل بالمعدة ، وإزالة جميع الأربطة البريتونية حول المعدة باستخدام المقص والملقط (الشكل 1 أ).
- قم بغرس المحلول الملحي المخزن بالفوسفات (PBS) باستخدام حقنة سعة 10 مل مع طرف ماصة متصل بجانب الاثني عشر. اضغط عليه باستخدام الأصابع لإزالة المحتوى اللمعي. كرر 3x (الشكل 1 ب).
- نفخ المعدة ب 2 مل من الفورمالين 10٪ باستخدام حقنة أخرى سعة 10 مل مع طرف ماصة متصل. مشبك بإحكام بالملقط عند تقاطع المعدة والاثني عشر لمدة 5-10 ثوان أثناء إزالة الطرف من المعدة (الشكل 1 ج).
- اغمر المعدة المنتفخة في 10٪ فورمالين طوال الليل عند 4 درجات مئوية مع الرج (الشكل 1 د).
تنبيه: استخدم معدات الحماية المناسبة عند العمل مع المواد السامة مثل الفورمالين.
- تحضير المعدة لتضمين البارافين
- اقطع الاثني عشر ومقدمة المعدة باستخدام شفرة حلاقة (الشكل 1E). اشطف أنسجة المعدة باستخدام PBS لمدة 5 دقائق ، 3 مرات مع الرج.
- قطع المعدة إلى 3-4 حلقات بنفس السماكة (3-5 مم) باستخدام شفرة حلاقة. قم بتضمين حلقات المعدة في 2٪ agarose للحفاظ على الاتجاه. ضع حلقات المعدة بالتتابع من القريبة إلى البعيدة عن طريق وضع جانب الانحناء الأصغر في نفس الاتجاه (الشكل 1F).
- ضع حلقات المعدة المضمنة في الاغاروز في كاسيت الأنسجة (الشكل 1G) وأرسل العينات إلى منشأة الأنسجة الأساسية لتضمين البارافين17.
2. تلطيخ الفلورسنت المناعي
- إعداد الشريحة
- قم بتسخين الشرائح مع أقسام البارافين عليها في فرن جاف أو على كتلة حرارية مضبوطة على 60 درجة مئوية لمدة لا تقل عن 1 ساعة إلى ليلة واحدة. اتركيها تبرد حتى تصل إلى درجة حرارة الغرفة وضعيها في رف منزلق.
- إزالة البارافين وإعادة الجفاف واسترجاع المستضد
- قم بتسمية برطمانين من الشرائح ، A و B ، واملأ كل منهما بمحلول Trilogy كاف لغمر الأنسجة بالكامل.
- ضع رف الانزلاق في البرطمان A وضع كلا البرطمانين في قدر الضغط. اضبط قدر الضغط على ضغط عال لمدة 15 دقيقة. اترك قدر الضغط يبرد قبل فتح الشرائح واسترجاعها.
- ضع رف الشرائح على الفور من البرطمان A في البرطمان B لمدة دقيقتين لضمان إزالة البارافين من الشرائح. قم بإزالة الشرائح من البرطمان B وضعها في ماء منزوع الأيونات (DI).
ملاحظة: يمكن ملء الجرة A بثلاثية مستخدمة مرة واحدة. يجب دائما استخدام ثلاثية جديدة في الجرة ب. - ضع الشرائح في محلول ملحي مخزن مؤقت (TBS) لمدة 5 دقائق قبل الشروع في الحظر.
- حجب تلطيخ الخلفية غير المحدد
- قم بإزالة الشرائح من رف الشرائح واضغط عليها بشكل جانبي لإزالة TBS الزائد.
- ارسم صندوقا حول الأنسجة باستخدام قلم تحديد كاره للماء. ضع المخزن المؤقت المانع لتغطية الأنسجة بالكامل واحتضانه لمدة 30-60 دقيقة في غرفة رطبة في درجة حرارة الغرفة.
- حضانة الأجسام المضادة الأولية
- حدد الأجسام المضادة الأولية للبروتينات المستهدفة التي يتم تربيتها في أنواع مضيفة مختلفة وتخفيفها في مخفف الأجسام المضادة وفقا لتوصية الشركة المصنعة. في هذه الدراسة ، تم استخدام الأجسام المضادة التالية: H + / K + -ATPase و GIF و Mist118،19 و CD44v920،21. يمكن العثور على معلومات مفصلة عن الأجسام المضادة الأولية في جدول المواد.
- قم بإزالة المخزن المؤقت المانع ، وقم بتطبيق الأجسام المضادة المخففة ، ثم ضع الشرائح مرة أخرى في الغرفة المرطبة. احتضان طوال الليل عند 4 درجات مئوية.
- قم بإزالة الأجسام المضادة الأولية وغسل الشرائح 3 مرات في TBS لمدة 5 دقائق لكل غسلة.
- الأجسام المضادة الثانوية والليكتين
- اختر الأجسام المضادة الثانوية وفقا للأنواع المضيفة للأجسام المضادة الأولية. يمكن خلط الليكتين مع الأجسام المضادة الثانوية وتطبيقه في نفس الوقت.
- تمييع الأجسام المضادة الثانوية والليكتين وفقا لتوصيات الشركة المصنعة في مخفف الأجسام المضادة. يمكن العثور على معلومات مفصلة عن الأجسام المضادة الثانوية والليكتين المستخدمة في هذه الدراسة في جدول المواد.
- ضع الأجسام المضادة الثانوية والليكتين و DAPI (1 ميكروغرام / مل) وضع الشرائح مرة أخرى في الغرفة المرطبة. احتضن لمدة 1 ساعة في درجة حرارة الغرفة بعيدا عن الضوء.
- قم بإزالة الشرائح من الحجرة المرطبة واشطفها 3 مرات باستخدام TBS لمدة 5 دقائق لكل غسلة.
- التركيب والتحضير المجهري
- قم بإزالة شريحة من TBS وقم بإزالة السوائل الزائدة عن طريق النقر على الشريحة الجانبية على منشفة ورقية.
- أضف 15-20 ميكرولتر من وسط التركيب. أمسك غطاء نظيفا من الحواف وضع حافة واحدة مقابل الأنسجة مع وسط التثبيت بينهما.
- قم بخفض الغطاء ببطء حتى ينتشر الوسط بالتساوي على الأنسجة ، مع الحرص على تجنب احتجاز الفقاعات.
- استخدم مسح المهام لامتصاص وسط التثبيت الزائد حول الحواف. جفف الشريحة النهائية في الظلام في درجة حرارة الغرفة قبل الشروع في الفحص المجهري. كرر هذه العملية للشرائح المتبقية.
النتائج
تلقت الفئران البالغة من النوع البري (WT) و MT-TGFα كبريتات الزنك (25 ملي مولار ZnSO4) في مياه الشرب لمدة أسبوعين قبل التضحية. بدت معدة الفئران WT طبيعية وبشكل جسيم ونسيجي. في تناقض ملحوظ ، كانت معدة MT-TGFα سميكة بشكل كبير (الشكل 2 أ). من الناحية المجهرية ، أظهرت هذه المعدة تضخما هائلا مع فقدان كل من الخلايا الجدارية والرئيسية (الشكل 2B-D) ، مما يلخص السمات النسيجية لمرض Ménétrier (MD). يمكن أن يحدث فقدان الخلايا الرئيسية بطريقتين مختلفتين: موت الخلايا الرئيسية أو حؤول عديد الببتيد المحلل التشنجي (SPEM) الناشئ عن الخلايا الرئيسية. للتمييز بين هذين الاحتمالين ، أجرينا تتبع النسب للخلايا الرئيسية عن طريق تقاطع الضباب 1-CreERT2. الفئران R26-LSL-mTmG مع فئران MT-TGFα. عولجت هذه الفئران أولا بجرعة منخفضة من تاموكسيفين (37.5 مجم / كجم داخل الصفاق لمدة 7 أيام متتالية) لتسمية الخلايا الرئيسية ب GFP ثم باستخدام ZnSO4 في مياه الشرب للحث على الإفراط في التعبير عن TGFα. لاحظنا خلايا نادرة تحمل علامة GFP في فئران MT-TGFα (البيانات غير معروضة). بالإضافة إلى ذلك ، لم تكن هناك اختلافات جسيمة ونسيجية في فئران MT-TGFα في وجود أو عدم وجود ZnSO4 (الشكل 3A-C). كان أحد التفسيرات المحتملة لهذه النتيجة هو أن TGFα ربما يكون قد قلل من التعبير عن Mist1 ، وهو عامل نسخ أساسي للخلايا الرئيسية18 ، وتخريب فائدة أليل Mist1-CreERT2. في الواقع ، فقد التلوين الكيميائي المناعي ل Mist1 في الفئران MT-TGFα بدون علاج ZnSO4 (الشكل 3 د).
للتغلب على تسرب نموذج الفأر MT-TGFα ، لجأنا إلى نموذج Doxi-TGFa المعدل وراثيا المحفز بالدوكسيسيكلين. تم تحقيق ذلك عن طريق تهجين الفئران TetO-TGFα14 إلى خط الماوس CMV-rtTA13 ؛ تم الإبلاغ سابقا عن RTTA يتم التعبير عنه في المعدة. أكدنا أن أسبوعين من العلاج بالدوكسيسيكلين يحفز تضخم الحفرة ويقلل من عدد الخلايا الجدارية والرئيسية في نموذج فأر MD الجديد هذا (الشكل 4A-C). بالمقارنة مع السمات النسيجية في فئران MT-TGFα ، أظهرت فئران Doxi-TGFα سماكة مخاطية أقل حدة وتضخم فوفيولار ، بالإضافة إلى انخفاض أقل في الخلايا الجدارية (الشكل التكميلي 2). ومع ذلك ، تمكنا من نسب الخلايا الرئيسية باستخدام خط الفأر Mist1-CreERT2 وأكدنا أن سلالات الخلايا الرئيسية مصنفة أيضا ب GSII و CD44v920،21 ، مما يؤكد أن الإفراط في التعبير عن TGFα يحفز SPEM من الخلايا الرئيسية (الشكل 4 د).
تظهر الدراسة الحالية أن نموذج الفأر MT-TGFα ينسخ السمات النسيجية المرضية ل MD في حالة عدم وجود معالجة للمعادن الثقيلة ، ويرجع ذلك على الأرجح إلى التسرب الجوهري للمحفز / المحسن و / أو عدم القدرة على تجنب التعرض للمعادن الثقيلة (الشكل 3 والشكل التكميلي 2). نظرا لأن TGFα يمنع تعبير Mist1، لا يمكن إستخدام خط الماوس Mist1-CreERT2 في نموذج الماوس MT-TGFα. لقد أنشأنا نموذجا جديدا للفأر MD يمكن فيه تحفيز تعبير TGFα عن طريق علاج الدوكسيسيكلين. باستخدام نموذج الماوس Doxi-TGFα MD الجديد هذا ، تمكنا من تأكيد أن الإفراط في التعبير عن TGFα يحفز SPEM المشتق من الخلايا الرئيسية. سيكون نموذج الماوس Doxi-TGFα MD مفيدا عندما يكون التحكم الدقيق في تعبير TGFα ضروريا وأيضا عندما يكون التغيير الجيني في الخلايا الرئيسية مطلوبا باستخدام خط الماوس Mist1-CreERT2.
توفر البيانات:
جميع البيانات الأولية متاحة كملفات تكميلية.
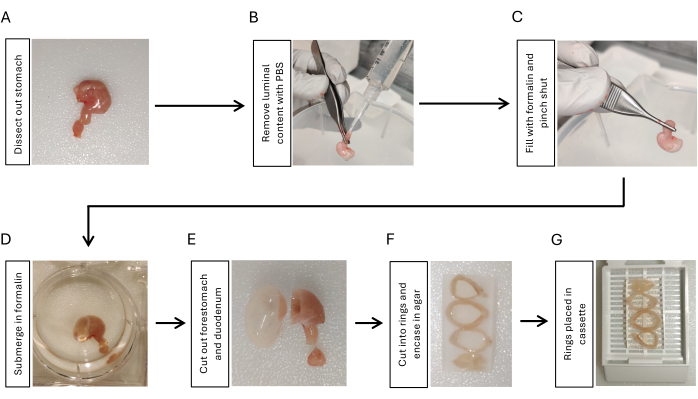
الشكل 1: سير العمل لتثبيت وإعداد تضمين أنسجة المعدة. (أ) تشريح المعدة مع جزء قصير (3-5 مم) من الاثني عشر. (ب) قم بإزالة المحتوى اللمعي عن طريق غرس PBS من الاثني عشر باستخدام حقنة بطرف ماصة والضغط عليها بالأصابع 3x. (ج) نفخ المعدة بالفورمالين من الاثني عشر باستخدام حقنة واضغط على تقاطع المعدة والاثني عشر للاحتفاظ بالفورمالين. (د) اغمر المعدة في الفورمالين وثبتها طوال الليل عند 4 درجات مئوية مع الرج. (ه) قم بإزالة مقدمة المعدة والاثني عشر بشفرة حلاقة واشطفها باستخدام PBS. (و) قم بتقطيع جسم المعدة إلى 3-4 حلقات بطريقة مقطعية وقم بتضمينها في 2٪ agarose للحفاظ على اتجاه حلقات أنسجة المعدة. (ز) ضع الأنسجة المضمنة في الأغاروز في أشرطة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
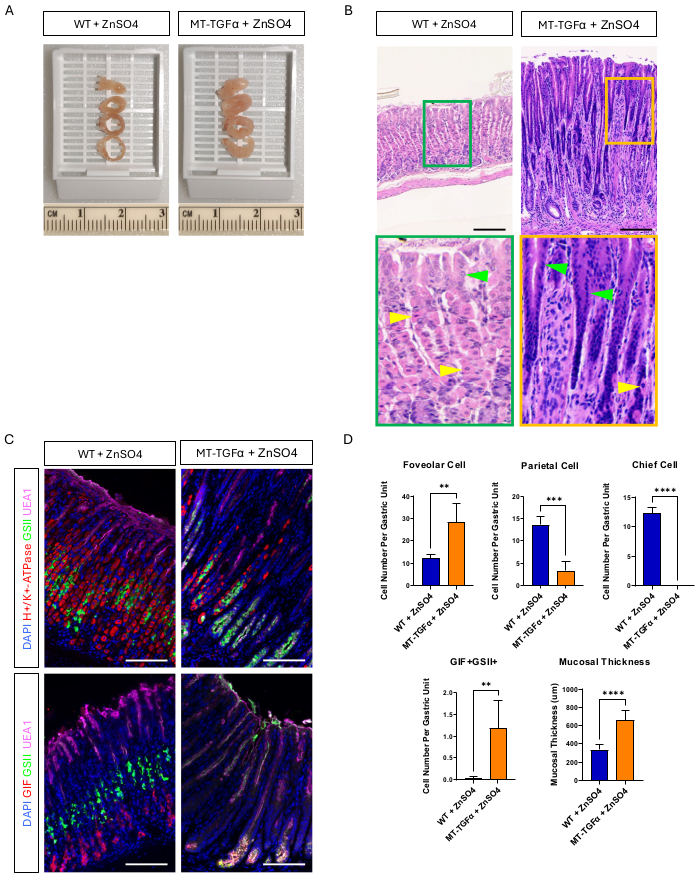
الشكل 2: الأنماط الظاهرية الإجمالية والمجهرية للفئران MT-TGFα المعالجة بالمعادن الثقيلة ZnSO4. (أ) جدار المعدة أكثر سمكا في فئران MT-TGFα (يمين) مقارنة بالفئران الضابطة (على اليسار). (ب) تظهر المعدة من فئران MT-TGFα (على اليمين) تضخما هائلا وفقدان الخلايا الجدارية. تشير رؤوس الأسهم الصفراء إلى الخلايا الجدارية ، وتشير رؤوس الأسهم الخضراء إلى الخلايا الحفرية. تمثل أشرطة المقياس 100 ميكرومتر. (ج) يؤكد تلطيخ الفلورسنت المناعي أن معدة الفأر MT-TGFα (على اليمين) تظهر أعدادا متزايدة من الخلايا النقرية (إيجابية UEA1) وخلايا SPEM (إيجابية مزدوجة GIF و GSII) وانخفاض عدد الخلايا الجدارية (H + / K + -ATPase إيجابي) والخلايا الرئيسية (GIF إيجابية واحدة) مقارنة بمعدة الفأر الضابطة (على اليسار). تمثل قضبان المقياس 100 ميكرومتر. (د) القياس الكمي لأنواع الخلايا الظهارية المختلفة وسماكة الغشاء المخاطي في الفئران من النوع البري (WT) المعالجة ب ZnSO4 (ن = 5) وفئران MT-TGFα مع ZnSO4 (ن = 3). تشير أشرطة الخطأ إلى الانحراف المعياري (** p < 0.01 ، ***p < 0.001 ، ****p < 0.0001). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
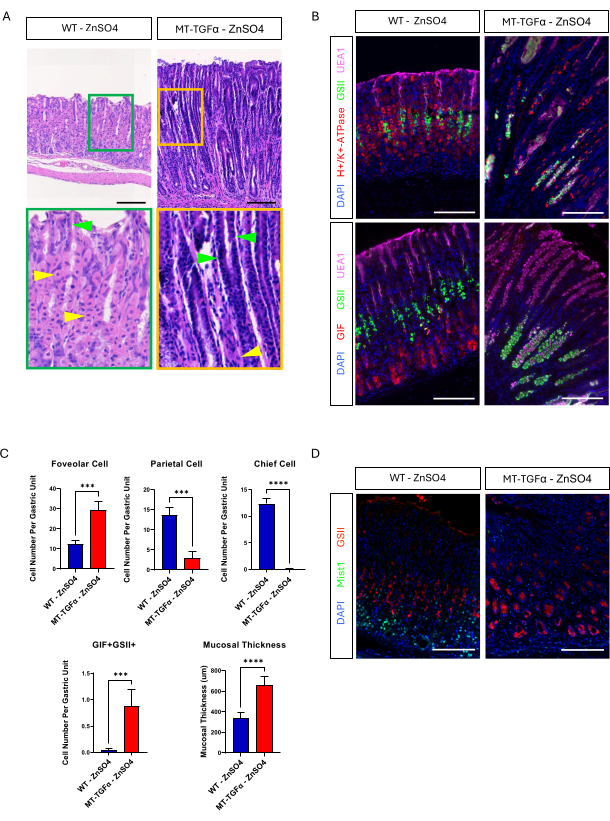
الشكل 3: تطور الفئران MT-TGFα أنماطا ظاهرية في المعدة دون معالجة المعادن الثقيلة. (أ) تظهر المعدة من فئران MT-TGFα (على اليمين) تضخما هائلا وفقدان الخلايا الجدارية دون معالجة المعادن الثقيلة. تشير رؤوس الأسهم الصفراء إلى الخلايا الجدارية ، وتشير رؤوس الأسهم الخضراء إلى الخلايا الحفرية. (ب) يؤكد تلطيخ الفلورسنت المناعي معدة الفأر MT-TGFα (على اليمين) بدون معالجة المعادن الثقيلة يظهر أعدادا متزايدة من الخلايا الحفرية (إيجابية UEA1) وخلايا SPEM (إيجابية مزدوجة GIF و GSII) ، وانخفاض عدد الخلايا الجدارية (H + / K + -ATPase إيجابي) والخلايا الرئيسية (GIF إيجابية واحدة) مقارنة بمعدة الفأر الضابطة (على اليسار). تمثل قضبان المقياس 100 ميكرومتر. (ج) القياس الكمي لأنواع الخلايا الظهارية المختلفة وسماكة الغشاء المخاطي في الفئران WT التي لا تحتوي على ZnSO4 (ن = 5) والفئران MT-TGFα ZnSO4 (ن = 3). تشير أشرطة الخطأ إلى الانحراف المعياري (***p < 0.001 ، **** p < 0.0001). (د) تظهر المعدة من فئران MT-TGFα (يمين) فقدان تعبير Mist1 ، والذي يتم التعبير عنه عادة في الخلايا الرئيسية (على اليسار). GSII هو علامة لخلايا الرقبة المخاطية. تمثل أشرطة المقياس 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
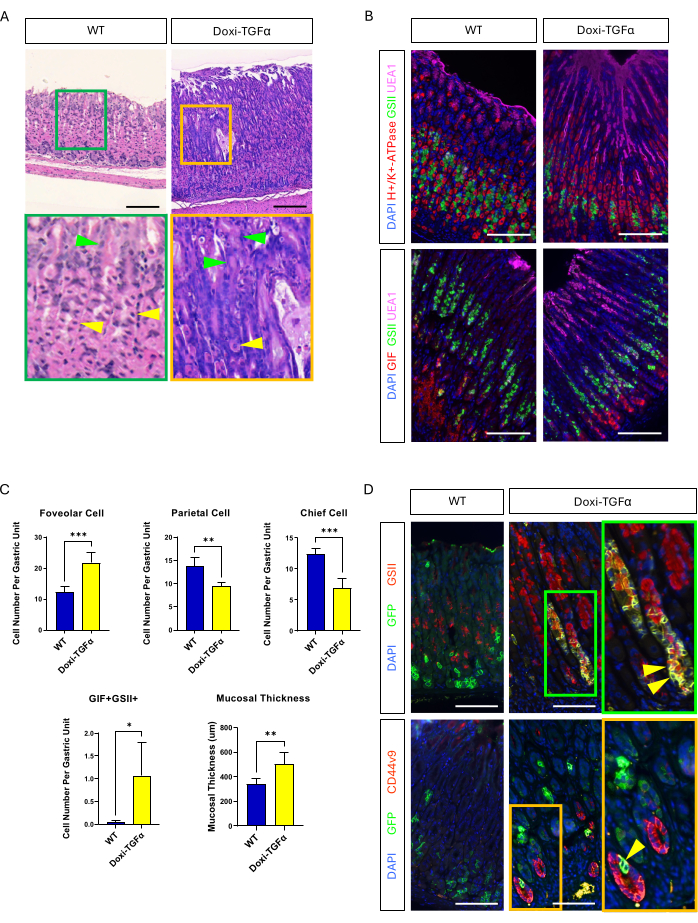
الشكل 4: يلخص نموذج الفأر TGFα المحفز للدوكسيسيكلين (Doxi-TGFα) الأنماط الظاهرية لمرض Ménétrier ، ويتم تأكيد تكوين SPEM في نموذج الفأر هذا. (أ) المعدة من CMV-rtTA ؛ تظهر الفئران TetO-TGFα (Doxi-TGFα ؛ يمين) تضخما هائلا وانخفاض عدد الخلايا الجدارية. تشير رؤوس الأسهم الصفراء إلى الخلايا الجدارية ، وتشير رؤوس الأسهم الخضراء إلى الخلايا الحفرية. تمثل أشرطة المقياس 100 ميكرومتر. (ب) يؤكد تلطيخ الفلورسنت المناعي أن معدة الفأر Doxi-TGFα (على اليمين) تظهر أعدادا متزايدة من الخلايا الحمرة (إيجابية UEA1) وخلايا SPEM (إيجابية مزدوجة GIF و GSII) ، وانخفاض عدد الخلايا الجدارية (H + / K + -ATPase إيجابي) والخلايا الرئيسية (GIF إيجابية واحدة) مقارنة بمعدة الفأر الضابطة (على اليسار). تمثل قضبان المقياس 100 ميكرومتر. (ج) القياس الكمي لأنواع الخلايا الظهارية المختلفة وسماكة الغشاء المخاطي في الفئران WT (ن = 5) وفئران Doxi-TGFα (ن = 5). تشير أشرطة الخطأ إلى الانحراف المعياري (* p < 0.05 ، ** p < 0.01 ، ***p < 0.001). (د) تتبع نسب الخلايا الرئيسية (إيجابي GFP) باستخدام Mist1-CreERT2 ؛ يكشف خط الفأر R26-LSL-mTmG أن الخلايا الإيجابية ل GFP إيجابية أيضا ل GSII و CD44v9 في معدة الفأر Doxi-TGFα ، مما يؤكد تكوين SPEM المشتق من الخلايا الرئيسية بينما تظهر معدة التحكم (على اليسار) أي خلايا إيجابية GFP تقريبا إيجابية أيضا ل GSII أو CD44v9. تمثل أشرطة المقياس 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: جرعة منخفضة من علاج تاموكسيفين (TMX) لا يسبب إصابة الغشاء المخاطي في المعدة. سبعة أيام متتالية من العلاج بجرعة منخفضة من TMX (37.5 مجم / كجم) لا تسبب إصابة الغشاء المخاطي في المعدة ، ويتمثل ذلك في الحفاظ على عدد الخلايا الجدارية. (أ) صور H&E التمثيلية بدون معالجة TMX (اللوحة اليسرى) ومع معالجة TMX (اللوحة اليمنى). تمثل قضبان المقياس 100 ميكرومتر. (ب) القياس الكمي لعدد الخلايا الجدارية لكل وحدة معدية في الفئران WT (ن = 5) و WT مع علاج TMX (ن = 5). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: مقارنة الأنماط الظاهرية بين نماذج الفئران المختلفة لمرض Ménétrier (MD). (أ) MT-TGFα مع علاج ZnSO4 ، MT-TGFα بدون علاج ZnSO4 ، ونماذج الفئران Doxi-TGFα MD تظهر تضخم الحمض ، وفقدان الخلايا الجدارية والرئيسية ، وزيادة خلايا الحؤول التي تعبر عن عديد الببتيد (SPEM) (الخلايا الموضعية المشتركة GIF و GSII) ، والغشاء المخاطي السميك. لا توجد فروق نمطية بين MT-TGFα مع وبدون مجموعات معالجة ZnSO4. يظهر نموذج الماوس Doxi-TGFα أنماطا ظاهرية أقل حدة من نموذج الماوس MT-TGFα. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
مرض Ménétrier هو اضطراب نادر في المعدة ما خبيث ناتج عن الإفراط في التعبير عن TGFα1،2،3. كانت الفئران المعدلة وراثيا التي تفرط في التعبير عن TGFα تحت سيطرة محسن / محفز جين الميتالوثيونين (MT-TGFα) هو نموذج الفأر الوحيد ل MD حتى الآن4،5. نظرا لأن جين Metallothionein يستجيب للمعادن الثقيلة ، تضاف كبريتات الزنك إلى مياه الشرب ، أو يتم حقن كبريتات الكادميوم للحث على TGFα في نموذج الفأرهذا 5،8. أحد الأنماط الظاهرية المميزة في MD هو استبدال الخلايا الرئيسية في قاعدة الغدد المعدية بخلايا مخاطية إيجابية للعلامات الموجودة في كل من خلايا الرقبة المخاطية وخلايا الميوسين الأنفية. يمكن أن يحدث هذا إما عن طريق موت الخلايا الرئيسية أو إعادة برمجة الخلايا الرئيسية إلى حؤول متعدد الببتيد الذي يعبر عن تحنج (SPEM) 8،11. يمكن اختبار ذلك عن طريق تتبع النسب للخلايا الرئيسية في نموذج فأر MD. حاولنا تتبع الخلايا الرئيسية باستخدام Mist1-CreERT2. الفئران R26-LSL-mTmG التي يتم فيها تصنيف الخلايا الرئيسية الإيجابية ل Mist1 ب GFP المستهدف بالغشاء. ومع ذلك ، لاحظنا عددا محدودا فقط من الخلايا المسماة GFP في فئران MT-TGFα. يشير هذا إلى أن معظم الخلايا الرئيسية المسماة GFP ماتت بسبب الإفراط في التعبير عن TGFα أو أن كفاءة وضع العلامات على GFP في الخلايا الرئيسية كانت منخفضة للغاية. نظرا لأنه تم الإبلاغ عن عدم وجود زيادة في موت الخلايا بسبب الإفراط في التعبير عن TGFα8 ، فقد درسنا إمكانية فقدان تعبير Mist1 من خلال تقييم الفئران MT-TGFα دون معالجة المعادن الثقيلة. لقد فوجئنا بالأنماط الظاهرية الكاملة في الفئران MT-TGFα دون معالجة المعادن الثقيلة ، بما في ذلك تضخم الحفرة وفقدان الخلايا الجدارية والرئيسية. أكدنا أيضا أن تعبير Mist1 يفقد في فئران MT-TGFα حتى بدون معالجة المعادن الثقيلة. تم الإبلاغ سابقا عن عدم التحكم في تعبير TGFα بشكل صارم في الفئران MT-TGFα بسبب عدم القدرة على التخلص من التعرض للمعادن الثقيلة. ومع ذلك ، تم زيادة تعبير TGFα بشكل كبير عن طريق معالجة المعادنالثقيلة 8. لم يتم إجراء تقييم شامل للنمط الظاهري من قبل في الفئران MT-TGFα دون معالجة المعادن الثقيلة. تظهر الدراسة الحالية أن الفئران MT-TGFα تطور مظهرا ظاهريا كاملا دون معالجة المعادن الثقيلة.
نظرا لفقد تعبير Mist1 في الفئران MT-TGFα حتى قبل معالجة المعادن الثقيلة ، ظلت هناك حاجة لنموذج فأر آخر يتم فيه التحكم في تعبير TGFα على وجه التحديد حتى لا تتطور الأنماط الظاهرية دون تحريض الإفراط في التعبير عن TGFα. لقد أنشأنا نموذجا جديدا للفأر MD يتم فيه إحداث تعبير TGFα عن طريق علاج الدوكسيسيكلين (Doxi-TGFα). لقد أكدنا أن نموذج الفأر هذا يحفز تضخم الحفرة وفقدان الخلايا الجدارية والرئيسية ، وهي الأنماط الظاهرية الرئيسية ل MD. تمكنا من نسب الخلايا الرئيسية باستخدام Mist1-CreERT2. الفئران R26-LSL-mTmG في نموذج الفأر هذا ووجدت أن بعض الخلايا المسماة ب GFP قد تم تصنيفها أيضا ب GSII و CD44v9 ، مما يؤكد أن SPEM يحدث في نموذج فأر MD الجديد هذا. إنه أول تقرير يؤكد تطور SPEM في المعدة مع الإفراط في التعبير عن TGFα. SPEM هي حالة أكثر شيوعا في المعدة ، والتي قد تكون سبب زيادة سرطان المعدة لدى مرضى MD22،23.
أحد التحذيرات لاستخدام خط الفأر Mist1-CreERT2 هو أنه تم الإبلاغ عن أنه يمكن أيضا التعبير عن Mist1 في الخلايا الجذعية المعدية24. وجدنا أن جرعة منخفضة (37.5 مجم / كجم) من علاج تاموكسيفين تحفز تنشيط Cre ، وبشكل أكثر تحديدا في الخلايا الرئيسية ، مع الحد الأدنى من التنشيط في منطقة البرزخ حتى في نقاط زمنية مبكرة قبل العلاج بالدوكسيسيكلين. تم الإبلاغ عن نتائج مماثلة سابقا25. تتبع النسب باستخدام Mist1-CreERT2 ؛ تظهر الفئران R26-LSL-mTmG خلايا إيجابية GFP بالقرب من GFP وعلامة SPEM (GSII و CD44v9) الخلايا الإيجابية المزدوجة موضعية بشكل أساسي في القاعدة حيث توجد الخلايا الرئيسية (الشكل 4 ج). إذا تم تتبع الخلايا الإيجابية المزدوجة لعلامة GFP و SPEM من الخلايا الجذعية ، فيجب أن يكون هناك المزيد من الخلايا الإيجابية ل GFP باتجاه البرزخ حيث توجد الخلايا الجذعية. بدلا من ذلك ، يمكن استخدام خط الفأر GIF-rtTA المحفز بالدوكسيسيكلين26 أو خط الفأر GPR30-rtTA27 جنبا إلى جنب مع فئران MT-TGFα للتعديلات الجينية أو تتبع النسب للخلايا الرئيسية. ومع ذلك ، تنخفض الخلايا الإيجابية ل GIF في فئران MT-TGFα بدون علاج ZnSO4 (الشكل 3B ، C) ، وتفقد الخلايا الإيجابية ل GPR30 في SPEM ، والذي يحدث في فئران MT-TGFα بدون علاج ZnSO4. لذلك ، ستكون أقل كفاءة مقارنة بفئران Doxi-TGFα التي تم عبورها مع خط الماوس Mist1-CreERT2.
تظهر الدراسة الحالية أن الفئران MT-TGFα تطور تغيرات مظهرية كاملة في المعدة دون علاج المعادن الثقيلة. نظهر أيضا أن أحد الأنماط الظاهرية هو فقدان تعبير Mist1 وهذا يمنع استخدام Mist1-CreERT2. خط الماوس R26-LSL-mTmG لتتبع الخلايا الرئيسية للنسب. لقد أنشأنا نموذجا جديدا للفأر MD ، Doxi-TGFα ، وأكدنا لأول مرة أن SPEM يتطور في MD باستخدام نموذج الماوس هذا. سيكون نموذج فأر MD الجديد هذا مفيدا عندما يكون التحكم الدقيق في تطوير الأنماط الظاهرية MD ضروريا وعندما تكون هناك حاجة إلى تعديلات جينية في الخلايا الرئيسية باستخدام خط الفأر Mist1-CreERT2. يتم تحفيز الأنماط الظاهرية MD عن طريق تنشيط إشارات EGFR عن طريق الإفراط في التعبير عن TGFα. ومع ذلك ، من غير المعروف تنشيط EGFR حيث تكون أنواع الخلايا مسؤولة عن الأنماط الظاهرية المرصودة. باستخدام نموذج الماوس Doxi-TGFα ، ندرس حاليا دور إشارات EGFR في أنواع الخلايا المختلفة ، بما في ذلك الخلايا الرئيسية التي تستخدم خط الماوس Mist1-CreERT2.
Disclosures
ليس لدى جميع المؤلفين تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى (K08 DK124686 إلى WJH). نشكر جينا ديلا بورتا وسارة إي جلاس على تحرير المخطوطة.
مساهمة المؤلف:
أجرت TTG تجارب ، وأنتجت شخصيات ، وكتبت المخطوطة ، وحررت المخطوطة. أجرى JDP تجارب ، وأنتج شخصيات ، وكتب المخطوطة ، وحرر المخطوطة. قدمت SKM خط الماوس TetO-TGFα وقامت بتحرير المخطوطة. تصور RJC التجارب وحرر المخطوطة. تصور WJH التجارب ، وأجرى التجارب ، وفسر البيانات ، وبحث في الأدبيات ، وكتب المخطوطة ، وحرر المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
References
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved