Research Article
Разработка мышиных моделей болезни Менетрие
В этой статье
Резюме
Настоящее исследование демонстрирует, что у мышей MT-TGFα наблюдается спазмолитическая полипептид-экспрессирующая метаплазия (SPEM) в желудке. Утечка промотора не позволила продемонстрировать, что основные клеточные линии восходят к SPEM. Таким образом, мы дополнительно разработали модель мыши, индуцируемую доксициклином (Doxi-TGFα) и подтвердили, что SPEM происходит из главных клеток.
Аннотация
Болезнь Менетье (БМ) — это редкое приобретенное предраковое заболевание желудка, характеризующееся гигантскими складчатыми складками, сниженной секрецией кислоты и потерей белка. У пациентов с МД наблюдается повышенная экспрессия лиганда рецептора EGF (EGFR), трансформирующего фактор роста-α (TGFα) в желудке. Нейтрализующее EGFR антитело, цетуксимаб, приводит к быстрому клиническому улучшению и гистологической ремиссии. Помимо этих результатов, этиология и лежащие в их основе молекулярные механизмы не совсем понятны. Трансгенная линия мышей Metallothionein (MT)-TGFα является первой моделью мыши с МД, которая повторяет гистопатологические особенности МД, включая фовеолярную гиперплазию и потерю париетальных клеток. В этой модели мыши TGFα управляется индуцируемым тяжелыми металлами усилителем/промотором МТ. В предыдущих исследованиях сульфат цинка (ZnSO4) использовался в питьевой воде или внутрибрюшинных инъекциях сульфата кадмия (CdSO4) для индуцирования TGFα. Тем не менее, мы обнаружили, что у мышей MT-TGFα фенотипы развиваются без обработки тяжелыми металлами, что указывает на негерметичность промотора. Мы также обнаружили, что сверхэкспрессия TGFα подавляет экспрессию Mist1, фактора транскрипции, важного для дифференцировки главных клеток, тем самым препятствуя генетическим манипуляциям в главных клетках с использованием мышиной линии Mist1-CreERT2. Чтобы преодолеть это, мы разработали индуцируемую мышиную модель (Doxi-TGFα), в которой TGFα индуцируется лечением доксициклином (CMV-rtTA; TetO-TGFα). Несмотря на то, что мышиная модель Doxi-TGFα развивает более мягкие фенотипы, чем модель MT-TGFα, она повторяет особенности МД, включая фовеолярную гиперплазию и потерю париетальных клеток. Используя мышиную модель Doxi-TGFα, мы обнаружили, что спазмолитическая метаплазия, экспрессирующая полипептиды (SPEM), индуцируется при МД, а SPEM получается из главных клеток путем трассировки линии линии Mist1-CreERT2. Обе модели мышей MT-TGFα и Doxi-TGFα предлагают модели МД in vivo и полезны для исследования молекулярных механизмов, лежащих в основе патогенеза МД, и вариантов лечения заболевания. Мыши Doxi-TGFα также будут полезной моделью для изучения эффектов сверхэкспрессии TGFα в других тканях.
Введение
Болезнь Менетье (БМ), также известная как гипертрофическая гастропатия с потерей белка, является редким предраковым заболеванием желудка. В желудках пациентов с МД наблюдается массивная фовеолярная гиперплазия, которая приводит к увеличению секреции желудочной слизи, и уменьшению количества париетальных клеток, что приводит к снижению секреции желудочной кислоты. Кроме того, белок избирательно теряется по всей слизистой оболочке желудка, что приводит к гипоальбуминемии и периферическим отекам 1,2,3. Патогенез МД не был известен до тех пор, пока не было сообщено, что трансгенные мыши с гиперэкспрессией TGFα под контролем энхансера/промотора гена металлотионеина (МТ) повторяли фенотипы МД в желудке 4,5. В желудках пациентов с МД также наблюдалась повышенная экспрессия TGFα, лиганда рецептора EGF (EGFR). Цетуксимаб, антитело против EGFR, было признано первым эффективным лекарственным средством для лечения МД, что подтвердило, что активация EGFR при сверхэкспрессии TGFα способствует патогенезу МД 6,7.
С тех пор линейка мышей MT-TGFα используется в качестве модели мыши для MD. Поскольку экспрессия TGFα регулируется геном реакции на тяжелые металлы, усилитель/промотор металлотионеина, сульфат цинка (ZnSO4) в питьевой воде или внутрибрюшинные инъекции сульфата кадмия (CdSO4) используются для индуцирования экспрессии TGFα 5,8. Мышиная модель MT-TGFα была дополнительно охарактеризована для фенотипов МД. Используя эту мышиную модель, было показано, что TGFα индуцирует дифференцировку поверхностных фовеолярных клеток, секретирующих муцин, в то же время ингибируя дифференцировку в кислот-секретирующие париетальные клетки и главные клеточные линии, секретирующие пепсиноген 9,10. Также было показано, что слизистая оболочка тела желудка/фундального аппарата антрализуется и что в основании желудочных желез присутствуют факторы трилистника 2 (TFF2)-положительные, что свидетельствует о наличии спазмолитической полипептид-экспрессирующей метаплазии (SPEM) при МД 8,11.
В данном исследовании мы показываем, как у мышей MT-TGFα развиваются признаки МД без обработки тяжелыми металлами. Эти фенотипы включают потерю экспрессии Mist1, транскрипционного фактора, который необходим для дифференцировки главных клеток и теряется при SPEM. Из-за потери Mist1 мышиная линия Mist1-CreERT212 не могла быть использована вместе с мышиной линией MT-TGFα для изучения того, возникает ли SPEM в MD из главных клеток путем трассировки линии. С целью преодоления негерметичности модели мыши MT-TGFα мы разработали новую модель мыши MD (CMV-rtTA13; TetO-TGFα14), где TGFα индуцируется лечением доксициклином (Doxi-TGFα). Мы убедились, что эта модель мыши также обладает функциями MD. Используя мышиную модель Doxi-TGFα, мы показываем, что SPEM возникает из главных клеток путем трассировки линии линии Mist1-CreERT2. В текущем исследовании мы представляем две модели мышей MD. Обе модели могут быть использованы для исследования патогенеза и поиска потенциальных терапевтических мишеней. Новая мышь Doxi-TGFα будет особенно ценна в тех случаях, когда необходимо точно контролировать инициацию фенотипов МД или когда требуется генетическая модификация в главных клетках с использованием линии мышей Mist1-CreERT2.
протокол
Все процедуры и процедуры животноводства были одобрены Институциональными комитетами по уходу за животными и их использованию в Йельском университете и в соответствии с Принципами правительства США по использованию и уходу за животными, используемыми в исследованиях, обучении и тестировании.
1. Эксперименты на мышах
- Лечение у мышей
- Мышей MT-TGFα (как самцов, так и самок в возрасте 2-4 месяцев) вводили 25 мМ ZnSO4 в питьевой воде в течение 2 недель, чтобы вызвать гиперэкспрессию TGFα.
- Лечить CMV-rtTA/+; Мышам TetO-TGFα/+ (Doxi-TGFα) (как самцам, так и самкам в возрасте 2-4 месяцев) вводили 2 мг/мл доксициклина в питьевой воде в течение 2 недель для индуцирования гиперэкспрессии TGFα.
- Добавьте один туман1-CreERT2/+; R26-LSL-mTmG/+ самец или самка мыши и добавьте одну мышь Doxi-TGFα противоположного пола в клетку для отслеживания линии главных клеток в моделях мышей MD.
- Впрыскиваем туман1-CreERT2/+; R26-LSL-mTmG/+; CMV-rtTA/+; Мышам TetO-TGFα/+ (как самцам, так и самкам в возрасте 2-4 месяцев) тамоксифен (37,5 мг/кг) внутрибрюшинно. Делайте инъекции в течение 7 дней подряд, чередуя правый и левый нижний квадранты брюшной полости и избегая попадания во внутренние органы. Индуцировать экспрессию TGFα путем обработки доксициклином (2 мг/мл) в питьевой воде в течение 2 недель.
Примечание: Проверьте отсутствие тамоксифен-индуцированного повреждения желудка15,16, как это делается здесь путем подсчета теменных клеток у мышей дикого типа с лечением тамоксифеном и без него (дополнительный рисунок 1).
- Фиксация тканей желудка
- Усыпляйте мышей при передозировке изофлурана после 2 недель гиперэкспрессии TGFα. С помощью банки с эксикатором в вытяжном шкафу для химикатов поместите мышей на перфорированную платформу, которая предотвращает прямой контакт с жидким анестетиком. Закройте крышку и наблюдайте за мышами до тех пор, пока они не начнут дышать более 60 с, после чего произойдет вывих шейки матки.
- Рассеките желудок, разрезав в гастроэзофагеальном соединении, разрезав двенадцатиперстную кишку диаметром 5 мм, прикрепленную к животу, и удалив все брюшные связки вокруг желудка с помощью ножниц и щипцов (рисунок 1A).
- Закапывайте фосфатно-солевой буфер (PBS) с помощью шприца объемом 10 мл с наконечником пипетки, прикрепленным к двенадцатиперстной кишке. Сожмите его пальцами, чтобы удалить содержимое люминала. Повторите 3 раза (рисунок 1B).
- Надуйте желудок 2 мл 10% формалина с помощью другого шприца объемом 10 мл с прикрепленным наконечником для пипетки. Плотно зажмите щипцами в гастродуоденальном соединении на 5-10 с, одновременно удаляя кончик из желудка (рисунок 1С).
- Погрузите надутый живот в 10% формалин на ночь при температуре 4 °C с встряхиванием (рисунок 1D).
ВНИМАНИЕ: При работе с токсичными веществами, такими как формалин, используйте надлежащие средства защиты.
- Подготовка желудка к заделке парафина
- Вырежьте двенадцатиперстную кишку и предбрюшную кишку с помощью бритвенного лезвия (рисунок 1E). Промойте ткани желудка PBS в течение 5 минут, 3 раза с встряхиванием.
- Разрежьте живот на 3-4 кольца одинаковой толщины (3-5 мм) с помощью лезвия бритвы. Заделайте животные кольца в 2% агарозу для поддержания ориентации. Расположите кольца живота последовательно от проксимального к дистальному, расположив сторону меньшей кривизны в том же направлении (рисунок 1F).
- Поместите желудочные кольца, залитые агарозой, в тканевую кассету (рисунок 1G) и отправьте образцы в гистологическое отделение для заделки парафина17.
2. Иммунофлуоресцентное окрашивание
- Подготовка предметного стекла
- Нагрейте предметные стекла с парафиновыми срезами на них в сухой духовке или на термоблоке, установленном на 60 °C, минимум от 1 часа до ночи. Дайте остыть до комнатной температуры и поместите в решетку для слайдов.
- Депарафинизация, регидратация и извлечение антигена
- Наклейте этикетки на две банки с предметными стеклами, A и B, и наполните каждую достаточным количеством раствора Trilogy для полного погружения ткани.
- Поместите решетку для слайдов в банку А и поставьте обе банки в скороварку. Установите скороварку на высокое давление на 15 минут. Дайте скороварке остыть, прежде чем открывать и доставать слайды.
- Немедленно поместите решетку для слайдов из банки А в банку Б на 2 минуты, чтобы убедиться, что парафин удален со слайдов. Извлеките предметные стекла из банки B и поместите их в деионизированную (DI) воду.
ПРИМЕЧАНИЕ: Баночка А может быть заполнена использованной трилогией. Новую трилогию всегда следует использовать в банке Б. - Поместите предметные стекла в трис-буферный физиологический раствор (TBS) на 5 минут, прежде чем приступить к блокировке.
- Блокировка неспецифических фоновых окрашиваний
- Снимите слайды со стойки для слайдов и постучите ими по сторонам, чтобы удалить излишки TBS.
- Нарисуйте рамку вокруг ткани с помощью гидрофобного маркера. Нанесите блокирующий буфер, чтобы полностью покрыть ткань, и инкубируйте в течение 30-60 минут во влажной камере при комнатной температуре.
- Инкубация с первичными антителами
- Отбирают первичные антитела к белкам-мишеням, выращенным у разных видов хозяев, и разводят в разбавителе антител в соответствии с рекомендацией производителя. Для данного исследования использовали следующие антитела: H+/K+-АТФаза, GIF, Mist118,19 и CD44v920,21. Подробную информацию о первичных антителах можно найти в Таблице материалов.
- Удалите блокирующий буфер, нанесите разведенные антитела и поместите предметные стекла обратно в увлажненную камеру. Выдерживать в течение ночи при температуре 4 °C.
- Удалите первичные антитела и промойте предметные стекла 3 раза в TBS в течение 5 минут для каждого мытья.
- Вторичные антитела и лектины
- Выбирайте вторичные антитела в соответствии с типом первичных антител хозяина. Лектины можно смешивать со вторичными антителами и применять одновременно.
- Развести вторичные антитела и лектины в соответствии с рекомендациями производителя в разбавителе антител. Подробную информацию о вторичных антителах и лектинах, использованных в этом исследовании, можно найти в таблице материалов.
- Нанесите вторичные антитела, лектины и DAPI (1 мкг/мл) и поместите предметные стекла обратно во увлажненную камеру. Выдерживать в течение 1 ч при комнатной температуре вдали от света.
- Выньте предметные стекла из увлажненной камеры и промойте 3 раза TBS в течение 5 минут при каждой стирке.
- Монтаж и подготовка к микроскопии
- Снимите предметное стекло с TBS и удалите лишнюю жидкость, постучав по предметному стеклу сбоку по бумажному полотенцу.
- Добавьте 15-20 μл монтажного материала. Держите чистый покровный лист за края и поместите один край напротив ткани, а монтажный носитель между ними.
- Медленно опустите покровное стекло, чтобы средство равномерно распределилось по ткани, стараясь не задерживать пузырьки.
- Используйте рабочую салфетку, чтобы впитать излишки монтажного материала по краям. Готовое предметное стекло высушите в темноте при комнатной температуре, прежде чем приступать к микроскопии. Повторите этот процесс для остальных слайдов.
Результаты
Взрослые мыши дикого типа (WT) и MT-TGFα получали сульфат цинка (25 мМ ZnSO4) в питьевой воде в течение 2 недель до жертвоприношения. Желудки мышей WT выглядели нормальными, грубо и гистологически. В отличие от этого, желудки MT-TGFα были сильно утолщены (рис. 2А). Микроскопически эти желудки показали массивную фовеолярную гиперплазию с потерей как теменных, так и главных клеток (рисунок 2B-D), что отражает гистологические особенности болезни Менетье (МД). Потеря главных клеток может происходить двумя различными способами: гибель главных клеток или спазмолитическая полипептид-экспрессирующая метаплазия (SPEM), возникающая из главных клеток. Чтобы различить эти две возможности, мы выполнили трассировку линии главных клеток путем скрещивания Mist1-CreERT2; Мыши R26-LSL-mTmG с мышами MT-TGFα. Этих мышей сначала обрабатывали низкими дозами тамоксифена (37,5 мг/кг внутрибрюшинно в течение 7 дней подряд) для маркировки главных клеток GFP, а затем ZnSO4 в питьевой воде для индуцирования гиперэкспрессии TGFα. Мы наблюдали редкие GFP-меченые клетки у мышей MT-TGFα (данные не показаны). Кроме того, не было выявлено грубых и гистологических различий у мышей MT-TGFα в присутствии или отсутствии ZnSO4 (рисунок 3A-C). Одним из возможных объяснений этого открытия было то, что TGFα, возможно, снижал экспрессию Mist1, важного фактора транскрипции для главных клеток18, и подрывал полезность аллеля Mist1-CreERT2. Фактически, иммуногистохимическое окрашивание на Mist1 было потеряно у мышей MT-TGFα без лечения ZnSO4 (рисунок 3D).
Чтобы преодолеть негерметичность мышиной модели MT-TGFα, мы обратились к доксициклин-индуцируемой трансгенной модели Doxi-TGFa. Это было достигнуто путем скрещивания мышей TetO-TGFα14 с мышиной линией13 CMV-rtTA; ранее сообщалось, что ртТА экспрессируется в желудке. Мы подтвердили, что 2 недели лечения доксициклином индуцируют фовеолярную гиперплазию и снижение количества теменных и главных клеток в этой новой модели мышей с МД (рис. 4A-C). По сравнению с гистоморфологическими особенностями у мышей MT-TGFα, у мышей Doxi-TGFα наблюдалась меньшая выраженная толщина слизистых оболочек и фовеолярная гиперплазия, а также меньшее снижение париетальных клеток (дополнительный рисунок 2). Тем не менее, мы смогли проследить происхождение главных клеток с помощью мышиной линии Mist1-CreERT2 и подтвердили, что линии главных клеток также помечены GSII и CD44v920,21, подтвердив, что сверхэкспрессия TGFα индуцирует SPEM из главных клеток (рисунок 4D).
Настоящее исследование показывает, что мышиная модель MT-TGFα фенокопирует гистопатологические особенности МД в отсутствие лечения тяжелыми металлами, вероятно, из-за внутренней негерметичности промотора/энхансера и/или невозможности избежать воздействия тяжелых металлов (Рисунок 3 и Дополнительный рисунок 2). Поскольку TGFα подавляет экспрессию Mist1, мышиную линию Mist1-CreERT2 нельзя использовать в модели мыши MT-TGFα. Мы создали новую мышиную модель МД, в которой экспрессия TGFα может быть индуцирована лечением доксициклином. Используя эту новую мышиную модель Doxi-TGFα MD, мы смогли подтвердить, что сверхэкспрессия TGFα индуцирует SPEM, полученный из главных клеток. Мышиная модель Doxi-TGFα MD будет полезна, когда необходим точный контроль экспрессии TGFα, а также когда требуется генетическое изменение в главных клетках с использованием мышиной линии Mist1-CreERT2.
Доступность данных:
Все исходные данные доступны в виде дополнительных файлов.
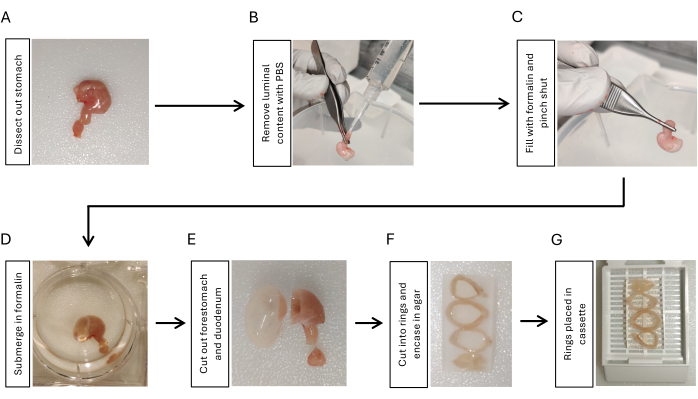
Рисунок 1: Рабочий процесс фиксации и подготовки к встраиванию желудочной ткани. (A) Рассеките желудок вместе с коротким сегментом (3-5 мм) двенадцатиперстной кишки. (В) Удалите содержимое люминала, закапывая PBS из двенадцатиперстной кишки с помощью шприца с наконечником пипетки и сжимая его пальцами в 3 раза. (В) Надуйте желудок формалином из двенадцатиперстной кишки с помощью шприца и защемите гастродуоденальное соединение для удержания формалина. (D) Погрузите желудок в формалин и зафиксируйте на ночь при температуре 4 °C с помощью встряхивания. (E) Удалите преджелудок и двенадцатиперстную кишку лезвием бритвы и промойте PBS. (F) Разрежьте тело желудка и антральный отдел на 3-4 кольца в поперечном сечении и вставьте их в 2% агарозу для сохранения ориентации колец ткани желудка. (G) Поместите салфетку, залитую агарозой, в кассеты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
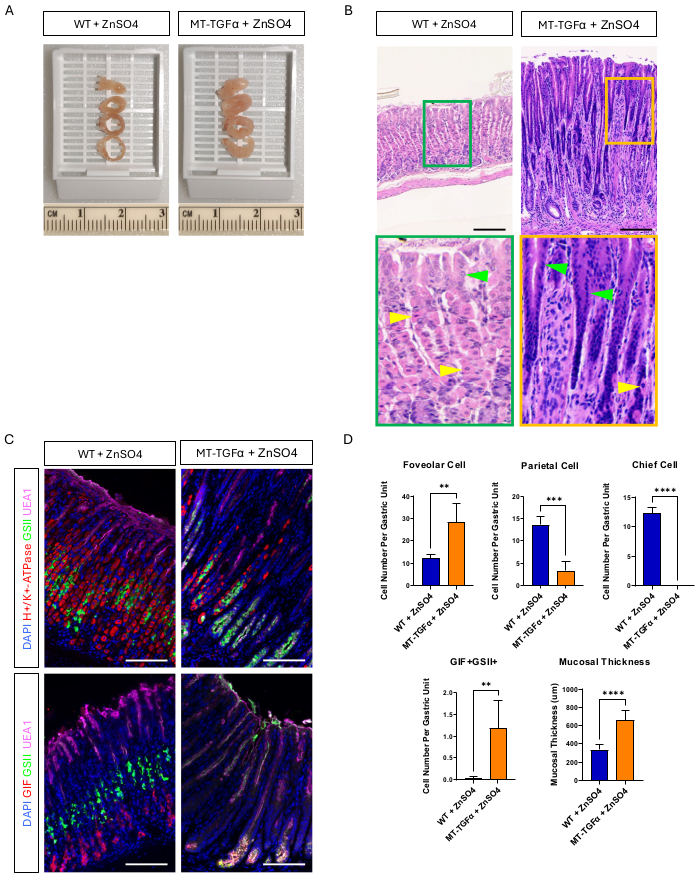
Рисунок 2: Валовые и микроскопические фенотипы мышей MT-TGFα, получавших тяжелый металл ZnSO4. (A) Стенка желудка толще у мышей MT-TGFα (справа) по сравнению с контрольными мышами (слева). (B) Желудок мышей MT-TGFα (справа) демонстрирует массивную фовеолярную гиперплазию и потерю париетальных клеток. Желтые стрелки обозначают теменные клетки, а зеленые — фовеолярные клетки. Масштабные линейки представляют 100 мкм. (C) Иммунофлуоресцентное окрашивание подтверждает, что в желудке мыши MT-TGFα (справа) наблюдается повышенное количество фовеолярных клеток (UEA1-положительные) и SPEM-клеток (GIF и GSII двойные положительные) и уменьшенное количество париетальных клеток (H+/K+-АТФаза-положительные) и главных клеток (одиночные GIF-положительные) по сравнению с контрольным желудком мыши (слева). Масштабные линейки представляют 100 мкм. (D) Количественная оценка различных типов эпителиальных клеток и толщины слизистой оболочки у мышей дикого типа (WT), получавших ZnSO4 (n = 5), и мышей MT-TGFα с ZnSO4 (n = 3). Полосы погрешности указывают на стандартное отклонение (**p < 0,01, ***p < 0,001, ****p < 0,0001). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
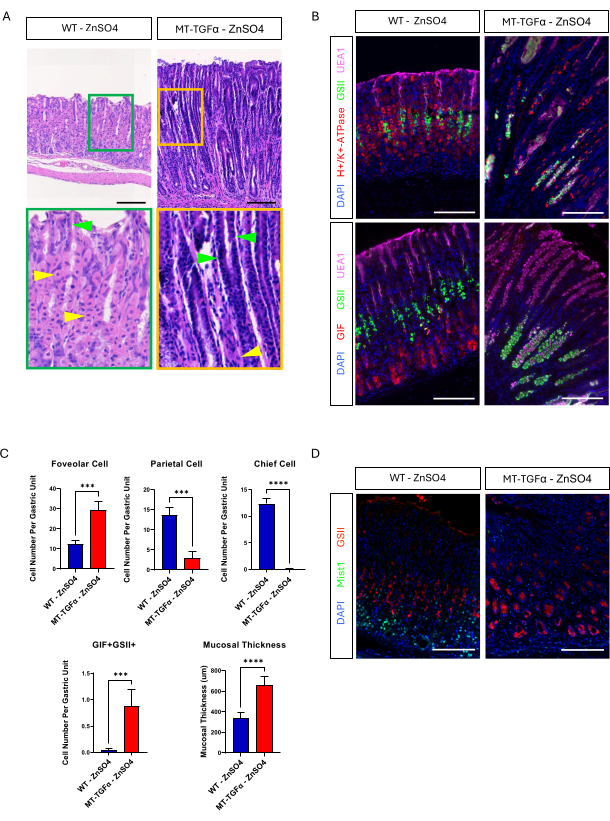
Рисунок 3: У мышей MT-TGFα развиваются желудочные фенотипы без лечения тяжелыми металлами. (A) Желудок мышей MT-TGFα (справа) демонстрирует массивную фовеолярную гиперплазию и потерю париетальных клеток без лечения тяжелыми металлами. Желтые стрелки обозначают теменные клетки, а зеленые — фовеолярные клетки. Масштабные линейки представляют 100 мкм. (B) Иммунофлуоресцентное окрашивание подтверждает, что желудок мыши MT-TGFα (справа) без обработки тяжелыми металлами показывает повышенное количество фовеолярных клеток (UEA1-положительные) и SPEM-клеток (GIF и GSII двойные положительные), а также уменьшенное количество париетальных клеток (H+/K+-АТФаза) и главных клеток (одинарно-положительные GIF) по сравнению с контрольным желудком мыши (слева). Масштабные линейки представляют 100 мкм. (C) Количественная оценка различных типов эпителиальных клеток и толщины слизистой оболочки у мышей WT без ZnSO4 (n = 5) и мышей MT-TGFα ZnSO4 (n = 3). Полосы погрешности указывают на стандартное отклонение (***p < 0,001, ****p < 0,0001). (D) В желудке мышей MT-TGFα (справа) наблюдается потеря экспрессии Mist1, которая в норме экспрессируется в главных клетках (слева). GSII является маркером для клеток слизистой шейки матки. Масштабные линейки представляют собой 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
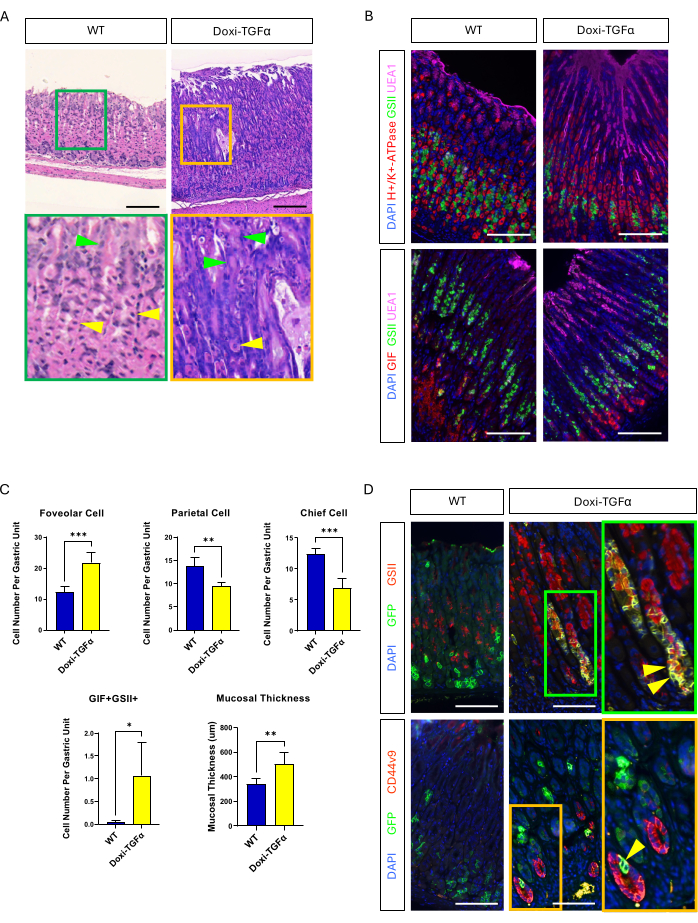
Рисунок 4: Мышиная модель индуцируемого доксициклином TGFα (Doxi-TGFα) повторяет фенотипы болезни Менетрие, и формирование SPEM подтверждено в этой мышиной модели. (A) Желудок от CMV-rtTA; У мышей TetO-TGFα (Doxi-TGFα; справа) наблюдается массивная фовеолярная гиперплазия и снижение количества париетальных клеток. Желтые стрелки обозначают теменные клетки, а зеленые — фовеолярные клетки. Масштабные линейки представляют 100 мкм. (B) Иммунофлуоресцентное окрашивание подтверждает, что желудок мыши Doxi-TGFα (справа) показывает повышенное количество фовеолярных клеток (UEA1-положительные) и SPEM-клеток (GIF и GSII двойные положительные), а также уменьшенное количество париетальных клеток (H+/K+-АТФаза-положительных) и главных клеток (GIF одиночно-положительные) по сравнению с контрольным желудком мыши (слева). Масштабные линейки представляют собой 100 мкм. (C) Количественная оценка различных типов эпителиальных клеток и толщины слизистой оболочки у мышей WT (n = 5) и мышей Doxi-TGFα (n = 5). Полосы погрешности указывают на стандартное отклонение (*p < 0,05, **p < 0,01, ***p < 0,001). (D) Отслеживание линии главных клеток (GFP-положительный) с использованием Mist1-CreERT2; Линия мышей R26-LSL-mTmG показывает, что GFP-положительные клетки также положительны на GSII и CD44v9 в желудке мыши Doxi-TGFα, подтверждая образование SPEM, полученное из главных клеток, в то время как в контрольном желудке (слева) почти нет GFP-положительных клеток, которые также положительны на GSII или CD44v9. Масштабные линейки представляют 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Лечение низкими дозами тамоксифена (TMX) не вызывает повреждения слизистой оболочки желудка. Семь дней подряд лечения низкими дозами TMX (37,5 мг/кг) не вызывают повреждения слизистой оболочки желудка, примером чего является поддержание числа париетальных клеток. (A) Репрезентативные изображения H&E без обработки TMX (левая панель) и с обработкой TMX (правая панель). Масштабные линейки представляют 100 мкм. (B) Количественная оценка количества париетальных клеток на желудочную единицу у мышей WT (n = 5) и WT при лечении TMX (n = 5). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Сравнение фенотипов среди различных моделей мышей с болезнью Менетье (МД). (A) Модели MT-TGFα с обработкой ZnSO4, MT-TGFα без обработки ZnSO4 и Doxi-TGFα MD демонстрируют фовеолярную гиперплазию, потерю париетальных и главных клеток, увеличение спазмолитической полипептид-экспрессирующей метаплазии (SPEM) клеток (ко-локализованные клетки GIF и GSII) и утолщение слизистой оболочки. Фенотипических различий между MT-TGFα с группами лечения ZnSO4 и без них нет. Мышиная модель Doxi-TGFα демонстрирует менее выраженные фенотипы, чем мышиная модель MT-TGFα. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Болезнь Менетье (БМ) — редкое предраковое заболевание желудка, вызванное сверхэкспрессией TGFα 1,2,3. Трансгенные мыши с гиперэкспрессией TGFα под контролем энхансера/промотора гена металлотионеина (MT-TGFα) на сегодняшний день являются единственной мышиной моделью для МД 4,5. Поскольку ген металлотионеина реагирует на тяжелые металлы, сульфат цинка добавляют в питьевую воду или вводят сульфат кадмия для индукции TGFα в этой модели мышей 5,8. Одним из характерных фенотипов при МД является замещение главных клеток в основании желудочных желез муцинозными клетками, положительными на маркеры, присутствующие как в клетках слизистой шеи, так и в клетках антрального муцина. Это может произойти либо в результате гибели главных клеток, либо в результате перепрограммирования главных клеток на спазмолитическую метаплазию, экспрессирующую полипептиды (SPEM)8,11. Это можно проверить с помощью отслеживания линии главных клеток на мышиной модели МД. Мы попытались проследить происхождение главных клеток с помощью Mist1-CreERT2; Мыши R26-LSL-mTmG, у которых Mist1-положительные главные клетки помечены мембранно-ориентированным GFP. Тем не менее, мы наблюдали лишь ограниченное количество GFP-меченых клеток у мышей MT-TGFα. Это говорит о том, что либо большинство меченых GFP главных клеток погибли из-за сверхэкспрессии TGFα, либо эффективность мечения GFP в главных клетках была слишком низкой. Поскольку сообщалось, что не было увеличения гибели клеток из-засверхэкспрессии TGFα8, мы изучили возможность потери экспрессии Mist1, оценивая мышей MT-TGFα без обработки тяжелыми металлами. Мы были удивлены полными фенотипами у мышей MT-TGFα без лечения тяжелыми металлами, включая фовеолярную гиперплазию и потерю париетальных и главных клеток. Мы также подтвердили, что экспрессия Mist1 теряется у мышей MT-TGFα даже без обработки тяжелыми металлами. Ранее сообщалось, что экспрессия TGFα у мышей MT-TGFα строго не контролировалась из-за неспособности устранять воздействие тяжелых металлов; однако экспрессия TGFα была значительно увеличена при обработке тяжелыми металлами8. Всесторонняя фенотипическая оценка ранее не проводилась у мышей MT-TGFα без обработки тяжелыми металлами. Текущее исследование показывает, что у мышей MT-TGFα развивается полное фенотипическое проявление без обработки тяжелыми металлами.
Поскольку экспрессия Mist1 была утрачена у мышей MT-TGFα еще до обработки тяжелыми металлами, оставалась необходимость в другой мышиной модели, в которой экспрессия TGFα специфически контролируется, чтобы фенотипы не развивались без индукции сверхэкспрессии TGFα. Мы создали новую мышиную модель МД, в которой экспрессия TGFα индуцируется лечением доксициклином (Doxi-TGFα). Мы подтвердили, что эта мышиная модель индуцирует фовеолярную гиперплазию и потерю теменных и главных клеток, которые являются основными фенотипами МД. Мы смогли определить линию следовых главных клеток с помощью Mist1-CreERT2; R26-LSL-mTmG мышей в этой мышиной модели и обнаружили, что некоторые GFP-меченые клетки также были помечены GSII и CD44v9, подтверждая, что SPEM имеет место в этой новой модели мыши MD. Это первое сообщение, подтверждающее, что SPEM развивается в желудке с гиперэкспрессией TGFα. SPEM является более распространенным предраковым заболеванием желудка, которое может быть причиной увеличения рака желудка у пациентов с МД22,23.
Одним из предостережений при использовании линии мышей Mist1-CreERT2 является то, что сообщалось, что Mist1 также может экспрессироваться в стволовых клетках желудка24. Мы обнаружили, что низкая доза (37,5 мг/кг) тамоксифена вызывает активацию Cre, более конкретно в главных клетках, с минимальной активацией в области перешейка даже в более ранние моменты времени до лечения доксициклином. Ранее сообщалось о подобных выводах25. Трассировка родословной с помощью Mist1-CreERT2; У мышей R26-LSL-mTmG наблюдаются GFP-положительные клетки вблизи GFP и SPEM-маркера (GSII и CD44v9) двойные положительные клетки в основном локализованы в основании, где расположены главные клетки (рис. 4C). Если от стволовых клеток прослеживаются двойные положительные маркеры GFP и SPEM, то в направлении перешейка, где расположены стволовые клетки, должно было быть больше GFP-положительных клеток. В качестве альтернативы, индуцируемые доксициклином GIF-rtTA мыши линии26 или GPR30-rtTA мыши линии27 могут быть использованы вместе с мышами MT-TGFα для генетических модификаций или отслеживания линии главных клеток. Тем не менее, GIF-положительные клетки уменьшаются у мышей MT-TGFα без лечения ZnSO4 (рис. 3B, C), а GPR30-положительные клетки теряются при SPEM, что происходит у мышей MT-TGFα без лечения ZnSO4. Поэтому они будут менее эффективны по сравнению с мышами Doxi-TGFα, скрещенными с линией мышей Mist1-CreERT2.
Текущее исследование показывает, что у мышей MT-TGFα развиваются полные фенотипические изменения в желудке без лечения тяжелыми металлами. Мы также показываем, что одним из фенотипов является потеря экспрессии Mist1, и это исключает использование Mist1-CreERT2; R26-LSL-mTmG от линии мыши к основным клеткам следа линии. Мы создали новую мышиную модель МД, Doxi-TGFα, и впервые подтвердили, что SPEM развивается в МД, используя эту мышиную модель. Эта новая мышиная модель МД будет полезна, когда необходим точный контроль за развитием фенотипов МД и когда необходимы генетические модификации в основных клетках с использованием линии мышей Mist1-CreERT2. Фенотипы МД индуцируются активацией сигнализации EGFR за счет сверхэкспрессии TGFα. Тем не менее, неизвестна активация EGFR, в каких типах клеток ответственны за наблюдаемые фенотипы. Используя мышиную модель Doxi-TGFα, мы в настоящее время исследуем роль передачи сигналов EGFR в различных типах клеток, включая главные клетки, использующие мышиную линию Mist1-CreERT2.
Раскрытие информации
У всех авторов нет конфликта интересов, который можно раскрыть.
Благодарности
Эта работа была поддержана Национальным институтом диабета, болезней пищеварительной системы и почек (K08 DK124686 to WJH). Мы благодарим Джину Делла Порта и Сару Э. Гласс за редактирование рукописи.
Вклад автора:
TTG проводила эксперименты, генерировала рисунки, писала рукопись и редактировала рукопись. JDP проводила эксперименты, генерировала цифры, писала рукопись и редактировала рукопись. SKM предоставила линию мышей TetO-TGFα и отредактировала рукопись. RJC задумал эксперименты и отредактировал рукопись. WJH придумывал эксперименты, проводил эксперименты, интерпретировал данные, искал литературу, писал рукопись и редактировал рукопись.
Материалы
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Ссылки
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены