Method Article
O Protocolo de Lublin da Embolização das Artérias Uterinas no Tratamento de Miomas Uterinos Sintomáticos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um método de embolização da artéria uterina para o tratamento de miomas uterinos sintomáticos dividido em cinco seções: qualificação, preparo, realização, cuidados pós-procedimento e visitas de acompanhamento. Este protocolo requer estreita cooperação entre ginecologistas e radiologistas intervencionistas, permitindo a execução adequada do procedimento acima.
Resumo
Os miomas uterinos são tumores benignos originados do tecido muscular liso, constituindo o estroma do músculo uterino. Os miomas uterinos são os tumores benignos mais comuns encontrados em mulheres. Em 20% a 50% das mulheres, os miomas são assintomáticos e não requerem nenhum tratamento. Os principais sintomas dos miomas uterinos são sangramento menstrual abundante, sangramento uterino anormal e sintomas de pressão. Os sintomas de pressão podem causar síndrome da dor pélvica, distúrbios urinários e constipação.
Os métodos de tratamento usados atualmente incluem tratamento cirúrgico, terapia farmacológica e procedimentos minimamente invasivos. O método minimamente invasivo mais comumente aplicado é a embolização das artérias uterinas. Este procedimento é atualmente um método amplamente aceito de tratamento para miomas uterinos sintomáticos e foi reconhecido como tal pelo Instituto Nacional de Saúde e Excelência Clínica nas diretrizes para sangramento menstrual intenso.
Este é um procedimento complicado e requer estreita cooperação entre ginecologistas e radiologistas intervencionistas. Apresentamos um protocolo aplicável à embolização da artéria uterina no tratamento de miomas uterinos sintomáticos. O protocolo é dividido em cinco seções. As duas primeiras seções são destinadas a ginecologistas e radiologistas intervencionistas, explicando como qualificar e preparar um paciente para a embolização de maneira passo a passo. A seção três, direcionada a radiologistas intervencionistas, explica como a embolização deve ser feita. A seção quatro é direcionada a ginecologistas ou médicos de enfermaria hospitalar que cuidam dos pacientes após a embolização. Esta seção do protocolo oferece um método para tratar a dor pós-embolização usando a bomba de Analgesia Controlada pelo Paciente (PCA). A seção cinco completa o procedimento com uma avaliação dos efeitos e complicações tardias da embolização da artéria uterina.
Todas as cinco seções criam um protocolo uniforme direcionado a médicos, especialistas e pesquisadores novos no campo.
Introdução
Os miomas uterinos são tumores benignos originados do tecido muscular liso, constituindo o estroma do músculo uterino. São tumores monoclonais, constituídos por uma grande quantidade de substância extracelular contendo colágeno, fibronectina e proteoglicanos. Os miomas são circundados por uma fina pseudocápsula feita de fibras musculares comprimidas, fibras de colágeno, neurofibras e vasos sanguíneos 1,2. A fisiopatologia dos miomas não é totalmente compreendida, mas parece depender principalmente da proliferação monoclonal causada por alterações epigenéticas seletivas e específicas do tecido3. Nenhum gene foi encontrado para causar miomas uterinos. No entanto, a presença de síndromes miomas uterinas raras, como leiomiomatose cutânea e uterina múltipla, tem sido atribuída a um gene que codifica a fumarato hidrase, uma enzima mitocondrial envolvida no ciclo de Krebs4. A presença de deleções e translocações do cromossomo 7 nos cromossomos 7, 12 e 14, que ocorrem em 50% dos miomas, parece ser secundária e não primária 5,6,7.
Os reguladores do crescimento dos miomas uterinos são hormônios esteróides produzidos pelos ovários (estrogênios e progesterona), fatores de crescimento, angiogênese e apoptose. Fatores de risco para o desenvolvimento de miomas uterinos também foram identificados, incluindo idade, menarca precoce, raça afro-americana, hereditariedade, nuliparidade, obesidade, síndrome dos ovários policísticos, diabetes, hipertensão, deficiência de vitamina D, uso de leite de soja, álcool e consumo de cafeína8.
Os miomas uterinos são os tumores benignos mais comuns dos órgãos reprodutivos em mulheres. Esses tumores foram descritos pela primeira vez em 1793 por Matthew Baillie no St George's Hospital, em Londres. Os dados epidemiológicos disponíveis não especificam com precisão a incidência de miomas uterinos, pois sua grande proporção permanece não diagnosticada. Estima-se que miomas uterinos ocorram em 5,4% a 77% de todas as pacientes. Sua prevalência é maior nos Estados Unidos do que na Europa, sendo a causa provável as diferenças raciais8.
Entre as mulheres em idade fértil, aproximadamente 30% dos miomas podem apresentar sintomas clínicos na forma de sangramento uterino anormal, resultando em suprimento sanguíneo inadequado nas pacientes9. Na maioria dos casos, as pacientes apresentam mais de um mioma, que são lesões esféricas localizadas no útero. Suas dimensões e localização podem variar. Em 90% dos casos, eles estão localizados no corpo do útero. Seu diâmetro pode ser de vários milímetros a 20 cm10.
A classificação FIGO (Fédération Internationale de Gynécologie et d'Obstétrique) os divide em grupos de 0 a 8, dependendo da proximidade do endométrio (quanto menor o número, mais próximo será o endométrio) (Figura 1)11. Em cerca de 50% a 75% dos casos, os miomas são assintomáticos. Os sintomas mais comuns de miomas uterinos são sangramento menstrual abundante, sangramento uterino anormal e sintomas de pressão. Os miomas estão associados a cerca de 10% dos casos de infertilidade, sendo que em 1% a 3% são a única causa12. Os miomas uterinos assintomáticos geralmente passam apenas por um controle médico regular, enquanto os miomas sintomáticos são uma indicação para o tratamento13.
Os métodos de tratamento para miomas uterinos atualmente utilizados incluem tratamento cirúrgico, terapia farmacológica e procedimentos minimamente invasivos 13,14,15,16,17,18. O tratamento cirúrgico inclui miomectomia (abdominal e histeroscópica) e histerectomia. Tanto a miomectomia quanto a histerectomia têm um impacto positivo na qualidade de vida19. A histerectomia está associada à perda irreversível da fertilidade; Assim, muitas mulheres buscam outras opções de tratamento20.
A miomectomia abdominal permite a preservação da fertilidade. Dependendo do tamanho e número de miomas, bem como da experiência do cirurgião, esse procedimento pode ser realizado por laparotomia ou laparoscopia. Embora as hemorragias sejam menos comuns do que na histerectomia, a morbidade geral é semelhante. A miomectomia histeroscópica é um método mais seguro e menos invasivo do que a miomectomia abdominal e permite o tratamento de miomas submucosos (FIGO 0). Procedimentos histeroscópicos subsequentes podem ser necessários para remover completamente miomas tipo21 maiores.
Os dispositivos intrauterinos liberadores de levonorgestrel são um tratamento eficaz para sangramento menstrual intenso, mas não reduzem o tamanho dos miomas. Seu uso é limitado em pacientes com cavidade uterina deformada. Os análogos de GnRH são usados principalmente como agente pré-operatório para reduzir o tamanho dos miomas e a perda de sangue perioperatória. Eles também reduzem a porcentagem de incisões verticais durante a histerectomia e a miomectomia, aumentando a possibilidade de um procedimento vaginal20.
A curto prazo, os moduladores seletivos do receptor de progesterona reduzem o volume do mioma e induzem a amenorréia. No entanto, a eficácia e a segurança a longo prazo requerem mais pesquisas. Juntamente com os inibidores da aromatase, podem existir outras opções para o tratamento pré-operatório da anemia e redução do volume do mioma22. Alguns estudos sugerem que a vitamina D pode retardar ou prevenir o crescimento de miomas e o aparecimento de sintomas23.
Novos métodos usando 2-metoxiestradiol combinado com nanopartículas também estão em desenvolvimento24. Os métodos minimamente invasivos utilizados no tratamento de miomas incluem embolização da artéria uterina (EAU), cirurgia de ultrassom focalizado guiada por ressonância magnética (MRgFUS), oclusão laparoscópica da artéria uterina (LUAO) e miólise por radiofrequência14,25. O ultrassom focalizado de alta intensidade guiado por ultrassom (US-HIFU) é um método novo, ainda experimental e minimamente invasivo26,27.
Métodos de oclusão vascular terapêutica e bloqueio do suprimento de sangue para o útero foram mencionados há mais de 120 anos. Em 1894, Kelly apresentou a ligadura das artérias ilíacas internas durante uma histerectomia oncológica para controle do sangramento pélvico intratável, que na época era uma complicação comum após o procedimento cirúrgico28. Em seguida, Sack (1973) descreveu o uso efetivo da mesma técnica no tratamento da hemorragia pós-parto maciça após o parto fórceps. Em ambos os casos, a hemostasia foi obtida sem histerectomia29. Em 1979, Heaston et al. e Brown et al., descreveram independentemente a embolização das artérias pélvicas com esponjas de gelatina absorvíveis para controle da hemorragia pós-parto30,31.
A UAE foi usada pela primeira vez como método de tratamento para miomas uterinos sintomáticos em 1991 na França32. Foi inicialmente usado para reduzir a perda de sangue após a miomectomia. Em 1995, Ravina et al. propuseram esse procedimento como o principal método de tratamento para miomas uterinos sintomáticos33. Nos Estados Unidos, a embolização da artéria uterina foi realizada com sucesso em 199734.
O crescente interesse na preservação uterina em mulheres com miomas sintomáticos colocou os Emirados Árabes Unidos na vanguarda do tratamento minimamente invasivo de miomas 14,18,35,36,37. Em 2000, o Grupo de Trabalho Conjunto do Royal College of Obstetricians and Gynecologists e do Royal College of Radiologists foi criado para emitir diretrizes sobre os Emirados Árabes Unidos. Naquela época, os Emirados Árabes Unidos eram considerados um método experimental (menos de 7.000 procedimentos realizados em todo o mundo). Desde que as diretrizes foram publicadas, mais de 100.000 procedimentos nos Emirados Árabes Unidos foram realizados em todo o mundo. Além disso, cinco ensaios clínicos randomizados foram realizados, comparando os Emirados Árabes Unidos com outros procedimentos cirúrgicos. Os resultados da pesquisa indicam que a EAU é altamente eficaz a curto e médio prazo (até alguns anos), com baixo risco de complicações médias (por exemplo, infecção uterina) e graves (com risco de vida)38,39. Em estudos randomizados, tempos de hospitalização mais curtos, recuperação mais rápida e retorno às atividades diárias falam a favor dos Emirados Árabes Unidos. Os procedimentos cirúrgicos mostraram-se mais baratos e menos frequentemente necessitaram de reintervenção, mantendo a significância estatística32. Atualmente, esse procedimento é um método de tratamento amplamente aceito para miomas uterinos sintomáticos e tem sido reconhecido como tal pelo National Institute for Health and Clinical Excellence (NICE) nas diretrizes para sangramento menstrual intenso40.
Atualmente, existem 11 recomendações sobre o uso da EAU no tratamento de miomas uterinos sintomáticos, criadas por sociedades científicas da Europa, América do Norte e Austrália. Na maioria dos casos, as recomendações são consistentes, enquanto a divergência diz respeito a duas discrepâncias. A primeira é se o mioma submucoso pedunculado (FIGO 0) e subseroso (FIGO 7) são contraindicações para a EAU. A segunda é se as mulheres que declaram gravidez futura devem ser qualificadas para esse procedimento41. O American College of Obstetricians and Gynecologists (ACOG) (2008) apresentou uma diretriz interessante para o tratamento de miomas uterinos. Com base em evidências científicas consistentes (Nível A), o ACOG definiu os Emirados Árabes Unidos como um método eficaz e seguro para mulheres devidamente qualificadas que desejam preservar o útero com indicações típicas para o tratamento de miomas. Ao mesmo tempo, as recomendações do ACOG enfatizaram a necessidade de uma estreita cooperação entre ginecologistas e radiologistas intervencionistas. Nas diretrizes publicadas, o ACOG reconheceu o desejo de preservar a fertilidade como a única contraindicação (relativa)42.
Uma das recomendações mais recentes foi emitida em 2013 pelo Royal College of Obstetricians and Gynecologists (RCOG) e em 2015 pela Society of Obstetricians and Gynecologists of Canada (SOGC)41. Na parte restante deste artigo, os autores usarão as recomendações acima. De acordo com as diretrizes do RCOG e SOGC, qualquer paciente com miomas sintomáticos pode ser candidato à embolização, desde que não haja contra-indicações e os benefícios do procedimento (resolução dos sintomas) superem o risco de complicações. Deve-se notar que a embolização de miomas uterinos como um procedimento minimamente invasivo acarreta um número insignificante de complicações graves. Assim, os benefícios na maioria dos casos superam o risco de complicações 14,32,43.
Uma qualificação adequada do paciente é de importância crucial para a alta eficácia clínica e prevenção de complicações após a EAU. A principal indicação para os EUA são miomas uterinos sintomáticos, resultando em sangramento menstrual intenso, dismenorreia, dor, dispareunia e outros efeitos adversos no trato urinário ou gastrointestinal. É necessário diferenciar miomas de adenomiose ou miomas coexistentes com adenomiose porque, em tal situação, a UAE é menos eficaz e requer modificação da técnica do procedimento 14,32,43,44,45,46,47. As indicações específicas para a realização do procedimento de EAU em mulheres com miomas uterinos sintomáticos incluem recusa de cirurgia, não consentimento para transfusão de sangue e cirurgia de miomas uterinos previamente malsucedida.
Nas indicações acima, os Emirados Árabes Unidos devem ser tratados como uma alternativa ao tratamento cirúrgico. No entanto, os pacientes devem ser informados de que, em um pequeno número de casos, as complicações após o procedimento podem resultar na necessidade de uma intervenção cirúrgica 14,32,43. De acordo com as diretrizes do RCOG, o uso de EAU em uma situação em que o mioma é uma causa provável de infertilidade requer cuidados especiais e avaliação adequada de um ginecologista especializado no tratamento da infertilidade e reprodução assistida. A infertilidade devido à presença de miomas não é absoluta e muitas mulheres engravidam sem qualquer intervenção. Portanto, é razoável excluir outras possíveis causas de infertilidade, incluindo a avaliação do parceiro masculino 14,32,43.
Assim, de acordo com as recomendações do RCOG e SOGC, as candidatas devem ser mulheres com miomas uterinos sintomáticos nas quais patologias na pelve com sintomas clínicos semelhantes a miomas foram excluídas41,43.
As contraindicações absolutas a esse procedimento incluem infecção genital atual ou recente, dúvidas diagnósticas devido a fatores clínicos ou imagem inadequada, miomas assintomáticos, gravidez viável e contraindicações para o uso de agentes de contraste radiológico.
As contraindicações relativas incluem miomas pedunculados submucosos (FIGO 0) e subserosais (FIGO 7), que teoricamente podem se desprender do endométrio devido à necrose do pedúnculo, em casos raros resultando em sepse. Nesses casos, a EAU só deve ser considerada se a remoção histeroscópica ou laparoscópica do mioma pedunculado antes do procedimento ser planejado.
Apesar do fato de que a literatura atual sugere que o tamanho do mioma não é uma contraindicação por si só, a experiência mostra que extrema cautela é necessária ao qualificar pacientes com miomas grandes (especialmente associados a sintomas de compressão) para a EAU 43,48.
Há muitos relatos de gravidez bem-sucedida após a EAU Portanto, esse procedimento deve ser usado com muita cautela em mulheres que declaram desejo de engravidar (pois há menor taxa de gravidez, maior taxa de aborto espontâneo, ruptura uterina, placenta acreta e desfechos adversos da gravidez após a EAU do que após a miomectomia)32,50,51,52,53,54,55. Como ginecologistas, não recomendamos os Emirados Árabes Unidos para mulheres que procuram engravidar. Para nós, é uma contraindicação relativa, desde que haja indicações adicionais para os Emirados Árabes Unidos, como recusa de cirurgia ou transfusões de sangue, onde a falta de tratamento pode ser fatal.
De acordo com as diretrizes do RCOG, o desejo de preservar ou melhorar a fertilidade em mulheres jovens com miomas uterinos sintomáticos é uma contraindicação relativa aos Emirados Árabes Unidos32. Em contraste, as diretrizes do SOGC recomendam que, em casos semelhantes, a UAE não deve ser proposta como uma opção de tratamento para miomas, porque a segurança e a eficácia nessas mulheres não foram estabelecidas14,43. Um ponto de vista semelhante é representado por outras sociedades científicas, incluindo a Sociedade Americana de Medicina Reprodutiva (ASRM), o Colégio Americano de Obstetras e Ginecologistas (ACOG), o Colégio Americano de Radiologia (ACR), o Colégio Real de Obstetras e Ginecologistas da Austrália e Nova Zelândia (RANZCOG) e outros, citando melhores resultados de fertilidade após a miomectomia 41,43,56. A EAU tem sido recomendada apenas pelo NICE para mulheres que buscam manter ou melhorar a fertilidade, especialmente com características desfavoráveis à miomectomia (miomas múltiplos)57.
Geralmente, os procedimentos da EAU podem ser realizados em qualquer fase do ciclo menstrual32. No entanto, supondo que não exista um método ideal para excluir a gravidez na fase de fertilização ou implantação, a fim de excluir a gravidez precoce, em nosso centro, ele é realizado até o 10º dia do ciclo. Na maioria dos casos, os pacientes são admitidos na enfermaria de ginecologia no dia do procedimento. A admissão de um paciente na enfermaria de cirurgia vascular é permitida se forem fornecidos exames apropriados e consulta ginecológica. Um ginecologista e um radiologista intervencionista realizam qualificação para embolização de miomas. A qualificação ginecológica inclui histórico médico, exame, avaliação ultrassonográfica do órgão reprodutor e do tipo de mioma. Além disso, para excluir qualquer malignidade dentro do útero, é necessário um esfregaço cervical (PAP) e biópsia endometrial. Nos casos em que a ultrassonografia dos ovários é questionável, o teste ROMA (Algoritmo de Risco de Malignidade Ovariana) é necessário.
Uma questão separada que requer discussão é o sarcoma uterino, em particular o leiomiossarcoma (LMS), que representa 70% desses tumores uterinos. A prevalência de LMS em pacientes operados por mioma é baixa e estimada em 0,13%–0,29%58,59. O aumento da incidência de LMS é observado em mulheres com mais de 40 anos de idade. A LMS é difícil de diagnosticar antes do tratamento, pois pode se assemelhar a miomas benignos60. A maioria dos LMSs não está relacionada a miomas pré-existentes e não há evidências de associação de LMS com miomas uterinos61. Tanto os miomas uterinos quanto o LMS tendem a crescer rapidamente. Assim, o tamanho ou a taxa de crescimento não são um fator de risco para um tumor uterino maligno60.
Atualmente, não existem exames laboratoriais ou de imagem confiáveis que nos permitam identificar claramente o leiomiossarcoma e diferenciá-lo do leiomioma60,62. A sensibilidade da biópsia endometrial no diagnóstico de leiomiossarcoma é de 86%. Assim, um resultado negativo da biópsia não exclui a existência de um tumor uterino maligno. A ressonância magnética com contraste é atualmente o método diagnóstico ideal para tumores uterinos. A sensibilidade desse teste no diagnóstico de LMS é de 94%60.
Como já mencionado, os testes acima não excluem 100% dos tumores uterinos malignos. Portanto, há um pequeno risco de prolongamento do diagnóstico de LMS após o tratamento, sem a possibilidade de verificação histopatológica do tumor uterino. O paciente deve ser informado sobre isso durante a qualificação para os Emirados Árabes Unidos.
A realização de hemograma completo (hemograma) e testes de coagulação (INR, APTT), painel renal (creatinina, ureia), hormônio estimulante da tireoide (TSH), concentração do hormônio anti-mülleriano (AMH) (recomendado) ou do hormônio folículo-estimulante (FSH) na fase folicular, proteína C reativa (PCR), exame geral de urina e esfregaço vaginal (cultura vaginal aeróbica) permitem avaliar e evitar possíveis complicações pós-embolização (infecções, dano ovariano iatrogênico, intensificação do comprometimento renal prévio após contraste à base de gadolínio, tireotoxicose em casos de hipertireoidismo após contraste à base de iodo)63,64. Observe que o teste de FSH não é recomendado com menos de 40 anos, pois o FSH não é um indicador sensível de alterações na reserva ovariana em mulheres jovens50,65.
Um radiologista intervencionista qualifica os pacientes para o procedimento com base no histórico médico e na ressonância magnética (RM). Ao coletar o histórico médico, os benefícios e possíveis complicações, bem como o procedimento em si, devem ser discutidos com o paciente. As expectativas do paciente em relação aos Emirados Árabes Unidos também devem ser discutidas. A RM visa excluir outras patologias do órgão reprodutor e estruturas adjacentes, bem como avaliar a morfologia e localização dos miomas e anatomia para a viabilidade técnica do procedimento 35,36,37,57.
Os Emirados Árabes Unidos visam bloquear completamente a vasculatura de todos os miomas, mantendo o suprimento de sangue para o útero, ovários e tecidos circundantes dentro da pelve. Os aspectos técnicos dos Emirados Árabes Unidos ainda estão evoluindo até certo ponto.
A embolização das artérias uterinas é realizada por radiologistas intervencionistas com competência adequada no campo da embolização intravascular. O procedimento é realizado sob orientação de fluoroscopia. Envolve a inserção percutânea de um cateter vascular desde a punção na região inguinal até a artéria femoral, a aorta, a artéria ilíaca interna, até a artéria uterina. Após colocar o cateter profundamente na artéria uterina e atingir uma posição estável, o agente de embolização misturado com contraste é injetado sob controle fluoroscópico de forma a evitar refluxo e embolização "não-alvo". O leito vascular dos miomas é fechado com partículas de 500 a 900 μm, dependendo do tipo de material de embolização - os tamanhos usuais são de 700 μm. A embolização é continuada até que o fluxo sanguíneo de estase seja alcançado. Ao final do procedimento, o cateter é removido e o local de acesso vascular é fixado com pressão manual e curativo ou fechamento mecânico. O procedimento dura aproximadamente 0,5 a 1,0 h. A dose média de radiação ionizante absorvida pelo ovário durante a EAU varia de 0,04 a 0,22 (Gy: cinza) e a dose efetiva média estimada varia de 22 a 34 (mSv: milisievert). O tempo médio de fluoroscopia é de cerca de 22 min66,67.
A vasculatura da maioria dos miomas vem das artérias uterinas. Apenas cerca de 5% a 10% dos miomas são adicionalmente fornecidos pelas artérias ovarianas. As anastomoses uterinas arteriais ocorrem em cerca de 10% dos casos, enquanto as útero-ovarianas, em 10% a 30%. O corte do suprimento sanguíneo para os tecidos embolizados causa necrose isquêmica, seguida de degeneração hialina ou necrose coagulativa. Esse processo leva vários meses 68,69.
A eficácia dos Emirados Árabes Unidos depende da resolução dos sintomas ou do grau de sua redução. Para o tratamento de sangramento menstrual excessivo, dor pélvica e sintomas de pressão, o índice de eficácia clínica para os Emirados Árabes Unidos é de 81% a 96%, 70% a 100% e 46% a 100%, respectivamente. Dentro de 3 a 6 meses após o procedimento, a redução observada no volume de miomas foi de 25% a 60%33,70,71,72. A redução média do diâmetro do mioma foi de 2,2 cm57.
A redução do volume de miomas nem sempre se correlaciona com a resolução ou redução dos sintomas clínicos. No acompanhamento de longo prazo após a EAU
Na avaliação do efeito precoce da UAE, os autores desta publicação propõem o uso de ultrassom tridimensional (3D), utilizando a Virtual Organ Computer-aided AnaLysis (VOCAL), realizando medidas dos índices vasculares: índice de vascularização (VI), índice de fluxo (FI) e índice de fluxo de vascularização (VFI)75.
A dor pós-embolização é um efeito colateral esperado precoce (com duração de cerca de 24 horas) da EAU bem-sucedida (não deve ser confundido com uma complicação) e deve ser tratada ativamente. Este sintoma clínico é causado pela liberação de produtos de degradação tecidual do mioma isquêmico. O tratamento inclui controle adequado da dor, hidratação e possível antibioticoterapia 32,43. A anestesia peridural (AE) mantida por 24 h após o procedimento reduz significativamente a dor a um nível completamente aceitável, mas a um custo maior e maior risco de complicações em comparação com a Analgesia Controlada pelo Paciente (ACP)76.
Outras abordagens também estão disponíveis em revisões de tratamento da dor pós-embolização. Vale ressaltar o uso de misturas de analgésicos com moléculas de álcool polivinílico e anestesia por eletroacupuntura durante a EAU Ambos os métodos pretendiam limitar o número de procedimentos de EAU realizados em ambiente hospitalar 77,78. Não usamos esses métodos em nossos centros e centros cooperantes.
As complicações precoces da EAU são geralmente complicações locais associadas ao procedimento de angiografia. Este grupo de eventos adversos é raro (ocorrem em menos de 1% dos casos) e está relacionado principalmente a hematoma na virilha, trombose arterial, dissecção arterial e pseudo-aneurisma, reações alérgicas a agentes de contraste, espasmo na artéria uterina causado pela manipulação do cateter no vaso durante o procedimento (tratado como um evento temporário após alguns minutos e o procedimento pode ser continuado, se o espasmo persistir, Verapamil (2,5-5 mg) ou nitrato (100-150 μg) por via intra-arterial podem ser administrados) e embolização "não-alvo" 32,37,38.
Também houve vários relatos de embolização "não-alvo" de outros órgãos pélvicos e sua subsequente isquemia. Essa complicação pode ocorrer em decorrência da má execução do procedimento, bem como pela presença de anastomoses e variantes anatômicas da vasculatura pélvica. Um caso especial de embolização não-alvo é o dano ovariano que resulta de anastomoses entre os vasos do útero e os ovários em algumas pacientes79,80.
A consequência da necrose do mioma é uma síndrome pós-embolização que ocorre dentro de 30 dias após o procedimento em aproximadamente 10% a 15% dos pacientes. Os sintomas dessa síndrome, que podem ocorrer em conjunto ou individualmente, incluem náuseas, vômitos, mal-estar, febre baixa, dor abdominal inferior e níveis elevados de leucócitos. Geralmente é uma síndrome autolimitada que geralmente desaparece dentro de 10 a 14 dias. Analgésicos e anti-inflamatórios são usados para tratar essa complicação32. É importante diferenciar os sintomas de uma síndrome pós-embolização com complicações mais graves, como sepse. Isso é especialmente verdadeiro nos casos em que os sintomas mencionados duram mais de duas semanas 32,37,38.
A infecção é potencialmente a complicação mais grave após a EAU e ocorre em cerca de 0,5% dos casos32,38. Em um caso de febre alta persistente (38.5 °C e acima) por 24 a 48 horas e abdome duro e doloroso, deve-se suspeitar de sepse. Nesse caso, o tratamento pode exigir não apenas o uso de antibioticoterapia, mas também a necessidade de remover o útero. Neste último caso, em menos de 1% dos casos, pode representar uma ameaça à vida do paciente. A sepse é mais comum quando a US é realizada em um útero grande (acima de 20 cm ou quando o diâmetro de um único mioma é maior que 9 cm, e também no caso de coexistência de miomas submucosos grandes)37,38.
Uma complicação tardia após a EAU (mais de 30 dias após o procedimento), que ocorre após a embolização de miomas submucosos, é a excreção de fragmentos necróticos demarcados de miomas através do canal cervical. Ocorre em cerca de 10% dos casos 32,81,82. Aproximadamente 16% das mulheres, após a EAU Após o procedimento dos Emirados Árabes Unidos, observa-se um encurtamento significativo da menstruação e uma diminuição de sua abundância, o que é considerado um efeito benéfico desse procedimento. No entanto, a amenorreia completa é tratada como efeito da insuficiência ovariana pós-embolização 50,84.
A amenorreia após a EAU geralmente é transitória e limitada a alguns ciclos. A amenorreia permanente ocorre em cerca de 15% das mulheres com mais de 40 anos e em cerca de 1% das mulheres com menos de 40 anos de idade. Em nossa própria pesquisa, foi encontrada uma diminuição da fertilidade em mulheres jovens (33–40 anos) como resultado da redução da reserva ovariana65. Estima-se que cerca de 85% das mulheres que relatam amenorreia após a EAU tenham mais de 45 anos85. Tem sido argumentado que a razão para o aumento da incidência de amenorreia em mulheres idosas se deve à redução da reserva ovariana e à maior sensibilidade do tecido ovariano à isquemia causada pela embolização "não-alvo"86.
O procedimento dos Emirados Árabes Unidos também afeta a função sexual das mulheres submetidas ao procedimento. A melhora da função sexual após a EAU foi relatada por 26% das mulheres, a deterioração foi encontrada em 10% e inalterada nas 64% restantes das mulheres. Uma possível causa de disfunção sexual é a vasculatura anormal do clitóris, colo do útero e corpo uterino como resultado do procedimento da EAU74.
Protocolo
Os autores declaram que o protocolo segue as diretrizes do Comitê de Ética local da Universidade Médica de Lublin.
1. Qualificação para o procedimento dos Emirados Árabes Unidos
NOTA: Dirige-se a ginecologistas e radiologistas intervencionistas.
- Informe o paciente sobre os detalhes do procedimento dos Emirados Árabes Unidos.
- Discuta as indicações e contraindicações para o procedimento dos Emirados Árabes Unidos.
- Discuta com a paciente as suposições da EAU e métodos alternativos (descritos na Introdução) no tratamento de miomas uterinos.
- AVISO! Informe ao paciente que os Emirados Árabes Unidos não são um procedimento radical (o mioma não será removido).
- AVISO! Informe à paciente que ela não receberá um relatório histopatológico de miomas uterinos após a EAU.
- AVISO! Informe ao paciente que 1 a 3 casos em 1.000 tumores uterinos podem ser malignos (LMS). Discuta com a paciente que a biópsia endometrial e a ressonância magnética realizadas durante a qualificação dos Emirados Árabes Unidos são altamente sensíveis no diagnóstico de leiomiossarcoma, mas não 100%. Informe ao paciente que a realização de EAU para leiomiossarcoma pode atrasar o diagnóstico e o tratamento adequado. Observe esse fato no prontuário médico.
- Se o paciente conscientemente deseja que a EAU seja realizada, continue este Protocolo.
- Informe ao paciente que a qualificação ocorre em duas etapas. A qualificação por um ginecologista inclui a análise de indicações e contraindicações, enquanto um radiologista intervencionista avalia as capacidades técnicas dos Emirados Árabes Unidos.
- Planeje ou realize uma consulta ginecológica e planeje uma consulta com o radiologista intervencionista antes dos Emirados Árabes Unidos.
- Se possível, realize o maior número possível de procedimentos de qualificação no ambulatório.
- Certifique-se de que a paciente tenha indicações para EAU a recusa do tratamento cirúrgico; nenhum consentimento para transfusão de sangue; cirurgia de miomas uterinos anteriormente falhada. Anote-os no histórico médico.
- Pergunte ao paciente sobre os sintomas do(s) mioma(s).
- Discuta a eficácia dos Emirados Árabes Unidos e as expectativas do paciente (nos Resultados Representativos).
- Pergunte se a paciente foi tratada para miomas uterinos anteriormente. Verifique qual método foi usado.
- Se o paciente recusar tratamento cirúrgico ou transfusão de sangue, faça uma declaração por escrito.
- Certifique-se de que o paciente que se qualificou para o procedimento dos Emirados Árabes Unidos não tenha contra-indicações absolutas: miomas assintomáticos; uma gravidez viável; infecção genital atual ou recente; dúvidas diagnósticas devido a fatores clínicos ou imagem inadequada; contra-indicações para o uso de agentes de contraste radiológico; características de leiomiossarcoma na ressonância magnética; tumor maligno uterino ou ovariano, a menos que seja realizado para paliação ou como adjuvante à cirurgia87. Anote-os no histórico médico.
- Se o paciente precisar de EAU apesar dos miomas assintomáticos, explique que esses casos não se qualificam para o procedimento. Explique ao paciente que miomas assintomáticos requerem apenas monitoramento ginecológico regular.
- Se houver contra-indicações relativas aos Emirados Árabes Unidos (miomas grandes e planos reprodutivos), discuta-as com o paciente e anote esse fato no prontuário médico.
- Concentre-se nas possíveis complicações relacionadas à contraindicação relativa, descritas na introdução, certifique-se de que o paciente entenda e concorde com o procedimento.
- Discuta o efeito colateral e as complicações da embolização da artéria uterina com a paciente (ver introdução) e anote esse fato no prontuário médico.
- Ao conversar com o paciente, preste atenção especial à dor pós-embolização.
- Discuta os tratamentos da dor pós-embolização.
- Realize uma qualificação ginecológica.
- Colete o histórico médico e faça um exame ginecológico.
- Realizar uma avaliação ultrassonográfica dos órgãos reprodutivos para avaliar o tamanho e o tipo de miomas (classificação FIGO)88.
- Use uma sonda vaginal para estimar o tamanho e a localização do mioma (Figura 2). Os miomas uterinos tratados com EAU devem ser de 2 a 5 (idealmente, 3 a 4) de acordo com a classificação FIGO, e o diâmetro não deve exceder 10 cm.
- Inclua o protocolo da ultrassonografia da pelve no prontuário.
- Certifique-se de que o resultado da ultrassonografia forneça indicações para qualificação para o procedimento dos Emirados Árabes Unidos.
- Exclua processos malignos dentro da pelve.
- Certifique-se de que o paciente tenha resultados atuais (de preferência realizados dentro de 6 meses) de esfregaço cervical (PAP) e biópsia endometrial.
- Durante um ultrassom pélvico, use a sonda vaginal para avaliar os ovários e confirmar se sua estrutura está correta. Em caso de dúvida, verifique a ultrassonografia anterior ou faça o teste ROMA.
- Solicite uma ressonância magnética para avaliar o tumor uterino quanto aos recursos do LMS e aos recursos técnicos dos Emirados Árabes Unidos.
- Anote os resultados do esfregaço cervical (PAP), da biópsia endometrial, da ultrassonografia (possivelmente o teste ROMA) e da ressonância magnética no prontuário médico.
- Se os resultados estiverem incorretos, desqualifique o paciente do procedimento.
- Informe as pacientes sobre os resultados da qualificação ginecológica.
- Observe esse fato no prontuário médico. Encaminhe o paciente para o hospital.
- Marque uma consulta para o procedimento dos Emirados Árabes Unidos e lembre-se de que o paciente deve estar antes do 10º dia do ciclo.
- Pergunte à paciente se ela recusa a cirurgia. Em caso de recusa, anote esse fato no consentimento informado do paciente ou no prontuário.
- Pacientes com miomas sintomáticos que recusam a cirurgia se qualificam para os Emirados Árabes Unidos.
- Realize os seguintes testes pelo menos 7 dias antes dos Emirados Árabes Unidos para avaliar e evitar possíveis complicações: teste microbiológico de esfregaço vaginal (cultura vaginal aeróbica); urinálise; exames de sangue selecionados: hemograma completo, testes de coagulação (INR, APPT), painel renal (creatina, uréia), TSH, PCR.
- Descreva os resultados no prontuário médico.
- Informe ao paciente que resultados incorretos o desqualificam para o procedimento.
- Verifique a reserva ovariana da paciente testando os níveis séricos de AMH (recomendado) ou FSH (não recomendado abaixo de 40 anos) na fase folicular. Discuta com a paciente que o teste acima será útil para avaliar o dano ovariano como resultado da embolização não-alvo. Observe esse fato no prontuário médico.
- Pacientes qualificadas para EAU não devem declarar a vontade de engravidar devido ao aumento do risco de complicações na gravidez 14,32,38,50,51,52,89,90,91.
- Informe o paciente sobre o aumento do risco de complicações na gravidez após os Emirados Árabes Unidos.
- Observe o fato de que a paciente não declara a vontade de engravidar no consentimento informado da paciente ou no prontuário.
- Se a paciente ainda não excluir a gravidez no futuro, mas precisar de EAU, faça uma declaração por escrito de que foi informada sobre possíveis complicações na gravidez após a EAU.
- Realizar qualificação radiológica.
- Certifique-se de que a ressonância magnética pélvica foi realizada. O exame de ressonância magnética permite excluir outras patologias do órgão reprodutor e estruturas adjacentes (etapa 1.6.3.3. do procedimento de qualificação para EAU), avaliar a morfologia e localização dos miomas e anatomia para a viabilidade técnica da embolização (Figura 3, Figura 4). Caso contrário, marque o exame de ressonância magnética e a consulta com um radiologista intervencionista.
- Analise os exames de imagem e avalie o tipo e tamanho dos miomas.
- Se miomas submucosos (FIGO 0–1) forem encontrados, informe a paciente sobre o risco de descamação na cavidade uterina. A excreção completa pode causar sepse, enquanto a excreção em fragmentos é geralmente assintomática50.
- Se forem encontrados miomas pedunculados (FIGO 7) com pedúnculos subserosas, informe o paciente sobre o risco de descolamento do mioma pós-embolização na cavidade abdominal. Pode levar à inflamação aguda, e a reoperação laparoscópica pode ser necessária92.
- Se forem encontrados miomas grandes, informe ao paciente que o risco de complicações permanece inalterado, mas o resultado do procedimento é melhor para miomas pequenos93.
- Observe esse fato no consentimento informado do paciente ou no prontuário médico.
2. Preparação para o procedimento dos Emirados Árabes Unidos
NOTA: Destina-se a ginecologistas ou cirurgiões vasculares e radiologistas intervencionistas.
- Internar o paciente no hospital (departamento de cirurgia ginecológica ou vascular).
- Certifique-se de que ela esteja antes do 10º dia do ciclo na admissão.
- Realize ou solicite um exame ginecológico e uma ultrassonografia da pelve.
- Certifique-se de que o diagnóstico e a qualificação para o procedimento dos Emirados Árabes Unidos estejam corretos.
- Certifique-se de que nenhuma nova contra-indicação tenha aparecido desde a qualificação para os Emirados Árabes Unidos. Em caso afirmativo, sugira outras opções de tratamento e altere a data do procedimento.
- Realizar a ultrassonografia transvaginal 3D (USTV) e calcular os índices de volume e vascularização do mioma (VI, FI e VFI) usando o exame do software VOCAL (que é usado para avaliar a eficácia do procedimento da EAU72,75) (descrito na introdução) (Figura 5 e Figura 6).
- Observe esse fato no prontuário médico.
- Certifique-se de que o paciente qualificado para os Emirados Árabes Unidos tenha testes realizados durante a qualificação para os Emirados Árabes Unidos (descritos nas etapas 1.6.2, 1.6.3, 1.6.5 e 1.6.6 da Qualificação para os Emirados Árabes Unidos).
- Se o paciente foi pré-qualificado por um ginecologista e não faz exames de sangue, exame de urina e ressonância magnética, solicite os exames e marque uma consulta com um radiologista intervencionista (etapa 1.7 da Qualificação para os Emirados Árabes Unidos).
- Classifique ou solicite o nível sérico de AMH (recomendado) ou FSH (não recomendado com menos de 40 anos) antes da EAU para permitir a avaliação do dano ovariano como resultado da embolização "não-alvo".
- Informe ao paciente que os resultados do teste estarão disponíveis em cerca de um dia e o procedimento nos Emirados Árabes Unidos só será possível após o recebimento desses resultados.
- Informe ao paciente que resultados incorretos o desqualificam para o procedimento.
- AVISO! No caso de resultados ausentes ou incorretos do exame de Papanicolau, biópsia endometrial; o teste microbiológico de esfregaço vaginal, desqualifica o paciente dos Emirados Árabes Unidos (muito tempo para obter esses resultados). Requalifique-se após obter os resultados corretos.
- Observe esse fato no prontuário médico.
- Obtenha um consentimento informado para realizar EAU.
- Forneça ao paciente todas as informações sobre os Emirados Árabes Unidos.
- Discuta as possíveis complicações dos Emirados Árabes Unidos (descritas na introdução).
- Deixe o paciente pensar e fazer perguntas; permitir que o paciente dê um consentimento informado para realizar o procedimento dos Emirados Árabes Unidos.
- Informe ao paciente que ele tem o direito de mudar sua decisão até que os Emirados Árabes Unidos comecem.
- Se a paciente mudar sua decisão em relação aos Emirados Árabes Unidos, sugira outras opções de tratamento para miomas uterinos (descritos na introdução).
- Observe esse fato no consentimento informado do paciente ou no prontuário médico.
- Imediatamente antes do procedimento nos Emirados Árabes Unidos, verifique e certifique-se de que os testes descritos nas seções 1.6.2, 1.6.3, 1.6.5 e 1.6.6 de Qualificação para Emirados Árabes Unidos, bem como TVUS 3D, ressonância magnética e consulta com um radiologista intervencionista foram realizados e os resultados estão corretos.
- Desqualificar um paciente dos Emirados Árabes Unidos se os testes estiverem ausentes ou os resultados estiverem incorretos.
- Observe esse fato no prontuário médico.
- Informe o paciente e cuide da proibição de ingerir alimentos e líquidos desde a manhã até o procedimento. A exceção é uma pequena quantidade de líquido necessária para tomar a dose matinal da medicação.
- Certifique-se de manhã (antes dos Emirados Árabes Unidos) de que o paciente está em jejum.
- Certifique-se de que o paciente tomou os medicamentos para as próprias doenças crônicas.
- Observe esse fato no prontuário médico.
- Solicite ao paciente os seguintes medicamentos: 1 comprimido de ansiolítico (por exemplo, Estazolam) por via oral, 1 dose de antibióticos intravenosos, 1 glóbulo de metronidazol por via intravaginal, diclofenaco 100 mg de supositório retal.
- Dê os medicamentos acima cerca de 30 a 40 minutos antes dos Emirados Árabes Unidos.
- Observe esse fato no prontuário médico.
- Prepare o campo operatório certificando-se de que a axila esquerda e a virilha direita estejam raspadas.
- Se as áreas da pele acima não estiverem raspadas, raspe-as suavemente.
- Observe esse fato no prontuário médico.
- Certifique-se de que o paciente não tenha um dispositivo intrauterino (DIU).
- Se a paciente tiver um DIU no útero, informe-a sobre o aumento do risco de infecção na cavidade uterina e ofereça-se para removê-lo antes dos Emirados Árabes Unidos.
- Se o paciente não concordar em remover o DIU, anote esse fato no consentimento informado do paciente ou no prontuário médico.
- Certifique-se de que o paciente relate quaisquer reações alérgicas a medicamentos, agentes de contraste e desinfetantes e anote esse fato e os resultados no prontuário médico.
3. Executando o procedimento dos Emirados Árabes Unidos
NOTA: Destina-se a radiologistas intervencionistas e anestesiologistas.
- Realize o procedimento em condições estéreis.
- Coloque o paciente na mesa de operação e desinfete amplamente a região inguinal direita usando um desinfetante hospitalar (com a aprovação apropriada).
- Cole o campo cirúrgico ao redor do local da cirurgia (virilha direita).
- Selecione o tipo de anestesia: anestesia local ou peridural (AE) e anote a escolha do paciente no prontuário.
- EAU sob anestesia local.
- Anestesiar (administração subcutânea) solução de lidocaína a 2% no local da cirurgia.
- Administre 5 mg de morfina por via intravenosa, conforme necessário.
- Antes de iniciar o procedimento de EAU, certifique-se de que a anestesia local esteja operacional.
- Emirados Árabes Unidos sob EA
- Prepare o paciente adequadamente para o EA.
- Execute o EA antes de colar o campo cirúrgico.
- Certifique-se de que o paciente qualificado para o procedimento de EA não tenha as seguintes contra-indicações EA: recusa do procedimento, coagulopatia, trombocitopenia, doença hemolítica, uso de anticoagulantes, choque, infecção no local da injeção peridural, bacteremia, alergia a anestésicos locais, deformidades anatômicas da coluna vertebral, aumento da pressão intracraniana, doença neurológica, estenose aórtica ou mitral grave94. Observe esse fato no prontuário médico.
- Ligue para um anestesiologista e peça EA.
- Coloque um cateter fino no espaço peridural na região lombar e aplique um anestésico (procedimento dirigido aos anestesiologistas).
- Antes de iniciar o procedimento dos Emirados Árabes Unidos, certifique-se de que o EA esteja operacional.
- O procedimento dos Emirados Árabes Unidos
- Realize o procedimento dos Emirados Árabes Unidos no Angio Suit sob orientação de fluoroscopia.
- Obter acesso ao sistema vascular pela técnica de Seldinger95,96 (Figura 7, Figura 8 e Figura 9).
- Insira um cateter pigtail na aorta abdominal, logo abaixo das artérias renais.
- Realize angiografia para visualizar os vasos.
- Realize aortonefrografia para avaliar a anatomia dos vasos que suprem os miomas e planejar o procedimento (Figura 10).
- Realizar angiografia da artéria ilíaca interna em projeção ântero-posterior e oblíqua para revelar o óstio da artéria uterina.
- Comece pelo lado esquerdo, depois pelo direito, devido ao local da punção e ao formato específico do cateter. Dependendo do calibre do vaso, o cateter principal ou microcateter é introduzido seletivamente na artéria uterina (Figura 11).
- Coloque o cateter profundamente na artéria uterina. Embolize o vaso com partículas de hidrogel. Devido à presença de anastomose útero-ovário, cujo tamanho é estimado em aproximadamente 500 μm, o tamanho sugerido das partículas para embolização é de 700 μm para reduzir o risco de "embolização não-alvo".
- Continue a embolização até que o fluxo sanguíneo no vaso esteja completamente bloqueado. O desfecho do tratamento é a estase de contraste no vaso, o que comprova seu fechamento eficaz.
- Realize a embolização da artéria uterina do lado oposto com o mesmo acesso. O tratamento dura cerca de 0,5 a 1,0 h66,67 (Figura 12).
- Avalie a eficácia da embolização de um cateter colocado na artéria ilíaca interna durante a angiografia de controle. A ausência de um influxo ativo de sangue sombreado (para as artérias uterinas) indica que o procedimento é considerado tecnicamente correto (Figura 13).
- Remova cuidadosamente o cateter.
- Fechar o local da punção por compressão manual com curativo de pressão, que deve ser mantido pelas próximas 6 h ou dispositivo de fechamento (Figura 14).
- Descreva o curso dos Emirados Árabes Unidos no prontuário médico.
4. Atendimento ao paciente após o procedimento nos Emirados Árabes Unidos
NOTA: Destina-se a ginecologistas ou cirurgiões vasculares e anestesiologistas.
- Inicie o tratamento analgésico: bomba de analgesia controlada pelo paciente (PCA) ou EA.
- Informar e discutir as opções de tratamento analgésico com o paciente.
- Informar ao paciente que a EA proporciona melhor controle da dor e reabilitação mais rápida, em comparação com a bomba PCA76.
- Observe esse fato e a escolha do paciente no prontuário.
- Tratamento analgésico da dor pós-embolização com bomba de PCA.
- Prepare a seringa para a bomba de PCA com a solução de morfina.
- Encha a seringa de 50 mL para a bomba de PCA com 50 mg de morfina e solução de NaCl a 0,9% (concentração de 1 mg/mL).
- Prepare a bomba PCA para uso intravenoso.
- Junte o dreno à seringa.
- Insira a punção venosa usando uma cânula.
- Insira a seringa na bomba PCA.
- Encha o dreno, inicie a bomba PCA.
- Ligue o botão INICIAR.
- Bloqueie a bomba PCA.
- Defina os parâmetros da bomba PCA (listados abaixo) (Figura 15).
AVISO! Doses mais altas de morfina podem causar depressão respiratória.- Use uma concentração de morfina de 1 mg / mL. Use uma dose de perfusão de morfina sob demanda (bolus intravenoso) (Bolus p.) de 0,5 mg com um intervalo de tempo após o qual a próxima infusão sob demanda pode ser fornecida (intervalo de bloqueio / [Karencja]) de 5 min (para evitar depressão respiratória). Use um tempo de injeção intravenosa de morfina durante a infusão sob demanda de 10 s.
- Certifique-se de que todas as etapas acima sejam executadas.
- Encomende morfina na bomba de PCA por até 24 h.
- Monitore a dor de acordo com a Escala de Avaliação Numérica (NRS). Anote o valor NRS no prontuário.
- Use o Cartão de Avaliação da Dor (PAC).
- Informe ao paciente que, quando os sintomas de dor surgirem, ele deve pressionar o "joy-stick", obtendo assim o medicamento sob demanda.
- Certifique-se de que o paciente entenda as instruções.
- Observe a quantidade de "bolus intravenoso" sob demanda para "bolus vazio" (lançado durante o intervalo de bloqueio - seção 4.2.3 do Atendimento ao paciente após o PROTOCOLO dos Emirados Árabes Unidos) (Figura 16).
- Se a proporção de "bolus vazio" para "bolus intravenoso" sob demanda atingir um valor superior a 2/1 (67% / 33%), use o procedimento abaixo (Figura 17, Figura 18).
- Para melhorar a eficácia da terapia de alívio da dor usando uma bomba de PCA e reduzir o risco de efeitos colaterais da morfina, considere o uso de paracetamol ou anti-inflamatórios não esteroidais em injeções intravenosas e doses padrão.
- Cuide das situações em que o paciente precisa sair do leito.
- Não desligue a bomba.
- Desconecte o dreno e prenda-o com uma rolha.
- Quando o paciente retornar, reconecte o dreno.
- Prepare a seringa para a bomba de PCA com a solução de morfina.
- Tratamento analgésico da dor pós-embolização com EA.
- Continue EA se ele foi usado para o procedimento dos Emirados Árabes Unidos.
- Se a anestesia local foi usada para o procedimento de EAU e o paciente solicitar EA, antes da colocação do cateter peridural, certifique-se de que os testes de hemograma completo e coagulação estejam corretos.
- Certifique-se de que o paciente qualificado para o procedimento de EA não tenha as contradições descritas na seção 3.4.3 de Realizando o procedimento dos Emirados Árabes Unidos. Observe esse fato no prontuário médico.
- Ligue para um anestesiologista e peça EA.
- Certifique-se de que o EA esteja operacional.
- Determine o modo de trabalho do EA (bolus ou contínuo) com o anestesiologista. Observe esse fato no prontuário médico.
- No modo contínuo (CEA), consulte um anestesiologista e verifique as configurações da bomba de infusão.
- No modo bolus (BEA), discuta com o anestesiologista os intervalos de tempo entre a administração do agente anestésico local.
- Mantenha o cateter por 24 a 48 h, dependendo das necessidades.
- Monitore a dor com a escala NRS. Anote o valor NRS no prontuário.
- Use o PAC.
- Continue CEA/BEA até que seja necessário, não mais do que 48 h.
- Continue o tratamento analgésico após PCA ou EA, se necessário.
- Encomende Paracetamol 3 x 1,0 g por via intravenosa.
- Encomende Diclofenaco 2 x 50 mg supositório retal.
- Se o tratamento analgésico acima não for suficiente, inclua analgésicos de suporte.
- Encomende cetoprofeno 2 x 100 mg por via intravenosa.
- Trate os sintomas do trato urinário solicitando Furazidina 3 x 100 mg por via oral.
5. Visita de controle após o procedimento dos Emirados Árabes Unidos
NOTA: Isso é dirigido a ginecologistas.
- Realize o primeiro exame de controle no primeiro dia após os Emirados Árabes Unidos.
- Avalie o estado geral do paciente.
- Meça a temperatura corporal do paciente.
- Classifique a dor após a EAU de acordo com a escala NRS. Use o PAC.
- Avalie a ferida onde o cateter vascular foi inserido.
- Realize hemograma completo e testes de coagulação.
- Realize uma USTV para avaliar a condição dos órgãos pélvicos após a EAU.
- Realize uma USTV 3D usando sonda de volume para avaliar os índices de volume e vascularização do mioma (VI, FI e VFI).
- Se não houver complicações e a dor pós-embolização tiver sido controlada por analgésicos orais, dê alta ao paciente para casa.
- Informe ao paciente que, se ocorrer febre, dor abdominal e corrimento vaginal purulento após a hospitalização, o paciente deve procurar atendimento médico imediatamente.
- Realize a próxima visita de controle 3 meses após os Emirados Árabes Unidos.
- Realize um exame ginecológico, teste de hemograma completo e nível sérico de AMH ou FSH.
- Realize ressonância magnética ou USTV para avaliar a condição dos órgãos pélvicos após a UAE (Figura 19).
- Realizar TVUS 3D usando sonda de volume para avaliar os índices de volume e vascularização do mioma (VI, FI e VFI).
- Realize a última visita de controle 6 meses após os Emirados Árabes Unidos.
- Realize um exame ginecológico, teste de hemograma completo e nível sérico de AMH ou FSH.
- Realize uma USTV para avaliar a condição dos órgãos pélvicos após a EAU.
- Realizar TVUS 3D usando sonda de volume para avaliar os índices de volume e vascularização do mioma (VI, FI e VFI).
- Avalie a eficácia dos Emirados Árabes Unidos.
- Compare os resultados do teste de hemograma antes e depois dos Emirados Árabes Unidos.
- Compare os volumes e índices de vascularização do mioma (VI, FI e VFI) antes e depois da EAU.
- Compare os níveis séricos de AMH ou FSH antes e depois da EAU para avaliar a possibilidade de danos iatrogênicos aos ovários durante a EAU como resultado da embolização "não-alvo".
- Informar à paciente que, após a embolização da artéria uterina, ela deve passar por exames ginecológicos regulares.
- Em casos selecionados (sem redução dos sintomas do mioma, suspeita de demarcação tecidual ou dúvida em outros exames adicionais), realize uma ressonância magnética um ano após a UAE (Figura 20).
Resultados
Foram realizados 557 procedimentos nos Emirados Árabes Unidos no período de 2009 a 2019. A média de idade dos pacientes foi de 38 anos (31–53 anos de idade). O sucesso técnico foi alcançado em 547 pacientes (98,2%).
A redução média do volume do mioma (avaliação do volume da RM) 3 meses após o procedimento de EAU realizado no período de 2009 a 2013 no grupo de 206 pacientes com idade entre 32 e 52 anos (média de idade: 39 anos) foi de 62%. A menor redução foi de 9% (paciente com mioma hialinizado). A redução completa (100%) foi alcançada em pacientes com mioma submucoso separado (FIGO 0). 90% dos pacientes relataram satisfação após o procedimento de EAU64.
A redução média do volume do mioma 3 meses após a UAE (avaliação do volume VOCAL por ultrassom) em um grupo de 65 pacientes com idades entre 29 e 52 anos (idade média: 43,1 anos) foi de 50,1% (2,7% a 93,5%). Antes do procedimento de EAU, o volume mediano do mioma era de 101 cm3 (variação de 23,6 a 610,0 cm3), enquanto, após 3 meses, foi observada a redução do volume mediano do mioma para 50,4 cm3 (variação de 6,9 a 193,9 cm3). O teste de correlação de Spearman mostrou uma correlação positiva estatisticamente significativa, mas relativamente fraca (R = 0,33; p = 0,006) entre o volume inicial do mioma dominante e a redução percentual do volume. Curiosamente, miomas menores mostraram uma grande variabilidade de redução do volume de miomas 3 meses após a EAU, enquanto miomas maiores mostraram uma reação estável e previsível aos Emirados Árabes Unidos72.
Foi observada redução dos índices vasculares do Doppler (VI, FI e VFI) no grupo de 17 pacientes 3 meses após a USC. A redução percentual em VI e VFI foi de 95,4%, enquanto em IF a redução foi de 58,3%75.
A avaliação da reserva ovariana foi realizada em 30 pacientes com idades entre 33 e 40 anos (idade média: 35 anos) 3 meses após a EAU. O volume médio do mioma dominante foi de 107,75 cm3 (variação de 87,4 a 131,1 cm3). Os seguintes marcadores da reserva ovariana foram investigados: contagem de folículos antrais (AFC), AMH, inibina B (INHB), FSH e estradiol (E2). Observou-se uma diminuição significativa na AFC (56,7%; p < 0,001), AHM (36,7%; p < 0,001), INHB (46,7%; p < 0,001) e E2 (43,3%; p < 0,001). Simultaneamente, observou-se um aumento significativo no nível sérico de FSH (43,4%; p < 0,001)65.
Três meses após o procedimento de EAU em duas pacientes com miomas submucosos (FIGO 0) (com diâmetros de 6 cm e 8 cm) foi observada inversão uterina durante a excreção de fragmentos necróticos demarcados de miomas através do canal cervical, o que resultou em histerectomia de emergência.
A redução da dor pós-embolização (de acordo com o CAP) com o uso de PCA (procedimento 4.2 do Protocolo de Atendimento ao Paciente após a EAU) foi avaliada em 60 pacientes na escala NRS no dia seguinte ao procedimento de EAU. O NRS mediano imediatamente após os Emirados Árabes Unidos foi de 10 (intervalo de 5 a 10), enquanto após o tratamento o NRS mediano foi classificado como 4 (intervalo de 1 a 5). O teste de correlação de Spearman entre o volume inicial de miomas (mediana de 194,5 cm3, variação de 79 a 411 cm3) e NRS imediatamente após a UAE mostrou uma correlação positiva forte e estatisticamente significativa (R = 0,6; p < 0,001), enquanto a correlação entre o volume inicial de miomas e NRS após o tratamento mostrou uma correlação positiva fraca estatisticamente significativa (R = 0,34; p < 0,001). Analisando as relações acima, pode-se concluir que os miomas maiores após a EAU causam dor pós-embolização mais forte após a EAU. No entanto, o tratamento da dor pós-embolização após a EAU de miomas menores com o uso de PCA dá melhores resultados.
Os dados resumidos para os Resultados Representativos são fornecidos na Tabela 1.
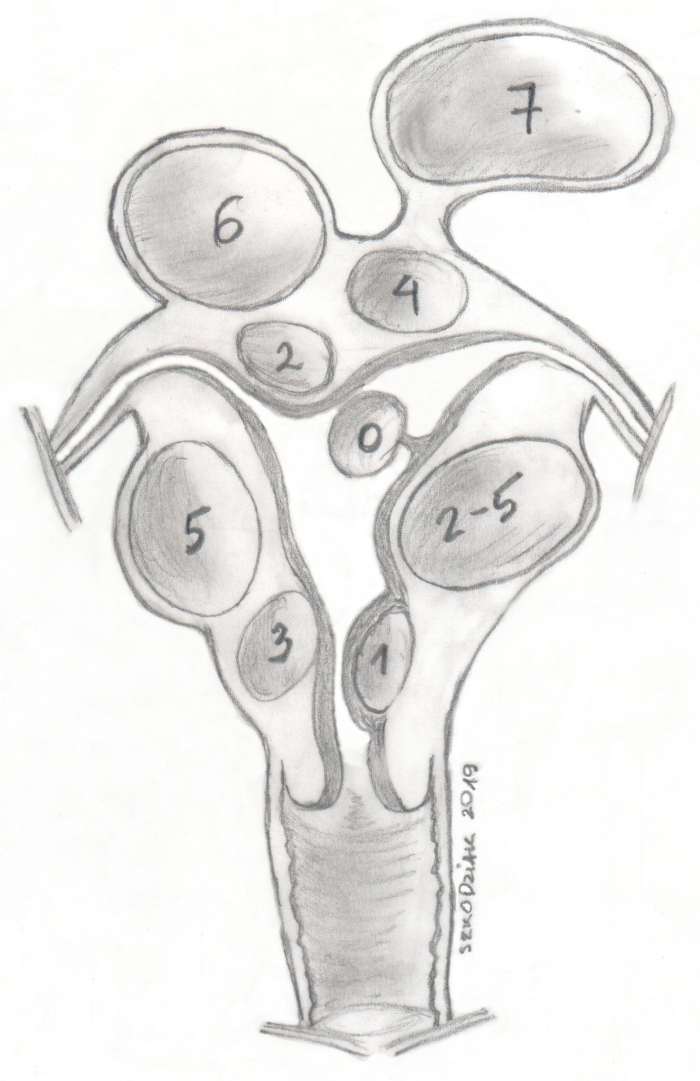
Figura 1: Classificação dos miomas uterinos da FIGO. Clique aqui para ver uma versão maior desta figura.
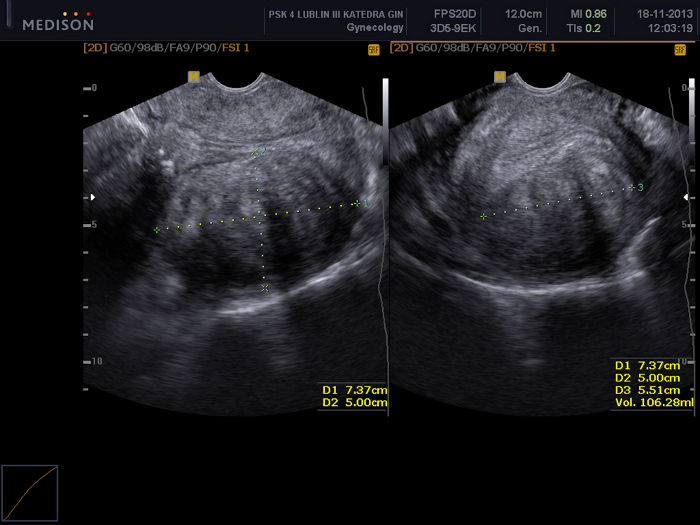
Figura 2: Exame pélvico usando uma ultrassonografia transvaginal.
Visível um mioma uterino (FIGO 5) com dimensões de 73 x 50 x 55 mm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Exame de ressonância magnética pélvica em pré-qualificação para os Emirados Árabes Unidos.
Visível na seção sagital um grande mioma uterino (FIGO 2–5) com efeito de massa. Clique aqui para ver uma versão maior desta figura.

Figura 4: Exame de ressonância magnética pélvica em pré-qualificação para os Emirados Árabes Unidos.
Visível na seção sagital um mioma uterino (FIGO 2–5). Clique aqui para ver uma versão maior desta figura.
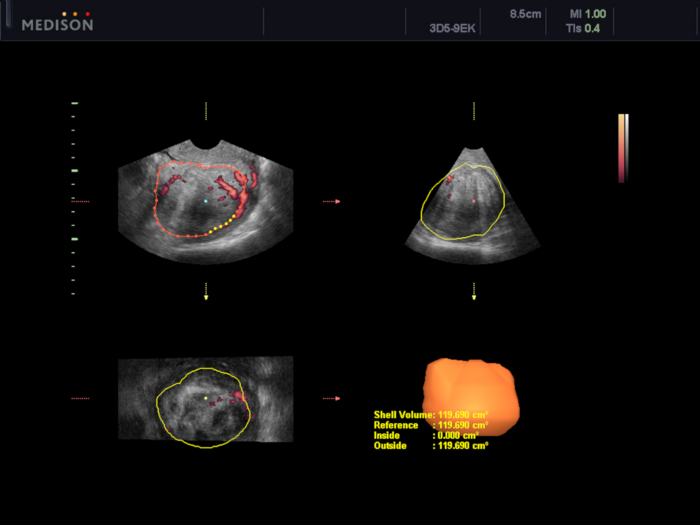
Figura 5: Avaliação do volume do mioma uterino usando o software VOCAL.
Nesse caso, o volume é estimado em 119,7 cm3. Clique aqui para ver uma versão maior desta figura.
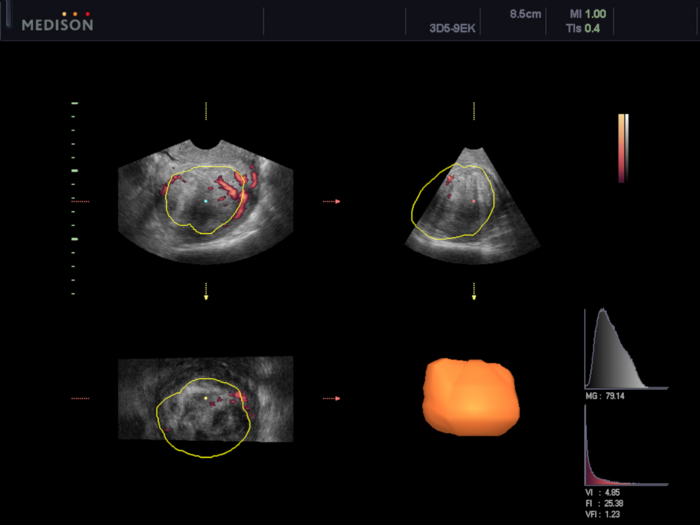
Figura 6: Avaliação da vascularização do mioma uterino usando o software VOCAL.
Nesse caso, foram calculados os índices de vascularização (VI 4,85, FI 25,38 e VFI 1,23). Clique aqui para ver uma versão maior desta figura.
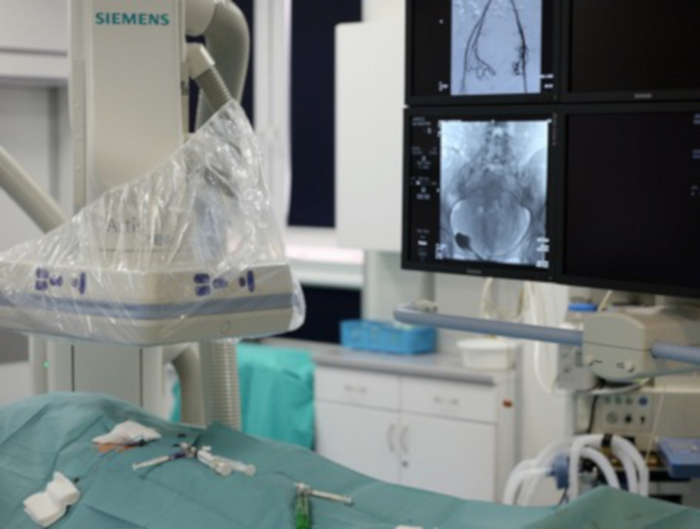
Figura 7: A figura mostra um fragmento do laboratório angiográfico.
No canto inferior esquerdo, o paciente com virilha exposta através da qual mais ferramentas são introduzidas. No canto superior esquerdo, o arco em C do angiógrafo pode ser visto. No canto superior direito, os monitores são visíveis, onde o operador rastreia a ferramenta de entrada. Clique aqui para ver uma versão maior desta figura.

Figura 8: Um conjunto para punções arteriais.
De baixo: uma agulha, uma trava vascular com um introdutor e um guia. Clique aqui para ver uma versão maior desta figura.
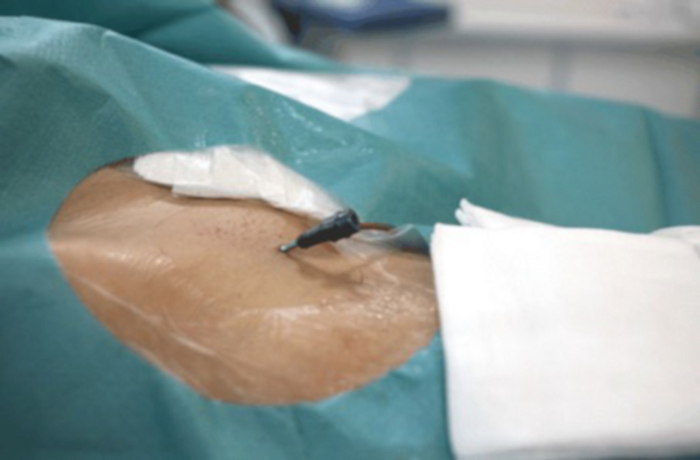
Figura 9: Close-up da virilha com bloqueio vascular visível inserido na artéria femoral. Clique aqui para ver uma versão maior desta figura.
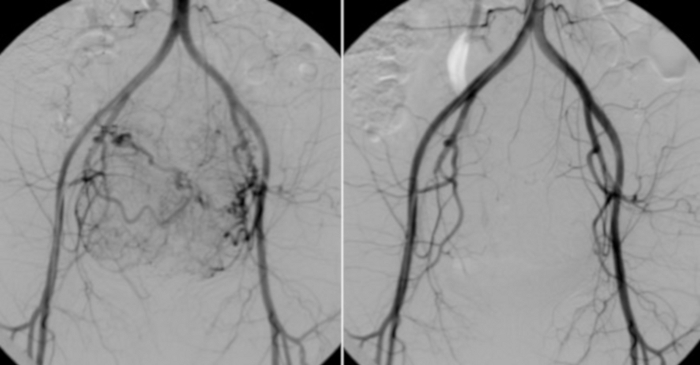
Figura 10: À esquerda, angiografia de cateter colocado na aorta abdominal.
O rolamento vascular visível dos miomas uterinos. Para comparação (à direita), um teste de controle realizado após os Emirados Árabes Unidos. Clique aqui para ver uma versão maior desta figura.
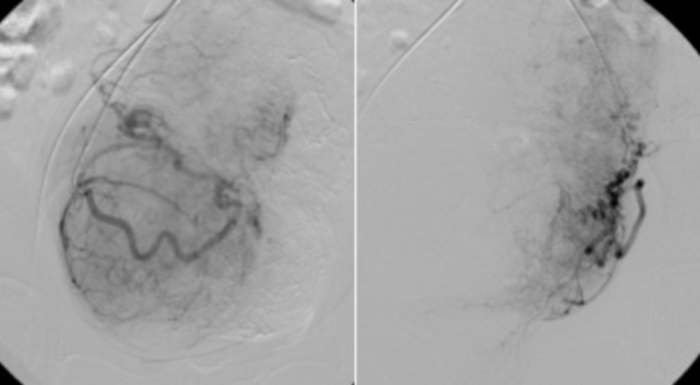
Figura 11: Angiografia seletiva com cateter RUC colocado nas partes proximais das artérias uterinas.
Leito vascular visível de miomas uterinos. Clique aqui para ver uma versão maior desta figura.
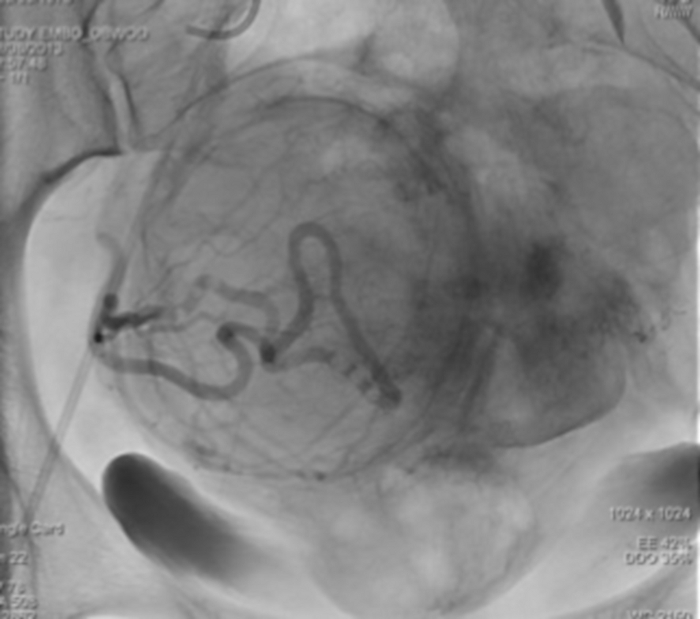
Figura 12: A imagem de raios-X único mostrando a estase do agente de contraste na artéria uterina direita. Clique aqui para ver uma versão maior desta figura.

Figura 13: A angiografia de controle realizada a partir do cateter principal localizado, respectivamente, na artéria ilíaca esquerda e direita, confirma a falta de entrada de sangue fresco (sombreamento) nas artérias uterinas. Clique aqui para ver uma versão maior desta figura.

Figura 14: O local do acesso vascular após a conclusão dos Emirados Árabes Unidos.
Incisão visível de 2 mm perto da virilha direita. Clique aqui para ver uma versão maior desta figura.

Figura 15: Configurações dos parâmetros da bomba PCA para dor pós-embolização após o tratamento da EAU (seção 4.2.3 do Protocolo de atendimento ao paciente após a EAU). Clique aqui para ver uma versão maior desta figura.

Figura 16: Bomba PCA em operação.
A proporção de bolus intravenoso sob demanda para "bolus vazio" (seção 4.2.6.2. do Atendimento ao paciente após o PROTOCOLO DOS EMIRADOS ÁRABES UNIDOS) 1:1 (50%:50%). Clique aqui para ver uma versão maior desta figura.

Figura 17: Bomba PCA em operação.
A proporção de bolus intravenoso sob demanda para "bolus vazio" (seção 4.2.6.3. do Atendimento ao paciente após o PROTOCOLO dos Emirados Árabes Unidos) 1:2 (33%:67%). Isso requer tratamento analgésico adicional (procedimento 4.2.6.4. do Atendimento ao paciente após o PROTOCOLO dos EAU). Clique aqui para ver uma versão maior desta figura.

Figura 18: Bomba PCA em operação.
A proporção de bolus intravenoso sob demanda para "bolus vazio" (seção 4.2.6.3. do Atendimento ao paciente após o PROTOCOLO DOS EMIRADOS ÁRABES UNIDOS) 1:3 (25%:75%). Isso requer tratamento analgésico adicional contínuo (procedimento 4.2.6.4. do Atendimento ao paciente após o PROTOCOLO DOS EMIRADOS ÁRABES UNIDOS). Clique aqui para ver uma versão maior desta figura.
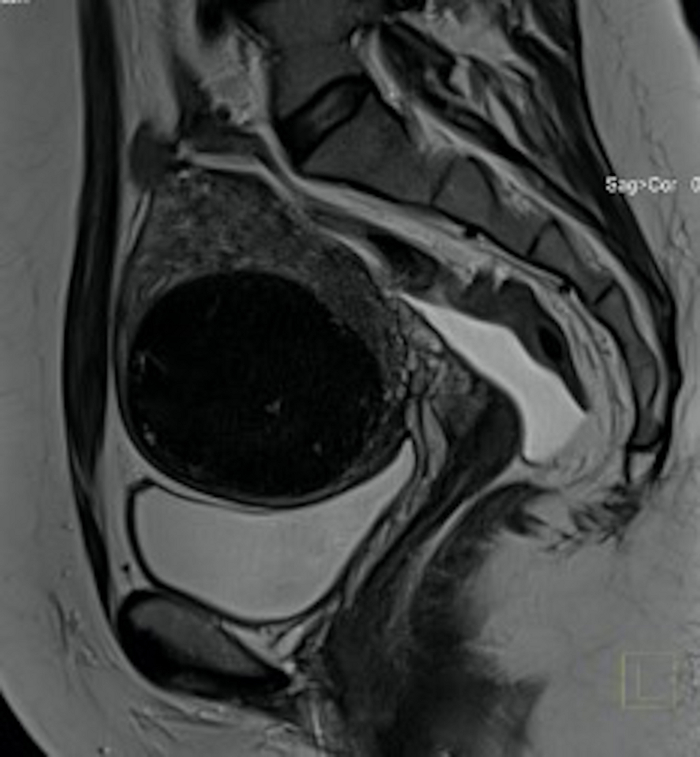
Figura 19: Exame de ressonância magnética pélvica 3 meses após o procedimento nos Emirados Árabes Unidos (o mesmo caso da Figura 3).
Visível na seção sagital é um mioma uterino (FIGO 5), significativamente menor do que antes do procedimento, densidade diferente do tecido fibróide. Clique aqui para ver uma versão maior desta figura.
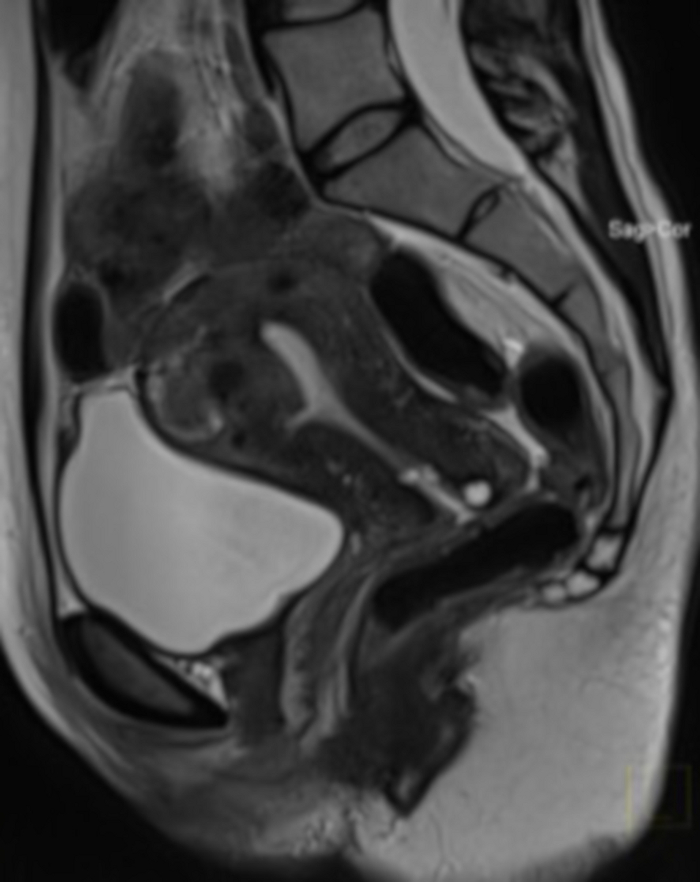
Figura 20: Exame de ressonância magnética pélvica 1 ano após o procedimento nos Emirados Árabes Unidos (o mesmo caso da Figura 4).
Visível na seção sagital é um mioma uterino (FIGO 2–5), com uma redução de volume muito grande após a UAE. A RM foi realizada devido à suspeita de demarcação tecidual após o procedimento (sem possibilidade de avaliar a estrutura do mioma em um exame bimanual). Clique aqui para ver uma versão maior desta figura.
| RESULTADOS REPRESENTATIVOS / O PROTOCOLO DE LUBLIN 64,65,72 | ||
| O número de procedimentos dos Emirados Árabes Unidos realizados no período de 2009 a 2019 | 557 | |
| Sucesso técnico | Alcançado em 547 pacientes (98,2%) | |
| A redução média do volume do mioma (avaliação do volume da ressonância magnética) 3 meses após a UAE no grupo de 206 pacientes com idades entre 32 e 52 anos (idade média - 39 anos) | 62.0% (9.0-100.0%) | |
| A redução média do volume do mioma (avaliação do volume VOCAL por ultrassom) 3 meses após a UAE no grupo de 65 pacientes com idade entre 29 e 52 anos (idade média – 43,1 anos) | 50.1% (2.7-93.5%) | |
| Avaliação da reserva ovariana | Diminuição no AFC | 56,7% (p<0,001) |
| Diminuição do AMH | 36,7% (p<0,001) | |
| Diminuição da INHB | 46,7% (p<0,001) | |
| Diminuição em E2 | 43,3% (p<0,001) | |
| Aumento do FSH | 43,4% (p<0,001) | |
| Redução da dor pós-embolização (de acordo com o CAP) com o uso de PCA (procedimento 2. do PROTOCOLO "Cuidados ao paciente após a EAU") avaliada no grupo de 60 pacientes | O NRS mediano imediatamente após os Emirados Árabes Unidos | 10 (intervalo 5-10) |
| O NRS mediano no dia seguinte aos Emirados Árabes Unidos | 4 (intervalo 1-5) | |
Tabela 1: Resultados representativos da técnica dos Emirados Árabes Unidos no tratamento de miomas uterinos sintomáticos realizados de acordo com o Protocolo de Lublin.
Discussão
Devido às diferenças na estrutura, tamanho, localização e sintomas dos miomas uterinos, a criação de um protocolo uniforme dos Emirados Árabes Unidos não foi uma tarefa fácil. Tem havido muitas discrepâncias quanto aos pressupostos desse método terapêutico com as expectativas dos pacientes, tanto na fase de qualificação quanto nos efeitos do tratamento. Mais de uma vez, as pacientes encaminhadas para a EAU não relataram nenhum sinal clínico de miomas e não sabiam que esses tumores uterinos não seriam removidos radicalmente. A única expectativa explícita era se livrar dos miomas sem cirurgia.
Portanto, é importante que a paciente compreenda os pressupostos desse método, aceite-o e conheça as diferenças em relação aos métodos alternativos de tratamento de miomas uterinos. Sua escolha consciente (seção 1.1. do Protocolo de Qualificação para os Emirados Árabes Unidos) é um ponto crítico, e sua implementação adequada permitirá que o protocolo seja continuado.
Durante a implementação do protocolo, alguns procedimentos são repetidos. Isso é pretendido e resulta da fórmula adotada por esta revista, na qual comandos individuais são escritos em modo imperativo e são direcionados a uma pessoa. No entanto, vários médicos estão frequentemente envolvidos na qualificação, preparação e outras etapas dos Emirados Árabes Unidos. Esses também são pontos críticos do protocolo; sua omissão pode resultar em EAU em condições não ideais ou com a presença de contraindicações. Daí a divisão do protocolo em 5 capítulos. Isso permite que ele seja continuado por vários especialistas, e os pontos de protocolo repetidos são verificados de forma independente.
Uma dificuldade adicional na criação de um protocolo uniforme de embolização da artéria uterina no tratamento de miomas uterinos é o grande número atual de recomendações (até 11) que se relacionam com o mesmo procedimento41. Embora suas suposições sejam semelhantes, como sempre, "o diabo está nos detalhes", detalhes que exigiam unificação. As contraindicações relativas à localização de miomas ou planos reprodutivos de pacientes submetidos a EAU são as mais controversas durante as qualificações. Aplicando critérios mais rigorosos propostos pelo SOGC, os pacientes devem ser excluídos desse procedimento, enquanto as recomendações mais liberais do RCOG permitem a qualificação para os Emirados Árabes Unidos 14,32,43. A questão é o que fazer. Durante a criação do protocolo, baseamos a decisão (além da extensa literatura) na análise de nossos casos e na experiência adquirida, o que requer uma abordagem individual de cada paciente. Portanto, o protocolo não exclui o desempenho da EAU em pacientes com contraindicações relativas (seções 1.4 do Protocolo de qualificação para EAU). A qualificação e preparação corretas para os Emirados Árabes Unidos parecem ser a chave para o sucesso terapêutico. A técnica em si também é muito importante, assim como os cuidados com os Emirados Árabes Unidos, que garantem não apenas o sucesso terapêutico ou a satisfação do paciente, mas também a ausência de complicações descritas acima.
Independentemente do número de miomas, todas as lesões são embolizadas durante um procedimento. Normalmente, quanto mais miomas, maior será o material de embolização que será injetado. Isso prolonga a duração da embolização, mas não altera o procedimento. A EAU pode ser modificada se observarmos uma conexão óbvia com a artéria ovariana, o que pode resultar em um risco aumentado de embolização não-alvo. Podemos então fechar essa conexão (por exemplo, usando bobinas), separando assim o suprimento dos ovários e do útero e, em seguida, continuar a embolização com o uso de partículas de 700 μm. Se não for possível implantar bobinas, aumentamos o diâmetro da partícula para 900 μm.
Existem também alguns casos em que os miomas podem ser supridos pelo lado das artérias ovarianas; Então, as artérias uterinas são hipoplásicas. Nesses casos, para realizar a embolização com sucesso, um microcateter deve ser inserido na artéria ovariana e além do ovário, depositando o material de embolização no leito vascular uterino, mantendo o suprimento ovariano adequado.
A vantagem indiscutível da embolização é o fato de não ser um procedimento tecnicamente difícil e não exigir equipamentos sofisticados.
Os pontos fortes do protocolo são os pontos referentes ao tratamento da dor pós-embolização, sobre a qual pelo menos metade dos pacientes não tinha ouvido falar ao se qualificar para a EAU. O procedimento padrão que propomos é o uso de uma bomba PCA (seção 4.2 do Protocolo de atendimento ao paciente após os Emirados Árabes Unidos), e os resultados obtidos confirmam a alta eficácia de tal tratamento.
Em relação a futuras modificações no protocolo dos Emirados Árabes Unidos, parece possível alterar a seção 10 do Protocolo de preparação para os Emirados Árabes Unidos, que exige a remoção do DIU do útero antes do procedimento devido ao risco de inflamação e sepse. Em grandes estudos de acompanhamento, o risco de infecção na pelve combinada com a presença de um DIU é inferior a 1 em 130049.
A UAE tem sido tratada como um método experimental desde o seu primeiro uso, pois exigiu avaliar a eficácia e examinar as complicações que esse procedimento pode causar em períodos de curto e longo prazo. Durante esses anos, as indicações e contraindicações foram modificadas com base em novos resultados de testes e observação clínica. Os dados atuais, incluindo vários estudos controlados randomizados, reconhecem os Emirados Árabes Unidos como um método de tratamento valioso para miomas uterinos sintomáticos, cuja eficácia e segurança foram bem estabelecidas.
A criação do protocolo acima se deve a uma análise minuciosa da literatura atual, recomendações relevantes e experiência adquirida como resultado da estreita cooperação de ginecologistas e radiologistas cirúrgicos durante a década.
Divulgações
Os autores não têm nada a divulgar.
DECLARAÇÃO:
Piotr Szkodziak como autor da Figura 1, ilustrando a classificação de miomas uterinos FIGO, permite o uso gratuito da figura para aplicações científicas e educacionais sem quaisquer modificações. A intenção de modificar a figura deve ser aceita pelo autor (piotr.szkodziak@gmail.com).
Agradecimentos
Os autores gostariam de agradecer a toda a equipe da 3ª Cátedra e Departamento de Ginecologia e Departamento de Radiologia Intervencionista e Neurorradiologia da Universidade Médica de Lublin por sua ajuda na implementação do protocolo de Embolização das Artérias Uterinas de Lublin.
Materiais
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
Referências
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados