Method Article
Le protocole de Lublin de l’embolisation des artères utérines dans le traitement des fibromes utérins symptomatiques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici une méthode d’embolisation de l’artère utérine pour le traitement des fibromes utérins symptomatiques divisée en cinq sections : qualification, préparation, performance, soins post-intervention et visites de suivi. Ce protocole nécessite une étroite collaboration entre les gynécologues et les radiologues interventionnels, permettant la bonne exécution de la procédure ci-dessus.
Résumé
Les fibromes utérins sont des tumeurs bénignes provenant du tissu musculaire lisse, constituant le stroma musculaire utérin. Les fibromes utérins sont les tumeurs bénignes les plus courantes chez les femmes. Chez 20 à 50 % des femmes, les fibromes sont asymptomatiques et ne nécessitent aucun traitement. Les principaux symptômes des fibromes utérins sont des saignements menstruels abondants, des saignements utérins anormaux et des symptômes de pression. Les symptômes de pression peuvent provoquer un syndrome de douleur pelvienne, des troubles de la miction et de la constipation.
Les méthodes de traitement actuellement utilisées comprennent le traitement chirurgical, la thérapie pharmacologique et les procédures mini-invasives. La méthode mini-invasive la plus couramment appliquée est l’embolisation des artères utérines. Cette procédure est actuellement une méthode de traitement largement acceptée pour les fibromes utérins symptomatiques et a été reconnue comme telle par le National Institute for Health and Clinical Excellence dans les directives pour les saignements menstruels abondants.
Il s’agit d’une procédure compliquée qui nécessite une étroite collaboration entre les gynécologues et les radiologues interventionnels. Nous présentons un protocole applicable à l’embolisation de l’artère utérine dans le traitement des fibromes utérins symptomatiques. Le protocole est divisé en cinq sections. Les deux premières sections s’adressent aux gynécologues et aux radiologues interventionnels, expliquant comment qualifier et préparer un patient à l’embolisation de manière étape par étape. La troisième section, qui s’adresse aux radiologues interventionnels, explique comment l’embolisation doit être effectuée. La quatrième section s’adresse aux gynécologues ou aux médecins hospitaliers qui s’occupent des patientes après l’embolisation. Cette section du protocole propose une méthode pour traiter la douleur post-embolisation à l’aide de la pompe d’analgésie contrôlée par le patient (PCA). La cinquième section complète la procédure par une évaluation des effets et des complications tardives de l’embolisation de l’artère utérine.
Les cinq sections créent un protocole uniforme destiné aux cliniciens, aux experts et aux chercheurs novices dans le domaine.
Introduction
Les fibromes utérins sont des tumeurs bénignes provenant du tissu musculaire lisse, constituant le stroma musculaire utérin. Ce sont des tumeurs monoclonales, constituées d’une grande quantité de substance extracellulaire contenant du collagène, de la fibronectine et des protéoglycanes. Les fibromes sont entourés d’une fine pseudocapsule composée de fibres musculaires compressées, de fibres de collagène, de neurofibres et de vaisseaux sanguins 1,2. La physiopathologie des myomes n’est pas entièrement comprise mais semble reposer principalement sur une prolifération monoclonale causée par des modifications épigénétiques sélectives et spécifiques aux tissus3. Aucun gène n’a été trouvé pour causer des fibromes utérins. Cependant, la présence de syndromes de fibromes utérins rares, tels que la léiomyomatose cutanée et utérine multiple, a été attribuée à un gène codant pour la fumarate hydratase, une enzyme mitochondriale impliquée dans le cycle4 de Krebs. La présence de délétions et de translocations du chromosome 7 dans les chromosomes 7, 12 et 14, qui se produisent dans 50 % des fibromes, semble être secondaire plutôt que primaire 5,6,7.
Les régulateurs de la croissance des fibromes utérins sont les hormones stéroïdes produites par les ovaires (œstrogènes et progestérone), les facteurs de croissance, l’angiogenèse et l’apoptose. Des facteurs de risque pour le développement de fibromes utérins ont également été identifiés, notamment l’âge, les règles précoces, la race afro-américaine, l’hérédité, la nulliparité, l’obésité, le syndrome des ovaires polykystiques, le diabète, l’hypertension, la carence en vitamine D, l’utilisation de lait de soja, l’alcool et la consommation de caféine8.
Les fibromes utérins sont les tumeurs bénignes les plus courantes des organes reproducteurs chez les femmes. Ces tumeurs ont été décrites pour la première fois en 1793 par Matthew Baillie au St George’s Hospital de Londres. Les données épidémiologiques disponibles ne précisent pas avec précision l’incidence des fibromes utérins, car leur grande proportion n’est pas diagnostiquée. On estime que les fibromes utérins sont présents chez 5,4 % à 77 % de toutes les patientes. Leur prévalence est plus élevée aux États-Unis qu’en Europe, la cause probable étant les différences raciales8.
Chez les femmes en âge de procréer, environ 30 % des myomes peuvent présenter des symptômes cliniques sous la forme de saignements utérins anormaux, entraînant un apport sanguin insuffisant chez les patientes9. Dans la plupart des cas, les patientes ont plus d’un myome, qui sont des lésions sphériques situées dans l’utérus. Leurs dimensions et leur emplacement peuvent varier. Dans 90 % des cas, ils sont situés dans le corps de l’utérus. Leur diamètre peut aller de quelques millimètres à 20 cm10.
La classification de la FIGO (Fédération Internationale de Gynécologie et d’Obstétrique) les divise en groupes de 0 à 8 en fonction de la proximité de l’endomètre (moins le chiffre est bas, plus l’endomètre est proche) (Figure 1)11. Dans environ 50 à 75 % des cas, les fibromes sont asymptomatiques. Les symptômes les plus courants des fibromes utérins sont les saignements menstruels abondants, les saignements utérins anormaux et les symptômes de pression. Les myomes sont associés à environ 10 % des cas d’infertilité, et dans 1 à 3 %, ils sont la seule cause12. Les fibromes utérins asymptomatiques ne font généralement l’objet que d’un contrôle médical régulier, tandis que les fibromes symptomatiques sont une indication de traitement13.
Les méthodes de traitement des fibromes utérins actuellement utilisées comprennent le traitement chirurgical, la thérapie pharmacologique et les procédures mini-invasives 13,14,15,16,17,18. Le traitement chirurgical comprend la myomectomie (abdominale et hystéroscopique) et l’hystérectomie. La myomectomie et l’hystérectomie ont toutes deux un impact positif sur la qualité de vie19. L’hystérectomie est associée à une perte irréversible de fertilité ; Ainsi, de nombreuses femmes recherchent d’autres options de traitement20.
La myomectomie abdominale permet de préserver la fertilité. En fonction de la taille et du nombre de fibromes, ainsi que de l’expérience du chirurgien, cette procédure peut être réalisée par laparotomie ou laparoscopie. Bien que les hémorragies soient moins fréquentes que dans l’hystérectomie, la morbidité globale est similaire. La myomectomie hystéroscopique est une méthode plus sûre, moins invasive que la myomectomie abdominale et permet le traitement des fibromes sous-muqueux (FIGO 0). Des procédures hystéroscopiques ultérieures peuvent être nécessaires pour enlever complètement les fibromes de type 2 plus gros21.
Les dispositifs intra-utérins libérant du lévonorgestrel sont un traitement efficace pour les saignements menstruels abondants, mais ils ne réduisent pas la taille des fibromes. Leur utilisation est limitée chez les patientes présentant une cavité utérine déformée. Les analogues de la GnRH sont principalement utilisés comme agent préopératoire pour réduire la taille des fibromes et la perte de sang périopératoire. Ils réduisent également le pourcentage d’incisions verticales pendant l’hystérectomie et la myomectomie tout en augmentant la possibilité d’une procédure vaginale20.
À court terme, les modulateurs sélectifs des récepteurs de la progestérone réduisent le volume du myome et induisent une aménorrhée. Cependant, l’efficacité et l’innocuité à long terme nécessitent des recherches supplémentaires. En plus des inhibiteurs de l’aromatase, il peut exister d’autres options pour le traitement préopératoire de l’anémie et la réduction du volume du myome22. Certaines études suggèrent que la vitamine D peut ralentir ou empêcher la croissance des fibromes et l’apparition des symptômes23.
De nouvelles méthodes utilisant du 2-méthoxyestradiol combiné à des nanoparticules sont également en coursde développement 24. Les méthodes mini-invasives utilisées dans le traitement des fibromes comprennent l’embolisation de l’artère utérine (EAU), la chirurgie par ultrasons focalisés guidée par résonance magnétique (MRgFUS), l’occlusion de l’artère utérine laparoscopique (LUAO) et la myolyse par radiofréquence14,25. L’échographie focalisée de haute intensité guidée par ultrasons (US-HIFU) est une nouvelle méthode encore expérimentale et peu invasive26,27.
Les méthodes d’occlusion vasculaire thérapeutique et de blocage de l’apport sanguin à l’utérus ont été mentionnées il y a plus de 120 ans. En 1894, Kelly a présenté la ligature des artères iliaques internes lors d’une hystérectomie oncologique pour contrôler les saignements pelviens réfractaires, qui à l’époque étaient une complication courante après l’intervention chirurgicale28. Ensuite, Sack (1973) a décrit l’utilisation efficace de la même technique dans le traitement de l’hémorragie post-partum massive après l’accouchement par forceps. Dans les deux cas, l’hémostase a été réalisée sans hystérectomie29. En 1979, Heaston et al. et Brown et al., ont décrit indépendamment l’embolisation des artères pelviennes à l’aide d’éponges de gélatine résorbables pour contrôler l’hémorragie post-partum30,31.
Les Émirats arabes unis ont été utilisés pour la première fois comme méthode de traitement des fibromes utérins symptomatiques en 1991 en France32. Il a d’abord été utilisé pour réduire la perte de sang après une myomectomie. En 1995, Ravina et al. ont proposé cette procédure comme méthode de traitement principale des fibromes utérins symptomatiques33. Aux États-Unis, l’embolisation de l’artère utérine a été réalisée avec succès en 199734.
L’intérêt croissant pour la préservation utérine chez les femmes atteintes de fibromes symptomatiques a placé les Émirats arabes unis à l’avant-garde du traitement des fibromes mini-invasifs 14,18,35,36,37. En 2000, le groupe de travail conjoint du Collège royal des obstétriciens et gynécologues et du Collège royal des radiologues a été créé pour publier des directives sur les Émirats arabes unis. À cette époque, les Émirats arabes unis étaient considérés comme une méthode expérimentale (moins de 7 000 procédures effectuées dans le monde). Depuis la publication des directives, plus de 100 000 procédures aux Émirats arabes unis ont été effectuées dans le monde. En outre, cinq essais contrôlés randomisés ont été réalisés, comparant les Émirats arabes unis à d’autres procédures chirurgicales. Les résultats de la recherche indiquent que les Émirats arabes unis sont très efficaces à court et moyen terme (jusqu’à quelques années) avec un faible risque de complications moyennes (par exemple, infection utérine) et graves (mettant la vie en danger)38,39. Dans les études randomisées, des temps d’hospitalisation plus courts, une récupération plus rapide et un retour aux activités quotidiennes parlent en faveur des Émirats arabes unis. Les interventions chirurgicales se sont avérées moins coûteuses et moins souvent nécessitaient une réintervention tout en maintenant une signification statistique32. Cette procédure est actuellement une méthode de traitement largement acceptée pour les fibromes utérins symptomatiques et a été reconnue comme telle par le National Institute for Health and Clinical Excellence (NICE) dans les directives pour les saignements menstruels abondants40.
À l’heure actuelle, il existe 11 recommandations concernant l’utilisation des Émirats arabes unis dans le traitement des fibromes utérins symptomatiques, créées par des sociétés scientifiques d’Europe, d’Amérique du Nord et d’Australie. Dans la plupart des cas, les recommandations sont cohérentes tandis que la divergence porte sur deux divergences. La première est de savoir si les myomes sous-muqueux pédonculés (FIGO 0) et sous-séreux (FIGO 7) sont des contre-indications aux Émirats arabes unis. La seconde est de savoir si les femmes qui déclarent une grossesse future devraient être qualifiées pour cette procédure41. L’American College of Obstetricians and Gynecologists (ACOG) (2008) a présenté une ligne directrice intéressante pour le traitement des fibromes utérins. Sur la base de preuves scientifiques cohérentes (niveau A), l’ACOG a défini les Émirats arabes unis comme une méthode efficace et sûre pour les femmes dûment qualifiées qui souhaitent préserver l’utérus avec des indications typiques pour le traitement des fibromes. Dans le même temps, les recommandations de l’ACOG ont souligné la nécessité d’une coopération étroite entre les gynécologues et les radiologues interventionnels. Dans les lignes directrices publiées, l’ACOG a reconnu le désir de préserver la fertilité comme la seule contre-indication (relative)42.
L’une des dernières recommandations a été émise en 2013 par le Collège royal des obstétriciens et gynécologues (RCOG) et en 2015 par la Société des obstétriciens et gynécologues du Canada (SOGC)41. Dans la suite de cet article, les auteurs utiliseront les recommandations ci-dessus. Selon les directives du RCOG et de la SOGC, tout patient présentant des myomes symptomatiques peut être candidat à l’embolisation, à condition qu’il n’y ait pas de contre-indications et que les avantages de la procédure (résolution des symptômes) l’emportent sur le risque de complications. Il convient de noter que l’embolisation des fibromes utérins en tant que procédure mini-invasive entraîne un nombre négligeable de complications graves. Par conséquent, dans la plupart des cas, les avantages l’emportent sur le risque de complications 14,32,43.
Une qualification appropriée du patient est d’une importance cruciale pour une efficacité clinique élevée et la prévention des complications après les Émirats arabes unis. La principale indication des Émirats arabes unis est les fibromes utérins symptomatiques, entraînant des saignements menstruels abondants, une dysménorrhée, des douleurs, une dyspareunie et d’autres effets indésirables sur le tractus urinaire ou gastro-intestinal. Il est nécessaire de différencier les fibromes de l’adénomyose ou des fibromes coexistant avec l’adénomyose car, dans une telle situation, les Émirats arabes unis sont moins efficaces et nécessitent une modification de la technique de procédure 14,32,43,44,45,46,47. Les indications spécifiques pour la réalisation de la procédure des Émirats arabes unis chez les femmes atteintes de fibromes utérins symptomatiques comprennent le refus de la chirurgie, l’absence de consentement à la transfusion sanguine et l’échec antérieur de la chirurgie des fibromes utérins.
Dans les indications ci-dessus, l’EAU doit être traité comme une alternative au traitement chirurgical. Cependant, les patients doivent être informés que dans un petit nombre de cas, des complications après l’intervention peuvent entraîner la nécessité d’une intervention chirurgicale 14,32,43. Selon les directives du RCOG, l’utilisation des Émirats arabes unis dans une situation dans laquelle le myome est une cause probable d’infertilité nécessite des soins particuliers et une évaluation appropriée de la part d’un gynécologue spécialisé dans le traitement de l’infertilité et la procréation assistée. L’infertilité due à la présence de fibromes n’est pas absolue et de nombreuses femmes tomberont enceintes sans aucune intervention. Par conséquent, il est raisonnable d’exclure d’autres causes possibles d’infertilité, y compris l’évaluation du partenaire masculin 14,32,43.
Ainsi, selon les recommandations du RCOG et de la SOGC, les candidates devraient être des femmes atteintes de fibromes utérins symptomatiques chez qui les pathologies du bassin avec des symptômes cliniques semblables à ceux des fibromes ont été exclues41,43.
Les contre-indications absolues à cette procédure comprennent une infection génitale actuelle ou récente, des doutes diagnostiques dus à des facteurs cliniques ou à une imagerie inadéquate, des fibromes asymptomatiques, une grossesse viable et des contre-indications à l’utilisation d’agents de contraste radiologiques.
Les contre-indications relatives comprennent les fibromes sous-muqueux pédonculés (FIGO 0) et sous-séreux (FIGO 7), qui peuvent théoriquement se détacher de l’endomètre en raison d’une nécrose du pédoncule, entraînant dans de rares cas une septicémie. Dans ces cas, l’EAU ne doit être envisagé que si l’ablation hystéroscopique ou laparoscopique du myome pédonculé avant la procédure est prévue.
Malgré le fait que la littérature actuelle suggère que la taille du myome n’est pas une contre-indication en soi, l’expérience montre qu’une extrême prudence est nécessaire lors de l’éligibilité des patients atteints de myomes de grande taille (en particulier associés à des symptômes de compression) pour l’EAU, car la réduction du volume peut être insuffisante pour soulager les symptômes et répondre aux attentes des patients14,32, 43 et 48.
Il existe de nombreux rapports de grossesse réussie après les Émirats arabes unis, mais les preuves existantes ne soutiennent pas pleinement son utilisation comme alternative au traitement pharmacologique ou chirurgical (myomectomie) chez les jeunes femmes49. Par conséquent, cette procédure doit être utilisée avec une grande prudence chez les femmes qui déclarent vouloir tomber enceintes (car il y a un taux de grossesse plus faible, un taux de fausses couches plus élevé, une rupture utérine, un placenta accreta et des issues défavorables de la grossesse après les Émirats arabes unis qu’après une myomectomie)32,50,51,52,53,54,55. En tant que gynécologues, nous ne recommandons pas les Émirats arabes unis aux femmes souhaitant une grossesse. Pour nous, il s’agit d’une contre-indication relative, à condition qu’il existe des indications supplémentaires pour les Émirats arabes unis, telles que le refus de la chirurgie ou des transfusions sanguines, où l’absence de traitement peut mettre la vie en danger.
Selon les directives du RCOG, le désir de préserver ou d’améliorer la fertilité chez les jeunes femmes atteintes de fibromes utérins symptomatiques est une contre-indication relative à l’eau32. En revanche, les lignes directrices de la SOGC recommandent que, dans des cas similaires, les Émirats arabes unis ne soient pas proposés comme option de traitement des fibromes, car l’innocuité et l’efficacité n’ont pas été établies chez ces femmes14,43. Un point de vue similaire est représenté par d’autres sociétés scientifiques, notamment l’American Society for Reproductive Medicine (ASRM), l’American College of Obstetricians and Gynecologists (ACOG), l’American College of Radiology (ACR), le Royal Australian and New Zealand College of Obstetricians and Gynecologists (RANZCOG) et d’autres, citant l’amélioration des résultats de fertilité après la myomectomie 41,43,56 . Les Émirats arabes unis n’ont été recommandés par le NICE que pour les femmes cherchant à maintenir ou à améliorer la fertilité, en particulier avec des caractéristiques défavorables à la myomectomie (fibromes multiples)57.
En règle générale, les procédures des Émirats arabes unis peuvent être effectuées à n’importe quel stade du cycle menstruel32. Cependant, en supposant qu’il n’y a pas de méthode idéale pour exclure la grossesse au stade de la fécondation ou de l’implantation, afin d’exclure une grossesse précoce, dans notre centre, il est effectué jusqu’au 10ème jour du cycle. Dans la plupart des cas, les patientes sont admises au service de gynécologie le jour de l’intervention. L’admission d’un patient dans le service de chirurgie vasculaire est autorisée si des examens et une consultation gynécologique appropriés sont prévus. Un gynécologue et un radiologue interventionnel effectuent la qualification pour l’embolisation des fibromes. La qualification gynécologique comprend les antécédents médicaux, l’examen, l’évaluation échographique de l’organe reproducteur et le type de myome. De plus, pour exclure toute tumeur maligne au sein de l’utérus, un frottis cervical (PAP) et une biopsie de l’endomètre sont nécessaires. Dans les cas où l’échographie des ovaires est douteuse, le test ROMA (Risk of Ovarian Malignancy Algorithm) est nécessaire.
Une question distincte nécessitant une discussion est celle du sarcome de l’utérus, en particulier le léiomyosarcome (LMS), qui représente 70 % de ces tumeurs utérines. La prévalence du LMS chez les patients opérés pour un myome est faible et est estimée entre 0,13 % et 0,29 %58,59. L’augmentation de l’incidence du LMS est observée chez les femmes de plus de 40 ans. Le LMS est difficile à diagnostiquer avant le traitement car il peut ressembler à des fibromesbénins 60. La plupart des LMS ne sont pas liés à des fibromes préexistants, et il n’y a aucune preuve d’une association entre les LMS et les fibromes utérins61. Les fibromes utérins et le LMS ont tendance à se développer rapidement. Ainsi, la taille ou le taux de croissance n’est pas un facteur de risque de tumeur utérine maligne60.
À l’heure actuelle, il n’existe pas de tests de laboratoire ou d’imagerie fiables qui permettraient d’identifier clairement le léiomyosarcome et de le différencier du léiomyome60,62. La sensibilité de la biopsie de l’endomètre dans le diagnostic du léiomyosarcome est de 86 %. Ainsi, un résultat de biopsie négatif n’exclut pas l’existence d’une tumeur utérine maligne. L’IRM avec produit de contraste est actuellement la méthode de diagnostic optimale pour les tumeurs utérines. La sensibilité de ce test dans le diagnostic de LMS est de 94%60.
Comme déjà mentionné, les tests ci-dessus n’excluent pas 100 % des tumeurs utérines malignes. Par conséquent, il existe un léger risque de prolonger le diagnostic de LMS après le traitement, sans possibilité de vérification histopathologique de la tumeur utérine. Le patient doit en être informé lors de l’éligibilité aux Émirats arabes unis.
La réalisation d’une formule sanguine complète (FSC) et de tests de coagulation (INR, APTT), d’un panel rénal (créatinine, urée), d’une thyréostimuline (TSH), d’une concentration d’hormone anti-müllérienne (AMH) (recommandée) ou d’hormone folliculo-stimulante (FSH) en phase folliculaire, d’une protéine C-réactive (CRP), d’un test urinaire général et d’un frottis vaginal (culture vaginale aérobie) permettent d’évaluer et d’éviter d’éventuelles complications post-embolisation (infections, lésions ovariennes iatrogènes, intensification de l’insuffisance rénale antérieure après des produits de contraste à base de gadolinium, thyrotoxicose en cas d’hyperthyroïdie après un produit de contraste à base d’iode)63,64. Veuillez noter que le test de FSH n’est pas recommandé avant l’âge de 40 ans, car la FSH n’est pas un indicateur sensible des modifications de la réserve ovarienne chez les jeunes femmes50,65.
Un radiologue interventionnel qualifie les patients pour l’intervention en fonction des antécédents médicaux et de l’imagerie par résonance magnétique (IRM). Lors de la collecte des antécédents médicaux, les avantages et les complications possibles, ainsi que la procédure elle-même, doivent être discutés avec le patient. Les attentes du patient concernant les Émirats arabes unis doivent également être discutées. L’IRM vise à exclure d’autres pathologies de l’organe reproducteur et des structures adjacentes, ainsi qu’à évaluer la morphologie et la localisation des fibromes et l’anatomie pour la faisabilité technique de la procédure 35,36,37,57.
Les Émirats arabes unis visent à bloquer complètement le système vasculaire de tous les myomes tout en maintenant l’apport sanguin à l’utérus, aux ovaires et aux tissus environnants du bassin. Les aspects techniques des Émirats arabes unis sont encore en train d’évoluer dans une certaine mesure.
L’embolisation des artères utérines est réalisée par des radiologues interventionnels ayant les compétences appropriées dans le domaine de l’embolisation intravasculaire. La procédure est réalisée sous guidage de fluoroscopie. Il s’agit de l’insertion percutanée d’un cathéter vasculaire à partir de la ponction dans la région inguinale dans l’artère fémorale, l’aorte, l’artère iliaque interne, jusqu’à l’artère utérine. Après avoir placé le cathéter profondément dans l’artère utérine et obtenu une position stable, l’agent d’embolisation mélangé à un produit de contraste est injecté sous contrôle fluoroscopique de manière à éviter le reflux et l’embolisation « non ciblée ». Le lit vasculaire des myomes est fermé à l’aide de particules de 500 à 900 μm selon le type de matériau d’embolisation - les tailles habituelles sont de 700 μm. L’embolisation se poursuit jusqu’à ce que le flux sanguin de stase soit atteint. À la fin de la procédure, le cathéter est retiré et le site d’accès vasculaire est sécurisé par une pression manuelle et un pansement ou un ferme-porte mécanique. La procédure dure environ 0,5 à 1,0 h. La dose moyenne de rayonnement ionisant absorbée par l’ovaire au cours des Émirats arabes unis varie de 0,04 à 0,22 (Gy : gris) et la dose efficace moyenne estimée de 22 à 34 (mSv : millisievert). Le temps fluoroscopique moyen est d’environ 22 min66,67.
Le système vasculaire de la plupart des fibromes provient des artères utérines. Seulement environ 5 à 10 % des fibromes sont en outre alimentés par les artères ovarienne. Une anastomose utérine artérielle survient dans environ 10 % des cas, tandis qu’elle est utéro-ovarienne dans 10 à 30 %. La coupure de l’apport sanguin aux tissus embolisés provoque une nécrose ischémique, suivie d’une dégénérescence hyaline ou d’une nécrose coagulative. Ce processus prend plusieurs mois 68,69.
L’efficacité de l’EAU dépend de la résolution des symptômes ou du degré de leur réduction. Pour le traitement des saignements menstruels excessifs, des douleurs pelviennes et des symptômes de pression, l’indice d’efficacité clinique des Émirats arabes unis est de 81 % à 96 %, de 70 % à 100 % et de 46 % à 100 %, respectivement. Dans les 3 à 6 mois suivant l’intervention, la réduction observée du volume des fibromes était de 25 % à 60 %33,70,71,72. La réduction moyenne du diamètre du myome était de 2,2 cm57.
La réduction du volume des fibromes n’est pas toujours corrélée à la résolution ou à la réduction des symptômes cliniques. Dans le suivi à long terme après l’EAU, plus de 70 % des patients ont signalé une résolution ou une réduction significative des symptômes cliniques dans les 5 ans suivant l’intervention, tandis que 16 à 23 % d’entre eux ont nécessité une réintervention73,74.
Pour évaluer l’effet précoce des Émirats arabes unis, les auteurs de cette publication proposent l’utilisation de l’échographie tridimensionnelle (3D), à l’aide de l’analyse assistée par ordinateur (VOCAL), en effectuant des mesures des indices vasculaires : indice de vascularisation (VI), indice de débit (FI) et indice de débit de vascularisation (VFI)75.
La douleur post-embolisation est un effet secondaire précoce (d’une durée d’environ 24 heures) attendu d’une EAU réussie (à ne pas confondre avec une complication) et doit être traitée activement. Ce symptôme clinique est causé par la libération de produits de dégradation tissulaire du myome ischémique. Le traitement comprend un contrôle adéquat de la douleur, une hydratation et une éventuelle antibiothérapie32,43. L’anesthésie péridurale (EA) maintenue pendant 24 heures après l’intervention réduit considérablement la douleur à un niveau tout à fait acceptable, mais à un coût plus élevé et à un risque accru de complications par rapport à l’analgésie contrôlée par le patient (ACP)76.
D’autres approches sont également disponibles dans les revues de gestion de la douleur post-embolisation. Il convient de mentionner l’utilisation de mélanges d’analgésiques avec des molécules d’alcool polyvinylique et l’anesthésie par électroacupuncture pendant les Émirats arabes unis. Les deux méthodes visaient à limiter le nombre d’interventions aux Émirats arabes unis effectuées en milieu hospitalier77,78. Nous n’utilisons pas ces méthodes dans nos centres et dans les centres coopérants.
Les complications précoces de l’EAU sont généralement des complications locales associées à la procédure d’angiographie. Ce groupe d’événements indésirables est rare (ils surviennent dans moins de 1 % des cas) et concerne principalement un hématome de l’aine, une thrombose artérielle, une dissection artérielle et un pseudo-anévrisme, des réactions allergiques aux produits de contraste, un spasme de l’artère utérine causé par la manipulation du cathéter dans le vaisseau pendant l’intervention (traité comme un événement temporaire après quelques minutes et la procédure peut être poursuivie, si le spasme persiste, on peut administrer du vérapamil (2,5 à 5 mg) ou du nitrate (100 à 150 μg) par voie intra-artérielle) et une embolisation « non ciblée » 32,37,38.
Il y a également eu plusieurs rapports d’embolisation « non ciblée » d’autres organes pelviens et de leur ischémie ultérieure. Cette complication peut survenir à la suite d’une mauvaise exécution de la procédure, ainsi qu’en raison de la présence d’anastomoses et de variantes anatomiques du système vasculaire pelvien. Un cas particulier d’embolisation non ciblée est l’atteinte ovarienne résultant d’anastomoses entre les vaisseaux de l’utérus et les ovaires chez certaines patientes79,80.
La conséquence de la nécrose du myome est un syndrome post-embolisation survenant dans les 30 jours suivant l’intervention chez environ 10 à 15 % des patients. Les symptômes de ce syndrome, qui peuvent survenir ensemble ou individuellement, comprennent des nausées, des vomissements, un malaise, une fièvre légère, des douleurs abdominales basses et des taux élevés de leucocytes. Il s’agit généralement d’un syndrome d’auto-limitation qui disparaît généralement en 10 à 14 jours. Des analgésiques et des anti-inflammatoires sont utilisés pour traiter cette complication32. Il est important de différencier les symptômes d’un syndrome post-embolisation avec des complications plus graves telles que la septicémie. Cela est particulièrement vrai dans les cas où les symptômes mentionnés durent plus de deux semaines 32,37,38.
L’infection est potentiellement la complication la plus grave après les Émirats arabes unis, et elle survient dans environ 0,5 % des cas32,38. En cas de fièvre persistante et élevée (38,5 °C et plus) pendant 24 à 48 heures et d’abdomen dur et douloureux, une septicémie doit être suspectée. Dans ce cas, le traitement peut non seulement nécessiter l’utilisation d’une antibiothérapie, mais également la nécessité d’enlever l’utérus. Dans ce dernier cas, dans moins de 1 % des cas, il peut constituer une menace pour la vie du patient. La septicémie est plus fréquente lorsque l’EAU est réalisée sur un utérus volumineux (plus de 20 cm ou lorsque le diamètre d’un seul myome est supérieur à 9 cm, et également en cas de coexistence de gros fibromes sous-muqueux)37,38.
Une complication tardive après l’EAU (plus de 30 jours après l’intervention), survenant après l’embolisation de fibromes sous-muqueux, est l’excrétion de fragments nécrotiques marqués de fibromes par le canal cervical. Cela se produit dans environ 10 % des cas 32,81,82. Environ 16 % des femmes, après les Émirats arabes unis, peuvent avoir des pertes vaginales abondantes pendant plusieurs semaines à plusieurs mois à la suite de l’excrétion de fibromes nécrotiques de l’utérus83. Après la procédure des Émirats arabes unis, un raccourcissement significatif des menstruations et une diminution de leur abondance sont observés, ce qui est considéré comme un effet bénéfique de cette procédure. Cependant, l’aménorrhée complète est traitée comme l’effet de l’insuffisance ovarienne post-embolisation50,84.
L’aménorrhée après l’EAU est généralement transitoire et limitée à quelques cycles. L’aménorrhée permanente survient chez environ 15 % des femmes de plus de 40 ans et chez environ 1 % des femmes de moins de cet âge, provoquant des symptômes de ménopause prématurée. Dans nos propres recherches, une diminution de la fertilité chez les jeunes femmes (33-40 ans) en raison de la réduction de la réserve ovarienne a été constatée65. On estime qu’environ 85 % des femmes qui signalent une aménorrhée après les Émirats arabes unis ont plus de 45ans. Il a été avancé que la raison de l’augmentation de l’incidence de l’aménorrhée chez les femmes âgées est due à la réduction de la réserve ovarienne et à une plus grande sensibilité du tissu ovarien à l’ischémie causée par l’embolisation « non ciblée »86.
La procédure des Émirats arabes unis affecte également la fonction sexuelle des femmes qui la subissent. L’amélioration de la fonction sexuelle après les Émirats arabes unis a été signalée par 26 % des femmes, la détérioration a été constatée chez 10 % et inchangée chez les 64 % restants. Une cause possible de dysfonctionnement sexuel est une vascularisation anormale du clitoris, du col de l’utérus et du corps utérin à la suite de la procédure des Émirats arabes unis74.
Protocole
Les auteurs déclarent que le protocole suit les directives du comité d’éthique local de l’Université de médecine de Lublin.
1. Qualification pour la procédure des Émirats arabes unis
REMARQUE : Cette adresse s’adresse aux gynécologues et aux radiologues interventionnels.
- Informez le patient des détails de la procédure aux Émirats arabes unis.
- Discutez des indications et des contre-indications de la procédure des Émirats arabes unis.
- Discutez avec la patiente des hypothèses des Émirats arabes unis et des méthodes alternatives (décrites dans l’introduction) dans le traitement des fibromes utérins.
- AVERTISSEMENT! Informez le patient que l’EAU n’est pas une procédure radicale (le myome ne sera pas enlevé).
- AVERTISSEMENT! Informer la patiente qu’elle ne recevra pas de rapport d’histopathologie des fibromes utérins après les Émirats arabes unis.
- AVERTISSEMENT! Informez la patiente que 1 à 3 cas sur 1 000 tumeurs utérines peuvent être malignes (LMS). Discutez avec la patiente du fait que la biopsie de l’endomètre et l’IRM effectuées lors de la qualification aux Émirats arabes unis sont très sensibles dans le diagnostic de léiomyosarcome, mais pas à 100 %. Informez le patient que la réalisation de l’EAU pour le léiomyosarcome peut retarder le diagnostic et le traitement approprié. Notez ce fait dans le dossier médical.
- Si le patient souhaite sciemment que l’EAU soit effectuée, continuez ce protocole.
- Informer le patient que la qualification se déroule en deux étapes. La qualification d’un gynécologue comprend l’analyse des indications et des contre-indications, tandis qu’un radiologue interventionnel évalue les capacités techniques des Émirats arabes unis.
- Planifiez ou effectuez une consultation gynécologique et planifiez une consultation avec le radiologue interventionnel avant les Émirats arabes unis.
- Si possible, effectuez autant de procédures de qualification que possible à la clinique externe.
- S’assurer que la patiente a des indications pour l’EAU : fibromes utérins symptomatiques (ménométrorragie, métrorragie, dysménorrhée, dyspareunie, douleurs pelviennes chroniques) ; le refus d’un traitement chirurgical ; l’absence de consentement à la transfusion sanguine ; la chirurgie des fibromes utérins avait précédemment échoué. Notez-les dans l’histoire médicale.
- Demandez au patient quels sont les symptômes du ou des fibromes.
- Discutez de l’efficacité de l’EAU et des attentes du patient (dans les résultats représentatifs).
- Demandez si la patiente a déjà été traitée pour des fibromes utérins. Assurez-vous de la méthode utilisée.
- Si le patient refuse un traitement chirurgical ou une transfusion sanguine, prenez une déclaration écrite.
- S’assurer que le patient qui s’est qualifié pour la procédure des Émirats arabes unis ne présente pas de contre-indications absolues : fibromes asymptomatiques ; une grossesse viable ; infection génitale actuelle ou récente ; doutes diagnostiques dus à des facteurs cliniques ou à une imagerie inadéquate ; contre-indications à l’utilisation de produits de contraste radiologiques ; caractéristiques du léiomyosarcome à l’IRM ; tumeur maligne de l’utérus ou de l’ovaire, à moins qu’elle ne soit pratiquée en soins palliatifs ou en complément d’une intervention chirurgicale87. Notez-les dans l’histoire médicale.
- Si le patient demande des Émirats arabes unis malgré des fibromes asymptomatiques, expliquez que ces cas ne sont pas admissibles à la procédure. Expliquez à la patiente que les fibromes asymptomatiques ne nécessitent qu’un suivi gynécologique régulier.
- S’il existe des contre-indications relatives aux Émirats arabes unis (fibromes importants et plans de reproduction), discutez-en avec le patient et notez-le dans le dossier médical.
- Concentrez-vous sur les complications possibles liées à la contre-indication relative, décrites dans l’introduction, assurez-vous que le patient comprend et accepte la procédure.
- Discutez avec la patiente des séquelles et des complications de l’embolisation de l’artère utérine (voir introduction) et notez ce fait dans le dossier médical.
- Lorsque vous parlez au patient, portez une attention particulière à la douleur post-embolisation.
- Discutez des traitements de la douleur post-embolisation.
- Effectuer une qualification gynécologique.
- Recueillir les antécédents médicaux et effectuer un examen gynécologique.
- Effectuer une évaluation échographique des organes reproducteurs pour évaluer la taille et le type de fibromes (classification FIGO)88.
- À l’aide d’une sonde vaginale, vous pouvez estimer la taille et l’emplacement du myome (figure 2). Les fibromes utérins traités par l’EAU doivent être de 2 à 5 (idéalement, 3 à 4) selon la classification FIGO, et le diamètre ne doit pas dépasser 10 cm.
- Inclure le protocole de l’échographie pelvienne dans le dossier médical.
- Assurez-vous que le résultat de l’échographie donne des indications pour la qualification pour la procédure des Émirats arabes unis.
- Exclure les apophyses malignes dans le bassin.
- Assurez-vous que la patiente a eu des résultats à jour (de préférence effectués dans les 6 mois) du frottis cervical (PAP) et de la biopsie de l’endomètre.
- Lors d’une échographie pelvienne, utilisez la sonde vaginale pour évaluer les ovaires et confirmer que leur structure est correcte. En cas de doute, vérifiez l’échographie précédente ou effectuez le test ROMA.
- Commandez une IRM pour évaluer les caractéristiques LMS de la tumeur utérine et les capacités techniques des Émirats arabes unis.
- Notez les résultats du frottis cervical (PAP), de la biopsie de l’endomètre, de l’échographie (éventuellement le test ROMA) et de l’IRM dans le dossier médical.
- Si les résultats sont incorrects, disqualifier le patient de la procédure.
- Informer les patientes sur les résultats de la qualification gynécologique.
- Notez ce fait dans le dossier médical. Dirigez le patient vers l’hôpital.
- Prenez rendez-vous pour l’intervention aux Émirats arabes unis et rappelez-vous que le patient doit être avant le 10e jour du cycle.
- Demandez à la patiente si elle refuse la chirurgie. En cas de refus, notez ce fait dans le consentement éclairé du patient ou dans le dossier médical.
- Les patients atteints de fibromes symptomatiques qui refusent la chirurgie sont éligibles aux Émirats arabes unis.
- Effectuez les tests suivants au moins 7 jours avant les Émirats arabes unis pour évaluer et éviter les complications potentielles : test microbiologique de frottis vaginal (culture vaginale aérobie) ; Urine; tests sanguins sélectionnés : FSC, tests de coagulation (INR, APPT), panel rénal (créatine, urée), TSH, CRP.
- Décrivez les résultats dans le dossier médical.
- Informez le patient que des résultats incorrects la disqualifient pour l’intervention.
- Vérifiez la réserve ovarienne de la patiente en testant les taux sériques d’AMH (recommandé) ou de FSH (non recommandé pour les moins de 40 ans) à la phase folliculaire. Discutez avec la patiente du fait que le test ci-dessus sera utile pour évaluer les lésions ovariennes résultant d’une embolisation non ciblée. Notez ce fait dans le dossier médical.
- Les patientes qui sont éligibles pour les Émirats arabes unis ne doivent pas déclarer leur volonté de tomber enceinte en raison du risque accru de complications de la grossesse 14,32,38,50,51,52,89,90,91.
- Informez la patiente du risque accru de complications de la grossesse après les Émirats arabes unis.
- Notez le fait que la patiente ne déclare pas la volonté de tomber enceinte dans le consentement éclairé de la patiente ou le dossier médical.
- Si la patiente n’exclut toujours pas une grossesse à l’avenir, mais qu’elle a besoin des Émirats arabes unis, faites une déclaration écrite indiquant qu’elle a été informée d’éventuelles complications de la grossesse après les Émirats arabes unis.
- Effectuer la qualification radiologique.
- Assurez-vous que l’IRM pelvienne a été effectuée. L’examen par IRM permet d’exclure d’autres pathologies de l’organe reproducteur et des structures adjacentes (étape 1.6.3.3. de la procédure de qualification pour les Émirats arabes unis), d’évaluer la morphologie et la localisation des fibromes, ainsi que l’anatomie pour la faisabilité technique de l’embolisation (Figure 3, Figure 4). Si ce n’est pas le cas, organisez l’examen IRM et la consultation avec un radiologue d’intervention.
- Analyser les examens d’imagerie et évaluer le type et la taille des fibromes.
- Si des fibromes sous-muqueux (FIGO 0-1) sont détectés, informez la patiente du risque de desquamation dans la cavité utérine. L’excrétion complète peut provoquer une septicémie, tandis que l’excrétion en fragments est généralement asymptomatique50.
- En cas de présence de fibromes sous-séreux à pédoncule étroit et pédonculé (FIGO 7), informer le patient du risque de décollement post-embolisation du fibrome dans la cavité abdominale. Cela peut entraîner une inflammation aiguë et une réopération laparoscopique peut être nécessaire92.
- Si de gros fibromes sont trouvés, informez le patient que le risque de complications reste inchangé, mais que le résultat de la procédure est meilleur pour les petits fibromes93.
- Notez ce fait dans le consentement éclairé du patient ou dans le dossier médical.
2. Préparation à la procédure des Émirats arabes unis
REMARQUE : Cette lettre s’adresse aux gynécologues ou aux chirurgiens vasculaires et aux radiologues interventionnels.
- Admettre le patient à l’hôpital (service de chirurgie gynécologique ou vasculaire).
- Assurez-vous qu’elle est avant le 10e jour du cycle à l’admission.
- Effectuer ou prescrire un examen gynécologique et une échographie du bassin.
- Assurez-vous que le diagnostic et la qualification pour la procédure des Émirats arabes unis sont corrects.
- S’assurer qu’aucune nouvelle contre-indication n’est apparue depuis la qualification pour les Émirats arabes unis. Si c’est le cas, proposez d’autres options de traitement et modifiez la date de l’intervention.
- Effectuez l’échographie transvaginale 3D (TVUS) et calculez le volume et les indices de vascularisation du fibrome (VI, FI et VFI) à l’aide de l’examen logiciel VOCAL (qui est utilisé pour évaluer l’efficacité de la procédure UAE72,75) (décrit dans l’introduction) (Figure 5 et Figure 6).
- Notez ce fait dans le dossier médical.
- Assurez-vous que le patient éligible pour l’EAU subit des tests effectués pendant la qualification pour l’EAU (décrits aux étapes 1.6.2, 1.6.3, 1.6.5 et 1.6.6 de la Qualification pour l’EAU).
- Si le patient a été pré-qualifié par un gynécologue et ne subit pas d’analyses de sang, d’urine et d’IRM, commandez les tests et organisez une consultation avec un radiologue interventionnel (étape 1.7 de la qualification pour les Émirats arabes unis).
- Évaluez ou commandez le taux sérique d’AMH (recommandé) ou de FSH (non recommandé avant 40 ans) avant les Émirats arabes unis pour permettre l’évaluation des lésions ovariennes résultant d’une embolisation « non ciblée ».
- Informez le patient que les résultats du test seront disponibles dans environ un jour et que la procédure des Émirats arabes unis ne sera possible qu’après réception de ces résultats.
- Informez le patient que des résultats incorrects la disqualifient pour l’intervention.
- AVERTISSEMENT! En cas de résultats manquants ou incorrects du frottis PAP, biopsie de l’endomètre ; le test microbiologique de frottis vaginal, disqualifie la patiente des Émirats arabes unis (délai trop long pour obtenir ces résultats). Se qualifier à nouveau après avoir obtenu les bons résultats.
- Notez ce fait dans le dossier médical.
- Obtenir un consentement éclairé pour effectuer des EAU.
- Fournir au patient toutes les informations sur les Émirats arabes unis.
- Discutez des complications possibles des Émirats arabes unis (décrites dans l’introduction).
- Laissez au patient le temps de réfléchir et de poser des questions ; permettre au patient de donner un consentement éclairé pour effectuer la procédure aux Émirats arabes unis.
- Informer la patiente qu’elle a le droit de modifier sa décision jusqu’au début des Émirats arabes unis.
- Si la patiente change sa décision concernant les Émirats arabes unis, proposez d’autres options de traitement pour les fibromes utérins (décrites dans l’introduction).
- Notez ce fait dans le consentement éclairé du patient ou dans le dossier médical.
- Immédiatement avant la procédure UAE, vérifiez et assurez-vous que les tests décrits aux sections 1.6.2, 1.6.3, 1.6.5 et 1.6.6 de la qualification pour les EAU ainsi que les PAS 3D, l’IRM et la consultation d’un radiologue interventionnel ont été effectués, et que les résultats sont corrects.
- Disqualifier un patient des Émirats arabes unis si les tests sont manquants ou si les résultats sont incorrects.
- Notez ce fait dans le dossier médical.
- Informer le patient et veiller à l’interdiction de prendre des aliments et des liquides dès le matin jusqu’à l’intervention. L’exception est une petite quantité de liquide nécessaire pour prendre la dose matinale de médicament.
- Assurez-vous le matin (avant les Émirats arabes unis) que le patient est à jeun.
- Assurez-vous que le patient a pris les médicaments pour ses propres maladies chroniques.
- Notez ce fait dans le dossier médical.
- Prescrire au patient les médicaments suivants : 1 comprimé d’anxiolytique (par exemple, Estazolam) par voie orale, 1 dose d’antibiotiques par voie intraveineuse, 1 globule de métronidazole par voie vaginale, 100 mg de suppositoire rectal de diclofénac.
- Donnez les médicaments ci-dessus environ 30 à 40 minutes avant l’EAU.
- Notez ce fait dans le dossier médical.
- Préparez le champ opératoire en vous assurant que l’aisselle gauche et l’aine droite sont rasées.
- Si les zones de peau ci-dessus ne sont pas rasées, rasez-les doucement.
- Notez ce fait dans le dossier médical.
- S’assurer que la patiente n’a pas de dispositif intra-utérin (DIU).
- Si la patiente porte un stérilet dans l’utérus, informez-la du risque accru d’infection dans la cavité utérine et proposez-lui de l’enlever avant les Émirats arabes unis.
- Si la patiente n’est pas d’accord pour retirer le stérilet, notez-le dans le consentement éclairé de la patiente ou dans le dossier médical.
- Assurez-vous que le patient signale toute réaction allergique aux médicaments, aux produits de contraste et aux désinfectants et notez ce fait et les résultats dans le dossier médical.
3. Exécution de la procédure EAU
REMARQUE : Cette note s’adresse aux radiologues d’intervention et aux anesthésistes.
- Effectuez la procédure dans des conditions stériles.
- Placez le patient sur la table d’opération et désinfectez largement la région inguinale droite à l’aide d’un désinfectant hospitalier (avec l’approbation appropriée).
- Collez le champ chirurgical autour du site chirurgical (aine droite).
- Sélectionnez le type d’anesthésie : anesthésie locale ou péridurale (EA) et notez le choix du patient dans le dossier médical.
- Émirats arabes unis sous anesthésie locale.
- Anesthésier (administration sous-cutanée) une solution de lignocaïne à 2 % sur le site de la chirurgie.
- Administrer 5 mg de morphine par voie intraveineuse au besoin.
- Avant de commencer la procédure aux Émirats arabes unis, assurez-vous que l’anesthésie locale est opérationnelle.
- Émirats arabes unis sous EA
- Préparez correctement le patient à l’EA.
- Effectuez l’EA avant de coller le champ chirurgical.
- S’assurer que le patient qualifié pour l’intervention EA ne présente pas les contre-indications suivantes : refus d’intervention, coagulopathie, thrombocytopénie, maladie hémolytique, prise d’anticoagulants, choc, infection au site d’injection épidurale, bactériémie, allergie aux anesthésiques locaux, déformations anatomiques de la colonne vertébrale, augmentation de la pression intracrânienne, maladie neurologique, sténose aortique ou mitrale sévère94. Notez ce fait dans le dossier médical.
- Appelez un anesthésiste et demandez une EA.
- Placez un cathéter mince dans l’espace épidural dans la région lombaire et administrez une anesthésie (procédure destinée aux anesthésistes).
- Avant de commencer la procédure aux Émirats arabes unis, assurez-vous que l’EA est opérationnel.
- La procédure des Émirats arabes unis
- Effectuez la procédure des Émirats arabes unis en combinaison angio sous guidage de fluoroscopie.
- Obtenir l’accès au système vasculaire à l’aide de la technique Seldinger95,96 (Figure 7, Figure 8 et Figure 9).
- Insérez un cathéter en queue de cochon dans l’aorte abdominale juste en dessous des artères rénales.
- Effectuez une angiographie pour visualiser les vaisseaux.
- Effectuer une aortonéphrographie pour évaluer l’anatomie des vaisseaux qui alimentent les fibromes et planifier l’intervention (Figure 10).
- Réaliser une angiographie de l’artère iliaque interne en projection antéro-postérieure et oblique pour révéler l’ostium de l’artère utérine.
- Commencez par le côté gauche, puis le côté droit, en raison du site d’une ponction et de la forme spécifique du cathéter. Selon le calibre du vaisseau, le cathéter ou microcathéter principal est introduit de manière sélective dans l’artère utérine (Figure 11).
- Placez le cathéter profondément dans l’artère utérine. Emboliser le récipient avec des particules d’hydrogel. En raison de la présence d’une anastomose utérine-ovaire, dont la taille est estimée à environ 500 μm, la taille suggérée des particules pour l’embolisation est de 700 μm afin de réduire le risque d'« embolisation non ciblée ».
- Poursuivez l’embolisation jusqu’à ce que le flux sanguin dans le vaisseau soit complètement bloqué. Le point final du traitement est la stase de contraste dans le vaisseau, ce qui prouve sa fermeture efficace.
- Effectuez l’embolisation de l’artère utérine du côté opposé avec le même accès. Le traitement dure environ 0,5 à 1,0 h66,67 (Figure 12).
- Évaluer l’efficacité de l’embolisation à partir d’un cathéter placé dans l’artère iliaque interne lors de l’angiographie de contrôle. L’absence d’un afflux actif de sang d’ombrage (vers les artères utérines) indique que la procédure est considérée comme techniquement correcte (Figure 13).
- Retirez délicatement le cathéter.
- Fermer le site de ponction par compression manuelle à l’aide d’un pansement compressif, qui doit être maintenu pendant les 6 prochaines heures ou d’un dispositif de fermeture (figure 14).
- Décrivez le parcours des Émirats arabes unis dans le dossier médical.
4. Prise en charge des patients après la procédure aux Émirats arabes unis
REMARQUE : Ceci s’adresse aux gynécologues ou aux chirurgiens vasculaires et anesthésistes.
- Commencer le traitement analgésique : pompe d’analgésie contrôlée par le patient (PCA) ou EA.
- Informer et discuter des options de traitement analgésique avec le patient.
- Informez le patient que l’EA offre un meilleur contrôle de la douleur et une rééducation plus rapide, par rapport à la pompe PCA76.
- Notez ce fait et le choix du patient dans le dossier médical.
- Traitement analgésique de la douleur post-embolisation à l’aide d’une pompe PCA.
- Préparez la seringue pour la pompe PCA avec la solution de morphine.
- Remplissez la seringue de 50 mL de la pompe PCA avec 50 mg de morphine et une solution de NaCl à 0,9 % (concentration de 1 mg/mL).
- Préparez la pompe PCA pour une utilisation intraveineuse.
- Joignez le drain à la seringue.
- Insérez la ponction veineuse à l’aide d’une canule.
- Insérez la seringue dans la pompe PCA.
- Remplissez le drain, lancez la pompe PCA.
- Activez le bouton START.
- Verrouillez la pompe PCA.
- Réglez les paramètres de la pompe PCA (répertoriés ci-dessous) (Figure 15).
AVERTISSEMENT! Des doses plus élevées de morphine peuvent provoquer une dépression respiratoire.- Utilisez une concentration de morphine de 1 mg/mL. Utiliser une dose de perfusion de morphine à la demande (bolus intraveineux) (bolus p.) de 0,5 mg avec un intervalle de temps après lequel la prochaine perfusion à la demande peut être administrée (intervalle de cadenassage/[Karencja]) de 5 min (pour éviter la dépression respiratoire). Utiliser une durée d’injection intraveineuse de morphine pendant la perfusion à la demande de 10 s.
- Assurez-vous que toutes les étapes ci-dessus sont effectuées.
- Commandez de la morphine dans la pompe PCA jusqu’à 24 h.
- Surveiller la douleur selon l’échelle d’évaluation numérique (NRS). Notez la valeur NRS dans le dossier médical.
- Utilisez la carte d’évaluation de la douleur (CAP).
- Informez la patiente que lorsque les symptômes de douleur apparaissent, elle doit appuyer elle-même sur le « joystick », obtenant ainsi le médicament sur demande.
- Assurez-vous que le patient comprend les instructions.
- Observez la quantité de « bolus intraveineux » à la demande par rapport au « bolus vide » (lancée pendant l’intervalle de verrouillage - section 4.2.3 du PROTOCOLE DES SOINS AUX PATIENTS après l’EAU) (figure 16).
- Si le rapport entre le « bolus vide » et le « bolus intraveineux » à la demande atteint une valeur supérieure à 2/1 (67 % / 33 %), utilisez la procédure ci-dessous (Figure 17, Figure 18).
- Pour améliorer l’efficacité du traitement antidouleur à l’aide d’une pompe PCA et réduire le risque d’effets secondaires de la morphine, envisagez d’utiliser du paracétamol ou des anti-inflammatoires non stéroïdiens en injections intraveineuses et à des doses standard.
- Prenez soin des situations où le patient doit quitter le lit.
- N’éteignez pas la pompe.
- Débranchez le drain et fixez-le avec un bouchon.
- Lorsque le patient revient, rebranchez le drain.
- Préparez la seringue pour la pompe PCA avec la solution de morphine.
- Traitement analgésique de la douleur post-embolisation par EA.
- Poursuivre l’EA si elle a été utilisée pour la procédure des Émirats arabes unis.
- Si une anesthésie locale a été utilisée pour l’intervention aux Émirats arabes unis et que le patient prescrit une EA, avant la pose du cathéter péridural, assurez-vous que les tests de CBC et de coagulation sont corrects.
- S’assurer que le patient qualifié pour la procédure d’EA ne présente pas les contradictions décrites à la section 3.4.3 de la section Réalisation de la procédure UAE. Notez ce fait dans le dossier médical.
- Appelez un anesthésiste et demandez une EA.
- Assurez-vous que l’EA est opérationnel.
- Déterminez le mode de fonctionnement de l’EA (bolus ou continu) avec l’anesthésiste. Notez ce fait dans le dossier médical.
- En mode continu (ACE), consultez un anesthésiste et vérifiez les réglages de la pompe à perfusion.
- En mode bolus (BEA), discutez avec l’anesthésiste des intervalles de temps entre l’administration de l’agent anesthésique local.
- Maintenez le cathéter pendant 24 à 48 h, selon les besoins.
- Surveillez la douleur à l’aide de l’échelle NRS. Notez la valeur NRS dans le dossier médical.
- Utilisez le PAC.
- Continuer le CEA/BEA jusqu’à ce que vous en ayez besoin, pas plus de 48 h.
- Poursuivre le traitement analgésique après l’ACP ou l’EA si nécessaire.
- Commandez Paracetamol 3 x 1,0 g par voie intraveineuse.
- Commandez le suppositoire rectal de diclofénac 2 x 50 mg.
- Si le traitement analgésique ci-dessus ne suffit pas, incluez des analgésiques de soutien.
- Commandez du kétoprofène 2 x 100 mg par voie intraveineuse.
- Traitez les symptômes des voies urinaires en prescrivant Furazidin 3 x 100 mg par voie orale.
5. Visite de contrôle après la procédure aux Émirats arabes unis
REMARQUE : Ceci s’adresse aux gynécologues.
- Effectuez le premier examen de contrôle le premier jour après les Émirats arabes unis.
- Évaluer l’état général du patient.
- Mesurez la température corporelle du patient.
- Évaluez la douleur après les Émirats arabes unis selon l’échelle NRS. Utilisez le PAC.
- Évaluez la plaie où le cathéter vasculaire a été inséré.
- Effectuer des tests de FSC et de coagulation.
- Effectuer une échographie veineuse pour évaluer l’état des organes pelviens après l’EAU.
- Effectuez une échographie télévisuelle 3D à l’aide d’une sonde de volume pour évaluer le volume et les indices de vascularisation du fibrome (VI, FI et VFI).
- S’il n’y a pas de complications et que la douleur post-embolisation a été contrôlée par des analgésiques oraux, renvoyez le patient à la maison.
- Informez le patient que si de la fièvre, des douleurs abdominales et des pertes vaginales purulentes surviennent après l’hospitalisation, le patient doit immédiatement consulter un médecin.
- Effectuer la prochaine visite de contrôle 3 mois après les Émirats arabes unis.
- Effectuez un examen gynécologique, un test CBC et un taux sérique d’AMH ou de FSH.
- Effectuer une IRM ou une échographie veineuse pour évaluer l’état des organes pelviens après l’EAU (Figure 19).
- Effectuer une TVUS 3D à l’aide d’une sonde de volume pour évaluer le volume et les indices de vascularisation du fibrome (VI, FI et VFI).
- Effectuez la dernière visite de contrôle 6 mois après les Émirats arabes unis.
- Effectuez un examen gynécologique, un test CBC et un taux sérique d’AMH ou de FSH.
- Effectuer une échographie veineuse pour évaluer l’état des organes pelviens après l’EAU.
- Effectuer une TVUS 3D à l’aide d’une sonde de volume pour évaluer le volume et les indices de vascularisation du fibrome (VI, FI et VFI).
- Évaluer l’efficacité des Émirats arabes unis.
- Comparez les résultats du test CBC avant et après les Émirats arabes unis.
- Comparez les volumes et les indices de vascularisation du fibrome (VI, FI et VFI) avant et après les Émirats arabes unis.
- Comparez les taux sériques d’AMH ou de FSH avant et après l’EAU pour évaluer la possibilité de lésions iatrogènes des ovaires pendant l’EAU à la suite d’une embolisation « non ciblée ».
- Informez la patiente qu’après l’embolisation de l’artère utérine, elle doit subir des contrôles gynécologiques réguliers.
- Dans certains cas (pas de réduction des symptômes du fibrome, suspicion de démarcation tissulaire, ou doute dans d’autres examens complémentaires), effectuez une IRM un an après l’EAU (Figure 20).
Résultats
557 procédures ont été effectuées aux Émirats arabes unis entre 2009 et 2019. L’âge moyen des patients était de 38 ans (31-53 ans). Un succès technique a été obtenu chez 547 patients (98,2 %).
La réduction moyenne du volume des fibromes (évaluation du volume IRM) 3 mois après l’intervention des Émirats arabes unis réalisée entre 2009 et 2013 dans le groupe de 206 patients âgés de 32 à 52 ans (âge moyen : 39 ans) était de 62 %. La réduction la plus faible était de 9 % (patient atteint de fibrome hyalinisé). Une réduction complète (100 %) a été obtenue chez les patients atteints de fibrome sous-muqueux séparé (FIGO 0). 90 % des patients ont déclaré être satisfaits après la procédure des Émirats arabes unis64.
La réduction moyenne du volume des fibromes 3 mois après l’EAU (évaluation du volume VOCAL par échographie) dans un groupe de 65 patients âgés de 29 à 52 ans (âge moyen : 43,1 ans) était de 50,1 % (2,7 % à 93,5 %). Avant la procédure des Émirats arabes unis, le volume médian des fibromes était de 101cm3 (plage de 23,6 à 610,0cm3), tandis qu’après 3 mois, la réduction du volume médian des fibromes à 50,4cm3 (plage de 6,9 à 193,9cm3) a été observée. Le test de corrélation de Spearman a montré une corrélation positive statistiquement significative, mais relativement faible (R = 0,33 ; p = 0,006) entre le volume initial dominant du fibrome et le pourcentage de réduction du volume. Il est intéressant de noter que les fibromes plus petits ont montré une grande variabilité de la réduction du volume des fibromes 3 mois après l’EAU, tandis que les fibromes plus gros ont montré une réaction stable et prévisible à l’EAU72.
Une réduction des indices vasculaires Doppler (VI, FI et VFI) dans le groupe de 17 patients 3 mois après l’EAU a été observée. Le pourcentage de réduction pour l’IV et l’IFV était de 95,4 %, tandis que pour l’IV, la réduction était de 58,3 %75.
Une évaluation de la réserve ovarienne a été réalisée chez 30 patientes âgées de 33 à 40 ans (âge moyen : 35 ans) 3 mois après l’EAU. Le volume moyen dominant des fibromes était de 107,75cm3 (intervalle de 87,4 à 131,1cm3). Les marqueurs suivants de la réserve ovarienne ont été étudiés : le nombre de follicules antraux (AFC), l’AMH, l’inhibine B (INHB), FSH et l’œstradiol (E2). Une diminution significative de l’AFC (56,7 % ; p < 0,001), de l’AHM (36,7 % ; p < 0,001), de l’INHB (46,7 % ; p < 0,001) et de l’E2 (43,3 % ; p < 0,001) a été observée. Simultanément, une augmentation significative du taux sérique de FSH (43,4 % ; p < 0,001) a été observée65.
Trois mois après l’intervention aux Émirats arabes unis, une inversion utérine a été observée chez deux patientes atteintes de fibromes sous-muqueux (FIGO 0) (d’un diamètre de 6 cm et 8 cm) lors de l’excrétion de fragments nécrotiques marqués de fibromes à travers le canal cervical, ce qui a entraîné une hystérectomie d’urgence.
La réduction de la douleur post-embolisation (selon le PAC) avec l’utilisation de l’ACP (procédure 4.2 du protocole Soins aux patients après les Émirats arabes unis) a été évaluée chez 60 patients sur l’échelle NRS le lendemain de l’intervention aux Émirats arabes unis. Le NRS médian immédiatement après l’EAU était de 10 (plage de 5 à 10), tandis qu’après le traitement, le NRS médian était évalué à 4 (plage de 1 à 5). Le test de corrélation de Spearman entre le volume initial des fibromes (médiane 194,5 cm3, plage de 79 à 411 cm3) et le NRS immédiatement après les Émirats arabes unis a montré une corrélation positive forte et statistiquement significative (R = 0,6 ; p < 0,001), tandis que la corrélation entre le volume initial des fibromes et le NRS après le traitement a montré une corrélation positive faiblement significative (R = 0,34 ; p < 0,001). En analysant les relations ci-dessus, on peut conclure que les principaux fibromes après l’EAU provoquent une douleur post-embolisation plus forte après l’EAU. Cependant, le traitement de la douleur post-embolisation après l’EAU de petits fibromes avec l’utilisation de l’ACP donne de meilleurs résultats.
Le tableau 1 présente un résumé des données pour les résultats représentatifs.
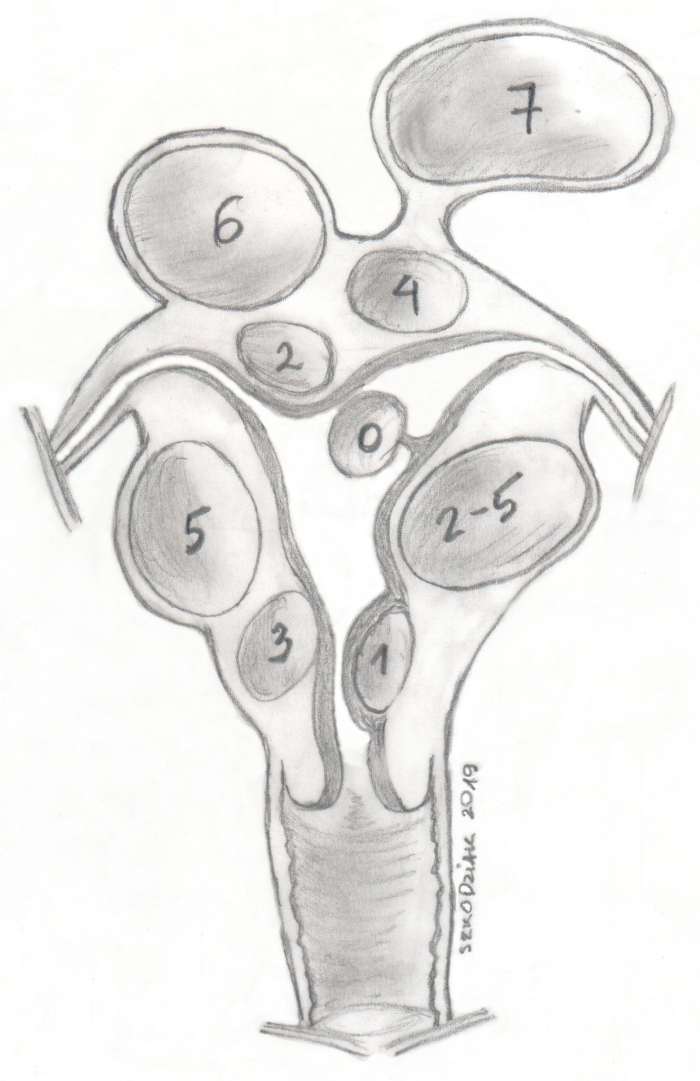
Figure 1 : Classification des fibromes utérins FIGO. Veuillez cliquer ici pour voir une version agrandie de cette figure.
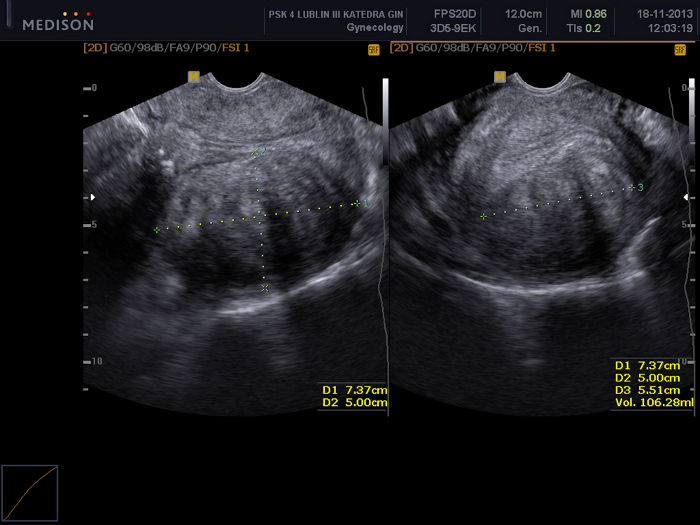
Figure 2 : Examen pelvien à l’aide d’une échographie transvaginale.
Visible un fibrome utérin (FIGO 5) de dimensions 73 x 50 x 55 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Examen d’IRM pelvienne en pré-qualification pour les Émirats arabes unis.
Visible dans la section sagittale un gros fibrome utérin (FIGO 2-5) avec effet de masse. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Examen d’IRM pelvienne en pré-qualification pour les Émirats arabes unis.
Visible dans la section sagittale un fibrome utérin (FIGO 2–5). Veuillez cliquer ici pour voir une version agrandie de cette figure.
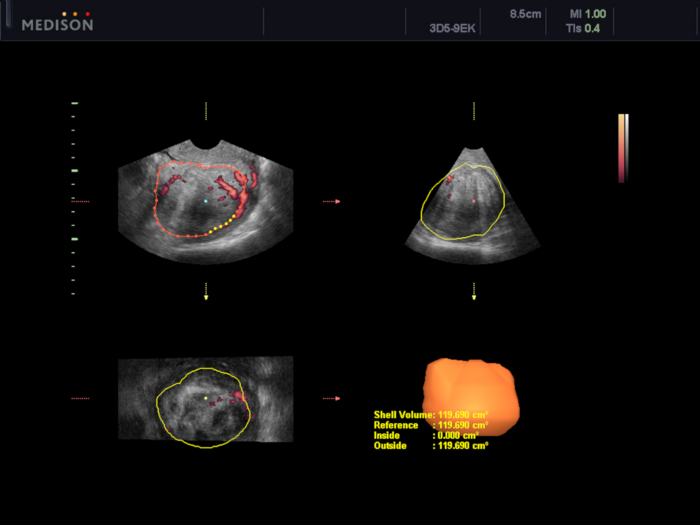
Figure 5 : Évaluation du volume du fibrome utérin à l’aide du logiciel VOCAL.
Dans ce cas, le volume est estimé à 119,7 cm3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
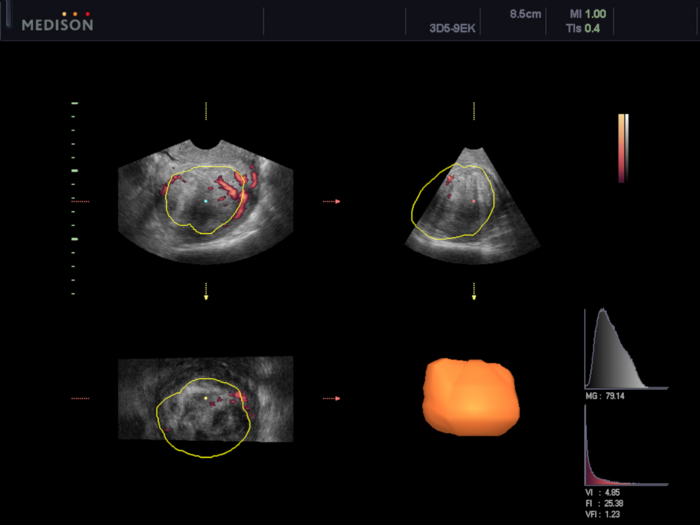
Figure 6 : Évaluation de la vascularisation du fibrome utérin à l’aide du logiciel VOCAL.
Dans ce cas, les indices de vascularisation ont été calculés (VI 4,85, FI 25,38 et VFI 1,23). Veuillez cliquer ici pour voir une version agrandie de cette figure.
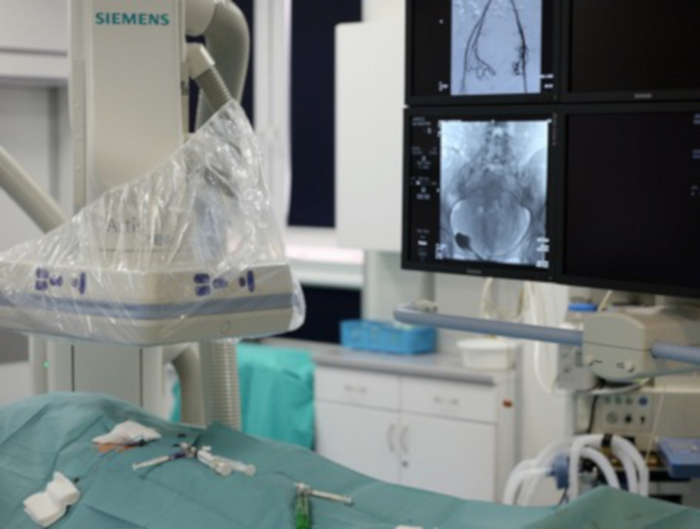
Figure 7 : La photo montre un fragment du laboratoire d’angiographie.
Dans le coin inférieur gauche, le patient avec une aine exposée par laquelle d’autres outils sont introduits. Dans le coin supérieur gauche, on peut voir l’arceau de l’angiographe. Dans le coin supérieur droit, les moniteurs sont visibles, où l’opérateur suit l’outil de saisie. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Un ensemble pour les ponctions artérielles.
Du bas : une aiguille, un verrou vasculaire avec un introducteur et un guide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
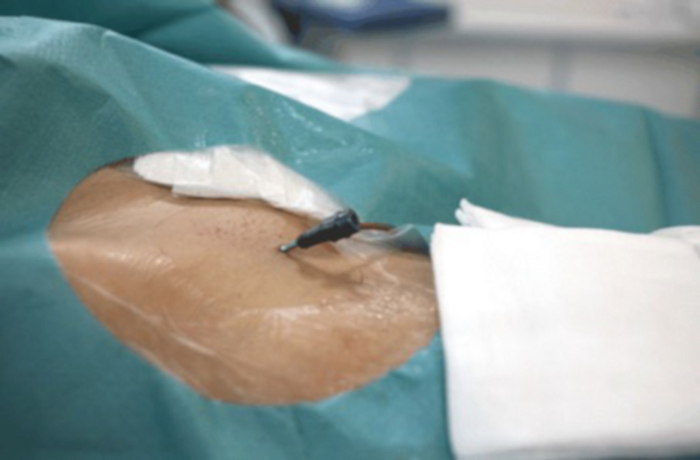
Figure 9 : Gros plan de l’aine avec verrou vasculaire visible inséré dans l’artère fémorale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
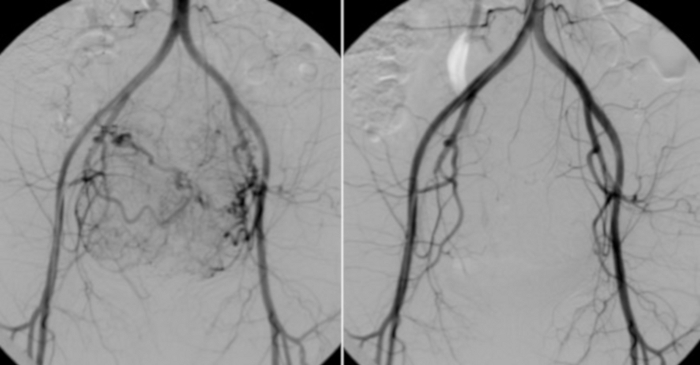
Figure 10 : A gauche, angiographie à partir d’un cathéter placé dans l’aorte abdominale.
Le port vasculaire visible des myomes utérins. À titre de comparaison (à droite), un test de contrôle effectué après les Émirats arabes unis. Veuillez cliquer ici pour voir une version agrandie de cette figure.
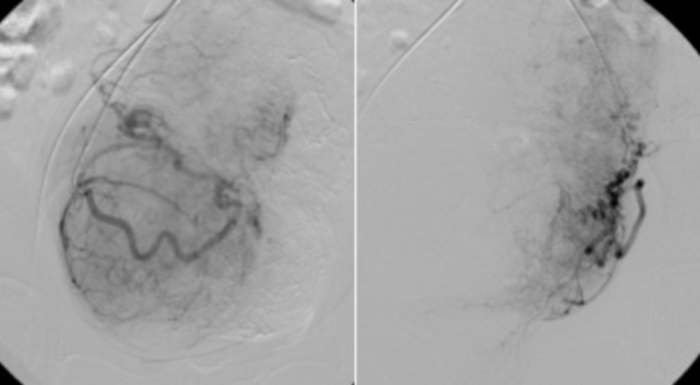
Figure 11 : Angiographie sélective à l’aide d’un cathéter RUC placé dans les parties proximales des artères utérines.
Lit vasculaire visible des fibromes utérins. Veuillez cliquer ici pour voir une version agrandie de cette figure.
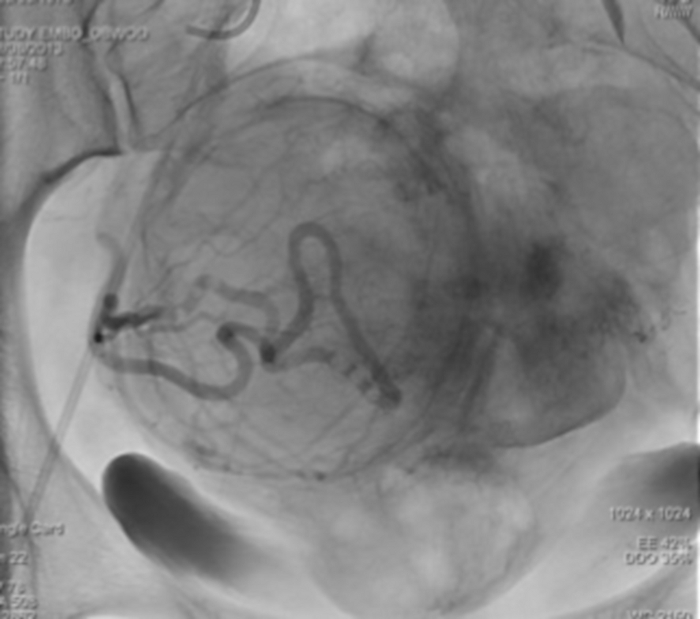
Figure 12 : L’imagerie par rayons X unique montrant la stase de l’agent de contraste dans l’artère utérine droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 13 : L’angiographie de contrôle réalisée à partir du cathéter principal situé respectivement dans l’artère iliaque gauche et droite, confirme l’absence d’afflux de sang frais (ombrage) dans les artères utérines. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 14 : Le site d’accès vasculaire après l’achèvement de l’EAU.
Incision visible de 2 mm près de l’aine droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 15 : Réglage des paramètres de la pompe PCA pour la douleur post-embolisation après le traitement des Émirats arabes unis (section 4.2.3 du Soins aux patients après le protocole des Émirats arabes unis). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 16 : Pompe PCA en fonctionnement.
Le rapport entre le bolus intraveineux à la demande et le « bolus vide » (section 4.2.6.2. du Soins aux patients après le PROTOCOLE DES ÉMIRATS ARABES UNIS) est de 1:1 (50 %:50 %). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 17 : Pompe PCA en fonctionnement.
Le rapport entre le bolus intraveineux à la demande et le « bolus vide » (section 4.2.6.3. du Soins aux patients après le PROTOCOLE DES ÉMIRATS) est de 1:2 (33 % : 67 %). Cela nécessite un traitement analgésique supplémentaire (procédure 4.2.6.4. de la prise en charge du patient après le PROTOCOLE EAU). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 18 : Pompe PCA en fonctionnement.
Le rapport entre le bolus intraveineux à la demande et le « bolus vide » (section 4.2.6.3. du Patient care after the UAE PROTOCOL) est de 1:3 (25 % : 75 %). Cela nécessite la poursuite d’un traitement analgésique supplémentaire (procédure 4.2.6.4. de la prise en charge du patient après le PROTOCOLE EAU). Veuillez cliquer ici pour voir une version agrandie de cette figure.
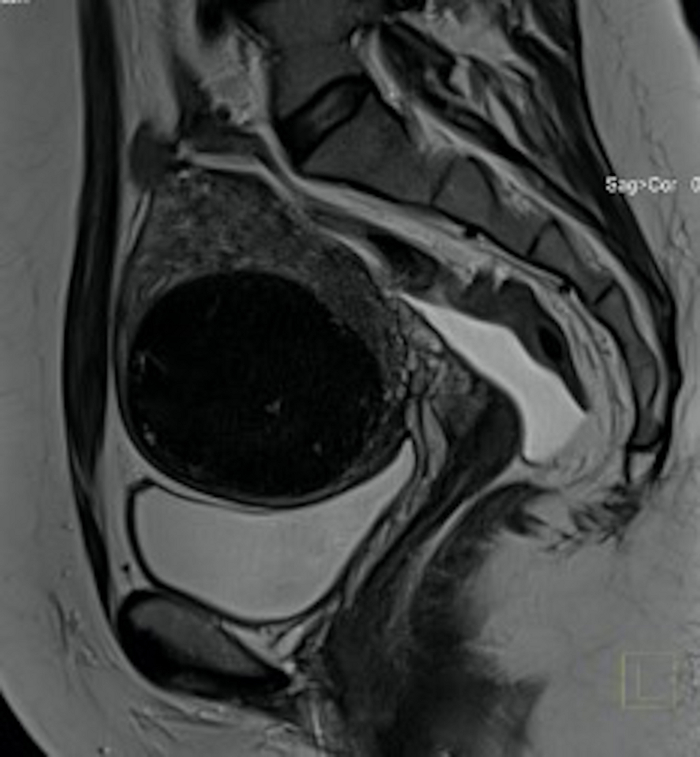
Figure 19 : Examen IRM pelvien 3 mois après l’intervention aux Émirats arabes unis (même cas que sur la figure 3).
Dans la section sagittale est visible un fibrome utérin (FIGO 5), nettement plus petit qu’avant la procédure, densité différente du tissu fibrome. Veuillez cliquer ici pour voir une version agrandie de cette figure.
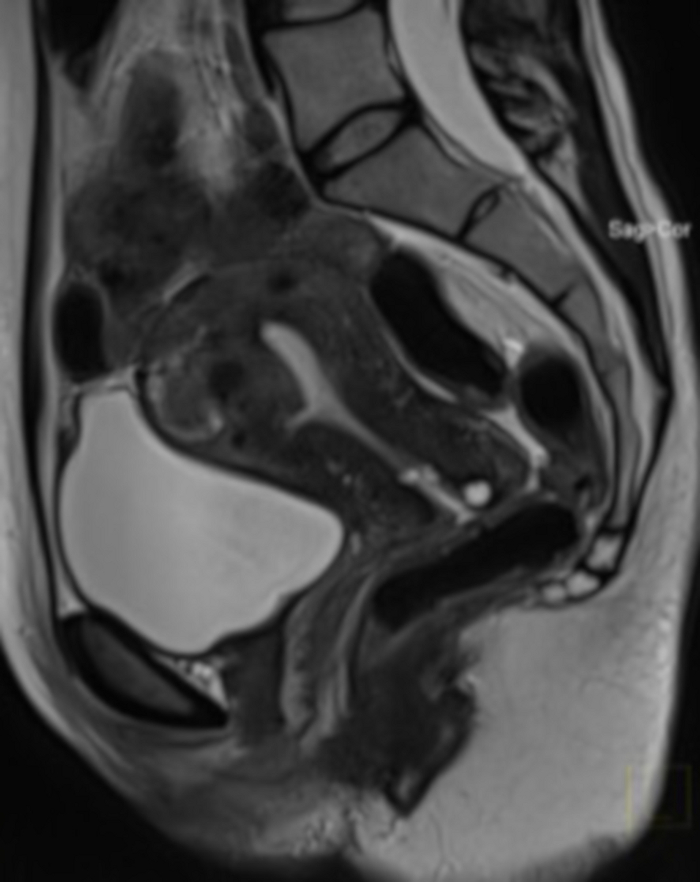
Figure 20 : Examen IRM pelvien 1 an après l’intervention aux Émirats arabes unis (même cas que sur la figure 4).
La section sagittale montre un fibrome utérin (FIGO 2-5), avec une très grande réduction de volume après l’EAU. L’IRM a été réalisée en raison d’une suspicion de démarcation tissulaire après l’intervention (pas de possibilité d’évaluer la structure du fibrome dans un examen bimanuel). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| RÉSULTATS REPRÉSENTATIFS / LE PROTOCOLE DE LUBLIN 64,65,72 | ||
| Le nombre d’interventions aux Émirats arabes unis effectuées entre 2009 et 2019 | 557 | |
| Succès technique | Réalisé chez 547 patients (98,2 %) | |
| La réduction moyenne du volume des fibromes (évaluation du volume IRM) 3 mois après les Émirats arabes unis dans le groupe de 206 patients âgés de 32 à 52 ans (âge moyen - 39 ans) | 62.0% (9.0-100.0%) | |
| La réduction moyenne du volume des fibromes (évaluation du volume VOCAL par échographie) 3 mois après les Émirats arabes unis dans le groupe de 65 patients âgés de 29 à 52 ans (âge moyen – 43,1 ans) | 50.1% (2.7-93.5%) | |
| Évaluation de la réserve ovarienne | Diminution de l’AFC | 56,7 % (<0,001) |
| Diminution de l’AMH | 36,7 % (P<0,001) | |
| Diminution de l’INHB | 46,7 % (< 0,001) | |
| Diminution de E2 | 43,3 % (p<0,001) | |
| Augmentation de la FSH | 43,4 % (p<0,001) | |
| Réduction de la douleur post-embolisation (selon PAC) avec l’utilisation de l’ACP (procédure 2. du PROTOCOLE « Soins aux patients après les Émirats arabes unis ») évaluée dans le groupe de 60 patients | Le NRS médian immédiatement après les Émirats arabes unis | 10 (plage 5-10) |
| Le NRS médian le lendemain des Émirats arabes unis | 4 (plage 1-5) | |
Tableau 1 : Résultats représentatifs de la technique des Émirats arabes unis dans le traitement des fibromes utérins symptomatiques réalisé conformément au protocole de Lublin.
Discussion
En raison des différences de structure, de taille, de localisation et de symptômes des fibromes utérins, la création d’un protocole uniforme aux Émirats arabes unis n’a pas été une tâche facile. Il y a eu de nombreuses divergences entre les hypothèses de cette méthode thérapeutique et les attentes des patients, tant au stade de la qualification qu’au niveau des effets du traitement. Plus d’une fois, les patientes référées pour les Émirats arabes unis n’ont signalé aucun signe clinique de fibromes et ne savaient pas que ces tumeurs utérines ne seraient pas éliminées radicalement. La seule attente explicite était de se débarrasser des fibromes sans chirurgie.
Par conséquent, il est important que la patiente comprenne les hypothèses de cette méthode, l’accepte et connaisse les différences concernant les méthodes alternatives de traitement des fibromes utérins. Son choix conscient (section 1.1. du Protocole de qualification pour les Émirats arabes unis) est un point critique, et sa bonne mise en œuvre permettra de poursuivre le protocole.
Lors de la mise en œuvre du protocole, certaines procédures sont répétées. C’est l’intention et le résultat de la formule adoptée par cette revue, dans laquelle les commandes individuelles sont écrites en mode impératif et s’adressent à une seule personne. Cependant, plusieurs médecins sont souvent impliqués dans la qualification, la préparation et d’autres étapes des Émirats arabes unis. Ce sont également des points critiques du protocole ; leur omission peut entraîner des EAU dans des conditions non optimales ou avec la présence de contre-indications. D’où la division du protocole en 5 chapitres. Cela permet de le poursuivre par différents spécialistes, et les points de protocole répétés sont ensuite vérifiés de manière indépendante.
Une difficulté supplémentaire dans la création d’un protocole uniforme d’embolisation de l’artère utérine dans le traitement des fibromes utérins est le grand nombre actuel de recommandations (jusqu’à 11) qui se rapportent à la même procédure41. Bien que leurs hypothèses soient similaires, comme toujours, « le diable est dans les détails », détails qui nécessitaient une unification. Les contre-indications relatives concernant l’emplacement des fibromes ou les plans reproductifs des patients subissant des Émirats arabes unis sont les plus controversées lors des qualifications. En appliquant des critères plus stricts proposés par la SOGC, les patients devraient être exclus de cette procédure, tandis que les recommandations plus libérales du RCOG permettent l’admissibilité aux Émirats arabes unis 14,32,43. La question est de savoir ce qu’il faut faire. Lors de la création du protocole, nous avons basé la décision (en dehors de la littérature abondante) sur l’analyse de nos cas et l’expérience acquise, ce qui nécessite une approche individuelle de chaque patient. Par conséquent, le protocole n’exclut pas la performance de l’EAU chez les patients présentant des contre-indications relatives (sections 1.4 de la qualification pour le protocole EAU). La bonne qualification et la bonne préparation pour les Émirats arabes unis semblent être la clé du succès thérapeutique. La technique elle-même est également très importante, ainsi que les soins aux Émirats arabes unis, qui garantissent non seulement le succès thérapeutique ou la satisfaction du patient, mais aussi l’absence de complications décrites ci-dessus.
Quel que soit le nombre de fibromes, toutes les lésions sont embolisées au cours d’une seule procédure. Habituellement, plus il y a de fibromes, plus il y aura de matériel d’embolisation qui sera injecté. Cela prolonge la durée de l’embolisation mais ne change pas la procédure. L’EAU peut être modifiée si nous voyons un lien évident avec l’artère ovarienne, ce qui peut entraîner un risque accru d’embolisation non ciblée. Nous pouvons ensuite fermer une telle connexion (par exemple, à l’aide de bobines), séparant ainsi l’approvisionnement des ovaires et de l’utérus, puis poursuivre l’embolisation avec l’utilisation de particules de 700 μm. S’il n’est pas possible d’implanter des bobines, nous augmentons le diamètre des particules à 900 μm.
Il existe également des cas où les fibromes peuvent être fournis par le côté des artères ovariennes ; Ensuite, les artères utérines sont hypoplasiques. Dans ces cas, pour réussir l’embolisation, un microcathéter doit être inséré dans l’artère ovarienne et au-delà de l’ovaire, déposant le matériel d’embolisation dans le lit vasculaire utérin, tout en maintenant un bon approvisionnement ovarien.
L’avantage incontestable de l’embolisation est le fait qu’il ne s’agit pas d’une procédure techniquement difficile et qu’elle ne nécessite pas d’équipement sophistiqué.
Les points forts du protocole sont les points concernant le traitement de la douleur post-embolisation, dont au moins la moitié des patients n’avaient pas entendu parler lorsqu’ils se sont qualifiés pour les Émirats arabes unis. La procédure standard que nous proposons est l’utilisation d’une pompe PCA (section 4.2 du Protocole Soins aux patients après les Émirats arabes unis), et les résultats obtenus confirment la grande efficacité d’un tel traitement.
En ce qui concerne les modifications futures du protocole des Émirats arabes unis, il semble possible de modifier la section 10 de la préparation au protocole des Émirats arabes unis, qui exige le retrait du stérilet de l’utérus avant la procédure en raison du risque d’inflammation et de septicémie. Dans les grandes études de suivi, le risque d’infection du bassin combiné à la présence d’un stérilet est inférieur à 1 sur 130049.
Les Émirats arabes unis ont été traités comme une méthode expérimentale depuis leur première utilisation car ils nécessitaient d’évaluer l’efficacité et d’examiner les complications que cette procédure peut entraîner à court et à long terme. Au cours de ces années, les indications et les contre-indications ont été modifiées en fonction des nouveaux résultats d’examens et de l’observation clinique. Les données actuelles, y compris plusieurs études contrôlées randomisées, reconnaissent que les Émirats arabes unis constituent une méthode de traitement précieuse pour les fibromes utérins symptomatiques, dont l’efficacité et l’innocuité ont été bien établies.
La création du protocole ci-dessus est le résultat d’une analyse approfondie de la littérature actuelle, des recommandations pertinentes et de l’expérience acquise grâce à l’étroite collaboration des gynécologues et des radiologues chirurgicaux au cours de la décennie.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
DÉCLARATION:
Piotr Szkodziak, en tant qu’auteur de la figure 1, illustrant la classification des fibromes utérins FIGO, permet l’utilisation gratuite de la figure à des fins scientifiques et éducatives sans aucune modification. L’intention de modifier la figure doit être acceptée par l’auteur (piotr.szkodziak@gmail.com).
Remerciements
Les auteurs tiennent à remercier toute l’équipe de la 3e chaire et du département de gynécologie et du département de radiologie interventionnelle et de neuroradiologie de l’Université de médecine de Lublin pour leur aide dans la mise en œuvre du protocole d’embolisation des artères utérines de Lublin.
matériels
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
Références
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon