Method Article
El protocolo Lublin de la embolización de las arterias uterinas en el tratamiento de los miomas uterinos sintomáticos
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un método de embolización de la arteria uterina para el tratamiento de los miomas uterinos sintomáticos dividido en cinco secciones: calificación, preparación, realización, atención posterior al procedimiento y visitas de seguimiento. Este protocolo requiere una estrecha cooperación entre ginecólogos y radiólogos intervencionistas, lo que permite la correcta ejecución del procedimiento anterior.
Resumen
Los miomas uterinos son tumores benignos que se originan en el tejido muscular liso, que constituye el estroma del músculo uterino. Los fibromas uterinos son los tumores benignos más comunes que se encuentran en las mujeres. En el 20% al 50% de las mujeres, los fibromas son asintomáticos y no requieren ningún tratamiento. Los principales síntomas de los fibromas uterinos son sangrado menstrual profuso, sangrado uterino anormal y síntomas de presión. Los síntomas de presión pueden causar síndrome de dolor pélvico, trastornos de la micción y estreñimiento.
Los métodos de tratamiento que se utilizan actualmente incluyen el tratamiento quirúrgico, la terapia farmacológica y los procedimientos mínimamente invasivos. El método mínimamente invasivo más comúnmente aplicado es la embolización de las arterias uterinas. Este procedimiento es actualmente un método ampliamente aceptado de tratamiento para los fibromas uterinos sintomáticos y ha sido reconocido como tal por el Instituto Nacional para la Salud y la Excelencia Clínica en las pautas para el sangrado menstrual abundante.
Este es un procedimiento complicado y requiere una estrecha cooperación entre ginecólogos y radiólogos intervencionistas. Presentamos un protocolo aplicable a la embolización de la arteria uterina en el tratamiento de los miomas uterinos sintomáticos. El protocolo se divide en cinco secciones. Las dos primeras secciones están destinadas a ginecólogos y radiólogos intervencionistas, y explican cómo calificar y preparar a una paciente para la embolización de manera paso a paso. La sección tres, que está dirigida a los radiólogos intervencionistas, explica cómo se debe realizar la embolización. La sección cuarta está dirigida a los ginecólogos o médicos de sala de hospital que atienden a los pacientes después de la embolización. Esta sección del protocolo ofrece un método para tratar el dolor posterior a la embolización utilizando la bomba de analgesia controlada por el paciente (PCA). La sección cinco completa el procedimiento con una evaluación de los efectos y las complicaciones tardías de la embolización de la arteria uterina.
Las cinco secciones crean un protocolo uniforme dirigido a médicos, expertos e investigadores nuevos en el campo.
Introducción
Los miomas uterinos son tumores benignos que se originan en el tejido muscular liso, que constituye el estroma del músculo uterino. Son tumores monoclonales, formados por una gran cantidad de sustancia extracelular que contiene colágeno, fibronectina y proteoglicanos. Los fibromas están rodeados por una delgada pseudocápsula hecha de fibras musculares comprimidas, fibras de colágeno, neurofibras y vasos sanguíneos 1,2. La fisiopatología de los miomas no se conoce completamente, pero parece basarse principalmente en la proliferación monoclonal causada por cambios epigenéticos selectivos y específicos de tejido3. No se encontró un solo gen que causara fibromas uterinos. Sin embargo, la presencia de síndromes raros de fibromas uterinos, como la leiomiomatosis cutánea múltiple y uterina, se ha atribuido a un gen que codifica la fumarato hidratasa, una enzima mitocondrial involucrada en el ciclo de Krebs4. La presencia de deleciones y translocaciones del cromosoma 7 en los cromosomas 7, 12 y 14, que ocurren en el 50% de los fibromas, parece ser secundaria en lugar de primaria 5,6,7.
Los reguladores del crecimiento de los fibromas uterinos son las hormonas esteroides producidas por los ovarios (estrógenos y progesterona), los factores de crecimiento, la angiogénesis y la apoptosis. También se han identificado factores de riesgo para el desarrollo de miomas uterinos, como la edad, la menarquia precoz, la raza afroamericana, la herencia, la nuliparidad, la obesidad, el síndrome de ovario poliquístico, la diabetes, la hipertensión, la deficiencia de vitamina D, el uso de leche de soja, el consumo de alcohol y cafeína8.
Los fibromas uterinos son los tumores benignos más comunes de los órganos reproductivos en las mujeres. Estos tumores fueron descritos por primera vez en 1793 por Matthew Baillie en el Hospital St George de Londres. Los datos epidemiológicos disponibles no especifican con precisión la incidencia de miomas uterinos, ya que su gran proporción sigue sin diagnosticarse. Se estima que los fibromas uterinos ocurren en el 5,4% al 77% de todas las pacientes. Su prevalencia es mayor en Estados Unidos que en Europa, siendo la causa probable las diferencias raciales8.
Entre las mujeres en edad fértil, aproximadamente el 30% de los miomas pueden presentar síntomas clínicos en forma de sangrado uterino anormal, lo que resulta en un suministro inadecuado de sangre en las pacientes9. En la mayoría de los casos, las pacientes tienen más de un mioma, que son lesiones esféricas localizadas en el útero. Sus dimensiones y ubicación pueden variar. En el 90% de los casos, se localizan en el cuerpo del útero. Su diámetro puede ser desde varios milímetros hasta 20 cm10.
La clasificación FIGO (Fédération Internationale de Gynécologie et d'Obstétrique) las divide en grupos de 0 a 8 dependiendo de la proximidad del endometrio (cuanto menor sea el número, más cerca estará el endometrio) (Figura 1)11. En alrededor del 50% al 75% de los casos, los fibromas son asintomáticos. Los síntomas más comunes de los fibromas uterinos son sangrado menstrual profuso, sangrado uterino anormal y síntomas de presión. Los miomas se asocian con alrededor del 10% de los casos de infertilidad, y en el 1%-3% son la única causa12. Los miomas uterinos asintomáticos suelen someterse a un control médico regular, mientras que los miomas sintomáticos son una indicación para el tratamiento13.
Los métodos de tratamiento para los miomas uterinos que se utilizan actualmente incluyen el tratamiento quirúrgico, la terapia farmacológica y los procedimientos mínimamente invasivos 13,14,15,16,17,18. El tratamiento quirúrgico incluye miomectomía (abdominal e histeroscópica) e histerectomía. Tanto la miomectomía como la histerectomía tienen un impacto positivo en la calidad de vida19. La histerectomía se asocia con la pérdida irreversible de la fertilidad; Por lo tanto, muchas mujeres buscan otras opciones de tratamiento20.
La miomectomía abdominal permite preservar la fertilidad. Dependiendo del tamaño y número de miomas, así como de la experiencia del cirujano, este procedimiento se puede realizar mediante laparotomía o laparoscopia. Aunque las hemorragias son menos comunes que en la histerectomía, la morbilidad general es similar. La miomectomía histeroscópica es un método más seguro y menos invasivo que la miomectomía abdominal y permite el tratamiento de los miomas submucosos (FIGO 0). Pueden ser necesarios procedimientos histeroscópicos posteriores para extirpar completamente los fibromas tipo 2 más grandes21.
Los dispositivos intrauterinos liberadores de levonorgestrel son un tratamiento eficaz para el sangrado menstrual abundante, pero no reducen el tamaño de los fibromas. Su uso es limitado en pacientes con la cavidad uterina deformada. Los análogos de la GnRH se utilizan principalmente como agente preoperatorio para reducir el tamaño de los miomas y la pérdida de sangre perioperatoria. También reducen el porcentaje de incisiones verticales durante la histerectomía y la miomectomía, al tiempo que aumentan la posibilidad de un procedimiento vaginal20.
A corto plazo, los moduladores selectivos de los receptores de progesterona reducen el volumen del mioma e inducen amenorrea. Sin embargo, la eficacia y la seguridad a largo plazo requieren más investigación. Junto con los inhibidores de la aromatasa, puede haber otras opciones para el tratamiento preoperatorio de la anemia y la reducción del volumen del mioma22. Algunos estudios sugieren que la vitamina D puede ralentizar o prevenir el crecimiento de los miomas y la aparición de los síntomas23.
También se están desarrollando nuevos métodos que utilizan 2-metoxiestradiol combinado con nanopartículas24. Los métodos mínimamente invasivos utilizados en el tratamiento de los miomas incluyen la embolización de la arteria uterina (EAU), la cirugía de ultrasonido focalizado guiada por resonancia magnética (MRgFUS), la oclusión laparoscópica de la arteria uterina (LUAO) y la miólisis por radiofrecuencia14,25. El ultrasonido focalizado de alta intensidad guiado por ultrasonido (US-HIFU) es un nuevo método, todavía experimental, mínimamente invasivo26,27.
Los métodos terapéuticos de oclusión vascular y bloqueo del suministro de sangre al útero se mencionaron hace más de 120 años. En 1894, Kelly presentó la ligadura de las arterias ilíacas internas durante una histerectomía oncológica para controlar el sangrado pélvico intratable, que en ese momento era una complicación común después del procedimiento quirúrgico28. Luego, Sack (1973) describió el uso efectivo de la misma técnica en el tratamiento de la hemorragia posparto masiva después del parto con fórceps. En ambos casos, la hemostasia se logró sin histerectomía29. En 1979, Heaston et al. y Brown et al., describieron de forma independiente la embolización de las arterias pélvicas utilizando esponjas de gelatina absorbibles para controlar la hemorragia posparto30,31.
Los EAU se utilizaron por primera vez como método de tratamiento para los fibromas uterinos sintomáticos en 1991 en Francia32. Inicialmente se utilizó para reducir la pérdida de sangre después de la miomectomía. En 1995, Ravina et al. propusieron este procedimiento como el método primario de tratamiento para los miomas uterinos sintomáticos33. En los Estados Unidos, la embolización de la arteria uterina se realizó con éxito en 199734.
El creciente interés en la preservación uterina en mujeres con miomas sintomáticos colocó a los EAU a la vanguardia del tratamiento de fibromas mínimamente invasivos 14,18,35,36,37. En el año 2000, se creó el Grupo de Trabajo Conjunto del Real Colegio de Obstetras y Ginecólogos y el Real Colegio de Radiólogos para emitir directrices sobre los EAU. En ese momento, los Emiratos Árabes Unidos se consideraban un método experimental (se realizaron menos de 7.000 procedimientos en todo el mundo). Desde que se publicaron las directrices, se han realizado más de 100.000 procedimientos de los EAU en todo el mundo. Además, se han llevado a cabo cinco ensayos controlados aleatorios, comparando los EAU con otros procedimientos quirúrgicos. Los resultados de la investigación indican que la EAU es altamente efectiva a corto y mediano plazo (hasta unos pocos años) con un bajo riesgo de complicaciones medias (por ejemplo, infección uterina) y graves (potencialmente mortales)38,39. En estudios aleatorizados, los tiempos de hospitalización más cortos, la recuperación más rápida y el regreso a las actividades diarias hablan a favor de los EAU. Los procedimientos quirúrgicos demostraron ser más baratos y requirieron con menor frecuencia una nueva intervención, manteniendo la significación estadística32. Este procedimiento es actualmente un método de tratamiento ampliamente aceptado para los miomas uterinos sintomáticos y ha sido reconocido como tal por el National Institute for Health and Clinical Excellence (NICE) en las guías para el sangrado menstrual abundante40.
Actualmente, existen 11 recomendaciones sobre el uso de EAU en el tratamiento de los miomas uterinos sintomáticos, elaboradas por sociedades científicas de Europa, América del Norte y Australia. En la mayoría de los casos, las recomendaciones son coherentes, mientras que la divergencia se refiere a dos discrepancias. La primera es si el mioma submucoso pediculado (FIGO 0) y subseroso (FIGO 7) son contraindicaciones para los EAU. La segunda es si las mujeres que declaran un embarazo futuro deben estar calificadas para este procedimiento41. El Colegio Americano de Obstetras y Ginecólogos (ACOG) (2008) presentó una interesante guía para el tratamiento de los miomas uterinos. Sobre la base de pruebas científicas consistentes (Nivel A), el ACOG definió a los EAU como un método eficaz y seguro para las mujeres debidamente cualificadas que desean preservar el útero con indicaciones típicas para el tratamiento de los fibromas. Al mismo tiempo, las recomendaciones del ACOG enfatizaron la necesidad de una estrecha cooperación entre los ginecólogos y los radiólogos intervencionistas. En las guías publicadas, el ACOG reconoció el deseo de preservar la fertilidad como la única contraindicación (relativa)42.
Una de las últimas recomendaciones fue emitida en 2013 por el Real Colegio de Obstetras y Ginecólogos (RCOG) y en 2015 por la Sociedad de Obstetras y Ginecólogos de Canadá (SOGC)41. En el resto de este artículo, los autores utilizarán las recomendaciones anteriores. De acuerdo con las guías de RCOG y SOGC, cualquier paciente con miomas sintomáticos puede ser candidato a la embolización, siempre que no haya contraindicaciones y los beneficios del procedimiento (resolución de los síntomas) superen el riesgo de complicaciones. Cabe señalar que la embolización de los miomas uterinos como procedimiento mínimamente invasivo conlleva un número insignificante de complicaciones graves. Por lo tanto, los beneficios en la mayoría de los casos superan el riesgo de complicaciones 14,32,43.
Una calificación adecuada del paciente es de crucial importancia para una alta efectividad clínica y la prevención de complicaciones después de la EAU. La principal indicación para los EAU son los fibromas uterinos sintomáticos, que provocan sangrado menstrual abundante, dismenorrea, dolor, dispareunia y otros efectos adversos en el tracto urinario o gastrointestinal. Es necesario diferenciar los miomas de la adenomiosis o los miomas que coexisten con adenomiosis porque, en tal situación, la EAU es menos efectiva y requiere la modificación de la técnica del procedimiento 14,32,43,44,45,46,47. Las indicaciones específicas para realizar el procedimiento de los EAU en mujeres con fibromas uterinos sintomáticos incluyen la negativa a la cirugía, la falta de consentimiento para la transfusión de sangre y la cirugía de fibromas uterinos previamente fallida.
En las indicaciones anteriores, los EAU deben tratarse como una alternativa al tratamiento quirúrgico. Sin embargo, se debe advertir a los pacientes que, en un pequeño número de casos, las complicaciones posteriores al procedimiento pueden resultar en la necesidad de una intervención quirúrgica 14,32,43. De acuerdo con las directrices del RCOG, el uso de los EAU en una situación en la que el mioma es una causa probable de infertilidad requiere un cuidado especial y una evaluación adecuada de un ginecólogo especializado en el tratamiento de la infertilidad y la reproducción asistida. La infertilidad debida a la presencia de fibromas no es absoluta, y muchas mujeres quedarán embarazadas sin ninguna intervención. Por lo tanto, es razonable excluir otras posibles causas de infertilidad, incluida la evaluación de la pareja masculina 14,32,43.
Así, de acuerdo con las recomendaciones de RCOG y SOGC, las candidatas deben ser mujeres con miomas uterinos sintomáticos en las que se hayan excluido patologías en la pelvis con síntomas clínicos similares a losmiomas 41,43.
Las contraindicaciones absolutas para este procedimiento incluyen infección genital actual o reciente, dudas diagnósticas debidas a factores clínicos o imágenes inadecuadas, miomas asintomáticos, embarazo viable y contraindicaciones para el uso de agentes de contraste radiológicos.
Las contraindicaciones relativas incluyen fibromas submucosos pediculados (FIGO 0) y subserosos (FIGO 7), que teóricamente pueden desprenderse del endometrio debido a la necrosis del pedúnculo, en casos raros que resultan en sepsis. En estos casos, solo se debe considerar la EAU si se planifica la extirpación histeroscópica o laparoscópica del mioma pediculado antes del procedimiento.
A pesar de que la literatura actual sugiere que el tamaño del mioma no es una contraindicación en sí mismo, la experiencia muestra que se requiere extrema precaución al calificar a los pacientes con miomas grandes (especialmente asociados con síntomas de compresión) para EAU, ya que la reducción del volumen puede ser insuficiente para aliviar los síntomas y cumplir con las expectativas del paciente14,32, 43,48.
Hay muchos informes de embarazos exitosos después de los EAU, pero la evidencia existente no apoya completamente su uso como alternativa al tratamiento farmacológico o quirúrgico (miomectomía) en mujeres jóvenes49. Por lo tanto, este procedimiento debe usarse con mucha precaución en las mujeres que declaran su deseo de quedar embarazadas (ya que hay una tasa de embarazo más baja, una tasa más alta de abortos espontáneos, ruptura uterina, placenta adherida y resultados adversos del embarazo después de la EAU que después de la miomectomía)32,50,51,52,53,54,55. Como ginecólogos, no recomendamos los EAU para las mujeres que buscan un embarazo. Para nosotros, es una contraindicación relativa, siempre que existan indicaciones adicionales para los EAU, como el rechazo a la cirugía o a las transfusiones de sangre, donde la falta de tratamiento puede poner en peligro la vida.
De acuerdo con las directrices del RCOG, el deseo de preservar o mejorar la fertilidad en mujeres jóvenes con miomas uterinos sintomáticos es una contraindicación relativa para los EAU32. Por el contrario, las directrices del SOGC recomiendan que, en casos similares, no se proponga la EAU como opción de tratamiento para los miomas, ya que no se ha establecido la seguridad y la eficacia en dichas mujeres14,43. Un punto de vista similar está representado por otras sociedades científicas, como la Sociedad Americana de Medicina Reproductiva (ASRM), el Colegio Americano de Obstetras y Ginecólogos (ACOG), el Colegio Americano de Radiología (ACR), el Real Colegio de Obstetras y Ginecólogos de Australia y Nueva Zelanda (RANZCOG) y otras, citando mejores resultados de fertilidad después de la miomectomía 41,43,56 . La EAU solo ha sido recomendada por el NICE para las mujeres que buscan mantener o mejorar la fertilidad, especialmente con características desfavorables para la miomectomía (fibromas múltiples)57.
En general, los procedimientos de los EAU pueden realizarse en cualquier etapa del ciclo menstrual32. Sin embargo, partiendo de la base de que no existe un método idóneo para excluir el embarazo en la etapa de fecundación o implantación, con el fin de excluir el embarazo precoz, en nuestro centro, se realiza hasta el día 10 del ciclo. En la mayoría de los casos, las pacientes ingresan en la sala de ginecología el día del procedimiento. La admisión de un paciente en la sala de cirugía vascular está permitida si se proporcionan los exámenes adecuados y la consulta ginecológica. Un ginecólogo y un radiólogo intervencionista realizan la calificación para la embolización de fibromas. La calificación ginecológica incluye la historia clínica, el examen, la evaluación ecográfica del órgano reproductor y el tipo de mioma. Además, para descartar cualquier neoplasia maligna dentro del útero, es necesario un frotis cervical (PAP) y una biopsia endometrial. En los casos en los que la ecografía de los ovarios es dudosa, es necesaria la prueba ROMA (Algoritmo de Riesgo de Malignidad Ovárica).
Un tema aparte que requiere discusión es el sarcoma uterino, en particular el leiomiosarcoma (LMS), que representa el 70% de estos tumores uterinos. La prevalencia de LMS en pacientes operados de mioma es baja y se estima en 0,13-0,29%58,59. El aumento de la incidencia de LMS se observa en mujeres mayores de 40 años. El LMS es difícil de diagnosticar antes del tratamiento, ya que puede parecerse a los miomas benignos60. La mayoría de los LMS no están relacionados con fibromas preexistentes, y no hay evidencia de una asociación de LMS con fibromas uterinos61. Tanto los fibromas uterinos como el LMS tienden a crecer rápidamente. Por lo tanto, el tamaño o la tasa de crecimiento no es un factor de riesgo para un tumor uterino maligno60.
En la actualidad, no existen pruebas de laboratorio o de imagen fiables que permitan identificar claramente el leiomiosarcoma y diferenciarlo del leiomioma 60,62. La sensibilidad de la biopsia endometrial en el diagnóstico de leiomiosarcoma es del 86%. Por lo tanto, un resultado negativo de la biopsia no excluye la existencia de un tumor uterino maligno. La resonancia magnética con contraste es actualmente el método diagnóstico óptimo para los tumores uterinos. La sensibilidad de esta prueba en el diagnóstico del SMI es del 94%60.
Como ya se ha mencionado, las pruebas anteriores no excluyen el 100% de los tumores uterinos malignos. Por lo tanto, existe un ligero riesgo de prolongar el diagnóstico de LMS después del tratamiento, sin la posibilidad de verificación histopatológica del tumor uterino. El paciente debe ser informado de esto durante la calificación para los EAU.
La realización de hemograma completo (CBC) y pruebas de coagulación (INR, TTPA), panel renal (creatinina, urea), hormona estimulante de la tiroides (TSH), concentración de hormona anti-Mulleriana (AMH) (recomendada) o de hormona foliculoestimulante (FSH) en fase folicular, proteína C reactiva (PCR), prueba general de orina y frotis vaginal (cultivo vaginal aeróbico) permiten evaluar y prevenir posibles complicaciones post-embolización (infecciones, daño ovárico iatrogénico, intensificación de la insuficiencia renal previa después de contrastes a base de gadolinio, tirotoxicosis en casos de hipertiroidismo después de un contrastante a base de yodo)63,64. Tenga en cuenta que la prueba de FSH no se recomienda antes de los 40 años, ya que la FSH no es un indicador sensible de cambios en la reserva ovárica en mujeres jóvenes50,65.
Un radiólogo intervencionista califica a los pacientes para el procedimiento basándose en la historia clínica y las imágenes por resonancia magnética (IRM). Al recopilar la historia clínica, los beneficios y las posibles complicaciones, así como el procedimiento en sí, deben discutirse con el paciente. También se deben discutir las expectativas del paciente con respecto a los EAU. La resonancia magnética tiene como objetivo excluir otras patologías del órgano reproductor y estructuras adyacentes, así como evaluar la morfología y localización de los miomas y la anatomía para la factibilidad técnica del procedimiento 35,36,37,57.
Los Emiratos Árabes Unidos tienen como objetivo bloquear completamente la vasculatura de todos los miomas mientras se mantiene el suministro de sangre al útero, los ovarios y los tejidos circundantes dentro de la pelvis. Los aspectos técnicos de los Emiratos Árabes Unidos todavía están evolucionando hasta cierto punto.
La embolización de las arterias uterinas es realizada por radiólogos intervencionistas con la competencia adecuada en el campo de la embolización intravascular. El procedimiento se lleva a cabo bajo guía de fluoroscopia. Consiste en la inserción percutánea de un catéter vascular desde la punción en la región inguinal en la arteria femoral, la aorta, la arteria ilíaca interna, hasta la arteria uterina. Después de colocar el catéter profundamente en la arteria uterina y lograr una posición estable, el agente de embolización mezclado con contraste se inyecta bajo control fluoroscópico de tal manera que se evite el reflujo y la embolización "no objetivo". El lecho vascular de los miomas se cierra con partículas de 500 a 900 μm, dependiendo del tipo de material de embolización, los tamaños habituales son de 700 μm. La embolización se continúa hasta que se logra el flujo sanguíneo en estasis. Al final del procedimiento, se retira el catéter y se asegura el sitio de acceso vascular con presión manual y vendaje o cierre mecánico. El procedimiento dura aproximadamente de 0,5 a 1,0 h. La dosis media de radiación ionizante absorbida por el ovario durante la EAU oscila entre 0,04 y 0,22 (Gy: gris) y la dosis efectiva media estimada oscila entre 22 y 34 (mSv: milisievert). El tiempo fluoroscópico medio es de unos 22 min66,67.
La vasculatura de la mayoría de los fibromas proviene de las arterias uterinas. Solo entre el 5% y el 10% de los fibromas son irrigados adicionalmente por las arterias ováricas. Las anastomosis arteriales uterinas se presentan en alrededor del 10 % de los casos, mientras que las útero-ováricas en el 10-30 %. El corte del suministro de sangre a los tejidos embolizados causa necrosis isquémica, seguida de degeneración hialina o necrosis coagulativa. Este proceso tarda varios meses 68,69.
La eficacia de los EAU depende de la resolución de los síntomas o del grado de su reducción. Para el tratamiento del sangrado menstrual excesivo, el dolor pélvico y los síntomas de presión, el índice de eficacia clínica de los EAU es del 81 % al 96 %, del 70 % al 100 % y del 46 % al 100 %, respectivamente. Dentro de los 3 a 6 meses posteriores al procedimiento, la reducción observada en el volumen de los miomas fue del 25% al 60%33,70,71,72. La reducción diáloga media del mioma fue de 2,2 cm57.
La reducción del volumen de los miomas no siempre se correlaciona con la resolución o reducción de los síntomas clínicos. En el seguimiento a largo plazo después de la EAU, más del 70 % de los pacientes informaron una resolución o reducción significativa de los síntomas clínicos dentro de los 5 años posteriores al procedimiento, mientras que entre el 16 % y el 23 % de ellos requirieron una nueva intervención73,74.
Al evaluar el efecto temprano de los EAU, los autores de esta publicación proponen el uso de ultrasonido tridimensional (3D), utilizando Virtual Organ Computer-aided AnaLysis (VOCAL), realizando mediciones de los índices vasculares: índice de vascularización (VI), índice de flujo (FI) e índice de flujo de vascularización (VFI)75.
El dolor post-embolización es un efecto secundario temprano (que dura aproximadamente 24 horas) de la EAU exitosa (que no debe confundirse con una complicación) y debe tratarse activamente. Este síntoma clínico es causado por la liberación de productos de descomposición tisular del mioma isquémico. El tratamiento incluye un adecuado control del dolor, hidratación y posible antibioticoterapia 32,43. La anestesia epidural (EA) mantenida durante 24 h después del procedimiento reduce significativamente el dolor a un nivel completamente aceptable, pero a un mayor costo y mayor riesgo de complicaciones en comparación con la analgesia controlada por el paciente (PCA)76.
Otros enfoques también están disponibles en las revisiones de manejo del dolor posteriores a la embolización. Vale la pena mencionar el uso de mezclas de analgésicos con moléculas de alcohol polivinílico y la anestesia electroacupuntura durante los EAU. Ambos métodos tenían como objetivo limitar el número de procedimientos de EAU realizados en un entorno hospitalario 77,78. No utilizamos estos métodos en nuestros centros de cooperación.
Las complicaciones tempranas de los EAU suelen ser complicaciones locales asociadas con el procedimiento de angiografía. Este grupo de eventos adversos es raro (ocurren en menos del 1% de los casos) y se relaciona principalmente con hematoma inguinal, trombosis arterial, disección arterial y pseudoaneurisma, reacciones alérgicas a agentes de contraste, un espasmo en la arteria uterina causado por la manipulación del catéter en el vaso durante el procedimiento (tratado como un evento temporal después de que pasan unos minutos y se puede continuar con el procedimiento, si el espasmo persiste, se podría administrar verapamilo (2,5-5 mg) o nitrato (100-150 μg) por vía intraarterial) y embolización "no diana" 32,37,38.
También ha habido varios informes de embolización "no diana" de otros órganos pélvicos y su posterior isquemia. Esta complicación puede ocurrir como resultado de una mala ejecución del procedimiento, así como debido a la presencia de anastomosis y variantes anatómicas de la vasculatura pélvica. Un caso especial de embolización no diana es el daño ovárico que resulta de las anastomosis entre los vasos del útero y los ovarios en algunas pacientes79,80.
La consecuencia de la necrosis del mioma es un síndrome posembolización que se presenta dentro de los 30 días posteriores al procedimiento en aproximadamente el 10 % al 15 % de los pacientes. Los síntomas de este síndrome, que pueden ocurrir juntos o individualmente, incluyen náuseas, vómitos, malestar general, fiebre baja, dolor abdominal inferior y niveles elevados de leucocitos. Suele ser un síndrome autolimitado que suele desaparecer en un plazo de 10 a 14 días. Se utilizan analgésicos y antiinflamatorios para tratar esta complicación32. Es importante diferenciar los síntomas de un síndrome post-embolización con complicaciones más graves como la sepsis. Esto es especialmente cierto en los casos en los que los síntomas mencionados duran más de dos semanas 32,37,38.
La infección es potencialmente la complicación más grave después de los EAU, y ocurre en aproximadamente el 0,5% de los casos32,38. En caso de fiebre alta persistente (38,5 °C o más) durante 24 a 48 horas y abdomen duro y doloroso, se debe sospechar una sepsis. En este caso, el tratamiento puede requerir no solo el uso de terapia antibiótica, sino también la necesidad de extirpar el útero. En este último caso, en menos del 1% de los casos, puede suponer una amenaza para la vida del paciente. La sepsis es más frecuente cuando la EAU se realiza en un útero grande (más de 20 cm o cuando el diámetro de un solo mioma es superior a 9 cm, y también en el caso de coexistencia de miomas submucosos grandes)37,38.
Una complicación tardía después de la EAU (más de 30 días después del procedimiento), que ocurre después de la embolización de fibromas submucosos, es la excreción de fragmentos necróticos demarcados de fibromas a través del canal cervical. Ocurre en aproximadamente el 10% de los casos 32,81,82. Aproximadamente el 16% de las mujeres, después de los EAU, pueden tener abundante flujo vaginal durante varias semanas hasta muchos meses como resultado de la excreción de fibromas necróticos delútero 83. Después del procedimiento de los EAU, se observa un acortamiento significativo de la menstruación y una disminución en su abundancia, lo que se considera un efecto beneficioso de este procedimiento. Sin embargo, la amenorrea completa es tratada como el efecto del fracaso ovárico post-embolización50,84.
La amenorrea después de la EAU suele ser transitoria y se limita a unos pocos ciclos. La amenorrea permanente se presenta en aproximadamente el 15% de las mujeres mayores de 40 años y en aproximadamente el 1% de las mujeres menores de esta edad, causando síntomas de menopausia prematura. En nuestra propia investigación, se encontró una disminución de la fertilidad en mujeres jóvenes (33-40 años) como consecuencia de la reducción de la reserva ovárica65. Se estima que alrededor del 85% de las mujeres que informan amenorrea después de los EAU tienen más de 45 años,85 años. Se ha argumentado que la razón del aumento de la incidencia de amenorrea en las mujeres mayores se debe a la reducción de la reserva ovárica y a la mayor sensibilidad del tejido ovárico a la isquemia causada por la embolización "no diana"86.
El procedimiento de los EAU también afecta la función sexual de las mujeres que se someten al procedimiento. El 26% de las mujeres informaron una mejora de la función sexual después de los EAU, se encontró deterioro en el 10% y sin cambios en el 64% restante de las mujeres. Una posible causa de disfunción sexual es la vasculatura anormal del clítoris, el cuello uterino y el cuerpo uterino como resultado del procedimiento de los EAU74.
Protocolo
Los autores declaran que el protocolo sigue las directrices del Comité de Ética local de la Universidad Médica de Lublin.
1. Calificación para el procedimiento de los EAU
NOTA: Está dirigido a ginecólogos y radiólogos intervencionistas.
- Informe al paciente sobre los detalles del procedimiento de los EAU.
- Discutir las indicaciones y contraindicaciones para el procedimiento de los EAU.
- Discutir con la paciente los supuestos de los EAU y los métodos alternativos (descritos en la Introducción) en el tratamiento de los fibromas uterinos.
- ¡ADVERTENCIA! Informar al paciente que la EAU no es un procedimiento radical (el mioma no se extirpará).
- ¡ADVERTENCIA! Informar a la paciente que no recibirá un informe histopatológico de fibromas uterinos después de la EAU.
- ¡ADVERTENCIA! Informe a la paciente que de 1 a 3 casos de cada 1.000 tumores uterinos pueden ser malignos. Discuta con el paciente que la biopsia endometrial y la resonancia magnética realizadas durante la calificación de los EAU son altamente sensibles en el diagnóstico de leiomiosarcoma, pero no al 100%. Informe al paciente que la realización de EAU para el leiomiosarcoma puede retrasar el diagnóstico y el tratamiento adecuado. Anote ese hecho en la historia clínica.
- Si el paciente desea a sabiendas que se le realice una EAU, continúe con este protocolo.
- Informar al paciente que la calificación se lleva a cabo en dos etapas. La calificación por parte de un ginecólogo incluye el análisis de las indicaciones y contraindicaciones, mientras que un radiólogo intervencionista evalúa las capacidades técnicas de los EAU.
- Planificar o realizar una consulta ginecológica y planificar una consulta con el radiólogo intervencionista antes de los EAU.
- Si es posible, realice la mayor cantidad posible de procedimientos de calificación en la clínica ambulatoria.
- Asegúrese de que la paciente tenga indicaciones para los EAU: miomas uterinos sintomáticos (menometrorragia, metrorragia, dismenorrea, dispareunia, dolor pélvico crónico); el rechazo del tratamiento quirúrgico; no dar su consentimiento para la transfusión de sangre; Cirugía de fibromas uterinos previamente fallida. Anótelos en la historia clínica.
- Pregúntele a la paciente acerca de los síntomas de los fibromas.
- Discuta la efectividad de los EAU y las expectativas del paciente (en los Resultados representativos).
- Pregunte si la paciente recibió tratamiento previo para los fibromas uterinos. Asegúrese de qué método se utilizó.
- Si el paciente se niega a recibir tratamiento quirúrgico o transfusión de sangre, tome una declaración por escrito.
- Asegúrese de que el paciente que calificó para el procedimiento de los EAU no tenga contraindicaciones absolutas: fibromas asintomáticos; un embarazo viable; infección genital actual o reciente; dudas diagnósticas debidas a factores clínicos o imágenes inadecuadas; contraindicaciones para el uso de contrastes radiológicos; características del leiomiosarcoma en la resonancia magnética; tumor maligno uterino o de ovario, a menos que se realice para paliación o como complemento de la cirugía87. Anótelos en la historia clínica.
- Si la paciente solicita EAU a pesar de tener fibromas asintomáticos, explique que tales casos no califican para el procedimiento. Explique a la paciente que los miomas asintomáticos solo requieren un seguimiento ginecológico regular.
- Si existen contraindicaciones relativas para los EAU (fibromas grandes y planes reproductivos), discútalas con la paciente y tome nota de ese hecho en el registro médico.
- Concéntrese en las posibles complicaciones relacionadas con la contraindicación relativa, descritas en la introducción, asegúrese de que el paciente comprenda y acepte el procedimiento.
- Discuta las secuelas y complicaciones de la embolización de la arteria uterina con el paciente (ver introducción) y anote ese hecho en la historia clínica.
- Al hablar con el paciente, preste especial atención al dolor posterior a la embolización.
- Hable sobre los tratamientos para el dolor después de la embolización.
- Realizar una titulación ginecológica.
- Recopilar la historia clínica y realizar un examen ginecológico.
- Realizar una evaluación ecográfica de los órganos reproductores para evaluar el tamaño y tipo de miomas (clasificación FIGO)88.
- Use una sonda vaginal para calcular el tamaño y la ubicación del mioma (Figura 2). Los fibromas uterinos tratados con EAU deben ser de 2 a 5 (idealmente, 3 a 4) según la clasificación FIGO, y el diámetro no debe exceder los 10 cm.
- Incluir en la historia clínica el protocolo de la ecografía de pelvis.
- Asegúrese de que el resultado de la ecografía dé indicaciones para la calificación para el procedimiento de los EAU.
- Excluir procesos malignos dentro de la pelvis.
- Asegúrese de que la paciente haya tenido los resultados actuales (preferiblemente realizados dentro de los 6 meses) de la citología cervical (PAP) y la biopsia endometrial.
- Durante una ecografía pélvica, utilice la sonda vaginal para evaluar los ovarios y confirmar que su estructura es correcta. En caso de duda, consulte la ecografía previa o realice la prueba de Roma.
- Solicitar una resonancia magnética para evaluar el tumor uterino en cuanto a las características del LMS y las capacidades técnicas de los EAU.
- Anote los resultados de la citología cervical (PAP), la biopsia endometrial, la ecografía (posiblemente la prueba ROMA) y la resonancia magnética en la historia clínica.
- Si los resultados son incorrectos, descalifique al paciente del procedimiento.
- Informar a las pacientes sobre los resultados de la calificación ginecológica.
- Anote ese hecho en la historia clínica. Remitir al paciente al hospital.
- Haga una cita para el procedimiento de EAU y recuerde que el paciente debe estar antes del día 10 del ciclo.
- Pregúntele a la paciente si se niega a la cirugía. En caso de negativa, anote ese hecho en el consentimiento informado del paciente o en la historia clínica.
- Los pacientes con fibromas sintomáticos que se niegan a la cirugía califican para los EAU.
- Realizar las siguientes pruebas al menos 7 días antes de los EAU para evaluar y evitar posibles complicaciones: prueba microbiológica de frotis vaginal (cultivo vaginal aeróbico); Urinálisis; análisis de sangre seleccionados: hemograma, pruebas de coagulación (INR, APPT), panel renal (creatina, urea), TSH, PCR.
- Describa los resultados en la historia clínica.
- Informe a la paciente que los resultados incorrectos la descalifican para el procedimiento.
- Comprobar la reserva ovárica de la paciente mediante la prueba de los niveles séricos de AMH (recomendado) o FSH (no recomendado antes de los 40 años) en la fase folicular. Hable con la paciente sobre la posibilidad de que la prueba anterior sea útil para evaluar el daño ovárico como resultado de una embolización no objetivo. Anote ese hecho en la historia clínica.
- Las pacientes que califican para los EAU no deben declarar la voluntad de quedar embarazadas debido al mayor riesgo de complicaciones del embarazo 14,32,38,50,51,52,89,90,91.
- Informe a la paciente sobre el mayor riesgo de complicaciones del embarazo después de los EAU.
- Nótese el hecho de que la paciente no declara la voluntad de quedarse embarazada en el consentimiento informado de la paciente ni en la historia clínica.
- Si la paciente aún no descarta un embarazo en el futuro, pero requiere EAU, tome una declaración por escrito de que ha sido informada sobre las posibles complicaciones del embarazo después de EAU.
- Realizar calificación radiológica.
- Asegúrese de que se haya realizado una resonancia magnética pélvica. El examen de resonancia magnética permite excluir otras patologías del órgano reproductor y las estructuras adyacentes (paso 1.6.3.3. del procedimiento de calificación para los EAU), evaluar la morfología y la ubicación de los fibromas, y la anatomía para la viabilidad técnica de la embolización (Figura 3, Figura 4). De lo contrario, programe el examen de resonancia magnética y la consulta con un radiólogo intervencionista.
- Analice los exámenes por imágenes y evalúe el tipo y tamaño de los fibromas.
- Si se encuentran fibromas submucosos (FIGO 0-1), informe a la paciente sobre el riesgo de desprendimiento en la cavidad uterina. La excreción completa puede causar sepsis, mientras que la excreción en fragmentos suele ser asintomática50.
- Si se encuentran fibromas subserosos pediculados de pecíolo estrecho (FIGO 7), informe a la paciente sobre el riesgo de desprendimiento del mioma posterior a la embolización en la cavidad abdominal. Puede conducir a una inflamación aguda y puede ser necesaria una reintervención laparoscópica92.
- Si se encuentran miomas grandes, informar a la paciente que el riesgo de complicaciones permanece inalterado, pero que el resultado del procedimiento es mejor para los miomas pequeños93.
- Anote ese hecho en el consentimiento informado del paciente o en la historia clínica.
2. Preparación para el procedimiento de los EAU
NOTA: Está dirigido a ginecólogos o cirujanos vasculares y radiólogos intervencionistas.
- Ingreso de la paciente en el hospital (servicio de cirugía ginecológica o vascular).
- Asegúrese de que esté antes del 10º día del ciclo en el momento de la admisión.
- Realizar u ordenar un examen ginecológico y una ecografía de la pelvis.
- Asegúrese de que el diagnóstico y la calificación para el procedimiento de los EAU sean correctos.
- Asegúrese de que no hayan aparecido nuevas contraindicaciones desde la calificación para los EAU. Si es así, sugiera otras opciones de tratamiento y cambie la fecha del procedimiento.
- Realizar la ecografía transvaginal 3D (TVUS) y calcular el volumen y los índices de vascularización del mioma (VI, FI y VFI) utilizando el examen del software VOCAL (que se utiliza para evaluar la eficacia del procedimiento de los EAU 72,75) (descrito en la introducción) (Figura 5 y Figura 6).
- Anote ese hecho en la historia clínica.
- Asegúrese de que el paciente calificado para los EAU se haya realizado pruebas durante la calificación para los EAU (descrita en los pasos 1.6.2, 1.6.3, 1.6.5 y 1.6.6 de Calificación para los EAU).
- Si la paciente ha sido precalificada por un ginecólogo y no tiene análisis de sangre, una prueba de orina y una resonancia magnética, solicite las pruebas y programe una consulta con un radiólogo intervencionista (paso 1.7 de Calificación para EAU).
- Evaluar u ordenar el nivel sérico de AMH (recomendado) o FSH (no recomendado para menores de 40 años) antes de los EAU para permitir la evaluación del daño ovárico como resultado de la embolización "no objetivo".
- Informe al paciente que los resultados de la prueba estarán disponibles en aproximadamente un día y que el procedimiento de los EAU solo será posible después de recibir estos resultados.
- Informe a la paciente que los resultados incorrectos la descalifican para el procedimiento.
- ¡ADVERTENCIA! En el caso de resultados faltantes o incorrectos de la citología Papanicolaou, biopsia endometrial; la prueba microbiológica de frotis vaginal, descalifican a la paciente de los EAU (demasiado tiempo para obtener estos resultados). Vuelva a calificar después de obtener los resultados correctos.
- Anote ese hecho en la historia clínica.
- Obtener un consentimiento informado para realizar EAU.
- Proporcionar al paciente toda la información sobre los EAU.
- Discuta las posibles complicaciones de los EAU (descritas en la introducción).
- Deje que el paciente tenga tiempo para pensar y hacer preguntas; permitir que el paciente dé su consentimiento informado para realizar el procedimiento de los EAU.
- Informar a la paciente que tiene derecho a cambiar su decisión hasta que comiencen los EAU.
- Si la paciente cambia su decisión con respecto a los EAU, sugiera otras opciones de tratamiento para los fibromas uterinos (descritos en la introducción).
- Anote ese hecho en el consentimiento informado del paciente o en la historia clínica.
- Inmediatamente antes del procedimiento de los EAU, verifique y asegúrese de que se hayan realizado las pruebas descritas en las secciones 1.6.2, 1.6.3, 1.6.5 y 1.6.6 de la Calificación para los EAU, así como las ETV 3D, la RM y la consulta con un radiólogo intervencionista, y que los resultados sean correctos.
- Descalificar a un paciente de los Emiratos Árabes Unidos si faltan las pruebas o los resultados son incorrectos.
- Anote ese hecho en la historia clínica.
- Informar al paciente y cuidar la prohibición de ingerir alimentos y líquidos desde la mañana hasta el procedimiento. La excepción es una pequeña cantidad de líquido necesaria para tomar la dosis matutina del medicamento.
- Asegúrese por la mañana (antes de los EAU) de que el paciente esté en ayunas.
- Asegúrese de que el paciente tomó los medicamentos para sus propias enfermedades crónicas.
- Anote ese hecho en la historia clínica.
- Ordene al paciente los siguientes medicamentos: 1 comprimido de ansiolítico (por ejemplo, Estazolam) por vía oral, 1 dosis de antibióticos intravenosos, 1 glóbulo de metronidazol por vía intravaginal, supositorio rectal de diclofenaco 100 mg.
- Administre los medicamentos anteriores unos 30-40 minutos antes de los EAU.
- Anote ese hecho en la historia clínica.
- Prepare el campo operatorio asegurándose de que la axila izquierda y la ingle derecha estén afeitadas.
- Si las áreas anteriores de la piel no están afeitadas, aféitelas suavemente.
- Anote ese hecho en la historia clínica.
- Asegúrese de que la paciente no tenga un dispositivo intrauterino (DIU).
- Si la paciente tiene un DIU en el útero, infórmele del mayor riesgo de infección en la cavidad uterina y ofrézcase a extraerlo antes de los EAU.
- Si la paciente no está de acuerdo en retirar el DIU, anote ese hecho en el consentimiento informado de la paciente o en la historia clínica.
- Asegúrese de que el paciente informe cualquier reacción alérgica a los medicamentos, agentes de contraste y desinfectantes, y anote ese hecho y los resultados en la historia clínica.
3. Realización del procedimiento de los EAU
NOTA: Está dirigido a radiólogos intervencionistas y anestesiólogos.
- Realizar el procedimiento en condiciones estériles.
- Coloque al paciente en la mesa de operaciones y desinfecte ampliamente la región inguinal derecha con un desinfectante hospitalario (con la aprobación adecuada).
- Pegue el paño quirúrgico alrededor del sitio quirúrgico (ingle derecha).
- Seleccione el tipo de anestesia: anestesia local o epidural (EA) y anote la elección del paciente en la historia clínica.
- Emiratos Árabes Unidos bajo anestesia local.
- Anestesiar (administración subcutánea) una solución de lignocaína al 2% en el sitio de la cirugía.
- Administre 5 mg de morfina por vía intravenosa según sea necesario.
- Antes de comenzar el procedimiento de los EAU, asegúrese de que la anestesia local esté funcionando.
- Emiratos Árabes Unidos bajo EA
- Prepare al paciente adecuadamente para la EA.
- Realice el EA antes de pegar el paño quirúrgico.
- Asegurar que el paciente calificado para el procedimiento de EA no tenga las siguientes contraindicaciones EA: rechazo del procedimiento, coagulopatía, trombocitopenia, enfermedad hemolítica, toma de anticoagulantes, shock, infección en el sitio de la inyección epidural, bacteriemia, alergia a los anestésicos locales, deformidades anatómicas de la columna, aumento de la presión intracraneal, enfermedad neurológica, estenosis aórtica o mitral severa94. Anote ese hecho en la historia clínica.
- Llame a un anestesiólogo y pregunte por EA.
- Colocar un catéter delgado en el espacio epidural en la región lumbar y administrar un anestésico (procedimiento dirigido a los anestesiólogos).
- Antes de iniciar el procedimiento de los EAU, asegúrese de que el EA esté operativo.
- El procedimiento de los Emiratos Árabes Unidos
- Realice el procedimiento de los EAU en Angio Suit bajo la guía de fluoroscopia.
- Obtener acceso al sistema vascular mediante la técnica de Seldinger95,96 (Figura 7, Figura 8 y Figura 9).
- Inserte un catéter de cola flexible en la aorta abdominal justo debajo de las arterias renales.
- Realizar una angiografía para visualizar los vasos.
- Realizar aortonefrografía para evaluar la anatomía de los vasos que irrigan los miomas y planificar el procedimiento (Figura 10).
- Realizar angiografía de la arteria ilíaca interna en proyección antero-posterior y oblicua para revelar el ostium de la arteria uterina.
- Comience por el lado izquierdo, luego por el derecho, debido al sitio de una punción y la forma específica del catéter. Dependiendo del calibre del vaso, el catéter principal o microcatéter se introduce selectivamente en la arteria uterina (Figura 11).
- Coloque el catéter profundamente en la arteria uterina. Embolizar el recipiente con partículas de hidrogel. Debido a la presencia de anastomosis uterino-ovárico, cuyo tamaño se estima en aproximadamente 500 μm, el tamaño sugerido de las partículas para la embolización es de 700 μm para reducir el riesgo de "embolización no objetivo".
- Continúe la embolización hasta que el flujo sanguíneo en el vaso esté completamente bloqueado. El punto final del tratamiento es la estasis de contraste en el vaso, lo que demuestra su cierre efectivo.
- Realizar la embolización de la arteria uterina del lado opuesto con el mismo acceso. El tratamiento dura aproximadamente de 0,5 a 1,0 h66,67 (Figura 12).
- Evaluar la efectividad de la embolización de un catéter colocado en la arteria ilíaca interna durante la angiografía de control. La ausencia de una afluencia activa de sangre de sombreado (a las arterias uterinas) indica que el procedimiento se considera técnicamente correcto (Figura 13).
- Retire con cuidado el catéter.
- Cierre el sitio de punción mediante compresión manual con vendaje de presión, que debe mantenerse durante las próximas 6 h o dispositivo de cierre (Figura 14).
- Describa el curso de los EAU en la historia clínica.
4. Atención al paciente después del procedimiento en los EAU
NOTA: Está dirigido a ginecólogos o cirujanos vasculares y anestesiólogos.
- Iniciar tratamiento analgésico: bomba de analgesia controlada por el paciente (PCA) o EA.
- Informar y discutir las opciones de tratamiento analgésico con el paciente.
- Informar al paciente de que la EA proporciona un mejor control del dolor y una rehabilitación más rápida, en comparación con la bomba PCA76.
- Anote ese hecho y la elección del paciente en la historia clínica.
- Tratamiento analgésico del dolor post-embolización mediante una bomba PCA.
- Prepare la jeringa para la bomba de PCA con la solución de morfina.
- Llene la jeringa de 50 ml para la bomba de PCA con 50 mg de morfina y una solución de NaCl al 0,9% (concentración de 1 mg/mL).
- Prepare la bomba PCA para su uso intravenoso.
- Une el drenaje a la jeringa.
- Inserte la venopunción con una cánula.
- Inserte la jeringa en la bomba PCA.
- Llene el desagüe, ponga en marcha la bomba PCA.
- Encienda el botón START.
- Bloquee la bomba PCA.
- Ajuste los parámetros de la bomba PCA (enumerados a continuación) (Figura 15).
¡ADVERTENCIA! Dosis más altas de morfina pueden causar depresión respiratoria.- Utilice una concentración de morfina de 1 mg/mL. Utilice una dosis de perfusión de morfina a demanda (bolo intravenoso) (bolo p.) de 0,5 mg con un intervalo de tiempo después del cual se puede proporcionar la siguiente perfusión a demanda (intervalo de bloqueo/[Karencja]) de 5 min (para evitar la depresión respiratoria). Utilice un tiempo de inyección de morfina intravenosa durante la infusión a demanda de 10 s.
- Asegúrese de que se realicen todos los pasos anteriores.
- Pida morfina en la bomba PCA durante un máximo de 24 horas.
- Monitorizar el dolor según la Escala de Valoración Numérica (NRS). Anote el valor NRS en la historia clínica.
- Use la Tarjeta de Evaluación del Dolor (PAC, por sus siglas en inglés).
- Informe a la paciente que cuando se presenten los síntomas de dolor, debe presionar ella misma el "joy-stick", obteniendo así el medicamento a demanda.
- Asegúrese de que el paciente entienda las instrucciones.
- Obsérvese la cantidad de "bolo intravenoso" a demanda a "bolo vacío" (lanzado durante el intervalo de bloqueo - sección 4.2.3 de la Atención al paciente después del PROTOCOLO de los EAU) (Figura 16).
- Si la relación entre el "bolo vacío" y el "bolo intravenoso" a demanda alcanza un valor superior a 2/1 (67% / 33%), utilice el siguiente procedimiento (Figura 17, Figura 18).
- Para mejorar la eficacia de la terapia de alivio del dolor con una bomba de PCA y reducir el riesgo de efectos secundarios de la morfina, considere el uso de paracetamol o medicamentos antiinflamatorios no esteroideos en inyecciones intravenosas y dosis estándar.
- Ocúpate de las situaciones en las que el paciente necesita levantarse de la cama.
- No apague la bomba.
- Desconecte el desagüe y asegúrelo con un tapón.
- Cuando el paciente regrese, vuelva a conectar el drenaje.
- Prepare la jeringa para la bomba de PCA con la solución de morfina.
- Tratamiento analgésico del dolor post-embolización mediante EA.
- Continúe con EA si se utilizó para el procedimiento de los EAU.
- Si se utilizó anestesia local para el procedimiento de los EAU y el paciente solicita EA, antes de la colocación del catéter epidural, asegúrese de que las pruebas de hemograma completo y de coagulación sean correctas.
- Asegúrese de que el paciente calificado para el procedimiento de EA no tenga las contradicciones descritas en la sección 3.4.3 de Realización del procedimiento de EAU. Anote ese hecho en la historia clínica.
- Llame a un anestesiólogo y pregunte por EA.
- Asegúrese de que el EA esté operativo.
- Determine el modo de trabajo del EA (bolo o continuo) con el anestesiólogo. Anote ese hecho en la historia clínica.
- En modo continuo (CEA), consulte con un anestesiólogo y verifique la configuración de la bomba de infusión.
- En el modo de bolo (BEA), discuta con el anestesiólogo los intervalos de tiempo entre la administración del agente anestésico local.
- Mantenga el catéter durante 24-48 h, dependiendo de las necesidades.
- Controle el dolor con la escala NRS. Anote el valor NRS en la historia clínica.
- Utilice el PAC.
- Continúe con CEA/BEA hasta que sea necesario, no más de 48 h.
- Continuar el tratamiento analgésico después de la PCA o EA si es necesario.
- Ordene Paracetamol 3 x 1,0 g por vía intravenosa.
- Pida 2 supositorio rectal de diclofenaco de 50 mg.
- Si el tratamiento analgésico anterior no es suficiente, incluya analgésicos de apoyo.
- Ordene Ketoprofeno 2 x 100 mg por vía intravenosa.
- Trate los síntomas del tracto urinario ordenando Furazidina 3 x 100 mg por vía oral.
5. Visita de control después del procedimiento de los EAU
NOTA: Está dirigido a ginecólogos.
- Realice el primer examen de control el primer día después de los EAU.
- Evaluar el estado general del paciente.
- Mida la temperatura corporal del paciente.
- Calificar el dolor después de los EAU según la escala NRS. Utilice el PAC.
- Evaluar la herida donde se insertó el catéter vascular.
- Realizar pruebas de hemograma completo y de coagulación.
- Realizar una ETV para evaluar el estado de los órganos pélvicos después de la EAU.
- Realizar una ETV 3D utilizando una sonda de volumen para evaluar el volumen y los índices de vascularización del mioma (VI, FI y VFI).
- Si no hay complicaciones, y el dolor post-embolización se ha controlado con analgésicos orales, dar de alta al paciente a casa.
- Informe a la paciente que si se presenta fiebre, dolor abdominal y secreción vaginal purulenta después de la hospitalización, la paciente debe buscar atención médica de inmediato.
- Realizar la siguiente visita de control 3 meses después de los EAU.
- Realice un examen ginecológico, una prueba de hemograma completo y el nivel sérico de AMH o FSH.
- Realizar una resonancia magnética o una ETV para evaluar el estado de los órganos pélvicos después de la EAU (Figura 19).
- Realizar ETV 3D con sonda de volumen para evaluar el volumen y los índices de vascularización del mioma (VI, FI y VFI).
- Realizar la última visita de control 6 meses después de los EAU.
- Realice un examen ginecológico, una prueba de hemograma completo y el nivel sérico de AMH o FSH.
- Realizar una ETV para evaluar el estado de los órganos pélvicos después de la EAU.
- Realizar ETV 3D con sonda de volumen para evaluar el volumen y los índices de vascularización del mioma (VI, FI y VFI).
- Evaluar la efectividad de los EAU.
- Compare los resultados de la prueba de CBC antes y después de los EAU.
- Comparar los volúmenes y los índices de vascularización del mioma (VI, FI y VFI) antes y después de la EAU.
- Comparar los niveles séricos de AMH o FSH antes y después de la EAU para evaluar la posibilidad de daño iatrogénico a los ovarios durante la EAU como resultado de la embolización "no objetivo".
- Informar a la paciente que después de la embolización de la arteria uterina, debe someterse a revisiones ginecológicas periódicas.
- En casos seleccionados (sin disminución de los síntomas del mioma, sospecha de demarcación de tejido o duda en otros exámenes adicionales), realice una resonancia magnética un año después de la EAU (Figura 20).
Resultados
Se realizaron 557 procedimientos de los EAU en el período de 2009 a 2019. La mediana de edad de los pacientes fue de 38 años (31-53 años). Se logró el éxito técnico en 547 pacientes (98,2%).
La reducción media del volumen de los miomas (evaluación del volumen de la resonancia magnética) a los 3 meses después del procedimiento de EAU realizado en el período de 2009 a 2013 en el grupo de 206 pacientes de 32 a 52 años (edad media: 39 años) fue del 62%. La reducción más pequeña fue del 9% (paciente con mioma hialinizado). Se logró una reducción completa (100%) en pacientes con mioma submucoso separado (FIGO 0). El 90% de los pacientes informaron satisfacción después del procedimiento de los EAU64.
La reducción media del volumen de los miomas 3 meses después de la EAU (evaluación del volumen VOCAL por ultrasonido) en un grupo de 65 pacientes de 29 a 52 años (edad media: 43,1 años) fue del 50,1% (2,7%-93,5%). Antes del procedimiento de EAU, el volumen medio de los fibromas era de 101cm3 (rango de 23,6 a 610,0cm3), mientras que, después de 3 meses, se observó la reducción del volumen medio de los fibromas a 50,4cm3 (rango de 6,9 a 193,9cm3). La prueba de correlación de Spearman mostró una correlación positiva estadísticamente significativa, pero relativamente débil (R = 0,33; p = 0,006) entre el volumen inicial de fibromas dominantes y la reducción porcentual del volumen. Curiosamente, los fibromas más pequeños mostraron una gran variabilidad en la reducción del volumen de los fibromas a los 3 meses después de los EAU, mientras que los fibromas más grandes mostraron una reacción estable y predecible a los EAU72.
Se observó una reducción de los índices vasculares Doppler (VI, FI y VFI) en el grupo de 17 pacientes a los 3 meses de la EAU. El porcentaje de reducción en VI y VFI fue de 95,4%, mientras que en FI la reducción fue de 58,3%75.
La evaluación de la reserva ovárica se realizó en 30 pacientes de 33 a 40 años (edad media: 35 años) 3 meses después de la EAU. El volumen medio de miomas dominantes fue de 107,75cm3 (rango de 87,4 a 131,1cm3). Se investigaron los siguientes marcadores de reserva ovárica: recuento de folículos antrales (AFC), AMH, inhibina B (INHB), FSH y estradiol (E2). Se observó una disminución significativa de AFC (56,7%; p < 0,001), AHM (36,7%; p < 0,001), INHB (46,7%; p < 0,001) y E2 (43,3%; p < 0,001). Simultáneamente, se observó un aumento significativo en el nivel sérico de FSH (43,4%; p < 0,001)65.
Tres meses después del procedimiento de los EAU, en dos pacientes con miomas submucosos (FIGO 0) (con diámetros de 6 cm y 8 cm) se observó una inversión uterina durante la excreción de fragmentos necróticos demarcados de fibromas a través del canal cervical, lo que resultó en una histerectomía de emergencia.
La reducción del dolor post-embolización (según PAC) con el uso de PCA (procedimiento 4.2 del Patient care after the UAE Protocol) se evaluó en 60 pacientes en la escala NRS al día siguiente del procedimiento de EAU. La mediana de NRS inmediatamente después de la EAU fue de 10 (rango 5-10), mientras que después del tratamiento la mediana de NRS se calificó como 4 (rango 1-5). La prueba de correlación de Spearman entre el volumen inicial de fibromas (mediana 194,5cm3, rango 79-411cm3) y NRS inmediatamente después de la EAU mostró una correlación positiva fuerte y estadísticamente significativa (R = 0,6; p < 0,001), mientras que la correlación entre el volumen inicial de fibromas y NRS después del tratamiento mostró una correlación positiva débil y estadísticamente significativa (R = 0,34; p < 0,001). Al analizar las relaciones anteriores, se puede concluir que los fibromas mayores después de los EAU causan un dolor posterior a la embolización más fuerte después de los EAU. Sin embargo, el tratamiento del dolor posterior a la embolización después de la EAU de fibromas más pequeños con el uso de PCA da mejores resultados.
En la Tabla 1 se proporcionan datos resumidos para los resultados representativos.
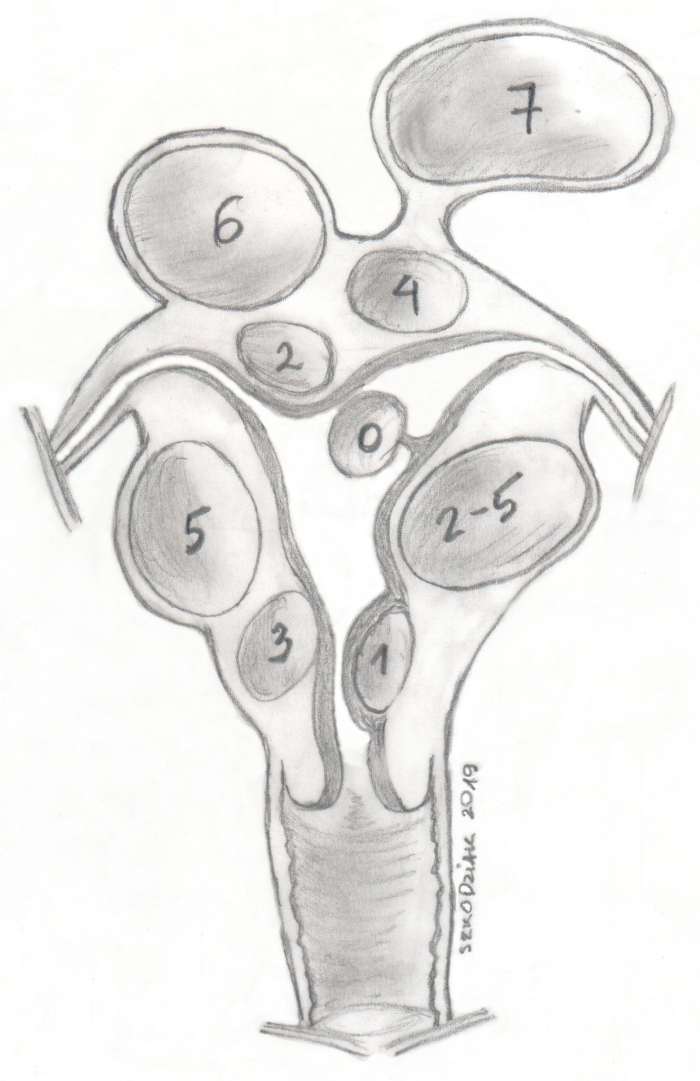
Figura 1: Clasificación FIGO de los miomas uterinos. Haga clic aquí para ver una versión más grande de esta figura.
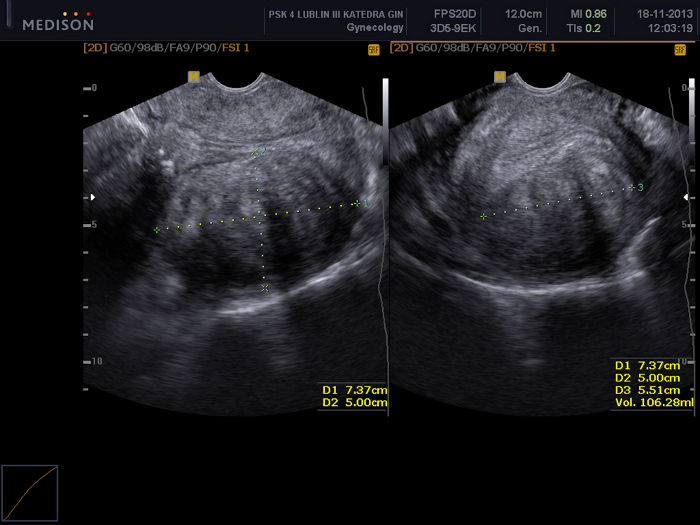
Figura 2: Exploración pélvica mediante ecografía transvaginal.
Visible un mioma uterino (FIGO 5) con unas dimensiones de 73 x 50 x 55 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Examen de resonancia magnética pélvica en precalificación para los EAU.
Visible en la sección sagital un gran mioma uterino (FIGO 2-5) con efecto masa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Examen de resonancia magnética pélvica en la precalificación para los EAU.
Visible en la sección sagital un mioma uterino (FIGO 2-5). Haga clic aquí para ver una versión más grande de esta figura.
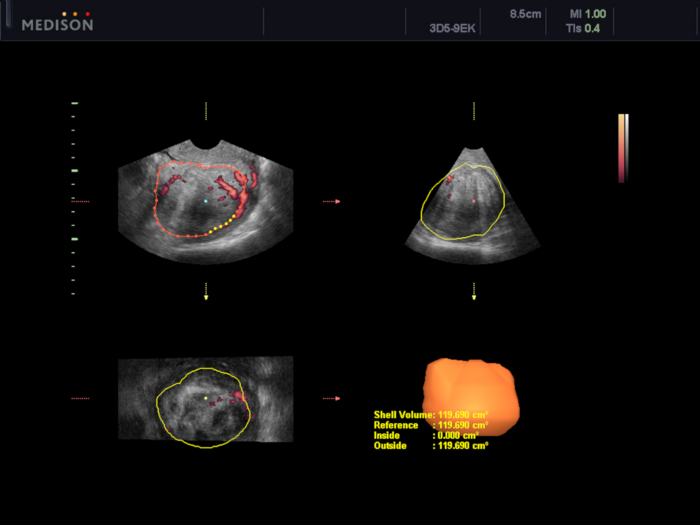
Figura 5: Evaluación del volumen del mioma uterino mediante el software VOCAL.
En este caso, el volumen se estima en 119,7cm3. Haga clic aquí para ver una versión más grande de esta figura.
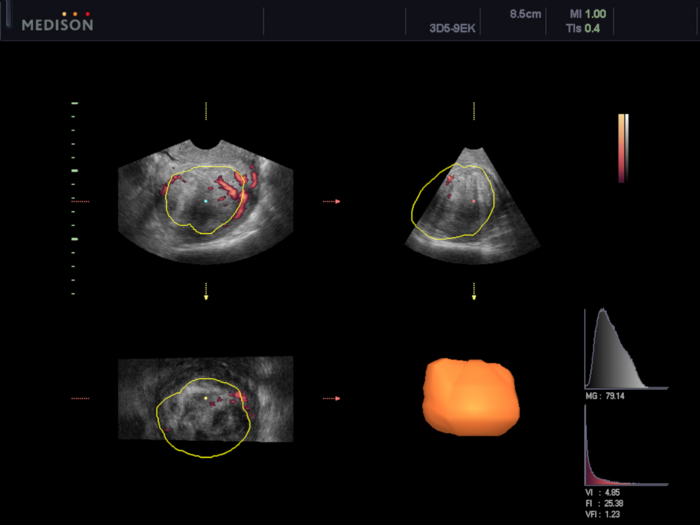
Figura 6: Valoración de la vascularización de los miomas uterinos mediante el software VOCAL.
En este caso, se calcularon los índices de vascularización (VI 4,85, FI 25,38 y VFI 1,23). Haga clic aquí para ver una versión más grande de esta figura.
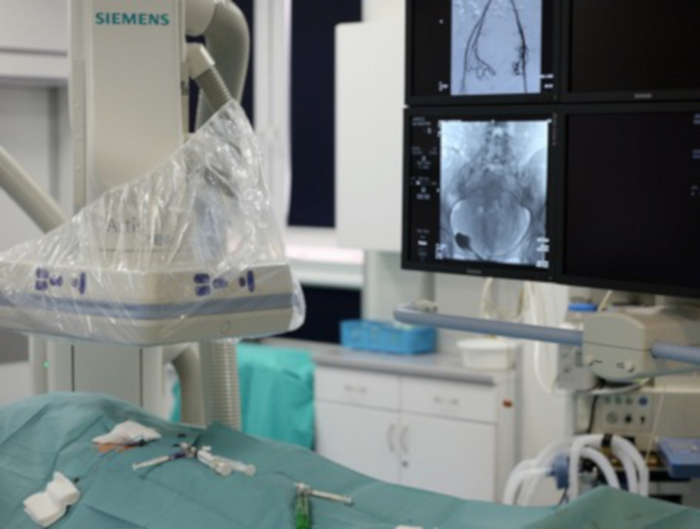
Figura 7: La imagen muestra un fragmento del laboratorio angiográfico.
En la esquina inferior izquierda, el paciente con una ingle expuesta a través de la cual se introducen más herramientas. En la esquina superior izquierda, se puede ver el arco en C del angiógrafo. En la esquina superior derecha, los monitores son visibles, donde el operador rastrea la herramienta de entrada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Un conjunto para punciones arteriales.
Desde la parte inferior: una aguja, una cerradura vascular con un introductor y una guía. Haga clic aquí para ver una versión más grande de esta figura.
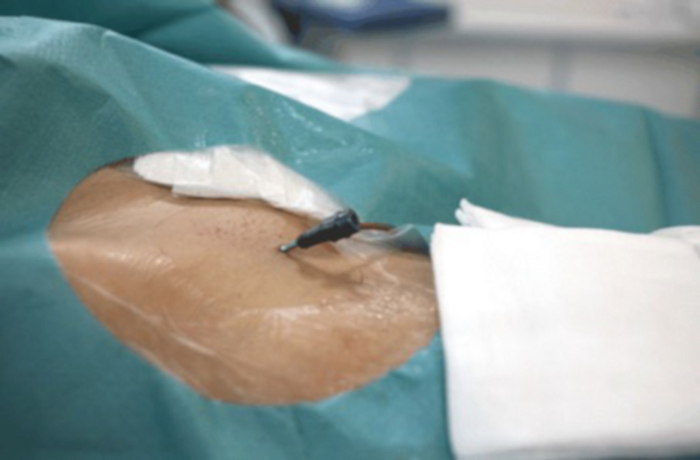
Figura 9: Primer plano de la ingle con bloqueo vascular visible insertado en la arteria femoral. Haga clic aquí para ver una versión más grande de esta figura.
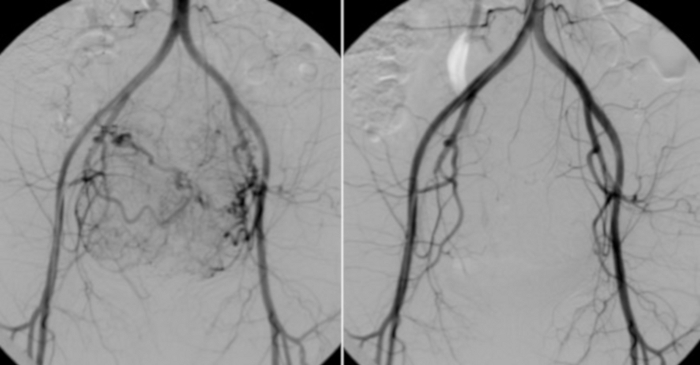
Figura 10: A la izquierda, angiografía de un catéter colocado en la aorta abdominal.
El porte vascular visible de los miomas uterinos. A modo de comparación (a la derecha), una prueba de control realizada después de los EAU. Haga clic aquí para ver una versión más grande de esta figura.
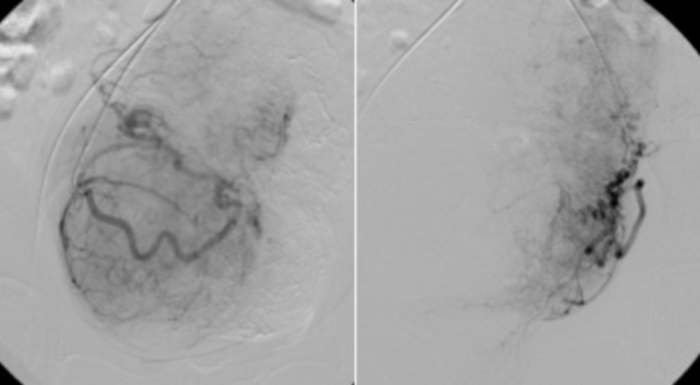
Figura 11: Angiografía selectiva con catéter RUC colocado en las partes proximales de las arterias uterinas.
Lecho vascular visible de los miomas uterinos. Haga clic aquí para ver una versión más grande de esta figura.
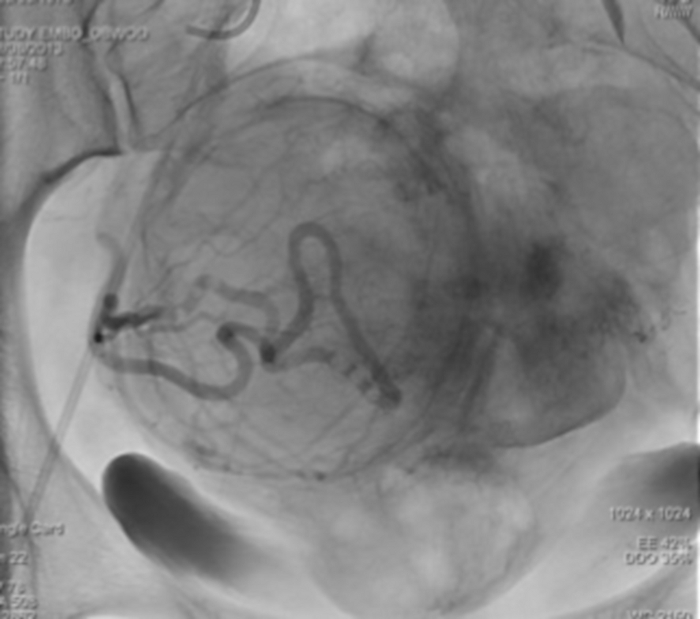
Figura 12: Imagen radiográfica única que muestra la estasis del agente de contraste en la arteria uterina derecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 13: La angiografía de control realizada desde el catéter principal situado, respectivamente, en la arteria ilíaca izquierda y derecha, confirma la falta de entrada de sangre fresca (sombreado) en las arterias uterinas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 14: El sitio de acceso vascular después de la finalización de la EAU.
Incisión visible de 2 mm cerca de la ingle derecha. Haga clic aquí para ver una versión más grande de esta figura.

Figura 15: Ajustes de los parámetros de la bomba PCA para el dolor posterior a la embolización después del tratamiento con EAU (sección 4.2.3 de la sección Atención al paciente después del PROTOCOLO de EAU). Haga clic aquí para ver una versión más grande de esta figura.

Figura 16: Bomba PCA en funcionamiento.
La relación entre el bolo intravenoso a demanda y el "bolo vacío" (sección 4.2.6.2. de la Atención al paciente después del PROTOCOLO de los EAU) 1:1 (50%:50%). Haga clic aquí para ver una versión más grande de esta figura.

Figura 17: Bomba PCA en funcionamiento.
La relación entre el bolo intravenoso a demanda y el "bolo vacío" (sección 4.2.6.3. de la Atención al paciente después del PROTOCOLO de los EAU) 1:2 (33%:67%). Esto requiere tratamiento analgésico adicional (procedimiento 4.2.6.4. de la Atención al paciente después del PROTOCOLO de los EAU). Haga clic aquí para ver una versión más grande de esta figura.

Figura 18: Bomba PCA en funcionamiento.
La relación entre el bolo intravenoso a demanda y el "bolo vacío" (sección 4.2.6.3. de la Atención al paciente después del PROTOCOLO DE LOS EAU) 1:3 (25%:75%). Esto requiere un tratamiento analgésico adicional continuo (procedimiento 4.2.6.4. de la Atención al paciente después del PROTOCOLO DE LOS EAU). Haga clic aquí para ver una versión más grande de esta figura.
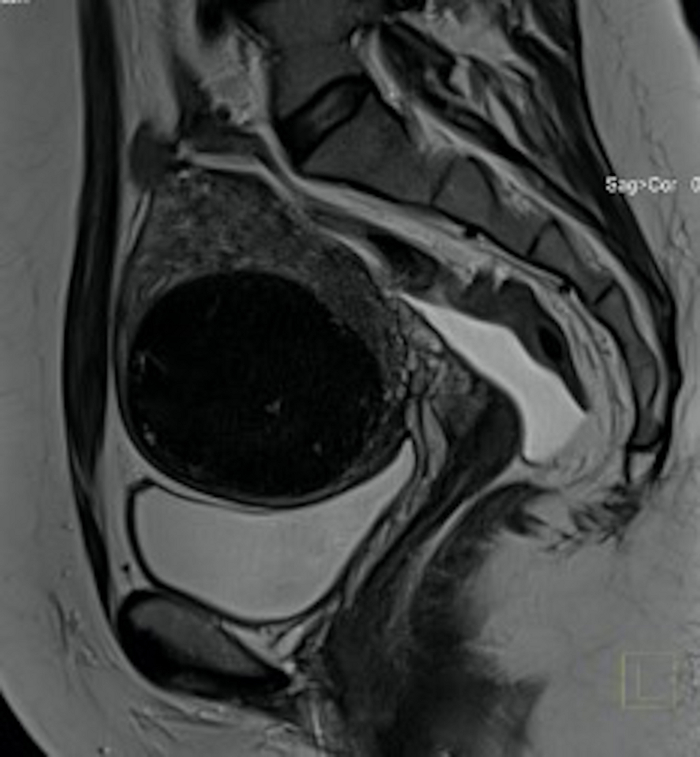
Figura 19: Resonancia magnética pélvica 3 meses después del procedimiento de los EAU (el mismo caso que en la Figura 3).
En la sección sagital se puede ver un mioma uterino (FIGO 5), significativamente más pequeño que antes del procedimiento, diferente densidad del tejido fibroide. Haga clic aquí para ver una versión más grande de esta figura.
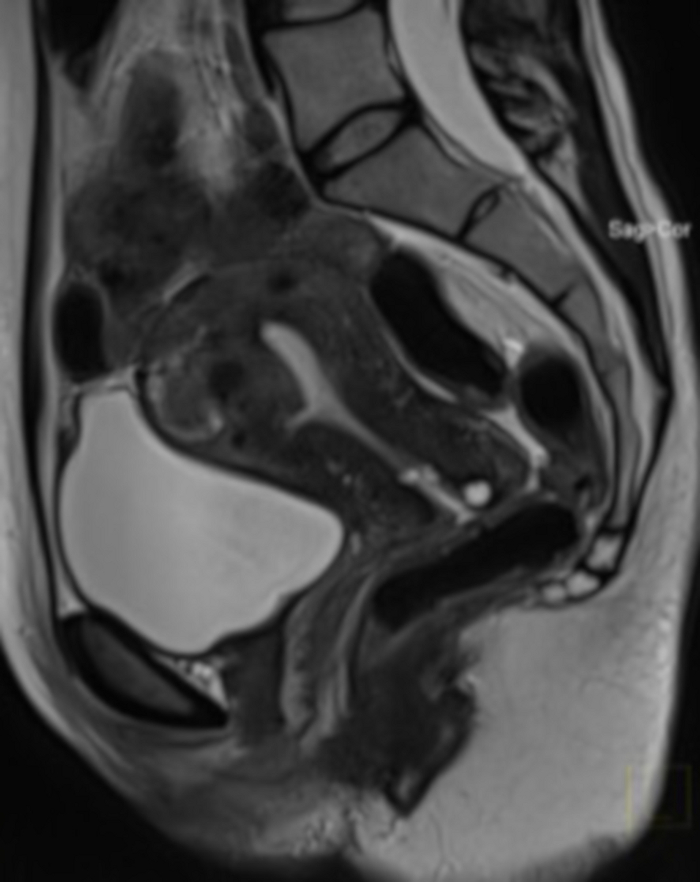
Figura 20: Resonancia magnética pélvica 1 año después del procedimiento de los EAU (el mismo caso que en la Figura 4).
En la sección sagital se puede ver un mioma uterino (FIGO 2-5), con una reducción de volumen muy grande después de la EAU. Se realizó una resonancia magnética debido a la sospecha de demarcación de tejido después del procedimiento (no hubo posibilidad de evaluar la estructura del mioma en un examen bimanual). Haga clic aquí para ver una versión más grande de esta figura.
| RESULTADOS REPRESENTATIVOS / EL PROTOCOLO DE LUBLIN 64,65,72 | ||
| El número de procedimientos realizados en los EAU en el período de 2009 a 2019 | 557 | |
| Éxito técnico | Se logró en 547 pacientes (98,2%) | |
| La reducción media del volumen de los fibromas (evaluación del volumen de la resonancia magnética) 3 meses después de la EAU en el grupo de 206 pacientes de 32 a 52 años (edad media: 39 años) | 62.0% (9.0-100.0%) | |
| La reducción media del volumen de los miomas (evaluación del volumen VOCAL por ultrasonido) 3 meses después de la EAU en el grupo de 65 pacientes de 29 a 52 años (edad media: 43,1 años) | 50.1% (2.7-93.5%) | |
| Valoración de la reserva ovárica | Disminución de la AFC | 56,7% (p<0,001) |
| Disminución de la AMH | 36,7% (p<0,001) | |
| Disminución del INHB | 46,7% (p<0,001) | |
| Disminución de E2 | 43,3% (p<0,001) | |
| Aumento de la FSH | 43,4% (p<0,001) | |
| Reducción del dolor post-embolización (según PAC) con el uso de PCA (procedimiento 2. del PROTOCOLO "Patient care after the UAE") evaluado en el grupo de 60 pacientes | La mediana de NRS inmediatamente después de los EAU | 10 (rango 5-10) |
| La mediana de los NRS el día después de los Emiratos Árabes Unidos | 4 (rango 1-5) | |
Tabla 1: Resultados representativos de la técnica de los EAU en el tratamiento de los miomas uterinos sintomáticos realizado de acuerdo con el Protocolo Lublin.
Discusión
Debido a las diferencias en la estructura, el tamaño, la localización y los síntomas de los fibromas uterinos, la creación de un protocolo uniforme de los EAU no ha sido una tarea fácil. Ha habido muchas discrepancias en cuanto a los supuestos de este método terapéutico con las expectativas de los pacientes, tanto en la etapa de calificación como en los efectos del tratamiento. Más de una vez, las pacientes remitidas a los EAU no informaron ningún signo clínico de fibromas y no sabían que estos tumores uterinos no se extirparían radicalmente. La única expectativa explícita era deshacerse de los fibromas sin cirugía.
Por lo tanto, es importante que la paciente comprenda los supuestos de este método, lo acepte y conozca las diferencias con respecto a los métodos alternativos de tratamiento de fibromas uterinos. Su elección consciente (sección 1.1. del Protocolo de Calificación para los EAU) es un punto crítico, y su implementación adecuada permitirá que el protocolo continúe.
Durante la implementación del protocolo, se repiten algunos procedimientos. Esto es lo que se pretende y es el resultado de la fórmula adoptada por esta revista, en la que los comandos individuales se escriben en modo imperativo y se dirigen a una persona. Sin embargo, varios médicos a menudo participan en la calificación, la preparación y otras etapas de los EAU. Estos también son puntos críticos del protocolo; su omisión puede dar lugar a EAU en condiciones no óptimas o con la presencia de contraindicaciones. De ahí la división del protocolo en 5 capítulos. Esto permite que varios especialistas lo continúen, y los puntos de protocolo repetidos se comprueban de forma independiente.
Una dificultad adicional para crear un protocolo uniforme de embolización de la arteria uterina en el tratamiento de los miomas uterinos es el gran número actual de recomendaciones (hasta 11) que se relacionan con el mismo procedimiento41. Aunque sus suposiciones son similares, como siempre, "el diablo está en los detalles", detalles que requerían unificación. Las contraindicaciones relativas con respecto a la ubicación de los fibromas o los planes reproductivos de los pacientes sometidos a EAU son las más controvertidas durante las calificaciones. Aplicando criterios más estrictos propuestos por SOGC, los pacientes deben ser excluidos de este procedimiento, mientras que las recomendaciones más liberales del RCOG permiten la calificación para EAU 14,32,43. La pregunta es qué hacer. Durante la creación del protocolo, basamos la decisión (aparte de la extensa literatura) en el análisis de nuestros casos y la experiencia adquirida, lo que requiere un abordaje individual de cada paciente. Por lo tanto, el protocolo no excluye la realización de EAU en pacientes con contraindicaciones relativas (secciones 1.4 de la calificación para el Protocolo de EAU). La cualificación y la preparación adecuadas para los EAU parecen ser la clave del éxito terapéutico. La técnica en sí también es muy importante, así como la atención de los EAU, que garantiza no solo el éxito terapéutico o la satisfacción del paciente, sino también la ausencia de complicaciones descritas anteriormente.
Independientemente del número de fibromas, todas las lesiones se embolizan durante un procedimiento. Por lo general, cuanto más fibromas haya, más material de embolización se inyectará. Esto prolonga la duración de la embolización, pero no cambia el procedimiento. La EAU puede modificarse si vemos una conexión evidente con la arteria ovárica, lo que puede resultar en un mayor riesgo de embolización no objetivo. A continuación, podemos cerrar dicha conexión (por ejemplo, mediante el uso de espirales), separando así el suministro de los ovarios y el útero, y luego continuar la embolización con el uso de partículas de 700 μm. Si no es posible implantar bobinas, aumentamos el diámetro de partícula a 900 μm.
También hay algunos casos en los que los fibromas pueden ser irrigados desde el lado de las arterias ováricas; Entonces, las arterias uterinas son hipoplásicas. En estos casos, para realizar con éxito la embolización, se debe insertar un microcatéter en la arteria ovárica y más allá del ovario, depositando el material de embolización en el lecho vascular uterino, mientras se mantiene el suministro ovárico adecuado.
La ventaja indudable de la embolización es el hecho de que no es un procedimiento técnicamente difícil y no requiere equipos sofisticados.
Los puntos fuertes del protocolo son los puntos relacionados con el tratamiento del dolor posterior a la embolización, del que al menos la mitad de los pacientes no habían oído hablar cuando calificaron para los EAU. El procedimiento estándar que proponemos es el uso de una bomba PCA (sección 4.2 del Protocolo de atención al paciente después de los EAU), y los resultados obtenidos confirman la alta efectividad de dicho tratamiento.
Con respecto a las futuras modificaciones del protocolo de los EAU, parece posible cambiar la sección 10 de la preparación para el Protocolo de los EAU, que requiere la extracción del DIU del útero antes del procedimiento debido al riesgo de inflamación y sepsis. En estudios de seguimiento a gran escala, el riesgo de infección en la pelvis combinado con la presencia de un DIU es inferior a 1 en 130049.
La EAU ha sido tratada como un método experimental desde su primer uso porque requería evaluar la efectividad y examinar las complicaciones que este procedimiento puede dar en períodos cortos y largos. Durante estos años, las indicaciones y contraindicaciones se han modificado en función de los nuevos resultados de las pruebas y la observación clínica. Los datos actuales, incluidos varios estudios controlados aleatorios, reconocen que los EAU son un método de tratamiento valioso para los fibromas uterinos sintomáticos, cuya eficacia y seguridad han sido bien establecidas.
La creación de este protocolo se debe a un análisis exhaustivo de la literatura actual, las recomendaciones relevantes y la experiencia adquirida como resultado de la estrecha cooperación de ginecólogos y radiólogos quirúrgicos durante la década.
Divulgaciones
Los autores no tienen nada que revelar.
DECLARACIÓN:
Piotr Szkodziak, como autor de la Figura 1, que ilustra la clasificación FIGO de los miomas uterinos, permite el uso libre de la figura para aplicaciones científicas y educativas sin ninguna modificación. La intención de modificar la figura debe ser aceptada por el autor (piotr.szkodziak@gmail.com).
Agradecimientos
Los autores desean agradecer a todo el equipo de la 3ª Cátedra y Departamento de Ginecología y Departamento de Radiología Intervencionista y Neurorradiología de la Universidad Médica de Lublin por su ayuda en la implementación del protocolo de Lublin para la embolización de las arterias uterinas.
Materiales
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
Referencias
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados