Method Article
자궁 동맥의 루블린 프로토콜(Lublin Protocol of the Uterine Arteries) 증상이 있는 자궁 근종 치료에서 색전술
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 증상이 있는 자궁 근종의 치료를 위한 자궁 동맥 색전술 방법을 적격성, 준비, 수행, 시술 후 관리 및 후속 방문의 5개 섹션으로 나누어 제시합니다. 이 프로토콜은 산부인과 전문의와 중재적 방사선 전문의의 긴밀한 협력을 필요로 하며, 이를 통해 위의 절차를 적절하게 실행할 수 있습니다.
초록
자궁 근종은 평활근 조직에서 유래한 양성 종양으로, 자궁 근육 기질을 구성합니다. 자궁 근종은 여성에서 발견되는 가장 흔한 양성 종양이다. 여성의 20%-50%에서 자궁근종은 증상이 없으며 치료가 필요하지 않습니다. 자궁근종의 주요 증상은 다량의 월경 출혈, 비정상적인 자궁 출혈, 압박 증상 등이다. 욕창 증상은 골반 통증 증후군, 배뇨 장애 및 변비를 유발할 수 있습니다.
현재 사용되고 있는 치료법으로는 외과적 치료, 약물 요법, 최소 침습적 시술 등이 있습니다. 가장 일반적으로 적용되는 최소 침습 방법은 자궁 동맥을 색전술하는 것입니다. 이 시술은 현재 증상이 있는 자궁 근종에 대한 치료로 널리 받아들여지고 있으며, 미국 국립보건임상우수연구소(National Institute for Health and Clinical Excellence)의 월경 과다 출혈 가이드라인에서 인정받은 바 있습니다.
이는 복잡한 절차이며 산부인과 전문의와 중재적 방사선 전문의의 긴밀한 협력이 필요합니다. 우리는 증상이 있는 자궁 근종의 치료에서 자궁 동맥 색전술에 적용할 수 있는 프로토콜을 제시합니다. 프로토콜은 5개의 섹션으로 나뉩니다. 처음 두 섹션은 산부인과 전문의와 중재적 방사선 전문의를 대상으로 하며, 단계별로 색전술을 위해 환자를 검증하고 준비시키는 방법을 설명합니다. 중재적 방사선 전문의를 대상으로 하는 섹션 3은 색전술이 어떻게 수행되어야 하는지 설명합니다. 섹션 4는 색전술 후 환자를 돌보는 산부인과 의사 또는 병동 의사를 대상으로 합니다. 프로토콜의 이 섹션에서는 PCA(Patient Controlled Analgesia) 펌프를 사용하여 색전술 후 통증을 치료하는 방법을 제공합니다. 섹션 5는 자궁 동맥 색전술의 영향과 후기 합병증에 대한 평가로 절차를 마무리합니다.
5개 섹션 모두 해당 분야에 새로운 임상의, 전문가 및 연구자를 대상으로 하는 통일된 프로토콜을 만듭니다.
서문
자궁 근종은 평활근 조직에서 유래한 양성 종양으로, 자궁 근육 기질을 구성합니다. 이들은 콜라겐, 피브로넥틴 및 프로테오글리칸을 포함하는 다량의 세포 외 물질로 구성된 단클론 종양입니다. 자궁근종은 압축된 근육 섬유, 콜라겐 섬유, 신경 섬유 및 혈관으로 만들어진 얇은 유사 캡슐로 둘러싸여 있습니다 1,2. 근종의 병태생리학은 완전히 이해되지 않았으며, 주로 선택적이고 조직 특이적인 후성유전학적 변화로 인한 단클론 증식에 의존하는 것으로 보인다3. 자궁 근종을 유발하는 단일 유전자는 발견되지 않았다. 그러나 다발성 피부 및 자궁 평활근종증과 같은 희귀 자궁 섬유종 증후군의 존재는 크렙스 회로에 관여하는 미토콘드리아 효소인 푸마르산염 히드라타아제를 암호화하는 유전자에 기인합니다4. 섬유종의 50%에서 발생하는 염색체 7, 12, 14번에서 염색체 7 결실 및 전좌의 존재는 1차 5,6,7이 아닌 2차 염색체인 것으로 보입니다.
자궁 근종의 성장을 조절하는 요인은 난소에서 생성되는 스테로이드 호르몬(에스트로겐 및 프로게스테론), 성장 인자, 혈관 신생 및 세포사멸입니다. 연령, 조기 초경, 아프리카계 미국인 인종, 유전, 무효, 비만, 다낭성 난소 증후군, 당뇨병, 고혈압, 비타민 D 결핍, 두유 사용, 알코올, 카페인 섭취 등 자궁 근종 발병의 위험 요인도 확인되었다8.
자궁 근종은 여성의 생식 기관에서 발생하는 가장 흔한 양성 종양입니다. 이 종양은 1793년 런던의 세인트 조지 병원(St George's Hospital)의 매튜 베일리(Matthew Baillie)에 의해 처음 설명되었습니다. 이용 가능한 역학 데이터는 자궁 근종의 발병률이 높기 때문에 진단되지 않은 상태로 남아 있기 때문에 정확하게 명시되어 있지 않습니다. 자궁근종은 모든 환자의 5.4%에서 77%에서 발생하는 것으로 추정됩니다. 이들의 유병률은 유럽보다 미국에서 더 높은데, 그 원인은 인종 차이8.
가임기 여성의 경우 근종의 약 30%에서 비정상적인 자궁 출혈의 형태로 임상 증상이 나타날 수 있으며, 이로 인해 환자에게 혈액 공급이 불충분할 수 있다9. 대부분의 경우 환자는 자궁에 위치한 구형 병변인 근종을 두 개 이상 가지고 있습니다. 크기와 위치는 다를 수 있습니다. 90%의 경우 자궁 몸체에 위치한다. 그들의 직경은 수 밀리미터에서 20cm10까지 일 수 있습니다.
FIGO(Fédération Internationale de Gynécologie et d'Obstétrique) 분류는 자궁내막의 근접성에 따라 0-8의 그룹으로 나눕니다(숫자가 낮을수록 자궁내막에 더 가까움)(그림 1)11. 약 50%-75%의 사례에서 자궁근종은 증상이 없습니다. 자궁 근종의 가장 흔한 증상은 다량의 월경 출혈, 비정상적인 자궁 출혈 및 압박 증상입니다. 근종은 불임 사례의 약 10%와 관련이 있으며, 1%-3%는 근종만이 유일한 원인이다12. 무증상 자궁 근종은 일반적으로 정기적인 의학적 통제만 받는 반면, 증상이 있는 자궁 근종은 치료의 적응증이다13.
현재 사용되고 있는 자궁근종의 치료방법은 외과적 치료, 약물 요법, 최소 침습적 시술 등이 있다 13,14,15,16,17,18. 외과적 치료에는 근종절제술(복부 및 자궁내시경)과 자궁절제술이 포함됩니다. 근종절제술과 자궁절제술은 모두 삶의 질에 긍정적인 영향을 미친다19. 자궁절제술은 돌이킬 수 없는 생식력 상실과 관련이 있습니다. 따라서 많은 여성들이 다른 치료법을 찾는다20.
복부 근종절제술은 생식력을 보존할 수 있습니다. 자궁근종의 크기와 수, 외과 의사의 경험에 따라 이 절차는 개복술 또는 복강경을 통해 수행될 수 있습니다. 출혈은 자궁절제술보다 덜 흔하지만, 전반적인 이환율은 비슷하다. 자궁경 근종절제술은 복부 근종절제술보다 안전하고 덜 침습적인 방법이며 점막하 근종(FIGO 0)을 치료할 수 있습니다. 더 큰 제2형 자궁근종을 완전히 제거하기 위해서는 후속 자궁경 시술이 필요할 수 있다21.
레보놀게스트렐 방출 자궁 내 장치는 월경 과다 출혈에 효과적인 치료법이지만 자궁 근종의 크기를 줄이지는 않습니다. 기형 자궁강이 있는 환자에서는 사용이 제한됩니다. GnRH 유사체는 주로 자궁근종의 크기와 수술 전후 출혈을 줄이기 위한 수술 전 약제로 사용됩니다. 또한 자궁절제술과 근종절제술 중 수직 절개의 비율을 감소시키는 동시에 질 절제의 가능성을 높인다20.
단기적으로는 선택적 프로게스테론 수용체 조절제는 근종 부피를 감소시키고 무월경을 유발합니다. 그러나 장기적인 효능과 안전성을 위해서는 추가 연구가 필요합니다. 아로마타제 억제제와 함께, 빈혈의 수술 전 치료와 근종 부피 감소를 위한 다른 옵션이 있을 수 있다22. 일부 연구에 따르면 비타민 D는 자궁 근종의 성장과 증상의 발병을 늦추거나 예방할 수 있다고 합니다23.
나노 입자와 결합 된 2- 메 톡시 에스트라 디올을 사용하는 새로운 방법도 개발 중입니다24. 자궁근종 치료에 사용되는 최소 침습적 방법에는 자궁동맥 색전술(UAE), 자기공명유도집속초음파수술(MRgFUS), 복강경 자궁동맥폐색(LUAO), 고주파 근용해술등이 있다 14,25. 초음파 유도 고강도 집속 초음파(US-HIFU)는 아직 실험 단계이며 최소 침습적 방법인 새로운 방법이다26,27.
치료적 혈관 폐색과 자궁으로의 혈액 공급을 차단하는 방법은 120여 년 전에 언급되었습니다. 1894년, 켈리는 종양학적 자궁절제술을 통해 난치성 골반 출혈을 조절하기 위해 내부 장골동맥의 결찰을 제시했는데, 이는 당시 수술 후 흔한 합병증이었다28. 그런 다음 Sack(1973)은 겸자 분만 후 대량 산후 출혈 치료에 동일한 기술을 효과적으로 사용하는 방법을 설명했습니다. 두 경우 모두에서, 자궁절제술 없이 지혈이 이루어졌다29. 1979년, Heaston 등과 Brown 등은 산후 출혈을 조절하기 위해 흡수성 젤라틴 스펀지를 사용하여 골반 동맥을 색전술하는 방법을 독립적으로 설명했다30,31.
UAE는 1991년 프랑스에서 증상이 있는 자궁근종의 치료 방법으로 처음 사용되었습니다32. 처음에는 근종절제술 후 출혈을 줄이기 위해 사용되었습니다. 1995년, Ravina 등은 증상이 있는 자궁근종의 1차 치료법으로 이 시술을 제안했다33. 미국에서는 1997년 자궁동맥 색전술이 성공적으로 시행되었다34.
증상이 있는 자궁근종이 있는 여성의 자궁 보존에 대한 관심이 높아짐에 따라 UAE는 최소 침습 자궁근종 치료의 최전선에 서게 되었습니다 14,18,35,36,37. 2000년, UAE에 대한 지침을 발표하기 위해 왕립 산부인과 학회(Royal College of Obstetricians and Gynecologists)와 왕립 방사선 학회(Royal College of Radiologists)의 합동 실무 위원회(Joint Working Party)가 설립되었습니다. 당시 UAE는 실험적인 방법으로 간주되었습니다(전 세계적으로 7,000건 미만의 절차가 수행됨). 지침이 발표된 이후 전 세계적으로 100,000건 이상의 UAE 절차가 수행되었습니다. 또한, UAE를 다른 수술 절차와 비교하는 5건의 무작위 대조 임상시험이 수행되었다. 연구 결과에 따르면 UAE는 중기(최대 몇 년)에 매우 효과적이며 중기(예: 자궁 감염) 및 심각한(생명을 위협하는) 합병증의 위험이 낮다38,39. 무작위 연구에서는 입원 시간이 짧아지고, 회복이 빠르며, 일상 활동 복귀가 UAE에 유리하게 작용했습니다. 수술 절차는 비용이 저렴하고 재개입이 필요한 빈도가 적으면서 통계적 유의성을 유지하는 것으로 입증되었다32. 이 시술은 현재 증상이 있는 자궁근종에 대한 치료법으로 널리 인정되고 있으며, 미국 국립보건임상우수연구소(National Institute for Health and Clinical Excellence, NICE)에 의해 월경 과다 출혈 가이드라인(guidelines for Heavy menstral bleeding40)에서 인정되었다.
현재 유럽, 북미 및 호주의 과학 협회에서 만든 증상이 있는 자궁 근종 치료에 UAE를 사용하는 것과 관련된 11가지 권장 사항이 있습니다. 대부분의 경우 권장 사항은 일관되는 반면 차이는 두 가지 불일치와 관련이 있습니다. 첫 번째는 pedunculated submucosal (FIGO 0) 및 subserosal (FIGO 7) myoma가 UAE에 대한 금기 사항인지 여부입니다. 두 번째는 향후 임신을 선언한 여성이 이 시술을 받을 자격이 있어야 하는지 여부41. 미국 산부인과학회(American College of Obstetricians and Gynecologists, ACOG) (2008)는 자궁 근종 치료에 대한 흥미로운 지침을 제시했다. 일관된 과학적 증거(레벨 A)를 기반으로 ACOG는 UAE를 자궁근종 치료를 위한 전형적인 적응증으로 자궁을 보존하고자 하는 적절한 자격을 갖춘 여성을 위한 효과적이고 안전한 방법으로 정의했습니다. 동시에 ACOG 권고안은 산부인과 전문의와 중재적 방사선 전문의의 긴밀한 협력의 필요성을 강조했다. 발표된 지침에서 ACOG는 생식력을 보존하고자 하는 욕구를 유일한 금기(상대적)로 인정했습니다42.
2013년에는 왕립산부인과학회(Royal College of Obstetricians and Gynecologists, RCOG)와 2015년에는 캐나다 산부인과학회(Society of Obstetricians and Gynecologists of Canada, SOGC)가 가장 최근의 권고안을 발표했다41. 이 기사의 나머지 부분에서 저자는 위의 권장 사항을 사용할 것입니다. RCOG 및 SOCKC의 지침에 따르면, 증상이 있는 근종이 있는 모든 환자는 금기 사항이 없고 절차의 이점(증상 해결)이 합병증의 위험보다 더 크다면 색전술 대상이 될 수 있습니다. 최소 침습적 시술인 자궁 근종의 색전술은 무시할 수 있는 수의 심각한 합병증을 수반한다는 점에 유의해야 합니다. 따라서 대부분의 경우 합병증의 위험보다 이점이 더 큽니다 14,32,43.
적절한 환자 적격성 평가는 높은 임상적 효과와 UAE 감염 후 합병증 예방을 위해 매우 중요합니다. UAE의 주요 적응증은 증상이 있는 자궁 근종으로, 이로 인해 월경 과다출혈, 월경통, 통증, 성교통, 비뇨기 또는 위장관에 대한 기타 부작용이 발생합니다. 자궁근종을 자궁선근증 또는 자궁선근증과 공존하는 자궁근종과 구별할 필요가 있는데, 이러한 상황에서는 UAE가 덜 효과적이며 시술 기법 14,32,43,44,45,46,47의 수정이 필요하기 때문이다. 증상이 있는 자궁근종이 있는 여성에서 UAE 시술을 수행하기 위한 구체적인 적응증으로는 수술 거부, 수혈에 대한 동의 없음, 이전에 실패한 자궁근종 수술 등이 있습니다.
위의 적응증에서 UAE는 외과적 치료의 대안으로 치료되어야 합니다. 그러나 소수의 사례에서는 시술 후 합병증으로 인해 외과적 개입이 필요할 수 있다는 점을 환자에게 알려야 한다 14,32,43. RCOG 지침에 따르면, 근종이 불임의 유력한 원인인 상황에서 UAE를 사용하려면 불임 및 보조 생식 치료를 전문으로 하는 산부인과 의사의 특별한 주의와 적절한 평가가 필요합니다. 자궁근종의 존재로 인한 불임은 절대적인 것이 아니며, 많은 여성들이 아무런 개입 없이 임신을 하게 된다. 따라서 남성 파트너에 대한 평가를 포함하여 불임의 다른 가능한 원인을 배제하는 것이 합리적이다 14,32,43.
따라서 RCOG 및 SOGC의 권고에 따라 후보자는 자궁 근종과 유사한 임상 증상이 있는 골반의 병리학이 배제된 증상이 있는 자궁 근종이 있는 여성이어야 합니다41,43.
이 절차에 대한 절대적인 금기 사항에는 현재 또는 최근의 생식기 감염, 임상적 요인 또는 부적절한 영상으로 인한 진단적 의심, 무증상 자궁 근종, 생존 가능한 임신 및 방사선 조영제 사용에 대한 금기 사항이 포함됩니다.
상대적 금기 사항으로는 pedunculated submucosal (FIGO 0) 및 subserosal (FIGO 7) 근종이 있으며, 이는 이론적으로 꽃자루 괴사로 인해 자궁 내막에서 분리될 수 있으며, 드물게 패혈증을 초래합니다. 이러한 경우, UAE는 시술을 계획하기 전에 자궁경 또는 복강경으로 족저근종을 제거하는 경우에만 고려해야 합니다.
현재 문헌에 따르면 근종의 크기 자체가 금기 사항이 아님에도 불구하고, 경험에 따르면 큰 근종(특히 압박 증상과 관련된)을 가진 환자를 UAE에 대해 자격을 부여할 때 용적 감소가 증상을 완화하고 환자의 기대를 충족시키기에 충분하지 않을 수 있으므로 극도의 주의가 필요합니다14,32, 43,48쪽.
UAE 임신 후 성공적인 임신에 대한 많은 보고가 있지만, 기존 증거는 젊은 여성에서 약물 또는 외과적 치료(근종절제술)의 대안으로 사용하는 것을 완전히 뒷받침하지는 못한다49. 따라서 임신 의사를 밝힌 여성(임신율이 낮고, 유산률이 높으며, 자궁 파열, 태반 유착, 임신 결과가 자궁종절제술 후보다 UAE 후에 불리한 임신 결과가 나옴)의 경우 이 시술을 매우 주의해서 사용해야 합니다.32,50,51,52,53,54,55 . 산부인과 의사로서 우리는 임신을 원하는 여성에게 UAE를 권장하지 않습니다. 우리에게는 UAE에서 수술이나 수혈을 거부하는 것과 같은 추가 징후가 있는 경우 치료 부족이 생명을 위협할 수 있는 경우 상대적인 금기 사항입니다.
RCOG 가이드라인에 따르면, 증상이 있는 자궁근종을 앓고 있는 젊은 여성의 생식력을 보존하거나 개선하고자 하는 욕구는 UAE32에 대한 상대적 금기 사항이다. 이와는 대조적으로, SOGC 가이드라인은 유사한 사례의 경우 UAE를 자궁근종에 대한 치료 옵션으로 제안해서는 안 된다고 권고하는데, 이는 이러한 여성에 대한 안전성과 유효성이 확립되지 않았기 때문이다14,43. 미국 생식의학회(American Society for Reproductive Medicine, ASRM), 미국 산부인과학회(American College of Obstetricians and Gynecologists, ACOG), 미국영상의학회(American College of Radiology, ACR), 왕립 호주 및 뉴질랜드 산부인과학회(Royal Australian and New Zealand College of Obstetricians and Gynecologists, RANZCOG) 등을 포함한 다른 과학회에서도 근종절제술 후 가임력 결과가 개선되었다고 언급하며 비슷한 견해를 제시하고 있다 41,43,56. UAE는 특히 근종절제술(다발성 근종)에 불리한 특징을 가진 여성, 특히 가임력을 유지하거나 개선하고자 하는 여성에게 NICE에서만 권장하고 있습니다57.
일반적으로 UAE의 절차는 월경 주기의 어느 단계에서나 시행될 수 있다32. 다만, 수정이나 착상 단계에서 임신을 배제하는 이상적인 방법이 없다고 가정하고, 조기 임신을 배제하기 위해 본 센터에서는 10주기일까지 시행하고 있습니다. 대부분의 경우 환자는 시술 당일 산부인과 병동에 입원합니다. 적절한 검사와 산부인과 상담이 제공되는 경우 환자를 혈관 수술 병동에 입원시키는 것이 허용됩니다. 산부인과 전문의와 중재적 방사선 전문의가 자궁근종 색전술 자격을 취득합니다. 부인과 자격에는 병력, 검사, 생식 기관 및 근종 유형에 대한 초음파 평가가 포함됩니다. 또한 자궁 내 악성 종양을 배제하기 위해서는 자궁경부(PAP) 도말과 자궁내막 생검이 필요합니다. 난소 초음파 검사가 의심되는 경우 ROMA 검사(Risk of Ovarian Malignancy Algorithm)가 필요합니다.
논의가 필요한 또 다른 문제는 자궁 육종, 특히 자궁 종양의 70%를 차지하는 평활근육종(LMS)입니다. 근종으로 수술을 받은 환자에서 LMS의 유병률은 낮으며 0.13%-0.29%로 추정됩니다58,59. LMS 발병률의 증가는 40세 이상의 여성에서 관찰됩니다. LMS는 양성 자궁근종과 유사할 수 있으므로 치료 전에 진단하기 어렵습니다60. 대부분의 LMS는 기존 자궁근종과 관련이 없으며, LMS가 자궁근종과 관련이 있다는 증거는 없다61. 자궁근종과 LMS는 모두 빠르게 성장하는 경향이 있습니다. 따라서, 크기나 성장률은 악성 자궁종양의 위험인자는 아니다60.
현재로서는 평활근육종을 명확하게 식별하고 평활근종과 구별할 수 있는 신뢰할 수 있는 검사실 또는 영상 검사는 없습니다60,62. 평활근육종의 진단에서 자궁내막 생검의 민감도는 86%입니다. 따라서 음성 생검 결과가 악성 자궁 종양의 존재를 배제하지 않습니다. 조영제 강화 MRI는 현재 자궁 종양에 대한 최적의 진단 방법입니다. LMS 진단에서 이 테스트의 민감도는 94%60입니다.
이미 언급했듯이 위의 검사는 악성 자궁 종양을 100% 배제하지 않습니다. 따라서 자궁 종양의 조직병리학적 검증 가능성 없이 치료 후 LMS의 진단을 연장할 위험이 약간 있습니다. 환자는 UAE 자격 심사 중에 이에 대해 알려야 합니다.
전체 혈구 수(CBC) 및 응고 검사(INR, APTT), 신장 패널(크레아티닌, 요소), 갑상선 자극 호르몬(TSH), 여포 단계에서 항뮬러관 호르몬(AMH) 농도(권장) 또는 여포 자극 호르몬(FSH) 농도, C-반응성 단백질(CRP), 일반 소변 검사 및 질 도말(호기성 질 배양)을 통해 잠재적인 색전술 후 합병증(감염, 의인성 난소 손상, 가돌리늄 기반 조영제 후 이전 신장 손상의 심화, 요오드 기반 조영제 후 갑상선 기능 항진증의 경우 갑상선 독성증)63,64. FSH는 젊은 여성의 난소 예비력 변화에 대한 민감한 지표가 아니기 때문에 FSH 검사는 40세 미만에서는 권장되지 않습니다50,65.
중재적 방사선 전문의는 병력과 자기공명영상(MRI)을 기반으로 환자에게 시술 자격을 부여합니다. 병력을 수집하는 동안 시술 자체뿐만 아니라 이점과 가능한 합병증에 대해 환자와 논의해야 합니다. UAE에 대한 환자의 기대치도 논의해야 합니다. MRI는 생식 기관 및 인접 구조의 다른 병리학을 배제하고 절차의 기술적 타당성을 위해 자궁 근종 및 해부학의 형태와 위치를 평가하는 것을 목표로 합니다 35,36,37,57.
UAE는 모든 근종의 혈관 구조를 완전히 차단하면서 자궁, 난소 및 골반 내 주변 조직에 혈액 공급을 유지하는 것을 목표로 합니다. UAE의 기술적 측면은 여전히 어느 정도 발전하고 있습니다.
자궁 동맥 색전술은 혈관 내 색전술 분야에서 적절한 역량을 갖춘 중재적 방사선 전문의가 수행합니다. 이 절차는 형광투시 지침에 따라 수행됩니다. 여기에는 서혜부 천자에서 대퇴 동맥, 대동맥, 내부 장골 동맥, 자궁 동맥까지 혈관 카테터를 경피적으로 삽입하는 것이 포함됩니다. 카테터를 자궁 동맥 깊숙이 삽입하고 안정된 위치를 얻은 후, 조영제와 혼합된 색전술을 역류 및 "비표적" 색전술을 방지하는 방식으로 형광 투시 제어 하에 주입합니다. 근종의 혈관층은 색전술 물질의 유형에 따라 500–900μm의 입자를 사용하여 닫힙니다(일반적인 크기는 700μm). 색전술은 정지 혈류가 달성될 때까지 계속됩니다. 절차가 끝나면 카테터를 제거하고 수동 압박 및 드레싱 또는 기계적 클로저로 혈관 접근 부위를 고정합니다. 절차는 약 0.5–1.0시간 동안 지속됩니다. UAE 동안 난소가 흡수하는 평균 전리 방사선 선량은 0.04–0.22(Gy: 회색) 범위이고 평균 추정 유효 선량 범위는 22–34(mSv: millisievert)입니다. 평균 형광 투시 시간은 약 22 분66,67입니다.
대부분의 자궁근종의 혈관 구조는 자궁 동맥에서 나옵니다. 자궁근종의 약 5%-10%만이 난소 동맥을 통해 추가로 공급됩니다. 동맥 자궁 문합은 약 10%의 사례에서 발생하며, 자궁-난소는 10%-30%에서 발생합니다. 색전술된 조직으로의 혈액 공급을 차단하면 허혈성 괴사가 발생하고 유리질 변성 또는 응고성 괴사가 발생합니다. 이 과정은 몇 달이 걸립니다68,69.
UAE의 효과는 증상의 해결 또는 감소 정도에 달려 있습니다. 과도한 월경 출혈, 골반 통증 및 압박 증상의 치료에 대한 UAE의 임상 효과 지수는 각각 81%-96%, 70%-100% 및 46%-100%입니다. 시술 후 3-6개월 이내에 관찰된 자궁근종의 부피 감소는 25%-60%33,70,71,72였습니다. 근종의 평균 직경 감소는 2.2cm였다57.
자궁근종의 부피 감소가 항상 임상 증상의 해결 또는 감소와 관련이 있는 것은 아닙니다. UAE 이후 장기 추적 관찰에서 환자의 70% 이상이 시술 후 5년 이내에 증상이 해결되거나 현저히 감소했다고 보고했으며, 그 중 16%-23%는 재중재가 필요했다73,74.
초기 UAE 효과를 평가하기 위해 이 간행물의 저자들은 VOCAL(Virtual Organ Computer-aided AnaLysis)을 사용하여 혈관 지수(vascularization index, VI), 유동 지수(flow index, FI) 및 혈관 유동 지수(vascularization flow index, VFI)75)를 측정하는 3차원(3D) 초음파의 사용을 제안합니다.
색전술 후 통증은 성공적인 UAE(합병증과 혼동하지 말 것)로 예상되는 초기(약 24시간 지속)의 후유증이므로 적극적으로 치료해야 합니다. 이 임상 증상은 허혈성 근종의 조직 파괴 산물의 방출로 인해 발생합니다. 치료에는 적절한 통증 조절, 수분 공급, 항생제 요법이 포함된다32,43. 시술 후 24시간 동안 경막외 마취를 유지하면 통증이 완전히 수용 가능한 수준으로 크게 감소하지만, 환자 조절 진통제(PCA)에 비해 비용이 더 많이 들고 합병증 위험이 증가한다76.
색전술 후 통증 관리 문헌고찰에서도 다른 접근법을 이용할 수 있다. UAE 기간 동안 폴리비닐 알코올 분자와 전기 침술 마취와 진통제의 혼합물을 사용하는 것을 언급할 가치가 있습니다. 두 방법 모두 병원 환경에서 수행되는 UAE 시술 횟수를 제한하기 위한 것이었습니다77,78. 우리는 우리 및 협력 센터에서 이러한 방법을 사용하지 않습니다.
UAE의 초기 합병증은 일반적으로 혈관 조영술 절차와 관련된 국소 합병증입니다. 이 그룹의 부작용은 드물며(사례의 1% 미만에서 발생) 주로 사타구니 혈종, 동맥 혈전증, 동맥 박리 및 가성 동맥류, 조영제에 대한 알레르기 반응, 시술 중 혈관 내 카테터 조작으로 인한 자궁 동맥 경련(몇 분 후 일시적인 사건으로 처리되고 시술을 계속할 수 있음, 경련이 지속되면 베라파밀(Verapamil, 2.5-5 mg) 또는 질산염(100-150 μg)을 동맥 내 투여할 수 있음) 및 "비표적(non-target)" 색전술 32,37,38.
또한 다른 골반 장기의 "비표적" 색전술과 그에 따른 허혈에 대한 여러 보고가 있었습니다. 이 합병증은 절차의 잘못된 실행의 결과뿐만 아니라 골반 혈관 구조의 문합 및 해부학적 변형의 존재로 인해 발생할 수 있습니다. 비표적 색전술의 특별한 경우는 일부 환자에서 자궁과 난소 사이의 문합으로 인한 난소 손상입니다79,80.
근종 괴사의 결과는 약 10%-15%의 환자에서 시술 후 30일 이내에 발생하는 색전술 후 증후군입니다. 이 증후군의 증상은 함께 또는 개별적으로 발생할 수 있으며 메스꺼움, 구토, 권태감, 미열, 하복부 통증, 백혈구 수치 상승 등이 있습니다. 이것은 일반적으로 10-14일 이내에 사라지는 자기 제한 증후군입니다. 이 합병증을 치료하기 위해 진통제와 항염증제가 사용된다32. 색전술 후 증후군의 증상을 패혈증과 같은 더 심각한 합병증과 구별하는 것이 중요합니다. 특히 증상이 2주 이상 지속되는 경우 32,37,38.
감염은 UAE 다음으로 가장 심각한 합병증일 수 있으며 사례의 약 0.5%에서 발생합니다32,38. 24-48시간 동안 지속되는 고열(38.5°C 이상)과 복부에 딱딱하고 통증이 있는 경우 패혈증을 의심해야 합니다. 이 경우 치료에는 항생제 요법뿐만 아니라 자궁을 제거해야 할 수도 있습니다. 후자의 경우, 1% 미만의 사례에서 환자의 생명에 위협이 될 수 있습니다. 패혈증은 UAE가 대자궁(20cm 이상 또는 단일 근종의 직경이 9cm 이상일 때, 그리고 큰 점막하 근종이 공존하는 경우)에서 시행될 때 더 흔합니다37,38.
UAE 감염 후(시술 후 30일 이상) 점막하 근종의 색전술 후 발생하는 후기 합병증은 자궁경부관을 통해 뚜렷한 괴사성 자궁근종 조각이 배설되는 것입니다. 약 10%의 사례에서 발생합니다 32,81,82. UAE 여성의 약 16%는 자궁에서 괴사성 자궁근종의 배설로 인해 몇 주에서 몇 달까지 질 분비물이 풍부할 수 있습니다83. UAE 시술 후 월경이 현저히 짧아지고 월경량이 감소하는 것이 관찰되며, 이는 이 시술의 유익한 효과로 간주됩니다. 그러나 완전 무월경은 색전술 후 난소 부전의 영향으로 취급된다50,84.
UAE 후의 무월경은 일반적으로 일시적이며 몇 주기로 제한됩니다. 영구적인 무월경은 40세 이상 여성의 약 15%와 이 연령 미만 여성의 약 1%에서 발생하며 조기 폐경 증상을 유발합니다. 본 연구에서는 난소 예비력 감소로 인한 젊은 여성(33-40세)의 출산율 감소가 발견되었다65. UAE 후 무월경을 보고하는 여성의 약 85%가 45세 이상인 것으로 추정됩니다85. 고령 여성의 무월경 발병률이 증가하는 이유는 난소 예비력이 감소하고 난소 조직이 "비표적" 색전술로 인한 허혈에 더 민감하기 때문이라고 주장되어 왔다86.
UAE 시술은 시술을 받는 여성의 성 기능에도 영향을 미칩니다. UAE 이후 여성의 26%가 성 기능 개선을 보고했고, 10%에서는 악화가 발견되었으며, 나머지 64%에서는 변화가 없었다. 성기능 장애의 가능한 원인은 UAE 절차74의 결과로 음핵, 자궁경부 및 자궁의 비정상적인 혈관 구조입니다.
프로토콜
저자는 의정서가 루블린 의과 대학의 지역 윤리 위원회의 지침을 따른다고 선언합니다.
1. UAE 절차 자격 요건
참고: 이것은 산부인과 전문의와 중재적 방사선 전문의를 대상으로 합니다.
- 환자에게 UAE 절차의 세부 사항을 알립니다.
- UAE 절차에 대한 적응증 및 금기 사항에 대해 논의합니다.
- 환자와 함께 자궁근종 치료에 대한 UAE의 가정과 대체 방법(서론에 설명)에 대해 논의합니다.
- 경고! 환자에게 UAE는 근치적 시술이 아님을 알립니다(근종은 제거되지 않습니다).
- 경고! 환자에게 UAE 이후에는 자궁 근종에 대한 조직병리학 보고서를 받지 않을 것이라고 알립니다.
- 경고! 환자에게 1,000개의 자궁 종양 중 1-3개는 악성(LMS)일 수 있다고 알립니다. UAE 자격 심사 기간 동안 수행된 자궁내막 생검 및 MRI는 평활근육종의 진단에 매우 민감하지만 100%는 아니라는 점에 대해 환자와 논의합니다. 평활근육종에 대한 UAE 시행으로 인해 진단과 적절한 치료가 지연될 수 있음을 환자에게 알립니다. 의료 기록에 그 사실을 주목하십시오.
- 환자가 고의로 UAE 시술을 원하는 경우, 이 프로토콜을 계속하십시오.
- 환자에게 적격성 평가가 두 단계로 이루어진다고 알립니다. 산부인과 전문의의 자격에는 적응증 및 금기 사항 분석이 포함되며, 중재적 방사선 전문의는 UAE의 기술적 능력을 평가합니다.
- 산부인과 상담을 계획하거나 수행하고 UAE 전에 중재적 방사선 전문의와의 상담을 계획하십시오.
- 가능하면 외래 환자 클리닉에서 가능한 한 많은 자격 절차를 수행하십시오.
- 환자가 UAE에 대한 적응증이 있는지 확인하십시오 : 증상이있는 자궁 근종 (폐경, 메트로 파기아, 월경 곤란, 성교통, 만성 골반 통증); 수술 치료 거부; 수혈에 대한 동의가 없는 경우; 이전에 실패한 자궁 근종 수술. 병력에 기록하십시오.
- 환자에게 자궁근종의 증상에 대해 물어보십시오.
- UAE의 효과와 환자의 기대치에 대해 논의합니다( 대표 결과에서).
- 환자가 이전에 자궁근종 치료를 받은 적이 있는지 물어본다. 어떤 방법이 사용되었는지 확인합니다.
- 환자가 외과적 치료나 수혈을 거부하는 경우, 진술서를 작성해야 한다.
- UAE 시술에 자격이 있는 환자가 절대적인 금기 사항이 없는지 확인하십시오: 무증상 자궁근종; 생존 가능한 임신; 현재 또는 최근의 생식기 감염; 임상적 요인 또는 부적절한 영상으로 인한 진단적 의심; 방사선 조영제 사용에 대한 금기 사항; MRI에서 평활근육종의 특징; 자궁 또는 난소 악성 종양(완화를 위해 또는 수술의 부속물로 시행되지 않는 경우)87. 병력에 기록하십시오.
- 환자가 무증상 자궁근종에도 불구하고 UAE를 요구하는 경우, 이러한 사례는 시술에 적합하지 않다는 점을 설명합니다. 환자에게 무증상 근종은 정기적인 부인과 모니터링만 필요하다고 설명합니다.
- UAE에 대한 상대적인 금기 사항(큰 자궁 근종 및 생식 계획)이 있는 경우 환자와 논의하고 의료 기록에 해당 사실을 기록하십시오.
- 서론에서 설명한 상대적 금기 사항과 관련된 가능한 합병증에 초점을 맞추고, 환자가 절차를 이해하고 동의하는지 확인합니다.
- 자궁 동맥 색전술의 후유증 및 합병증에 대해 환자와 논의하고(소개 참조) 의료 기록에 해당 사실을 기록하십시오.
- 환자와 대화할 때 색전술 후 통증에 특히 주의하십시오.
- 색전술 후 통증 치료에 대해 논의합니다.
- 부인과 자격을 수행합니다.
- 병력을 수집하고 산부인과 검진을 실시합니다.
- 자궁근종의 크기와 유형을 평가하기 위해 생식 기관에 대한 초음파 평가를 수행합니다(FIGO 분류)88.
- 질 프로브를 사용하여 근종의 크기와 위치를 추정합니다(그림 2). UAE로 치료한 자궁 근종은 FIGO 분류에 따라 2-5(이상적으로는 3-4)여야 하며 직경은 10cm를 초과해서는 안 됩니다.
- 의료 기록에 골반 초음파 스캔 프로토콜을 포함합니다.
- 초음파 스캔 결과가 UAE 절차에 대한 적격성을 나타내는지 확인합니다.
- 골반 내의 악성 돌기를 제외합니다.
- 환자가 자궁경부(PAP) 도말 및 자궁내막 생검의 최신(가급적 6개월 이내에 수행된) 결과를 받았는지 확인합니다.
- 골반 초음파 검사 중에는 질 프로브를 사용하여 난소를 평가하고 난소 구조가 올바른지 확인합니다. 의심스러우면 이전 초음파 스캔을 확인하거나 ROMA 테스트를 수행하십시오.
- 자궁 종양에서 LMS 기능 및 UAE의 기술적 역량을 평가하기 위해 MRI를 의뢰합니다.
- 경추(PAP) 도말, 자궁내막 생검, 초음파 스캔(ROMA 검사일 수 있음) 및 MRI 결과를 의료 기록에 기록하십시오.
- 결과가 정확하지 않은 경우 환자를 시술에서 실격 처리하십시오.
- 환자에게 부인과 자격 심사 결과를 알립니다.
- 의료 기록에 그 사실을 주목하십시오. 환자를 병원에 의뢰합니다.
- UAE 시술을 예약하고 환자가 주기의 10일 이전이어야 한다는 점을 기억하십시오.
- 환자에게 수술을 거부하는지 물어보십시오. 거부하는 경우 환자의 사전 동의 또는 의료 기록에 해당 사실을 기록하십시오.
- 수술을 거부하는 자궁근종 증상 환자는 UAE에 입국할 수 있습니다.
- 잠재적인 합병증을 평가하고 피하기 위해 UAE에 도착하기 최소 7일 전에 다음 검사를 수행하십시오: 질 도말에 대한 미생물 검사(호기성 질 배양); 소변; 선별된 혈액 검사: CBC, 응고 검사(INR, APPT), 신장 패널(크레아틴, 요소), TSH, CRP.
- 의료 기록에 결과를 설명하십시오.
- 환자에게 잘못된 결과는 시술에 대한 자격을 박탈한다고 알립니다.
- 난포 단계에서 AMH(권장) 또는 FSH(40세 미만 권장하지 않음) 혈청 수치를 검사하여 환자의 난소 예비력을 확인합니다. 위의 검사가 비표적 색전술의 결과로 인한 난소 손상을 평가하는 데 도움이 될 것이라는 점에 대해 환자와 논의합니다. 의료 기록에 그 사실을 주목하십시오.
- UAE 자격이 있는 환자는 임신 합병증 14,32,38,50,51,52,89,90,91의 위험이 증가하므로 임신 의지를 선언해서는 안 됩니다.
- UAE 이후 임신 합병증의 위험이 증가한다는 사실을 환자에게 알립니다.
- 환자가 환자의 사전 동의서나 의료 기록에 임신 의지를 선언하지 않는다는 사실에 유의하십시오.
- 환자가 여전히 향후 임신을 배제하지 않지만 UAE가 필요한 경우, UAE 이후에 발생할 수 있는 임신 합병증에 대해 통보받았다는 서면 신고서를 지참하십시오.
- 방사선 적격성 평가를 수행합니다.
- 골반 MRI가 수행되었는지 확인하십시오. MRI 검사를 통해 생식 기관 및 인접 구조의 다른 병리학을 배제하고(UAE 자격 심사 절차의 1.6.3.3. 단계), 자궁근종의 형태와 위치, 색전술의 기술적 타당성을 위한 해부학적 구조를 평가할 수 있습니다(그림 3, 그림 4). 그렇지 않은 경우 MRI 검사를 예약하고 중재적 방사선 전문의와 상담하십시오.
- 영상 검사를 분석하고 자궁근종의 유형과 크기를 평가합니다.
- 점막하(FIGO 0–1) 근종이 발견되면 환자에게 자궁강 속으로 빠져들어갈 위험에 대해 알립니다. 완전한 배설은 패혈증을 유발할 수 있으며, 단편적인 배설은 일반적으로 무증상이다50.
- 장막하 좁고 줄기가 좁고 꽃자루가 있는(FIGO 7) 자궁근종이 발견되면 색전술 후 자궁근종이 복강으로 박리될 위험에 대해 환자에게 알립니다. 이는 급성 염증을 유발할 수 있으며, 복강경 재수술이 필요할 수 있다92.
- 큰 자궁근종이 발견되면, 환자에게 합병증의 위험은 변하지 않지만, 시술의 결과는 작은 자궁근종에 더 좋다고 알린다93.
- 환자의 사전 동의 또는 의료 기록에 해당 사실을 유의하십시오.
2. UAE 절차 준비
참고: 이것은 산부인과 의사 또는 혈관 외과 의사 및 중재적 방사선 전문의를 대상으로 합니다.
- 환자를 병원(부인과 또는 혈관 외과)에 입원시킵니다.
- 입원 시 주기의 10일 이전인지 확인하십시오.
- 산부인과 검사 및 골반 초음파 검사를 수행하거나 지시합니다.
- UAE 절차에 대한 진단 및 자격이 올바른지 확인하십시오.
- UAE 자격 이후 새로운 금기 사항이 나타나지 않았는지 확인합니다. 그렇다면, 다른 치료 옵션을 제안하고 시술 날짜를 변경하십시오.
- 3D 경질 초음파 스캔(TVUS)을 수행하고 VOCAL 소프트웨어 검사(UAE 절차72,75의 효과를 평가하는 데 사용됨)를 사용하여 자궁근종(VI, FI 및 VFI)의 부피 및 혈관화 지수를 계산합니다(서문에 설명)(그림 5 및 그림 6).
- 의료 기록에 그 사실을 주목하십시오.
- UAE 자격을 갖춘 환자가 UAE 자격 기간 동안 검사를 수행했는지 확인합니다(UAE 자격 요건의 1.6.2, 1.6.3, 1.6.5 및 1.6.6 단계에서 설명).
- 환자가 산부인과 전문의의 사전 자격을 얻었고 혈액 검사, 소변 검사 및 MRI를 받지 않은 경우 검사를 주문하고 중재적 방사선 전문의와 상담을 주선합니다(UAE 자격 1.7단계).
- "비표적" 색전술의 결과로 인한 난소 손상을 평가할 수 있도록 UAE 전에 AMH(권장) 또는 FSH(40세 미만 권장하지 않음) 혈청 수치를 평가하거나 주문합니다.
- 환자에게 검사 결과는 약 하루 안에 확인할 수 있으며 UAE 절차는 이러한 결과를 받은 후에만 가능하다고 알립니다.
- 환자에게 잘못된 결과는 시술에 대한 자격을 박탈한다고 알립니다.
- 경고! 자궁경부암 도말 결과가 누락되거나 잘못된 경우, 자궁내막 생검; 질 도말에 대한 미생물 검사는 환자를 UAE에서 실격 처리합니다 (이러한 결과를 얻기에는 너무 오랜 시간). 올바른 결과를 얻은 후 다시 자격을 회복하십시오.
- 의료 기록에 그 사실을 주목하십시오.
- UAE를 수행하기 위해 정보에 입각한 동의를 얻습니다.
- 환자에게 UAE에 대한 모든 정보를 제공합니다.
- UAE의 가능한 합병증에 대해 논의하십시오 (소개에서 설명).
- 환자가 생각하고 질문할 시간을 갖도록 하십시오. 환자가 UAE 절차를 수행하기 위해 정보에 입각한 동의를 제공할 수 있도록 합니다.
- 환자에게 UAE가 시작될 때까지 결정을 변경할 권리가 있음을 알립니다.
- 환자가 UAE에 대한 결정을 바꾸면 자궁근종에 대한 다른 치료 옵션을 제안하십시오(서문에 설명).
- 환자의 사전 동의 또는 의료 기록에 해당 사실을 유의하십시오.
- UAE 절차 직전에 UAE 적격성 평가 섹션 1.6.2, 1.6.3, 1.6.5 및 1.6.6에 설명된 검사와 3D TVUS, MRI 및 중재적 방사선 전문의와의 상담이 수행되었으며 결과가 정확한지 확인하고 확인합니다.
- 검사가 누락되었거나 결과가 잘못된 경우 UAE에서 환자의 자격을 박탈합니다.
- 의료 기록에 그 사실을 주목하십시오.
- 환자에게 알리고 아침부터 시술까지 음식물 및 액체 섭취 금지 사항을 주의하십시오. 단, 아침에 복용하는 약을 복용하는 데 필요한 소량의 액체는 예외입니다.
- 아침(UAE 전)에 환자가 금식 중인지 확인하십시오.
- 환자가 자신의 만성 질환에 대한 약을 복용했는지 확인하십시오.
- 의료 기록에 그 사실을 주목하십시오.
- 환자에게 다음 약물을 주문하십시오 : 경구 용 항산화 제 (예 : Estazolam) 1 정, 정맥 항생제 1 복용량, 메트로니다졸 1 globule 질 투여, Diclofenac 100mg 직장 좌약.
- UAE에 도착하기 약 30-40분 전에 위의 약을 투여하십시오.
- 의료 기록에 그 사실을 주목하십시오.
- 왼쪽 겨드랑이와 오른쪽 사타구니를 면도하여 수술 영역을 준비합니다.
- 위의 피부 부위를 면도하지 않은 경우 부드럽게 면도하십시오.
- 의료 기록에 그 사실을 주목하십시오.
- 환자에게 자궁 내 장치(IUD)가 없는지 확인합니다.
- 환자의 자궁에 IUD가 있는 경우, 자궁강 내 감염 위험이 증가했음을 알리고 UAE 전에 제거하겠다고 제안하십시오.
- 환자가 IUD 제거에 동의하지 않는 경우, 환자의 사전 동의서 또는 의료 기록에 해당 사실을 기록하십시오.
- 환자가 의약품, 조영제 및 소독제에 대한 알레르기 반응을 보고하고 해당 사실과 결과를 의료 기록에 기록하도록 합니다.
3. UAE 절차 수행
참고: 이것은 중재적 방사선 전문의와 마취과 의사를 대상으로 합니다.
- 멸균 상태에서 절차를 수행하십시오.
- 환자를 수술대에 눕히고 병원 소독제(적절한 승인 필요)를 사용하여 올바른 서혜부 부위를 광범위하게 소독합니다.
- 수술 부위(오른쪽 사타구니) 주위에 수술용 드레이프를 붙입니다.
- 마취 유형을 선택합니다: 국소 마취 또는 경막외 마취(EA)를 선택하고 의료 기록에 환자의 선택 사항을 기록합니다.
- 국소 마취하에 아랍 에미리트.
- 수술 부위에 마취 (피하 투여) 2 % 리그 노카인 용액.
- 필요에 따라 모르핀 5mg을 정맥 주사합니다.
- UAE 절차를 시작하기 전에 국소 마취가 작동하는지 확인하십시오.
- EA에 따른 UAE
- 환자가 EA에 적절하게 대비할 수 있도록 합니다.
- 수술용 드레이프를 접착하기 전에 EA를 수행하십시오.
- EA 시술을 받을 자격이 있는 환자가 다음과 같은 금기 사유가 없는지 확인하십시오: 시술 거부, 혈액 응고병증, 혈소판 감소증, 용혈성 질환, 항응고제 복용, 쇼크, 경막외 주사 부위 감염, 세균혈증, 국소 마취제 알레르기, 척추의 해부학적 기형, 두개내압 상승, 신경 질환, 중증 대동맥 또는 승모판 협착증94. 의료 기록에 그 사실을 주목하십시오.
- 마취과 의사에게 전화하여 EA를 요청하십시오.
- 요추 부위의 경막외 공간에 얇은 카테터를 삽입하고 마취제를 투여합니다(마취과 의사를 위한 절차).
- UAE 절차를 시작하기 전에 EA가 작동하는지 확인하십시오.
- UAE 절차
- 형광투시 지침에 따라 Angio Suit에서 UAE 절차를 수행합니다.
- Seldinger 기법95,96을 사용하여 혈관계에 접근합니다(그림 7, 그림 8 및 그림 9).
- 피그테일 카테터를 신장 동맥 바로 아래의 복부 대동맥에 삽입합니다.
- 혈관 조영술을 수행하여 혈관을 시각화합니다.
- 대동맥 초음파 검사를 수행하여 자궁근종에 공급되는 혈관의 해부학적 구조를 평가하고 절차를 계획합니다(그림 10).
- 자궁 동맥 골을 드러내기 위해 전방-후방 및 비스듬한 돌출부에서 내부 장골 동맥의 혈관 조영술을 수행합니다.
- 왼쪽에서 시작하여 오른쪽에서 시작하여 천공 부위와 카테터의 특정 모양으로 인해 오른쪽에서 시작하십시오. 혈관의 구경에 따라 주 카테터 또는 마이크로 카테터가 자궁 동맥에 선택적으로 삽입됩니다(그림 11).
- 카테터를 자궁 동맥 깊숙이 삽입한다. 혈관을 하이드로겔 입자로 색전술합니다. 크기가 약 500μm로 추정되는 자궁-난소 문합이 있기 때문에 색전술을 위한 입자의 권장 크기는 "비표적 색전술"의 위험을 줄이기 위해 700μm입니다.
- 혈관의 혈류가 완전히 차단될 때까지 색전술을 계속합니다. 치료의 종말점은 혈관의 조영제 정지이며, 이는 혈관의 효과적인 폐쇄를 증명합니다.
- 동일한 접근으로 반대쪽의 자궁 동맥 색전술을 수행합니다. 치료는 약 0.5 - 1.0 시간 동안 지속됩니다66,67 (그림 12).
- 대조군 혈관 조영술 중 내부 장골 동맥에 삽입된 카테터의 색전술 효과를 평가합니다. (자궁 동맥으로) 음영 혈액이 활발하게 유입되지 않는다는 것은 이 절차가 기술적으로 올바른 것으로 간주된다는 것을 나타냅니다(그림 13).
- 카테터를 조심스럽게 제거합니다.
- 압력 드레싱으로 수동 압축을 통해 펑크 부위를 닫고, 이는 다음 6시간 동안 유지되어야 하거나 폐쇄 장치를 사용해야 합니다(그림 14).
- 의료 기록에 UAE의 과정을 설명하십시오.
4. UAE 시술 후 환자 치료
참고: 이것은 산부인과 의사 또는 혈관 외과 의사 및 마취과 의사를 대상으로 합니다.
- 진통제 치료 시작: 환자 조절 진통제(PCA) 펌프 또는 EA.
- 환자와 함께 진통제 치료 옵션에 대해 알리고 논의합니다.
- 환자에게 EA가 PCA 펌프76에 비해 더 나은 통증 조절과 더 빠른 재활을 제공한다는 것을 알립니다.
- 의료 기록에서 그 사실과 환자의 선택을 주목하십시오.
- PCA 펌프를 사용한 색전술 후 통증의 진통제 치료.
- 모르핀 용액으로 PCA 펌프용 주사기를 준비합니다.
- PCA 펌프용 50mL 주사기에 모르핀 50mg과 0.9% NaCl(농도 1mg/mL) 용액을 채웁니다.
- 정맥 주사를 위해 PCA 펌프를 준비합니다.
- 배수구를 주사기에 연결합니다.
- 캐뉼라를 사용하여 정맥 천자를 삽입합니다.
- PCA 펌프에 주사기를 삽입합니다.
- 배수구를 채우고 PCA 펌프를 시작하십시오.
- START 버튼을 켭니다.
- PCA 펌프를 잠급니다.
- PCA 펌프 매개변수(아래 나열됨)를 설정합니다(그림 15).
경고! 모르핀을 더 많이 복용하면 호흡 억제를 유발할 수 있습니다.- 1mg/mL의 모르핀 농도를 사용하십시오. 0.5mg의 모르핀 주입 용량(정맥 주사)(Bolus p.)을 사용한 후 5분(호흡 억제를 방지하기 위해)의 다음 주문형 주입(잠금 간격/[Karencja])을 제공할 수 있습니다. 10초의 주문형 주입 중 모르핀 정맥 주사 시간을 사용하십시오.
- 위의 모든 단계가 완료되었는지 확인하십시오.
- PCA 펌프에서 최대 24시간 동안 모르핀을 주문합니다.
- NRS(Numerical Rating Scale)에 따라 통증을 모니터링합니다. 의료 기록의 NRS 값을 기록해 둡니다.
- 통증 평가 카드(PAC)를 사용합니다.
- 통증 증상이 나타나면 환자가 직접 "조이스틱"을 눌러 필요에 따라 약을 구해야 한다고 환자에게 알려 주십시오.
- 환자가 지침을 이해했는지 확인하십시오.
- 온디맨드 "정맥 주사 볼루스"에서 "빈 볼루스"까지의 양을 관찰하십시오(잠금 간격 동안 시작 - UAE 프로토콜 이후 환자 치료의 섹션 4.2.3)(그림 16).
- 주문형 "정맥 주사 볼루스"에 대한 "빈 볼루스"의 비율이 2/1(67% / 33%)보다 높은 값에 도달하면 아래 절차를 사용하십시오(그림 17, 그림 18).
- PCA 펌프를 사용한 통증 완화 요법의 효과를 높이고 모르핀 부작용의 위험을 줄이려면 파라세타몰 또는 비스테로이드성 항염증제를 정맥 주사 및 표준 용량에 사용하는 것이 좋습니다.
- 환자가 침대에서 일어나야 하는 상황을 돌본다.
- 펌프를 끄지 마십시오.
- 배수구를 분리하고 스토퍼로 고정하십시오.
- 환자가 돌아오면 배액관을 다시 연결하십시오.
- 모르핀 용액으로 PCA 펌프용 주사기를 준비합니다.
- EA를 이용한 색전술 후 통증의 진통제 치료.
- UAE 절차에 사용된 경우 EA를 계속합니다.
- UAE 시술에 국소 마취가 사용되었고 환자가 경막외 카테터를 삽입하기 전에 EA를 지시한 경우 CBC 및 응고 검사가 올바른지 확인하십시오.
- EA 시술에 적격한 환자가 UAE 시술 수행의 섹션 3.4.3에 설명된 모순이 없는지 확인합니다. 의료 기록에 그 사실을 주목하십시오.
- 마취과 의사에게 전화하여 EA를 요청하십시오.
- EA가 작동하는지 확인하십시오.
- 마취과 의사와 함께 EA 작업 모드(볼루스 또는 연속)를 결정합니다. 의료 기록에 그 사실을 주목하십시오.
- 연속 모드(CEA)에서는 마취과 의사와 상담하고 주입 펌프 설정을 확인하십시오.
- 볼루스 모드(BEA)에서 마취과 의사와 국소 마취제 투여 사이의 시간 간격에 대해 논의합니다.
- 필요에 따라 카테터를 24-48시간 동안 유지하십시오.
- NRS 척도로 통증을 모니터링하십시오. 의료 기록의 NRS 값을 기록해 둡니다.
- PAC를 사용합니다.
- 필요할 때까지 CEA/BEA를 48시간 이상 계속하지 마십시오.
- 필요한 경우 PCA 또는 EA 후 진통제 치료를 계속합니다.
- 파라세타몰 3 x 1.0g을 정맥 주사로 주문하십시오.
- Diclofenac 2 x 50 mg 직장 좌약을 주문하십시오.
- 위의 진통제 치료가 충분하지 않은 경우 보조 진통제를 포함하십시오.
- 케토프로펜 2 x 100mg을 정맥 주사로 주문하십시오.
- 요로 증상을 치료하려면 푸라지딘 3 x 100mg을 경구로 투여하십시오.
5. UAE 절차 후 대조군 방문
참고: 이것은 산부인과 의사를 대상으로 합니다.
- UAE 입국 후 첫날에 첫 번째 대조군 검사를 수행합니다.
- 환자의 전반적인 상태를 평가합니다.
- 환자의 체온을 측정합니다.
- NRS 척도에 따라 UAE 후 통증을 평가합니다. PAC를 사용합니다.
- 혈관 카테터가 삽입된 상처를 평가합니다.
- CBC 및 응고 테스트를 수행합니다.
- UAE 투여 후 골반 장기의 상태를 평가하기 위해 TVUS를 수행합니다.
- 부피 프로브를 사용하여 3D TVUS를 수행하여 섬유종(VI, FI 및 VFI)의 부피 및 혈관화 지수를 평가합니다.
- 합병증이 없고 색전술 후 통증이 경구 진통제로 조절된 경우 환자를 집으로 퇴원시킵니다.
- 입원 후 발열, 복통 및 화농성 질 분비물이 발생하면 환자는 즉시 의사의 진료를 받아야 한다고 환자에게 알립니다.
- UAE 3개월 후 다음 대조군 방문을 수행합니다.
- 부인과 검사, CBC 검사, AMH 또는 FSH 혈청 수치를 수행합니다.
- UAE 후 골반 장기의 상태를 평가하기 위해 MRI 또는 TVUS를 수행합니다(그림 19).
- 부피 프로브를 사용하여 3D TVUS를 수행하여 섬유종(VI, FI 및 VFI)의 부피 및 혈관화 지수를 평가합니다.
- UAE 입국 후 6개월 후에 마지막 대조군 방문을 수행합니다.
- 부인과 검사, CBC 검사, AMH 또는 FSH 혈청 수치를 수행합니다.
- UAE 투여 후 골반 장기의 상태를 평가하기 위해 TVUS를 수행합니다.
- 부피 프로브를 사용하여 3D TVUS를 수행하여 섬유종(VI, FI 및 VFI)의 부피 및 혈관화 지수를 평가합니다.
- UAE의 효과를 평가합니다.
- UAE 전후의 CBC 테스트 결과를 비교합니다.
- UAE 전후의 자궁근종(VI, FI 및 VFI)의 부피와 혈관화 지수를 비교합니다.
- UAE 전후의 혈청 AMH 또는 FSH 수치를 비교하여 "비표적" 색전술의 결과로 UAE 기간 동안 난소의 의인성 손상 가능성을 평가합니다.
- 환자에게 자궁 동맥 색전술 후 정기적인 부인과 검진을 받아야 한다고 알립니다.
- 일부 사례(자궁근종 증상의 감소가 없거나, 조직 경계가 의심되거나, 다른 추가 검사에서 의심이 없는 경우)에서는 UAE 발병 1년 후 MRI를 실시한다(그림 20).
결과
2009년부터 2019년까지 UAE에서 557건의 시술이 수행되었습니다. 환자의 평균 연령은 38세(31-53세)였다. 547명(98.2%)의 환자에서 기술적 성공이 이루어졌습니다.
2009년부터 2013년까지 32세에서 52세(평균 연령: 39세)의 환자 206명으로 구성된 그룹에서 UAE 시술 3개월 후 자궁근종의 평균 감소(MRI 부피 평가)는 62%였습니다. 가장 작은 감소는 9%(히알린화 자궁근종 환자)였다. 분리된 점막하 섬유종(FIGO 0)이 있는 환자에서 완전한 감소(100%)가 달성되었습니다. 환자의 90%가 UAE 시술 후 만족감을 보고했다64.
29-52세(평균 연령: 43.1세)의 환자 65명에서 UAE(초음파 보컬 볼륨 평가) 후 3개월 후 자궁근종의 평균 감소는 50.1%(2.7%-93.5%)였습니다. UAE 시술 전에는 자궁근종 부피 중앙값이 101cm3(범위 23.6 - 610.0cm3)였던 반면, 3개월 후에는 자궁근종 부피 중앙값이 50.4cm3(범위 6.9 - 193.9cm3)로 감소하는 것이 관찰되었습니다. Spearman 상관 관계 검사는 초기의 우세한 섬유종 부피와 백분율 부피 감소 사이에 통계적으로 유의하지만 상대적으로 약한 양의 상관관계(R = 0.33; p = 0.006)를 보여주었습니다. 흥미롭게도, 작은 자궁근종은 UAE 접종 후 3개월에 자궁근종 부피 감소의 큰 변동성을 보인 반면, 큰 자궁근종은 UAE72에 대해 안정적이고 예측 가능한 반응을 보였다.
UAE 발병 3개월 후 17명의 환자 그룹에서 도플러 혈관 지수(VI, FI 및 VFI)의 감소가 관찰되었습니다. VI 및 VFI의 감소율은 95.4%인 반면 FI의 감소율은 58.3%75였습니다.
난소 예비력 평가는 UAE 3개월 후 33-40세(평균 연령: 35세)의 환자 30명을 대상으로 수행되었습니다. 평균 우성 자궁근종 부피는 107.75 cm3 (87.4 - 131.1 cm3 범위)였다. 난소 예비력의 다음 마커를 조사했습니다: 전방 여포 수(AFC), AMH, 인히빈 B(INHB), FSH 및 에스트라디올(E2). AFC(56.7%; p < 0.001), AHM(36.7%; p < 0.001), INHB(46.7%; p < 0.001), E2(43.3%; p < 0.001)에서 유의한 감소가 관찰되었다. 동시에 FSH 혈청 수치의 유의한 증가(43.4%; p < 0.001)가 관찰되었다65.
UAE 시술 3개월 후, 점막하 근종(FIGO 0) 환자 2명(직경 6cm 및 8cm)에서 자궁경관을 통해 뚜렷한 괴사 자궁 근종 조각이 배설되는 동안 자궁 역전이 관찰되어 응급 자궁 절제술이 시행되었습니다.
UAE 시술 다음 날 60명의 환자를 대상으로 PCA(UAE 의정서 후 환자 치료의 절차 4.2)를 사용하여 색전술 후 통증 감소(PAC에 따름)를 평가했습니다. UAE 발병 직후 NRS 중앙값은 10(범위 5-10)이었고, 치료 후 NRS 중앙값은 4(범위 1-5)였다. UAE 투여 직후 자궁근종의 초기 용적(중앙값 194.5 cm3, 범위 79–411 cm3)과 NRS 사이의 Spearman's correlation test는 통계적으로 유의하고 강한 양의 상관관계를 보인 반면(R = 0.6; p < 0.001), 치료 후 자궁근종의 초기 용적과 NRS 사이의 상관관계는 통계적으로 유의하고 약한 양의 상관관계를 보였다(R = 0.34; p < 0.001). 위의 관계를 분석하면 UAE 이후의 주요 자궁 근종이 UAE 후 색전술 후 더 강한 통증을 유발한다는 결론을 내릴 수 있습니다. 그러나 PCA를 사용하여 더 작은 자궁 근종의 UAE 후 색전술 후 통증을 치료하면 더 나은 결과를 얻을 수 있습니다.
대표 결과에 대한 요약 데이터는 표 1에 나와 있습니다.
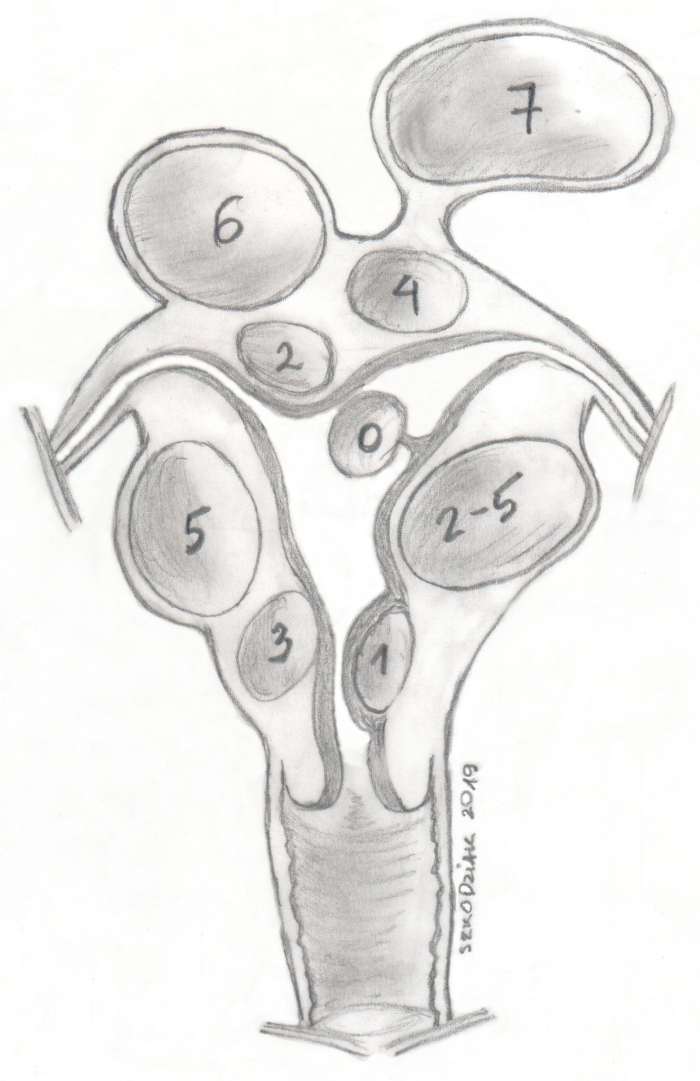
그림 1: FIGO 자궁 근종 분류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
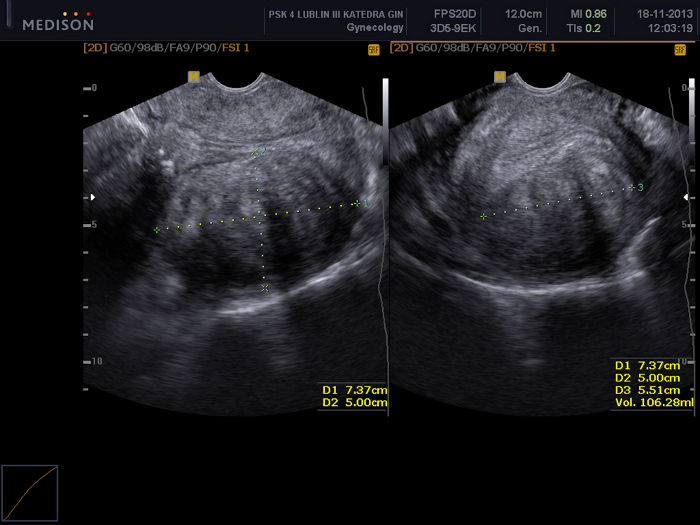
그림 2: 경질 초음파 스캔을 사용한 골반 검사.
73 x 50 x 55mm 크기의 자궁 근종(FIGO 5)이 보입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: UAE에 대한 사전 적격성 평가에서의 골반 MRI 검사.
시상 단면에서 볼 수 있는 큰 자궁 근종(FIGO 2-5)은 종괴 효과가 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: UAE의 사전 적격성 평가에서 골반 MRI 검사.
시상 단면에서 볼 수 있는 자궁 근종(FIGO 2–5). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
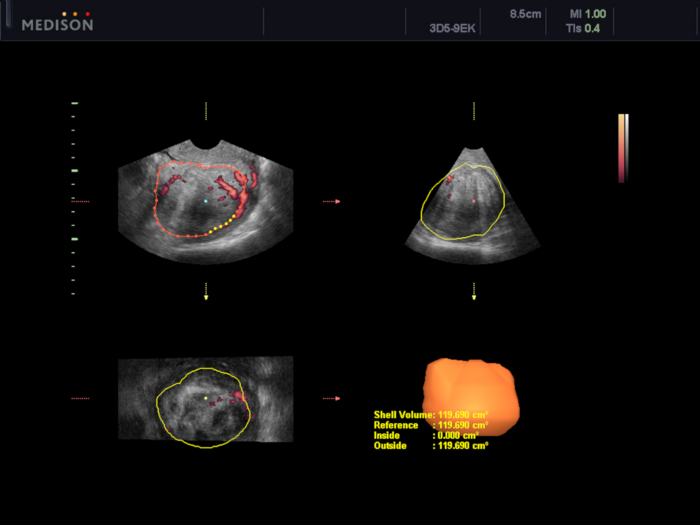
그림 5: VOCAL 소프트웨어를 사용한 자궁 근종의 부피 평가.
이 경우 부피는 119.7cm3로 추정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
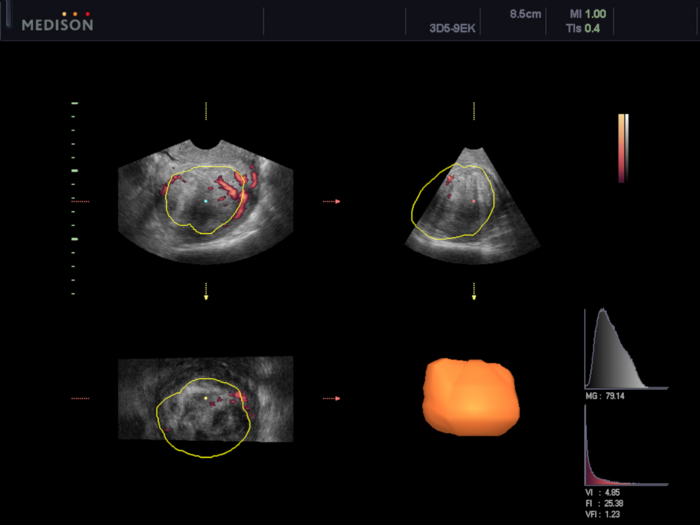
그림 6: VOCAL 소프트웨어를 사용한 자궁 근종의 혈관형성 평가.
이 경우, 혈관형성 지수를 계산하였다(VI 4.85, FI 25.38, VFI 1.23). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
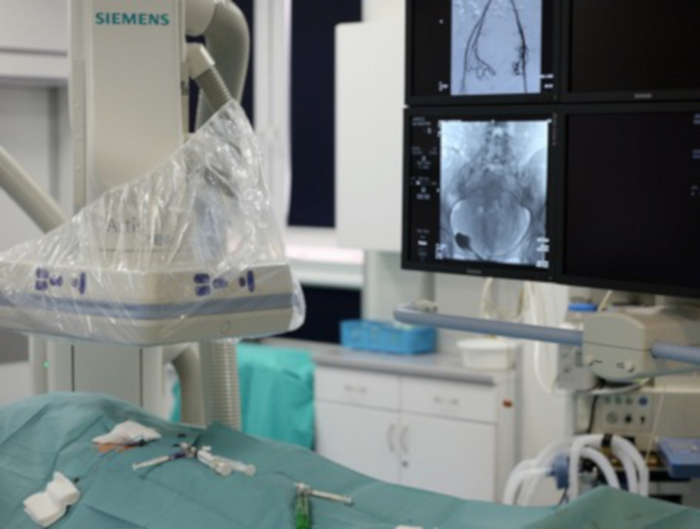
그림 7: 그림은 혈관 조영술 실험실의 일부를 보여줍니다.
왼쪽 하단 모서리에는 사타구니가 노출된 환자가 더 많은 도구가 도입됩니다. 왼쪽 상단 모서리에서 혈관 조영술의 C-arm을 볼 수 있습니다. 오른쪽 위 모서리에는 운영자가 입력 도구를 추적하는 모니터가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 동맥 천자를 위한 세트.
아래에서: 바늘, 도입기가 있는 혈관 잠금 장치, 가이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
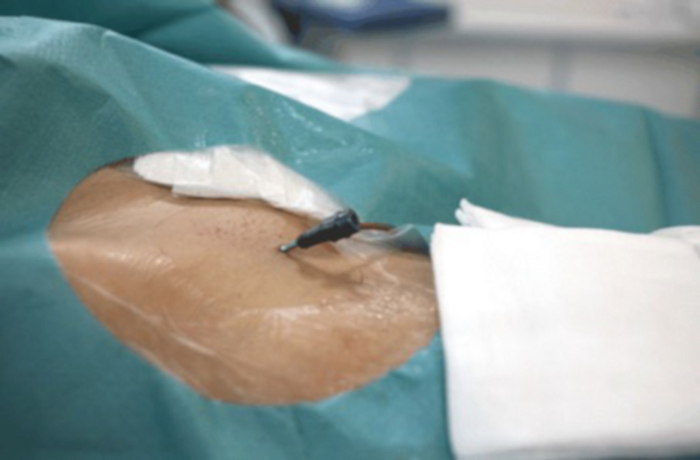
그림 9: 대퇴 동맥에 삽입된 눈에 보이는 혈관 잠금이 있는 사타구니 클로즈업. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
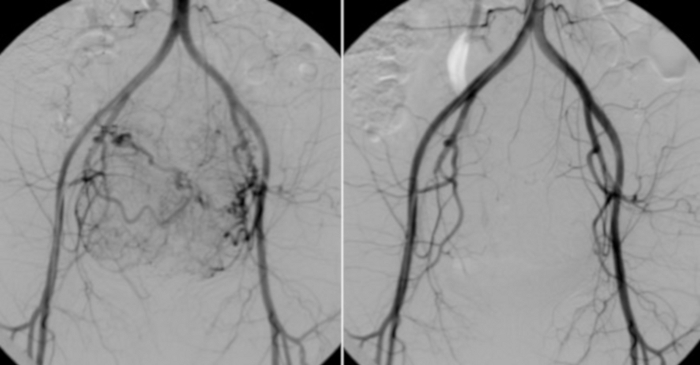
그림 10: 왼쪽은 복부 대동맥에 삽입된 카테터의 혈관 조영술.
자궁 근종의 눈에 보이는 혈관 베어링. 비교를 위해(오른쪽), UAE 이후에 수행된 대조군 테스트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
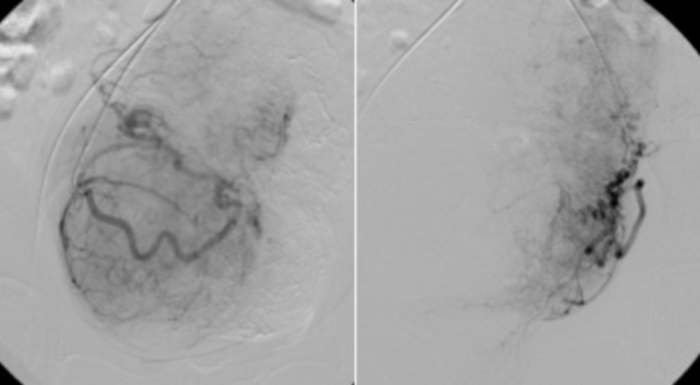
그림 11: 자궁 동맥 근위부에 삽입된 RUC 카테터를 사용한 선택적 혈관 조영술.
자궁 근종의 눈에 보이는 혈관층. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
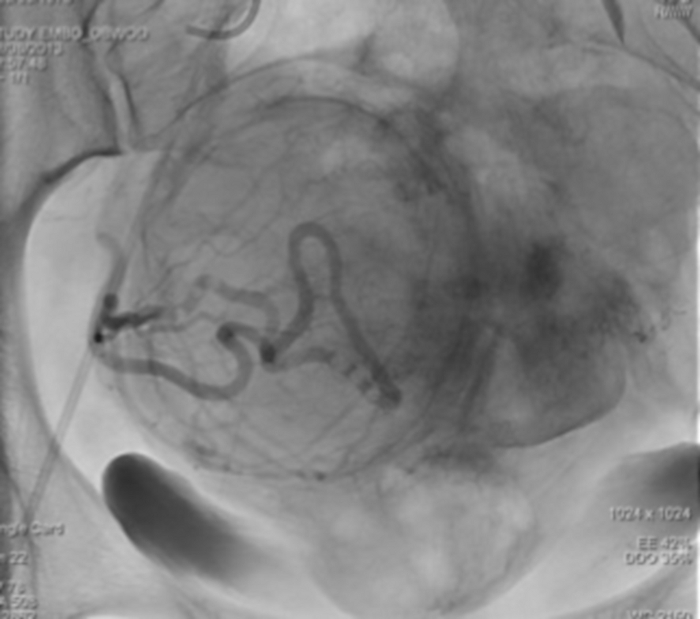
그림 12: 우측 자궁 동맥에 있는 조영제의 정체를 보여주는 단일 X-ray 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 13: 좌측 및 우측 장골 동맥에 각각 위치한 주 카테터에서 수행된 대조 혈관 조영술은 자궁 동맥으로 신선한 혈액이 유입되지 않음(음영)을 확인했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 14: UAE 완공 후의 혈관 접근 부위.
오른쪽 사타구니 근처에 2mm 절개가 보입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 15: UAE 치료 후 색전술 후 통증에 대한 PCA 펌프 매개변수 설정(UAE PROTOCOL 후 환자 치료의 섹션 4.2.3). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 16: 작동 중인 PCA 펌프.
주문형 정맥 주사 볼루스와 "빈 볼루스"의 비율(UAE PROTOCOL 이후 환자 치료의 섹션 4.2.6.2.) 1:1(50%:50%). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 17: 작동 중인 PCA 펌프.
주문형 정맥 주사 볼루스 대 "빈 볼루스"의 비율(UAE 의정서 이후 환자 치료의 섹션 4.2.6.3.) 1:2(33%:67%). 이를 위해서는 추가 진통제 치료가 필요합니다(UAE 의정서 이후 환자 치료의 절차 4.2.6.4.). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 18: 작동 중인 PCA 펌프.
주문형 정맥 주사 볼루스와 "빈 볼루스"의 비율(UAE 의정서 이후 환자 치료의 섹션 4.2.6.3.) 1:3(25%:75%). 이를 위해서는 지속적인 추가 진통제 치료가 필요합니다(UAE 의정서 이후 환자 치료의 절차 4.2.6.4.). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
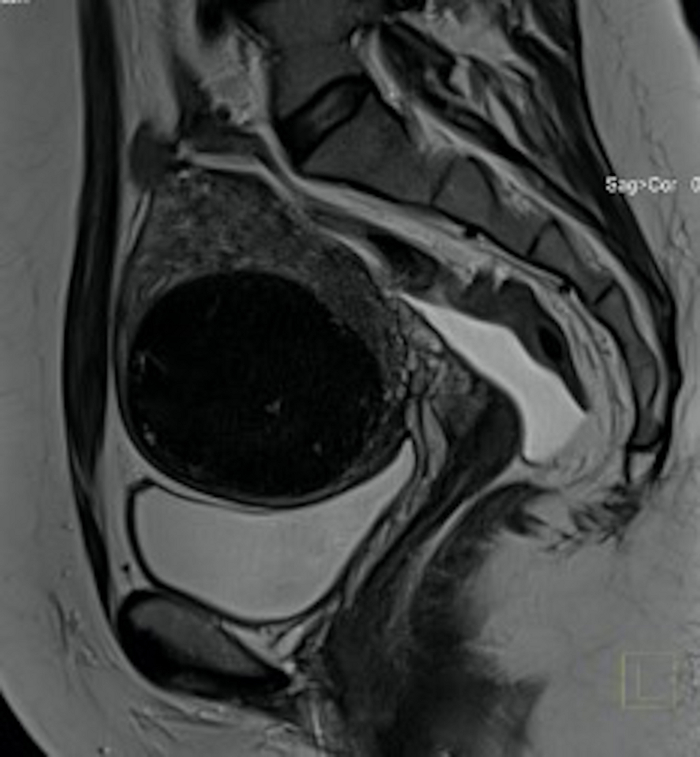
그림 19: UAE 시술 3개월 후 골반 MRI 검사(그림 3과 동일한 경우).
시상 부분에서 볼 수 있는 것은 자궁 근종(FIGO 5)으로, 시술 전보다 훨씬 작으며 섬유종 조직의 밀도가 다릅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
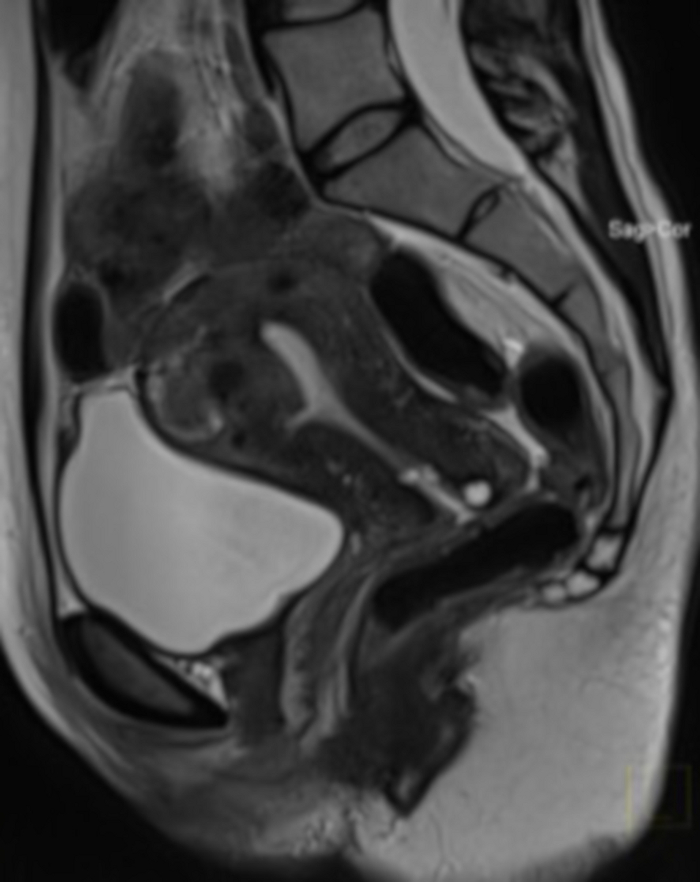
그림 20: UAE 시술 1년 후 골반 MRI 검사(그림 4와 동일한 경우).
시상절에서 볼 수 있는 것은 자궁 근종(FIGO 2-5)으로, UAE 이후 매우 큰 부피 감소가 있습니다. MRI는 시술 후 조직 경계가 의심되어 수행되었습니다(양수동 검사에서 자궁근종 구조를 평가할 가능성 없음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 대표적 결과 / 루블린 프로토콜 64,65,72 | ||
| 2009년부터 2019년까지 UAE에서 수행된 시술 건수 | 557 | |
| 기술적 성공 | 547명의 환자에서 달성 (98.2%) | |
| 32세에서 52세(평균 연령 - 39세)의 환자 206명으로 구성된 그룹에서 UAE 투여 3개월 후 자궁근종의 평균 감소(MRI 부피 평가) | 62.0% (9.0-100.0%) | |
| 29-52세(평균 연령 – 43.1세)의 환자 65명으로 구성된 그룹에서 UAE 3개월 후 자궁근종량의 평균 감소(초음파 보음성 평가) | 50.1% (2.7-93.5%) | |
| 난소 예비력 평가 | AFC 감소 | 56.7% (<0.001쪽) |
| AMH 감소 | 36.7% (P<0.001) | |
| INHB의 감소 | 46.7% (P<0.001) | |
| E2 감소 | 43.3% (<0.001쪽) | |
| FSH 증가 | 43.4% (<0.001쪽) | |
| 60명의 환자 그룹에서 평가된 PCA("UAE 후 환자 치료" 프로토콜의 절차 2)를 사용하여 색전술 후 통증 감소(PAC에 따름) | UAE 직후의 NRS 중앙값 | 10(범위 5-10) |
| UAE 다음 날의 NRS 중앙값 | 4(범위 1-5) | |
표 1: 루블린 프로토콜에 따라 수행된 증상이 있는 자궁 근종 치료에 대한 UAE 기술의 대표적인 결과.
토론
자궁근종의 구조, 크기, 국소화 및 증상의 차이로 인해 통일된 UAE 프로토콜을 만드는 것은 쉬운 일이 아니었습니다. 이 치료법의 가정과 적격성 평가 단계와 치료 효과 모두에서 환자의 기대에 대해 많은 불일치가 있었습니다. UAE에 의뢰된 환자들은 자궁근종의 임상적 징후를 보고하지 않았으며, 이러한 자궁 종양이 근본적으로 제거되지 않을 것이라는 사실을 알지 못하는 경우가 여러 차례 있었습니다. 유일하게 명백한 기대는 수술 없이 자궁근종을 제거하는 것이었습니다.
따라서 환자가 이 방법의 가정을 이해하고, 이를 받아들이고, 자궁 근종 치료의 대체 방법에 대한 차이점을 아는 것이 중요합니다. 그녀의 의식적인 선택(UAE 의정서 자격 요건 1.1항)은 중요한 포인트이며, 이 의정서의 적절한 이행은 의정서가 지속될 수 있도록 할 것입니다.
프로토콜을 구현하는 동안 일부 절차가 반복됩니다. 이것은 이 저널에서 채택한 공식의 의도이며 결과이며, 개별 명령은 명령형 모드로 작성되고 한 사람에게 전달됩니다. 그러나 여러 의사가 자격, 준비 및 기타 UAE 단계에 참여하는 경우가 많습니다. 이것들은 또한 프로토콜의 중요한 포인트입니다. 그들의 누락은 최적이 아닌 조건 또는 금기 사항의 존재와 함께 UAE에서 발생할 수 있습니다. 따라서 프로토콜은 5개의 장으로 나뉩니다. 이를 통해 다양한 전문가가 계속할 수 있으며 반복되는 프로토콜 포인트는 독립적으로 확인됩니다.
자궁근종 치료에서 자궁동맥 색전술의 통일된 프로토콜을 만드는 데 있어 또 다른 어려움은 현재 동일한 절차와 관련된 많은 수의 권장 사항(최대 11개)이 있다는 것입니다41. 그들의 가정은 비슷하지만, 항상 그렇듯이 "악마는 세부 사항에 있습니다", 세부 사항에는 통일이 필요했습니다. UAE를 받는 환자의 자궁근종의 위치 또는 생식 계획에 관한 상대적 금기 사항은 자격 심사 과정에서 가장 논란이 되는 사항입니다. SOGC가 제안한 보다 엄격한 기준을 적용하여 환자는 이 절차에서 제외되어야 하며, 보다 자유로운 RCOG 권장 사항은 UAE 14,32,43에 대한 자격을 허용합니다. 문제는 무엇을해야합니까? 임상시험계획서를 만드는 동안, 우리는 (광범위한 문헌을 제외하고) 우리의 사례와 얻은 경험에 대한 분석을 기반으로 결정을 내렸으며, 이를 위해서는 각 환자에 대한 개별적인 접근이 필요합니다. 그러므로, 이 프로토콜은 상대적 금기 사항이 있는 환자에 대한 UAE의 수행을 배제하지 않습니다(UAE 프로토콜 자격 섹션 1.4). UAE에 대한 올바른 자격과 준비가 치료 성공의 열쇠인 것 같습니다. 기술 자체뿐만 아니라 UAE 치료도 매우 중요하며, 이는 치료의 성공이나 환자 만족도뿐만 아니라 위에서 설명한 합병증의 부재를 보장합니다.
자궁근종의 수에 관계없이 모든 병변은 한 번의 시술로 색전술됩니다. 일반적으로 자궁 근종이 많을수록 주입 될 색전술 물질이 더 많아집니다. 이렇게 하면 색전술 기간이 연장되지만 절차가 변경되지는 않습니다. UAE는 난소 동맥에 대한 명백한 연관성이 확인되면 변형될 수 있으며, 이는 비표적 색전술의 위험을 증가시킬 수 있습니다. 그런 다음 이러한 연결을 닫을 수 있으며(예: 코일 사용) 난소와 자궁의 공급을 분리한 다음 700μm 입자를 사용하여 색전술을 계속할 수 있습니다. 코일을 이식 할 수 없으면 입자 직경을 900μm로 늘립니다.
또한 자궁근종이 난소 동맥 측면에서 공급될 수 있는 경우도 있습니다. 그런 다음 자궁 동맥은 저형성 상태입니다. 이러한 경우, 색전술을 성공적으로 수행하기 위해서는 마이크로 카테터를 난소 동맥에 삽입하고 난소를 지나 색전술 물질을 자궁 혈관층에 축적하면서 적절한 난소 공급을 유지해야 합니다.
색전술의 의심할 여지 없는 장점은 기술적으로 어려운 절차가 아니며 정교한 장비가 필요하지 않다는 사실입니다.
이 프로토콜의 강점은 색전술 후 통증 치료에 관한 요점인데, UAE 입국 자격을 갖추었을 때 환자의 절반 이상이 이에 대해 들어본 적이 없었습니다. 우리가 제안하는 표준 절차는 PCA 펌프의 사용이며(UAE 의정서 이후 환자 치료 섹션 4.2), 얻은 결과는 이러한 치료의 높은 효과를 확인합니다.
UAE 의정서의 향후 수정과 관련하여, 염증과 패혈증의 위험으로 인해 시술 전에 자궁에서 IUD를 제거하도록 요구하는 UAE 의정서 준비의 섹션 10을 변경할 수 있을 것으로 보입니다. 대규모 추적 연구에서 IUD의 존재와 결합된 골반 감염 위험은 1300명 중 1명 미만이었다49.
UAE는 처음 사용된 이래로 이 절차가 단기 및 장기적으로 제공할 수 있는 합병증을 조사하고 효과를 평가해야 했기 때문에 실험 방법으로 취급되었습니다. 이 기간 동안 적응증 및 금기 사항은 새로운 테스트 결과와 임상 관찰에 따라 수정되었습니다. 여러 무작위 대조 연구를 포함한 최신 데이터는 UAE를 효과와 안전성이 잘 확립된 증상이 있는 자궁 근종에 대한 가치 있는 치료 방법으로 인정하고 있습니다.
위 프로토콜의 제정은 10년 동안 산부인과 전문의와 외과 방사선 전문의의 긴밀한 협력의 결과로 얻은 최신 문헌, 관련 권장 사항 및 경험에 대한 철저한 분석 덕분입니다.
공개
저자는 공개할 내용이 없습니다.
성명서:
FIGO 자궁 근종 분류를 보여주는 그림 1의 저자인 Piotr Szkodziak은 수정 없이 과학 및 교육 응용 프로그램에 그림을 무료로 사용할 수 있습니다. 그림을 수정하려는 의도는 저자가 수락해야 합니다(piotr.szkodziak@gmail.com).
감사의 말
저자는 자궁 동맥 색전술 루블린 프로토콜을 구현하는 데 도움을 준 루블린 의과대학 산부인과 및 중재 방사선 및 신경방사선과 3대 의장 및 부서의 전체 팀에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
참고문헌
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109(2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), London, England. 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242(2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists. , Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013).
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK). , Available from: https://www.nice.org.uk/guidance/cg44 (2007).
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507(2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381(2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126(2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), Part 2 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Uterine artery embolization for fibroids (Interventional procedures guidance [IPG367]). Nice Guidelines. National Institute for Health and Clinical Excellence (NICE). , Available from: http://publications.nice.org.uk/uterine-artery-embolization-for-fibroids-ipg367 (2010).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, suppl 1 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1(2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유