Method Article
Das Lubliner Protokoll der Embolisation der Uterusarterien bei der Behandlung symptomatischer Uterusmyome
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Im Folgenden stellen wir eine Methode zur Embolisation der Gebärmutterarterie zur Behandlung symptomatischer Uterusmyome vor, die in fünf Abschnitte unterteilt ist: Qualifizierung, Vorbereitung, Durchführung, Nachsorge und Nachsorgebesuche. Dieses Protokoll erfordert eine enge Zusammenarbeit zwischen Gynäkologen und interventionellen Radiologen, um die ordnungsgemäße Durchführung des oben genannten Eingriffs zu ermöglichen.
Zusammenfassung
Uterusmyome sind gutartige Tumoren, die aus glattem Muskelgewebe stammen und das Uterusmuskelstroma bilden. Uterusmyome sind die häufigsten gutartigen Tumoren bei Frauen. Bei 20 % bis 50 % der Frauen sind die Myome asymptomatisch und erfordern keine Behandlung. Die Hauptsymptome von Uterusmyomen sind starke Menstruationsblutungen, abnormale Gebärmutterblutungen und Drucksymptome. Drucksymptome können das Beckenschmerzsyndrom, Störungen beim Wasserlassen und Verstopfung verursachen.
Zu den Behandlungsmethoden, die derzeit angewendet werden, gehören die chirurgische Behandlung, die pharmakologische Therapie und minimalinvasive Eingriffe. Die am häufigsten angewandte minimal-invasive Methode ist die Embolisation der Gebärmutterarterien. Dieses Verfahren ist derzeit eine weithin akzeptierte Methode zur Behandlung von symptomatischen Uterusmyomen und wurde vom National Institute for Health and Clinical Excellence in den Leitlinien für starke Menstruationsblutungen als solche anerkannt.
Dies ist ein komplizierter Eingriff und erfordert eine enge Zusammenarbeit zwischen Gynäkologen und interventionellen Radiologen. Wir stellen ein Protokoll vor, das auf die Embolisation der Uterusarterie bei der Behandlung von symptomatischen Uterusmyomen anwendbar ist. Das Protokoll ist in fünf Abschnitte unterteilt. Die ersten beiden Abschnitte richten sich an Gynäkologen und interventionelle Radiologen und erklären Schritt für Schritt, wie ein Patient für die Embolisation qualifiziert und vorbereitet wird. Abschnitt drei, der sich an interventionelle Radiologen richtet, erklärt, wie eine Embolisation durchgeführt werden sollte. Der vierte Abschnitt richtet sich an Gynäkologen oder Stationsärzte, die die Patientinnen nach der Embolisation betreuen. Dieser Abschnitt des Protokolls bietet eine Methode zur Behandlung von Schmerzen nach der Embolisation mit der Patient Controlled Analgese (PCA) Pumpe. Der fünfte Abschnitt schließt das Verfahren mit einer Beurteilung der Auswirkungen und Spätkomplikationen der Embolisation der Gebärmutterarterie ab.
Alle fünf Sektionen erstellen ein einheitliches Protokoll, das sich an Kliniker, Experten und Forscher richtet, die neu auf diesem Gebiet sind.
Einleitung
Uterusmyome sind gutartige Tumoren, die aus glattem Muskelgewebe stammen und das Uterusmuskelstroma bilden. Es handelt sich um monoklonale Tumoren, die aus einer großen Menge extrazellulärer Substanzen bestehen, die Kollagen, Fibronektin und Proteoglykane enthalten. Die Myome sind von einer dünnen Pseudokapsel umgeben, die aus komprimierten Muskelfasern, Kollagenfasern, Neurofasern und Blutgefäßen besteht 1,2. Die Pathophysiologie der Myome ist nicht vollständig verstanden, scheint sich aber hauptsächlich auf die monoklonale Proliferation zu stützen, die durch selektive und gewebespezifische epigenetische Veränderungen verursachtwird 3. Es wurde kein einzelnes Gen gefunden, das Uterusmyome verursacht. Das Vorhandensein seltener uteriner Myomsyndrome, wie z. B. der multiplen kutanen und uterinen Leiomyomatose, wurde jedoch auf ein Gen zurückgeführt, das für die Fumarathydratase kodiert, ein mitochondriales Enzym, das am Krebszyklus beteiligt ist4. Das Vorhandensein von Chromosom 7-Deletionen und -Translokationen in den Chromosomen 7, 12 und 14, die bei 50% der Myome auftreten, scheint eher sekundär als primär zu sein 5,6,7.
Die Regulatoren des Wachstums von Uterusmyomen sind Steroidhormone, die von den Eierstöcken (Östrogene und Progesteron), Wachstumsfaktoren, Angiogenese und Apoptose produziert werden. Es wurden auch Risikofaktoren für die Entwicklung von Uterusmyomen identifiziert, darunter Alter, frühe Menarche, afroamerikanische Rasse, Vererbung, Nulliparität, Fettleibigkeit, polyzystisches Ovarialsyndrom, Diabetes, Bluthochdruck, Vitamin-D-Mangel, Konsum von Sojamilch, Alkohol und Koffeinkonsum8.
Uterusmyome sind die häufigsten gutartigen Tumoren der Fortpflanzungsorgane bei Frauen. Diese Tumoren wurden erstmals 1793 von Matthew Baillie am St. George's Hospital in London beschrieben. Die verfügbaren epidemiologischen Daten geben die Inzidenz von Uterusmyomen nicht genau an, da ihr großer Anteil nicht diagnostiziert wird. Es wird geschätzt, dass Uterusmyome bei 5,4 % bis 77 % aller Patientinnen auftreten. Ihre Prävalenz ist in den Vereinigten Staaten höher als in Europa, was wahrscheinlich auf Rassenunterschiede zurückzuführenist 8.
Bei Frauen im gebärfähigen Alter können etwa 30 % der Myome klinische Symptome in Form von abnormalen Uterusblutungen hervorrufen, was bei Patienten zu einer unzureichenden Blutversorgung führt9. In den meisten Fällen haben die Patientinnen mehr als ein Myom, bei denen es sich um kugelförmige Läsionen handelt, die sich in der Gebärmutter befinden. Ihre Abmessungen und Lage können variieren. In 90% der Fälle befinden sie sich im Körper der Gebärmutter. Ihr Durchmesser kann zwischen einigen Millimetern und 20 cm10 liegen.
Die FIGO-Klassifikation (Fédération Internationale de Gynécologie et d'Obstétrique) unterteilt sie in Gruppen von 0 bis 8, abhängig von der Nähe des Endometriums (je niedriger die Anzahl, desto näher ist das Endometrium) (Abbildung 1)11. In etwa 50 bis 75 % der Fälle sind die Myome asymptomatisch. Die häufigsten Symptome von Uterusmyomen sind starke Menstruationsblutungen, abnormale Gebärmutterblutungen und Drucksymptome. Myome sind mit etwa 10 % der Fälle von Unfruchtbarkeit verbunden, und in 1 % bis 3 % sind sie die einzige Ursache12. Asymptomatische Uterusmyome werden in der Regel nur einer regelmäßigen ärztlichen Kontrolle unterzogen, während symptomatische Myome eine Indikation für eine Behandlung sind13.
Zu den Behandlungsmethoden für Uterusmyome, die derzeit angewendet werden, gehören die chirurgische Behandlung, die pharmakologische Therapie und die minimalinvasiven Verfahren 13,14,15,16,17,18. Die chirurgische Behandlung umfasst die Myomektomie (abdominale und hysteroskopische) und Hysterektomie. Sowohl die Myomektomie als auch die Hysterektomie wirken sich positiv auf die Lebensqualitätaus 19. Die Hysterektomie ist mit einem irreversiblen Verlust der Fruchtbarkeit verbunden. Daher suchen viele Frauen nach anderen Behandlungsmöglichkeiten20.
Die abdominale Myomektomie ermöglicht die Erhaltung der Fruchtbarkeit. Abhängig von der Größe und Anzahl der Myome sowie der Erfahrung des Chirurgen kann dieser Eingriff per Laparotomie oder Bauchspiegelung durchgeführt werden. Obwohl Blutungen seltener sind als bei der Hysterektomie, ist die Gesamtmorbidität ähnlich. Die hysteroskopische Myomektomie ist eine sicherere, weniger invasive Methode als die abdominale Myomektomie und ermöglicht die Behandlung von submukösen Myomen (FIGO 0). Nachfolgende hysteroskopische Eingriffe können erforderlich sein, um größere Typ-2-Myome vollständig zu entfernen21.
Levonorgestrel freisetzende Intrauterinpessare sind eine wirksame Behandlung für starke Menstruationsblutungen, aber sie reduzieren nicht die Größe der Myome. Ihre Verwendung ist bei Patienten mit deformierter Gebärmutterhöhle eingeschränkt. GnRH-Analoga werden hauptsächlich als präoperatives Mittel eingesetzt, um die Größe von Myomen und den perioperativen Blutverlust zu reduzieren. Sie reduzieren auch den Prozentsatz der vertikalen Schnitte während der Hysterektomie und Myomektomie und erhöhen gleichzeitig die Möglichkeit eines vaginalen Eingriffs20.
Kurzfristig reduzieren selektive Progesteronrezeptor-Modulatoren das Myomvolumen und induzieren Amenorrhoe. Die langfristige Wirksamkeit und Sicherheit bedarf jedoch weiterer Forschung. Neben Aromatasehemmern kann es andere Optionen zur präoperativen Behandlung der Anämie und zur Verringerung des Myomvolumens geben22. Einige Studien deuten darauf hin, dass Vitamin D das Wachstum von Myomen und das Auftreten von Symptomen verlangsamen oder verhindern kann23.
Neue Methoden, bei denen 2-Methoxyestradiol in Kombination mit Nanopartikeln verwendet wird, befinden sich ebenfalls in der Entwicklung24. Zu den minimalinvasiven Methoden, die bei der Behandlung von Myomen eingesetzt werden, gehören die Embolisation der Uterusarterie (UAE), die magnetresonanzgesteuerte fokussierte Ultraschallchirurgie (MRgFUS), der laparoskopische Verschluss der Uterusarterie (LUAO) und die Radiofrequenzmyolyse14,25. Der ultraschallgesteuerte hochintensive fokussierte Ultraschall (US-HIFU) ist ein neues, noch experimentelles, minimal-invasives Verfahren 26,27.
Vor über 120 Jahren wurden Methoden des therapeutischen Gefäßverschlusses und der Blockade der Blutversorgung der Gebärmutter erwähnt. Im Jahr 1894 stellte Kelly die Ligatur der Arteria iliaca interna während einer onkologischen Hysterektomie vor, um hartnäckige Beckenblutungen zu kontrollieren, die zu dieser Zeit eine häufige Komplikation nach dem chirurgischen Eingriff waren28. Dann beschrieb Sack (1973) die effektive Anwendung der gleichen Technik bei der Behandlung massiver postpartaler Blutungen nach der Zangengeburt. In beiden Fällen wurde die Blutstillung ohne Hysterektomie erreicht29. Im Jahr 1979 beschrieben Heaston et al. und Brown et al. unabhängig voneinander die Embolisation der Beckenarterien mit resorbierbaren Gelatineschwämmen zur Kontrolle der postpartalen Blutung 30,31.
Die Vereinigten Arabischen Emirate wurden erstmals 1991 in Frankreich als Behandlungsmethode für symptomatische Uterusmyome eingesetzt32. Es wurde ursprünglich verwendet, um den Blutverlust nach einer Myomektomie zu reduzieren. Im Jahr 1995 schlugen Ravina et al. dieses Verfahren als primäre Behandlungsmethode für symptomatische Uterusmyome vor33. In den Vereinigten Staaten wurde die Embolisation der Gebärmutterarterie 1997 erfolgreich durchgeführt34.
Das wachsende Interesse an der Erhaltung der Gebärmutter bei Frauen mit symptomatischen Myomen bringt die VAE an die Spitze der minimal-invasiven Myombehandlung 14,18,35,36,37. Im Jahr 2000 wurde die gemeinsame Arbeitsgruppe des Royal College of Obstetricians and Gynecologists und des Royal College of Radiologists gegründet, um Richtlinien zu den VAE herauszugeben. Zu dieser Zeit galten die VAE als experimentelle Methode (weltweit wurden weniger als 7.000 Eingriffe durchgeführt). Seit der Veröffentlichung der Richtlinien wurden weltweit mehr als 100.000 Eingriffe in den VAE durchgeführt. Außerdem wurden fünf randomisierte kontrollierte Studien durchgeführt, in denen die VAE mit anderen chirurgischen Verfahren verglichen wurden. Forschungsergebnisse deuten darauf hin, dass die VAE kurz- bis mittelfristig (bis zu einigen Jahren) hochwirksam sind und ein geringes Risiko für mittlere (z. B. Gebärmutterinfektionen) und schwere (lebensbedrohliche) Komplikationen aufweisen38,39. In randomisierten Studien sprachen kürzere Krankenhausaufenthalte, eine schnellere Genesung und die Rückkehr zu täglichen Aktivitäten für die VAE. Chirurgische Eingriffe erwiesen sich als kostengünstiger und erforderten seltener einen erneuten Eingriff bei gleichzeitiger statistischer Signifikanz32. Dieses Verfahren ist derzeit eine weithin akzeptierte Methode zur Behandlung von symptomatischen Uterusmyomen und wurde vom National Institute for Health and Clinical Excellence (NICE) in den Leitlinien für starke Menstruationsblutungen40 als solche anerkannt.
Derzeit gibt es 11 Empfehlungen zur Verwendung von VAE bei der Behandlung von symptomatischen Uterusmyomen, die von wissenschaftlichen Gesellschaften aus Europa, Nordamerika und Australien erstellt wurden. In den meisten Fällen sind die Empfehlungen konsistent, während die Abweichung zwei Diskrepanzen betrifft. Die erste ist, ob gestielte submuköse (FIGO 0) und subserosale (FIGO 7) Myome Kontraindikationen für VAE sind. Die zweite Frage ist, ob Frauen, die eine zukünftige Schwangerschaft erklären, für dieses Verfahren qualifiziert sein sollten41. Das American College of Obstetricians and Gynecologists (ACOG) (2008) hat einen interessanten Leitfaden für die Behandlung von Uterusmyomen vorgestellt. Basierend auf konsistenten wissenschaftlichen Erkenntnissen (Stufe A) definierte das ACOG UAE als wirksame und sichere Methode für entsprechend qualifizierte Frauen, die die Gebärmutter mit typischen Indikationen für die Behandlung von Myomen erhalten möchten. Gleichzeitig betonten die ACOG-Empfehlungen die Notwendigkeit einer engen Zusammenarbeit zwischen Gynäkologen und interventionellen Radiologen. In den veröffentlichten Leitlinien erkannte das ACOG den Wunsch nach Erhalt der Fruchtbarkeit als einzige Kontraindikation (relativ) an42.
Eine der jüngsten Empfehlungen wurde 2013 vom Royal College of Obstetricians and Gynecologists (RCOG) und 2015 von der Society of Obstetricians and Gynecologists of Canada (SHAB) herausgegeben41. Im restlichen Teil dieses Artikels werden die Autoren die oben genannten Empfehlungen verwenden. Gemäß den Leitlinien von RCOG und SHAB kann jeder Patient mit symptomatischen Myomen ein Kandidat für eine Embolisation sein, sofern keine Kontraindikationen vorliegen und der Nutzen des Eingriffs (Abklingen der Symptome) das Risiko von Komplikationen überwiegt. Zu beachten ist, dass die Embolisation von Uterusmyomen als minimalinvasiver Eingriff eine vernachlässigbare Anzahl schwerwiegender Komplikationen mit sich bringt. Daher überwiegen die Vorteile in den meisten Fällen das Risiko von Komplikationen 14,32,43.
Eine angemessene Patientenqualifizierung ist von entscheidender Bedeutung für eine hohe klinische Wirksamkeit und die Vermeidung von Komplikationen nach UAE. Die Hauptindikation für UAE sind symptomatische Uterusmyome, die zu starken Menstruationsblutungen, Dysmenorrhoe, Schmerzen, Dyspareunie und anderen nachteiligen Auswirkungen auf den Harn- oder Magen-Darm-Trakt führen. Es ist notwendig, Myome von Adenomyose oder Myomen, die mit Adenomyose koexistieren, zu unterscheiden, da UAE in einer solchen Situation weniger wirksam ist und eine Modifikation der Verfahrenstechnikerfordert 14,32,43,44,45,46,47. Zu den spezifischen Indikationen für die Durchführung des UAE-Verfahrens bei Frauen mit symptomatischen Uterusmyomen gehören die Ablehnung einer Operation, keine Zustimmung zur Bluttransfusion und eine zuvor fehlgeschlagene Operation an Uterusmyomen.
In den oben genannten Indikationen sollten die VAE als Alternative zur chirurgischen Behandlung behandelt werden. Die Patienten sollten jedoch darauf hingewiesen werden, dass in einer kleinen Anzahl von Fällen Komplikationen nach dem Eingriff dazu führen können, dass ein chirurgischer Eingriff erforderlich wird 14,32,43. Gemäß den RCOG-Richtlinien erfordert die Anwendung von UAE in einer Situation, in der das Myom eine wahrscheinliche Ursache für Unfruchtbarkeit ist, eine besondere Sorgfalt und eine angemessene Beurteilung durch einen Gynäkologen, der auf die Behandlung von Unfruchtbarkeit und assistierte Reproduktion spezialisiert ist. Unfruchtbarkeit aufgrund des Vorhandenseins von Myomen ist nicht absolut, und viele Frauen werden ohne Eingriff schwanger. Daher ist es sinnvoll, andere mögliche Ursachen der Unfruchtbarkeit auszuschließen, einschließlich der Beurteilung des männlichen Partners 14,32,43.
Demnach sollten es sich nach den Empfehlungen von RCOG und SHAB um Frauen mit symptomatischen Uterusmyomen handeln, bei denen Pathologien im Becken mit myomähnlichen klinischen Symptomen ausgeschlossen wurden41,43.
Zu den absoluten Kontraindikationen für dieses Verfahren gehören aktuelle oder kürzlich erfolgte Genitalinfektionen, diagnostische Zweifel aufgrund klinischer Faktoren oder unzureichender Bildgebung, asymptomatische Myome, lebensfähige Schwangerschaft und Kontraindikationen für die Verwendung radiologischer Kontrastmittel.
Zu den relativen Kontraindikationen gehören gestielte submuköse (FIGO 0) und subseröse (FIGO 7) Myome, die sich theoretisch aufgrund einer Stielnekrose vom Endometrium lösen und in seltenen Fällen zu einer Sepsis führen können. In diesen Fällen sollte eine UAE nur in Betracht gezogen werden, wenn eine hysteroskopische oder laparoskopische Entfernung des gestielten Myoms vor dem Eingriff geplant ist.
Trotz der Tatsache, dass die aktuelle Literatur darauf hindeutet, dass die Größe des Myoms an sich keine Kontraindikation ist, zeigt die Erfahrung, dass bei der Qualifizierung von Patienten mit großen Myomen (insbesondere in Verbindung mit Kompressionssymptomen) für UAE äußerste Vorsicht geboten ist, da die Volumenreduktion möglicherweise nicht ausreicht, um die Symptome zu lindern und die Erwartungen der Patienten zu erfüllen14,32, 43,48.
Es gibt viele Berichte über eine erfolgreiche Schwangerschaft nach den VAE, aber die vorhandenen Erkenntnisse stützen die Verwendung als Alternative zur pharmakologischen oder chirurgischen Behandlung (Myomektomie) bei jungen Frauen nicht vollständig49. Daher sollte dieses Verfahren bei Frauen, die den Wunsch erklären, schwanger zu werden, mit großer Vorsicht angewendet werden (da es eine niedrigere Schwangerschaftsrate, eine höhere Fehlgeburtenrate, eine Uterusruptur, Placenta accreta und ungünstige Schwangerschaftsergebnisse nach UAE als nach einer Myomektomie gibt)32,50,51,52,53,54,55. Als Gynäkologen empfehlen wir den Vereinigten Arabischen Emiraten nicht für Frauen, die eine Schwangerschaft anstreben. Für uns ist es eine relative Kontraindikation, vorausgesetzt, es gibt zusätzliche Indikationen für die VAE, wie z. B. die Ablehnung von Operationen oder Bluttransfusionen, bei denen das Fehlen einer Behandlung lebensbedrohlich sein kann.
Gemäß den RCOG-Richtlinien ist der Wunsch, die Fruchtbarkeit bei jungen Frauen mit symptomatischen Uterusmyomen zu erhalten oder zu verbessern, eine relative Kontraindikation für VAE32. Im Gegensatz dazu empfehlen die SHAB-Leitlinien, dass in ähnlichen Fällen die VAE nicht als Behandlungsoption für Myome vorgeschlagen werden sollten, da die Sicherheit und Wirksamkeit bei solchen Frauen nicht nachgewiesen wurde14,43. Ein ähnlicher Standpunkt wird von anderen wissenschaftlichen Gesellschaften vertreten, darunter die American Society for Reproductive Medicine (ASRM), das American College of Obstetricians and Gynecologists (ACOG), das American College of Radiology (ACR), das Royal Australian and New Zealand College of Obstetricians and Gynecologists (RANZCOG) und andere, die verbesserte Fruchtbarkeitsergebnisse nach Myomektomie anführen 41,43,56 . UAE wurde von NICE nur für Frauen empfohlen, die die Fruchtbarkeit erhalten oder verbessern möchten, insbesondere mit Merkmalen, die für eine Myomektomie ungünstig sind (multiple Myome)57.
Im Allgemeinen können die Eingriffe der VAE in jedem Stadium des Menstruationszyklus durchgeführt werden32. Unter der Annahme, dass es keine ideale Methode gibt, um eine Schwangerschaft im Stadium der Befruchtung oder Implantation auszuschließen, wird sie in unserem Zentrum bis zum 10. Zyklustag durchgeführt, um eine frühe Schwangerschaft auszuschließen. In den meisten Fällen werden die Patientinnen am Tag des Eingriffs in die Gynäkologie aufgenommen. Die Aufnahme in die gefäßchirurgische Abteilung ist zulässig, wenn entsprechende Untersuchungen und gynäkologische Beratungen durchgeführt werden. Ein Gynäkologe und ein interventioneller Radiologe führen die Qualifizierung für die Embolisation von Myomen durch. Die gynäkologische Qualifikation umfasst die Anamnese, die Untersuchung, eine Ultraschalluntersuchung des Fortpflanzungsorgans und des Myomtyps. Um eine Malignität in der Gebärmutter auszuschließen, sind außerdem ein Gebärmutterhalsabstrich (PAP) und eine Endometriumbiopsie erforderlich. In Fällen, in denen die Ultraschalluntersuchung der Eierstöcke fragwürdig ist, ist ein ROMA-Test (Risk of Ovarian Malignancy Algorithm) erforderlich.
Ein separates, diskussionsbedürftiges Thema ist das Uterussarkom, insbesondere das Leiomyosarkom (LMS), das 70 % dieser Gebärmuttertumoren ausmacht. Die Prävalenz von LMS bei Patienten, die wegen eines Myoms operiert wurden, ist gering und wird auf 0,13 % bis 0,29 % geschätzt58,59. Der Anstieg der Inzidenz von LMS wird bei Frauen über 40 Jahren beobachtet. LMS ist vor der Behandlung schwer zu diagnostizieren, da es gutartigen Myomen ähneln kann60. Die meisten LMS stehen in keinem Zusammenhang mit bereits bestehenden Myomen, und es gibt keine Hinweise auf eine Assoziation von LMS mit Uterusmyomen61. Sowohl Uterusmyome als auch LMS neigen dazu, schnell zu wachsen. Die Größe oder die Wachstumsrate ist also kein Risikofaktor für einen bösartigen Gebärmuttertumor60.
Derzeit gibt es keine zuverlässigen Labor- oder bildgebenden Tests, die es uns ermöglichen würden, das Leiomyosarkom eindeutig zu identifizieren und es vom Leiomyomzu unterscheiden 60,62. Die Sensitivität der Endometriumbiopsie bei der Diagnose des Leiomyosarkoms beträgt 86%. Ein negatives Biopsieergebnis schließt also das Vorhandensein eines bösartigen Gebärmuttertumors nicht aus. Die kontrastmittelverstärkte MRT ist derzeit die optimale Diagnosemethode für Gebärmuttertumoren. Die Sensitivität dieses Tests bei der Diagnose von LMS beträgt 94%60.
Wie bereits erwähnt, schließen die oben genannten Tests bösartige Gebärmuttertumoren nicht zu 100% aus. Daher besteht ein geringes Risiko, die Diagnose des LMS nach der Behandlung zu verlängern, ohne dass eine histopathologische Überprüfung des Gebärmuttertumors möglich ist. Der Patient sollte während der Qualifikation für die VAE darüber informiert werden.
Die Durchführung eines großen Blutbildes (CBC) und Gerinnungstests (INR, APTT), des Nierenpanels (Kreatinin, Harnstoff), des Schilddrüsen-stimulierenden Hormons (TSH), der Konzentration des Anti-Müller-Hormons (AMH) (empfohlen) oder des follikelstimulierenden Hormons (FSH) in der Follikelphase, des C-reaktiven Proteins (CRP), des allgemeinen Urintests und des Vaginalabstrichs (aerobe Vaginalkultur) ermöglichen es, mögliche Komplikationen nach der Embolisation (Infektionen, iatrogene Schädigung der Eierstöcke, Intensivierung der vorangegangenen Nierenfunktionsstörung nach gadoliniumhaltigen Kontrastmitteln, Thyreotoxikose bei Hyperthyreose nach einem jodhaltigen Kontrastmittel)63,64. Bitte beachten Sie, dass FSH-Tests unter 40 Jahren nicht empfohlen werden, da FSH kein sensitiver Indikator für Veränderungen der Eierstockreserve bei jungen Frauen ist 50,65.
Ein interventioneller Radiologe qualifiziert die Patienten auf der Grundlage der Anamnese und der Magnetresonanztomographie (MRT) für das Verfahren. Bei der Anamnese sollten der Nutzen und mögliche Komplikationen sowie das Verfahren selbst mit dem Patienten besprochen werden. Die Erwartungen der Patienten in Bezug auf die VAE sollten ebenfalls besprochen werden. Die MRT zielt darauf ab, andere Pathologien des Fortpflanzungsorgans und der angrenzenden Strukturen auszuschließen sowie die Morphologie und Lokalisation von Myomen und die Anatomie für die technische Machbarkeit des Verfahrens zu beurteilen 35,36,37,57.
UAE zielt darauf ab, das Gefäßsystem aller Myome vollständig zu blockieren und gleichzeitig die Blutversorgung der Gebärmutter, der Eierstöcke und des umliegenden Gewebes im Becken aufrechtzuerhalten. Die technischen Aspekte der VAE entwickeln sich bis zu einem gewissen Grad noch weiter.
Die Embolisation der Gebärmutterarterien wird von interventionellen Radiologen mit entsprechender Kompetenz auf dem Gebiet der intravaskulären Embolisation durchgeführt. Der Eingriff wird unter Anleitung der Durchleuchtung durchgeführt. Dabei handelt es sich um das perkutane Einführen eines Gefäßkatheters von der Punktion im Leistenbereich in die Oberschenkelarterie, die Aorta, die Arteria iliaca interna bis hin zur Arteria uterinerie. Nach dem Platzieren des Katheters tief in der Uterusarterie und dem Erreichen einer stabilen Position wird das mit Kontrastmittel vermischte Embolisationsmittel unter fluoroskopischer Kontrolle so injiziert, dass Reflux und "Nicht-Ziel"-Embolisation vermieden werden. Das Gefäßbett von Myomen wird mit Partikeln von 500–900 μm verschlossen, abhängig von der Art des Embolisationsmaterials – übliche Größen sind 700 μm. Die Embolisation wird fortgesetzt, bis der Blutfluss aus der Stase erreicht ist. Am Ende des Eingriffs wird der Katheter entfernt und die Gefäßzugangsstelle mit manuellem Druck und Verband oder mechanischem Verschluss gesichert. Der Eingriff dauert ca. 0,5–1,0 h. Die mittlere Dosis ionisierender Strahlung, die während der VAE vom Eierstock absorbiert wird, liegt zwischen 0,04 und 0,22 (Gy: grau) und die mittlere geschätzte effektive Dosis im Bereich von 22 bis 34 (mSv: Millisievert). Die mittlere Durchleuchtungszeit beträgt etwa 22 min66,67.
Das Gefäßsystem der meisten Myome kommt aus den Gebärmutterarterien. Nur etwa 5 % – 10 % der Myome werden zusätzlich von den Eierstockarterien versorgt. Arterielle Uterusanastomosen treten in etwa 10 % der Fälle auf, während utero-ovariale Anastomosen in 10 % bis 30 % der Fälle auftreten. Die Unterbrechung der Blutversorgung des embolisierten Gewebes führt zu einer ischämischen Nekrose, gefolgt von hyaliner Degeneration oder koagulativer Nekrose. Dieser Vorgang dauert mehrere Monate 68,69.
Die Wirksamkeit von UAE hängt von der Auflösung der Symptome oder dem Grad ihrer Verringerung ab. Für die Behandlung von übermäßigen Menstruationsblutungen, Beckenschmerzen und Drucksymptomen beträgt der klinische Wirksamkeitsindex für UAE 81 % bis 96 %, 70 % bis 100 % bzw. 46 % bis 100 %. Innerhalb von 3–6 Monaten nach dem Eingriff betrug die beobachtete Verringerung des Myomvolumens 25%–60%33,70,71,72. Die mittlere Durchmesserreduktion des Myoms betrug 2,2 cm57.
Die Verringerung des Volumens von Myomen korreliert nicht immer mit der Auflösung oder Verringerung der klinischen Symptome. In der Langzeitnachsorge nach UAE berichteten mehr als 70 % der Patienten über ein Abklingen oder eine signifikante Verringerung der klinischen Symptome innerhalb von 5 Jahren nach dem Eingriff, während 16 % bis 23 % von ihnen eine erneute Intervention erforderten73,74.
Bei der Bewertung des frühen UAE-Effekts schlagen die Autoren dieser Veröffentlichung die Verwendung von dreidimensionalem (3D) Ultraschall unter Verwendung der Virtual Organ Computer-aided AnaLysis (VOCAL) vor, bei der Messungen der vaskulären Indizes durchgeführt werden: Vaskularisationsindex (VI), Flussindex (FI) und Vaskularisationsflussindex (VFI)75.
Schmerzen nach der Embolisation sind eine frühe (ca. 24 Stunden anhaltende) erwartete Nachwirkung einer erfolgreichen UAE (nicht zu verwechseln mit einer Komplikation) und sollte aktiv behandelt werden. Dieses klinische Symptom wird durch die Freisetzung von Gewebeabbauprodukten des ischämischen Myoms verursacht. Die Behandlung umfasst eine angemessene Schmerzkontrolle, Flüssigkeitszufuhr und eine mögliche Antibiotikatherapie32,43. Die Epiduralanästhesie (EA), die 24 Stunden nach dem Eingriff aufrechterhalten wird, reduziert die Schmerzen signifikant auf ein völlig akzeptables Niveau, jedoch zu höheren Kosten und einem erhöhten Komplikationsrisiko im Vergleich zur patientenkontrollierten Analgesie (PCA)76.
Andere Ansätze sind auch in der Schmerztherapie nach der Embolisation verfügbar. Erwähnenswert ist die Verwendung von Mischungen von Schmerzmitteln mit Polyvinylalkoholmolekülen und Elektroakupunktur-Anästhesie während der VAE. Beide Methoden sollten die Anzahl der in einem Krankenhaus durchgeführten Eingriffe in den VAE begrenzen77,78. Wir wenden diese Methoden in unseren und kooperierenden Zentren nicht an.
Die frühen Komplikationen der UAE sind in der Regel lokale Komplikationen, die mit dem Angiographie-Verfahren verbunden sind. Diese Gruppe von unerwünschten Ereignissen ist selten (sie treten in weniger als 1% der Fälle auf) und bezieht sich hauptsächlich auf Leistenhämatome, arterielle Thrombosen, arterielle Dissektionen und Pseudoaneurysmen, allergische Reaktionen auf Kontrastmittel, einen Krampf in der Gebärmutterarterie, der durch eine Manipulation des Katheters im Gefäß während des Eingriffs verursacht wurde (wird als vorübergehendes Ereignis behandelt, nachdem einige Minuten verstrichen sind und der Eingriff fortgesetzt werden kann), wenn der Spasmus anhält, kann Verapamil (2,5–5 mg) oder Nitrat (100–150 μg) intraarterial verabreicht werden) und eine "Non-Target"-Embolisation 32,37,38.
Es gab auch mehrere Berichte über "Non-Target"-Embolisationen anderer Beckenorgane und deren anschließende Ischämie. Diese Komplikation kann als Folge einer schlechten Ausführung des Eingriffs sowie aufgrund des Vorhandenseins von Anastomosen und anatomischen Varianten des Beckengefäßsystems auftreten. Ein Sonderfall der Non-Target-Embolisation ist die Schädigung der Eierstöcke, die bei einigen Patientinnen durch Anastomosen zwischen den Gefäßen der Gebärmutter und den Eierstöcken entsteht79,80.
Die Folge der Myomnekrose ist ein Postembolisationssyndrom, das innerhalb von 30 Tagen nach dem Eingriff bei etwa 10 % bis 15 % der Patienten auftritt. Zu den Symptomen dieses Syndroms, die zusammen oder einzeln auftreten können, gehören Übelkeit, Erbrechen, Unwohlsein, leichtes Fieber, Unterleibsschmerzen und erhöhte Leukozytenspiegel. Dabei handelt es sich in der Regel um ein selbstlimitierendes Syndrom, das in der Regel innerhalb von 10–14 Tagen verschwindet. Analgetika und entzündungshemmende Medikamente werden zur Behandlung dieser Komplikation eingesetzt32. Es ist wichtig, die Symptome eines Postembolisationssyndroms mit schwerwiegenderen Komplikationen wie einer Sepsis zu differenzieren. Dies gilt insbesondere in Fällen, in denen die genannten Symptome länger als zwei Wochen andauern 32,37,38.
Die Infektion ist nach den VAE möglicherweise die schwerwiegendste Komplikation und tritt in etwa 0,5 % der Fälle auf 32,38. Bei anhaltendem, hohem Fieber (38,5 °C und mehr) über 24–48 Stunden und hartem und schmerzendem Bauchraum sollte der Verdacht auf eine Sepsis bestehen. In diesem Fall kann die Behandlung nicht nur den Einsatz einer Antibiotikatherapie erfordern, sondern auch die Notwendigkeit, die Gebärmutter zu entfernen. Im letzteren Fall kann es in weniger als 1% der Fälle eine Bedrohung für das Leben des Patienten darstellen. Eine Sepsis tritt häufiger auf, wenn die UAE an einem großen Uterus durchgeführt wird (über 20 cm oder wenn der Durchmesser eines einzelnen Myoms größer als 9 cm ist, und auch bei Koexistenz großer submuköser Myome)37,38.
Eine späte Komplikation nach UAE (mehr als 30 Tage nach dem Eingriff), die nach der Embolisation submuköser Myome auftritt, ist die Ausscheidung von markierten, nekrotischen Fragmenten von Myomen durch den Gebärmutterhalskanal. Es passiert in etwa 10% der Fälle 32,81,82. Etwa 16% der Frauen können nach der UAE über mehrere Wochen bis zu vielen Monaten einen häufigen vaginalen Ausfluss haben, der auf die Ausscheidung nekrotischer Myome aus der Gebärmutter zurückzuführenist 83. Nach dem VAE-Verfahren wird eine signifikante Verkürzung der Menstruation und eine Abnahme ihrer Häufigkeit beobachtet, was als vorteilhafter Effekt dieses Verfahrens angesehen wird. Eine vollständige Amenorrhoe wird jedoch als Folge eines Ovarialversagens nach Embolisation behandelt50,84.
Amenorrhoe nach den VAE ist in der Regel vorübergehend und auf wenige Zyklen beschränkt. Dauerhafte Amenorrhoe tritt bei etwa 15 % der Frauen über 40 Jahre und bei etwa 1 % der Frauen unter diesem Alter auf und verursacht Symptome einer vorzeitigen Menopause. In unseren eigenen Untersuchungen wurde eine Abnahme der Fruchtbarkeit bei jungen Frauen (33–40 Jahre) als Folge der Verringerung der ovariellen Reserve festgestellt65. Es wird geschätzt, dass etwa 85% der Frauen, die nach den VAE über Amenorrhoe berichten, über 45Jahre alt sind. Es wurde argumentiert, dass der Grund für die Zunahme der Inzidenz von Amenorrhoe bei älteren Frauen auf die verringerte ovarielle Reserve und die größere Empfindlichkeit des Eierstockgewebes gegenüber Ischämie zurückzuführen ist, die durch eine "Nicht-Ziel"-Embolisation verursacht wird86.
Das Verfahren in den VAE wirkt sich auch auf die sexuelle Funktion von Frauen aus, die sich dem Eingriff unterziehen. Eine Verbesserung der sexuellen Funktion nach den VAE wurde von 26 % der Frauen berichtet, eine Verschlechterung wurde bei 10 % festgestellt und blieb bei den restlichen 64 % der Frauen unverändert. Eine mögliche Ursache für sexuelle Dysfunktion ist eine abnormale Gefäßstruktur der Klitoris, des Gebärmutterhalses und des Gebärmutterkörpers als Folge des UAE-Verfahrens74.
Protokoll
Die Autoren erklären, dass das Protokoll den Richtlinien der lokalen Ethikkommission der Medizinischen Universität Lublin folgt.
1. Qualifikation für das VAE-Verfahren
HINWEIS: Dies richtet sich an Gynäkologen und interventionelle Radiologen.
- Informieren Sie den Patienten über die Details des Verfahrens in den VAE.
- Besprechen Sie Indikationen und Kontraindikationen für das VAE-Verfahren.
- Besprechen Sie mit der Patientin die Annahmen der UAE und alternative Methoden (beschrieben in der Einleitung) bei der Behandlung von Uterusmyomen.
- WARNUNG! Informieren Sie den Patienten, dass es sich bei der UAE nicht um ein radikales Verfahren handelt (das Myom wird nicht entfernt).
- WARNUNG! Informieren Sie die Patientin, dass sie nach UAE keinen histopathologischen Bericht über Uterusmyome erhalten wird.
- WARNUNG! Informieren Sie die Patientin, dass 1-3 Fälle von 1.000 Gebärmuttertumoren bösartig sein können (LMS). Besprechen Sie mit der Patientin, dass die Endometriumbiopsie und die MRT, die während der UAE-Qualifizierung durchgeführt wurden, bei der Diagnose eines Leiomyosarkoms hochsensitiv sind, aber nicht 100%. Informieren Sie den Patienten, dass die Durchführung einer UAE bei Leiomyosarkom die Diagnose und die richtige Behandlung verzögern kann. Vermerken Sie diese Tatsache in der Krankenakte.
- Wenn der Patient wissentlich eine UAE-Behandlung wünscht, setzen Sie dieses Protokoll fort.
- Informieren Sie den Patienten, dass die Qualifizierung in zwei Stufen erfolgt. Die Qualifizierung durch einen Gynäkologen umfasst die Analyse von Indikationen und Kontraindikationen, während ein interventioneller Radiologe die technischen Fähigkeiten der VAE beurteilt.
- Planen oder führen Sie eine gynäkologische Beratung durch und planen Sie eine Konsultation mit dem interventionellen Radiologen vor den VAE.
- Führen Sie möglichst viele der Qualifizierungsverfahren in der Ambulanz durch.
- Stellen Sie sicher, dass die Patientin Indikationen für UAE hat: symptomatische Uterusmyome (Menometrorrhagie, Metrorrhagie, Dysmenorrhoe, Dyspareunie, chronische Beckenschmerzen); die Verweigerung einer chirurgischen Behandlung; keine Zustimmung zur Bluttransfusion; Zuvor fehlgeschlagene Operation von Uterusmyomen. Notieren Sie sie in der Anamnese.
- Fragen Sie den Patienten nach den Symptomen von Myomen.
- Besprechen Sie die Wirksamkeit von UAE und die Erwartungen des Patienten (in den repräsentativen Ergebnissen).
- Fragen Sie, ob die Patientin zuvor wegen Uterusmyomen behandelt wurde. Stellen Sie sicher, welche Methode verwendet wurde.
- Wenn der Patient eine chirurgische Behandlung oder Bluttransfusion ablehnt, nehmen Sie eine schriftliche Erklärung ab.
- Stellen Sie sicher, dass der Patient, der sich für das VAE-Verfahren qualifiziert hat, keine absoluten Kontraindikationen hat: asymptomatische Myome; eine lebensfähige Schwangerschaft; aktuelle oder kürzliche Genitalinfektion; diagnostische Zweifel aufgrund klinischer Faktoren oder unzureichender Bildgebung; Kontraindikationen für die Verwendung von radiologischen Kontrastmitteln; Merkmale des Leiomyosarkoms in der MRT; bösartiger Tumor der Gebärmutter oder der Eierstöcke, es sei denn, er wird zur Palliation oder als Ergänzung zur Operation durchgeführt87. Notieren Sie sie in der Anamnese.
- Wenn der Patient trotz asymptomatischer Myome eine UAE verlangt, erklären Sie, dass solche Fälle nicht für das Verfahren in Frage kommen. Erklären Sie der Patientin, dass asymptomatische Myome nur eine regelmäßige gynäkologische Überwachung erfordern.
- Wenn es relative Kontraindikationen für UAE gibt (große Myome und Fortpflanzungspläne), besprechen Sie diese mit dem Patienten und vermerken Sie diese Tatsache in der Krankenakte.
- Konzentrieren Sie sich auf die möglichen Komplikationen im Zusammenhang mit der relativen Kontraindikation, die in der Einleitung beschrieben werden, und stellen Sie sicher, dass der Patient das Verfahren versteht und ihm zustimmt.
- Besprechen Sie mit der Patientin die Nachwirkungen und Komplikationen der Embolisation der Gebärmutterarterie (siehe Einleitung) und vermerken Sie diese Tatsache in der Krankenakte.
- Achten Sie im Gespräch mit dem Patienten besonders auf die Schmerzen nach der Embolisation.
- Besprechen Sie Schmerzbehandlungen nach der Embolisation.
- Führen Sie eine gynäkologische Qualifizierung durch.
- Sammeln Sie die Anamnese und führen Sie eine gynäkologische Untersuchung durch.
- Führen Sie eine Ultraschalluntersuchung der Fortpflanzungsorgane durch, um die Größe und Art der Myome zu beurteilen (FIGO-Klassifikation)88.
- Verwenden Sie eine Vaginalsonde, um die Größe und Lokalisation des Myoms abzuschätzen (Abbildung 2). Die mit UAE behandelten Uterusmyome sollten gemäß der FIGO-Klassifikation 2–5 (idealerweise 3–4) betragen und der Durchmesser sollte 10 cm nicht überschreiten.
- Nehmen Sie das Protokoll der Ultraschalluntersuchung des Beckens in die Krankenakte auf.
- Stellen Sie sicher, dass das Ultraschallergebnis Hinweise auf die Qualifikation für das VAE-Verfahren gibt.
- Schließen Sie bösartige Prozesse im Becken aus.
- Stellen Sie sicher, dass die Patientin ein aktuelles Ergebnis (vorzugsweise innerhalb von 6 Monaten) des Gebärmutterhalsabstrichs (PAP) und der Endometriumbiopsie erhalten hat.
- Verwenden Sie bei einem Beckenultraschall die Vaginalsonde, um die Eierstöcke zu beurteilen und zu bestätigen, dass ihre Struktur korrekt ist. Überprüfen Sie im Zweifelsfall die vorherige Ultraschalluntersuchung oder führen Sie den ROMA-Test durch.
- Bestellen Sie ein MRT, um den Gebärmuttertumor auf LMS-Funktionen und technische Fähigkeiten der VAE zu untersuchen.
- Notieren Sie die Ergebnisse des Gebärmutterhalsabstrichs (PAP), der Endometriumbiopsie, der Ultraschalluntersuchung (möglicherweise des ROMA-Tests) und des MRT in der Krankenakte.
- Wenn die Ergebnisse falsch sind, disqualifizieren Sie den Patienten von dem Verfahren.
- Informieren Sie die Patientinnen über die Ergebnisse der gynäkologischen Qualifizierung.
- Vermerken Sie diese Tatsache in der Krankenakte. Überweisen Sie den Patienten an das Krankenhaus.
- Vereinbaren Sie einen Termin für das UAE-Verfahren und denken Sie daran, dass der Patient vor dem 10. Tag des Zyklus sein sollte.
- Fragen Sie die Patientin, ob sie eine Operation ablehnt. Im Falle einer Verweigerung ist dies in der Einverständniserklärung des Patienten oder in der Krankenakte zu vermerken.
- Patienten mit symptomatischen Myomen, die eine Operation ablehnen, qualifizieren sich für UAE.
- Führen Sie die folgenden Tests mindestens 7 Tage vor der Abreise in die VAE durch, um mögliche Komplikationen zu beurteilen und zu vermeiden: mikrobiologischer Test des Vaginalabstrichs (aerobe Vaginalkultur); Harnuntersuchung; ausgewählte Blutuntersuchungen: CBC, Gerinnungstests (INR, APPT), Nierenpanel (Kreatin, Harnstoff), TSH, CRP.
- Beschreiben Sie die Ergebnisse in der Krankenakte.
- Informieren Sie die Patientin, dass falsche Ergebnisse sie für den Eingriff disqualifizieren.
- Überprüfen Sie die ovarielle Reserve der Patientin, indem Sie die AMH- (empfohlen) oder FSH-Serumspiegel (nicht empfohlen unter 40 Jahren) in der follikulären Phase testen. Besprechen Sie mit der Patientin, dass der obige Test hilfreich sein wird, um die Schädigung der Eierstöcke infolge einer Nicht-Zielembolisation zu beurteilen. Vermerken Sie diese Tatsache in der Krankenakte.
- Patientinnen, die für die VAE qualifiziert sind, sollten aufgrund des erhöhten Risikos von Schwangerschaftskomplikationen nicht den Willen erklären, schwanger zu werden 14,32,38,50,51,52,89,90,91.
- Informieren Sie die Patientin über das erhöhte Risiko von Schwangerschaftskomplikationen nach den VAE.
- Beachten Sie, dass die Patientin den Willen zur Schwangerschaft weder in der Einverständniserklärung der Patientin noch in der Krankenakte erklärt.
- Wenn die Patientin eine Schwangerschaft in der Zukunft immer noch nicht ausschließt, aber VAE benötigt, geben Sie eine schriftliche Erklärung ab, dass sie über mögliche Schwangerschaftskomplikationen nach UAE informiert wurde.
- Führen Sie eine radiologische Qualifizierung durch.
- Stellen Sie sicher, dass eine MRT des Beckens durchgeführt wurde. Die MRT-Untersuchung ermöglicht es, andere Pathologien des Fortpflanzungsorgans und der angrenzenden Strukturen auszuschließen (Schritt 1.6.3.3. des Verfahrens zur Qualifizierung für die VAE), die Morphologie und Lokalisation der Myome zu beurteilen und die Anatomie auf die technische Machbarkeit der Embolisation zu untersuchen (Abbildung 3, Abbildung 4). Wenn nicht, vereinbaren Sie die MRT-Untersuchung und das Beratungsgespräch mit einem interventionellen Radiologen.
- Analysieren Sie die bildgebenden Untersuchungen und beurteilen Sie Art und Größe von Myomen.
- Wenn submuköse Myome (FIGO 0–1) gefunden werden, informieren Sie die Patientin über das Risiko, sich in die Gebärmutterhöhle zu lösen. Eine vollständige Ausscheidung kann eine Sepsis verursachen, während die Ausscheidung in Fragmenten in der Regel asymptomatisch ist50.
- Wenn subseröse schmalstielige, gestielte (FIGO 7) Myome gefunden werden, informieren Sie den Patienten über das Risiko einer Ablösung des Myoms in die Bauchhöhle nach der Embolisation. Sie kann zu akuten Entzündungen führen, und eine laparoskopische Reoperation kann erforderlich sein92.
- Wenn große Myome gefunden werden, informieren Sie den Patienten, dass das Risiko von Komplikationen unverändert bleibt, das Ergebnis des Eingriffs jedoch bei kleinen Myomen besser ist93.
- Beachten Sie diese Tatsache in der Einverständniserklärung des Patienten oder in der Krankenakte.
2. Vorbereitung auf das Verfahren in den VAE
HINWEIS: Dies richtet sich an Gynäkologen oder Gefäßchirurgen und interventionelle Radiologen.
- Nehmen Sie den Patienten in das Krankenhaus (gynäkologische oder gefäßchirurgische Abteilung) auf.
- Stellen Sie sicher, dass sie vor dem 10. Tag des Zyklus bei der Aufnahme ist.
- Führen Sie eine gynäkologische Untersuchung und eine Ultraschalluntersuchung des Beckens durch oder ordnen Sie sie an.
- Stellen Sie sicher, dass die Diagnose und die Qualifizierung für das VAE-Verfahren korrekt sind.
- Stellen Sie sicher, dass seit der Qualifikation für die VAE keine neuen Kontraindikationen aufgetreten sind. Wenn ja, schlagen Sie andere Behandlungsmöglichkeiten vor und ändern Sie das Datum des Eingriffs.
- Führen Sie die transvaginale 3D-Ultraschalluntersuchung (TVUS) durch und berechnen Sie das Volumen und die Vaskularisationsindizes des Myoms (VI, FI und VFI) mit der VOCAL-Softwareuntersuchung (die zur Beurteilung der Wirksamkeit des UAE-Verfahrens72,75 verwendet wird) (beschrieben in der Einleitung) (Abbildung 5 und Abbildung 6).
- Vermerken Sie diese Tatsache in der Krankenakte.
- Stellen Sie sicher, dass bei dem Patienten, der für die VAE qualifiziert ist, Tests durchgeführt wurden, die während der Qualifikation für die VAE durchgeführt wurden (beschrieben in den Schritten 1.6.2, 1.6.3, 1.6.5 und 1.6.6 der Qualifikation für die VAE).
- Wenn die Patientin von einem Gynäkologen vorqualifiziert wurde und keine Blutuntersuchungen, keinen Urintest und kein MRT hat, bestellen Sie die Tests und vereinbaren Sie einen Beratungstermin mit einem interventionellen Radiologen (Schritt 1.7 der Qualifikation für die VAE).
- Bewerten oder ordnen Sie den AMH- (empfohlen) oder FSH- (nicht empfohlen unter 40 Jahren) Serumspiegel vor den VAE an, um die Beurteilung von Eierstockschäden als Folge einer "Nicht-Ziel"-Embolisation zu ermöglichen.
- Informieren Sie den Patienten, dass die Testergebnisse in etwa einem Tag vorliegen werden und das Verfahren in den VAE erst nach Erhalt dieser Ergebnisse möglich sein wird.
- Informieren Sie die Patientin, dass falsche Ergebnisse sie für den Eingriff disqualifizieren.
- WARNUNG! Im Falle fehlender oder falscher Ergebnisse des PAP-Abstrichs, der Endometriumbiopsie; Der mikrobiologische Test des Vaginalabstrichs disqualifiziert die Patientin aus den VAE (zu lange Zeit, um diese Ergebnisse zu erhalten). Qualifizieren Sie sich erneut, nachdem Sie die korrekten Ergebnisse erhalten haben.
- Vermerken Sie diese Tatsache in der Krankenakte.
- Holen Sie eine Einverständniserklärung zur Durchführung der VAE ein.
- Stellen Sie dem Patienten alle Informationen über die VAE zur Verfügung.
- Besprechen Sie die möglichen Komplikationen der VAE (in der Einleitung beschrieben).
- Lassen Sie dem Patienten Zeit zum Nachdenken und Fragen stellen. dem Patienten zu ermöglichen, eine Einverständniserklärung zur Durchführung des VAE-Verfahrens zu geben.
- Informieren Sie die Patientin darüber, dass sie das Recht hat, ihre Entscheidung bis zum Beginn der VAE zu ändern.
- Wenn die Patientin ihre Entscheidung bezüglich der UAE ändert, schlagen Sie andere Behandlungsoptionen für Uterusmyome vor (in der Einleitung beschrieben).
- Beachten Sie diese Tatsache in der Einverständniserklärung des Patienten oder in der Krankenakte.
- Überprüfen und stellen Sie unmittelbar vor dem Eingriff in den VAE sicher, dass die in den Abschnitten 1.6.2, 1.6.3, 1.6.5 und 1.6.6 der Qualifikation für die VAE beschriebenen Tests sowie 3D-TVUS, MRT und Rücksprache mit einem interventionellen Radiologen durchgeführt wurden und die Ergebnisse korrekt sind.
- Disqualifizieren Sie einen Patienten aus den VAE, wenn die Tests fehlen oder die Ergebnisse falsch sind.
- Vermerken Sie diese Tatsache in der Krankenakte.
- Informieren Sie den Patienten und achten Sie auf das Verbot, von morgens bis zum Eingriff Nahrung und Flüssigkeit zu sich zu nehmen. Die Ausnahme ist eine kleine Menge Flüssigkeit, die für die Einnahme der morgendlichen Dosis von Medikamenten benötigt wird.
- Stellen Sie morgens (vor den VAE) sicher, dass der Patient nüchtern ist.
- Stellen Sie sicher, dass der Patient die Medikamente für eigene chronische Krankheiten eingenommen hat.
- Vermerken Sie diese Tatsache in der Krankenakte.
- Bestellen Sie dem Patienten die folgenden Medikamente: 1 Tablette Anxiolytikum (z. B. Estazolam) oral, 1 Dosis intravenöse Antibiotika, 1 Globuli Metronidazol intravaginal, Diclofenac 100 mg rektales Zäpfchen.
- Verabreichen Sie die oben genannten Arzneimittel etwa 30–40 Minuten vor der Einreise in die VAE.
- Vermerken Sie diese Tatsache in der Krankenakte.
- Bereiten Sie das Operationsfeld vor, indem Sie sicherstellen, dass die linke Achselhöhle und die rechte Leiste rasiert sind.
- Wenn die oben genannten Hautpartien nicht rasiert sind, rasieren Sie sie vorsichtig.
- Vermerken Sie diese Tatsache in der Krankenakte.
- Stellen Sie sicher, dass der Patient kein Intrauterinpessar (IUP) hat.
- Wenn die Patientin eine Spirale in der Gebärmutter hat, informieren Sie sie über das erhöhte Infektionsrisiko in der Gebärmutterhöhle und bieten Sie an, sie vor den VAE zu entfernen.
- Wenn der Patient nicht damit einverstanden ist, die Spirale zu entfernen, vermerken Sie dies in der Einverständniserklärung des Patienten oder in der Krankenakte.
- Stellen Sie sicher, dass der Patient allergische Reaktionen auf Medikamente, Kontrastmittel und Desinfektionsmittel meldet und vermerken Sie diese Tatsache und Ergebnisse in der Krankenakte.
3. Durchführung des VAE-Verfahrens
HINWEIS: Dies richtet sich an interventionelle Radiologen und Anästhesisten.
- Führen Sie den Eingriff unter sterilen Bedingungen durch.
- Legen Sie den Patienten auf den Operationstisch und desinfizieren Sie die rechte Leistenregion großflächig mit einem Krankenhausdesinfektionsmittel (mit entsprechender Zulassung).
- Kleben Sie das OP-Tuch um die Operationsstelle (rechte Leiste).
- Wählen Sie die Art der Anästhesie: Lokalanästhesie oder Epiduralanästhesie (EA) und vermerken Sie die Wahl des Patienten in der Krankenakte.
- VAE unter örtlicher Betäubung.
- Betäuben Sie (subkutane Verabreichung) 2% ige Lignocainlösung an der Operationsstelle.
- Verabreichen Sie bei Bedarf 5 mg Morphin intravenös.
- Stellen Sie vor Beginn des Eingriffs in den VAE sicher, dass die Lokalanästhesie betriebsbereit ist.
- VAE unter EA
- Bereiten Sie den Patienten richtig auf den EA vor.
- Führen Sie den EA durch, bevor Sie das OP-Abdecktuch verkleben.
- Stellen Sie sicher, dass der Patient, der für das EA-Verfahren qualifiziert ist, nicht die folgenden Kontraindikationen EA hat: Verweigerung des Verfahrens, Gerinnungsverweigerung, Koagulopathie, Thrombozytopenie, hämolytische Erkrankung, Einnahme von Antikoagulanzien, Schock, Infektion an der Stelle der epiduralen Injektion, Bakteriämie, Lokalanästhesieallergie, anatomische Deformitäten der Wirbelsäule, erhöhter Hirndruck, neurologische Erkrankung, schwere Aorten- oder Mitralstenose94. Vermerken Sie diese Tatsache in der Krankenakte.
- Rufen Sie einen Anästhesisten an und fragen Sie nach EA.
- Legen Sie einen dünnen Katheter in den Epiduralraum in der Lendenwirbelsäule und verabreichen Sie ein Anästhetikum (Verfahren für Anästhesisten).
- Bevor Sie mit dem VAE-Verfahren beginnen, stellen Sie sicher, dass der EA betriebsbereit ist.
- Das Verfahren in den VAE
- Führen Sie das VAE-Verfahren in Angio Suit unter fluoroskopierischer Anleitung durch.
- Verschaffen Sie sich Zugang zum Gefäßsystem mit der Seldinger-Technik95,96 (Abbildung 7, Abbildung 8 und Abbildung 9).
- Führen Sie einen Pigtail-Katheter in die Bauchaorta direkt unterhalb der Nierenarterien ein.
- Führen Sie eine Angiographie durch, um die Gefäße sichtbar zu machen.
- Führen Sie eine Aortonephrographie durch, um die Anatomie der Gefäße, die die Myome versorgen, zu beurteilen und den Eingriff zu planen (Abbildung 10).
- Führen Sie eine Angiographie der Arteria iliaca interna in anterior-posteriorer und schräger Projektion durch, um das Ostium der Arteria uterine freizulegen.
- Beginnen Sie auf der linken Seite, dann auf der rechten, aufgrund der Einstichstelle und der spezifischen Form des Katheters. Je nach Kaliber des Gefäßes wird der Hauptkatheter oder Mikrokatheter selektiv in die Gebärmutterarterie eingeführt (Abbildung 11).
- Platzieren Sie den Katheter tief in der Gebärmutterarterie. Embolisieren Sie das Gefäß mit Hydrogelpartikeln. Aufgrund des Vorhandenseins einer Uterus-Ovarial-Anastomose, deren Größe auf etwa 500 μm geschätzt wird, beträgt die empfohlene Größe der Partikel für die Embolisation 700 μm, um das Risiko einer "Nicht-Ziel-Embolisation" zu verringern.
- Setzen Sie die Embolisation fort, bis der Blutfluss im Gefäß vollständig blockiert ist. Der Endpunkt der Behandlung ist die Kontraststase im Gefäß, die den wirksamen Verschluss beweist.
- Führen Sie die Embolisation der Gebärmutterarterie auf der gegenüberliegenden Seite mit demselben Zugang durch. Die Behandlung dauert etwa 0,5 bis 1,0 h66,67 (Abbildung 12).
- Beurteilen Sie die Wirksamkeit der Embolisation aus einem Katheter, der während der Kontrollangiographie in die Arteria iliaca interna gelegt wird. Das Fehlen eines aktiven Zuflusses von schattierendem Blut (in die Uterusarterien) deutet darauf hin, dass das Verfahren als technisch korrekt angesehen wird (Abbildung 13).
- Entfernen Sie vorsichtig den Katheter.
- Die Einstichstelle durch manuelle Kompression mit Druckverband verschließen, der für die nächsten 6 h oder Verschlussvorrichtung beibehalten werden sollte (Abbildung 14).
- Beschreiben Sie den Kurs der VAE in der Krankenakte.
4. Patientenversorgung nach dem Eingriff in den VAE
HINWEIS: Dies richtet sich an Gynäkologen oder Gefäßchirurgen und Anästhesisten.
- Beginn der analgetischen Behandlung: patientenkontrollierte Analgesiepumpe (PCA) oder EA.
- Informieren und besprechen Sie mit dem Patienten die Möglichkeiten der analgetischen Behandlung.
- Informieren Sie den Patienten, dass die EA im Vergleich zur PCA-Pumpe76 eine bessere Schmerzkontrolle und eine schnellere Rehabilitation bietet.
- Notieren Sie diese Tatsache und die Wahl des Patienten in der Krankenakte.
- Analgetische Behandlung von Schmerzen nach der Embolisation mit einer PCA-Pumpe.
- Bereiten Sie die Spritze für die PCA-Pumpe mit der Morphinlösung vor.
- Füllen Sie die 50-ml-Spritze für die PCA-Pumpe mit 50 mg Morphin und einer Lösung von 0,9 % NaCl (Konzentration 1 mg/ml).
- Bereiten Sie die PCA-Pumpe für die intravenöse Anwendung vor.
- Verbinden Sie den Abfluss mit der Spritze.
- Führe die Venenpunktion mit einer Kanüle ein.
- Führen Sie die Spritze in die PCA-Pumpe ein.
- Füllen Sie den Abfluss und starten Sie die PCA-Pumpe.
- Schalten Sie die START-Taste ein.
- Verriegeln Sie die PCA-Pumpe.
- Stellen Sie die PCA-Pumpenparameter ein (siehe unten) (Abbildung 15).
WARNUNG! Höhere Dosen von Morphin können Atemdepressionen verursachen.- Verwenden Sie eine Morphinkonzentration von 1 mg/ml. Verwenden Sie eine Dosis einer Morphininfusion bei Bedarf (intravenöser Bolus) (Bolus S.) von 0,5 mg mit einem Zeitintervall, nach dem die nächste On-Demand-Infusion (Lockout-Intervall/[Karencja]) von 5 Minuten verabreicht werden kann (um Atemdepression zu vermeiden). Verwenden Sie eine Zeit der intravenösen Morphininjektion während der On-Demand-Infusion von 10 s.
- Stellen Sie sicher, dass alle oben genannten Schritte ausgeführt sind.
- Bestellen Sie Morphin in der PCA-Pumpe für bis zu 24 h.
- Überwachen Sie die Schmerzen gemäß der numerischen Bewertungsskala (NRS). Notieren Sie sich den NRS-Wert in der Krankenakte.
- Verwenden Sie die Schmerzbewertungskarte (PAC).
- Informieren Sie die Patientin, dass sie bei Auftreten der Schmerzsymptome selbst den "Joy-Stick" drücken soll, um so das Medikament auf Verlangen zu erhalten.
- Stellen Sie sicher, dass der Patient die Anweisungen versteht.
- Beobachten Sie die Menge des bei Bedarf verabreichten "intravenösen Bolus" zum "leeren Bolus" (der während des Lockout-Intervalls gestartet wird - Abschnitt 4.2.3 der Patientenversorgung nach dem VAE-PROTOKOLL) (Abbildung 16).
- Wenn das Verhältnis von "leerem Bolus" zu "intravenösem Bolus" bei Bedarf einen Wert von mehr als 2/1 (67% / 33%) erreicht, gehen Sie wie folgt vor (Abbildung 17, Abbildung 18).
- Um die Wirksamkeit der Schmerztherapie mit einer PCA-Pumpe zu verbessern und das Risiko von Morphin-Nebenwirkungen zu verringern, sollten Sie die Verwendung von Paracetamol oder nichtsteroidalen entzündungshemmenden Arzneimitteln in intravenösen Injektionen und Standarddosen in Betracht ziehen.
- Kümmern Sie sich um die Situationen, in denen der Patient das Bett verlassen muss.
- Schalten Sie die Pumpe nicht aus.
- Trennen Sie den Abfluss und sichern Sie ihn mit einem Stopfen.
- Wenn der Patient zurückkehrt, schließen Sie den Abfluss wieder an.
- Bereiten Sie die Spritze für die PCA-Pumpe mit der Morphinlösung vor.
- Analgetische Behandlung von Schmerzen nach Embolisation mit EA.
- Fahren Sie mit EA fort, wenn es für das VAE-Verfahren verwendet wurde.
- Wenn für das UAE-Verfahren eine Lokalanästhesie verwendet wurde und der Patient EA bestellt, stellen Sie vor der Platzierung eines Epiduralkatheters sicher, dass CBC- und Gerinnungstests korrekt sind.
- Stellen Sie sicher, dass der Patient, der für das EAE-Verfahren qualifiziert ist, nicht die in Abschnitt 3.4.3 der Durchführung des VAE-Verfahrens beschriebenen Widersprüche aufweist. Vermerken Sie diese Tatsache in der Krankenakte.
- Rufen Sie einen Anästhesisten an und fragen Sie nach EA.
- Stellen Sie sicher, dass der EA betriebsbereit ist.
- Bestimmen Sie mit dem Anästhesisten den EA-Arbeitsmodus (Bolus oder kontinuierlich). Vermerken Sie diese Tatsache in der Krankenakte.
- Konsultieren Sie im kontinuierlichen Modus (CEA) einen Anästhesisten und überprüfen Sie die Einstellungen der Infusionspumpe.
- Besprechen Sie im Bolusmodus (BEA) mit dem Anästhesisten die Zeitabstände zwischen der Verabreichung des Lokalanästhetikums.
- Halten Sie den Katheter je nach Bedarf 24–48 Stunden lang.
- Überwachen Sie die Schmerzen mit der NRS-Skala. Notieren Sie sich den NRS-Wert in der Krankenakte.
- Verwenden Sie das PAC.
- Fahren Sie mit CEA/BEA fort, bis es benötigt wird, nicht länger als 48 h.
- Setzen Sie die analgetische Behandlung nach PCA oder EA fort, falls erforderlich.
- Bestellen Sie Paracetamol 3 x 1,0 g intravenös.
- Bestellen Sie Diclofenac 2 x 50 mg rektales Zäpfchen.
- Wenn die oben genannte analgetische Behandlung nicht ausreicht, nehmen Sie unterstützende Analgetika auf.
- Bestellen Sie Ketoprofen 2 x 100 mg intravenös.
- Behandeln Sie Harnwegsbeschwerden, indem Sie Furazidin 3 x 100 mg oral bestellen.
5. Kontrollbesuch nach dem Verfahren in den VAE
HINWEIS: Dies richtet sich an Gynäkologen.
- Führen Sie die erste Kontrolluntersuchung am ersten Tag nach den VAE durch.
- Beurteilen Sie den Allgemeinzustand des Patienten.
- Messen Sie die Körpertemperatur des Patienten.
- Bewerten Sie die Schmerzen nach den VAE gemäß der NRS-Skala. Verwenden Sie das PAC.
- Beurteilen Sie die Wunde, an der der Gefäßkatheter eingeführt wurde.
- Führen Sie CBC- und Gerinnungstests durch.
- Führen Sie einen TVUS durch, um den Zustand der Beckenorgane nach den VAE zu beurteilen.
- Führen Sie einen 3D-TVUS mit Volumensonde durch, um das Volumen und die Vaskularisationsindizes des Myoms (VI, FI und VFI) zu beurteilen.
- Wenn es keine Komplikationen gibt und die Schmerzen nach der Embolisation durch orale Analgetika kontrolliert wurden, entlassen Sie den Patienten nach Hause.
- Informieren Sie den Patienten, dass der Patient sofort einen Arzt aufsuchen sollte, wenn nach dem Krankenhausaufenthalt Fieber, Bauchschmerzen und eitriger Vaginalausfluss auftreten.
- Führen Sie den nächsten Kontrollbesuch 3 Monate nach den VAE durch.
- Führen Sie eine gynäkologische Untersuchung, einen CBC-Test und den AMH- oder FSH-Serumspiegel durch.
- Führen Sie eine MRT oder TVUS durch, um den Zustand der Beckenorgane nach UAE zu beurteilen (Abbildung 19).
- Führen Sie eine 3D-TVUS mit einer Volumensonde durch, um das Volumen und die Vaskularisierungsindizes des Myoms (VI, FI und VFI) zu beurteilen.
- Führen Sie den letzten Kontrollbesuch 6 Monate nach der Einreise in die VAE durch.
- Führen Sie eine gynäkologische Untersuchung, einen CBC-Test und den AMH- oder FSH-Serumspiegel durch.
- Führen Sie einen TVUS durch, um den Zustand der Beckenorgane nach den VAE zu beurteilen.
- Führen Sie eine 3D-TVUS mit einer Volumensonde durch, um das Volumen und die Vaskularisierungsindizes des Myoms (VI, FI und VFI) zu beurteilen.
- Bewerten Sie die Wirksamkeit der VAE.
- Vergleichen Sie die Ergebnisse des CBC-Tests vor und nach den VAE.
- Vergleichen Sie die Volumina und Vaskularisationsindizes des Myoms (VI, FI und VFI) vor und nach den VAE.
- Vergleichen Sie die AMH- oder FSH-Spiegel im Serum vor und nach den VAE, um die Möglichkeit einer iatrogenen Schädigung der Eierstöcke während der VAE als Folge einer "Nicht-Ziel"-Embolisation zu beurteilen.
- Informieren Sie die Patientin darüber, dass sie sich nach einer Embolisation der Gebärmutterarterie regelmäßigen gynäkologischen Untersuchungen unterziehen sollte.
- In ausgewählten Fällen (keine Verringerung der Myomsymptome, Verdacht auf Gewebeabgrenzung oder Zweifel an anderen zusätzlichen Untersuchungen) ist ein Jahr nach UAE ein MRT durchzuführen (Abbildung 20).
Ergebnisse
Im Zeitraum von 2009 bis 2019 wurden 557 Eingriffe in den VAE durchgeführt. Das Durchschnittsalter der Patienten lag bei 38 Jahren (31–53 Jahre). Technischer Erfolg wurde bei 547 Patienten (98,2%) erzielt.
Die durchschnittliche Reduktion des Myomvolumens (MRT-Volumenbewertung) 3 Monate nach dem UAE-Eingriff, der im Zeitraum von 2009 bis 2013 in der Gruppe von 206 Patienten im Alter von 32 bis 52 Jahren (Durchschnittsalter: 39 Jahre) durchgeführt wurde, betrug 62%. Die geringste Reduktion betrug 9% (Patient mit hyalinisiertem Myom). Bei Patienten mit dem abgetrennten submukösen Myom (FIGO 0) wurde eine vollständige Reduktion (100%) erreicht. 90 % der Patienten gaben an, nach dem Verfahren in den VAE zufriedenzu sein 64.
Die mittlere Reduktion des Myomvolumens 3 Monate nach UAE (Ultraschall VOCAL Volume Assessment) in einer Gruppe von 65 Patienten im Alter von 29–52 Jahren (Durchschnittsalter: 43,1 Jahre) betrug 50,1 % (2,7 %–93,5 %). Vor dem UAE-Verfahren betrug das mediane Myomvolumen 101 cm3 (Bereich von 23,6 bis 610,0 cm3), während nach 3 Monaten eine Verringerung des medianen Myomvolumens auf 50,4 cm3 (Bereich von 6,9 bis 193,9 cm3) beobachtet wurde. Der Spearman-Korrelationstest zeigte eine statistisch signifikante, aber relativ schwache, positive Korrelation (R = 0,33; p = 0,006) zwischen dem anfänglich dominanten Myomvolumen und der prozentualen Volumenreduktion. Interessanterweise zeigten kleinere Myome eine große Variabilität der Myomvolumenreduktion 3 Monate nach UAE, während größere Myome eine stabile, vorhersagbare Reaktion auf UAE72 zeigten.
Reduktion der Doppler-Gefäßindizes (VI, FI und VFI) in der Gruppe von 17 Patienten 3 Monate nach der Beobachtung der UAE. Die prozentuale Verringerung bei VI und VFI betrug 95,4 %, während sie bei FI 58,3 % betrug75.
Die Beurteilung der ovariellen Reserve wurde bei 30 Patientinnen im Alter von 33–40 Jahren (Durchschnittsalter: 35 Jahre) 3 Monate nach UAE durchgeführt. Das mittlere dominante Myomvolumen betrug 107,75 cm3 (Bereich von 87,4 bis 131,1 cm3). Folgende Marker der ovariellen Reserve wurden untersucht: Antralfollikelzahl (AFC), AMH, Inhibin B (INHB), FSH und Östradiol (E2). Ein signifikanter Rückgang der AFC (56,7 %; p < 0,001), AHM (36,7 %; p < 0,001), INHB (46,7 %; p < 0,001) und E2 (43,3 %; p < 0,001) wurde beobachtet. Gleichzeitig wurde ein signifikanter Anstieg des FSH-Serumspiegels (43,4 %; p < 0,001) beobachtet65.
Drei Monate nach dem UAE-Eingriff wurde bei zwei Patientinnen mit submukösen Myomen (FIGO 0) (mit Durchmessern von 6 cm und 8 cm) eine Uterusinversion bei der Ausscheidung von markierten, nekrotischen Fragmenten von Myomen durch den Gebärmutterhalskanal beobachtet, was zu einer Notfall-Hysterektomie führte.
Die Schmerzreduktion nach der Embolisation (gemäß PAC) mit PCA (Verfahren 4.2 der Patientenversorgung nach dem UAE-Protokoll) wurde bei 60 Patienten auf der NRS-Skala am Tag nach dem VAE-Verfahren bewertet. Die mediane NRS unmittelbar nach der UAE betrug 10 (Bereich 5–10), während die mediane NRS nach der Behandlung mit 4 (Bereich 1–5) bewertet wurde. Der Spearman-Korrelationstest zwischen dem anfänglichen Volumen der Myome (Median 194,5 cm3, Bereich 79–411 cm3) und der NRS unmittelbar nach UAE zeigte eine statistisch signifikante, starke positive Korrelation (R = 0,6; p < 0,001), während die Korrelation zwischen dem anfänglichen Volumen der Myome und der NRS nach der Behandlung eine statistisch signifikante, schwach positive Korrelation aufwies (R = 0,34; p < 0,001). Bei der Analyse der oben genannten Zusammenhänge kann der Schluss gezogen werden, dass große Myome nach UAE stärkere Schmerzen nach der Embolisation nach UAE verursachen. Die Behandlung von Schmerzen nach der Embolisation nach UAE kleinerer Myome mit PCA führt jedoch zu besseren Ergebnissen.
Zusammengefasste Daten für repräsentative Ergebnisse sind in Tabelle 1 enthalten.
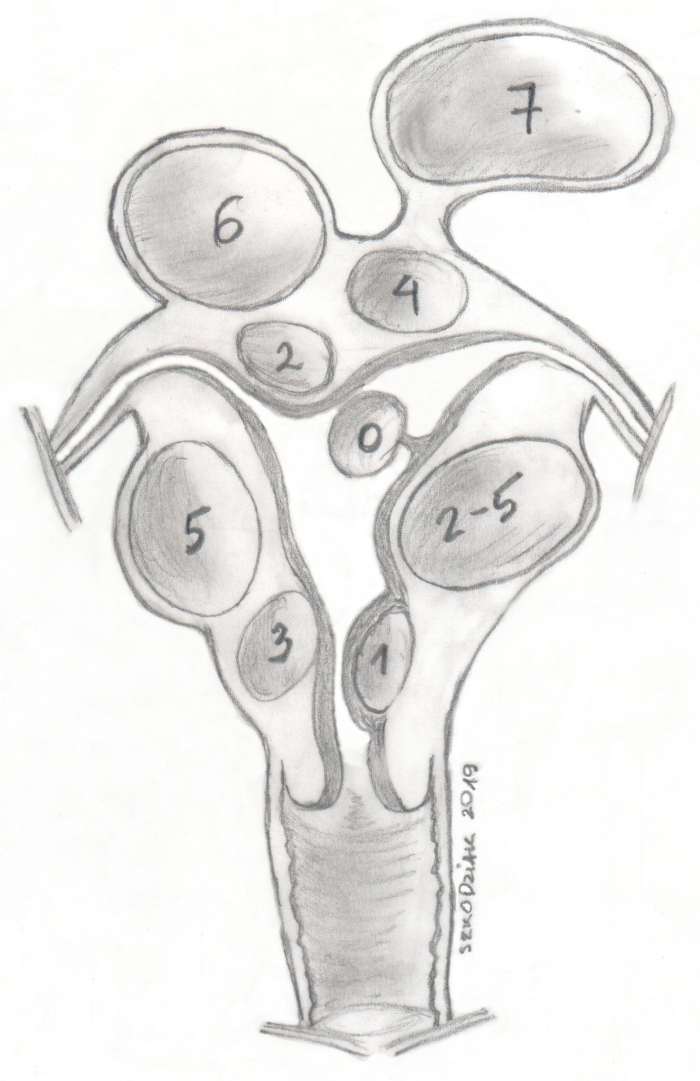
Abbildung 1: Klassifikation der Uterusmyome von FIGO. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
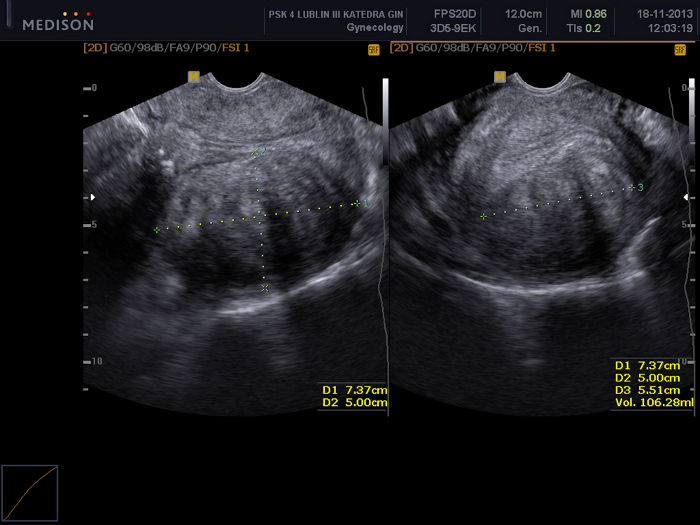
Abbildung 2: Untersuchung des Beckens mittels transvaginaler Ultraschalluntersuchung.
Zu sehen ist ein Uterusmyom (FIGO 5) mit den Maßen 73 x 50 x 55 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: MRT-Untersuchung des Beckens in der Präqualifikation für die VAE.
Sichtbar im sagittalen Schnitt ein großes Uterusmyom (FIGO 2–5) mit Massenwirkung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Becken-MRT-Untersuchung in der Präqualifikation für die VAE.
Sichtbar im sagittalen Schnitt ein Uterusmyom (FIGO 2–5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
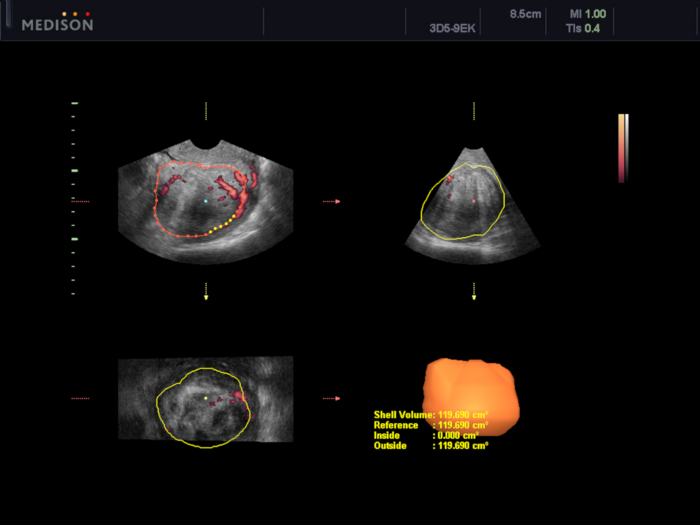
Abbildung 5: Beurteilung des Volumens des Uterusmyoms mit der Software VOCAL.
In diesem Fall wird das Volumen auf 119,7 cmgeschätzt 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
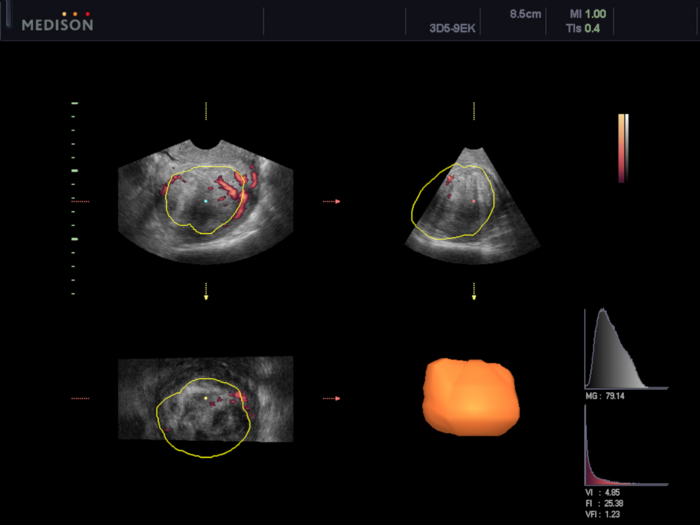
Abbildung 6: Beurteilung der Vaskularisation des Uterusmyoms mit der Software VOCAL.
In diesem Fall wurden die Vaskularisierungsindizes berechnet (VI 4,85, FI 25,38 und VFI 1,23). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
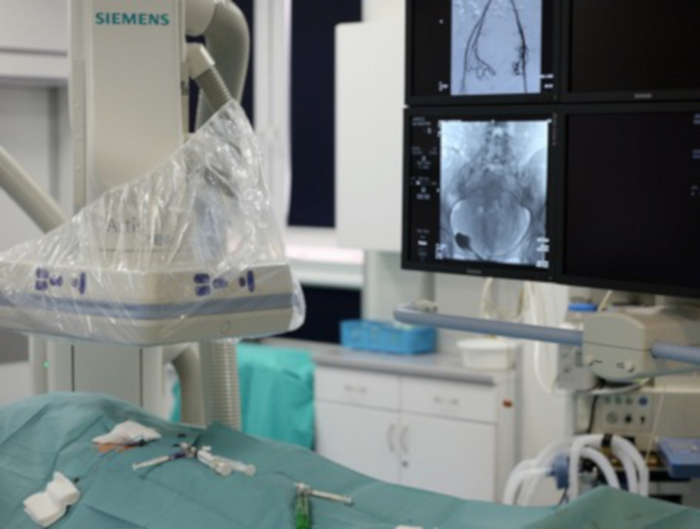
Abbildung 7: Das Bild zeigt ein Fragment des angiographischen Labors.
In der unteren linken Ecke befindet sich der Patient mit einer freiliegenden Leiste, durch die weitere Werkzeuge eingeführt werden. In der oberen linken Ecke ist der C-Bogen des Angiographen zu sehen. In der oberen rechten Ecke sind die Monitore sichtbar, auf denen der Bediener das Eingabewerkzeug verfolgt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Ein Set für arterielle Punktionen.
Von unten: eine Nadel, ein Gefäßschloss mit einem Einführknopf und eine Führung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
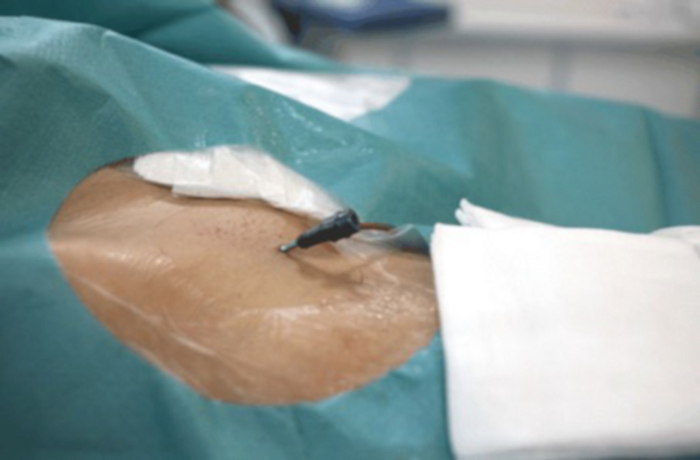
Abbildung 9: Nahaufnahme der Leiste mit sichtbarem Gefäßverschluss, der in die Oberschenkelarterie eingeführt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
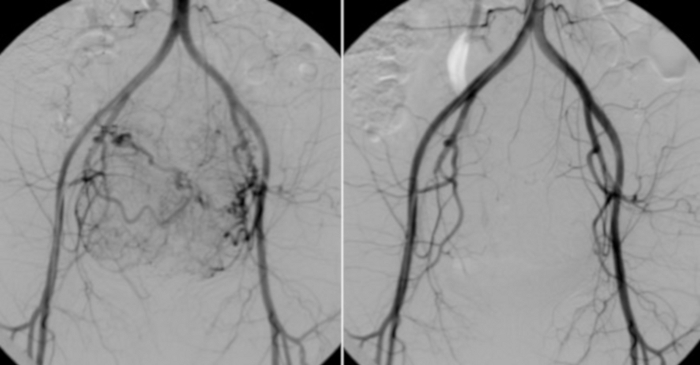
Abbildung 10: Links Angiographie aus einem Katheter, der in die Bauchschlagader gelegt wurde.
Die sichtbare Gefäßlagerung von Uterusmyomen. Zum Vergleich (rechts) ein Kontrolltest, der nach den VAE durchgeführt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
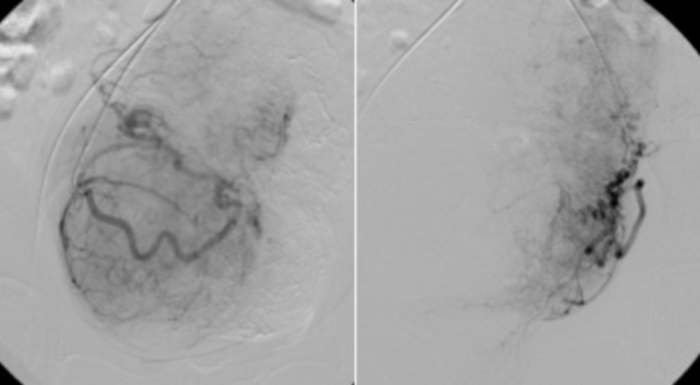
Abbildung 11: Selektive Angiographie mittels RUC-Katheter, der in den proximalen Teilen der Uterusarterien platziert wird.
Sichtbares Gefäßbett mit Uterusmyomen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
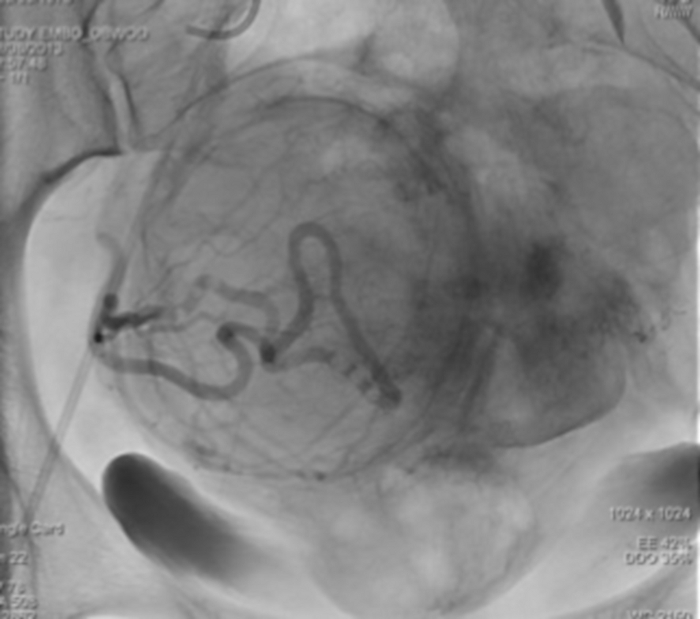
Abbildung 12: Die Einzelröntgenaufnahme, die die Stase des Kontrastmittels in der rechten Uterusarterie zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 13: Die Kontrollangiographie, die am Hauptkatheter in der linken bzw. rechten Beckenarterie durchgeführt wird, bestätigt den fehlenden Zufluss von frischem Blut (Beschattung) in die Uterusarterien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 14: Die Gefäßzugangsstelle nach der Fertigstellung von UAE.
Sichtbarer 2-mm-Schnitt in der Nähe der rechten Leiste. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 15: Einstellungen der PCA-Pumpenparameter für Schmerzen nach der Embolisation nach der Behandlung in den VAE (Abschnitt 4.2.3 der Patientenversorgung nach dem UAE-PROTOKOLL). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 16: PCA-Pumpe in Betrieb.
Das Verhältnis von intravenösem Bolus auf Abruf zu "leerem Bolus" (Abschnitt 4.2.6.2. der Patientenversorgung nach dem VAE-PROTOKOLL) 1:1 (50%:50%). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 17: PCA-Pumpe in Betrieb.
Das Verhältnis von intravenösem Bolus auf Abruf zu "leerem Bolus" (Abschnitt 4.2.6.3. der Patientenversorgung nach dem VAE-PROTOKOLL) 1:2 (33%:67%). Dies erfordert eine zusätzliche analgetische Behandlung (Verfahren 4.2.6.4. der Patientenversorgung nach dem VAE-PROTOKOLL). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 18: PCA-Pumpe in Betrieb.
Das Verhältnis von intravenösem Bolus auf Abruf zu "leerem Bolus" (Abschnitt 4.2.6.3. der Patientenversorgung nach dem VAE-PROTOKOLL) 1:3 (25%:75%). Dies erfordert die Fortsetzung einer zusätzlichen analgetischen Behandlung (Verfahren 4.2.6.4. der Patientenversorgung nach dem VAE-PROTOKOLL). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
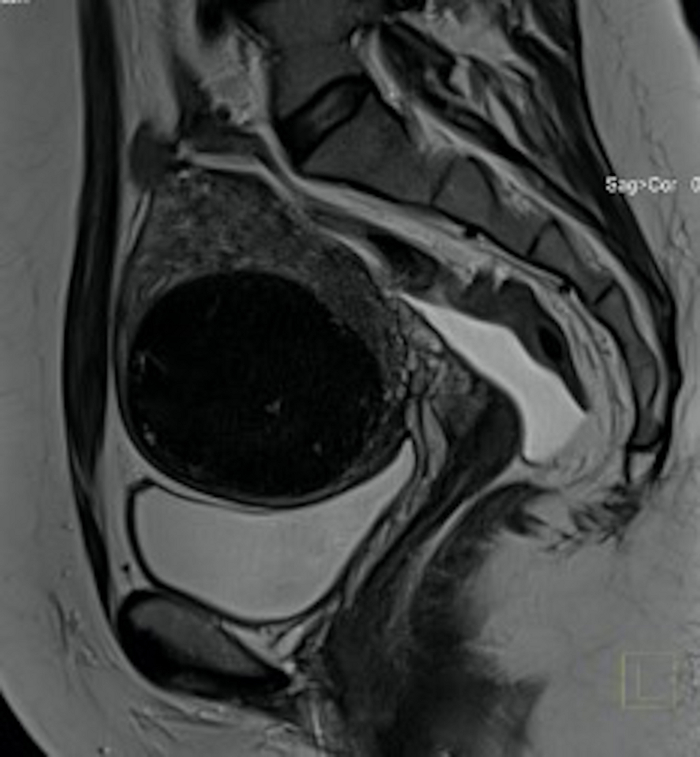
Abbildung 19: MRT-Untersuchung des Beckens 3 Monate nach dem UAE-Eingriff (gleicher Fall wie in Abbildung 3).
Im sagittalen Schnitt ist ein Uterusmyom (FIGO 5) sichtbar, deutlich kleiner als vor dem Eingriff, unterschiedliche Dichte des Myomgewebes. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
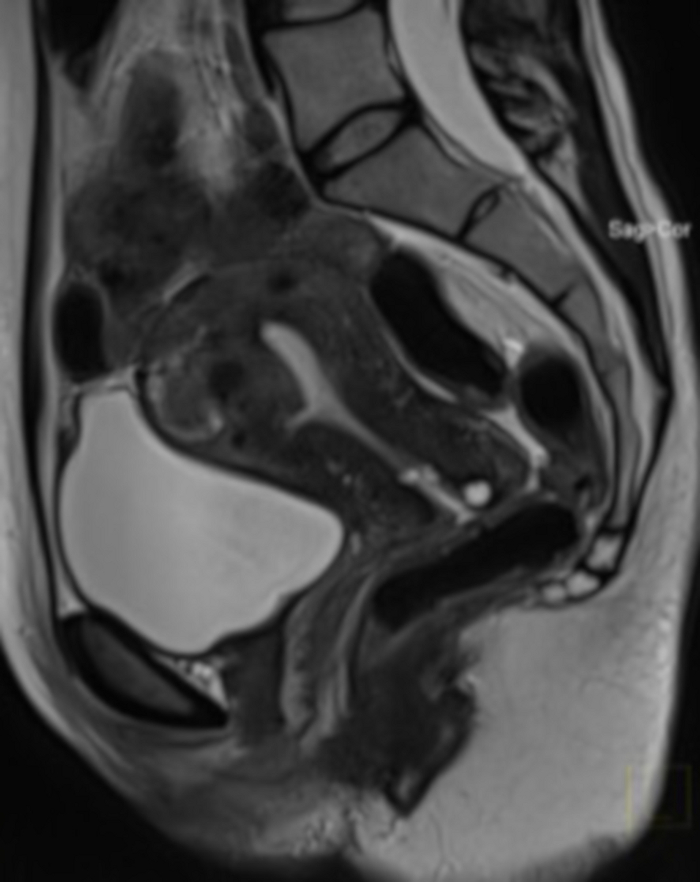
Abbildung 20: MRT-Untersuchung des Beckens 1 Jahr nach dem UAE-Eingriff (gleicher Fall wie in Abbildung 4).
Im sagittalen Schnitt ist ein Uterusmyom (FIGO 2–5) sichtbar, mit einer sehr starken Volumenreduktion nach UAE. Die MRT wurde wegen Verdacht auf eine Gewebeabgrenzung nach dem Eingriff durchgeführt (keine Möglichkeit, die Myomstruktur in einer bimanuellen Untersuchung zu beurteilen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| REPRÄSENTATIVE ERGEBNISSE / DAS LUBLIN-PROTOKOLL 64,65,72 | ||
| Die Anzahl der in den VAE durchgeführten Eingriffe im Zeitraum von 2009 bis 2019 | 557 | |
| Technischer Erfolg | Erreicht bei 547 Patienten (98,2 %) | |
| Die mittlere Reduktion des Myomvolumens (MRT-Volumenbeurteilung) 3 Monate nach UAE in der Gruppe von 206 Patienten im Alter von 32 bis 52 Jahren (Durchschnittsalter - 39 Jahre) | 62.0% (9.0-100.0%) | |
| Die mittlere Reduktion des Myomvolumens (Ultraschall VOCAL Volume Assessment) 3 Monate nach UAE in der Gruppe von 65 Patienten im Alter von 29-52 Jahren (Durchschnittsalter – 43,1 Jahre) | 50.1% (2.7-93.5%) | |
| Beurteilung der ovariellen Reserve | Rückgang der AFC | 56,7 % (p<0,001) |
| Abnahme der AMH | 36,7 % (p<0,001) | |
| Rückgang des INHB | 46,7 % (p<0,001) | |
| Abnahme von E2 | 43,3 % (p<0,001) | |
| Anstieg der FSH | 43,4 % (p<0,001) | |
| Schmerzreduktion nach der Embolisation (nach PAC) mit Hilfe von PCA (Verfahren 2. des Protokolls "Patientenversorgung nach den VAE"), das in der Gruppe von 60 Patienten bewertet wurde | Der Median der NRS unmittelbar nach den VAE | 10 (Bereich 5-10) |
| Der Median der NRS am Tag nach den VAE | 4 (Bereich 1-5) | |
Tabelle 1: Repräsentative Ergebnisse der UAE-Technik bei der Behandlung von symptomatischen Uterusmyomen, die gemäß dem Lublin-Protokoll durchgeführt wurde.
Diskussion
Aufgrund der Unterschiede in der Struktur, Größe, Lokalisation und Symptomatik von Uterusmyomen war die Erstellung eines einheitlichen VAE-Protokolls keine leichte Aufgabe. Es gab viele Diskrepanzen zwischen den Annahmen über diese therapeutische Methode und den Erwartungen der Patienten, sowohl im Stadium der Qualifizierung als auch in den Auswirkungen der Behandlung. Mehr als einmal berichteten Patientinnen, die in die VAE überwiesen wurden, über keine klinischen Anzeichen von Myomen und wussten nicht, dass diese Gebärmuttertumoren nicht radikal entfernt werden würden. Die einzige explizite Erwartung war, Myome ohne Operation loszuwerden.
Daher ist es wichtig, dass die Patientin die Annahmen dieser Methode versteht, sie akzeptiert und die Unterschiede zu den alternativen Methoden der Behandlung von Uterusmyomen kennt. Ihre bewusste Entscheidung (Abschnitt 1.1. des Protokolls zur Qualifikation für die VAE) ist ein kritischer Punkt, und seine ordnungsgemäße Umsetzung wird es ermöglichen, das Protokoll fortzusetzen.
Während der Implementierung des Protokolls werden einige Verfahren wiederholt. Dies ist beabsichtigt und ergibt sich aus der von dieser Zeitschrift angenommenen Formel, in der einzelne Befehle im imperativen Modus geschrieben und an eine Person gerichtet werden. Häufig sind jedoch mehrere Ärzte an der Qualifizierung, Vorbereitung und anderen Phasen in den VAE beteiligt. Dies sind auch kritische Punkte des Protokolls; Ihre Unterlassung kann in den VAE unter nicht optimalen Bedingungen oder bei Vorhandensein von Kontraindikationen dazu führen. Daher die Unterteilung des Protokolls in 5 Kapitel. So kann es von verschiedenen Spezialisten fortgeführt werden, und die wiederholten Protokollpunkte werden dann unabhängig voneinander überprüft.
Eine zusätzliche Schwierigkeit bei der Erstellung eines einheitlichen Protokolls für die Embolisation der Uterusarterie bei der Behandlung von Uterusmyomen ist die derzeitige große Anzahl von Empfehlungen (bis zu 11), die sich auf dasselbe Verfahren beziehen41. Obwohl ihre Annahmen ähnlich sind, steckt wie immer "der Teufel im Detail", und diese Details bedurften einer Vereinheitlichung. Relative Kontraindikationen in Bezug auf die Lokalisation von Myomen oder Fortpflanzungspläne von Patienten, die sich einer VAE unterziehen, sind bei der Qualifizierung am umstrittensten. Unter Anwendung strengerer Kriterien, die vom SHAB vorgeschlagen werden, sollten Patienten von diesem Verfahren ausgeschlossen werden, während liberalere RCOG-Empfehlungen eine Qualifikation für VAE 14,32,43 ermöglichen. Die Frage ist, was zu tun ist. Bei der Erstellung des Protokolls haben wir die Entscheidung (abgesehen von umfangreicher Literatur) auf die Analyse unserer Fälle und die gewonnenen Erfahrungen gestützt, die eine individuelle Herangehensweise an jeden Patienten erfordern. Daher schließt das Protokoll die Durchführung von UAE bei Patienten mit relativen Kontraindikationen nicht aus (Abschnitte 1.4 der Qualifikation für das UAE-Protokoll). Die richtige Qualifikation und Vorbereitung auf die VAE scheint der Schlüssel zum therapeutischen Erfolg zu sein. Sehr wichtig ist auch die Technik selbst, ebenso wie die Versorgung in den VAE, die nicht nur den therapeutischen Erfolg oder die Patientenzufriedenheit gewährleistet, sondern auch das Fehlen der oben beschriebenen Komplikationen.
Unabhängig von der Anzahl der Myome werden alle Läsionen während eines Eingriffs embolisiert. In der Regel gilt: Je mehr Myome, desto mehr wird das Embolisationsmaterial injiziert. Dies verlängert die Dauer der Embolisation, ändert aber nichts am Ablauf. Die UAE kann modifiziert werden, wenn wir eine offensichtliche Verbindung zur Ovarialarterie sehen, was zu einem erhöhten Risiko einer Non-Target-Embolisation führen kann. Wir können dann eine solche Verbindung schließen (z. B. mit Spiralen), wodurch die Versorgung der Eierstöcke und der Gebärmutter getrennt wird, und dann die Embolisation mit Hilfe von 700 μm Partikeln fortsetzen. Wenn es nicht möglich ist, Spulen zu implantieren, erhöhen wir den Partikeldurchmesser auf 900 μm.
Es gibt auch einige Fälle, in denen die Myome von der Seite der Eierstockarterien zugeführt werden können; Dann sind die Gebärmutterarterien hypoplastisch. In diesen Fällen sollte für eine erfolgreiche Embolisation ein Mikrokatheter in die Eierstockarterie und an den Eierstock eingeführt werden, wobei das Embolisationsmaterial in das Gefäßbett der Gebärmutter eingebracht wird, während die ordnungsgemäße Versorgung der Eierstöcke aufrechterhalten wird.
Der unbestrittene Vorteil der Embolisation ist die Tatsache, dass es sich nicht um ein technisch schwieriges Verfahren handelt und keine ausgeklügelte Ausrüstung erforderlich ist.
Die Stärken des Protokolls sind die Punkte in Bezug auf die Behandlung von Schmerzen nach der Embolisation, von denen mindestens die Hälfte der Patienten bei der Qualifizierung für UAE noch nichts gehört hatte. Das von uns vorgeschlagene Standardverfahren ist die Verwendung einer PCA-Pumpe (Abschnitt 4.2 der Patientenversorgung nach dem VAE-Protokoll), und die erzielten Ergebnisse bestätigen die hohe Wirksamkeit einer solchen Behandlung.
In Bezug auf zukünftige Änderungen des VAE-Protokolls scheint es möglich, Abschnitt 10 der Vorbereitung auf das VAE-Protokoll zu ändern, der die Entfernung der Spirale aus der Gebärmutter vor dem Eingriff aufgrund des Risikos von Entzündungen und Sepsis vorschreibt. In großen Folgestudien liegt das Risiko einer Infektion des Beckens in Kombination mit dem Vorhandensein einer Spirale bei weniger als 1 zu 130049.
VAE wurde seit seiner ersten Anwendung als experimentelle Methode behandelt, da es eine Bewertung der Wirksamkeit und die Untersuchung der Komplikationen erforderte, die dieses Verfahren kurz- und langfristig verursachen kann. In diesen Jahren wurden Indikationen und Kontraindikationen auf der Grundlage neuer Testergebnisse und klinischer Beobachtungen modifiziert. Aktuelle Daten, darunter mehrere randomisierte kontrollierte Studien, erkennen die UAE als wertvolle Behandlungsmethode für symptomatische Uterusmyome an, deren Wirksamkeit und Sicherheit gut etabliert sind.
Die Erstellung des oben genannten Protokolls ist das Ergebnis einer gründlichen Analyse der aktuellen Literatur, relevanter Empfehlungen und Erfahrungen, die durch die enge Zusammenarbeit von Gynäkologen und chirurgischen Radiologen während des Jahrzehnts gewonnen wurden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
AUSSAGE:
Piotr Szkodziak als Autor der Abbildung 1, die die FIGO-Klassifikation der Uterusmyome veranschaulicht, ermöglicht die freie Verwendung der Abbildung für wissenschaftliche und pädagogische Anwendungen ohne jegliche Änderungen. Die Absicht, die Abbildung zu ändern, sollte vom Autor akzeptiert werden (piotr.szkodziak@gmail.com).
Danksagungen
Die Autoren danken dem gesamten Team des 3. Lehrstuhls und der Abteilung für Gynäkologie und der Abteilung für Interventionelle Radiologie und Neuroradiologie der Medizinischen Universität Lublin für ihre Hilfe bei der Implementierung des Protokolls zur Embolisation der Gebärmutterarterien Lublin.
Materialien
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
Referenzen
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten