Method Article
Mielinização e Remielinização Ex Vivo em Culturas de Fatias Cerebelares como Modelo Quantitativo para Manipulações Relevantes para o Desenvolvimento e a Doença
Neste Artigo
Resumo
Apresenta-se um protocolo para um modelo quantitativo ex vivo de desmielinização e remielinização usando culturas de fatias cerebelares de camundongos. Este método recapitula de perto um modelo in vivo com seu complemento completo de tipos de células do SNC em tecido intacto, mantendo a receptividade química, genética e ambiental de um sistema in vitro.
Resumo
O estudo da mielinização in vitro e in vivo apresenta inúmeros desafios. A diferenciação de células precursoras de oligodendrócitos (OPCs) in vitro, embora escalável, não recapitula a mielinização axonal. As coculturas de neurônios OPC e as culturas de fibras OPC permitem o exame da mielinização in vitro, mas carecem de tipos de células adicionais presentes in vivo, como astrócitos e micróglia. Os modelos de camundongos in vivo, no entanto, são menos passíveis de manipulação química, ambiental e genética e são muito mais trabalhosos. Aqui, descrevemos um sistema quantitativo de cultura de fatia cerebelar de camundongo ex vivo (CSC) que é útil para: 1) estudar a mielinização do desenvolvimento, 2) modelar a desmielinização e remielinização e 3) conduzir pesquisas translacionais. Seções sagitais do cerebelo e rombencéfalo são isoladas de camundongos pós-natais do dia (P) 0–2, após o que mielinizam ex vivo por 12 dias. Durante esse período, as fatias podem ser manipuladas de várias maneiras, incluindo a adição de compostos para testar o efeito na mielinização do desenvolvimento. Além disso, o tecido pode ser fixado para microscopia eletrônica para avaliar a ultraestrutura e compactação da mielina. Para modelar a doença, a CSC pode ser submetida a hipóxia aguda para induzir a hipomielinização. A desmielinização nesses explantes também pode ser induzida pela lisolecitina, que permite a identificação de fatores que promovem a remielinização. Além das modificações químicas e ambientais, o CSC pode ser isolado de camundongos transgênicos e responde à manipulação genética induzida com adenovírus Ad-Cre e tamoxifeno. Assim, as culturas de fatias cerebelares são um modelo rápido, reprodutível e quantificável para recapitular a mielinização.
Introdução
A mielinização dos axônios permite a rápida propagação dos potenciais de ação, mecanismo conhecido como condução saltatória1. A importância da mielina é ressaltada por doenças desmielinizantes, como a esclerose múltipla (EM), que incluem uma ampla gama de manifestações debilitantes, incluindo perda de visão, problemas cognitivos e paralisia. Não há cura para a EM, e as terapias atuais se concentram em limitar a progressão da doença, visando as células imunológicas periféricas. Acredita-se que a incapacidade na EM e doenças relacionadas seja causada por uma falha na remielinização e neurodegeneração progressiva. Em particular, desmielinização, atrofia e perda axonal são observadas na EM progressiva 2,3. Assim, promover a remielinização representa uma estratégia promissora que pode ser realizada em paralelo aos tratamentos atuais e produzir benefícios terapêuticos adicionais.
No sistema nervoso central (SNC), a mielinização é realizada por células gliais especializadas conhecidas como oligodendrócitos. As células precursoras de oligodendrócitos (OPCs) se diferenciam em oligodendrócitos mielinizantes maduros por meio de uma série de etapas altamente orquestradas, incluindo o crescimento de processos que entram em contato com axônios, aumentos na complexidade morfológica, expansão da membrana de mielina e, finalmente, compactação da bainha de mielina4. Assim, a interação entre oligodendrócitos e neurônios é altamente íntima. Interações recíprocas entre neurônios e oligodendrócitos também são necessárias para a saúde e manutenção do SNC2. A atividade axonal desempenha um papel na estimulação da mielinização e os fatores neurotróficos gliais apoiam a integridade dos neurônios. A importância da diafonia glia-glia no SNC também está se tornando cada vez mais reconhecida 5,6,7,8. Por exemplo, fatores astrocíticos podem influenciar a diferenciação de OPCs e a manutenção de tratos de substância branca. A microglia também desempenha um papel na modulação da diferenciação de OPC, bem como na limpeza de detritos de mielina, uma etapa importante do processo de remielinização. Identificar fatores autônomos celulares e compreender a influência de outros tipos de células do SNC na desmielinização e remielinização será inestimável para o desenvolvimento de terapias para doenças desmielinizantes e desmielinizantes.
Aqui, descrevemos um sistema ex vivo usando culturas de fatias cerebelares de camundongos (CSC) que permite a manipulação e quantificação de tecido intacto do SNC. O uso de CSC permite que a mielinização, ou remielinização após a indução da desmielinização pela lisolecitina 9,10, seja medida usando métodos tradicionalmente usados em estudos in vivo, como imunomarcação e microscopia eletrônica 11,12,13. A lisolecitina é um produto químico que perturba a membrana e resulta em uma rápida perda de mielina e oligodendrócitos. Uma possível ressalva a ser observada é que a lisolecitina também pode resultar na redução de outros tipos de células próximas à área da lesão. Ao contrário dos experimentos in vivo, no entanto, as fatias sagitais do cerebelo podem ser facilmente manipuladas por meio da adição de compostos ou geneticamente alteradas usando adenovírus Ad-Cre. O método também permite a manipulação de tecido isolado de camundongos transgênicos ou submetidos a insultos ambientais, como hipóxia 11,12,13,14. O modelo CSC, portanto, permite o estudo da mielinização do desenvolvimento, modelagem de doenças e identificação de fatores que promovem ou inibem a mielinização, ao mesmo tempo em que integra as contribuições de diferentes tipos de células do SNC para a função dos oligodendrócitos.
Protocolo
Todos os estudos em animais foram autorizados e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Genentech.
1. Preparação de meios e suprimentos para dissecação (~ 30–45 min)
- Prepare e esterilize o meio de cultura de fatias de filtro (SCM) e o meio de dissecção (DM) conforme detalhado na Tabela 1. Conservar a 4 °C. Se algum fator estiver sendo testado para o ensaio de mielinização, adicione-o ao SCM imediatamente antes de usar.
- Pipete 1 mL de SCM em cada poço de placa de 6 poços.
- Usando uma pinça estéril, coloque uma inserção organotípica em cada poço, garantindo que nenhuma bolha fique presa sob a membrana. Aqueça a placa com mídia a 37 °C em incubadora de CO7.5% 2 .
2. Preparação da área de dissecção (~5–10 min)
- Realize procedimentos em uma capela de fluxo laminar estéril ou na bancada com técnicas assépticas adequadas para todas as etapas do procedimento. Limpe todas as áreas com etanol 70%.
- Coloque uma nova lâmina e um novo estágio de corte de silicone no picador de tecidos. Pipete ~300 μL de água estéril ou etanol a 70% sob o estágio de corte para garantir que permaneça no lugar.
- Use um cotonete para limpar suavemente a lâmina do picador de lenços de papel e o estágio de corte com etanol a 70%. Seque antes de usar o picador de tecidos.
- Pulverize todas as ferramentas de dissecação com etanol a 70% e seque antes da dissecação.
- Prepare duas placas de Petri de 10 cm: uma com 15–20 mL de MS, outra com 10 mL de SCM. Armazene no gelo. Mantenha todos os meios e placas de Petri no gelo quando não estiver dissecando.
3. Dissecção da cultura de fatias cerebelares (~ 15–20 min por filhote)
- Coloque a placa de Petri com DM em um microscópio de dissecação.
- Eutanásia de um filhote de camundongo, dia pós-natal P0-2, por decapitação rápida com tesouras afiadas.
- Coloque a cabeça na placa de Petri com DM sob o microscópio de dissecação para limpar o sangue.
- Usando uma tesoura fina, corte uma vez em cada borda lateral na base do crânio.
- Com a cabeça colocada de cabeça para baixo em DM, pressione firmemente a parte inferior do crânio usando uma pinça # 5/45, forçando o rombencéfalo não danificado através do orifício no crânio.
- Sob o microscópio de dissecação, corte o excesso de tecido usando dois bisturis # 11. Certifique-se de que o cerebelo permaneça preso à parte subjacente do rombencéfalo. Consulte a Figura 1A para obter um diagrama detalhado.
- Usando a espátula, transfira o cerebelo para o estágio de corte do cortador de tecidos com o tecido apoiado na face rostral do rombencéfalo e a face caudal do rombencéfalo voltada para o pesquisador. Certifique-se de que o plano medial do cérebro esteja exatamente paralelo à lâmina do picador de tecidos.
- Usando a pipeta P200, remova o excesso de meio ao redor do tecido, garantindo que ele ainda esteja úmido, mas não flutuando ou cercado por líquido.
- Troque a placa de Petri contendo DM pela placa de Petri contendo SCM sob o microscópio de dissecação.
- Corte o tecido em fatias de 350 μm de espessura usando o picador de tecidos.
NOTA: A velocidade da lâmina (por exemplo, aproximadamente um corte por segundo) e a força precisam ser otimizadas para garantir condições de corte ideais. Em casos raros, o tecido ficará preso na lâmina. Para minimizar a perda de seções de tecido, mantenha o polegar no botão liga/desliga para desligar rapidamente o picador de tecidos, se necessário. - Pipete suavemente 100 μL de SCM sob o tecido, para que as fatias flutuem. Transferir o tecido fatiado com a espátula para a placa de Petri com SCM ao microscópio de dissecação.
- Use um cotonete para limpar suavemente a lâmina do picador de lenços de papel e o estágio de corte com etanol a 70%.
- Usando os bisturis (lado rombudo), separe delicadamente as fatias sob o microscópio de dissecação. Usando um bisturi e uma espátula, transfira as fatias para a membrana na placa de 6 poços com SCM.
NOTA: As seções mais mediais geralmente têm a melhor mielinização e integridade do tecido. Em média, 4 a 6 fatias podem ser dissecadas de um cérebro de camundongo. - Incubar fatias em SCM a 37 °C em 7,5% de CO2.
4. Mudanças de cultura e mídia (~ 15–30 min)
- Substitua o SCM a cada dois dias.
- Pipete 1 mL de meio fresco em cada poço de uma nova placa de 6 poços e aqueça em uma incubadora. Usando uma pinça estéril, transfira as membranas para a nova placa, garantindo que não haja bolhas por baixo. Devolva as placas para a incubadora.
5. Mielinização e remielinização padrão
- Protocolo padrão de mielinização (Figura 1B).
- Cortes de cultura dissecados na seção 3 de 0 a 12 dias in vitro (DIV). Se o efeito de qualquer fator na mielinização estiver sendo testado, adicione-o ao meio no momento da cultura (0 DIV) e reabasteça-o a cada mudança de meio.
- Corrija em 12 DIV (etapa 7.1), um ponto de tempo otimizado para mielinização incompleta 11,12,13. Isso permite a detecção de quaisquer efeitos de aumento ou bloqueio na mielinização devido ao fator adicionado ao meio. Um resultado positivo representativo com a adição de 100 ng/mL de Activina A é mostrado na Figura 2.
- Protocolo de remielinização (Figura 1C)
- Siga o protocolo de mielinização padrão descrito na seção 5.1 sem fatores adicionais até 14 DIV, momento em que os cortes estão totalmente mielinizados 11,12,13.
- Prepare o estoque de lisolecitina (125 mg / mL) conforme detalhado na Tabela 1. Pipete 1 mL de lisolecitina a 0,5% em SCM em cada poço de uma nova placa de 6 poços e aqueça em uma incubadora.
- Transfira as membranas para uma placa de lisolecitina e coloque em uma incubadora durante a noite por 16 a 18 h.
- No dia seguinte, prepare novas placas com SCM fresco, adicionando qualquer fator que esteja sendo testado quanto aos efeitos da remielinização, se necessário. Pratos quentes em uma incubadora.
- Para a troca de meio, bata suavemente na membrana na lateral do poço para garantir que todo o meio de lisolecitina seja removido. Reabasteça o(s) fator(es) que está(ão) sendo testado(s) em cada mudança de mídia (seção 4).
- Corrija as fatias em 28 DIV (etapa 7.1), um ponto de tempo otimizado para remielinização incompleta. Isso permite a detecção de realce ou bloqueio da remielinização devido ao fator adicionado ao meio. Um resultado positivo representativo com a adição de 0,1 μM XAV939 é apresentado na Figura 3.
6. Variações do protocolo de mielinização e remielinização
- Protocolo de hipomielinização induzida por hipóxia (Figura 1D)11,13.
NOTA: Isso é apresentado como uma variação do protocolo de mielinização padrão apresentado na seção 5.1.- Fatias de placa em SCM sem fatores.
- Transfira as placas de fatias para uma incubadora hipóxica (2% FiO2) por 24 h entre 2–3 DIV.
- No dia seguinte, prepare novas placas com SCM fresco, adicionando qualquer fator que esteja sendo testado quanto ao potencial de mielinização, se necessário. Pratos quentes em uma incubadora.
- Após a cultura em hipóxia, troque o meio (seção 4) e retorne as culturas para uma incubadora de cultura padrão (37 ° C, 7,5% CO2). Reabasteça todos os fatores que estão sendo testados com cada mudança de mídia subsequente (seção 4).
- Corrija em 12 DIV (etapa 7.1).
- Protocolo de manipulação genética (Figura 1E)13
- Isole o tecido de camundongos transgênicos para dissecação, como na seção 3.
- Com linhagens de camundongos transgênicos induzíveis, o tamoxifeno (100 nM, uma dose que não induz mielinização ou diferenciação de OPC) ou um adenovírus Ad-Cre podem ser adicionados ao SCM durante as mudanças de mídia feitas em 1 DIV e 3 DIV.
- Após a manipulação genética com tamoxifeno ou adenovírus Ad-Cre, continue as alterações de mídia a cada dois dias, como na seção 4 (com fatores adicionados, se necessário).
NOTAS: Todas as fatias de um camundongo cabem em uma membrana, permitindo a genotipagem após a dissecação, simplificando assim os experimentos com camundongos transgênicos.
7. Processamento e análise de tecidos
- Fixe as fatias submergindo suavemente a membrana em paraformaldeído a 4% por 1 h em temperatura ambiente (RT).
- Enxágue suavemente submergindo em solução salina tamponada com fosfato (PBS). Em seguida, mergulhe em PBS em uma placa de 6 poços.
NOTA: O protocolo pode ser pausado aqui. As fatias fixas podem ser armazenadas em PBS a 4 °C por até um mês. Se não for armazenar fatias, enxágue 2x em PBS por 5 min antes de prosseguir. - Use um bisturi para cortar a membrana do anel e prossiga com a coloração em uma placa de 6 poços. Certifique-se de manter as fatias voltadas para cima (com a membrana voltada para baixo) para coloração e posterior montagem nas lâminas.
- Bloquear por 1 h em RT em solução em bloco (soro de cavalo inativado por calor a 3%, albumina de soro bovino a 2% e Triton-X 100 a 0,25% diluído em PBS).
NOTA: Se a recuperação do antígeno for necessária para a coloração de anticorpos (por exemplo, CC1 / Olig2), isso pode ser feito em placas de Petri de vidro. - Envolver as placas em película de parafina e incubar durante a noite a 4 °C em anticorpo primário diluído em solução de bloqueio.
- Lave 3x em solução de bloqueio: 1) enxágue breve, 2) lavagem de 15 min e 3) lavagem de 1 h. Para um breve enxágue, encha uma pequena placa de Petri com solução e mergulhe suavemente a membrana usando uma pinça antes de transferir para uma solução fresca. Para lavagens mais longas (ou seja, 15 min e 1 h), mergulhe a membrana em solução em uma placa de 6 poços e coloque em um balancim suave.
- Incubar coberto da luz por 2 h em RT em anticorpos secundários diluídos 1:500 em PBS.
- Lave 3x em PBS: 1) enxágue breve, 2) lavagem de 15 min e 3) lavagem de 1 h.
- Se for necessária a coloração com DAPI, mergulhe em solução de DAPI 1:1.000 por 7 min em RT. Enxágue brevemente e depois lave por 15 min em PBS.
- Enxágüe em água bidestilada
- Monte as membranas em uma lâmina com as fatias voltadas para cima (lado da membrana para baixo).
NOTA: As fatias montadas podem ser armazenadas a 4 °C. A imagem em um microscópio confocal é melhor feita dentro de 1 semana, antes que a membrana se torne opaca e difícil de visualizar. - Corte a imagem usando microscopia confocal e quantifique conforme descrito anteriormente 11,12,13.
Resultados
Culturas de fatias cerebelares derivadas de camundongos P0-2 (Figura 1A) foram usadas para estudar a mielinização e avaliar os efeitos da adição de vários fatores de 0-12 DIV (Figura 1B). Para estudar a remielinização, as culturas de fatias em 14 DIV foram primeiro desmielinizadas com lisolecitina e deixadas remielinizadas por 14 dias adicionais em cultura com os fatores testados (Figura 1C), após o que a remielinização foi quantificada. O efeito da hipóxia na mielinização também foi estudado colocando culturas de fatias em uma incubadora hipóxica de FiO2% por 24 h, de 2–3 DIV (Figura 1D). Por fim, culturas de fatias derivadas de camundongos transgênicos foram usadas para estudar o efeito de nocautes genéticos na mielinização. Nesse sistema, a recombinação de Cre foi induzida pela adição de tamoxifeno ou adenovírus Ad-Cre em 1 DIV e 3 DIV, e culturas de fatias fixadas para análise em 12 DIV (Figura 1E). Após a fixação dos tecidos, a quantificação da desmielinização e remielinização foi realizada por imunomarcação (Figura 2, Figura 3) e microscopia eletrônica 11,12,13.
Os dados representativos mostrados (Figura 2, Figura 3) ilustram a faixa dinâmica de mielinização e remielinização em culturas de fatias. O índice de mielinização foi quantificado pela razão entre Caspr, um marcador paranodal que é uma leitura indireta da mielina compacta, e a proteína do neurofilamento H (NFH), que cora os axônios. Esse índice de mielinização foi validado para representar a formação de mielina compacta por microscopia eletrônica e coloração do canal de sódio12. A desmielinização induzida por lisolecitina 9,10 levou ao desaparecimento completo dos paranodes positivos para Caspr (índice de mielinização = 0, Figura 3A) e perda da mielina compacta, que foi restaurada durante a remielinização11,12.
Para demonstrar um resultado positivo na mielinização, as fatias foram cultivadas com Activin A seguindo a linha do tempo na Figura 1B. A ativina A envolve receptores de ativina nos oligodendrócitos e impulsiona a diferenciação de oligodendrócitos e a compactação da mielina15. Os dados representativos mostram que o tratamento de fatias com 100 ng/mL de ativina A durante a mielinização resultou em um índice de mielinização mais alto (Figuras 2A, B). Consistente com isso, o tratamento com Activin A acelerou a diferenciação de OPC, conforme quantificado pela proporção de oligodendrócitos maduros positivos para CC1 para células da linhagem de oligodendrócitos Olig2+11,13 (Figuras 2C,D).
Um inibidor de pequena molécula da Tankirase, XAV939, demonstrou promover a mielinização e a remielinização pela estabilização dos níveis de Axin2 em oligodendrócitos11. Após o tratamento com lisolecitina, a desmielinização foi visualizada e quantificada em culturas de fatias por coloração fragmentada de proteína básica de mielina (MBP) e falta de paránodes positivos para Caspr (Figuras 3A). O tratamento com 0,1 μM de XAV939 durante a remielinização (15-28 DIV) aumentou significativamente o índice de mielinização em comparação com os controles do veículo, conforme quantificado pela proporção de Caspr para coloração NFH (Figuras 3B, C). O modelo de cultura de fatias pode, portanto, ser usado para examinar e quantificar os efeitos na diferenciação, mielinização e remielinização de OPC em tecido intacto.
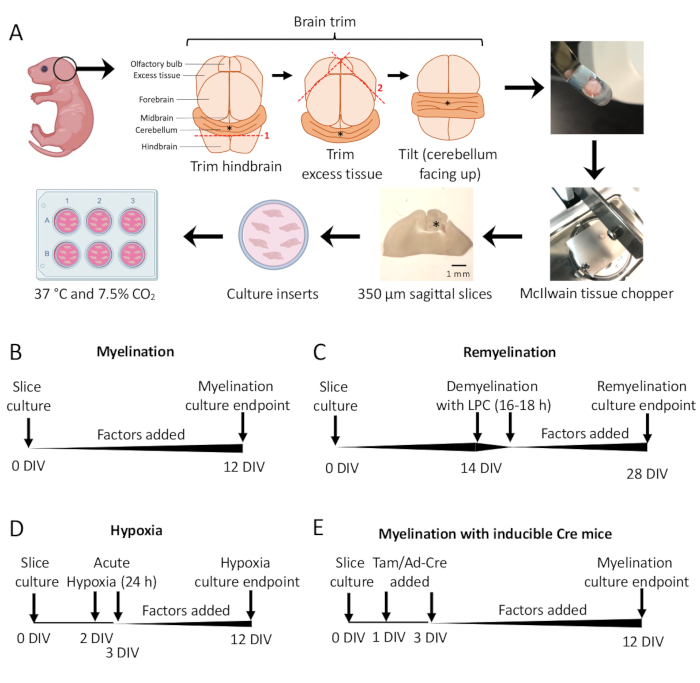
Figura 1: Esquema de culturas de fatias cerebelares mostrando as principais etapas do processo de dissecção e cronogramas para diferentes protocolos de cultura de fatias. (A) Representação das etapas para gerar culturas de fatias: dissecação de cérebros de filhotes de camundongos P0-2, aparando o cérebro (como mostrado), cortando o cérebro com um picador de tecidos para gerar fatias sagitais de 350 μm, colocando fatias em inserções de cultura organotípica em um prato de 6 poços e incubando a 37 ° C e 7,5% de CO2. * denota cerebelo. (B) Linha do tempo para culturas de fatias mielinizantes. As culturas de fatias foram incubadas por 12 dias antes da fixação para análise. (C) Linha do tempo para remielinização de culturas de fatias. As fatias foram tratadas com lisolecitina a 14 DIV por 16 a 18 h para induzir a desmielinização completa e permitiram remielinizar até 28 DIV antes da fixação para análise. (D) Linha do tempo para mielinização após insulto hipóxico. As fatias foram expostas a um insulto hipóxico agudo por 24 h entre 2–3 DIV, o que causou hipomielinização. (E) Linha do tempo para CSC de camundongos geneticamente modificados. Tamoxifeno (Tam, 100nM) ou vírus Ad-Cre foi adicionado a 1 DIV e 3 DIV para induzir modificação genética, e as fatias foram analisadas a 12 DIV. Diagramas de linha do tempo adaptados de publicações anteriores 11,13. Clique aqui para ver uma versão maior desta figura.

Figura 2: Dados representativos mostrando que a ativina A promove a mielinização e a diferenciação de OPC. (A) Aumento da mielinização (MBP) e paránodes (Caspr) com 100 ng/mL de tratamento com Activina A, demonstrado pela imunocoloração de culturas de fatias. (B) Quantificação do índice de mielinização (razão entre a área corada para paranodes Caspr+ e a área corada para axônios NFH+). (C) Quantificação da diferenciação OPC (proporção de oligodendrócitos CC1+ para células da linhagem de oligodendrócitos Olig2+). (D) Imagens representativas da coloração CC1/Olig2. Os valores apresentados são média + desvio padrão. P < 0,0001; teste T não pareado. Barras de escala: A = 25 μm, D = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 3: Dados representativos mostrando que o XAV939 promove a remielinização. (A) Imagens mostrando desmielinização por coloração fragmentada de MBP e falta de paranodes de Caspr em culturas de fatias tratadas com lisolecitina. (B) Aumento da remielinização (MBP) e paranodes (Caspr) com tratamento com 0,1 μM XAV939 após desmielinização induzida por lisolecitina demonstrada por imunocoloração de culturas de fatias. (C) Quantificação do índice de mielinização (razão entre a área corada para os paranodes Caspr+ e a área corada para axônios NFH+). Os valores apresentados são média + desvio padrão. P < 0,0001; teste T não pareado. Barras de escala = 25 μm. Clique aqui para ver uma versão maior desta figura.
| Meios de cultura de fatias (SCM) | |
| Volume | Reagente |
| 100 mL | Meios essenciais mínimos (MEM), HEPES, sem glutamina |
| 50 mL | Soro de cavalo inativado pelo calor |
| 50 mL | Solução salina balanceada de Earle |
| 2 mL | Penicilina-estreptomicina 10.000 U/mL |
| 2 mL | Suplemento GlutaMAX |
| 2888 μL | Solução de glicose a 45% |
| 1 mL | Zona de fungos |
| Filtrar esterilizado através de um filtro de 0,22 μm e conservar no frigorífico a 4 °C durante um período máximo de 2 semanas. | |
| Meios de dissecção (DM) | |
| Volume | Reagente |
| 100 mL | MEM, HEPES, com sais de Earle |
| 1 mL | Penicilina-estreptomicina 10.000 U/mL |
| Filtrar estéril através de um filtro de 0,22 μm e conservar no frigorífico a 4 °C até 2 meses. | |
| Estoque de lisolecitina (125 mg / mL) | |
| Quantidade | Reagente |
| 100 mg | Lisolecitina |
| 0,8 mL | PBS estéril |
| Dissolva 100 mg de lisolecitina em 0,8 mL de PBS estéril. Armazenar alíquotas de 80 μL da solução-mãe a -20 °C. | |
| Antes de usar, descongele 80 μL de alíquota e dissolva em 20 mL de SCM (0,5% de lisolecitina em SCM), aquecido em incubadora de 37 °C, 7,5% de CO2. Se necessário, vórtice para dissolver a lisolecitina em SCM. | |
Tabela 1: Lista de componentes e protocolo para fazer meio de cultura de fatias (SCM), meio de dissecção (DM) e solução de lisolecitina.
Discussão
Este protocolo descreve um modelo de cultura de fatias cerebelares organotípicas que recapitula a composição celular in vivo com a simplicidade de um modelo in vitro. Este protocolo poderia ser desenvolvido para se tornar um modelo mais representativo das patologias humanas. O CSC pode ser potencialmente desenvolvido como modelos para lesões específicas da doença, como lesão tecidual induzida por força, lesão induzida por anticorpos específicos de mielina ou lesão de oligodendrócitos na EM com a adição de células imunes periféricas. Esse protocolo também pode ser otimizado para tecidos dissecados de outras partes do cérebro e da medula espinhal16,17. Embora este protocolo se concentre na quantificação histológica da mielinização, o CSC representa um modelo conveniente para examinar vários desfechos experimentais. Essas culturas podem ser usadas para caracterizar diferentes tipos de células por meio de sequenciamento de RNA de célula única, avaliar a ultraestrutura de axônios e bainhas de mielina por meio de microscopia eletrônica e estudar a dinâmica do OPC realizando imagens de lapso de tempo. A imunocoloração também pode ser contornada com o uso de linhagens repórteres de camundongos transgênicos18,19. Finalmente, diferentes idades de filhotes de camundongos, tempo em cultura ou espessura das seções podem ser usados para adaptar o CSC para modelar diferentes mecanismos de doença 10,17,18,19,20,23.
As culturas de fatias são ideais para testar e quantificar fatores que afetam a mielinização e a remielinização, mas são limitadas em sua representação do SNC em determinados contextos. Derivadas de cérebros P 0-2, as CSC vêm de cérebros que estão no início do desenvolvimento e têm semelhanças limitadas com um cérebro envelhecido ou neurodegenerativo. Dada a crescente conscientização sobre a importância da mielina em distúrbios do SNC, como a doença de Alzheimer21 e a esquizofrenia22, são necessários modelos adultos ou idosos de quantificação e caracterização da mielinização. Outros protocolos foram publicados isolando tecido de roedores mais velhos, embora ainda durante os estágios de desenvolvimento 10,18,19,23. Além disso, pode haver diferenças intrínsecas e extrínsecas nos oligodendrócitos e OPCs no cerebelo em comparação com a medula espinhal e outros tratos de substância branca no cérebro. Os CSC também são menos adequados do que os sistemas in vitro baseados em células para CRISPR em larga escala ou telas de moléculas pequenas. Devido ao corte inicial do tecido, há também uma ativação de células imunes inatas residentes no cérebro (ou seja, microglia e astrócitos), uma ressalva importante para o sistema24. Finalmente, as células imunes periféricas desempenham um papel importante na patologia da EM25; As CSC são desprovidas de células periféricas, a menos que essas células sejam adicionadas exogenamente e, portanto, não são um modelo ideal do meio inflamatório do SNC.
A parte de dissecação deste protocolo é talvez a mais crítica. As etapas de dissecção devem ser realizadas com o máximo cuidado, para não danificar o tecido e a estrutura subjacente. O alinhamento adequado do cérebro ao longo da lâmina do picador de tecidos garante danos mínimos ao tecido e às células. Além disso, a dissecção e separação cuidadosas das fatias, bem como sua transferência para as membranas para cultura, são importantes. Os prazos descritos neste protocolo foram otimizados para a pesquisa descrita, mas podem precisar ser ajustados para obter resultados ideais em diferentes estudos. Este protocolo será útil para aqueles que gostariam de estudar a mielinização do desenvolvimento e o reparo da mielina.
É importante notar que não há cura para a EM. Embora as terapias atuais sejam bastante eficazes para amortecer o sistema imunológico adaptativo, nenhuma terapia atual pode interromper a progressão. Acredita-se que uma falha na remielinização e subsequente neurodegeneração esteja subjacente à progressão da EM2. A presença de OPCs em lesões crônicas de EM sugere que a falha no reparo da mielina pode ser devido a uma parada na diferenciação de OPC. O uso de CSC abre uma avenida de descoberta para terapias de reparo de mielina que podem ajudar a reverter a progressão da EM e restaurar a função. A terapia de reparo da mielina também pode ajudar na recuperação em pacientes com lesão medular, onde os tratos desmielinizados inibem a funçãolocomotora 26. Portanto, a importância do CSC reside em sua adequação para identificar fatores que afetam a desmielinização e remielinização de mamíferos de maneira relativamente alta em comparação com modelos animais in vivo. Embora muitos estudos tenham usado OPCs primários para triagem de compostos que afetam a diferenciação, gerar e isolar OPCs primários requer imunopanning trabalhoso e sequencial27. Além disso, os ensaios baseados em células não recapitulam a diversidade e a interação dos tipos de células presentes in vivo. A geração de CSC a partir de filhotes de camundongos é um modelo rápido e econômico para estudar mielinização e remielinização que não requer equipamentos ou consumíveis caros. As culturas de fatias cerebelares representam, portanto, um modelo quantitativo inestimável para recapitular a mielinização ex vivo e permitir a descoberta de medicamentos e a pesquisa científica básica.
Divulgações
Os autores são funcionários da Genentech, Inc., membro do Grupo Roche.
Agradecimentos
Os autores gostariam de agradecer a Yun-An Shen, Roxanne Kyauk e Chris Bohlen pelos comentários construtivos e contribuições sobre este artigo. Além disso, os autores reconhecem as contribuições de Charles ffrench-Constant, Andrew Jarjour, Veronique Miron e David Rowitch no desenvolvimento inicial de metodologia relacionada publicada anteriormente 11,12,13.
Materiais
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Referências
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados