Method Article
ex vivo Myelinisierung und Remyelinisierung in Kleinhirnschnittkulturen als quantitatives Modell für entwicklungs- und krankheitsrelevante Manipulationen
In diesem Artikel
Zusammenfassung
Vorgestellt wird ein Protokoll für ein ex vivo quantitatives Modell der Demyelinisierung und Remyelinisierung unter Verwendung von Kleinhirnschnittkulturen der Maus. Diese Methode rekapituliert ein in vivo-Modell mit seiner vollständigen Ergänzung von ZNS-Zelltypen in intaktem Gewebe, während die chemische, genetische und umweltbedingte Zugänglichkeit eines in vitro-Systems erhalten bleibt.
Zusammenfassung
Die Untersuchung der Myelinisierung in vitro und in vivo birgt zahlreiche Herausforderungen. Die Differenzierung von Oligodendrozyten-Vorläuferzellen (OPCs) in vitro ist zwar skalierbar, führt aber nicht zu einer Rekapitulation der axonalen Myelinisierung. OPC-Neuronen-Kokulturen und OPC-Faserkulturen ermöglichen die Untersuchung der in vitro Myelinisierung, aber es fehlen zusätzliche Zelltypen, die in vivo vorhanden sind, wie Astrozyten und Mikroglia. In-vivo-Mausmodelle sind jedoch weniger anfällig für chemische, umweltbedingte und genetische Manipulationen und sind viel arbeitsintensiver. Hier beschreiben wir ein quantitatives ex vivo-System der Kleinhirnschnittkultur (CSC) der Maus, das nützlich ist für: 1) die Untersuchung der entwicklungsbedingten Myelinisierung, 2) die Modellierung von Demyelinisierung und Remyelinisierung und 3) die Durchführung translationaler Forschung. Sagittale Abschnitte des Kleinhirns und des Hinterhirns werden von Mäusen am postnatalen Tag (P) 0–2 isoliert, wonach sie 12 Tage lang ex vivo myelinieren. Während dieser Zeit können die Scheiben auf verschiedene Weise manipuliert werden, einschließlich der Zugabe von Verbindungen, um eine Wirkung auf die Entwicklungsmyelinisierung zu testen. Darüber hinaus kann Gewebe für die Elektronenmikroskopie fixiert werden, um die Ultrastruktur und Verdichtung des Myelins zu beurteilen. Um die Krankheit zu modellieren, kann CSC einer akuten Hypoxie ausgesetzt werden, um eine Hypomyelinisierung zu induzieren. Die Demyelinisierung in diesen Explantaten kann auch durch Lysolecithin induziert werden, was die Identifizierung von Faktoren ermöglicht, die die Remyelinisierung fördern. Abgesehen von chemischen und umweltbedingten Modifikationen können CSC aus transgenen Mäusen isoliert werden und reagieren auf genetische Manipulationen, die mit Ad-Cre-Adenoviren und Tamoxifen induziert werden. Daher sind Kleinhirnschnittkulturen ein schnelles, reproduzierbares und quantifizierbares Modell für die Rekapitulation der Myelinisierung.
Einleitung
Die Myelinisierung von Axonen ermöglicht die schnelle Ausbreitung von Aktionspotentialen, ein Mechanismus, der als saltatorische Leitungbekannt ist 1. Die Bedeutung des Myelins wird durch demyelinisierende Erkrankungen wie Multiple Sklerose (MS) unterstrichen, die eine breite Palette von schwächenden Manifestationen umfassen, darunter Sehverlust, kognitive Probleme und Lähmungen. Es gibt keine Heilung für MS, und die derzeitigen Therapien konzentrieren sich darauf, das Fortschreiten der Krankheit zu begrenzen, indem sie auf periphere Immunzellen abzielen. Es wird angenommen, dass die Behinderung bei MS und verwandten Krankheiten durch ein Versagen der Remyelinisierung und eine fortschreitende Neurodegeneration verursacht wird. Insbesondere Demyelinisierung, Atrophie und axonaler Verlust werden bei der progressiven MSbeobachtet 2,3. Die Förderung der Remyelinisierung stellt somit eine vielversprechende Strategie dar, die parallel zu aktuellen Behandlungen durchgeführt werden könnte und einen zusätzlichen therapeutischen Nutzen bringen könnte.
Im Zentralnervensystem (ZNS) wird die Myelinisierung von spezialisierten Gliazellen, den Oligodendrozyten, durchgeführt. Oligodendrozyten-Vorläuferzellen (OPCs) differenzieren sich in reife, myelinisierende Oligodendrozyten durch eine Reihe von hochgradig orchestrierten Schritten, einschließlich des Wachstums von Prozessen, die Axone kontaktieren, einer Zunahme der morphologischen Komplexität, der Expansion der Myelinmembran und schließlich der Verdichtung der Myelinscheide4. Die Interaktion zwischen Oligodendrozyten und Neuronen ist also sehr intim. Reziproke Wechselwirkungen zwischen Neuronen und Oligodendrozyten sind auch für die Gesundheit und den Erhalt des ZNSerforderlich 2. Die axonale Aktivität spielt eine Rolle bei der Stimulierung der Myelinisierung und gliale neurotrophe Faktoren unterstützen die Integrität der Neuronen. Die Bedeutung des Glia-Glia-Crosstalks im ZNS wird ebenfalls zunehmend anerkannt 5,6,7,8. Zum Beispiel können astrozytäre Faktoren die Differenzierung von OPCs und die Erhaltung der Bahnen der weißen Substanz beeinflussen. Mikroglia spielen auch eine Rolle bei der Modulation der OPC-Differenzierung sowie bei der Beseitigung von Myelin-Trümmern, einem wichtigen Schritt des Remyelinisierungsprozesses. Die Identifizierung zellautonomer Faktoren und das Verständnis des Einflusses anderer ZNS-Zelltypen auf die Demyelinisierung und Remyelinisierung werden von unschätzbarem Wert für die Entwicklung von Therapien für demyelinisierende und dysmyelinisierende Erkrankungen sein.
In dieser Arbeit beschreiben wir ein ex vivo System unter Verwendung von zerebellären Schnittkulturen (CSC) der Maus, das die Manipulation und Quantifizierung von intaktem ZNS-Gewebe ermöglicht. Die Verwendung von CSC ermöglicht die Messung der Myelinisierung oder Remyelinisierung nach Induktion der Demyelinisierung durch Lysolecithin 9,10 mit Methoden, die traditionell bei In-vivo-Studien verwendet werden, wie z. B. Immunfärbung und Elektronenmikroskopie 11,12,13. Lysolecithin ist eine membranzerstörende Chemikalie, die zu einem schnellen Verlust von Myelin und Oligodendrozyten führt. Ein möglicher Vorbehalt ist, dass Lysolecithin auch zu einer Verringerung anderer Zelltypen in der Nähe des Läsionsbereichs führen kann. Im Gegensatz zu In-vivo-Experimenten können sagittale Schnitte des Kleinhirns jedoch leicht durch Zugabe von Verbindungen manipuliert oder mit Ad-Cre-Adenoviren genetisch verändert werden. Die Methode ermöglicht auch die Manipulation von isoliertem Gewebe von transgenen Mäusen oder Mäusen, die Umwelteinflüssen wie Hypoxie ausgesetzt waren 11,12,13,14. Das CSC-Modell ermöglicht somit die Untersuchung der entwicklungsbedingten Myelinisierung, die Modellierung von Krankheiten und die Identifizierung von Faktoren, die die Myelinisierung fördern oder hemmen, während die Beiträge verschiedener ZNS-Zelltypen zur Oligodendrozytenfunktion integriert werden.
Protokoll
Alle Tierversuche wurden vom Genentech Institutional Animal Care and Use Committee genehmigt und genehmigt.
1. Vorbereitung der Medien und Verbrauchsmaterialien für die Dissektion (~30–45 min)
- Bereiten Sie das Filterscheiben-Kulturmedium (SCM) und das Dissektionsmedium (DM) vor und sterilisieren Sie es, wie in Tabelle 1 beschrieben. Bei 4 °C lagern. Wenn Faktoren für den Myelinisierungstest getestet werden, fügen Sie diese dem SCM kurz vor der Anwendung hinzu.
- Pipettieren Sie 1 ml SCM in jede Vertiefung der 6-Well-Platte.
- Setzen Sie mit einer sterilen Pinzette einen organotypischen Einsatz in jede Vertiefung ein und stellen Sie sicher, dass keine Blasen unter der Membran eingeschlossen werden. Die Platte mit Medien bei 37 °C im Inkubator mit 7,5 % CO2 erwärmen.
2. Vorbereitung des Präparierbereichs (~5–10 min)
- Führen Sie Eingriffe in einer sterilen Laminar-Flow-Haube oder auf dem Labortisch mit geeigneten aseptischen Techniken für alle Schritte des Eingriffs durch. Wischen Sie alle Bereiche mit 70% Ethanol sauber.
- Platzieren Sie eine neue Klinge und einen Silikon-Schneidetisch auf dem Tissue-Zerkleinerer. Pipettieren Sie ~300 μl steriles Wasser oder 70 % Ethanol unter die Schneidstufe, um sicherzustellen, dass es an Ort und Stelle bleibt.
- Wischen Sie mit einem Wattestäbchen die Klinge und den Schneidtisch vorsichtig mit 70 % Ethanol ab. Trocknen Sie es ab, bevor Sie den Tissue-Zerkleinerer verwenden.
- Besprühen Sie alle Sezierwerkzeuge mit 70% Ethanol und trocknen Sie sie vor dem Sezieren.
- Bereiten Sie zwei 10 cm große Petrischalen vor: eine mit 15–20 mL TM, eine mit 10 mL SCM. Auf Eis lagern. Bewahren Sie alle Medien und Petrischalen auf Eis auf, wenn Sie nicht präparieren.
3. Dissektion der Kleinhirnschnittkultur (~15–20 min pro Welpe)
- Stellen Sie die Petrischale mit DM auf ein Präpariermikroskop.
- Euthanasieren Sie ein Mäusejunges am postnatalen Tag P0–2 durch schnelle Enthauptung mit einer scharfen Schere.
- Legen Sie den Kopf mit DM unter das Präpariermikroskop in die Petrischale, um das Blut zu reinigen.
- Schneiden Sie mit einer feinen Schere einmal an jeder Seitenkante an der Schädelbasis.
- Wenn du den Kopf kopfüber in DM legst, drückst du mit der Pinzette #5/45 fest auf die Unterseite des Schädels und zwingst das unbeschädigte Hinterhirn durch das Loch im Schädel.
- Schneiden Sie unter dem Präpariermikroskop überschüssiges Gewebe mit zwei Skalpellen #11 weg. Stellen Sie sicher, dass das Kleinhirn mit dem darunter liegenden Teil des Hinterhirns verbunden bleibt. In Abbildung 1A finden Sie ein detailliertes Diagramm.
- Übertragen Sie mit dem Spatel das Kleinhirn in die Schnittstufe des Gewebehackers, wobei das Gewebe auf der rostralen Fläche des Hinterhirns und die kaudale Fläche des Hinterhirns dem Forscher zugewandt aufliegt. Stellen Sie sicher, dass die mediale Ebene des Gehirns genau parallel zur Klinge des Gewebehackers verläuft.
- Entfernen Sie mit der P200-Pipette überschüssiges Medium um das Gewebe herum und stellen Sie sicher, dass es noch feucht, aber nicht schwimmend oder von Flüssigkeit umgeben ist.
- Tauschen Sie die Petrischale mit DM gegen die Petrischale mit SCM unter dem Präpariermikroskop aus.
- Schneiden Sie das Gewebe mit dem Gewebezerkleinerer in 350 μm dicke Scheiben.
HINWEIS: Die Sägeblattgeschwindigkeit (z. B. etwa ein Schnitt pro Sekunde) und die Kraft müssen optimiert werden, um optimale Schnittbedingungen zu gewährleisten. In seltenen Fällen bleibt das Gewebe an der Klinge hängen. Um den Verlust von Gewebeschnitten zu minimieren, halten Sie den Daumen auf dem Netzschalter, um den Gewebezerkleinerer bei Bedarf schnell auszuschalten. - Pipettieren Sie vorsichtig 100 μl SCM unter das Gewebe, so dass die Scheiben schwimmen. Übertragen Sie das geschnittene Gewebe mit dem Spatel unter einem Präpariermikroskop in die Petrischale mit SCM.
- Wischen Sie mit einem Wattestäbchen die Klinge und den Schneidtisch vorsichtig mit 70 % Ethanol ab.
- Trennen Sie die Scheiben vorsichtig mit dem Skalpell (stumpfe Seite) unter dem Präpariermikroskop. Übertragen Sie die Scheiben mit einem Skalpell und einem Spatel auf die Membran in der 6-Well-Platte mit SCM.
HINWEIS: Die medialsten Schnitte weisen oft die beste Myelinisierung und Gewebeintegrität auf. Im Durchschnitt können 4-6 Scheiben aus einem Mäusegehirn seziert werden. - Inkubieren Sie die Scheiben in SCM bei 37 °C mit 7,5 % CO2.
4. Kultur- und Medienwandel (~15–30 min)
- Tauschen Sie das SCM alle zwei Tage aus.
- Pipettieren Sie 1 ml frisches Medium in jede Vertiefung einer neuen 6-Well-Platte und erwärmen Sie es in einem Inkubator. Übertragen Sie die Membranen mit einer sterilen Pinzette auf die neue Platte, wobei Sie sicherstellen, dass sich keine Blasen darunter befinden. Bringen Sie die Platten wieder in den Inkubator.
5. Standard-Myelinisierung und Remyelinisierung
- Standardprotokoll für die Myelinisierung (Abbildung 1B).
- Kulturschnitte, die in Abschnitt 3 von 0 bis 12 Tagen in vitro (DIV) präpariert wurden. Wenn die Wirkung eines Faktors auf die Myelinisierung getestet wird, fügen Sie ihn dem Medium zum Zeitpunkt der Kultivierung hinzu (0 DIV) und füllen Sie es bei jedem Medienwechsel auf.
- Fixieren Sie auf 12 DIV (Schritt 7.1), einen Zeitpunkt, der für die unvollständige Myelinisierungoptimiert ist 11,12,13. Dies ermöglicht den Nachweis von verstärkenden oder blockierenden Effekten auf die Myelinisierung aufgrund des Faktors, der dem Medium zugesetzt wird. Ein repräsentatives positives Ergebnis mit der Zugabe von 100 ng/ml Activin A ist in Abbildung 2 dargestellt.
- Remyelinisierungsprotokoll (Abbildung 1C)
- Befolgen Sie das in Abschnitt 5.1 beschriebene Standard-Myelinisierungsprotokoll ohne zusätzliche Faktoren bis 14 DIV, dem Zeitpunkt, zu dem die Scheiben vollständig myelinisiert sind 11,12,13.
- Bereiten Sie Lysolecithin-Brühe (125 mg/ml) wie in Tabelle 1 beschrieben vor. Pipettieren Sie 1 ml 0,5 % Lysolecithin in SCM in jede Vertiefung einer neuen 6-Well-Platte und erwärmen Sie sie in einem Inkubator.
- Übertragen Sie die Membranen auf eine Lysolecithinplatte und stellen Sie sie über Nacht für 16–18 Stunden in einen Inkubator.
- Bereiten Sie am nächsten Tag neue Platten mit frischem SCM vor und fügen Sie bei Bedarf alle Faktoren hinzu, die auf Remyelinisierungseffekte getestet werden. Warme Platten in einem Inkubator.
- Klopfen Sie für den Medienwechsel vorsichtig auf die Membran an der Seite der Vertiefung, um sicherzustellen, dass das gesamte Lysolecithin-Medium entfernt wird. Füllen Sie die zu testenden Faktoren bei jedem Medienwechsel auf (Abschnitt 4).
- Fixieren Sie Slices bei 28 DIV (Schritt 7.1), einem Zeitpunkt, der für die unvollständige Remyelinisierung optimiert ist. Dies ermöglicht den Nachweis einer Verstärkung oder Blockierung der Remyelinisierung aufgrund des Faktors, der dem Medium zugesetzt wird. Ein repräsentatives positives Ergebnis mit der Zugabe von 0,1 μM XAV939 ist in Abbildung 3 dargestellt.
6. Änderungen des Myelinisierungs- und Remyelinisierungsprotokolls
- Hypoxie-induziertes Hypomyelinisierungsprotokoll (Abbildung 1D)11,13.
HINWEIS: Dies wird als eine Variation des in Abschnitt 5.1 beschriebenen Standard-Myelinisierungsprotokolls dargestellt.- Plattenscheiben in SCM ohne Faktoren.
- Übertragen Sie die Scheibenplatten für 24 h zwischen 2–3 DIV in einen hypoxischen Inkubator (2%FiO 2).
- Bereiten Sie am nächsten Tag neue Platten mit frischem SCM vor und fügen Sie bei Bedarf alle Faktoren hinzu, die auf Myelinisierungspotenzial getestet werden. Warme Platten in einem Inkubator.
- Nach der Kultur in Hypoxie ist das Medium zu wechseln (Abschnitt 4) und die Kulturen wieder in einen Standardkultur-Inkubator (37 °C, 7,5 % CO2) zu stellen. Füllen Sie die zu testenden Faktoren bei jedem weiteren Medienwechsel auf (Abschnitt 4).
- Fixieren Sie auf 12 DIV (Schritt 7.1).
- Protokoll zur genetischen Manipulation (Abbildung 1E)13
- Gewebe von transgenen Mäusen für die Dissektion wie in Abschnitt 3 isolieren.
- Bei induzierbaren transgenen Mauslinien kann Tamoxifen (100 nM, eine Dosis, die keine Myelinisierung oder OPC-Differenzierung induziert) oder ein Ad-Cre-Adenovirus zu SCM hinzugefügt werden, während Medienwechsel an 1 DIV und 3 DIV durchgeführt werden.
- Nach der genetischen Manipulation mit Tamoxifen oder Ad-Cre-Adenoviren sind die Medienveränderungen jeden zweiten Tag wie in Abschnitt 4 fortzusetzen (mit zusätzlichen Faktoren, falls erforderlich).
HINWEISE: Alle Schnitte einer Maus passen auf eine Membran, was eine Genotypisierung nach der Dissektion ermöglicht und somit die Durchführung von Experimenten mit transgenen Mäusen erleichtert.
7. Gewebeaufbereitung und -analyse
- Fixieren Sie die Scheiben, indem Sie die Membran 1 h lang bei Raumtemperatur (RT) vorsichtig in 4 % Paraformaldehyd eintauchen.
- Spülen Sie es vorsichtig aus, indem Sie es in phosphatgepufferte Kochsalzlösung (PBS) tauchen. Tauchen Sie dann PBS in eine 6-Well-Platte.
HINWEIS: Das Protokoll kann hier pausiert werden. Fixierte Scheiben können bis zu einem Monat bei 4 °C in PBS gelagert werden. Wenn Sie die Scheiben nicht lagern, spülen Sie sie 2x 5 Minuten lang in PBS, bevor Sie fortfahren. - Schneiden Sie mit einem Skalpell die Membran aus dem Ring aus und fahren Sie mit der Färbung in einer 6-Well-Platte fort. Achten Sie darauf, dass die Scheiben mit der Membran nach oben (mit der Membran nach unten) zum Färben und anschließenden Aufkleben auf Objektträger aufbewahrt werden.
- 1 h bei RT in Blocklösung blockieren (3 % hitzeinaktiviertes Pferdeserum, 2 % Rinderserumalbumin und 0,25 % Triton-X 100 in PBS verdünnt).
HINWEIS: Wenn für die Antikörperfärbung (z. B. CC1/Olig2) eine Antigen-Entnahme erforderlich ist, kann dies in Petrischalen aus Glas erfolgen. - Die Platten werden in Paraffinfolie eingewickelt und über Nacht bei 4 °C in einem in Blockierungslösung verdünnten Primärantikörper inkubiert.
- 3x in Blockierlösung waschen: 1) kurz spülen, 2) 15 min waschen und 3) 1 h waschen. Füllen Sie für eine kurze Spülung eine kleine Petrischale mit der Lösung und tauchen Sie die Membran vorsichtig mit einer Pinzette ein, bevor Sie sie in die frische Lösung überführen. Für längere Wäschen (z. B. 15 min und 1 h) tauchen Sie die Membran in Lösung in eine 6-Well-Platte und legen Sie sie auf eine sanfte Wippe.
- Inkubieren Sie 2 h lang bei RT unter Lichtschutz in Sekundärantikörpern, verdünnt 1:500 in PBS.
- 3x in PBS waschen: 1) kurze Spülung, 2) 15 min Wäsche und 3) 1 h Wäsche.
- Wenn eine DAPI-Färbung erforderlich ist, tauchen Sie sie 7 Minuten lang bei RT in 1:1.000 DAPI-Lösung ein. Spülen Sie kurz aus und waschen Sie sie dann 15 Minuten lang in PBS.
- In doppelt destilliertem Wasser abspülen.
- Montieren Sie Membranen auf einer Folie mit den Scheiben nach oben (mit der Membranseite nach unten).
HINWEIS: Montierte Scheiben können bei 4 °C gelagert werden. Die Bildgebung mit einem konfokalen Mikroskop erfolgt am besten innerhalb von 1 Woche, bevor die Membran undurchsichtig und schwer abzubilden ist. - Bilde Schnitte mit konfokaler Mikroskopie und quantifiziere wie zuvor beschrieben 11,12,13.
Ergebnisse
Kleinhirnschnittkulturen, die von P0-2-Mäusen abgeleitet wurden (Abbildung 1A), wurden verwendet, um die Myelinisierung zu untersuchen und die Auswirkungen der Zugabe verschiedener Faktoren von 0-12 DIV zu bewerten (Abbildung 1B). Um die Remyelinisierung zu untersuchen, wurden Schnittkulturen bei 14 DIV zunächst mit Lysolecithin demyelinisiert und 14 weitere Tage in Kultur mit den getesteten Faktoren remyeliniert (Abbildung 1C), wonach die Remyelinisierung quantifiziert wurde. Die Wirkung von Hypoxie auf die Myelinisierung wurde ebenfalls untersucht, indem Schnittkulturen 24 Stunden lang von 2–3 DIV in einen 2%igen FiO2-Hypoxik-Inkubator gelegt wurden (Abbildung 1D). Schließlich wurden Schnittkulturen von transgenen Mäusen verwendet, um die Wirkung von Gen-Knockouts auf die Myelinisierung zu untersuchen. In diesem System wurde die Cre-Rekombination durch die Zugabe von Tamoxifen oder Ad-Cre-Adenoviren an 1 DIV und 3 DIV induziert und Schnittkulturen für die Analyse bei 12 DIV fixiert (Abbildung 1E). Nach der Fixierung des Gewebes erfolgte die Quantifizierung der Demyelinisierung und Remyelinisierung durch Immunfärbung (Abbildung 2, Abbildung 3) und Elektronenmikroskopie 11,12,13.
Repräsentative Daten (Abbildung 2, Abbildung 3) veranschaulichen den dynamischen Bereich von Myelinisierung und Remyelinisierung in Schnittkulturen. Der Myelinisierungsindex wurde durch das Verhältnis von Caspr, einem paranodalen Marker, der eine indirekte Ablesung von kompaktem Myelin darstellt, zu dem Neurofilamentprotein H (NFH), das Axone färbt, quantifiziert. Dieser Myelinisierungsindex wurde durch Elektronenmikroskopie und Natriumkanalfärbung validiert, um die Bildung von kompaktem Myelin darzustellen12. Die Lysolecithin-induzierte Demyelinisierung 9,10 führte zum vollständigen Verschwinden der Caspr-positiven Paranoden (Myelinisierungsindex = 0, Abbildung 3A) und zum Verlust des kompakten Myelins, das während der Remyelinisierung wiederhergestellt wurde11,12.
Um ein positives Ergebnis bei der Myelinisierung zu demonstrieren, wurden die Schnitte mit Activin A kultiviert, die dem Zeitplan in Abbildung 1B folgen. Activin A bindet an Activinrezeptoren an Oligodendrozyten und treibt die Differenzierung von Oligodendrozyten und die Myelinverdichtungvoran 15. Die repräsentativen Daten zeigen, dass die Behandlung von Schnitten mit 100 ng/ml Activin A während der Myelinisierung zu einem höheren Myelinisierungsindex führte (Abbildungen 2A,B). In Übereinstimmung damit beschleunigte die Behandlung mit Activin A die OPC-Differenzierung, was durch das Verhältnis von CC1-positiven reifen Oligodendrozyten zu Zellen der Olig2+-Oligodendrozytenlinie quantifiziert wurde 11,13 (Abbildungen 2C, D).
Es wurde gezeigt, dass ein niedermolekularer Inhibitor der Tankyrase, XAV939, die Myelinisierung und Remyelinisierung fördert, indem er die Axin2-Spiegel in den Oligodendrozyten stabilisiert11. Nach der Behandlung mit Lysolecithin wurde die Demyelinisierung in Schnittkulturen durch fragmentierte Myelin-Basisprotein-Färbung (MBP) und das Fehlen von Caspr-positiven Paranodes sichtbar und quantifiziert (Abbildungen 3A). Die Behandlung mit 0,1 μM XAV939 während der Remyelinisierung (15-28 DIV) erhöhte den Myelinisierungsindex im Vergleich zu Vehikelkontrollen signifikant, was durch das Verhältnis von Caspr- zu NFH-Färbung quantifiziert wurde (Abbildungen 3B, C). Das Slice-Kultur-Modell kann somit verwendet werden, um Effekte auf die OPC-Differenzierung, Myelinisierung und Remyelinisierung in intaktem Gewebe zu untersuchen und zu quantifizieren.
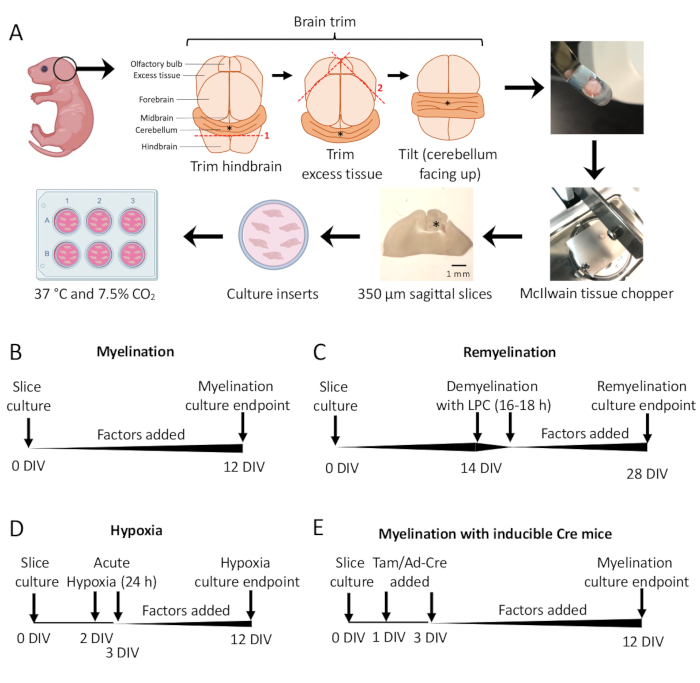
Abbildung 1: Schematische Darstellung von Kleinhirnschnittkulturen, die die wichtigsten Schritte im Dissektionsprozess und die Zeitpläne für verschiedene Schnittkulturprotokolle zeigen. (A) Darstellung der Schritte zur Erzeugung von Schnittkulturen: Sektion von Gehirnen von P0–2-Mausjungen, Trimmen des Gehirns (wie gezeigt), Schneiden des Gehirns mit einem Gewebehacker zur Erzeugung von 350 μm sagittalen Schnitten, Platzieren von Scheiben auf organotypischen Kultureinsätzen in einer 6-Well-Schale und Inkubation bei 37 °C und 7,5 % CO2. * steht für Kleinhirn. (B) Zeitplan für die Myelinisierung von Schnittkulturen. Die Schnittkulturen wurden 12 Tage lang inkubiert, bevor sie für die Analyse fixiert wurden. (C) Zeitplan für die Remyelinisierung von Schnittkulturen. Die Scheiben wurden 16–18 h lang mit Lysolecithin bei 14 DIV behandelt, um eine vollständige Demyelinisierung zu induzieren, und bis 28 DIV remyelinisieren lassen, bevor sie zur Analyse fixiert wurden. (D) Zeitachse für die Myelinisierung nach hypoxischer Beleidigung. Die Schnitte wurden 24 Stunden lang zwischen 2 und 3 DIV einem akuten hypoxischen Insult ausgesetzt, der eine Hypomyelinisierung verursachte. (E) Zeitleiste für CSC aus genetisch veränderten Mäusen. Tamoxifen (Tam, 100nM) oder Ad-Cre-Virus wurde bei 1 DIV und 3 DIV hinzugefügt, um eine genetische Veränderung zu induzieren, und Schnitte wurden bei 12 DIV analysiert. Zeitleistendiagramme aus früheren Veröffentlichungenangepasst 11,13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Daten, die zeigen, dass Activin A die Myelinisierung und die OPC-Differenzierung fördert. (A) Zunahme der Myelinisierung (MBP) und der Paranoden (Caspr) durch 100 ng/ml Activin A-Behandlung, nachgewiesen durch Immunfärbung von Schnittkulturen. (B) Quantifizierung des Myelinisierungsindex (Verhältnis der für Caspr+-Paranode gefärbten Fläche zur für NFH+-Axone gefärbten Fläche). (C) Quantifizierung der OPC-Differenzierung (Verhältnis von CC1+-Oligodendrozyten zu Zellen der Olig2+-Oligodendrozytenlinie). (D) Repräsentative Bilder der CC1/Olig2-Färbung. Die angegebenen Werte sind Mittelwert + Standardabweichung. P < 0,0001; ungepaarter T-Test. Maßstabsleisten: A = 25 μm, D = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentative Daten, die zeigen, dass XAV939 die Remyelinisierung fördert. (A) Bilder, die die Demyelinisierung durch fragmentierte MBP-Färbung und das Fehlen von Caspr-Paranodes in mit Lysolecithin behandelten Schnittkulturen zeigen. (B) Zunahme der Remyelinisierung (MBP) und Paranoden (Caspr) mit 0,1 μM XAV939 Behandlung nach Lysolecithin-induzierter Demyelinisierung, nachgewiesen durch Immunfärbung von Schnittkulturen. (C) Quantifizierung des Myelinisierungsindex (Verhältnis der für Caspr+-Paranoden gefärbten Fläche zur für NFH+-Axone gefärbten Fläche). Die angegebenen Werte sind Mittelwert + Standardabweichung. P < 0,0001; ungepaarter T-Test. Maßstabsleisten = 25 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Scheiben-Nährmedien (SCM) | |
| Volumen | Reagenz |
| 100 mL | Minimum Essential Media (MEM), HEPES, kein Glutamin |
| 50 mL | Hitzeinaktiviertes Pferdeserum |
| 50 mL | Earles ausgewogene Salzlösung |
| 2 mL | Penicillin-Streptomycin 10.000 U/ml |
| 2 mL | GlutaMAX Ergänzung |
| 2888 μL | 45%ige Glukoselösung |
| 1 mL | Fungizone |
| Steril durch einen 0,22 μm Filter filtrieren und bis zu 2 Wochen im Kühlschrank bei 4 °C lagern. | |
| Medien zum Sezieren (DM) | |
| Volumen | Reagenz |
| 100 mL | MEM, HEPES, mit Earle-Salzen |
| 1 mL | Penicillin-Streptomycin 10.000 U/ml |
| Steril durch einen 0,22 μm Filter filtrieren und bis zu 2 Monate im Kühlschrank bei 4 °C lagern. | |
| Lysolecithin-Stamm (125 mg/ml) | |
| Menge | Reagenz |
| 100 mg | Lysolecithin |
| 0,8 mL | Steriles PBS |
| Löse 100 mg Lysolecithin in 0,8 ml sterilem PBS auf. 80 μl Aliquots der Stammlösung bei -20 °C lagern. | |
| Vor Gebrauch 80 μl aliquot auftauen und in 20 ml SCM (0,5 % Lysolecithin in SCM) auflösen, erwärmt in 37 °C, 7,5 % CO2-Inkubator. Falls erforderlich, Lysolecithin in SCM auflösen. | |
Tabelle 1: Liste der Komponenten und des Protokolls zur Herstellung von Scheibenkulturmedium (SCM), Dissektionsmedium (DM) und Lysolecithinlösung.
Diskussion
Dieses Protokoll beschreibt ein organotypisches Kleinhirnschnittkulturmodell, das die zelluläre Zusammensetzung in vivo mit der Einfachheit eines in vitro Modells rekapituliert. Dieses Protokoll könnte weiterentwickelt werden, um ein repräsentativeres Modell für menschliche Pathologien zu werden. CSC können potenziell als Modelle für krankheitsspezifische Verletzungen entwickelt werden, wie z.B. kraftinduzierte Gewebeverletzungen, Verletzungen, die durch myelinspezifische Antikörper induziert werden, oder Oligodendrozytenschäden bei MS unter Zugabe von peripheren Immunzellen. Dieses Protokoll kann auch für Gewebe optimiert werden, das aus anderen Teilen des Gehirns und des Rückenmarks präpariert wurde16,17. Während sich dieses Protokoll auf die histologische Quantifizierung der Myelinisierung konzentriert, stellen CSC ein geeignetes Modell für die Untersuchung verschiedener experimenteller Endpunkte dar. Diese Kulturen können verwendet werden, um verschiedene Zelltypen mittels Einzelzell-RNA-Sequenzierung zu charakterisieren, die Ultrastruktur von Axonen und Myelinscheiden mittels Elektronenmikroskopie zu beurteilen und die OPC-Dynamik durch Zeitraffer-Bildgebung zu untersuchen. Die Immunfärbung kann auch durch die Verwendung transgener Maus-Reporterlinien umgangen werden 18,19. Schließlich können unterschiedliche Altersstufen von Mäusewelpen, die Zeit in Kultur oder die Dicke der Schnitte verwendet werden, um CSC an verschiedene Krankheitsmechanismen anzupassen 10,17,18,19,20,23.
Schnittkulturen eignen sich ideal zum Testen und Quantifizieren von Faktoren, die die Myelinisierung und Remyelinisierung beeinflussen, sind jedoch in ihrer Repräsentation des ZNS in bestimmten Kontexten begrenzt. CSC stammt aus P 0-2-Gehirnen und stammt aus Gehirnen, die sich in einem frühen Entwicklungsstadium befinden und begrenzte Ähnlichkeiten mit einem alternden oder neurodegenerativen Gehirn aufweisen. Angesichts des zunehmenden Bewusstseins für die Bedeutung von Myelin bei ZNS-Erkrankungen wie Alzheimer21 und Schizophrenie22 sind Erwachsenen- oder Altersmodelle zur Quantifizierung und Charakterisierung der Myelinisierung erforderlich. Es wurden weitere Protokolle veröffentlicht, in denen Gewebe von älteren Nagetieren isoliert wurde, wenn auch noch in den Entwicklungsstadien 10,18,19,23. Darüber hinaus kann es intrinsische und extrinsische Unterschiede zwischen Oligodendrozyten und OPCs im Kleinhirn im Vergleich zum Rückenmark und anderen Bahnen der weißen Substanz im Gehirn geben. CSC eignen sich auch weniger als zellbasierte In-vitro-Systeme für großflächige CRISPR- oder niedermolekulare Screenings. Aufgrund der anfänglichen Gewebeaufteilung kommt es auch zu einer Aktivierung von im Gehirn ansässigen angeborenen Immunzellen (d. h. Mikroglia und Astrozyten), ein wichtiger Vorbehalt für das System24. Schließlich spielen periphere Immunzellen eine große Rolle in der MS-Pathologie25; CSC sind frei von peripheren Zellen, es sei denn, diese Zellen werden exogen hinzugefügt, und sind daher kein ideales Modell des entzündlichen ZNS-Milieus.
Der Sezierteil dieses Protokolls ist vielleicht der kritischste. Die Dissektionsschritte müssen mit größter Sorgfalt durchgeführt werden, um das Gewebe und die darunterliegende Struktur nicht zu beschädigen. Die richtige Ausrichtung des Gehirns entlang der Klinge des Gewebehackers sorgt für minimale Schäden an Gewebe und Zellen. Darüber hinaus ist das sorgfältige Präparieren und Trennen der Scheiben sowie deren Transfer auf die Membranen für die Kultur wichtig. Die in diesem Protokoll beschriebenen Zeitrahmen wurden für die beschriebene Forschung optimiert, müssen jedoch möglicherweise angepasst werden, um in verschiedenen Studien optimale Ergebnisse zu erzielen. Dieses Protokoll ist nützlich für diejenigen, die die Entwicklungsmyelinisierung und die Myelinreparatur untersuchen möchten.
Bemerkenswert ist, dass es keine Heilung für MS gibt. Während die derzeitigen Therapien das adaptive Immunsystem recht wirksam dämpfen, kann keine der aktuellen Therapien das Fortschreiten aufhalten. Es wird angenommen, dass ein Versagen der Remyelinisierung und eine anschließende Neurodegeneration dem Fortschreiten der MS2 zugrunde liegen. Das Vorhandensein von OPCs in chronischen MS-Läsionen deutet darauf hin, dass das Versagen der Myelinreparatur auf einen Stillstand der OPC-Differenzierung zurückzuführen sein könnte. Die Verwendung von CSC eröffnet einen Entdeckungsweg für Myelinreparaturtherapien, die dazu beitragen können, das Fortschreiten der MS umzukehren und die Funktion wiederherzustellen. Die Myelinreparaturtherapie kann auch die Genesung bei Patienten mit Rückenmarksverletzungen unterstützen, bei denen demyelinisierte Bahnen die Bewegungsfunktion hemmen26. Daher liegt die Bedeutung von CSC in seiner Eignung zur Identifizierung von Faktoren, die die Demyelinisierung und Remyelinisierung von Säugetieren im Vergleich zu in vivo-Tiermodellen mit relativ hohem Durchsatz beeinflussen. Während in vielen Studien primäre OPCs zum Screening von Verbindungen verwendet wurden, die die Differenzierung beeinflussen, erfordert die Erzeugung und Isolierung von primären OPCs ein aufwändiges und sequentielles Immunpanning27. Darüber hinaus rekapitulieren zellbasierte Assays nicht die Diversität und Interaktion der in vivo vorhandenen Zelltypen. Die Erzeugung von CSC aus Maus-Welpen ist ein schnelles und kostengünstiges Modell zur Untersuchung von Myelinisierung und Remyelinisierung, das keine teuren Geräte oder Verbrauchsmaterialien erfordert. Kleinhirnschnittkulturen stellen somit ein unschätzbares quantitatives Modell für die Rekapitulation der Myelinisierung ex vivo dar und ermöglichen die Wirkstoffforschung und Grundlagenforschung.
Offenlegungen
Die Autoren sind Mitarbeitende von Genentech, Inc., einem Unternehmen der Roche-Gruppe.
Danksagungen
Die Autoren danken Yun-An Shen, Roxanne Kyauk und Chris Bohlen für ihre konstruktiven Kommentare und Beiträge zu diesem Artikel. Darüber hinaus würdigen die Autoren die Beiträge von Charles ffrench-Constant, Andrew Jarjour, Veronique Miron und David Rowitch in der frühen Entwicklung der verwandten Methodik, die zuvor veröffentlicht wurde 11,12,13.
Materialien
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Referenzen
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , Sunderland (MA): Sinauer Associates. (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder? Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71(2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532(2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679(2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46(2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835(2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592(2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22(2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163(2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131(2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten