Method Article
Mielinizzazione e rimielinizzazione ex vivo in colture di fette cerebellari come modello quantitativo per manipolazioni rilevanti per lo sviluppo e la malattia
In questo articolo
Riepilogo
Viene presentato un protocollo per un modello quantitativo ex vivo di demielinizzazione e rimielinizzazione utilizzando colture di fette cerebellari di topo. Questo metodo ricapitola da vicino un modello in vivo con il suo complemento completo di tipi di cellule del SNC in tessuto intatto, mantenendo l'adattabilità chimica, genetica e ambientale di un sistema in vitro.
Abstract
Lo studio della mielinizzazione in vitro e in vivo pone numerose sfide. La differenziazione delle cellule precursori degli oligodendrociti (OPC) in vitro, sebbene scalabile, non ricapitola la mielinizzazione assonale. Le cocolture OPC-neuroni e le colture di fibre OPC consentono l'esame della mielinizzazione in vitro, ma mancano di ulteriori tipi di cellule presenti in vivo, come gli astrociti e la microglia. I modelli murini in vivo, tuttavia, sono meno suscettibili alla manipolazione chimica, ambientale e genetica e sono molto più laboriosi. Qui, descriviamo un sistema quantitativo di coltura di fette cerebellari di topo (CSC) ex vivo che è utile per: 1) studiare la mielinizzazione dello sviluppo, 2) modellare la demielinizzazione e la rimielinizzazione e 3) condurre ricerche traslazionali. Le sezioni sagittali del cervelletto e del rombencefalo vengono isolate da topi postnatali (P) 0-2, dopodiché mielinano ex vivo per 12 giorni. Durante questo periodo, le fette possono essere manipolate in vari modi, inclusa l'aggiunta di composti per testare un effetto sulla mielinizzazione dello sviluppo. Inoltre, il tessuto può essere fissato per la microscopia elettronica per valutare l'ultrastruttura e la compattazione della mielina. Per modellare la malattia, le CSC possono essere sottoposte a ipossia acuta per indurre ipomielinizzazione. La demielinizzazione in questi espianti può anche essere indotta dalla lisolecitina, che consente l'identificazione dei fattori che promuovono la rimielinizzazione. Oltre alle modificazioni chimiche e ambientali, le CSC possono essere isolate da topi transgenici e rispondono alla manipolazione genetica indotta con adenovirus Ad-Cre e tamoxifene. Pertanto, le colture di fette cerebellari sono un modello veloce, riproducibile e quantificabile per ricapitolare la mielinizzazione.
Introduzione
La mielinizzazione degli assoni consente la rapida propagazione dei potenziali d'azione, un meccanismo noto come conduzione saltatoria1. L'importanza della mielina è sottolineata dalle malattie demielinizzanti, come la sclerosi multipla (SM), che includono un'ampia gamma di manifestazioni debilitanti, tra cui perdita della vista, problemi cognitivi e paralisi. Non esiste una cura per la SM e le terapie attuali si concentrano sulla limitazione della progressione della malattia prendendo di mira le cellule immunitarie periferiche. Si ritiene che la disabilità nella SM e nelle malattie correlate sia causata da un fallimento della rimielinizzazione e dalla neurodegenerazione progressiva. In particolare, la demielinizzazione, l'atrofia e la perdita assonale sono osservate nella SMprogressiva 2,3. Pertanto, la promozione della rimielinizzazione rappresenta una strategia promettente che potrebbe essere attuata in parallelo ai trattamenti attuali e produrre ulteriori benefici terapeutici.
Nel sistema nervoso centrale (SNC), la mielinizzazione è effettuata da cellule gliali specializzate note come oligodendrociti. Le cellule precursori degli oligodendrociti (OPC) si differenziano in oligodendrociti maturi e mielinizzanti attraverso una serie di passaggi altamente orchestrati, tra cui la crescita dei processi che entrano in contatto con gli assoni, l'aumento della complessità morfologica, l'espansione della membrana mielinica e, infine, la compattazione della guaina mielinica4. Pertanto, l'interazione tra oligodendrociti e neuroni è molto intima. Le interazioni reciproche tra neuroni e oligodendrociti sono necessarie anche per la salute e il mantenimento del SNC2. L'attività assonale svolge un ruolo nello stimolare la mielinizzazione e i fattori neurotrofici gliali supportano l'integrità dei neuroni. Anche l'importanza del crosstalk glia-glia nel SNC sta diventando sempre più riconosciuta 5,6,7,8. Ad esempio, i fattori astrocitici possono influenzare la differenziazione delle OPC e il mantenimento dei tratti di sostanza bianca. Le microglia svolgono anche un ruolo nella modulazione della differenziazione OPC e nell'eliminazione dei detriti di mielina, una fase importante del processo di rimielinizzazione. L'identificazione dei fattori cellulo-autonomi e la comprensione dell'influenza di altri tipi di cellule del SNC nella demielinizzazione e nella rimielinizzazione saranno preziose per lo sviluppo di terapie per le malattie demielinizzanti e demielinizzanti.
Qui, descriviamo un sistema ex vivo che utilizza colture di fette cerebellari di topo (CSC) che consente la manipolazione e la quantificazione del tessuto del SNC intatto. L'uso di CSC consente di misurare la mielinizzazione, o rimielinizzazione dopo l'induzione della demielinizzazione da parte della lisolecitina 9,10, utilizzando metodi tradizionalmente utilizzati negli studi in vivo, come l'immunocolorazione e la microscopia elettronica 11,12,13. La lisolecitina è una sostanza chimica che distrugge la membrana e provoca una rapida perdita di mielina e oligodendrociti. Un potenziale avvertimento da notare è che la lisolecitina può anche comportare la riduzione di altri tipi di cellule vicino all'area della lesione. A differenza degli esperimenti in vivo, tuttavia, le fette sagittali del cervelletto possono essere facilmente manipolate tramite l'aggiunta di composti o geneticamente modificate utilizzando adenovirus Ad-Cre. Il metodo consente anche la manipolazione di tessuto isolato da topi transgenici o topi sottoposti a insulti ambientali come l'ipossia 11,12,13,14. Il modello CSC consente quindi lo studio della mielinizzazione dello sviluppo, la modellazione della malattia e l'identificazione di fattori che promuovono o inibiscono la mielinizzazione, integrando al contempo i contributi di diversi tipi di cellule del SNC alla funzione degli oligodendrociti.
Protocollo
Tutti gli studi sugli animali sono stati autorizzati e approvati dal Comitato Istituzionale per la Cura e l'Uso degli Animali di Genentech.
1. Preparazione dei terreni e dei materiali di consumo per la dissezione (~30–45 min)
- Preparare e sterilizzare il terreno di coltura a fette filtrate (SCM) e il terreno di dissezione (DM) come descritto nella Tabella 1. Conservare a 4 °C. Se vengono testati fattori per il test di mielinizzazione, aggiungerli all'SCM appena prima dell'uso.
- Pipettare 1 mL di SCM in ciascun pozzetto della piastra a 6 pozzetti.
- Utilizzando una pinza sterile, posizionare un inserto organotipico in ciascun pozzetto, assicurandosi che non rimangano intrappolate bolle sotto la membrana. Riscaldare la piastra con un fluido a 37 °C in un incubatore con CO2 al 7,5%.
2. Preparazione dell'area di dissezione (~5–10 min)
- Eseguire le procedure in una cappa sterile a flusso laminare o sul banco di lavoro con tecniche asettiche adeguate per tutte le fasi della procedura. Pulire tutte le aree con etanolo al 70%.
- Posizionare una nuova lama e un tavolino di taglio in silicone sul tritatutto. Pipettare ~300 μL di acqua sterile o etanolo al 70% durante la fase di taglio per assicurarsi che rimanga in posizione.
- Utilizzare un batuffolo di cotone per pulire delicatamente la lama del tritatutto e la fase di taglio con etanolo al 70%. Asciugare prima di utilizzare il tritafazzoletti.
- Spruzzare tutti gli strumenti di dissezione con etanolo al 70% e asciugare prima della dissezione.
- Preparare due piastre di Petri da 10 cm: una con 15-20 ml di SS, una con 10 ml di SCM. Conservare con ghiaccio. Tenere tutti i terreni e le piastre di Petri sul ghiaccio quando non si dissezionano.
3. Dissezione della coltura della fetta cerebellare (~15-20 min per cucciolo)
- Posizionare la capsula di Petri con DM su un microscopio da dissezione.
- Eutanasia di un cucciolo di topo, giorno postnatale P0-2, mediante decapitazione rapida con forbici affilate.
- Posizionare la testa nella capsula di Petri con DM sotto il microscopio da dissezione per eliminare il sangue.
- Usando le forbici sottili, taglia una volta su ciascun bordo laterale alla base del cranio.
- Con la testa posizionata a testa in giù in DM, premi con decisione sul lato inferiore del cranio usando una pinza #5/45, forzando il rombencefalo non danneggiato attraverso il foro nel cranio.
- Sotto il microscopio da dissezione, tagliare il tessuto in eccesso usando due bisturi #11. Assicurati che il cervelletto rimanga attaccato al pezzo sottostante del rombencefalo. Vedere la Figura 1A per un diagramma dettagliato.
- Usando la spatola, trasferire il cervelletto allo stadio di taglio del trinciatessuti con il tessuto appoggiato sulla faccia rostrale del rombencefalo e la faccia caudale del rombencefalo rivolta verso il ricercatore. Assicurarsi che il piano mediale del cervello sia esattamente parallelo alla lama del tritatessuti.
- Utilizzando la pipetta P200, rimuovere il terreno in eccesso intorno al tessuto, assicurandosi che sia ancora umido ma non galleggiante o circondato da liquido.
- Sostituire la piastra di Petri contenente DM con la piastra di Petri contenente SCM al microscopio da dissezione.
- Tagliare il tessuto in fette spesse 350 μm utilizzando il tritatessuti.
NOTA: La velocità della lama (ad esempio, circa un taglio al secondo) e la forza devono essere ottimizzate per garantire condizioni di taglio ottimali. In rari casi, il tessuto rimarrà impigliato nella lama. Per ridurre al minimo la perdita di sezioni di tessuto, tenere il pollice sul pulsante di accensione per spegnere rapidamente il tritafazzoletti, se necessario. - Pipettare delicatamente 100 μl di SCM sotto il tessuto, in modo che le fette galleggino. Trasferire il tessuto affettato utilizzando la spatola nella piastra di Petri con SCM al microscopio da dissezione.
- Utilizzare un batuffolo di cotone per pulire delicatamente la lama del tritatutto e la fase di taglio con etanolo al 70%.
- Utilizzando i bisturi (lato smussato), separare delicatamente le fette al microscopio da dissezione. Utilizzando un bisturi e una spatola, trasferire le fette sulla membrana nella piastra a 6 pozzetti con SCM.
NOTA: Le sezioni più mediali avranno spesso la migliore mielinizzazione e integrità dei tessuti. In media, 4-6 fette possono essere sezionate da un cervello di topo. - Incubare le fette in SCM a 37 °C in CO2 al 7,5%.
4. Cambiamenti culturali e mediatici (~15-30 min)
- Sostituire l'SCM a giorni alterni.
- Pipettare 1 mL di terreno fresco in ciascun pozzetto di una nuova piastra a 6 pozzetti e scaldare in un'incubatrice. Utilizzando una pinza sterile, trasferire le membrane sulla nuova piastra, assicurandosi che non vi siano bolle al di sotto. Rimettere le piastre nell'incubatrice.
5. Mielinizzazione e rimielinizzazione standard
- Protocollo di mielinizzazione standard (Figura 1B).
- Fette di coltura sezionate nella sezione 3 da 0 a 12 giorni in vitro (DIV). Se si sta testando l'effetto di un qualsiasi fattore sulla mielinizzazione, aggiungerlo al terreno al momento della coltura (0 DIV) e reintegrarlo ad ogni cambio di terreno.
- Correzione a 12 DIV (passaggio 7.1), un punto temporale ottimizzato per la mielinizzazione incompleta 11,12,13. Ciò consente di rilevare eventuali effetti di miglioramento o blocco sulla mielinizzazione dovuti al fattore aggiunto al mezzo. Un risultato positivo rappresentativo con l'aggiunta di 100 ng/mL di Activina A è mostrato nella Figura 2.
- Protocollo di rimielinizzazione (Figura 1C)
- Seguire il protocollo di mielinizzazione standard descritto nella sezione 5.1 senza fattori aggiuntivi fino a 14 DIV, il momento in cui le fette sono completamente mielinizzate 11,12,13.
- Preparare il brodo di lisolecitina (125 mg/mL) come descritto nella Tabella 1. Pipettare 1 mL di lisolecitina allo 0,5% in SCM in ciascun pozzetto di una nuova piastra a 6 pozzetti e scaldare in un incubatore.
- Trasferire le membrane su una piastra di lisolecitina e metterle in un'incubatrice per una notte per 16-18 ore.
- Il giorno successivo, preparare nuove piastre con SCM fresco, aggiungendo eventuali fattori da testare per gli effetti della rimielinizzazione, se necessario. Piatti caldi in un'incubatrice.
- Per il cambio del terreno, picchiettare delicatamente la membrana sul lato del pozzetto per assicurarsi che tutto il mezzo di lisolecitina venga rimosso. Reintegrare il/i fattore/i da testare ad ogni cambio di fluido (sezione 4).
- Correggere le sezioni a 28 DIV (passaggio 7.1), un punto temporale ottimizzato per la rimielinizzazione incompleta. Ciò consente di rilevare l'aumento o il blocco della rimielinizzazione a causa del fattore aggiunto al mezzo. Un risultato positivo rappresentativo con l'aggiunta di 0,1 μM di XAV939 è presentato nella Figura 3.
6. Variazioni al protocollo di mielinizzazione e rimielinizzazione
- Protocollo di ipomielinizzazione indotta da ipossia (Figura 1D)11,13.
NOTA: Questo è presentato come una variante del protocollo di mielinizzazione standard presentato nella sezione 5.1.- Fette di piastre in SCM senza fattori.
- Trasferire le piastre a fette in un'incubatrice ipossica (2% FiO2) per 24 ore tra 2-3 DIV.
- Il giorno successivo, preparare nuove piastre con SCM fresco, aggiungendo eventuali fattori da testare per il potenziale di mielinizzazione, se necessario. Piatti caldi in un'incubatrice.
- Dopo la coltura in ipossia, cambiare il terreno (sezione 4) e riportare le colture in un incubatore di coltura standard (37 °C, 7,5% CO2). Reintegrare tutti i fattori da testare con ogni successivo cambio di supporto (sezione 4).
- Correzione a 12 DIV (passaggio 7.1).
- Protocollo di manipolazione genetica (Figura 1E)13
- Isolare il tessuto da topi transgenici per la dissezione come nella sezione 3.
- Con linee di topo transgenico inducibili, il tamoxifene (100 nM, una dose che non induce mielinizzazione o differenziazione OPC) o un adenovirus Ad-Cre possono essere aggiunti all'SCM durante i cambi di terreno effettuati a 1 DIV e 3 DIV.
- Dopo la manipolazione genetica con tamoxifene o adenovirus Ad-Cre, continuare i cambi di terreno a giorni alterni come nel paragrafo 4 (con l'aggiunta di fattori se necessario).
NOTE: Tutte le fette di un topo si adatteranno a una membrana, consentendo la genotipizzazione dopo la dissezione, rendendo così semplice l'esecuzione di esperimenti con topi transgenici.
7. Processamento e analisi dei tessuti
- Fissare le fette immergendo delicatamente la membrana in paraformaldeide al 4% per 1 ora a temperatura ambiente (RT).
- Risciacquare delicatamente immergendolo in soluzione salina tamponata con fosfato (PBS). Quindi, immergere in PBS in una piastra a 6 pozzetti.
NOTA: Il protocollo può essere messo in pausa qui. Le fette fisse possono essere conservate in PBS a 4 °C per un massimo di un mese. Se non si conservano le fette, sciacquare 2 volte in PBS per 5 minuti prima di procedere. - Utilizzare un bisturi per ritagliare la membrana dall'anello e procedere con la colorazione in una piastra a 6 pozzetti. Assicurarsi di tenere le fette rivolte verso l'alto (con la membrana rivolta verso il basso) per la colorazione e il successivo montaggio sui vetrini.
- Bloccare per 1 ora a RT in soluzione a blocchi (3% di siero di cavallo inattivato termicamente, 2% di albumina sierica bovina e 0,25% di Triton-X 100 diluito in PBS).
NOTA: Se è necessario il recupero dell'antigene per la colorazione degli anticorpi (ad es. CC1/Olig2), questo può essere fatto in piastre di Petri di vetro. - Avvolgere le piastre in un film di paraffina e incubare per una notte a 4 °C in anticorpo primario diluito in soluzione bloccante.
- Lavare 3 volte in soluzione bloccante: 1) breve risciacquo, 2) 15 minuti di lavaggio e 3) 1 ora di lavaggio. Per un breve risciacquo, riempire una piccola capsula di Petri con la soluzione e immergere delicatamente la membrana con una pinza prima di trasferirla in una soluzione fresca. Per lavaggi più lunghi (ad es. 15 minuti e 1 ora), immergere la membrana in soluzione in una piastra a 6 pozzetti e posizionarla su un bilanciere delicato.
- Incubare al riparo dalla luce per 2 ore a RT in anticorpi secondari diluiti 1:500 in PBS.
- Lavare 3 volte in PBS: 1) risciacquo breve, 2) 15 minuti di lavaggio e 3) 1 ora di lavaggio.
- Se è necessaria la colorazione DAPI, immergere in una soluzione DAPI 1:1.000 per 7 minuti a RT. Risciacquare brevemente e poi lavare per 15 minuti in PBS.
- Sciacquare in acqua bidistillata.
- Montare le membrane su un vetrino con le fette rivolte verso l'alto (con la membrana rivolta verso il basso).
NOTA: Le fette montate possono essere conservate a 4 °C. L'imaging su un microscopio confocale viene eseguito preferibilmente entro 1 settimana, prima che la membrana diventi opaca e difficile da visualizzare. - Immagini con microscopia confocale e quantificazione come descritto in precedenza 11,12,13.
Risultati
Le colture di fette cerebellari derivate da topi P0-2 (Figura 1A) sono state utilizzate per studiare la mielinizzazione e valutare gli effetti dell'aggiunta di vari fattori da 0 a 12 DIV (Figura 1B). Per studiare la rimielinizzazione, le colture di fette a 14 DIV sono state prima demielinizzate con lisolecitina e lasciate rimielinare per altri 14 giorni in coltura con i fattori testati (Figura 1C), dopodiché la rimielinizzazione è stata quantificata. L'effetto dell'ipossia sulla mielinizzazione è stato studiato anche posizionando colture di fette in un incubatore ipossico FiO2 al 2% per 24 ore, da 2-3 DIV (Figura 1D). Infine, sono state utilizzate colture di fette derivate da topi transgenici per studiare l'effetto dei knockout genici sulla mielinizzazione. In questo sistema, la ricombinazione Cre è stata indotta dall'aggiunta di tamoxifene o adenovirus Ad-Cre a 1 DIV e 3 DIV, e le colture di fette sono state fissate per l'analisi a 12 DIV (Figura 1E). Dopo la fissazione dei tessuti, la quantificazione della demielinizzazione e della rimielinizzazione è stata effettuata mediante immunocolorazione (Figura 2, Figura 3) e microscopia elettronica 11,12,13.
I dati rappresentativi mostrati (Figura 2, Figura 3) illustrano l'intervallo dinamico della mielinizzazione e della rimielinizzazione nelle colture a fette. L'indice di mielinizzazione è stato quantificato dal rapporto tra Caspr, un marcatore paranodale che è una lettura indiretta della mielina compatta, e la proteina H del neurofilamento (NFH), che colora gli assoni. Questo indice di mielinizzazione è stato convalidato per rappresentare la formazione di mielina compatta mediante microscopia elettronica e colorazione con canale del sodio12. La demielinizzazione 9,10 indotta dalla lisolecitina ha portato alla completa scomparsa dei paranodi Caspr-positivi (indice di mielinizzazione = 0, Figura 3A) e alla perdita della mielina compatta, che è stata ripristinata durante la rimielinizzazione11,12.
Per dimostrare un risultato positivo sulla mielinizzazione, le fette sono state coltivate con Activin A seguendo la sequenza temporale nella Figura 1B. L'activina A coinvolge i recettori dell'activina sugli oligodendrociti e guida la differenziazione degli oligodendrociti e la compattazione della mielina15. I dati rappresentativi mostrano che il trattamento di fette con 100 ng/mL di Activina A durante la mielinizzazione ha portato a un indice di mielinizzazione più elevato (Figure 2A, B). Coerentemente con ciò, il trattamento con Activina A ha accelerato la differenziazione dell'OPC, come quantificato dal rapporto tra oligodendrociti maturi CC1-positivi e cellule di lignaggio oligodendrocitario Olig2+11,13 (Figure 2C,D).
È stato dimostrato che una piccola molecola inibitrice della tankirasi, XAV939, promuove la mielinizzazione e la rimielinizzazione stabilizzando i livelli di Axin2 negli oligodendrociti11. Dopo il trattamento con lisolecitina, la demielinizzazione è stata visualizzata e quantificata in colture di fette mediante colorazione frammentata della proteina basica della mielina (MBP) e assenza di paranodi Caspr-positivi (Figure 3A). Il trattamento con 0,1 μM di XAV939 durante la rimielinizzazione (15-28 DIV) ha aumentato significativamente l'indice di mielinizzazione rispetto ai controlli del veicolo, come quantificato dal rapporto tra colorazione Caspr e NFH (Figure 3B, C). Il modello di coltura a fette può quindi essere utilizzato per esaminare e quantificare gli effetti sulla differenziazione, la mielinizzazione e la rimielinizzazione dell'OPC nel tessuto intatto.
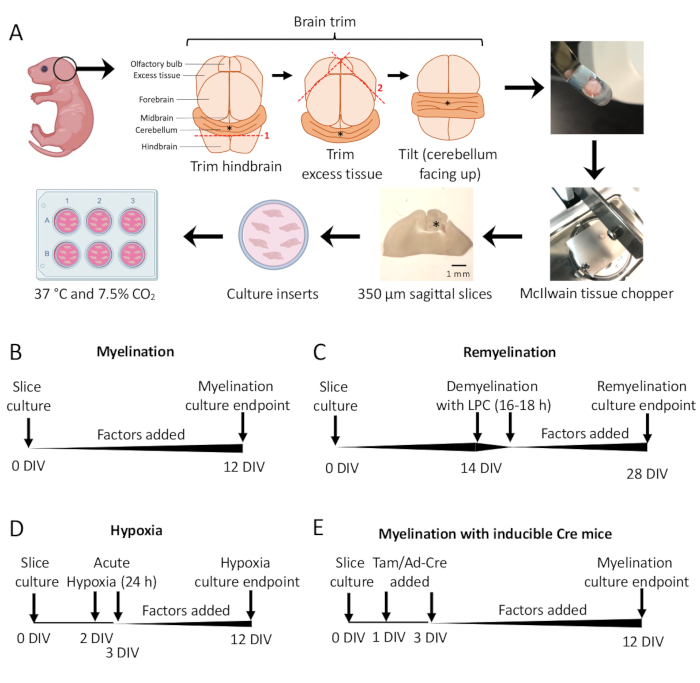
Figura 1: Schema delle colture di fette cerebellari che mostra le fasi chiave del processo di dissezione e le tempistiche per i diversi protocolli di coltura delle fette. (A) Rappresentazione delle fasi per generare colture di fette: dissezione del cervello da cuccioli di topo P0-2, rifilatura del cervello (come mostrato), taglio del cervello con un tritatutto per tessuti per generare fette sagittali da 350 μm, posizionamento di fette su inserti di coltura organotipica in un piatto a 6 pozzetti e incubazione a 37 °C e 7,5% di CO2. * denota il cervelletto. (B) Cronologia per le colture di fette mielininizzanti. Le colture a fette sono state incubate per 12 giorni prima della fissazione per l'analisi. (C) Cronologia per la rimielinizzazione delle colture di fette. Le fette sono state trattate con lisolecitina a 14 DIV per 16-18 ore per indurre la demielinizzazione completa e lasciate rimielinare fino a 28 DIV prima della fissazione per l'analisi. (D) Cronologia per la mielinizzazione a seguito di insulto ipossico. Le fette sono state esposte a un insulto ipossico acuto per 24 ore tra 2-3 DIV, che ha causato ipomielinizzazione. (E) Cronologia per CSC da topi geneticamente modificati. Il tamoxifene (Tam, 100nM) o virus Ad-Cre è stato aggiunto a 1 DIV e 3 DIV per indurre la modificazione genetica, e le fette sono state analizzate a 12 DIV. Diagrammi temporali adattati da precedenti pubblicazioni11,13. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Dati rappresentativi che mostrano che l'activina A promuove la mielinizzazione e la differenziazione OPC. (A) Aumento della mielinizzazione (MBP) e dei paranodi (Caspr) con 100 ng/mL di trattamento con Activina A, dimostrato dall'immunocolorazione delle colture a fette. (B) Quantificazione dell'indice di mielinizzazione (rapporto tra l'area colorata per i paranodi Caspr+ e l'area colorata per gli assoni NFH+). (C) Quantificazione del differenziamento OPC (rapporto tra oligodendrociti CC1+ e cellule di lignaggio di oligodendrociti Olig2+). (D) Immagini rappresentative della colorazione CC1/Olig2. I valori mostrati sono media + deviazione standard. P < 0,0001; test T non accoppiato. Barre della scala: A = 25 μm, D = 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Dati rappresentativi che mostrano che XAV939 promuove la rimielinizzazione. (A) Immagini che mostrano demielinizzazione mediante colorazione MBP frammentata e mancanza di paranodi Caspr in colture di fette trattate con lisolecitina. (B) Aumento della rimielinizzazione (MBP) e dei paranodi (Caspr) con trattamento con XAV939 0,1 μM a seguito di demielinizzazione indotta da lisolecitina, dimostrata dall'immunocolorazione delle colture a fette. (C) Quantificazione dell'indice di mielinizzazione (rapporto tra l'area colorata per i paranodi Caspr+ e l'area colorata per gli assoni NFH+). I valori mostrati sono media + deviazione standard. P < 0,0001; test T non accoppiato. Barre di scala = 25 μm. Clicca qui per visualizzare una versione più grande di questa figura.
| Terreni di coltura a fette (SCM) | |
| Volume | Reagente |
| 100 ml | Terreni minimi essenziali (MEM), HEPES, senza glutammina |
| 50 ml | Siero di cavallo inattivato a caldo |
| 50 ml | La soluzione salina bilanciata di Earle |
| 2 ml | Penicillina-streptomicina 10.000 U/mL |
| 2 ml | Integratore GlutaMAX |
| 2888 μL | Soluzione di glucosio al 45% |
| 1 ml | Fungizone |
| Filtrare in modo sterile con un filtro da 0,22 μm e conservare in frigorifero a 4 °C per un massimo di 2 settimane. | |
| Mezzi di dissezione (DM) | |
| Volume | Reagente |
| 100 ml | MEM, HEPES, con sali di Earle |
| 1 ml | Penicillina-streptomicina 10.000 U/mL |
| Filtrare in modo sterile con un filtro da 0,22 μm e conservare in frigorifero a 4 °C per un massimo di 2 mesi. | |
| Lisolecitina (125 mg/mL) | |
| Importo | Reagente |
| 100 mg | Lisolecitina |
| 0,8 ml | Sterile PBS |
| Sciogliere 100 mg di lisolecitina in 0,8 mL di PBS sterile. Conservare 80 μL di aliquote di soluzione madre a -20 °C. | |
| Prima dell'uso, scongelare 80 μL di aliquota e sciogliere in 20 mL di SCM (0,5% di lisolecitina in SCM), riscaldato in incubatore a 37 °C, 7,5% CO2. Se necessario, vorticare per sciogliere la lisolecitina in SCM. | |
Tabella 1: Elenco dei componenti e del protocollo per la produzione di terreno di coltura a fette (SCM), terreno di dissezione (DM) e soluzione di lisolecitina.
Discussione
Questo protocollo descrive un modello di coltura di fette cerebellari organotipiche che ricapitola la composizione cellulare in vivo con la semplicità di un modello in vitro. Questo protocollo potrebbe essere ulteriormente sviluppato per diventare un modello più rappresentativo delle patologie umane. Le CSC possono essere potenzialmente sviluppate come modelli per lesioni specifiche della malattia, come le lesioni tissutali indotte dalla forza, le lesioni indotte da anticorpi specifici per la mielina o le lesioni da oligodendrociti nella SM con l'aggiunta di cellule immunitarie periferiche. Questo protocollo può anche essere ottimizzato per il tessuto sezionato da altre parti del cervello e del midollo spinale16,17. Mentre questo protocollo si concentra sulla quantificazione istologica della mielinizzazione, le CSC rappresentano un modello conveniente per esaminare vari endpoint sperimentali. Queste colture possono essere utilizzate per caratterizzare diversi tipi di cellule tramite il sequenziamento dell'RNA di una singola cellula, valutare l'ultrastruttura degli assoni e delle guaine mieliniche tramite microscopia elettronica e studiare la dinamica OPC conducendo l'imaging time lapse. L'immunocolorazione può anche essere aggirata con l'uso di linee reporter di topo transgenico18,19. Infine, le diverse età dei cuccioli di topo, il tempo trascorso in coltura o lo spessore delle sezioni possono essere utilizzati per adattare le CSC per modellare diversi meccanismi di malattia 10,17,18,19,20,23.
Le colture a fette sono ideali per testare e quantificare i fattori che influenzano la mielinizzazione e la rimielinizzazione, ma sono limitate nella loro rappresentazione del SNC in determinati contesti. Derivate da cervelli P 0-2, le CSC provengono da cervelli che sono all'inizio dello sviluppo e hanno somiglianze limitate con un cervello che invecchia o neurodegenerativo. Data la crescente consapevolezza dell'importanza della mielina nei disturbi del SNC come il morbo di Alzheimer21 e la schizofrenia22, sono necessari modelli adulti o di invecchiamento per quantificare e caratterizzare la mielinizzazione. Altri protocolli sono stati pubblicati isolando il tessuto da roditori più anziani, anche se ancora durante le fasi di sviluppo 10,18,19,23. Inoltre, ci possono essere differenze intrinseche ed estrinseche negli oligodendrociti e nelle OPC nel cervelletto rispetto al midollo spinale e ad altri tratti di sostanza bianca nel cervello. Le CSC sono anche meno adatte dei sistemi in vitro basati su cellule per CRISPR su larga scala o screening di piccole molecole. A causa del taglio iniziale del tessuto, c'è anche un'attivazione delle cellule immunitarie innate residenti nel cervello (cioè microglia e astrociti), un avvertimento importante per il sistema24. Infine, le cellule immunitarie periferiche svolgono un ruolo importante nella patologia della SM25; Le CSC sono prive di cellule periferiche a meno che queste cellule non siano aggiunte esogenamente, e quindi non sono un modello ideale dell'ambiente infiammatorio del SNC.
La parte di dissezione di questo protocollo è forse la più critica. Le fasi di dissezione devono essere eseguite con la massima cura, in modo da non danneggiare il tessuto e la struttura sottostante. Il corretto allineamento del cervello lungo la lama del tritatessuti garantisce un danno minimo ai tessuti e alle cellule. Inoltre, sono importanti un'attenta dissezione e separazione delle fette, nonché il loro trasferimento alle membrane per la coltura. I tempi delineati in questo protocollo sono stati ottimizzati per la ricerca descritta, ma potrebbe essere necessario adattarli per ottenere risultati ottimali in diversi studi. Questo protocollo sarà utile per coloro che desiderano studiare la mielinizzazione dello sviluppo e la riparazione della mielina.
Da notare che non esiste una cura per la SM. Mentre le terapie attuali sono abbastanza efficaci nello smorzare il sistema immunitario adattativo, nessuna terapia attuale può arrestare la progressione. Si ritiene che un fallimento della rimielinizzazione e la successiva neurodegenerazione siano alla base della progressione della SM2. La presenza di OPC nelle lesioni croniche della SM suggerisce che il fallimento della riparazione della mielina potrebbe essere dovuto ad un arresto nella differenziazione delle OPC. L'uso delle CSC apre una strada alla scoperta delle terapie di riparazione della mielina che possono aiutare a invertire la progressione della SM e ripristinare la funzione. La terapia di riparazione della mielina può anche aiutare il recupero nei pazienti con lesione del midollo spinale, dove i tratti demielinizzati inibiscono la funzione locomotoria26. Pertanto, l'importanza delle CSC risiede nella sua idoneità a identificare i fattori che influenzano la demielinizzazione e la rimielinizzazione dei mammiferi in modo relativamente elevato rispetto ai modelli animali in vivo. Mentre molti studi hanno utilizzato OPC primarie per lo screening di composti che influenzano la differenziazione, la generazione e l'isolamento di OPC primarie richiede un'immunopanning laboriosa e sequenziale27. Inoltre, i saggi basati su cellule non ricapitolano la diversità e l'interazione dei tipi di cellule presenti in vivo. La generazione di CSC da cuccioli di topo è un modello rapido ed economico per lo studio della mielinizzazione e della rimielinizzazione che non richiede attrezzature o materiali di consumo costosi. Le colture di fette cerebellari rappresentano quindi un modello quantitativo inestimabile per ricapitolare la mielinizzazione ex vivo e consentono la scoperta di farmaci e la ricerca scientifica di base.
Divulgazioni
Gli autori sono dipendenti di Genentech, Inc., membro del Gruppo Roche.
Riconoscimenti
Gli autori desiderano ringraziare Yun-An Shen, Roxanne Kyauk e Chris Bohlen per i commenti costruttivi e l'input su questo articolo. Inoltre, gli autori riconoscono i contributi di Charles Ffrench-Constant, Andrew Jarjour, Veronique Miron e David Rowitch nello sviluppo iniziale della metodologia correlata precedentemente pubblicata 11,12,13.
Materiali
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Riferimenti
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , Sunderland (MA): Sinauer Associates. (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder? Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71(2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532(2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679(2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46(2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835(2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592(2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22(2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163(2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131(2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon