Method Article
小脑切片培养物中的离体髓鞘形成和髓鞘再生作为发育和疾病相关作的定量模型
摘要
提出的是使用小鼠小脑切片培养物的脱髓鞘和髓鞘再生的离体定量模型的方案。该方法紧密概括了完整组织中 CNS 细胞类型的完整补充的体内模型,同时保持了体外系统的化学、遗传和环境适应性。
摘要
在体外和体内研究髓鞘形成带来了许多挑战。少突胶质细胞前体细胞 (OPC) 在体外的分化虽然可扩展,但不能概括轴突髓鞘形成。OPC 神经元共培养和 OPC 纤维培养允许检查体外髓鞘形成,但它们缺乏体内存在的其他细胞类型,例如星形胶质细胞和小胶质细胞。然而,体内小鼠模型不太容易受到化学、环境和遗传作的影响,并且劳动强度要高得多。在这里,我们描述了一种离体小鼠小脑切片培养 (CSC) 定量系统,该系统可用于:1) 研究发育髓鞘形成,2) 模拟脱髓鞘和髓鞘再生,以及 3) 进行转化研究。从出生后第 0-2 天小鼠中分离出小脑和后脑的矢状切片,之后它们在体外进行髓鞘化 12 天。在此期间,可以通过多种方式纵切片,包括添加化合物以测试对发育髓鞘形成的影响。此外,可以固定组织进行电子显微镜检查,以评估髓鞘超微结构和压实。为了模拟疾病,CSC 可以进行急性缺氧以诱导髓鞘形成不足。溶血卵磷脂也可诱导这些外植体中的脱髓鞘,从而可以识别促进髓鞘再生的因子。除了化学和环境修饰外,CSC 还可以从转基因小鼠中分离出来,并且对 Ad-Cre 腺病毒和他莫昔芬诱导的基因作有反应。因此,小脑切片培养是一种快速、可重复且可量化的模型,用于概括髓鞘形成。
引言
轴突的髓鞘形成使动作电位能够快速传播,这种机制称为盐传导1。髓鞘的重要性通过脱髓鞘疾病得到强调,例如多发性硬化症 (MS),其中包括多种使人衰弱的表现,包括视力丧失、认知问题和瘫痪。MS 无法治愈,目前的疗法侧重于通过靶向外周免疫细胞来限制疾病进展。MS 和相关疾病的残疾被认为是由髓鞘再生失败和进行性神经退化引起的。特别是在进行性 MS 中观察到脱髓鞘、萎缩和轴突丢失 2,3。因此,促进髓鞘再生是一种很有前途的策略,可以与目前的治疗同时进行,并产生额外的治疗益处。
在中枢神经系统 (CNS) 中,髓鞘形成由称为少突胶质细胞的特殊神经胶质细胞进行。少突胶质细胞前体细胞 (OPC) 通过一系列高度协调的步骤分化为成熟的髓鞘少突胶质细胞,包括接触轴突的过程的生长、形态复杂性的增加、髓鞘膜的扩张,最后是髓鞘压缩4。因此,少突胶质细胞和神经元之间的相互作用是高度密切的。神经元和少突胶质细胞之间的相互作用也是 CNS2 的健康和维持所必需的。轴突活动在刺激髓鞘形成中发挥作用,神经胶质神经营养因子支持神经元的完整性。神经胶质细胞-胶质细胞串扰在 CNS 中的重要性也越来越受到认可 5,6,7,8。例如,星形胶质细胞因子可以影响 OPC 的分化和白质束的维持。小胶质细胞还在调节 OPC 分化和清除髓鞘碎片中发挥作用,这是髓鞘再生过程的重要步骤。鉴定细胞自主因子并了解其他 CNS 细胞类型在脱髓鞘和髓鞘再生中的影响对于开发脱髓鞘和髓鞘异常疾病的治疗方法将非常宝贵。
在这里,我们描述了一种使用小鼠小脑切片培养物 (CSC) 的离体系统,该系统允许作和定量完整的 CNS 组织。使用 CSC 可以使用传统上用于体内研究的方法(例如免疫染色和电子显微镜检查)来测量髓鞘形成或溶血卵磷脂诱导脱髓鞘后 9,10 的髓鞘再生 11,12,13。溶血卵磷脂是一种破坏膜的化学物质,可导致髓鞘和少突胶质细胞迅速丢失。需要注意的一个潜在警告是,溶血卵磷脂也可能导致靠近病变区域的其他细胞类型的减少。然而,与体内实验不同的是,小脑的矢状切片可以通过添加化合物轻松纵,或使用 Ad-Cre 腺病毒进行基因改变。该方法还允许作来自转基因小鼠或受环境损伤(如缺氧)的小鼠的分离组织11、12、13、14。因此,CSC 模型允许研究发育中的髓鞘形成、疾病建模以及识别促进或抑制髓鞘形成的因素,同时整合不同 CNS 细胞类型对少突胶质细胞功能的贡献。
研究方案
所有动物研究均已获得基因泰克机构动物护理和使用委员会的授权和批准。
1. 制备用于解剖的培养基和用品(~30-45 分钟)
- 如 表 1 中所述,准备并无菌过滤切片培养基 (SCM) 和解剖培养基 (DM)。储存在 4 °C。 如果正在测试任何因子进行髓鞘形成测定,请在使用前将它们添加到 SCM 中。
- 将 1 mL 的 SCM 移液到 6 孔板的每个孔中。
- 使用无菌镊子,将器官型插入物放入每个孔中,确保膜下没有气泡滞留。在 37 °C 的 7.5% CO2 培养箱中用培养基加热板。
2. 准备解剖区域(~5-10 分钟)
- 在无菌层流罩中或在工作台上执行程序,并为程序的所有步骤使用适当的无菌技术。用 70% 乙醇将所有区域擦拭干净。
- 在组织切碎机上放置新的刀片和硅胶切割台。在切割阶段移液 ~300 μL 无菌水或 70% 乙醇,以确保其保持在原位。
- 用棉签用 70% 乙醇轻轻擦拭组织切碎机刀片和切割台。使用组织切碎机前干燥。
- 用 70% 乙醇喷洒所有解剖工具,并在解剖前干燥。
- 准备两个 10 cm 培养皿:一个装有 15-20 mL DM,一个装有 10 mL SCM。储存在冰上。不解剖时,将所有培养基和培养皿放在冰上。
3. 小脑切片培养解剖(每只幼崽 ~15-20 分钟)
- 将含有 DM 的培养皿放在解剖显微镜上。
- 在出生后第 P0-2 天,用锋利的剪刀迅速斩首,对小鼠幼崽实施安乐死。
- 将头部放入带有 DM 的培养皿中,在解剖显微镜下清除血液。
- 使用细剪刀,在颅骨底部的每个侧边剪一次。
- 将头部倒置在 DM 中,使用 #5/45 镊子用力按压颅骨下侧,迫使未受损的后脑穿过颅骨上的孔。
- 在解剖显微镜下,使用两把 #11 手术刀切掉多余的组织。确保小脑仍然附着在后脑的底层部分。有关详细图表,请参见 图 1A 。
- 使用刮刀,将小脑转移到组织切碎机的切割阶段,组织放在后脑的喙面上,后脑的尾面面向研究人员。确保大脑的内侧平面与组织切碎器刀片完全平行。
- 使用 P200 移液器去除组织周围多余的培养基,确保其仍然湿润,但不会漂浮或被液体包围。
- 在解剖显微镜下,将含有 DM 的培养皿与含有 SCM 的培养皿交换。
- 使用组织切碎机将组织切成 350 μm 厚的切片。
注意:需要优化刀片速度(例如,大约每秒一次切割)和力,以确保最佳的切割条件。在极少数情况下,组织会被刀片卡住。为了最大限度地减少组织切片的损失,请按住电源按钮的拇指,以便在需要时快速关闭组织切碎机。 - 在组织下轻轻吸取 100 μL 的 SCM,使切片漂浮。在解剖显微镜下,用刮刀将切片的组织转移到带有 SCM 的培养皿中。
- 用棉签用 70% 乙醇轻轻擦拭组织切碎机刀片和切割台。
- 使用手术刀(钝侧),在解剖显微镜下轻轻分离切片。使用手术刀和抹刀,用 SCM 将切片转移到 6 孔板中的膜上。
注意:最内侧的部分通常具有最佳的髓鞘形成和组织完整性。平均而言,可以从一个小鼠大脑中解剖 4-6 个切片。 - 在 37 °C 和 7.5% CO2 的 SCM 中孵育切片。
4. 更换文化和培养基(~15–30 分钟)
- 每隔一天更换一次 SCM。
- 将 1 mL 新鲜培养基移液到新的 6 孔板的每个孔中,并在培养箱中加热。使用无菌镊子将膜转移到新板上,确保下面没有气泡。将板放回培养箱中。
5. 标准髓鞘形成和髓鞘再生
- 标准髓鞘形成方案(图 1B)。
- 在第 3 部分中解剖的 0-12 天体外 (DIV) 培养切片。如果正在测试任何因素对髓鞘形成的影响,请在培养时将其添加到培养基中 (0 DIV) 并在每次更换培养基时补充。
- 固定在 12 DIV(步骤 7.1),针对不完全髓鞘形成 11,12,13 优化的时间点。这允许检测由于添加到培养基中的因子而对髓鞘形成的任何增强或阻断作用。添加 100 ng/mL 激活素 A 后的代表性阳性结果如图 2 所示。
- 髓鞘再生方案(图 1C)
- 遵循第 5.1 节中描述的标准髓鞘形成方案,在 14 DIV 之前没有其他因素,即切片完全髓鞘化的时间点 11,12,13。
- 如 表 1 中所述制备溶血卵磷脂原液 (125 mg/mL)。将 1 mL 的 0.5% 溶卵磷脂在 SCM 中移液到新的 6 孔板的每个孔中,并在培养箱中加热。
- 将膜转移到溶血卵磷脂板中,并在培养箱中放置过夜 16-18 小时。
- 第二天,用新鲜的 SCM 准备新的板,如果需要,添加任何正在测试髓鞘再生效果的因子。在培养箱中加热板。
- 更换培养基时,轻轻敲击孔侧面的膜,以确保去除所有溶血卵磷脂培养基。在每次介质更换时补充被测因子(第 4 节)。
- 将切片固定在 28 DIV(步骤 7.1),这是针对不完全髓鞘再生优化的时间点。这允许检测由于添加到培养基中的因子而导致的髓鞘再生的增强或阻断。添加 0.1 μM XAV939 后的代表性阳性结果如图 3 所示。
6. 髓鞘形成和髓鞘再生方案的变化
- 缺氧诱导的髓鞘形成不足方案(图 1D)11,13。
注意:这是作为第 5.1 节中介绍的标准髓鞘形成方案的变体。- 在 SCM 中无因子的板切片。
- 将切片板转移到低氧培养箱 (2% FiO2) 中 2-3 DIV 之间 24 小时。
- 第二天,用新鲜的 SCM 准备新的板,如果需要,添加任何正在测试髓鞘形成潜力的因子。在培养箱中加热板。
- 在缺氧条件下培养后,更换培养基(第 4 部分)并将培养物放回标准培养箱(37 °C,7.5% CO2 )中。在每次后续介质更改中补充正在测试的任何因素(第 4 部分)。
- 固定在 12 DIV 处(步骤 7.1)。
- 遗传作方案(图 1E)13
- 从转基因小鼠中分离组织进行解剖,如第 3 节所示。
- 对于可诱导型转基因小鼠品系,在以 1 DIV 和 3 DIV 进行培养基更换期间,可以将他莫昔芬(100 nM,不诱导髓鞘形成或 OPC 分化的剂量)或 Ad-Cre 腺病毒添加到 SCM 中。
- 在用他莫昔芬或 Ad-Cre 腺病毒进行基因作后,如第 4 节所示,每隔一天继续更换培养基(如果需要,添加因子)。
注意:一只小鼠的所有切片都适合在一个膜上,允许在解剖后进行基因分型,从而使转基因小鼠的实验变得简单。
7. 组织处理和分析
- 通过在室温 (RT) 下将膜轻轻浸入 4% 多聚甲醛中 1 小时来固定切片。
- 浸入磷酸盐缓冲盐水 (PBS) 中轻轻冲洗。然后,浸没在 6 孔板中的 PBS 中。
注意:协议可以在此处暂停。固定切片可在 4 °C 的 PBS 中储存长达一个月。如果不储存切片,请在继续之前在 PBS 中冲洗 2 次 5 分钟。 - 使用手术刀从环上切下膜,然后在 6 孔板中进行染色。确保切片面朝上(膜面朝下),以便染色和随后封片到载玻片上。
- 在封闭溶液(3% 热灭活马血清、2% 牛血清白蛋白和 0.25% Triton-X 100 在 PBS 中稀释)中在 RT 下封闭 1 小时。
注:如果抗体染色需要抗原修复(例如 CC1/Olig2),则可以在玻璃培养皿中进行。 - 将板包裹在石蜡膜中,并在 4 °C 下在封闭溶液中稀释的一抗中孵育过夜。
- 在封闭溶液中洗涤 3 次:1) 短暂冲洗,2) 洗涤 15 分钟,以及 3) 洗涤 1 小时。要进行短暂冲洗,请在小培养皿中加入溶液,并使用镊子轻轻浸入膜中,然后转移到新鲜溶液中。对于更长的洗涤时间(即 15 分钟和 1 小时),将膜浸入 6 孔板的溶液中,并置于温和的摇杆上。
- 在 RT 中,在 PBS 中以 1:500 稀释的二抗中避光孵育 2 小时。
- 在 PBS 中洗涤 3 次:1) 短暂冲洗,2) 洗涤 15 分钟,以及 3) 洗涤 1 小时。
- 如果需要 DAPI 染色,在 RT 下浸入 1:1,000 DAPI 溶液中 7 分钟。短暂冲洗,然后在 PBS 中洗涤 15 分钟。
- 用双蒸水冲洗。
- 将膜安装在载玻片上,切片朝上(膜面朝下)。
注意:封片的切片可以储存在 4 °C 下。 在共聚焦显微镜上成像最好在 1 周内完成,以免膜变得不透明且难以成像。 - 使用共聚焦显微镜对切片进行成像,并如前所述进行定量 11,12,13。
结果
来自P0-2小鼠的小脑切片培养物(图1A)用于研究髓鞘形成并评估添加 0-12 DIV 的各种因子的影响(图 1B)。为了研究髓鞘再生,首先用溶血黄素对 14 DIV 的切片培养物进行髓鞘再生,并让其在培养物中再髓鞘再生 14 天(图 1C),然后定量髓鞘再生。通过将切片培养物置于 2% FiO2 缺氧培养箱中 24 小时,从 2-3 DIV 研究缺氧对髓鞘形成的影响(图 1D)。最后,使用来自转基因小鼠的切片培养物研究基因敲除对髓鞘形成的影响。在该系统中,通过在 1 DIV 和 3 DIV 添加他莫昔芬或 Ad-Cre 腺病毒来诱导 Cre 重组,并在 12 DIV 下固定切片培养物进行分析(图 1E)。固定组织后,通过免疫染色(图 2、图 3)和电子显微镜进行脱髓鞘和髓鞘再生的定量 11,12,13。
所示的代表性数据(图 2、图 3)说明了切片培养物中髓鞘形成和髓鞘再生的动态范围。髓鞘形成指数通过 Caspr 的比率来量化,Caspr 是一种旁结标志物,是致密髓鞘的间接读数,与染色轴突的神经丝蛋白 H (NFH) 的比率。该髓鞘形成指数已通过电子显微镜和钠通道染色验证为代表致密髓鞘的形成12。溶血卵磷脂诱导的脱髓鞘 9,10 导致 Caspr 阳性旁节点完全消失(髓鞘形成指数 = 0,图 3A)和致密髓鞘丢失,在髓鞘再生过程中恢复11,12。
为了证明髓鞘形成的阳性结果,按照图 1B 中的时间表用激活素 A 培养切片。激活素 A 与少突胶质细胞上的激活素受体结合,并驱动少突胶质细胞分化和髓鞘压缩15。代表性数据显示,在髓鞘形成过程中用 100 ng/mL 激活素 A 处理切片导致更高的髓鞘形成指数(图 2A、B)。与此一致,激活素 A 治疗加速了 OPC 分化,通过 CC1 阳性成熟少突胶质细胞与 Olig2+ 少突胶质细胞谱系细胞的比率11,13 进行量化(图 2C、D)。
Tankyrase 的小分子抑制剂 XAV939 已被证明可通过稳定少突胶质细胞中的 Axin2 水平来促进髓鞘形成和髓鞘再生11。溶血卵磷脂处理后,通过碎片化髓鞘碱性蛋白 (MBP) 染色和缺乏 Caspr 阳性旁腺,在切片培养物中观察和定量脱髓鞘(图 3A)。与载体对照相比,在髓鞘再生 (15-28 DIV) 期间用 0.1 μM XAV939 处理显着增加了髓鞘形成指数,通过 Caspr 与 NFH 染色的比率进行量化(图 3B、C)。因此,切片培养模型可用于检查和量化对完整组织中 OPC 分化、髓鞘形成和髓鞘再生的影响。
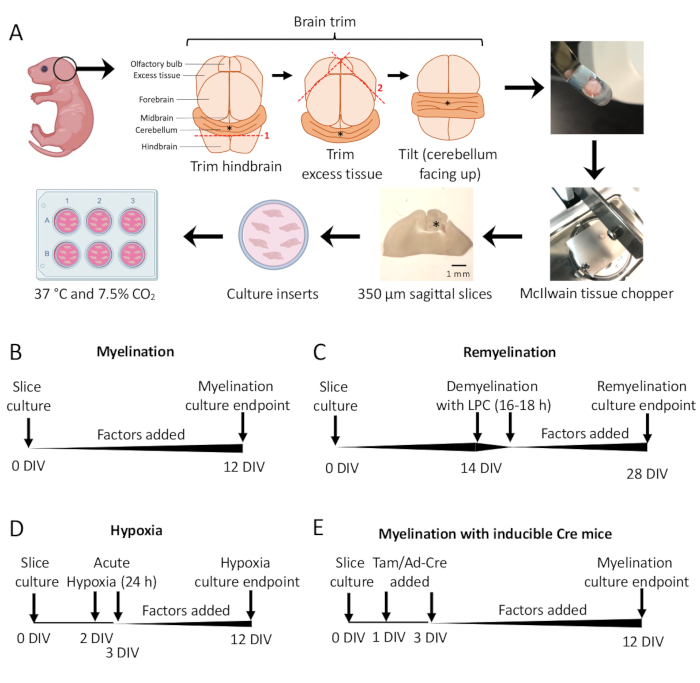
图 1:小脑切片培养示意图,显示了解剖过程中的关键步骤和不同切片培养方案的时间表。(A) 生成切片培养物的步骤描述:从 P0-2 小鼠幼崽解剖大脑,修剪大脑(如图所示),用组织切碎机切割大脑以产生 350 μm 矢状切片,将切片放在 6 孔培养皿中的器官型培养插入物上,并在 37 °C 和 7.5% CO2 下孵育。* 表示小脑。(B) 髓鞘切片培养的时间表。切片培养物在固定前孵育 12 天以进行分析。(C) 再髓鞘切片培养物的时间表。用 14 DIV 的溶血卵磷脂处理切片 16-18 小时以诱导完全脱髓鞘,并让其髓鞘再生至 28 DIV,然后固定进行分析。(D) 缺氧性损伤后髓鞘形成的时间表。切片在 2-3 DIV 之间暴露于急性缺氧损伤 24 小时,导致髓鞘发育不足。(E) 来自转基因小鼠的 CSC 时间表。在 1 DIV 和 3 DIV 处添加他莫昔芬 (Tam, 100nM) 或 Ad-Cre 病毒以诱导基因修饰,并在 12 DIV 处分析切片。时间线图改编自以前的出版物11,13。请单击此处查看此图的较大版本。

图 2:显示激活素 A 促进髓鞘形成和 OPC 分化的代表性数据。 (A) 100 ng/mL 激活素 A 处理后髓鞘形成 (MBP) 和旁节点 (Caspr) 增加,通过切片培养物的免疫染色显示。(B) 髓鞘形成指数的定量(Caspr + 旁节点染色面积与 NFH + 轴突染色面积的比率)。(C) OPC 分化的定量(CC1+ 少突胶质细胞与 Olig2+ 少突胶质细胞谱系细胞的比率)。(D) CC1/Olig2 染色的代表性图像。显示的值是平均值 + 标准差。P < 0.0001;未配对的 T 检验。比例尺:A = 25 μm,D = 50 μm。 请点击此处查看此图的较大版本。

图 3:显示 XAV939 促进髓鞘再生的代表性数据。(A) 显示溶血卵黄素处理的切片培养物中碎片化 MBP 染色的脱髓鞘和缺乏 Caspr 旁节点的图像。(B) 切片培养物免疫染色显示溶血卵磷脂诱导的脱髓鞘后,0.1 μM XAV939 处理后髓鞘再生 (MBP) 和旁节点 (Caspr) 增加。(C) 髓鞘形成指数的定量(Caspr + 旁节点染色面积与 NFH + 轴突染色面积的比率)。显示的值是平均值 + 标准差。P < 0.0001;未配对的 T 检验。比例尺 = 25 μm。 请单击此处查看此图的较大版本。
| 切片培养基 (SCM) | |
| 卷 | 试剂 |
| 100 毫升 | 最低必需培养基 (MEM)、HEPES、无谷氨酰胺 |
| 50 毫升 | 热灭活马血清 |
| 50 毫升 | 厄尔平衡盐溶液 |
| 2 毫升 | 青霉素-链霉素 10,000 U/mL |
| 2 毫升 | GlutaMAX 添加剂 |
| 2888 微升 | 45% 葡萄糖溶液 |
| 1 毫升 | Fungizone (真菌宗) |
| 通过 0.22 μm 过滤器进行无菌过滤,并在 4 °C 冰箱中储存长达 2 周。 | |
| 解剖培养基 (DM) | |
| 卷 | 试剂 |
| 100 毫升 | MEM、HEPES 和 Earle's 盐 |
| 1 毫升 | 青霉素-链霉素 10,000 U/mL |
| 通过 0.22 μm 过滤器进行无菌过滤,并在 4 °C 冰箱中储存长达 2 个月。 | |
| 溶血卵磷脂原液 (125 mg/mL) | |
| 量 | 试剂 |
| 100 毫克 | 溶血卵磷脂 |
| 0.8 毫升 | 无菌 PBS |
| 将 100 mg 溶卵磷脂溶于 0.8 mL 无菌 PBS 中。将 80 μL 等分试样的储备溶液储存在 -20 °C 下。 | |
| 使用前,解冻 80 μL 等分试样并溶解在 20 mL SCM(0.5% 溶卵磷脂的 SCM 溶液)中,在 37 °C、7.5% CO2 培养箱中加热。如果需要,涡旋以将溶血卵磷脂溶解到 SCM 中。 | |
表 1:制作切片培养基 (SCM)、解剖培养基 (DM) 和溶血卵磷脂溶液的成分和方案列表。
讨论
该协议描述了一种器官型小脑切片培养模型,该模型以体外模型的简单性概括了体内细胞组成。该协议可以进一步发展,成为更具代表性的人类病理模型。CSC 有可能开发为疾病特异性损伤的模型,例如外力诱导的组织损伤、髓鞘特异性抗体诱导的损伤或添加外周免疫细胞的 MS 少突胶质细胞损伤。该方案还可以针对从大脑和脊髓其他部分解剖的组织进行优化16,17。虽然该方案侧重于髓鞘形成的组织学定量,但 CSC 代表了检查各种实验终点的便捷模型。这些培养物可用于通过单细胞 RNA 测序表征不同的细胞类型,通过电子显微镜评估轴突和髓鞘的超微结构,并通过进行延时成像来研究 OPC 动力学。使用转基因小鼠报告基因系18,19 也可以绕过免疫染色。最后,可以使用不同年龄的小鼠幼崽、培养时间或切片厚度来适应 CSC 以模拟不同的疾病机制10、17、18、19、20、23。
切片培养物是检测和量化影响髓鞘形成和髓鞘再生的因素的理想选择,但在某些情况下它们在 CNS 的代表性方面受到限制。CSC 源自 P 0-2 大脑,来自发育早期的大脑,与衰老或神经退行性大脑的相似性有限。鉴于人们越来越意识到髓鞘在阿尔茨海默病21 和精神分裂症22 等 CNS 疾病中的重要性,需要量化和表征髓鞘形成的成人或衰老模型。已经发布了其他方案从老年啮齿动物中分离组织,尽管仍处于发育阶段10、18、19、23。此外,与脊髓和大脑中的其他白质束相比,小脑中的少突胶质细胞和 OPC 可能存在内在和外在差异。CSC 也不太适合用于大规模 CRISPR 或小分子筛选的基于细胞的体外系统。由于初始组织切片,还激活了驻留在脑中的先天免疫细胞(即小胶质细胞和星形胶质细胞),这是该系统的一个重要警告24。最后,外周免疫细胞在 MS 病理中起重要作用25;CSC 没有外周细胞,除非这些细胞是外源添加的,因此不是炎性 CNS 环境的理想模型。
该协议的解剖部分可能是最关键的。解剖步骤必须非常小心,以免损坏组织和底层结构。大脑沿组织切碎机刀片的正确对齐可确保对组织和细胞的损伤最小。此外,仔细解剖和分离切片,以及将其转移到膜上进行培养也很重要。本协议中概述的时间框架已针对所述研究进行了优化,但可能需要调整以在不同研究中获得最佳结果。该方案对于那些想要研究发育髓鞘形成和髓鞘修复的人很有用。
值得注意的是,MS 无法治愈。虽然目前的疗法在抑制适应性免疫系统方面非常有效,但目前没有任何疗法可以阻止进展。髓鞘再生失败和随后的神经变性被认为是 MS2 进展的基础。慢性 MS 病变中存在 OPCs 表明髓鞘修复失败可能是由于 OPC 分化停滞。CSC 的使用为髓鞘修复疗法开辟了一条发现途径,可能有助于逆转 MS 进展和恢复功能。髓鞘修复疗法还可以帮助脊髓损伤患者的恢复,其中脱髓鞘束会抑制运动功能26。因此,CSC 的意义在于,与体内动物模型相比,它适用于以相对高通量的方式识别影响哺乳动物脱髓鞘和髓鞘再生的因素。虽然许多研究使用初级 OPC 来筛选影响分化的化合物,但生成和分离初级 OPC 需要费力且连续的免疫淘选27。此外,基于细胞的测定并不能概括体内存在的细胞类型的多样性和相互作用。从小鼠幼崽生成 CSC 是一种快速且经济高效的模型,用于研究髓鞘形成和髓鞘再生,不需要昂贵的设备或耗材。因此,小脑切片培养物代表了一种宝贵的定量模型,用于体外概括髓鞘形成,并实现药物发现和基础科学研究。
披露声明
作者是罗氏集团成员 Genentech, Inc. 的员工。
致谢
作者感谢 Yun-An Shen、Roxanne Kyauk 和 Chris Bohlen 对本文的建设性评论和意见。此外,作者感谢 Charles ffrench-Constant、Andrew Jarjour、Veronique Miron 和 David Rowitch 在相关方法的早期开发中的贡献,这些方法之前发表过 11,12,13。
材料
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
参考文献
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71 (2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532 (2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679 (2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46 (2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835 (2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592 (2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22 (2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163 (2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131 (2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。