Method Article
Myélinisation et remyélinisation ex vivo dans des cultures de coupes cérébelleuses comme modèle quantitatif pour les manipulations développementales et pertinentes pour la maladie
Dans cet article
Résumé
Il s’agit d’un protocole pour un modèle quantitatif ex vivo de démyélinisation et de remyélinisation à l’aide de cultures de tranches cérébelleuses de souris. Cette méthode récapitule étroitement un modèle in vivo avec son ensemble complet de types de cellules du SNC dans des tissus intacts, tout en maintenant l’adaptabilité chimique, génétique et environnementale d’un système in vitro.
Résumé
L’étude de la myélinisation in vitro et in vivo pose de nombreux défis. La différenciation des cellules précurseurs d’oligodendrocytes (OPC) in vitro, bien que scalable, ne récapitule pas la myélinisation axonale. Les cocultures OPC-neurones et les cultures OPC-fibres permettent l’examen de la myélinisation in vitro, mais elles manquent de types cellulaires supplémentaires présents in vivo, tels que les astrocytes et les microglies. Les modèles murins in vivo, cependant, sont moins susceptibles d’être manipulés par des produits chimiques, environnementaux et génétiques et nécessitent beaucoup plus de main-d’œuvre. Ici, nous décrivons un système quantitatif de culture de tranches cérébelleuses (CSC) de souris ex vivo qui est utile pour : 1) étudier la myélinisation développementale, 2) modéliser la démyélinisation et la remyélinisation, et 3) mener des recherches translationnelles. Les sections sagittales du cervelet et du cerveau postérieur sont isolées chez des souris postnatales (P) 0 à 2, après quoi elles myélinisent ex vivo pendant 12 jours. Au cours de cette période, les tranches peuvent être manipulées de diverses manières, y compris l’ajout de composés pour tester un effet sur la myélinisation développementale. De plus, les tissus peuvent être fixés pour la microscopie électronique afin d’évaluer l’ultrastructure et le compactage de la myéline. Pour modéliser la maladie, le CSC peut être soumis à une hypoxie aiguë pour induire une hypomyélinisation. La démyélinisation de ces explants peut également être induite par la lysolécithine, ce qui permet d’identifier les facteurs favorisant la remyélinisation. Outre les modifications chimiques et environnementales, le CSC peut être isolé à partir de souris transgéniques et répond à la manipulation génétique induite par les adénovirus Ad-Cre et le tamoxifène. Ainsi, les cultures en tranches cérébelleuses sont un modèle rapide, reproductible et quantifiable pour récapituler la myélinisation.
Introduction
La myélinisation des axones permet la propagation rapide des potentiels d’action, un mécanisme connu sous le nom de conduction saltatoire1. L’importance de la myéline est soulignée par les maladies démyélinisantes, telles que la sclérose en plaques (SEP), qui comprennent un large éventail de manifestations débilitantes, notamment la perte de vision, les problèmes cognitifs et la paralysie. Il n’existe aucun remède contre la SP, et les traitements actuels visent à limiter la progression de la maladie en ciblant les cellules immunitaires périphériques. On pense que l’invalidité associée à la SP et aux maladies apparentées est due à un échec de la remyélinisation et à une neurodégénérescence progressive. En particulier, une démyélinisation, une atrophie et une perte axonale sont observées dans la SEPprogressive 2,3. Ainsi, favoriser la remyélinisation représente une stratégie prometteuse qui pourrait être menée en parallèle des traitements actuels et apporter des bénéfices thérapeutiques supplémentaires.
Dans le système nerveux central (SNC), la myélinisation est réalisée par des cellules gliales spécialisées appelées oligodendrocytes. Les cellules précurseurs des oligodendrocytes (OPC) se différencient en oligodendrocytes matures et myélinisants par une série d’étapes hautement orchestrées, notamment la croissance des processus qui entrent en contact avec les axones, l’augmentation de la complexité morphologique, l’expansion de la membrane de myéline et, enfin, le compactage de la gaine de myéline4. Ainsi, l’interaction entre les oligodendrocytes et les neurones est très intime. Des interactions réciproques entre les neurones et les oligodendrocytes sont également nécessaires à la santé et au maintien du SNC2. L’activité axonale joue un rôle dans la stimulation de la myélinisation et les facteurs neurotrophiques gliaux soutiennent l’intégrité des neurones. L’importance de la diaphonie gliale-glie dans le SNC est également de plus en plus reconnue 5,6,7,8. Par exemple, les facteurs astrocytaires peuvent influencer la différenciation des OPC et le maintien des faisceaux de substance blanche. Les microglies jouent également un rôle dans la modulation de la différenciation des OPC ainsi que dans l’élimination des débris de myéline, une étape importante du processus de remyélinisation. L’identification des facteurs autonomes cellulaires et la compréhension de l’influence d’autres types de cellules du SNC dans la démyélinisation et la remyélinisation seront inestimables pour le développement de thérapies pour les maladies démyélinisantes et dysmyélinisantes.
Ici, nous décrivons un système ex vivo utilisant des cultures de tranches cérébelleuses (CSC) de souris qui permet la manipulation et la quantification de tissu intact du SNC. L’utilisation de la CSC permet de mesurer la myélinisation, ou la remyélinisation après l’induction de la démyélinisation par la lysolécithine 9,10, à l’aide de méthodes traditionnellement utilisées pour les études in vivo, telles que l’immunocoloration et la microscopie électronique 11,12,13. La lysolécithine est un produit chimique perturbateur de la membrane qui entraîne une perte rapide de myéline et d’oligodendrocytes. Une mise en garde potentielle à noter est que la lysolécithine peut également entraîner la réduction d’autres types de cellules proches de la zone de la lésion. Cependant, contrairement aux expériences in vivo, les tranches sagittales du cervelet peuvent être facilement manipulées par l’ajout de composés ou génétiquement modifiées à l’aide d’adénovirus Ad-Cre. La méthode permet également de manipuler des tissus isolés de souris transgéniques ou de souris soumises à des agressions environnementales telles que l’hypoxie 11,12,13,14. Le modèle CSC permet ainsi l’étude de la myélinisation développementale, la modélisation de la maladie et l’identification des facteurs qui favorisent ou inhibent la myélinisation, tout en intégrant les contributions des différents types de cellules du SNC à la fonction des oligodendrocytes.
Protocole
Toutes les études sur les animaux ont été autorisées et approuvées par le comité institutionnel de protection et d’utilisation des animaux de Genentech.
1. Préparation des milieux et des fournitures pour la dissection (~30–45 min)
- Préparez et filtrez stérilement le milieu de culture en tranches (SCM) et le milieu de dissection (DM) comme indiqué dans le tableau 1. Conserver à 4 °C. Si des facteurs sont testés pour le test de myélinisation, ajoutez-les au SCM juste avant l’utilisation.
- Pipeter 1 mL de SCM dans chaque puits de plaque à 6 puits.
- À l’aide d’une pince stérile, placez un insert organotypique dans chaque puits, en veillant à ce qu’aucune bulle ne soit piégée sous la membrane. Réchauffer la plaque avec le milieu à 37 °C dans un incubateur à 7,5 % de CO2 .
2. Préparation de la zone de dissection (~5–10 min)
- Effectuez les procédures dans une hotte stérile à flux laminaire ou sur la paillasse avec des techniques aseptiques adéquates pour toutes les étapes de la procédure. Essuyez toutes les zones avec de l’éthanol à 70 %.
- Placez une nouvelle lame et un nouvel étage de coupe en silicone sur le hachoir à tissus. Pipetez ~300 μL d’eau stérile ou d’éthanol à 70 % sous l’étape de coupe pour vous assurer qu’elle reste en place.
- Utilisez un coton-tige pour essuyer délicatement la lame du hachoir à mouchoirs et l’étape de coupe avec de l’éthanol à 70 %. Sécher avant d’utiliser le hachoir à tissus.
- Vaporisez tous les outils de dissection avec de l’éthanol à 70 % et séchez-les avant la dissection.
- Préparez deux boîtes de Pétri de 10 cm : l’une avec 15 à 20 ml de MS, l’autre avec 10 ml de SCM. Conserver sur de la glace. Gardez tous les supports et boîtes de Pétri sur la glace lorsque vous ne disséquez pas.
3. Dissection de culture en tranches cérébelleuses (~15 à 20 min par chiot)
- Placez la boîte de Pétri avec DM sur un microscope à dissection.
- Euthanasier un bébé souris, jour postnatal P0-2, par décapitation rapide avec des ciseaux tranchants.
- Placez la tête dans la boîte de Pétri avec du DM sous le microscope de dissection pour éliminer le sang.
- À l’aide de ciseaux fins, coupez une fois sur chaque bord latéral à la base du crâne.
- Avec la tête placée à l’envers dans DM, appuyez fermement sur le dessous du crâne à l’aide d’une pince #5/45, forçant le cerveau postérieur non endommagé à travers le trou dans le crâne.
- Sous le microscope de dissection, coupez l’excès de tissu à l’aide de deux scalpels #11. Assurez-vous que le cervelet reste attaché au morceau sous-jacent du cerveau postérieur. Voir la figure 1A pour un schéma détaillé.
- À l’aide de la spatule, transférez le cervelet dans l’étape de coupe du hachoir à tissus, le tissu reposant sur la face rostrale du cerveau postérieur et la face caudale du cerveau postérieur face au chercheur. Assurez-vous que le plan médial du cerveau est exactement parallèle à la lame du hachoir à tissus.
- À l’aide de la pipette P200, retirez l’excès de fluide autour du tissu, en veillant à ce qu’il soit toujours humide mais pas flottant ou entouré de liquide.
- Remplacez la boîte de Pétri contenant le MS par la boîte de Pétri contenant le SCM sous le microscope de dissection.
- Coupez le tissu en tranches de 350 m d’épaisseur à l’aide du hachoir à tissus.
REMARQUE : La vitesse de la lame (par exemple, environ une coupe par seconde) et la force doivent être optimisées pour assurer des conditions de coupe optimales. Dans de rares cas, le tissu se coince dans la lame. Pour minimiser la perte de sections de tissus, gardez le pouce sur le bouton d’alimentation pour éteindre rapidement le hachoir à tissus si nécessaire. - Pipetez doucement 100 μL de SCM sous le tissu, de sorte que les tranches flottent. Transférez le tissu tranché à l’aide de la spatule dans la boîte de Pétri avec SCM sous un microscope à dissection.
- Utilisez un coton-tige pour essuyer délicatement la lame du hachoir à mouchoirs et l’étape de coupe avec de l’éthanol à 70 %.
- À l’aide des scalpels (côté émoussé), séparez délicatement les tranches sous le microscope à dissection. À l’aide d’un scalpel et d’une spatule, transférez les tranches sur la membrane dans la plaque à 6 puits avec SCM.
REMARQUE : Les sections les plus médiales auront souvent la meilleure myélinisation et l’intégrité des tissus. En moyenne, 4 à 6 tranches peuvent être disséquées à partir du cerveau d’une souris. - Incuber les tranches dans SCM à 37 °C dans 7,5 % CO2.
4. Changements de culture et de médias (~15–30 min)
- Remplacez le SCM tous les deux jours.
- Pipeter 1 mL de milieu frais dans chaque puits d’une nouvelle plaque à 6 puits et réchauffer dans un incubateur. À l’aide d’une pince stérile, transférez les membranes sur la nouvelle plaque, en vous assurant qu’il n’y a pas de bulles en dessous. Remettez les plaques dans l’incubateur.
5. Myélinisation et remyélinisation standard
- Protocole standard de myélinisation (Figure 1B).
- Coupes de culture disséquées dans la section 3 de 0 à 12 jours in vitro (DIV). Si l’effet d’un facteur sur la myélinisation est testé, ajoutez-le au milieu au moment de la culture (0 DIV) et reconstituez-le à chaque changement de milieu.
- Correction à 12 DIV (étape 7.1), un point temporel optimisé pour la myélinisation incomplète 11,12,13. Cela permet de détecter tout effet d’amélioration ou de blocage sur la myélinisation en raison du facteur ajouté au milieu. La figure 2 montre un résultat positif représentatif avec l’ajout de 100 ng/mL d’Activine A.
- Protocole de remyélinisation (Figure 1C)
- Suivre le protocole de myélinisation standard décrit à la section 5.1 sans facteurs supplémentaires jusqu’à 14 DIV, le moment où les tranches sont complètement myélinisées 11,12,13.
- Préparez une base de lysolécithine (125 mg/mL) comme indiqué dans le tableau 1. Pipeter 1 mL de lysolécithine à 0,5 % dans du SCM dans chaque puits d’une nouvelle plaque à 6 puits et réchauffer dans un incubateur.
- Transférez les membranes dans une plaque de lysolécithine et placez-les dans un incubateur pendant la nuit pendant 16 à 18 h.
- Le lendemain, préparez de nouvelles plaques avec du SCM frais, en ajoutant le(s) facteur(s) testé(s) pour les effets de remyélinisation si nécessaire. Des assiettes chaudes dans un incubateur.
- Pour le changement de média, tapotez doucement la membrane sur le côté du puits pour vous assurer que tout le milieu de lysolécithine est éliminé. Réapprovisionner le(s) facteur(s) testé(s) à chaque changement de milieu (section 4).
- Correction des tranches à 28 DIV (étape 7.1), un point temporel optimisé pour la remyélinisation incomplète. Cela permet de détecter l’amélioration ou le blocage de la remyélinisation en raison du facteur ajouté au milieu. Un résultat positif représentatif avec l’ajout de 0,1 μM XAV939 est présenté à la figure 3.
6. Variantes du protocole de myélinisation et de remyélinisation
- Protocole d’hypomyélinisation induite par l’hypoxie (Figure 1D)11,13.
REMARQUE : Il s’agit d’une variante du protocole standard de myélinisation présenté à la section 5.1.- Tranches de plaque en SCM sans facteurs.
- Transférer les plaques de tranches dans un incubateur hypoxique (2 % de FiO2) pendant 24 h entre 2 et 3 DIV.
- Le lendemain, préparez de nouvelles plaques avec du SCM frais, en ajoutant le(s) facteur(s) testé(s) pour le potentiel de myélinisation si nécessaire. Des assiettes chaudes dans un incubateur.
- Après une culture en hypoxie, changer de milieu (section 4) et remettre les cultures dans un incubateur de culture standard (37 °C, 7,5 % de CO2). Réapprovisionner tous les facteurs testés à chaque changement de milieu subséquent (section 4).
- Fixez à 12 DIV (étape 7.1).
- Protocole de manipulation génétique (Figure 1E)13
- Isolez du tissu de souris transgéniques pour la dissection comme dans la section 3.
- Avec des lignées de souris transgéniques inductibles, du tamoxifène (100 nM, une dose qui n’induit pas de myélinisation ou de différenciation OPC) ou un adénovirus Ad-Cre peut être ajouté à la SCM lors des changements de milieu effectués à 1 DIV et 3 DIV.
- Après la manipulation génétique avec du tamoxifène ou de l’adénovirus Ad-Cre, continuez les changements de milieu tous les deux jours comme dans la rubrique 4 (avec des facteurs ajoutés si nécessaire).
NOTES : Toutes les tranches d’une souris s’adapteront à une seule membrane, ce qui permet le génotypage après dissection, ce qui simplifie la réalisation d’expériences avec des souris transgéniques.
7. Traitement et analyse des tissus
- Fixez les tranches en immergeant doucement la membrane dans du paraformaldéhyde à 4 % pendant 1 h à température ambiante (RT).
- Rincer doucement en l’immergeant dans une solution saline tamponnée au phosphate (PBS). Ensuite, immergez-le dans du PBS dans une plaque à 6 puits.
REMARQUE : Le protocole peut être mis en pause ici. Les tranches fixes peuvent être stockées dans PBS à 4 °C pendant un mois au maximum. Si vous ne stockez pas les tranches, rincez 2 fois dans du PBS pendant 5 minutes avant de continuer. - À l’aide d’un scalpel, découpez la membrane de l’anneau et procédez à la coloration dans une plaque à 6 puits. Assurez-vous de garder les tranches vers le haut (côté membrane vers le bas) pour la coloration et le montage ultérieur sur les lames.
- Bloc pendant 1 h à RT dans une solution en bloc (sérum de cheval inactivé à la chaleur à 3 %, albumine sérique bovine à 2 % et Triton-X 100 à 0,25 % dilué dans du PBS).
REMARQUE : Si la récupération d’antigène est nécessaire pour la coloration des anticorps (par exemple, CC1/Olig2), cela peut être fait dans des boîtes de Pétri en verre. - Enveloppez les plaques dans un film de paraffine et incubez toute la nuit à 4 °C dans un anticorps primaire dilué dans une solution bloquante.
- Laver 3 fois dans une solution bloquante : 1) rinçage bref, 2) lavage 15 minutes et 3) lavage 1 h. Pour un rinçage bref, remplissez une petite boîte de Pétri de solution et immergez doucement la membrane à l’aide d’une pince avant de la transférer dans la solution fraîche. Pour les lavages plus longs (c.-à-d. 15 min et 1 h), immergez la membrane en solution dans une plaque à 6 puits et placez-la sur une bascule douce.
- Incuber à l’abri de la lumière pendant 2 h à RT dans des anticorps secondaires dilués 1:500 dans du PBS.
- Lavage 3 fois en PBS : 1) rinçage bref, 2) lavage 15 min et 3) lavage 1 h.
- Si une coloration DAPI est nécessaire, immergez-la dans une solution de DAPI 1:1 000 pendant 7 minutes à RT. Rincez brièvement, puis lavez pendant 15 minutes dans du PBS.
- Rincer à l’eau distillée deux fois.
- Montez les membranes sur une lame avec les tranches vers le haut (côté membrane vers le bas).
REMARQUE : Les tranches montées peuvent être stockées à 4 °C. Il est préférable de faire l’imagerie sur un microscope confocal dans un délai de 1 semaine, avant que la membrane ne devienne opaque et difficile à imager. - Imagez les coupes à l’aide de la microscopie confocale et quantifiez comme décrit précédemment 11,12,13.
Résultats
Des cultures de coupes cérébelleuses dérivées de souris P0-2 (figure 1A) ont été utilisées pour étudier la myélinisation et évaluer les effets de l’ajout de divers facteurs de DIV 0-12 (figure 1B). Pour étudier la remyélinisation, des cultures en tranches à 14 DIV ont d’abord été démyélinisées avec de la lysolécithine et laissées se remyéliniser pendant 14 jours supplémentaires en culture avec les facteurs testés (Figure 1C), après quoi la remyélinisation a été quantifiée. L’effet de l’hypoxie sur la myélinisation a également été étudié en plaçant des cultures en tranches dans un incubateur hypoxique FiO2 à 2 % pendant 24 h, à partir de 2 à 3 DIV (figure 1D). Enfin, des cultures de tranches dérivées de souris transgéniques ont été utilisées pour étudier l’effet des gènes knock-out sur la myélinisation. Dans ce système, la recombinaison Cre a été induite par l’ajout de tamoxifène ou d’adénovirus Ad-Cre à 1 DIV et 3 DIV, et de cultures de tranches fixées pour l’analyse à 12 DIV (Figure 1E). Après fixation des tissus, la quantification de la démyélinisation et de la remyélinisation a été réalisée par immunomarquage (Figure 2, Figure 3) et microscopie électronique 11,12,13.
Les données représentatives présentées (figure 2, figure 3) illustrent la plage dynamique de la myélinisation et de la remyélinisation dans les cultures en tranches. L’indice de myélinisation a été quantifié par le rapport entre Caspr, un marqueur paranodal qui est une lecture indirecte de la myéline compacte, et la protéine de neurofilament H (NFH), qui colore les axones. Cet indice de myélinisation a été validé pour représenter la formation de myéline compacte par microscopie électronique et coloration des canaux sodiques12. La démyélinisation induite par la lysolécithine 9,10 a conduit à la disparition complète des paranodes positifs à Caspr (indice de myélinisation = 0, Figure 3A) et à la perte de myéline compacte, qui a été restaurée lors de la remyélinisation11,12.
Pour démontrer un résultat positif sur la myélinisation, des tranches ont été cultivées avec de l’Activin A en suivant la chronologie de la figure 1B. L’activine A active les récepteurs de l’activine sur les oligodendrocytes et entraîne la différenciation des oligodendrocytes et la compaction de la myéline15. Les données représentatives montrent que le traitement des tranches avec 100 ng/mL d’Activin A pendant la myélinisation a entraîné un indice de myélinisation plus élevé (figures 2A, B). Dans le même ordre d’idées, le traitement par Activin A a accéléré la différenciation des OPC, comme le quantifie le rapport entre les oligodendrocytes matures CC1-positifs et les cellules de la lignée des oligodendrocytes Olig2+11,13 (Figures 2C,D).
Il a été démontré qu’une petite molécule inhibitrice de la Tankyrase, XAV939, favorise la myélinisation et la remyélinisation en stabilisant les niveaux d’Axin2 dans les oligodendrocytes11. Après un traitement à la lysolécithine, la démyélinisation a été visualisée et quantifiée dans des cultures de tranches par coloration fragmentée de la protéine de base de la myéline (MBP) et absence de paranœuds positifs à Caspr (figures 3A). Le traitement avec 0,1 μM XAV939 pendant la remyélinisation (15-28 DIV) a significativement augmenté l’indice de myélinisation par rapport aux témoins de véhicules, tel que quantifié par le rapport entre la coloration Caspr et NFH (figures 3B, C). Le modèle de culture en coupe peut donc être utilisé pour examiner et quantifier les effets sur la différenciation, la myélinisation et la remyélinisation des OPC dans les tissus intacts.
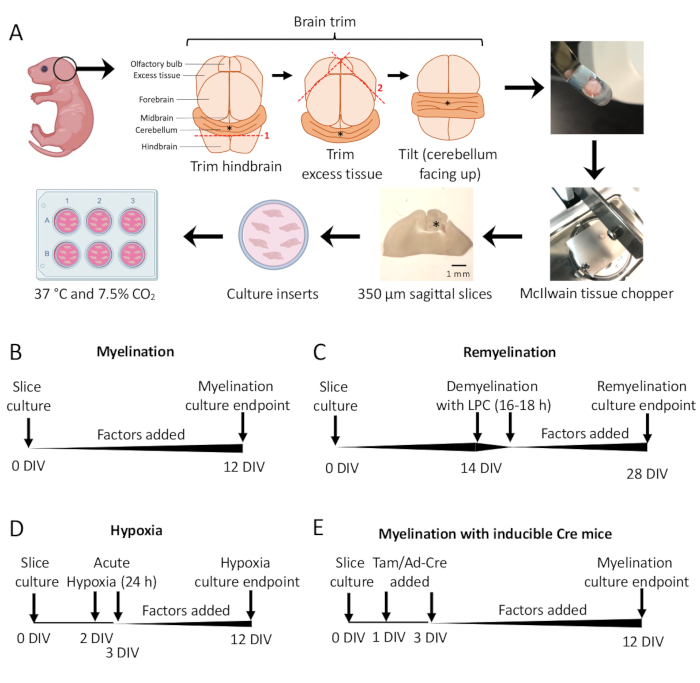
Figure 1 : Schéma des cultures de coupes cérébelleuses montrant les étapes clés du processus de dissection et les chronologies des différents protocoles de culture de tranches. (A) Représentation des étapes de génération de cultures de tranches : dissection du cerveau de petits souris P0-2, coupe du cerveau (comme illustré), coupe du cerveau avec un hachoir à tissus pour générer des coupes sagittales de 350 μm, placement des tranches sur des inserts de culture organotypique dans une boîte à 6 puits et incubation à 37 °C et 7,5 % de CO2. * désigne le cervelet. (B) Chronologie des cultures de tranches myélinisantes. Les cultures en tranches ont été incubées pendant 12 jours avant d’être fixées pour analyse. (C) Calendrier de remyélinisation des cultures en tranches. Les tranches ont été traitées avec de la lysolécithine à 14 DIV pendant 16 à 18 h pour induire une démyélinisation complète et laissées se remyéliniser jusqu’à 28 DIV avant d’être fixées pour analyse. (D) Chronologie de la myélinisation après une agression hypoxique. Les tranches ont été exposées à une agression hypoxique aiguë pendant 24 h entre 2 et 3 DIV, ce qui a provoqué une hypomyélinisation. (E) Chronologie du CSC à partir de souris génétiquement modifiées. Le tamoxifène (Tam, 100nM) ou le virus Ad-Cre a été ajouté à 1 DIV et 3 DIV pour induire une modification génétique, et des coupes ont été analysées à 12 DIV. Diagrammes chronologiques adaptés de publications précédentes11,13. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Données représentatives montrant que l’Activine A favorise la myélinisation et la différenciation des OPC. (A) Augmentation de la myélinisation (MBP) et des paranœuds (Caspr) avec un traitement à 100 ng/mL d’Activine A, mise en évidence par immunocoloration des cultures de coupes. (B) Quantification de l’indice de myélinisation (rapport entre la surface colorée pour les paranœuds Caspr+ et la surface colorée pour les axones NFH+). (C) Quantification de la différenciation des OPC (rapport entre les oligodendrocytes CC1+ et les cellules de la lignée des oligodendrocytes Olig2+). (D) Images représentatives de la coloration CC1/Olig2. Les valeurs indiquées sont la moyenne + l’écart-type. P < 0,0001 ; test T non apparié. Barres d’échelle : A = 25 μm, D = 50 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3 : Données représentatives montrant que le XAV939 favorise la remyélinisation. (A) Images montrant la démyélinisation par coloration fragmentée du MBP et l’absence de paranodes Caspr dans les cultures de tranches traitées avec de la lysolécithine. (B) Augmentation de la remyélinisation (MBP) et des paranœuds (Caspr) avec un traitement par XAV939 de 0,1 μM après démyélinisation induite par la lysolécithine mise en évidence par immunocoloration des cultures de coupes. (C) Quantification de l’indice de myélinisation (rapport entre la surface colorée pour les paranœuds Caspr+ et la surface colorée pour les axones NFH+). Les valeurs indiquées sont la moyenne + l’écart-type. P < 0,0001 ; test T non apparié. Barres d’échelle = 25 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Milieu de culture en tranches (SCM) | |
| Volume | Réactif |
| 100 ml | Média essentiel minimum (MEM), HEPES, sans glutamine |
| 50 ml | Sérum de cheval inactivé par la chaleur |
| 50 ml | La solution saline équilibrée d’Earle |
| 2 mL | Pénicilline-streptomycine 10 000 U/mL |
| 2 mL | Supplément GlutaMAX |
| 2888 μL | Solution de glucose à 45 % |
| 1 mL | Zone fongique |
| Filtrer stérilement à travers un filtre de 0,22 μm et conserver au réfrigérateur à 4 °C jusqu’à 2 semaines. | |
| Milieux de dissection (DM) | |
| Volume | Réactif |
| 100 ml | MEM, HEPES, avec sels d’Earle |
| 1 mL | Pénicilline-streptomycine 10 000 U/mL |
| Filtrer stérilement à travers un filtre de 0,22 μm et conserver au réfrigérateur à 4 °C jusqu’à 2 mois. | |
| Stock de lysolécithine (125 mg/mL) | |
| Quantité | Réactif |
| 100 mg | Lysolécithine |
| 0,8 mL | PBS stérile |
| Dissoudre 100 mg de lysolécithine dans 0,8 mL de PBS stérile. Conserver 80 μL d’aliquotes de solution mère à -20 °C. | |
| Avant utilisation, décongeler 80 μL d’aliquote et dissoudre dans 20 mL de SCM (0,5 % de lysolécithine dans la SCM), réchauffé dans un incubateur à 37 °C, 7,5 % de CO2. Si nécessaire, vortex pour dissoudre la lysolécithine dans la SCM. | |
Tableau 1 : Liste des composants et du protocole de fabrication d’un milieu de culture en tranches (SCM), d’un milieu de dissection (DM) et d’une solution de lysolécithine.
Discussion
Ce protocole décrit un modèle de culture de tranches cérébelleuses organotypiques qui récapitule la composition cellulaire in vivo avec la simplicité d’un modèle in vitro. Ce protocole pourrait être développé pour devenir un modèle plus représentatif des pathologies humaines. Le CSC peut potentiellement servir de modèle pour des lésions spécifiques à une maladie, comme les lésions tissulaires induites par la force, les lésions induites par des anticorps spécifiques de la myéline ou les lésions oligodendrocytaires dans la SEP avec l’ajout de cellules immunitaires périphériques. Ce protocole peut également être optimisé pour les tissus disséqués dans d’autres parties du cerveau et de la moelle épinière16,17. Bien que ce protocole se concentre sur la quantification histologique de la myélinisation, les CSC représentent un modèle pratique pour examiner divers paramètres expérimentaux. Ces cultures peuvent être utilisées pour caractériser différents types de cellules via le séquençage de l’ARN d’une seule cellule, évaluer l’ultrastructure des axones et des gaines de myéline par microscopie électronique et étudier la dynamique des OPC en effectuant une imagerie en accéléré. L’immunocoloration peut également être contournée avec l’utilisation de lignées déclarantes de souris transgéniques18,19. Enfin, différents âges de petits souris, le temps passé en culture ou l’épaisseur des sections peuvent être utilisés pour adapter le CSC afin de modéliser différents mécanismes de la maladie 10,17,18,19,20,23.
Les cultures en tranches sont idéales pour tester et quantifier les facteurs affectant la myélinisation et la remyélinisation, mais leur représentation du SNC est limitée dans certains contextes. Dérivées de cerveaux P 0-2, les CSC proviennent de cerveaux qui sont au début du développement et présentent des similitudes limitées avec un cerveau vieillissant ou neurodégénératif. Compte tenu de la prise de conscience croissante de l’importance de la myéline dans les troubles du SNC tels que la maladie d’Alzheimer21 et la schizophrénie22, des modèles adultes ou vieillissants de quantification et de caractérisation de la myélinisation sont nécessaires. D’autres protocoles ont été publiés pour isoler les tissus des rongeurs plus âgés, bien qu’encore aux stades de développement 10,18,19,23. De plus, il peut y avoir des différences intrinsèques et extrinsèques dans les oligodendrocytes et les OPC dans le cervelet par rapport à la moelle épinière et à d’autres faisceaux de substance blanche dans le cerveau. Les CSC sont également moins adaptés que les systèmes in vitro basés sur des cellules pour les cribles CRISPR à grande échelle ou les cribles de petites molécules. En raison du tranchage tissulaire initial, il y a également une activation des cellules immunitaires innées résidentes du cerveau (c’est-à-dire la microglie et les astrocytes), une mise en garde importante pour le système24. Enfin, les cellules immunitaires périphériques jouent un rôle important dans la pathologie de la SP25 ; Les CSC sont dépourvus de cellules périphériques à moins que ces cellules ne soient ajoutées de manière exogène, et ne sont donc pas un modèle idéal du milieu inflammatoire du SNC.
La partie dissection de ce protocole est peut-être la plus critique. Les étapes de dissection doivent être entreprises avec le plus grand soin, afin de ne pas endommager les tissus et la structure sous-jacente. Un bon alignement du cerveau le long de la lame du hachoir à tissus garantit des dommages minimaux aux tissus et aux cellules. De plus, la dissection et la séparation soigneuses des tranches, ainsi que leur transfert vers les membranes pour la culture sont importants. Les délais décrits dans ce protocole ont été optimisés pour la recherche décrite, mais il peut être nécessaire de les ajuster pour obtenir des résultats optimaux dans différentes études. Ce protocole sera utile pour ceux qui souhaitent étudier la myélinisation développementale et la réparation de la myéline.
Il convient de noter qu’il n’existe aucun remède contre la SEP. Bien que les thérapies actuelles soient très efficaces pour atténuer le système immunitaire adaptatif, aucune thérapie actuelle ne peut arrêter la progression. On pense qu’un échec de la remyélinisation et une neurodégénérescence subséquente sont à l’origine de la progression de la SEP2. La présence d’OPC dans les lésions chroniques de la SEP suggère que l’échec de la réparation de la myéline pourrait être dû à un arrêt de la différenciation des OPC. L’utilisation du CSC ouvre la voie à des traitements de réparation de la myéline qui pourraient aider à inverser la progression de la SP et à rétablir la fonction. La thérapie de réparation de la myéline peut également aider à la récupération chez les patients atteints de lésions de la moelle épinière, où les voies démyélinisées inhibent la fonction locomotrice26. Par conséquent, l’importance de la CSC réside dans sa capacité à identifier les facteurs qui affectent la démyélinisation et la remyélinisation des mammifères à un débit relativement élevé par rapport aux modèles animaux in vivo. Alors que de nombreuses études ont utilisé des OPC primaires pour le criblage de composés affectant la différenciation, la génération et l’isolement des OPC primaires nécessitent une immunopannage laborieuse et séquentielle27. De plus, les essais cellulaires ne récapitulent pas la diversité et l’interaction des types de cellules présentes in vivo. La génération de CSC à partir de bébés souris est un modèle rapide et rentable pour étudier la myélinisation et la remyélinisation qui ne nécessite pas d’équipement ou de consommables coûteux. Les cultures de tranches cérébelleuses représentent donc un modèle quantitatif inestimable pour récapituler la myélinisation ex vivo et permettent la découverte de médicaments et la recherche en sciences fondamentales.
Déclarations de divulgation
Les auteurs sont des employés de Genentech, Inc., membre du groupe Roche.
Remerciements
Les auteurs tiennent à remercier Yun-An Shen, Roxanne Kyauk et Chris Bohlen pour leurs commentaires constructifs et leurs contributions à cet article. De plus, les auteurs remercient Charles ffrench-Constant, Andrew Jarjour, Véronique Miron et David Rowitch pour leur contribution aux premiers développements de la méthodologie connexe publiée précédemment 11,12,13.
matériels
| Name | Company | Catalog Number | Comments |
| #5/45 Forceps | Fine Science Tools | 11251-35 | Dissection tools |
| 32% Paraformaldehyde | Electron Microscopy Sciences | 50-980-495 | Fixative for staining |
| 45% glucose solution | Sigma | G8769 | Slice culture media component |
| 6-well tissue culture plates | Corning | 3516 | Plates for cultures |
| Alexa Fluor Goat anti-chicken 647 | Thermo Fisher Scientific | A21449 | Secondary staining antibody |
| Alexa Fluor Goat anti-mouse 647 | Thermo Fisher Scientific | A21236 | Secondary staining antibody |
| Alexa Fluor Goat anti-rabbit 555 | Thermo Fisher Scientific | A11006 | Secondary staining antibody |
| Alexa Fluor Goat anti-rat 488 | Thermo Fisher Scientific | A21428 | Secondary staining antibody |
| Blades, Double-edge, PTFE coated Stainless steel | Ted Pella | 121-6 | Chopping blades |
| Bovine Serum Albumin (BSA) | Sigma | A9418 | Blocking solution component |
| Chicken anti-NFH antibody | Encor Biotech | CPCA-NF-H | Staining antibody |
| Confocal Microscope | Zeiss | LSM780 | Confocal for imaging |
| Corning 250 mL vacuum filter/storage bottle system, 0.22 µm pore | Corning | 431096 | For media preparation |
| Earl's balanced salt solution | Sigma | E2888 | Slice culture media component |
| Feather surgical blade | Feather | 2976#11 | Dissection tools |
| Fungizone | Thermo Fisher Scientific | 15290-18 | Dissection media component |
| GlutaMAX supplement | Thermo Fisher Scientific | 35050-061 | Slice culture media component |
| Heat-inactivated horse serum | Thermo Fisher Scientific | 26050-88 | Slice culture media component |
| Lysolecithin | Sigma | L4129 | |
| Lysophosphatidylcholine from egg yolk | Sigma | L4129 | To induce demyelination |
| McIlwain Tissue Chopper | Ted Pella | 10180 | Tissue chopper |
| MEM, Hepes, no glutamine | Thermo Fisher Scientific | 12360-038 | Slice culture media component |
| MEM, Hepes, with Earle's salts | Sigma | M7278 | Dissection media component |
| Metal spatula | Fisher Scientific | 470149-442 | Dissection tools - bend flat end at angle for use |
| Millicell Culture Plate Insert 30mm Organotypic PTFE | Fisher | PICM0RG50 | Culture insert |
| Mouse anti-CC1 antibody | Millipore | OP80-100UG | Staining antibody |
| Noyes spring scissors | Fine Science Tools | 15012-12 | Dissection tools |
| PBS pH 7.4 | Gibco | 10010023 | For dilution of fixative |
| Penicillin-streptomycin 10,000U/mL | Thermo Fisher Scientific | 15140-122 | Slice culture media component |
| Rabbit anti-Caspr antibody | Abcam | ab34151 | Staining antibody |
| Rabbit anti-Olig2 antibody | Millipore | AB9610 | Staining antibody |
| Rat anti-MBP antibody | Serotec | MCA409S | Staining antibody |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | Dissection tools |
| Silicone rubber foam sheet | MSC Industrial Direct Co | 31939176 | Cutting base |
| Stereo Microscope | Olympus Life Sciences | SZ61 | Microscope for dissection |
| Student surgical scissors | Fine Science Tools | 91401-12 | Dissection tools |
Références
- Purves, D., Augustine, G. J., Fitzpatrick, D. Increased Conduction Velocity as a Result of Myelination. Neuroscience 2nd edition. , Sunderland (MA): Sinauer Associates. (2001).
- Dutta, R., Trapp, B. D. Mechanisms of neuronal dysfunction and degeneration in multiple sclerosis. Progress in Neurobiology. 93 (1), 1-12 (2011).
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder? Annual Review of Neuroscience. 31, 247-269 (2008).
- Bradl, M., Lassmann, H. Oligodendrocytes: biology and pathology. Acta Neuropathologica. 119 (1), 37-53 (2010).
- Domingues, H. S., Portugal, C. C., Socodato, R., Relvas, J. B. Oligodendrocyte, Astrocyte, and Microglia Crosstalk in Myelin Development, Damage, and Repair. Frontiers in Cell and Developmental Biology. 4, 71(2016).
- Nave, K. A., Werner, H. B. Myelination of the nervous system: mechanisms and functions. Annual Review of Cell and Developmental Biology. 30, 503-533 (2014).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS myelin – from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18 (12), 753-769 (2017).
- Molina-Gonzalez, I., Miron, V. E. Astrocytes in myelination and remyelination. Neuroscience Letters. 713, 134532(2019).
- Keough, M. B., Jensen, S. K., Yong, V. W. Experimental demyelination and remyelination of murine spinal cord by focal injection of lysolecithin. Journal of Visualized Experiments. (97), e52679(2015).
- Birgbauer, E., Rao, T. S., Webb, M. Lysolecithin induces demyelination in vitro in a cerebellar slice culture system. Journal of Neuroscience Research. 78, 157-166 (2004).
- Fancy, S. P., et al. Axin2 as regulatory and therapeutic target in newborn brain injury and remyelination. Nature Neuroscience. 14 (8), 1009-1016 (2011).
- Yuen, T. J., et al. Identification of endothelin-2 as an inflammatory factor that promotes CNS remyelination. Brain. 136, 1035-1047 (2013).
- Yuen, T. J., et al. Oligodendrocyte-encoded HIF function couples postnatal myelination and white matter angiogenesis. Cell. 158 (2), 383-396 (2014).
- Stokes, C. E., Murphy, D., Paton, J. F., Kasparov, S. Dynamics of a transgene expression in acute rat brain slices transfected with adenoviral vectors. Experimental Physiology. 88, 459-466 (2003).
- Dillenburg, A., et al. Activin receptors regulate the oligodendrocyte lineage in health and disease. Acta Neuropathologica. 135 (6), 887-906 (2018).
- Dean, J. M., et al. An organotypic slice culture model of chronic white matter injury with maturation arrest of oligodendrocyte progenitors. Molecular Neurodegeneration. 6, 46(2011).
- Zhang, H., Jarjour, A. A., Boyd, A., Williams, A. Central nervous system remyelination in culture--a tool for multiple sclerosis research. Experimental Neurology. 230 (1), 138-148 (2011).
- Hill, R. A., Medved, J., Patel, K. D., Nishiyama, A. Organotypic slice cultures to study oligodendrocyte dynamics and myelination. Journal of Visualized Experiments. (90), e51835(2014).
- Sherafat, A., Hill, R. A., Nishiyama, A. Organotypic Slice Cultures to Study Oligodendrocyte Proliferation, Fate, and Myelination. Molecular Biology (Clifton, N.J.). 1791, 145-156 (2018).
- Croft, C. L., Noble, W. Preparation of organotypic brain slice cultures for the study of Alzheimer's disease. F1000Research. 7, 592(2018).
- Nasrabady, S. E., Rizvi, B., Goldman, J. E., Brickman, A. M. White matter changes in Alzheimer's disease: a focus on myelin and oligodendrocytes. Acta Neuropathologica Communications. 6 (1), 22(2019).
- Flynn, S. W., et al. Abnormalities of myelination in schizophrenia detected in vivo with MRI, and post-mortem with analysis of oligodendrocyte proteins. Molecular Psychiatry. 38, 811-820 (2003).
- Thetiot, M., Ronzano, R., Aigrot, M. S., Lubetzki, C., Desmazières, A. Preparation and Immunostaining of Myelinating Organotypic Cerebellar Slice Cultures. Journal of Visualized Experiments. (145), e59163(2019).
- Gerlach, J., Donkels, C., Münzner, G., Haas, C. A. Persistent Gliosis Interferes with Neurogenesis in Organotypic Hippocampal Slice Cultures. Frontiers in Cellular Neuroscience. 10, 131(2016).
- Reich, D. S., Lucchinette, C. F., Calabresi, P. A. Multiple Sclerosis. New England Journal of Medicine. 378 (2), 169-180 (2018).
- Jeffery, N. D., Blakemore, W. F. Locomotor deficits induced by experimental spinal cord demyelination are abolished by spontaneous remyelination. Brain. 120, 27-37 (1997).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harbor Protocols. , 854-868 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon