Method Article
Studio randomizzato, in triplo cieco e controllato in parallelo sulla stimolazione transcranica a corrente continua per la riabilitazione cognitiva dopo l'ictus
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio presenta un nuovo protocollo di stimolazione transcranica a corrente continua (tDCS) combinato con la stimolazione cognitiva per affrontare la negligenza emispaziale post-ictus. I dati iniziali di un paziente pilota garantiscono la fattibilità della procedura e suggeriscono una potenziale efficacia, fornendo una base per un futuro studio clinico parallelo, in triplo cieco e controllato.
Abstract
L'ictus dell'emisfero destro provoca frequentemente negligenza emispaziale, una condizione invalidante che può ostacolare significativamente il processo di recupero. La presenza cronica di neglect è stata collegata a risultati peggiori sia in ambito cognitivo che motorio. In aggiunta agli interventi neuropsicologici convenzionali, la stimolazione transcranica a corrente continua (tDCS), una tecnica non invasiva che modula l'eccitabilità neurale attraverso correnti elettriche a bassa intensità, ha attirato l'attenzione per il suo potenziale di migliorare la plasticità corticale e supportare il miglioramento funzionale negli individui affetti.
In questo studio, proponiamo un protocollo di intervento combinato volto a ridurre i sintomi della negligenza emispaziale post-ictus. Consiste in un protocollo tDCS catodico combinato con un programma di riabilitazione neuropsicologica computerizzata specificamente progettato per la riabilitazione della negligenza emispaziale.
La strategia di neuromodulazione consiste nel ridurre l'iperattivazione dell'emisfero non danneggiato sulla base del modello di rivalità interemisferica. L'intervento consiste in 2 settimane, 10 sessioni (dal lunedì al venerdì), di 45 minuti ciascuna, di tDCS e stimolazione cognitiva convenzionale applicate contemporaneamente. La tDCS viene applicata da un dispositivo tDCS ad alta definizione a 8 canali (HD-tDCS) per 20 minuti e a 2 mA di intensità. Il catodo è posizionato sopra la corteccia parietale posteriore sinistra (P3 seguendo il sistema 10/20 per il posizionamento degli elettrodi dell'elettroencefalogramma [EEG]) e gli elettrodi di ritorno sono posizionati a C3, CP5, CP1, Pz, PO3, PO7 e P7. Una valutazione neuropsicologica e funzionale è stata effettuata al basale e dopo la fine dell'intervento.
L'obiettivo principale del presente studio è quello di descrivere il protocollo per un disegno sperimentale parallelo, randomizzato, in triplo cieco. Per garantire la fattibilità del protocollo e la sua potenziale efficacia, viene fornita una descrizione completa delle procedure applicate a un singolo partecipante pilota.
L'integrazione di strategie di neuromodulazione della tDCS nei processi di riabilitazione cognitiva può portare a tempi di intervento ridotti e migliorare lo stato funzionale e la qualità della vita dei pazienti.
Introduzione
L'ictus è la causa più comune di disabilità negli adulti e la seconda causa di morte dopo la cardiopatia ischemica1. La maggior parte dei pazienti sopravvissuti a un ictus sviluppa condizioni cliniche molto eterogenee e diversi gradi di disabilità. Tra il 55% e il 75% dei pazienti con ictus presenta limitazioni motorie che persistono 6 mesi dopo l'infortunio2. Oltre alle conseguenze fisiche, le alterazioni cognitive sono molto frequenti3. Questi deficit influiscono negativamente sullo svolgimento delle attività della vita quotidiana, limitando l'indipendenza funzionale e la qualità della vita dei pazienti e dei parenti 4,5. La negligenza emispaziale è tra le menomazioni attentive più comuni a seguito di un ictus, si verifica in circa il 25-50% dei casi 6,7,8 e sale fino all'80% negli individui con ictus dell'emisfero destro 9,10.
La negligenza emispaziale implica una difficoltà nel frequentare l'emicampo controlaterale all'area lesa, essendo questa disattenzione allocentrica (omettendo oggetti situati nella metà sinistra dello spazio) o egocentrica (il paziente non si occupa delle parti sinistre del proprio corpo). Dal punto di vista funzionale, la negligenza genera gravi difficoltà nell'indipendenza del paziente, sia nelle attività di base (ad esempio, la toelettatura, l'abbigliamento, l'alimentazione, ecc.) che nelle attività strumentali della vita quotidiana (ad esempio, la gestione del denaro, il trasporto pubblico o la deambulazione indipendente). Inoltre, la presenza di questa alterazione è stata associata a tempi di ospedalizzazione e riabilitazione più lunghi, a un maggior rischio di cadute, a uno scarso recupero motorio e a una minore probabilità di rientro a casa dopo la dimissione dall'ospedale11,12.
Sono state implementate diverse strategie per trattare la negligenza emispaziale. All'interno degli approcci riabilitativi tradizionali, possiamo distinguere gli approcci top-down e bottom-up. La principale differenza tra loro è il livello di partecipazione attiva e consapevolezza della persona nei compiti. All'interno di questi approcci, le procedure più utilizzate fino ad oggi sono state rispettivamente l'addestramento alla scansione visiva e l'adattamento prismatico13. Altre tecniche riabilitative nel neglect emispaziale con ampio uso della localizzazione centrale, stimolazione optocinetica, calorica e vestibolare, vibrazione del collo e trattamenti farmacologici 13,14,15,16. Tuttavia, questi trattamenti hanno alcune limitazioni: la durata dei loro risultati è molto limitata, e hanno una bassa applicabilità nelle fasi acute o subacute perché la gravità dei pazienti in queste fasi interferisce con la loro collaborazione nelle attività da svolgere17.
La stimolazione transcranica a corrente continua (tDCS) è una tecnica di neuromodulazione sicura non invasiva in grado di modificare l'attività corticale inducendo una debole corrente elettrica nel cervello che modifica l'attività corticale e può essere utilizzata per integrare la riabilitazione neuropsicologica per la negligenza emispaziale. La tDCS modula l'attivazione neuronale spontanea in risposta agli input provenienti da altre aree cerebrali. Inoltre, la tDCS induce cambiamenti sinaptici plastici che assomigliano al potenziamento a lungo termine (LTP) o alla depressione a lungo termine (LTD) e durano anche oltre la durata della stimolazione18.
Per mezzo della tDCS, l'attività corticale può essere modulata applicando una corrente elettrica a bassissima intensità che scorre dall'anodo al catodo. La tDCS modula l'attività cerebrale influenzando la soglia del potenziale d'azione, aumentandola o diminuendola, ma senza causare potenziali d'azione18. In generale, l'anodo induce un aumento dell'eccitabilità della regione cerebrale su cui si trova, mentre il catodo induce l'inibizione corticale. Questa tecnica non ha un'alta risoluzione spaziale, ma questa limitazione è stata superata dalla comparsa di nuovi dispositivi tDCS chiamati multisito o ad alta definizione (HD-tDCS). Questi dispositivi consentono diverse configurazioni di elettrodi, come la formazione di un anello catodico attorno all'anodo (o viceversa) al fine di aumentare o diminuire l'eccitabilità corticale in una specifica area del cervello. L'anello catodico agisce in modo simile agli elettrodi di ritorno, limitando l'area di stimolazione; In questo modo si ottiene una stimolazione più focale. La tDCS si è dimostrata efficace come approccio terapeutico per il recupero motorio dopo l'ictus19 e c'è una certa letteratura scientifica con risultati promettenti nella riabilitazione della negligenza emispaziale20.
L'ipotesi più accettata della negligenza emispaziale sostiene che potrebbe essere spiegata sulla base del modello di rivalità emisferica, proposto da Kinsbourne nel 197721,22. Secondo questo approccio, nello stato basale, entrambi gli emisferi si inibiscono costantemente a vicenda in modo reciproco; La negligenza emispaziale è causata da uno squilibrio tra di loro. Dopo un infortunio, l'emisfero danneggiato non è in grado di inibire efficacemente l'attività dell'emisfero preservato. Ciò si traduce in un'iperattività patologica dell'emisfero sano a causa dell'assenza di inibizione esercitata da quello danneggiato, che riduce, ancora di più, l'attività neurale dell'emisfero interessato a causa dell'aumentata inibizione esercitata su di esso23. Pertanto, la disfunzione che sta alla base della negligenza emispaziale è causata sia dall'ipoattività dell'emisfero danneggiato che dall'iperattività di quello integro24.
Con questo modello come base teorica, vengono proposte diverse strategie di stimolazione cerebrale non invasiva volte a migliorare i sintomi della negligenza emispaziale. Queste strategie sono indirizzate a diminuire l'iperattività dell'emisfero sano, aumentare l'attività dell'emisfero danneggiato o una combinazione di entrambi25,26.
Diversi studi hanno dimostrato il potenziale della tDCS nel ridurre la sintomatologia della negligenza emispaziale applicando sia la tDCS anodica 17,27,28,29 che la tDCS catodica 17,29 nell'emisfero danneggiato o non danneggiato, rispettivamente, o una combinazione di entrambi 28,30,31,32. Nonostante i risultati promettenti, sono necessarie ulteriori prove empiriche per conoscere i parametri esatti della tDCS per ottenere risultati ottimali, il che è essenziale per sapere se la tDCS focale è più efficace dei montaggi tDCS convenzionali. Per quanto ne sappiamo, tutte le ricerche precedenti sono state sviluppate utilizzando la tDCS convenzionale, e il presente studio è stato il primo ad utilizzare la HD-tDCS per la riabilitazione da negligenza emispaziale.
Gli interventi basati sulla stimolazione cerebrale non invasiva costituiscono un approccio clinico molto promettente dati i risultati aggiornati e gli effetti avversi limitati secondo diverse meta-analisi e revisioni 33,34,35,36,37. Inoltre, la tDCS è una tecnica altamente sicura, portatile e a basso costo, motivo per cui il suo uso è aumentato come priorità in ambito clinico e di ricerca. Inoltre, la sua facilità di montaggio e portabilità consentono di utilizzare il dispositivo contemporaneamente allo svolgimento di qualsiasi altra attività, come la riabilitazione fisica, cognitiva o funzionale. Pertanto, sono garantiti studi più controllati, in cieco e randomizzati con campioni di dimensioni maggiori per convalidare i protocolli tDCS che migliorano gli effetti degli approcci di intervento convenzionali.
Protocollo
Questo progetto è stato approvato dal Comitato Etico di Ricerca Clinica dell'Ospedale 12 de Octubre (rif. Nº CEIm: 19/180), ed è registrato presso www.clinicaltrials.gov (ID: NCT04458974). I ricercatori si impegnano a rispettare tutta la legislazione vigente in materia di ricerca clinica e protezione dei dati (Dichiarazione di Helsinki dell'AMM, 2004; il regolamento (UE) 2016/679 e la legge organica 3/2018 sulla protezione dei dati personali; Legge 41/2002 sull'autonomia del paziente). Ai sensi del Regolamento (UE) 2016/679 sulla protezione dei dati personali, tutti i dati raccolti presso i partecipanti saranno trattati con la massima riservatezza. Il protocollo tDCS segue le linee guida internazionali sulla sicurezza per la tDCS38.
NOTA: L'obiettivo principale del presente studio è quello di descrivere un protocollo di intervento tDCS per uno studio clinico parallelo, randomizzato, in triplo cieco. A tal fine, viene fornita una descrizione completa delle procedure e in questo documento vengono illustrati i risultati di una domanda di partecipazione pilota. Il protocollo di intervento consiste in un programma di 10 sessioni che combina la tDCS catodica (20 min, 2 mA) con un programma di riabilitazione neuropsicologica computerizzata progettato per migliorare la negligenza emispaziale. Le valutazioni neuropsicologiche e funzionali vengono eseguite al basale e dopo la fine dell'intervento. La Figura 1 mostra la sequenza temporale del protocollo. La figura mostra la valutazione di base, la descrizione dettagliata dell'intervento e la valutazione post-intervento dello studio. La partecipazione dei pazienti è stata volontaria dopo essere stati informati sullo scopo dello studio e aver firmato un modulo di consenso informato scritto. Il partecipante può ritirarsi dallo studio in qualsiasi momento. Il partecipante a questo studio soddisfa tutti i criteri di inclusione ed esclusione delineati nella Tabella 1.
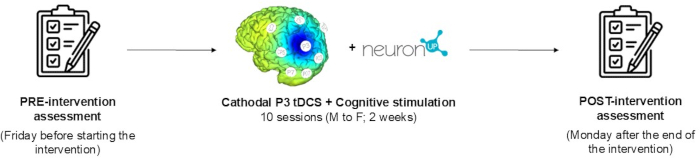
Figura 1: Sequenza temporale del protocollo. Vengono descritte tutte le fasi dello studio: valutazione di base, descrizione dettagliata dell'intervento e valutazione post-intervento. Clicca qui per visualizzare una versione più grande di questa figura.
1. Criteri di inclusione ed esclusione
- Assicurarsi che il partecipante pilota a questo studio soddisfi i seguenti criteri di inclusione ed esclusione (Tabella 1).
| Criteri di inclusione: |
| Ictus emorragico o ischemico nell'emisfero destro |
| Ictus da 3 a 12 mesi dopo l'evento (indipendentemente dal fatto che abbiano ricevuto o meno una precedente riabilitazione) |
| Dai 18 agli 89 anni |
| Studio di neuroimaging |
| Assenza di colpi precedenti |
| Capacità funzionale che consente al paziente di rimanere seduto e attivo per un'ora (punteggio dell'indice di Barthel superiore a 5 nella voce dei trasferimenti tra poltrona e letto; questa voce può essere valutata da 0 a 15, essendo 0 totalmente dipendente e 15 totalmente indipendente). |
| Dominanza manuale con la mano destra |
| Punteggi di neglect in almeno due dei test somministrati per la valutazione della neglect visuospaziale |
| Firma del consenso informato da parte del paziente o del suo tutore legale |
| Criteri di esclusione: |
| Problemi dermatologici (psoriasi, dermatiti sul cuoio capelluto o sul viso) |
| Presenza di protesi o parti metalliche nella testa, escluse le otturazioni. |
| Pacemaker, pompe per farmaci, stimolatori (vagali, cerebrali, transcutanei), shunt ventricoloperitoneali o clip per aneurisma. |
| Presenza di tratti precedenti |
| Malattia neurologica diversa dall'ictus descritta nei criteri di inclusione |
| Grave deterioramento cognitivo valutato utilizzando il Mini-mental state examination (MMSE) (Folstein, 1975), escludendo i pazienti con punteggi inferiori a 24 (i punteggi di MMSE sono compresi tra 0 e 30, essendo 0 grave deterioramento cognitivo e 30 nessun deterioramento cognitivo) |
| Notevoli difficoltà linguistiche che non consentono una corretta comprensione delle attività o limitano fortemente l'espressione |
| Storia di abuso di alcol o droghe |
| Depressione attiva moderata o grave |
| Problemi medici incontrollati (patologie in fase acuta senza trattamento medico o farmacologico di provata efficacia o patologie con imminente rischio di vita) |
| Gravidanza o sospetta gravidanza che sarà verificata mediante test di gravidanza all'inizio dello studio in pazienti in età fertile e con la raccomandazione dell'uso di metodi contraccettivi fino alla fine dell'intervento |
Tabella 1: Criteri di inclusione ed esclusione. Il partecipante pilota di questo studio soddisfa tutti i criteri di inclusione ed esclusione descritti in questa tabella.
2. Materiali
NOTA: Tutti i materiali utilizzati in tutte le fasi dello studio sono meticolosamente descritti.
- Kit dispositivo tDCS
- Per l'applicazione della tDCS, utilizzare un dispositivo HD-tDCS a 8 canali e i relativi elettrodi consigliati (vedere la Figura 2). Per facilitare il montaggio, posizionare una base di plastica nella posizione desiderata sulla calotta in neoprene (seguendo il sistema EEG 10/20). Una volta posizionato, applicare il gel conduttivo e successivamente assemblare l'elettrodo.
- Piattaforma computerizzata di neuroriabilitazione
NOTA: Per effettuare la stimolazione cognitiva viene utilizzata una piattaforma di neuroriabilitazione computerizzata online (vedi Figura 3). La piattaforma consente la progettazione e l'applicazione di ogni sessione del programma di intervento, adattando individualmente la difficoltà dei compiti.- Crea un nuovo utente per ogni paziente cliccando su gestione utenti e aggiungendo un nuovo utente. Nomina utilizzando un codice di studio per personalizzare individualmente il programma cognitivo.
- Per progettare le attività, accedi all'area di lavoro/sessioni/sessioni digitali e clicca sulla data in cui si svolgerà la sessione.
- Inserire il nome della sessione, ad esempio sessione 1. Seleziona un'icona e un colore per quella sessione e fai clic sul pulsante Crea .
- Clicca sulle attività da includere nel programma.
- Verifica che le attività per ogni sessione vengano visualizzate sul lato sinistro dello schermo.
- In ciascuno di essi, programmare i seguenti parametri: Tempo (7 min) e iniziare dall'ultimo risultato (indicare SI solo nelle sessioni 3-10).
- Indicare per salvare.
- Ripetere i passaggi 2.2.3-2.2.7 per la progettazione di ciascuna delle 10 sessioni del programma di stimolazione cognitiva.

Figura 2: kit dispositivo tDCS. (1) Cappuccio in neoprene, (2) dispositivo tDCS, (3) Elettrodi, (4) Cavi, (5) Clip per l'orecchio, (6) Gel conduttore; (7) Siringa per somministrare il gel conduttivo sotto gli elettrodi. Clicca qui per visualizzare una versione più grande di questa figura.
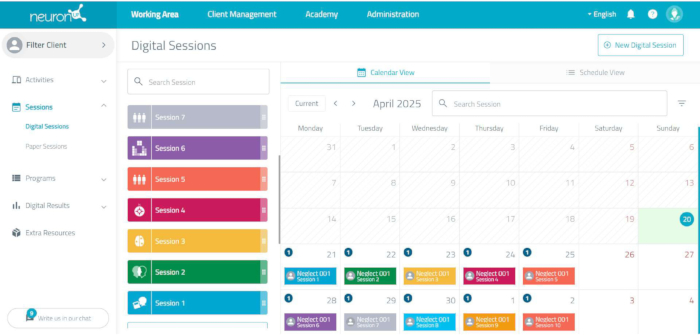
Figura 3: La programmazione delle sessioni della piattaforma di neuroriabilitazione. Facendo clic su ciascuna sessione, vengono visualizzate le attività, inclusa la durata di ciascuna attività e la durata totale della sessione. Clicca qui per visualizzare una versione più grande di questa figura.
3. Descrizione del protocollo di valutazione: Valutazione neuropsicologica e funzionale pre-intervento:
NOTA: Una volta che il partecipante ha firmato il consenso informato, viene condotta una valutazione neuropsicologica e funzionale. La valutazione avviene il venerdì prima dell'inizio del programma di stimolazione e dura 50 minuti. Durante questa sessione vengono valutate le prestazioni cognitive generali e somministrati test neuropsicologici incentrati sulla valutazione dei processi attentivi e della negligenza emispaziale, insieme a scale funzionali. In una sessione informativa prima della prima valutazione, al partecipante vengono forniti tutti i dettagli necessari sull'obiettivo dello studio, la procedura, la durata della sessione e i potenziali effetti avversi. Il consenso firmato viene ottenuto prima di procedere con la valutazione e l'intervento. Il partecipante è inoltre informato della possibilità di ritirarsi dallo studio in qualsiasi momento.
- Somministrazione di mini esame dello stato mentale (MMSE) (5 min)
NOTA: Una scala strutturata semplice. Ottiene un punteggio massimo di 30 punti e gli elementi sono raggruppati in 5 sezioni che valutano l'orientamento, la memoria immediata, l'attenzione e il calcolo, la memoria differita, il linguaggio e la costruzione. I punteggi vanno da 0 a 30 punti, con il punto limite a 24; I punteggi inferiori a 24 indicano un deterioramento cognitivo.- Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test. Controlla che il punteggio totale sia di ≥24 punti per continuare.
- Somministrazione del test di bisezione in linea (5 min)
NOTA: Diciotto righe sono presentate in un foglio formato A4 organizzato in 3 serie da 6: una serie situata principalmente a sinistra del foglio, una al centro del foglio e una principalmente a destra del foglio. Ai pazienti viene chiesto di segnare i punti centrali di ogni linea. La deviazione del segno del paziente dal vero centro della linea viene misurata per ciascuna linea e mediata per le 18 linee.- Posiziona l'attività centrata davanti al partecipante, indicando sul foglio i lati destro e sinistro del partecipante. Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Somministrazione del test delle campane (5 min)
NOTA: Strumento finalizzato alla valutazione della scansione visiva orizzontale in presenza di distrattori. Il compito consisteva nell'identificare figure a forma di campana disposte in modo semi-casuale. Questi erano esposti in sette colonne verticali, ciascuna contenente cinque campane. Per quanto riguarda il loro posizionamento sul foglio, apparivano tre colonne a sinistra, una al centro e tre a destra.- Posiziona l'attività centrata davanti al partecipante, indicando sul foglio i lati destro e sinistro del partecipante. Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Sottotest di disegno di immagini dalla somministrazione del test di Barcellona (5 min)
NOTA: Si compone di una copia di 6 figure: cerchio, quadrato, triangolo, croce, cubo e casa. Il tempo di esecuzione è controllato. Ogni cifra è valutata come segue: 3 punti per la riproduzione perfetta, 2 punti per l'alterazione discreta, 1 punto per l'alterazione moderata, 0 punti per l'alterazione grave. Il punteggio massimo è 18. Viene ricompensato con 3, 2 o 1 punto, a seconda del tempo trascorso nell'esecuzione.- Posiziona l'attività centrata di fronte al partecipante, puntando il puntatore del mouse sulle immagini visualizzate. Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Annullamento dei sottotest dalla somministrazione dei test di Barcellona (5 min)
- Posiziona l'attività centrata davanti al partecipante, indicando sul foglio i lati destro e sinistro del partecipante. Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Digit span amministrazione avanti e indietro (5 min).
- Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Gestisci prima l'attività di cifra diretta. In secondo luogo, amministra l'attività successiva delle cifre inverse.
- Somministrazione di un breve test di attenzione (BTA) (5 min)
- Somministrare verbalmente la prima parte del compito (contare i numeri che compaiono nella sequenza). Subito dopo, applica la seconda parte del test (conta le lettere che compaiono nella sequenza)
- Non consentire l'uso di note o il conteggio con le dita.
- Somministrazione del test facciale (5 min)
- Presentare il foglio di prova facciale. Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Attiva il cronometro e termina l'attività dopo 3 min. Conta il numero di stimoli contrassegnati correttamente.
- Somministrazione del test di percezione visiva senza motore (MVPT-4) (15 min)
NOTA: Il test a scelta multipla a 36 elementi valuta 5 sottodimensioni della negligenza visuospaziale: discriminazione visiva, discriminazione figura-fondo, relazione spaziale, chiusura visiva e memoria visiva. Diversi parametri vengono utilizzati per quantificare il comportamento della risposta sinistra (comportamento della risposta sinistra/destra, punteggio lordo, prestazioni sinistra/destra e tempo di elaborazione della percezione visiva). I punteggi per le risposte del lato sinistro vanno da 0 a 21, con valori più bassi che indicano una negligenza visuospaziale più grave.- Posizionare il quaderno dei compiti davanti al paziente. Spiegare il test al partecipante e chiedere al partecipante di seguire le istruzioni del test.
- Bilance funzionali
NOTA: Condurre interviste al paziente e ai familiari/caregiver per conoscere lo stato funzionale del paziente e l'impatto della negligenza sulle attività della vita quotidiana.- Somministrare la scala dell'indice di Barthel (5 minuti) al familiare o al caregiver primario e registrare le risposte sul foglio delle risposte.
NOTA: L'indice di Barthel misura la capacità di una persona di svolgere dieci attività fondamentali della vita quotidiana, ottenendo una stima quantitativa del suo grado di indipendenza. - Somministrare la scala Catherine Bergego (CBS) (5 min) al familiare o al caregiver primario e registrare le risposte sul foglio delle risposte.
NOTA: Questo questionario si basa sull'osservazione diretta delle prestazioni del paziente in 10 situazioni di vita reale clinicamente simulate, tra cui attività come la toelettatura, la vestizione e l'uso della sedia a rotelle. La valutazione del paziente viene confrontata con quella di un familiare/caregiver primario. Questo questionario produce un punteggio compreso tra 0 e 30, dove punteggi più alti riflettono una maggiore gravità della negligenza visuospaziale. .
- Somministrare la scala dell'indice di Barthel (5 minuti) al familiare o al caregiver primario e registrare le risposte sul foglio delle risposte.
4. Descrizione del protocollo di intervento
- Configurazione del dispositivo di intervento
NOTA: Impostare i parametri della stimolazione HD-tDCS nel software. Giorni prima dell'inizio dell'intervento, il dispositivo deve essere programmato con i parametri da applicare nell'intervento, ovvero durata, intensità, polarità, condizione (attivo vs. fittizio), montaggio, tipo di elettrodi, sito di stimolazione, posizioni degli elettrodi restituiti e percentuale di ritorno elettrico a ciascuno di essi (vedi punto 5). Verificare che il dispositivo abbia una batteria sufficiente per completare l'intera sessione.- Aprire il software, selezionare Editor protocollo, quindi aggiungere un nuovo protocollo.
- Immettere il nome del protocollo. Imposta la durata della rampa: Passi: (a sinistra).
- Confermare la rampa e il tempo totale di stimolazione. Indicare Ramp-Up: 30 e Ramp-Down: 30.
- Nella sezione della durata totale della stimolazione, indicare 20 min. Impostare le impostazioni di stimolazione e dell'elettrodo: Design (a destra).
- Impostare la polarità della stimolazione nel catodale. Impostare ogni elettrodo in modo indipendente. Iniziare con l'elettrodo attivo, P3.
- Seleziona l'elettrodo P3 e trascinalo sulla casella a destra. Selezionare la stimolazione e il catodale. Selezionare 2000 μA.
- Seleziona e trascina verso sinistra, distanzia il resto degli elettrodi uno per uno. In questi casi, sono tutti elettrodi di ritorno e fanno la stessa azione, indicando la percentuale di ritorno in ogni elettrodo.
NOTA: È importante notare che la somma della percentuale di reso deve essere pari a 100. In questo studio, le percentuali di rendimento erano CP1, PO3, PO7, P7, CP5, C3: 10% e PZ: 40% (vedi Figura 4 e Figura 5). Questo montaggio è progettato per ridurre l'iperattivazione patologica della corteccia parietale posteriore nell'emisfero controlaterale alla lesione. - Fare clic sul pulsante Fine una volta completati tutti i passaggi.
- Valutazione pre-intervento del paziente
- Valutazione generale dello stato.
- Prima e dopo ogni sessione di tDCS, valuta le condizioni generali ponendo le seguenti domande: Ti senti bene? Hai mal di testa? Hai dolore al collo? Hai bevuto alcolici ieri o oggi? Hai fatto uso di droghe ieri o oggi? Hai consumato caffè, tè o cioccolata nelle ultime 5 ore? Hai dormito bene la scorsa notte? Quando è stata l'ultima volta che hai mangiato in poche ore?
- Valuta le scale analogiche visive (VAS) per la stanchezza e l'umore.
- Valuta il livello di affaticamento mentale e l'umore utilizzando due VAS autosomministrati. In risposta a queste domande, chiedi al partecipante di fornire un punteggio compreso tra 1 e 10, riferendosi a come si sente riguardo alle domande: Quanto sei stanco in questo momento?, dove 1 significa per niente stanco, 10 significa molto stanco e Com'è il tuo umore in questo momento?, dove 1 significa molto triste e 10 significa molto felice.
- Valutazione generale dello stato.
- Montaggio tDCS ad alta definizione
- Prima di iniziare il montaggio del dispositivo tDCS, verificare che siano disponibili tutti i materiali necessari e che il dispositivo tDCS abbia una batteria sufficiente per eseguire la sessione di stimolazione.
- Parte inferiore in plastica del posizionamento dell'elettrodo
- Selezionare nel cappuccio in neoprene le seguenti posizioni: posizionare l'elettrodo catodico attivo su P3; posizionare gli elettrodi di ritorno su C3, CP5, CP1, Pz, PO3, PO7 e P7 (vedere Figura 5 e Figura 6).
- Posizionare la parte inferiore dell'elettrodo in ciascuna delle aree selezionate del cappuccio. Metti il berretto sulla testa del partecipante, regolando Cz in base alle misure precedentemente prese.
- Posizionamento del cappuccio in neoprene tDCS
- Far sedere il partecipante in una posizione comoda su una sedia.
- Indossare il cappuccio in neoprene (vedi Figura 6), selezionando la misura che meglio si adatta alla testa del soggetto. Evita di scegliere un berretto grande poiché deve essere aderente alla testa. Regolare il cappuccio con l'archetto finché non si adatta perfettamente alla testa.
- Individuare il punto Cz e le zone di stimolazione del protocollo.
- Misurare la distanza tra nasion e inion e tra i punti preauricolari, utilizzando un metro. Individua il punto Cz nel punto medio di entrambe le posizioni.
- Posizionamento di gel elettroconduttivo
- Separare i capelli situati sotto l'elettrodo dal punto di stimolazione. Garantire un buon contatto tra l'elettrodo e la pelle; Utilizzare un oggetto allungato che permetta di rimuovere i peli dall'interno degli elettrodi senza modificare il posizionamento della calotta sono stati precedentemente misurati.
- Assicurati che il cuoio capelluto sia asciutto senza altre preparazioni aggiunte. Rimuovere forcine o altri elementi metallici (fasce, mollette, ecc.).
- Non pulire mai la pelle con alcol poiché potrebbe produrre abrasione con la tDCS.
- Introdurre, utilizzando una siringa con punta finale in plastica, una quantità sufficiente di gel elettroconduttivo alla base di ciascun elettrodo.
ATTENZIONE: È consentito l'utilizzo di gel elettroconduttivo; Non utilizzare mai acqua o soluzione salina in questo tipo di elettrodo perché potrebbe causare abrasione. - Rimuovere quanto più pelo possibile con l'aiuto della punta di plastica della siringa.
- Controllo dell'impedenza
NOTA: Il pulsante di controllo dell'impedenza misura l'impedenza di tutti i canali attivi e di ritorno prima della stimolazione. Deve essere utilizzato prima di iniziare qualsiasi protocollo di stimolazione. I livelli di impedenza vengono visualizzati sotto l'icona di ciascun canale di stimolazione sotto le barre di colore, con il verde che indica i valori accettabili. Il programma di stimolazione può iniziare solo quando tutti i canali diventano verdi. Durante la stimolazione, l'impedenza viene monitorata ogni secondo e se un elettrodo supera i 20 kW in qualsiasi momento, il protocollo viene automaticamente interrotto.- Accendi il dispositivo. Aprire il software del dispositivo tDCS sul computer.
- Selezionare la connessione utilizzata con il dispositivo. Selezionare l'opzione di scansione del dispositivo.
- Selezionare Controlla impedenza.
- Se tutti gli elettrodi appaiono in verde, premere il pulsante Play e il programma di stimolazione si avvierà.
- Se, dopo aver completato il controllo dell'impedenza, un elettrodo appare rosso, riapplicare il gel su quell'elettrodo, rimuovere eventuali peli e ricontrollare l'impedenza fino a quando tutti gli elettrodi rimangono verdi.
- Piattaforma computerizzata di neuroriabilitazione
NOTA: Progettare in anticipo le 10 sessioni di intervento sulla piattaforma di neuroriabilitazione e preparare la piattaforma per essa (vedi punto 2.2). Ogni sessione è composta da quattro attività, ciascuna della durata di 7 minuti. Le attività incluse in ciascuna sessione sono mostrate nella Tabella 2. Quando si pianifica ogni sessione, è necessario selezionare tra i parametri di ogni attività: durata di ogni attività: durata di ogni attività: 7 min, durata totale della sessione (28 min), lingua, includere la valutazione dell'utente dopo ogni attività, includere la conferma della fine di ogni attività alla fine di ogni attività e l'assenza del pulsante continuo in ogni attività, poiché le attività devono essere eseguite in sequenza una dopo l'altra (Figura 7).- Accedi alla piattaforma informatizzata di neuroriabilitazione.
- Accedere alla sessione precedentemente pianificata (vedere il passaggio 2.2) e premere il pulsante Start. Presentare quattro diverse attività di stimolazione di 7 minuti ciascuna in sequenza.
NOTA: La sessione di stimolazione cognitiva ha una durata totale di 30 minuti. Trascorso il tempo totale di simulazione (30 minuti), le attività si interrompono. La stimolazione cognitiva continua per altri 5 minuti dopo la fine della stimolazione tDCS.
- Programma di stimolazione tDCS (20 min)
- Attivare l'inizio della stimolazione tDCS premendo il pulsante Play sul software di controllo tDCS 4 minuti e 20 s dopo l'inizio dell'attività di neuroriabilitazione computerizzata.
- Dopo 30 s di rampa ascendente, inizia la stimolazione attiva o sham. Applicare la stimolazione tDCS (20 min) contemporaneamente all'attività di neuroriabilitazione computerizzata. Dopo 20 minuti inizia una rampa di discesa che dura 30 s. Trascorso questo tempo, la stimolazione tDCS si interrompe.
- Valutazione post-intervento del paziente.
- Questionario sugli effetti collaterali.
- Applicare un adattamento del Questionario delle sensazioni relative alla stimolazione elettrica transcranica39 (Tabella 3) con 9 domande sulla presenza di vari sintomi come mal di testa, bruciore sul cuoio capelluto o sensazione di prurito o formicolio sotto gli elettrodi.
- In ogni item, valutare la gravità del sintomo su una scala da 1 a 4 e la sua relazione con la tDCS su una scala da 1 a 5 (vedi Tabella 3).
- Bilance analogiche visive per la stanchezza e l'umore
- Somministrare la stessa bilancia utilizzata prima della sessione di stimolazione per valutare la stanchezza e l'umore dopo l'intervento (vedi passaggio 4.2.2.).
- Questionario sugli effetti collaterali.
Figura 4: Montaggio rappresentativo HD-tDCS. Il colore blu mostra la posizione degli elettrodi seguendo il sistema internazionale 10-20 per il posizionamento degli elettrodi. Clicca qui per visualizzare una versione più grande di questa figura.
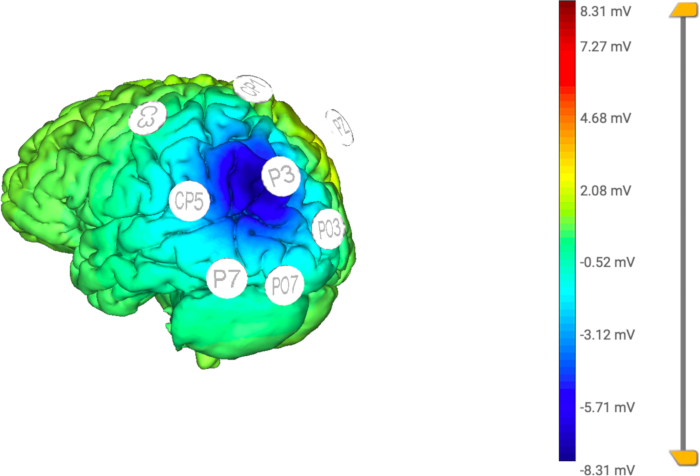
Figura 5: Modello computazionale della HD-tDCS applicata. La distribuzione della corrente elettrica è focalizzata nell'elettrodo centrale (attivo) (P3), limitando la stimolazione a un'area specifica da parte degli elettrodi di ritorno (C3, CP5, CP1, Pz, PO3, PO7, P7). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Cappuccio in neoprene per la stimolazione HD-tDCS. Il cappuccio è dotato di fori per posizionare gli elettrodi seguendo il sistema di classificazione 10/20 per l'EEG. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Programmazione delle attività. Parametri da selezionare in fase di programmazione di ogni attività nella piattaforma di Neuroriabilitazione Computerizzata. Clicca qui per visualizzare una versione più grande di questa figura.
| Blocco | Sessione | Attività della piattaforma di neuroriabilitazione | Durata |
| Io | 1, 3, 6 e 8 | · Lettere nascoste | 7 minuti per ciascuna delle attività. |
| · Somma delle cifre | |||
| · Zuppa di lettere | |||
| · Trova forme corrispondenti | |||
| II | 2, 4, 7 e 9 | · Copia di matrici di lettere | |
| · Il piccolo ghiottone | |||
| · Trovare i numeri mancanti | |||
| · Confronto di testi | |||
| III | 5 e 10 | · Confronto del testo | |
| · Somma delle cifre | |||
| · Il piccolo ghiottone | |||
| · Ricerca di stimoli consecutivi |
Tabella 2: Compiti inclusi in ciascuna delle 10 sessioni di intervento. Tutte le attività sono incluse nella piattaforma di Neuroriabilitazione Computerizzata.
| Hai una delle seguenti sensazioni o sintomi? | Classificazione della gravità (1-4) | Se presente: relazione con la tDCS? |
| 1-Assente | 1-Nessuno | |
| 2-Delicato | 2-Telecomando | |
| 3-Moderato | 3-Possibile | |
| 4-Grave | 4-Probabile | |
| 5-Definitivo | ||
| Mal di testa | ||
| Dolore al collo o al collo | ||
| Dolore al cuoio capelluto | ||
| Ustione del cuoio capelluto | ||
| Sensazioni sotto l'elettrodo (formicolio, prurito, bruciore, dolore) | ||
| Arrossamento della pelle | ||
| Intorpidimento | ||
| Problema di concentrazione | ||
| Forti sbalzi d'umore | ||
| Altri (specificare) | ||
| Commenti aggiuntivi | ||
Tabella 3: questionario sugli effetti collaterali della tDCS. Viene fornito un elenco degli effetti avversi che possono comparire dopo l'applicazione della stimolazione. La presenza o l'assenza di ciascuno di questi effetti viene registrata immediatamente dopo l'applicazione della stimolazione. Adattamento del questionario delle sensazioni correlate alla stimolazione elettrica transcranica39.
5. Rimozione della tDCS
- Una volta terminato il programma di stimolazione tDCS e le attività di neuroriabilitazione computerizzata, chiudere il software tDCS.
- Scollegare il dispositivo tDCS.
- Rimuovere il cavo che collega il tDCS con gli elettrodi.
- Rimuovere il cappuccio dalla testa del paziente.
- Rimuovere gli elettrodi dal cappuccio in neoprene.
- Pulire i capelli del paziente.
- Dopo aver rimosso il tappo in neoprene, rimuovere il gel rimanente con l'aiuto di carta/tovagliolo e lavare con acqua.
- Pulire il cappuccio in neoprene tDCS e l'elettrodo.
- Lavare il tappo con acqua per rimuovere il gel rimanente dopo ogni sessione e lasciarlo asciugare.
- Lavare gli elettrodi con acqua, evitare di strofinarli e asciugarli delicatamente con un panno asciutto. Non utilizzare mai sapone, alcol o altri prodotti per pulire gli elettrodi.
6. Valutazione neuropsicologica e funzionale post-intervento
- Il lunedì, dopo aver completato l'intervento, seguire la stessa procedura della pre-valutazione, somministrando gli stessi compiti di valutazione e questionari (vedi sezione 3).
Risultati
L'obiettivo principale del presente studio è quello di descrivere un protocollo di intervento tDCS per uno studio clinico parallelo, randomizzato, in triplo cieco. Per studiare la fattibilità dell'intervento, il protocollo è stato applicato ad un singolo partecipante; I risultati sono illustrati in questo documento.
Abbiamo applicato il protocollo di intervento completo a un uomo di 57 anni con un alto livello di istruzione (Laurea in Giornalismo) che ha subito un ictus ai gangli della base destra nove mesi prima e soddisfaceva tutti i criteri di inclusione per la partecipazione allo studio.
I risultati pre e post intervento (vedere Tabella 4 e Figura 8) sono mostrati per tutti i compiti somministrati. Nella valutazione post-intervento sono stati osservati cambiamenti quantitativi in 6 delle 13 variabili misurate, 4 delle quali sono direttamente correlate alla negligenza.
| Valutazioni | ||
| Pre-intervento | Post-intervento | |
| Test MMSE | 29 | 29 |
| Test delle campane | 21 | 25* |
| Test di annullamento | 24 | 28* |
| Test dei disegni | 12 | 12 |
| Test di bisezione | 19.95 | 3.47* |
| Test BTA | 11 | 9 |
| Volti Colpi | 11 | 9 |
| Errori di Faces | 3 | 2* |
| Test delle cifre dirette | 11 | 10 |
| Test delle cifre inverse | 9 | 8 |
| Senza motore | 26 | 29* |
| Test di Barthel | 25 | 30* |
| CBS | 20 | 20 |
Tabella 4: Risultati delle valutazioni pre e post intervento. I risultati della valutazione neuropsicologica e funzionale prima e dopo l'intervento sono riportati in punteggi diretti. *Miglioramenti quantitativi delle prestazioni nella valutazione post-intervento rispetto al basale. **I valori più lontani dal punteggio 0 indicano prestazioni peggiori e maggiore negligenza.
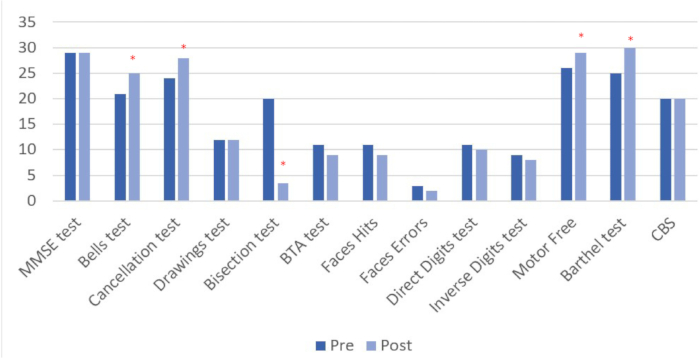
Figura 8: Risultati della valutazione pre e post intervento. Valori più alti indicano un cambiamento positivo, tranne nel test di bisezione in linea, dove il miglioramento è rappresentato da punteggi più bassi. I risultati sono mostrati in punteggi diretti. *Miglioramenti quantitativi delle prestazioni nella valutazione post-intervento rispetto al basale. Clicca qui per visualizzare una versione più grande di questa figura.
È stata calcolata la percentuale di miglioramento tra la valutazione pre e post-trattamento. Un miglioramento clinico è stato osservato nei test specifici di negligenza emispaziale: test di Bells, test di annullamento, bisezione di linea, test di percezione visiva motoria libera e scala dell'indice di Barthel. D'altra parte, sono stati osservati cambiamenti negativi in altri compiti attentivi (test delle cifre, test breve dell'attenzione, test del volto). Infine, non sono apparse modifiche nell'MMSE, nella copia dei disegni o nella scala funzionale Catherine Bergego (CBS) (vedi Figura 9).
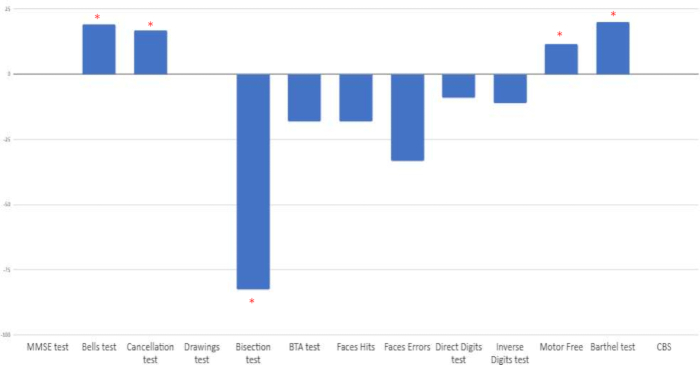
Figura 9: Percentuale di variazione tra la valutazione basale e quella post-intervento. I risultati sono mostrati in percentuale. I punteggi positivi indicano un cambiamento positivo, tranne nel test di bisezione delle linee, dove il miglioramento è rappresentato da punteggi negativi. *Percentuale di miglioramento positivo quando si confrontano le valutazioni pre e post intervento. Clicca qui per visualizzare una versione più grande di questa figura.
Le procedure di studio sono state svolte in ampi locali attrezzati per la corretta esecuzione delle sedute di valutazione e intervento e per il rispetto delle misure di sicurezza e igiene.
Per quanto riguarda il paziente, non ha manifestato affaticamento in nessuna delle sessioni di pre e post valutazione, quindi non è stato necessario riposare in nessuna di esse. La terapia è stata valutata dal paziente come divertente e stimolante, il che ha migliorato l'aderenza al trattamento e la collaborazione attiva durante tutta la procedura. Pertanto, si ritiene che il protocollo avrebbe un'elevata fattibilità e continueremo lo studio seguendo la procedura stabilita.
In termini di disagio ed effetti collaterali, il partecipante non ha manifestato alcun effetto collaterale moderato o grave correlato all'applicazione della tDCS.
Discussione
La negligenza emispaziale è una conseguenza cognitiva frequente dell'ictus e, quando persiste, tende ad avere un impatto negativo sull'efficacia del processo di riabilitazione. L'efficacia e l'efficienza degli approcci terapeutici disponibili possono essere migliorate includendo tecniche di stimolazione cerebrale non invasiva nella neuroriabilitazione, alla ricerca di un effetto sinergico 40,41. Pertanto, per mezzo della tDCS, possiamo aumentare l'efficacia dell'intervento convenzionale, ottenendo un maggiore recupero, tempi di riabilitazione più brevi e migliori risultati funzionali nella riabilitazione del paziente colpito da ictus rispetto all'intervento convenzionale in isolamento. La ricerca sul potenziale della tDCS nei disturbi neurologici e psichiatrici è aumentata esponenzialmente nell'ultimo decennio 42,43,44,45,46,47,48,49.
Inoltre, il costo della tDCS è accessibile e il dispositivo è portatile, il che lo rende altamente scalabile, consentendone l'applicazione sia in ambulatori che in contesti ospedalieri, con la formazione professionale richiesta50.
Abbiamo riscontrato un miglioramento dopo il trattamento in quattro dei tredici test somministrati (test di Bells, test di annullamento, bisezione di linea, test di percezione visiva motoria). I test in cui abbiamo osservato questi cambiamenti positivi sono legati alle prestazioni associate alla negligenza emispaziale. D'altra parte, la stabilizzazione è stata osservata nell'esecuzione di alcuni test relativi alle prestazioni cognitive generali, ai processi attentivi e/o alla memoria di lavoro (MMSE, disegni, CBS). È stata osservata una riduzione nell'esecuzione di alcune altre attività (BTA, volti, cifre dirette e inverse).
Per quanto riguarda le scale funzionali, c'erano prove di miglioramento, riportate dal caregiver primario e valutate dalla scala dell'indice di Barthel. È stata somministrata anche la scala funzionale CBS, che è direttamente correlata all'impatto dell'abbandono sulla vita quotidiana, e, in questo caso, non è stato evidenziato alcun cambiamento, rimanendo stabile rispetto alla valutazione precedente. In questo studio, abbiamo trovato i benefici del trattamento combinato per alcuni domini cognitivi ma non per altri. Questi risultati sono coerenti con l'idea che il trattamento potrebbe essere più vantaggioso per alcuni domini attentivi 51,52,53,54,55,56,57. Alcuni studi dimostrano come specifici protocolli di tDCS inducano alterazioni durature dell'eccitabilità e dell'attività corticale58. Per poter analizzare il mantenimento delle modifiche oltre una settimana, sarebbe consigliabile effettuare una nuova valutazione dopo un periodo di tempo più lungo 53,54,55,56,57.
La tDCS ad alta definizione o ad alta risoluzione, utilizzata in questo studio, è una versione tecnicamente migliorata della tDCS che consente di aumentare la focalità della stimolazione utilizzando un anello di elettrodi di ritorno attorno a un anodo o un catodo per aumentare o diminuire, rispettivamente, l'eccitabilità corticale in un modo molto più focale59. Sulla base di questa elevata focalità e della precedente tollerabilità ed effetti dello studio HD-tDCS di Borckardt et al.60, l'uso di HD-tDCS è aumentato negli ultimi anni.
Gli studi di modellazione indicano che questa configurazione dell'elettrodo genera la massima intensità del campo elettrico (EF) sotto l'elettrodo bersaglio, con il flusso di corrente cerebrale vincolato dal raggio della configurazione dell'anello 4 x 1 e, quindi, un campo elettrico più grande sul bersaglio selezionato rispetto al posizionamento convenzionale dell'elettrodo 60,61,62 . Gli elettrodi di ritorno contribuiscono a isolare l'area mirata, consentendo una stimolazione cerebrale più mirata e producendo effetti più duraturi rispetto alla tDCS63 convenzionale.
Inoltre, secondo alcuni studi, la HD-tDCS ha effetti più duraturi. Ultimamente, la ricerca clinica ha prestato attenzione a questo protocollo. Per quanto ne sappiamo, sono stati condotti solo sei studi con HD-tDCS nelle malattie neurologiche, tre studi di controllo randomizzati, due rapporti in aperto e un caso clinico (fare riferimento alla revisione49).
Sebbene non vi sia un consenso totale sulle aree anatomiche correlate alla negligenza emispaziale, sembra esserci un certo accordo su alcune aree specifiche. La corteccia parietale posteriore sembra essere l'area chiave dell'alterazione 64,65,66, e all'interno di quest'area, il giro angolare 64,65,67,68,69, il solco intraparietale 64,69,70, la giunzione temporoparietale 69,71 e il giro sopramarginale65,72,73,74.
Dato che il vantaggio della HD-tDCS rispetto alla tDCS convenzionale è l'aumento della precisione nel target di stimolazione e sulla base della conoscenza di una posizione precisa per la presenza di negligenza emispaziale, possiamo aspettarci di ottenere maggiori benefici dalla stimolazione focale rispetto a una stimolazione più generale o diffusa. Nel frattempo, la configurazione più utilizzata negli studi neurologici è il montaggio 4 x 1 75,76,77,78,79. Nel nostro studio, abbiamo utilizzato una configurazione 7 x 1 con l'obiettivo di aumentare ulteriormente la focalità della stimolazione, essendo il primo studio che utilizza questo montaggio nella riabilitazione clinica della negligenza. Pertanto, è necessario condurre ulteriori ricerche in questa e in altre condizioni cliniche per determinare la superiorità o l'efficacia di questo montaggio HD-tDCS rispetto ad altri montaggi HD e tDCS convenzionale.
Per quanto riguarda l'intensità, 2 mA viene applicato in questo protocollo, come nella maggior parte degli studi con tDCS, indipendentemente dal montaggio o dalla configurazione utilizzata. Sarebbe interessante confrontare lo stesso protocollo con intensità più basse e più alte in ulteriori studi per capire l'effetto delle diverse intensità applicate.
Con il protocollo attuale è necessario prendere in considerazione alcune raccomandazioni utili per quanto riguarda la sicurezza e la risoluzione dei problemi tecnici. In ogni paziente, ma soprattutto nei pazienti con ictus, i problemi di sicurezza devono essere valutati attentamente. Sebbene la tDCS nei pazienti con ictus sia sicura e ben tollerata80, i pazienti e le loro famiglie a volte hanno dubbi al riguardo. Pertanto, le informazioni comprensibili devono essere consegnate in anticipo e discusse con il paziente e i parenti, assicurandosi che comprendano la procedura e possano abbandonare il protocollo ogni volta che lo desiderano.
D'altra parte, in questo protocollo, la posizione esatta della lesione è stata considerata e registrata poiché siamo disposti a confrontare l'effetto del protocollo sulla negligenza emispaziale dopo lesioni corticali (ad esempio, arteria cerebrale media destra)69 e dopo lesioni sottocorticali (ad esempio, gangli della base)81. In questo contesto, è fondamentale valutare l'efficacia della tecnica alla luce dell'eterogeneità delle sedi delle lesioni. In particolare, è necessario analizzare le variazioni di efficacia relative alle lesioni corticali rispetto a quelle sottocorticali.
Per quanto riguarda la fase di ictus, quando si applica la stimolazione (acuta, subacuta o cronica), è importante conoscere il momento in cui l'intervento potrebbe essere più vantaggioso. In questo studio, abbiamo utilizzato come criterio di inclusione da 3 a 12 mesi dall'infortunio (fase subacuta). Tuttavia, una precedente revisione sistematica si è concentrata sugli aspetti motori dopo l'ictus e i risultati hanno mostrato miglioramenti nelle fasi croniche ma non nella fase acuta (entro i primi 3 giorni dall'insorgenza dei sintomi)82. Sono necessarie ulteriori indagini per esplorare i benefici della tDCS sulle alterazioni cognitive post-ictus e per identificare i fattori che ne predicono l'efficacia ottimale nelle varie fasi del recupero.
Le attuali conoscenze sulla HD-tDCS come approccio terapeutico nelle malattie neurologiche ne supportano la tollerabilità e l'efficacia clinica. Inoltre, sono necessarie ulteriori ricerche randomizzate controllate per capire i parametri ottimali in ogni malattia e in ogni paziente al fine di stabilire l'efficacia di questa tecnica di stimolazione cerebrale non invasiva nei disturbi neurologici e oltre.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo NeuronUp (www.neuronup.com) per il suo supporto e la sua collaborazione disinteressata in questo progetto.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 electrode cable | Neuroelectrics | NE017 | |
| Barthel Index | N/A | Mahoney, F. I., Barthel, D. W. Functional evaluation: The Barthel Index. Md State Med J. 14, 61–65 (1965). | |
| Copy of drawings subtest | N/A | https://test-barcelona.com/es/tienda.html | J. Peña Casanova, Programa integrado de exploración neuropsicológica: test Barcelona revisado?: TBR. Barcelona: Masson. |
| Curved Syrenge | Neuroelectrics | NE014 | |
| Electrode Gel | Neuroelectrics | NE016a | |
| Line bisection test | N/A | Schenkenberg, T., Bradford, D. C., Ajax, E. T. Line bisection and unilateral visual neglect in patients with neurologic impairment. Neurology. 30 (5) 509–517 (1980). | |
| Mini-mental state examination (MMSE) | N/A | Folstein, M. F., Folstein, S. E., McHugh, P. R. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 12 (3) 189–198 (1975). | |
| Neoprene headcap | Neuroelectrics | NE019-M | |
| Saline Solution | Neuroelectrics | NE033 | |
| Satrstim Necbox | Neuroelectrics | NE012 | |
| Starstim tES-EEG System | Neuroelectrics | ||
| Teastboard Cable | Neuroelectrics | NE039 | |
| Testboard Head | Neuroelectrics | NE038 | |
| The Bell Test | N/A | https://strokengine.ca/en/assessments/bells-test/ | L. Gauthier, F. Deahault and Y. Joanette, The Bells Test: A quantitative and qualitative test for visual neglect (Vol. 11). |
| The Catherine Bergego Scale | N/A | Azouvi, P. et al. Behavioral assessment of unilateral neglect: study of the psychometric properties of the Catherine Bergego Scale. Arch Phys Med Rehabil. 84 (1) 51–57 (2003). | |
| The motor-free visual perception test (MVPT) | N/A | https://www.wpspublish.com/mvpt-4-motor-free-visual-perception-test-4 | Colarusso, R. P., Hammill, D.D. The Motor Free Visual Perception Test (MVPT-3). Navato, CA: Academic Therapy Publications (2003). |
| USB Bluetooth Dongle | Neuroelectrics | NE031 | |
| USB charging Cable | Neuroelectrics | NE043 | |
| USB Power Adapter & Power Supply Plug | Neuroelectrics | NE013 & NE013a, NE013b, NE013c | |
| USB Stick with Manuals & NIC SW | Neuroelectrics | NE015 |
Riferimenti
- Sun, J. -H., Tan, L., Yu, J. -T. Post-stroke cognitive impairment: epidemiology, mechanisms and management. Ann Transl Med. 2 (8), 80(2014).
- Abo, M., et al. comparative study of NEURO versus CIMT in poststroke patients with upper limb hemiparesis: the neuro-verify study. Int J Stroke. 9 (5), 607-612 (2014).
- Mijajlović, M. D., et al. Post-stroke dementia - a comprehensive review. BMC Med. 15 (1), 11(2017).
- Kerkhoff, G., Schenk, T. Rehabilitation of neglect: an update. Neuropsychologia. 50 (6), 1072-1079 (2012).
- Jehkonen, M., et al. Predictors of discharge to home during the first year after right hemisphere stroke. Acta Neurol Scand. 104 (3), 136-141 (2001).
- Buxbaum, L. J., et al. Hemispatial neglect: subtypes, neuroanatomy, and disability. Neurology. 62 (5), 749-756 (2004).
- Nijboer, T. C. W., Kollen, B. J., Kwakkel, G. Time course of visuospatial neglect early after stroke: a longitudinal cohort study. Cortex. 49 (8), 2021-2027 (2013).
- Ringman, J. M., Saver, J. L., Woolson, R. F., Clarke, W. R., Adams, H. P. Frequency, risk factors, anatomy, and course of unilateral neglect in an acute stroke cohort. Neurology. 63 (3), 468-474 (2004).
- Parton, A., Malhotra, P., Husain, M. Hemispatial neglect. J Neurol Neurosurg Psychiatry. 75 (1), 13-21 (2004).
- Stone, S. P., Patel, P., Greenwood, R. J., Halligan, P. W. Measuring visual neglect in acute stroke and predicting its recovery: the visual neglect recovery index. J Neurol Neurosurg Psychiatry. 55 (6), 431(1992).
- Chen, P., Hreha, K., Kong, Y., Barrett, A. M. Impact of spatial neglect on stroke rehabilitation: evidence from the setting of an inpatient rehabilitation facility. Arch Phys Med Rehabil. 96 (8), 1458-1466 (2015).
- Wilkinson, D., Sakel, M., Camp, S. -J., Hammond, L. Patients with hemispatial neglect are more prone to limb spasticity, but this does not prolong their hospital stay. Arch Phys Med Rehabil. 93 (7), 1191-1195 (2012).
- Gammeri, R., Iacono, C., Ricci, R., Salatino, A. Unilateral spatial neglect after stroke: current insights. Neuropsychiatr Dis Treat. 16, 131-152 (2020).
- Muñoz-Marrón, E., Redolar-Ripoll, D., Zulaica-Cardoso, A. New therapeutic approaches in the treatment of neglect: transcranial magnetic stimulation. Rev Neurol. 55 (5), 297-305 (2012).
- Cicerone, K. D., et al. Evidence-based cognitive rehabilitation: systematic review of the literature from 2009 through 2014. Arch Phys Med Rehabil. 100 (8), 1515-1533 (2009).
- Pizzamiglio, L., et al. Cognitive rehabilitation of the hemineglect disorder in chronic patients with unilateral right brain damage. J Clin Exp Neuropsychol. 14 (6), 901-923 (1992).
- Yi, Y., et al. The effect of transcranial direct current stimulation on neglect syndrome in stroke patients. Ann Rehabil Med. 40 (2), 223-229 (2016).
- Fregni, F., Pascual-Leone, A. Technology insight: noninvasive brain stimulation in neurology-perspectives on the therapeutic potential of rTMS and tDCS. Nat Rev Neurol. 3 (7), 383-393 (2007).
- Lefaucheur, J. -P., et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol. 128 (1), 56-92 (2017).
- González-Rodriguez, B., Serradell-Ribé, N., Viejo-Sobera, R., Romero-Muñoz, J. P., Marron, E. M. Transcranial direct current stimulation in neglect rehabilitation after stroke: a systematic review. J Neurol. 269 (12), 6310-6329 (2022).
- Kinsbourne, M. A model for the mechanism of unilateral neglect of space. Trans Am Neurol Assoc. 95, 143-146 (1970).
- Kinsbourne, M. Hemi-neglect and hemisphere rivalry. Adv Neurol. 18, 41-49 (1977).
- Koch, I. Instruction effects in task switching. Psychon Bull Rev. 15 (2), 448-452 (2008).
- Corbetta, M., Kincade, M. J., Lewis, C., Snyder, A. Z., Sapir, A. Neural basis and recovery of spatial attention deficits in spatial neglect. Nat Neurosci. 8 (11), 1603-1610 (2005).
- Hummel, F. C., Cohen, L. G. Noninvasive brain stimulation: a new strategy to improve neurorehabilitation after stroke. Lancet Neurol. 5 (8), 708-712 (2006).
- Miniussi, C., et al. Efficacy of repetitive transcranial magnetic stimulation/transcranial direct current stimulation in cognitive neurorehabitation. Brain Stimul. 1 (4), 326-336 (2008).
- Bornheim, S., Maquet, P., Croisier, J., Crielaard, J., Kaux, J. Motor cortex transcranial direct current stimulation (tDCS) improves acute stroke visuo-spatial neglect: a series of four case reports. Brain Stimul. 11 (2), 459-461 (2018).
- Sunwoo, H., et al. Effects of dual transcranial direct current stimulation on post-stroke unilateral visuospatial neglect. Neurosci Lett. 554, 94-98 (2013).
- Ladavas, E., et al. A-tDCS on the ipsilesional parietal cortex boosts the effects of prism adaptation treatment in neglect. Restor Neurol Neurosci. 33 (5), 647-662 (2015).
- Turgut, N., Miranda, M., Kastrup, A., Eling, P., Hildebrandt, H. tDCS combined with optokinetic drift reduces egocentric neglect in severely impaired post-acute patients. Neuropsychol Rehabil. 28 (4), 515-526 (2018).
- Smit, M., et al. Transcranial direct current stimulation to the parietal cortex in hemispatial neglect: a feasibility study. Neuropsychologia. 74, 152-161 (2015).
- Brem, A. -K., Unterburger, E., Speight, I., Jancke, L. Treatment of visuospatial neglect with biparietal tDCS and cognitive training: a single-case study. Front Syst Neurosci. 8, 180-180 (2014).
- Cappon, D., Jahanshahi, M., Bisiacchi, P. Value and efficacy of transcranial direct current stimulation in the cognitive rehabilitation: a critical review since 2000. Front Neurosci. 10, 157(2016).
- Fan, J., Li, Y., Yang, Y., Qu, Y., Li, S. Efficacy of noninvasive brain stimulation on unilateral neglect after stroke: a systematic review and meta-analysis. Am J Phys Med Rehabil. 97 (4), 261-269 (2018).
- Kashiwagi, F. T., et al. Noninvasive brain stimulations for unilateral spatial neglect after stroke: a systematic review and meta-analysis of randomized and nonrandomized controlled trials. Neural Plast. , (2018).
- Salazar, A. P. S., et al. Noninvasive brain stimulation improves hemispatial neglect after stroke: a systematic review and meta-analysis. Arch Phys Med Rehabil. 99 (2), 355-366 (2018).
- Zebhauser, P. T., Vernet, M., Unterburger, E., Brem, A. -K. Visuospatial neglect-a theory-informed overview of current and emerging strategies and a systematic review on the therapeutic use of noninvasive brain stimulation. Neuropsychol Rev. 29 (4), 397-420 (2019).
- Bikson, M., et al. Safety of transcranial direct current stimulation: evidence based update 2016. Brain Stimul. 9 (5), 641-661 (2016).
- Antal, A., et al. Low intensity transcranial electric stimulation: safety, ethical, legal regulatory and application guidelines. Clin Neurophysiol. 128 (9), 1774-1809 (2017).
- Sathappan, A. V., Luber, B. M., Lisanby, S. H. The dynamic duo: combining noninvasive brain stimulation with cognitive interventions. Prog Neuropsychopharmacol Biol Psychiatry. 89, 347-360 (2019).
- Draaisma, L. R., Wessel, M. J., Hummel, F. C. Noninvasive brain stimulation to enhance cognitive rehabilitation after stroke. Neurosci Lett. 719, 133678(2020).
- David, M. C. M. M., Moraes, A. A., de Costa, M. L., da Franco, C. I. F. Transcranial direct current stimulation in the modulation of neuropathic pain: a systematic review. Neurol Res. 40 (7), 557-565 (2018).
- Dondé, C., et al. Transcranial direct-current stimulation (tDCS) for bipolar depression: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry. 78, 123-131 (2017).
- Gowda, S. M., et al. Efficacy of pre-supplementary motor area transcranial direct current stimulation for treatment resistant obsessive compulsive disorder: a randomized, double blinded, sham controlled trial. Brain Stimul. 12 (4), 922-929 (2019).
- Kang, N., Summers, J. J., Cauraugh, J. H. Transcranial direct current stimulation facilitates motor learning post-stroke: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 87 (4), 345-355 (2016).
- Narayanaswamy, J. C., et al. Successful application of add-on transcranial direct current stimulation (tDCS) for treatment of SSRI resistant OCD. Brain Stimul. 8 (3), 655-657 (2015).
- Osoegawa, C., et al. Noninvasive brain stimulation for negative symptoms in schizophrenia: an updated systematic review and meta-analysis. Schizophr Res. 197, 34-44 (2018).
- Vacas,, et al. Noninvasive brain stimulation for behavioural and psychological symptoms of dementia: a systematic review and meta-analysis. Int J Geriatr Psychiatry. 34 (9), 1336-1345 (2019).
- Parlikar, R., et al. High definition transcranial direct current stimulation (HD-tDCS): a systematic review on the treatment of neuropsychiatric disorders. Asian J Psychiatry. 56, 102542(2021).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: recommendations from an IFCN committee. Clin Neurophysiol. 132 (3), 819-837 (2021).
- Cappa, S. F., et al. EFNS guidelines on cognitive rehabilitation: report of an EFNS task force. Eur J Neurol. 12 (9), 665-680 (2005).
- Sturm, W., Willmes, K., Orgass, B., Hartje, W. Do specific attention deficits need specific training. Neuropsychol Rehabil. 7 (2), 81-103 (1997).
- Verveer, I., Remmerswaal, D., Van der Veen, F. M., Franken, I. H. A. Long-term tDCS effects on neurophysiological measures of cognitive control in tobacco smokers. Biol Psychol. 156, 107962(2020).
- Katz, B., et al. Individual differences and long-term consequences of tDCS-augmented cognitive training. J Cogn Neurosci. 29 (9), 1498-1508 (2017).
- Gu, J., et al. The effect and mechanism of transcranial direct current stimulation on episodic memory in patients with mild cognitive impairment. Front Neurosci. 16, 811403(2022).
- Zhou, Y., et al. Efficacy and safety of transcranial direct current stimulation (tDCS) on cognitive function in chronic schizophrenia with tardive dyskinesia (TD): a randomized, double-blind, sham-controlled, clinical trial. BMC Psychiatry. 23 (1), 623(2023).
- Au, J., et al. Enhancing working memory training with transcranial direct current stimulation. J Cogn Neurosci. 28 (9), 1419-1432 (2016).
- Stagg, C. J., Antal, A., Nitsche, M. A. Physiology of transcranial direct current stimulation. J ECT. 34 (3), 144-152 (2018).
- Da Silva Machado, D. G., et al. Acute effect of high-definition and conventional tDCS on exercise performance and psychophysiological responses in endurance athletes: a randomized controlled trial. Sci Rep. 11, 13911(2021).
- Borckardt, J. J., et al. A pilot study of the tolerability and effects of high-definition transcranial direct current stimulation (HD-tDCS) on pain perception. J Pain. 13 (2), 112-120 (2012).
- Villamar, M. F., et al. Technique and considerations in the use of 4x1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309(2013).
- Effects of electrode configurations and injected current intensity on the electrical field of transcranial direct current stimulation: a simulation study. Mackenbach, C., Tian, R., Yang, Y. Annu Int Conf IEEE Eng Med Biol Soc, , 3517-3520 (2020).
- Bikson, M., Datta, A., Rahman, A., Scaturro, J. Electrode montages for tDCS and weak transcranial electrical stimulation: role of "return" electrode's position and size. Clin Neurophysiol. 121 (12), 1976-1978 (2010).
- Chambers, C. D., Stokes, M. G., Mattingley, J. B. Modality-specific control of strategic spatial attention in parietal cortex. Neuron. 44 (6), 925-930 (2004).
- Chambers, C. D., Payne, J. M., Mattingley, J. B. Parietal disruption impairs reflexive spatial attention within and between sensory modalities. Neuropsychologia. 45 (8), 1715-1724 (2007).
- Chambers, C. D., Mattingley, J. B. Neurodisruption of selective attention: insights and implications. Trends Cogn Sci. 9 (11), 542-550 (2005).
- Rushworth, M. F., Ellison, A., Walsh, V. Complementary localization and lateralization of orienting and motor attention. Nat Neurosci. 4 (6), 656-661 (2001).
- Hillis, A. E., et al. Anatomy of spatial attention: insights from perfusion imaging and hemispatial neglect in acute stroke. J Neurosci. 25 (12), 3161-3167 (2005).
- Mort, D. J., et al. The anatomy of visual neglect. Brain. 126 (9), 1986-1997 (2003).
- Mannan, S. K., et al. Revisiting previously searched locations in visual neglect: role of right parietal and frontal lesions in misjudging old locations as new. J Cogn Neurosci. 17 (2), 340-354 (2005).
- Vallar, G. Extrapersonal visual unilateral spatial neglect and its neuroanatomy. Neuroimage. 14 (1 Pt 2), S52-S58 (2001).
- Oliveri, M., Vallar, G. Parietal versus temporal lobe components in spatial cognition: setting the mid-point of a horizontal line. J Neuropsychol. 3 (2), 201-211 (2009).
- Committeri, G., et al. Neural bases of personal and extrapersonal neglect in humans. Brain. 130 (Pt 2), 431-441 (2007).
- Doricchi, F., Tomaiuolo, F. The anatomy of neglect without hemianopia: a key role for parietal-frontal disconnection. Neuroreport. 14 (17), 2239-2243 (2003).
- Fiori, V., Nitsche, M. A., Cucuzza, G., Caltagirone, C., Marangolo, P. High-definition transcranial direct current stimulation improves verb recovery in aphasic patients depending on current intensity. Neuroscience. 406, 159-166 (2019).
- Karvigh, S. A., Motamedi, M., Arzani, M., Roshan, J. H. N. HD-tDCS in refractory lateral frontal lobe epilepsy patients. Seizure. 47, 74-80 (2017).
- Meiron, O., et al. Antiepileptic effects of a novel noninvasive neuromodulation treatment in a subject with early-onset epileptic encephalopathy: case report with 20 sessions of HD-tDCS intervention. Front Neurosci. 13, (2019).
- Reckow, J., et al. Tolerability and blinding of 4x1 high-definition transcranial direct current stimulation (HD-tDCS) at two and three milliamps. Brain Stimul. 11 (5), 991-997 (2018).
- Motes, M. A., et al. High-definition transcranial direct current stimulation to improve verbal retrieval deficits in chronic traumatic brain injury. J Neurotrauma. 37 (1), 170-177 (2020).
- Russo, C., Souza Carneiro, M. I., Bolognini, N., Fregni, F. Safety review of transcranial direct current stimulation in stroke. Neuromodulation. 20 (3), 215-222 (2017).
- Hochstenbach, J., Van Spaendonck, K. P., Cools, A. R., Horstink, M. W., Mulder, T. Cognitive deficits following stroke in the basal ganglia. Clin Rehabil. 12 (6), 514-520 (1998).
- Marquez, J., Van Vliet, P., McElduff, P., Lagopoulos, J., Parsons, M. Transcranial direct current stimulation (tDCS): does it have merit in stroke rehabilitation? A systematic review. Int J Stroke. 10 (3), 306-316 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon