Method Article
Randomisierte, dreifach verblindete und parallelkontrollierte Studie zur transkraniellen Gleichstromstimulation zur kognitiven Rehabilitation nach Schlaganfall
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Studie wird ein neuartiges transkranielles Gleichstromstimulationsprotokoll (tDCS) in Kombination mit kognitiver Stimulation vorgestellt, um den hemiräumlichen Neglect nach einem Schlaganfall zu behandeln. Erste Daten eines Pilotpatienten stellen die Machbarkeit des Verfahrens sicher und deuten auf eine potenzielle Wirksamkeit hin, was eine Grundlage für eine zukünftige parallele, dreifach blinde, kontrollierte klinische Studie bildet.
Zusammenfassung
Ein Schlaganfall der rechten Hemisphäre führt häufig zu einem hemiräumlichen Neglect, einer Behinderung, die den Genesungsprozess erheblich behindern kann. Das chronische Vorhandensein von Vernachlässigung wurde mit schlechteren Ergebnissen sowohl im kognitiven als auch im motorischen Bereich in Verbindung gebracht. Als Ergänzung zu herkömmlichen neuropsychologischen Interventionen hat die transkranielle Gleichstromstimulation (tDCS) - eine nichtinvasive Technik, die die neuronale Erregbarkeit durch elektrische Ströme geringer Intensität moduliert - Aufmerksamkeit erregt, da sie das Potenzial hat, die kortikale Plastizität zu verbessern und die funktionelle Verbesserung bei Betroffenen zu unterstützen.
In dieser Studie schlagen wir ein kombiniertes Interventionsprotokoll vor, das darauf abzielt, die Symptome des hemiräumlichen Neglects nach einem Schlaganfall zu reduzieren. Es besteht aus einem kathodalen tDCS-Protokoll in Kombination mit einem computergestützten neuropsychologischen Rehabilitationsprogramm, das speziell für die Rehabilitation von hemiräumlichem Neglect entwickelt wurde.
Die Neuromodulationsstrategie besteht darin, die Hyperaktivierung der ungeschädigten Hemisphäre auf der Grundlage des interhemisphärischen Rivalitätsmodells zu reduzieren. Die Intervention besteht aus 2 Wochen, 10 Sitzungen (von Montag bis Freitag) zu je 45 Minuten, aus tDCS und konventioneller kognitiver Stimulation gleichzeitig. Das tDCS wird von einem 8-Kanal-High-Definition-tDCS (HD-tDCS)-Baustein für 20 min und mit einer Intensität von 2 mA angewendet. Die Kathode wird über dem linken hinteren parietalen Kortex positioniert (P3 nach dem 10/20-System für die Elektrodenplatzierung im Elektroenzephalogramm [EEG]), und die Rückelektroden werden bei C3, CP5, CP1, Pz, PO3, PO7 und P7 platziert. Eine neuropsychologische und funktionelle Beurteilung wurde zu Studienbeginn und nach Beendigung der Intervention durchgeführt.
Das primäre Ziel der vorliegenden Studie ist es, das Protokoll für ein paralleles, randomisiertes, dreifach verblindetes Versuchsdesign zu beschreiben. Um die Durchführbarkeit des Protokolls und seine potenzielle Wirksamkeit zu gewährleisten, wird eine umfassende Beschreibung der Verfahren bereitgestellt, die auf einen einzelnen Pilotteilnehmer angewendet werden.
Die Einbeziehung von tDCS-Neuromodulationsstrategien in kognitive Rehabilitationsprozesse kann zu verkürzten Interventionszeiten führen und den Funktionsstatus und die Lebensqualität der Patienten verbessern.
Einleitung
Ein Schlaganfall ist weltweit die häufigste Ursache für Behinderungen bei Erwachsenen und nach der ischämischen Herzkrankheit die zweithäufigste Todesursache1. Die meisten Patienten, die einen Schlaganfall überlebt haben, entwickeln sehr heterogene Krankheitsbilder und unterschiedliche Grade der Behinderung. Zwischen 55 % und 75 % der Schlaganfallpatienten haben motorische Einschränkungen, die 6 Monate nach der Verletzung bestehen2. Neben den körperlichen Folgen sind kognitive Veränderungen sehr häufig3. Diese Defizite wirken sich negativ auf die Leistungsfähigkeit der Aktivitäten des täglichen Lebens aus und schränken die funktionelle Unabhängigkeit und die Lebensqualität von Patienten und Angehörigen ein 4,5. Die hemiräumliche Neglect gehört zu den häufigsten Aufmerksamkeitsbeeinträchtigungen nach einem Schlaganfall und tritt in etwa 25 % bis 50 % der Fälle auf 6,7,8 und steigt bei Personen mit Schlaganfällen der rechten Hemisphäre auf bis zu 80 %an 9,10.
Der hemiräumliche Neglect impliziert die Schwierigkeit, das kontralaterale Hemifeld auf den verletzten Bereich zu konzentrieren, da es sich um eine allozentrische (Auslassung von Gegenständen, die sich in der linken Hälfte des Raumes befinden) oder egozentrisch (der Patient kümmert sich nicht um die linken Teile seines eigenen Körpers) handelt. Funktionell führt Neglect zu schwerwiegenden Schwierigkeiten bei der Unabhängigkeit des Patienten, sowohl bei grundlegenden (z. B. Körperpflege, Kleidung, Essen usw.) als auch bei instrumentellen Aktivitäten des täglichen Lebens (z. B. Geldmanagement, öffentliche Verkehrsmittel oder selbstständiges Gehen). Darüber hinaus wurde das Vorhandensein dieser Veränderung mit längeren Krankenhausaufenthalten und Rehabilitationszeiten, einem höheren Sturzrisiko, einer schlechten motorischen Erholung und einer geringeren Wahrscheinlichkeit einer Rückkehr nach Hause nach der Entlassung aus dem Krankenhaus in Verbindung gebracht11,12.
Es wurden mehrere Strategien zur Behandlung von hemiräumlichem Neglect implementiert. Innerhalb der traditionellen Rehabilitationsansätze können wir den Top-down- und den Bottom-up-Ansatz unterscheiden. Der Hauptunterschied zwischen ihnen ist der Grad der aktiven Teilnahme und des Bewusstseins der Person an Aufgaben. Innerhalb dieser Ansätze waren die bisher am weitesten verbreiteten Verfahren das visuelle Scantraining bzw. die prismatische Adaption13. Andere Rehabilitationstechniken bei hemiräumlichem Neglect mit breiter Anwendung sind zentrale Lokalisation, optokinetische, kalorische und vestibuläre Stimulation, Nackenvibration und pharmakologische Behandlungen 13,14,15,16. Diese Behandlungen haben jedoch einige Einschränkungen: Die Dauer ihrer Ergebnisse ist sehr begrenzt, und sie sind in der akuten oder subakuten Phase nur wenig anwendbar, da der Schweregrad der Patienten in diesen Phasen ihre Mitarbeit bei den durchzuführenden Aktivitäten beeinträchtigt17.
Die transkranielle Gleichstromstimulation (tDCS) ist eine nicht-invasive, sichere Neuromodulationstechnik, die in der Lage ist, die kortikale Aktivität zu modifizieren, indem sie einen schwachen elektrischen Strom in das Gehirn induziert, der die kortikale Aktivität verändert, und sie kann zur Ergänzung der neuropsychologischen Rehabilitation bei hemiräumlichem Neglect eingesetzt werden. tDCS moduliert die spontane neuronale Aktivierung als Reaktion auf Eingaben aus anderen Hirnarealen. Darüber hinaus induziert tDCS plastische synaptische Veränderungen, die einer Langzeitpotenzierung (LTP) oder Langzeitdepression (LTD) ähneln und sogar über die Dauer der Stimulation hinaus anhalten18.
Mittels tDCS kann die kortikale Aktivität moduliert werden, indem ein elektrischer Strom mit sehr geringer Intensität angelegt wird, der von der Anode zur Kathode fließt. tDCS moduliert die Gehirnaktivität, indem es die Schwelle des Aktionspotentials beeinflusst, sie erhöht oder verringert, ohne jedoch Aktionspotentiale zu verursachen18. Im Allgemeinen induziert die Anode eine Erhöhung der Erregbarkeit der Gehirnregion, auf der sie sich befindet, während die Kathode eine kortikale Hemmung induziert. Diese Technik hat keine hohe räumliche Auflösung, aber diese Einschränkung wurde durch das Erscheinen neuer tDCS-Geräte überwunden, die als Multisite oder High Definition (HD-tDCS) bezeichnet werden. Diese Geräte ermöglichen unterschiedliche Elektrodenkonfigurationen, wie z. B. die Bildung eines Kathodenrings um die Anode (oder umgekehrt), um die kortikale Erregbarkeit in einem bestimmten Gehirnbereich zu erhöhen oder zu verringern. Der Kathodenring wirkt ähnlich wie die Rücklaufelektroden und begrenzt den Stimulationsbereich. Auf diese Weise wird eine fokussiertere Stimulation erreicht. tDCS hat sich als therapeutischer Ansatz für die motorische Erholung nach Schlaganfall als wirksam erwiesen19, und es gibt einige wissenschaftliche Literatur mit vielversprechenden Ergebnissen bei der Rehabilitation von hemiräumlichem Neglect20.
Die am meisten akzeptierte Hypothese der hemiräumlichen Vernachlässigung argumentiert, dass sie auf der Grundlage des hemisphärischen Rivalitätsmodells erklärt werden könnte, das 1977 von Kinsbourne vorgeschlagen wurde21,22. Nach diesem Ansatz hemmen sich beide Hemisphären im basalen Zustand ständig gegenseitig in wechselseitiger Weise; Die hemiräumliche Vernachlässigung wird durch ein Ungleichgewicht zwischen ihnen verursacht. Nach einer Verletzung ist die geschädigte Hemisphäre nicht mehr in der Lage, die Aktivität der erhaltenen Hemisphäre wirksam zu hemmen. Dies führt zu einer pathologischen Hyperaktivität der gesunden Hemisphäre aufgrund des Fehlens einer Hemmung, die von der geschädigten Hemisphäre ausgeübt wird, was die neuronale Aktivität der betroffenen Hemisphäre aufgrund der erhöhten Hemmung, die auf sie ausgeübt wird, noch mehr reduziert23. Daher wird die Dysfunktion, die dem hemiräumlichen Neglect zugrunde liegt, sowohl durch die Hypoaktivität der geschädigten Hemisphäre als auch durch die Hyperaktivität der intakten Hemisphäre verursacht24.
Mit diesem Modell als theoretischem Hintergrund werden verschiedene nicht-invasive Hirnstimulationsstrategien vorgeschlagen, die darauf abzielen, die hemiräumliche Neglect-Symptome zu verbessern. Diese Strategien zielen darauf ab, die Hyperaktivität der gesunden Hemisphäre zu verringern, die Aktivität der verletzten Hemisphäre zu erhöhen oder eine Kombination aus beidem25,26.
Mehrere Studien haben das Potenzial von tDCS bei der Verringerung der hemiräumlichen Neglect-Symptomatik gezeigt, indem sowohl anodal 17,27,28,29 als auch kathodal 17,29 tDCS in der verletzten bzw. ungeschädigten Hemisphäre oder eine Kombination aus beiden angewendetwird 28,30,31,32. Trotz vielversprechender Ergebnisse sind mehr empirische Beweise erforderlich, um die genauen Parameter von tDCS zu kennen und optimale Ergebnisse zu erzielen, was wichtig ist, um zu wissen, ob fokale tDCS effektiver ist als herkömmliche tDCS-Montagen. Unseres Wissens wurden alle bisherigen Forschungen unter Verwendung der konventionellen tDCS entwickelt, wobei die vorliegende Studie die erste ist, die HD-tDCS für die Rehabilitation des hemiräumlichen Neglects einsetzt.
Interventionen, die auf nicht-invasiver Hirnstimulation basieren, stellen angesichts der aktuellen Ergebnisse und der begrenzten Nebenwirkungen gemäß verschiedenen Metaanalysen und Übersichtsarbeiten 33,34,35,36,37 einen sehr vielversprechenden klinischen Ansatz dar. Darüber hinaus ist tDCS eine äußerst sichere, tragbare und kostengünstige Technik, weshalb ihr Einsatz in klinischen und Forschungsumgebungen als Priorität zugenommen hat. Dank seiner einfachen Montage und Tragbarkeit kann das Gerät gleichzeitig mit der Ausführung anderer Aktivitäten verwendet werden, wie z. B. körperlicher, kognitiver Rehabilitation oder funktioneller Aktivitäten. Daher sind stärker kontrollierte, verblindete, randomisierte Studien mit größeren Stichprobengrößen gerechtfertigt, um tDCS-Protokolle zu validieren, die die Wirkung konventioneller Interventionsansätze verstärken.
Protokoll
Dieses Projekt wurde von der Ethikkommission für klinische Forschung des Krankenhauses 12 de Octubre genehmigt (Ref. Nº CEIm: 19/180) und ist bei www.clinicaltrials.gov (ID: NCT04458974) registriert. Die Forscher verpflichten sich, alle geltenden Rechtsvorschriften in Bezug auf klinische Forschung und Datenschutz einzuhalten (WMA-Deklaration von Helsinki, 2004; Verordnung (EU) 2016/679 und Organgesetz 3/2018 über den Schutz personenbezogener Daten; Gesetz 41/2002 über die Patientenautonomie). In Übereinstimmung mit der Verordnung (EU) 2016/679 über den Schutz personenbezogener Daten werden alle von den Teilnehmern erhobenen Daten streng vertraulich behandelt. Das tDCS-Protokoll folgt den internationalen Sicherheitsrichtlinien für tDCS38.
HINWEIS: Das primäre Ziel der vorliegenden Studie ist es, ein tDCS-Interventionsprotokoll für eine parallele, randomisierte, dreifach verblindete klinische Studie zu beschreiben. Um dies zu erreichen, wird eine umfassende Beschreibung der Verfahren zur Verfügung gestellt und die Ergebnisse einer Pilotteilnehmerbewerbung in diesem Beitrag dargestellt. Das Interventionsprotokoll besteht aus einem 10-Sitzungen-Programm, das die kathodale tDCS (20 min, 2 mA) mit einem computergestützten neuropsychologischen Rehabilitationsprogramm kombiniert, das darauf abzielt, den hemiräumlichen Neglect zu verbessern. Neuropsychologische und funktionelle Beurteilungen werden zu Studienbeginn und nach Beendigung der Intervention durchgeführt. Abbildung 1 zeigt die Zeitleiste des Protokolls. Die Abbildung zeigt die Baseline-Bewertung, eine detaillierte Beschreibung der Intervention und die Bewertung der Studie nach der Intervention. Die Teilnahme der Patienten war freiwillig, nachdem sie über den Zweck der Studie informiert worden waren und eine schriftliche Einwilligungserklärung unterzeichnet hatten. Der Teilnehmer kann jederzeit von der Studie zurücktreten. Der Teilnehmer dieser Studie erfüllt alle in Tabelle 1 aufgeführten Ein- und Ausschlusskriterien.
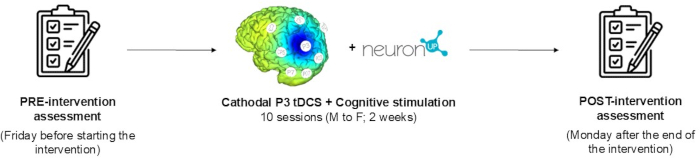
Abbildung 1: Zeitleiste des Protokolls. Alle Phasen der Studie werden beschrieben: Baseline-Assessment, detaillierte Beschreibung der Intervention und Bewertung nach der Intervention. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Ein- und Ausschlusskriterien
- Stellen Sie sicher, dass der Pilotteilnehmer an dieser Studie die folgenden Ein- und Ausschlusskriterien erfüllt (Tabelle 1).
| Einschlusskriterien: |
| Hämorrhagischer oder ischämischer Schlaganfall in der rechten Hemisphäre |
| Schlaganfall 3 bis 12 Monate nach dem Ereignis (unabhängig davon, ob sie zuvor rehabilitiert wurden oder nicht) |
| 18 bis 89 Jahre alt |
| Neuroimaging-Studie |
| Fehlen früherer Schlaganfälle |
| Funktionsfähigkeit, die es dem Patienten ermöglicht, eine Stunde lang sitzen und aktiv zu bleiben (Barthel-Index-Wert größer als 5 im Element der Transfers zwischen Stuhl und Bett; dieses Element kann von 0 bis 15 bewertet werden, wobei 0 völlig abhängig und 15 völlig unabhängig ist). |
| Manuelle Dominanz bei Rechtshändern |
| Neglect-Ergebnisse bei mindestens zwei der Tests, die zur Beurteilung von visuell-räumlicher Neglect durchgeführt wurden |
| Unterschrift der Einverständniserklärung durch den Patienten oder seinen Erziehungsberechtigten |
| Ausschlusskriterien: |
| Dermatologische Probleme (Schuppenflechte, Dermatitis auf der Kopfhaut oder im Gesicht) |
| Vorhandensein von Implantaten oder Metallteilen im Kopf, ausgenommen Füllungen. |
| Herzschrittmacher, Medikamentenpumpen, Stimulatoren (vagal, zerebral, transkutan), ventrikuloperitoneale Shunts oder Aneurysmaclips. |
| Vorhandensein früherer Schlaganfälle |
| Andere neurologische Erkrankungen als Schlaganfall, die in den Einschlusskriterien beschrieben sind |
| Schwere kognitive Beeinträchtigung, die mit der Mini-mentalen Zustandsuntersuchung (MMSE) bewertet wurde (Folstein, 1975), ohne Patienten mit Werten unter 24 (die MMSE-Werte liegen zwischen 0 und 30, wobei 0 eine schwere kognitive Beeinträchtigung und 30 keine kognitive Beeinträchtigung ist) |
| Erhebliche Sprachschwierigkeiten, die kein richtiges Verständnis der Aktivitäten ermöglichen oder den Ausdruck stark einschränken |
| Vorgeschichte von Alkohol- oder Drogenmissbrauch |
| Mittelschwere oder schwere aktive Depression |
| Unkontrollierte medizinische Probleme (Pathologien in der akuten Phase ohne medizinische oder pharmakologische Behandlung mit nachgewiesener Wirksamkeit oder Pathologien mit unmittelbarer Lebensgefahr) |
| Schwangerschaft oder Verdacht auf Schwangerschaft, die zu Beginn der Studie bei Patientinnen im gebärfähigen Alter und mit der Empfehlung der Anwendung von Verhütungsmethoden bis zum Ende des Eingriffs durch einen Schwangerschaftstest überprüft wird |
Tabelle 1: Ein- und Ausschlusskriterien. Der Pilotteilnehmer dieser Studie erfüllt alle in dieser Tabelle beschriebenen Ein- und Ausschlusskriterien.
2. Materialien
HINWEIS: Alle Materialien, die in allen Phasen der Studie verwendet wurden, sind sorgfältig beschrieben.
- tDCS-Gerätesatz
- Verwenden Sie für die Anwendung von tDCS ein 8-Kanal-HD-tDCS-Gerät und die empfohlenen Elektroden (siehe Abbildung 2). Um die Montage zu erleichtern, platzieren Sie eine Kunststoffbasis an der gewünschten Stelle auf der Neoprenkappe (nach dem 10/20 EEG-System). Tragen Sie nach dem Platzieren das leitfähige Gel auf und montieren Sie anschließend die Elektrode.
- Computergestützte Neurorehabilitationsplattform
HINWEIS: Für die Durchführung der kognitiven Stimulation wird eine computergestützte Online-Neurorehabilitationsplattform verwendet (siehe Abbildung 3). Die Plattform ermöglicht die Gestaltung und Anwendung jeder Sitzung des Interventionsprogramms, wobei die Schwierigkeit der Aufgaben individuell angepasst wird.- Legen Sie für jeden Patienten einen neuen Benutzer an, indem Sie auf Benutzerverwaltung klicken und einen neuen Benutzer hinzufügen. Benennen Sie mit einem Lerncode, um das kognitive Programm individuell zu personalisieren.
- Um die Aufgaben zu gestalten, rufen Sie den Arbeitsbereich/Sitzungen/digitale Sitzungen auf und klicken Sie auf das Datum, an dem die Sitzung stattfinden wird.
- Geben Sie den Namen der Sitzung ein, z. B. Sitzung 1. Wählen Sie ein Symbol und eine Farbe für diese Sitzung aus und klicken Sie auf die Schaltfläche Erstellen .
- Klicken Sie auf die Aktivitäten, die in das Programm aufgenommen werden sollen.
- Vergewissern Sie sich, dass die Aufgaben für jede Sitzung auf der linken Seite des Bildschirms angezeigt werden.
- Programmieren Sie in jedem von ihnen die folgenden Parameter: Zeit (7 min) und Start beim letzten Ergebnis (geben Sie nur in den Sitzungen 3-10 JA an).
- Geben Sie an, dass Sie speichern möchten.
- Wiederholen Sie die Schritte 2.2.3-2.2.7 für die Gestaltung jeder der 10 Sitzungen des kognitiven Stimulationsprogramms.

Abbildung 2: tDCS-Gerätesatz. (1) Neoprenkappe, (2) tDCS-Gerät, (3) Elektroden, (4) Kabel, (5) Ohrclip, (6) Leitgel; (7) Spritze zur Verabreichung des leitfähigen Gels unter den Elektroden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
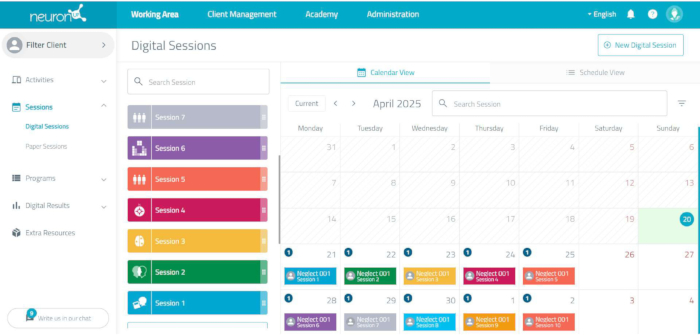
Abbildung 3: Die Sitzungsplanung der Neurorehabilitationsplattform. Wenn Sie auf jede Sitzung klicken, werden die Aufgaben angezeigt, einschließlich der Dauer jeder Aufgabe und der Gesamtdauer der Sitzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Beschreibung des Bewertungsprotokolls: Neuropsychologische und funktionelle Beurteilung vor der Intervention:
HINWEIS: Sobald der Teilnehmer die Einverständniserklärung unterschrieben hat, wird eine neuropsychologische und funktionelle Bewertung durchgeführt. Die Auswertung findet am Freitag vor Beginn des Stimulationsprogramms statt und dauert 50 Minuten. Während dieser Sitzung wird die allgemeine kognitive Leistungsfähigkeit bewertet, und es werden neuropsychologische Tests durchgeführt, die sich auf die Bewertung von Aufmerksamkeitsprozessen und hemiräumlichem Neglect konzentrieren, zusammen mit Funktionsskalen. In einer Informationsveranstaltung vor der ersten Auswertung erhält der Teilnehmer alle notwendigen Informationen über das Ziel der Studie, den Ablauf, die Sitzungsdauer und mögliche Nebenwirkungen. Eine unterschriebene Einverständniserklärung wird eingeholt, bevor mit der Bewertung und Intervention fortgefahren wird. Der Teilnehmer wird auch über die Möglichkeit informiert, jederzeit von der Studie zurückzutreten.
- Mini-Durchführung der psychischen Zustandsuntersuchung (MMSE) (5 min)
HINWEIS: Eine einfache strukturierte Skala. Es erhält maximal 30 Punkte, und die Elemente sind in 5 Abschnitte unterteilt, in denen Orientierung, unmittelbares Gedächtnis, Aufmerksamkeit und Berechnung, verzögertes Gedächtnis, Sprache und Konstruktion bewertet werden. Die Punktzahlen reichen von 0 bis 30 Punkten, wobei der Cut-off-Punkt bei 24 liegt; Die Werte unter 24 deuten auf eine kognitive Beeinträchtigung hin.- Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen. Überprüfen Sie, ob die Gesamtpunktzahl ≥24 Punkte beträgt, um fortzufahren.
- Durchführung des Linienbisektionstests (5 min)
HINWEIS: Achtzehn Zeilen werden in einem Blatt im DIN-A4-Format dargestellt, das in 3 Sätze à 6 unterteilt ist: ein Satz befindet sich hauptsächlich links auf dem Papier, einer in der Mitte des Papiers und einer hauptsächlich rechts auf dem Papier. Die Patienten werden gebeten, die Mittelpunkte jeder Linie zu markieren. Die Abweichung der Markierung des Patienten von der wahren Mitte der Linie wird für jede Linie gemessen und für die 18 Linien gemittelt.- Platzieren Sie die Aufgabe zentriert vor dem Teilnehmer, und zeigen Sie auf dem Blatt die rechte und linke Seite des Teilnehmers an. Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Durchführung des Bells-Tests (5 min)
HINWEIS: Ein Instrument zur Bewertung des horizontalen visuellen Scannens in Gegenwart von Distraktoren. Die Aufgabe bestand darin, glockenförmige Figuren zu identifizieren, die halb zufällig angeordnet waren. Diese wurden in sieben vertikalen Spalten mit jeweils fünf Glocken dargestellt. Was ihre Platzierung auf dem Blatt anbelangt, so erschienen links drei Spalten, eine in der Mitte und drei rechts.- Platzieren Sie die Aufgabe zentriert vor dem Teilnehmer, und zeigen Sie auf dem Blatt die rechte und linke Seite des Teilnehmers an. Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Bilderzeichnung Subtests aus der Testdurchführung in Barcelona (5 min)
HINWEIS: Es besteht aus einer Kopie von 6 Figuren: Kreis, Quadrat, Dreieck, Kreuz, Würfel und Haus. Der Zeitpunkt der Ausführung wird kontrolliert. Jede Figur wird wie folgt bewertet: 3 Punkte für perfekte Wiedergabe, 2 Punkte für diskrete Änderung, 1 Punkt für moderate Änderung, 0 Punkte für schwerwiegende Änderungen. Die maximale Punktzahl beträgt 18. Er wird mit 3, 2 oder 1 Punkt belohnt, je nachdem, wie viel Zeit für die Ausführung aufgewendet wurde.- Platzieren Sie die Aufgabe zentriert vor dem Teilnehmer und zeigen Sie auf die angezeigten Bilder. Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Absage Subtests von der Testverwaltung in Barcelona (5 min)
- Platzieren Sie die Aufgabe zentriert vor dem Teilnehmer, und zeigen Sie auf dem Blatt die rechte und linke Seite des Teilnehmers an. Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Ziffernspanne Vorwärts- und Rückwärtsverabreichung (5 min).
- Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Verwalten Sie zuerst die Aufgabe mit der direkten Ziffer. Zweitens, verwalten Sie als Nächstes die Aufgabe mit den inversen Ziffern.
- Kurzer Test der Aufmerksamkeitsgabe (BTA) (5 min)
- Verwalten Sie den ersten Teil der Aufgabe verbal (zählen Sie die Zahlen, die in der Sequenz erscheinen). Wenden Sie unmittelbar danach den zweiten Teil des Tests an (zählen Sie die Buchstaben, die in der Sequenz erscheinen)
- Erlauben Sie nicht die Verwendung von Notizen oder das Zählen mit den Fingern.
- Durchführung eines Gesichtstests (5 min)
- Zeigen Sie das Gesichtstestblatt vor. Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Aktivieren Sie die Stoppuhr und beenden Sie die Aufgabe nach 3 Minuten. Zählen Sie die Anzahl der korrekt markierten Stimuli.
- Durchführung eines motorfreien visuellen Wahrnehmungstests (MVPT-4) (15 min)
HINWEIS: Der Multiple-Choice-Test mit 36 Elementen bewertet 5 Unterdimensionen der visuell-räumlichen Vernachlässigung: visuelle Unterscheidung, Abbildungs-Po-Diskriminierung, räumliche Beziehung, visuelle Schließung und visuelles Gedächtnis. Verschiedene Parameter werden verwendet, um das Verhalten der linken Reaktion zu quantifizieren (Links/Rechts-Reaktionsverhalten, Bruttowert, Links/Rechts-Leistung und Zeit der Verarbeitung der visuellen Wahrnehmung). Die Werte für linksseitige Reaktionen reichen von 0 bis 21, wobei niedrigere Werte auf einen schwereren visuell-räumlichen Neglect hinweisen.- Legen Sie das Hausaufgabenheft vor den Patienten. Erklären Sie dem Teilnehmer den Test und lassen Sie ihn die Testanweisungen befolgen.
- Funktionswaagen
HINWEIS: Führen Sie Interviews mit Patienten und Familienmitgliedern/Betreuern durch, um den Funktionsstatus des Patienten und die Auswirkungen der Vernachlässigung auf die Aktivitäten des täglichen Lebens zu erfahren.- Geben Sie dem Familienmitglied oder der primären Bezugsperson die Barthel-Index-Skala (5 Minuten) und notieren Sie die Antworten auf dem Antwortbogen.
HINWEIS: Der Barthel-Index misst die Fähigkeit einer Person, zehn grundlegende Aktivitäten des täglichen Lebens auszuführen, und erhält eine quantitative Schätzung ihres Grades an Unabhängigkeit. - Verabreichen Sie dem Familienmitglied oder der primären Bezugsperson die Catherine-Bergego-Skala (CBS) (5 Minuten) und notieren Sie die Antworten auf dem Antwortbogen.
HINWEIS: Dieser Fragebogen basiert auf der direkten Beobachtung der Leistung des Patienten in 10 klinisch simulierten realen Situationen, einschließlich Aufgaben wie Körperpflege, Anziehen und Rollstuhlnutzung. Die Einschätzung des Patienten wird mit der eines Familienmitglieds / einer primären Bezugsperson verglichen. Dieser Fragebogen ergibt eine Punktzahl zwischen 0 und 30, wobei höhere Punktzahlen einen größeren Schweregrad der visuell-räumlichen Vernachlässigung widerspiegeln. .
- Geben Sie dem Familienmitglied oder der primären Bezugsperson die Barthel-Index-Skala (5 Minuten) und notieren Sie die Antworten auf dem Antwortbogen.
4. Beschreibung des Interventionsprotokolls
- Konfiguration des Interventionsgeräts
HINWEIS: Stellen Sie die Parameter der HD-tDCS-Stimulation in der Software ein. Tage vor Beginn des Eingriffs muss das Gerät mit den Parametern programmiert werden, die bei dem Eingriff angewendet werden sollen, d.h. Dauer, Intensität, Polarität, Zustand (aktiv vs. Schein), Montage, Art der Elektroden, Stimulationsstelle, Positionen der zurückgegebenen Elektroden und Prozentsatz der elektrischen Rückkehr zu jeder einzelnen Elektrode (siehe Punkt 5). Vergewissern Sie sich, dass der Akku des Geräts für die gesamte Sitzung ausreicht.- Öffnen Sie die Software, wählen Sie Protokoll-Editor aus, und fügen Sie dann ein neues Protokoll hinzu.
- Geben Sie den Namen des Protokolls ein. Legen Sie die Dauer der Rampe fest: Schritte: (links).
- Bestätigen Sie die Rampe und die Gesamtstimulationszeit. Zeigen Sie Ramp-up: 30 und Ramp-down: 30 an.
- Geben Sie im Abschnitt über die Gesamtstimulationsdauer 20 Minuten an. Stellen Sie die Stimulations- und Elektrodeneinstellungen ein: Design (rechts).
- Stellen Sie die Polarität der Stimulation in kathodal ein. Richten Sie jede Elektrode unabhängig voneinander ein. Beginnen Sie mit der aktiven Elektrode P3.
- Wählen Sie die Elektrode P3 aus und ziehen Sie sie in das Feld auf der rechten Seite. Wählen Sie Stimulation und Kathodal. Wählen Sie 2000 μA.
- Wählen Sie aus und ziehen Sie nach links, und verteilen Sie die restlichen Elektroden nacheinander. In diesen Fällen handelt es sich bei allen um Rückführelektroden und führt die gleiche Aktion aus, indem sie den prozentualen Rücklauf in jeder Elektrode angibt.
HINWEIS: Es ist wichtig zu beachten, dass die Summe des Renditeprozentsatzes 100 ergeben muss. In dieser Studie betrugen die Renditeprozentsätze CP1, PO3, PO7, P7, CP5, C3: 10 % und PZ: 40 % (siehe Abbildung 4 und Abbildung 5). Diese Montage soll die pathologische Hyperaktivierung des hinteren parietalen Kortex in der Hemisphäre kontralateral der Läsion reduzieren. - Klicken Sie auf die Schaltfläche Fertigstellen , sobald alle Schritte abgeschlossen sind.
- Beurteilung des Patienten vor der Intervention
- Allgemeine staatliche Bewertung.
- Beurteilen Sie vor und nach jeder tDCS-Sitzung den Allgemeinzustand, indem Sie die folgenden Fragen stellen: Fühlen Sie sich gut? Haben Sie Kopfschmerzen? Haben Sie Nackenschmerzen? Haben Sie gestern oder heute Alkohol getrunken? Haben Sie gestern oder heute Drogen genommen? Haben Sie in den letzten 5 Stunden Kaffee, Tee oder Schokolade konsumiert? Hast du letzte Nacht gut geschlafen? Wann haben Sie das letzte Mal in Stunden gegessen?
- Beurteilen Sie die visuellen Analogskalen (VAS) für Müdigkeit und Stimmung.
- Beurteilen Sie den Grad der geistigen Müdigkeit und Stimmung mit zwei selbst verabreichten VAS. Bitten Sie den Teilnehmer als Antwort auf diese Fragen, eine Punktzahl zwischen 1 und 10 zu geben, die sich darauf bezieht, wie er sich in Bezug auf die Fragen fühlt: Wie müde bist du gerade?, wobei 1 bedeutet, überhaupt nicht müde, 10 bedeutet sehr müde und Wie ist deine Stimmung gerade?, wobei 1 sehr traurig und 10 sehr glücklich bedeutet.
- Allgemeine staatliche Bewertung.
- Hochauflösende tDCS-Montage
- Bevor Sie mit der Montage des tDCS-Geräts beginnen, überprüfen Sie, ob alle erforderlichen Materialien verfügbar sind und ob das tDCS-Gerät über genügend Akku verfügt, um die Stimulationssitzung durchzuführen.
- Unterer Teil der Elektrodenplatzierung aus Kunststoff
- Wählen Sie in der Neoprenkappe die folgenden Positionen: Platzieren Sie die aktive Kathodenelektrode auf P3; Platzieren Sie die Rücklaufelektroden an C3, CP5, CP1, Pz, PO3, PO7 und P7 (siehe Abbildung 5 und Abbildung 6).
- Platzieren Sie den unteren Teil der Elektrode in jedem der ausgewählten Bereiche der Kappe. Setzen Sie die Kappe auf den Kopf des Teilnehmers und stellen Sie Cz basierend auf den zuvor durchgeführten Messungen ein.
- Platzierung der tDCS-Neoprenkappe
- Setzen Sie den Teilnehmer in eine bequeme Position auf einem Stuhl.
- Setzen Sie die Neoprenkappe auf (siehe Abbildung 6) und wählen Sie die Größe, die am besten zum Kopf des Motivs passt. Vermeiden Sie die Auswahl einer großen Kappe, da sie eng am Kopf anliegen muss. Passen Sie die Kappe mit dem Stirnband an, bis sie eng am Kopf anliegt.
- Lokalisieren Sie den Cz-Punkt und die Stimulationszonen des Protokolls.
- Messen Sie den Abstand zwischen Nasion und Inion sowie zwischen den präaurikulären Punkten mit einem Messgerät. Positionieren Sie den Punkt Cz in der Mitte beider Positionen.
- Elektrisch leitfähige Gelplatzierung
- Trennen Sie die Haare, die sich unter der Elektrode befinden, von der Stimulationsstelle. Sorgen Sie für einen guten Kontakt zwischen der Elektrode und der Haut; Verwenden Sie einen länglichen Gegenstand, mit dem die Haare aus dem Inneren der Elektroden entfernt werden können, ohne die Position der Kappe zu verändern, die zuvor gemessen wurde.
- Stellen Sie sicher, dass die Kopfhaut ohne weitere Vorbereitungen trocken ist. Haarnadeln oder andere Metallteile (Stirnbänder, Haarspangen usw.) entfernen.
- Reinigen Sie die Haut niemals mit Alkohol, da dies bei tDCS zu Abrieb führen kann.
- Führen Sie mit einer Spritze mit einer abschließenden Kunststoffspitze eine ausreichende Menge elektrisch leitfähiges Gel an die Basis jeder Elektrode ein.
ACHTUNG: Es darf nur elektrisch leitfähiges Gel verwendet werden; Verwenden Sie niemals Wasser oder Kochsalzlösung in dieser Art von Elektrode, da dies Abrieb verursachen kann. - Entfernen Sie so viele Haare wie möglich mit Hilfe der Kunststoffspitze der Spritze.
- Impedanzprüfung
HINWEIS: Die Taste "Impedanzprüfung " misst die Impedanz aller Aktiv- und Rückkanale vor der Stimulation. Es muss vor Beginn eines Stimulationsprotokolls verwendet werden. Die Impedanzpegel werden als farbcodierte Balken unter jedem Symbol des Stimulationskanals angezeigt, wobei Grün akzeptable Werte anzeigt. Das Stimulationsprogramm kann erst gestartet werden, wenn alle Kanäle grün leuchten. Während der Stimulation wird die Impedanz jede Sekunde überwacht, und wenn eine Elektrode zu irgendeinem Zeitpunkt 20 kW überschreitet, wird das Protokoll automatisch unterbrochen.- Schalten Sie das Gerät ein. Öffnen Sie die tDCS-Gerätesoftware auf dem Computer.
- Wählen Sie die Verbindung aus, die mit dem Gerät verwendet wird. Wählen Sie die Option Nach Gerät suchen.
- Wählen Sie Impedanz prüfen.
- Wenn alle Elektroden grün erscheinen, drücken Sie die Play-Taste und das Stimulationsprogramm wird gestartet.
- Wenn nach Abschluss der Impedanzprüfung eine Elektrode rot erscheint, tragen Sie erneut Gel auf diese Elektrode auf, entfernen Sie alle Haare und überprüfen Sie die Impedanz erneut, bis alle Elektroden grün bleiben.
- Computergestützte Neurorehabilitationsplattform
HINWEIS: Gestalten Sie die 10 Interventionssitzungen im Vorfeld auf der Neurorehabilitationsplattform und bereiten Sie die Plattform dafür vor (siehe Punkt 2.2). Jede Sitzung besteht aus vier Aufgaben, die jeweils 7 Minuten dauern. Die Aufgaben, die in den einzelnen Sitzungen enthalten sind, sind in Tabelle 2 aufgeführt. Bei der Planung jeder Sitzung ist es notwendig, unter den Parametern jeder Aufgabe auszuwählen: Zeitdauer jeder Aufgabe: 7 Minuten, Gesamtdauer der Sitzung (28 Minuten), Sprache, Benutzerbewertung nach jeder Aktivität einbeziehen, Bestätigung des Endes jeder Aktivität am Ende jeder Aufgabe und Fehlen der Schaltfläche "Kontinuierlich" in jeder Aufgabe, da die Aufgaben nacheinander ausgeführt werden müssen (Abbildung 7).- Greifen Sie auf die computergestützte Neurorehabilitationsplattform zu.
- Rufen Sie die zuvor geplante Sitzung auf (siehe Schritt 2.2) und drücken Sie die Schaltfläche Start. Präsentieren Sie vier verschiedene Stimulationsaktivitäten von jeweils 7 Minuten nacheinander.
HINWEIS: Die kognitive Stimulationssitzung hat eine Gesamtdauer von 30 Minuten. Nach Ablauf der gesamten Simulationszeit (30 Minuten) werden die Aktivitäten gestoppt. Die kognitive Stimulation wird nach dem Ende der tDCS-Stimulation noch 5 Minuten fortgesetzt.
- tDCS-Stimulationsprogramm (20 min)
- Aktivieren Sie den Start der tDCS-Stimulation, indem Sie die Play-Taste auf der tDCS-Steuerungssoftware 4 Minuten und 20 s nach dem Start der computergestützten Neurorehabilitationsaufgabe drücken.
- Nach 30 s aufsteigender Rampe beginnt die aktive Stimulation oder Scheinstimulation. Wenden Sie die tDCS-Stimulation (20 min) gleichzeitig auf die computergestützte Neurorehabilitationsaufgabe an. Nach 20 Min. beginnt eine Abstiegsrampe, die 30 s dauert. Nach dieser Zeit hört die tDCS-Stimulation auf.
- Beurteilung des Patienten nach dem Eingriff.
- Fragebogen zu Nebenwirkungen.
- Wenden Sie eine Adaption des Fragebogens der Empfindungen im Zusammenhang mit der transkraniellen Elektrostimulation39 (Tabelle 3) mit 9 Fragen über das Vorhandensein verschiedener Symptome wie Kopfschmerzen, Brennen auf der Kopfhaut oder Juckreiz oder Kribbeln unter den Elektroden an.
- Bewerten Sie in jedem Item den Schweregrad des Symptoms auf einer Skala von 1-4 und seine Beziehung zu tDCS auf einer Skala von 1-5 (siehe Tabelle 3).
- Visuelle Analogskalen für Müdigkeit und Stimmung
- Es wird dieselbe Skala verabreicht, die vor der Stimulationssitzung verwendet wurde, um die Müdigkeit und die Stimmung nach der Intervention zu beurteilen (siehe Schritt 4.2.2.).
- Fragebogen zu Nebenwirkungen.
Abbildung 4: Repräsentative HD-tDCS-Montage. Die blaue Farbe zeigt die Position der Elektroden nach dem internationalen 10-20-System für die Elektrodenplatzierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
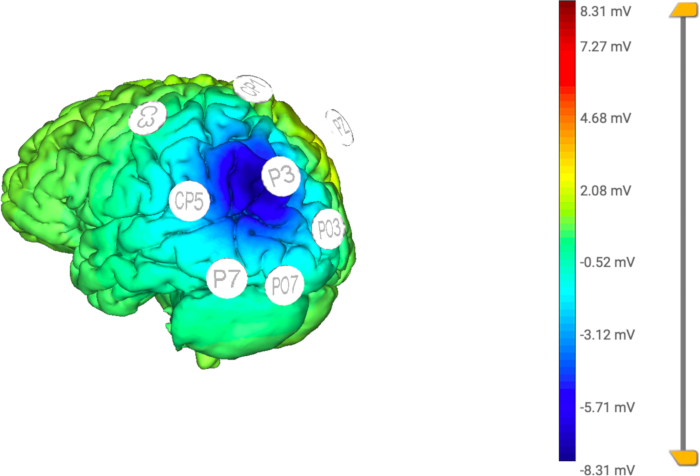
Abbildung 5: Computermodell des angewandten HD-tDCS. Die Verteilung des elektrischen Stroms wird in der zentralen (aktiven) Elektrode (P3) fokussiert, wodurch die Stimulation durch die Rückelektroden (C3, CP5, CP1, Pz, PO3, PO7, P7) auf einen bestimmten Bereich begrenzt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Neoprenkappe für die HD-tDCS-Stimulation. Die Kappe hat Löcher zum Platzieren von Elektroden nach dem 10/20-Klassifizierungssystem für EEG. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Planen von Aufgaben. Parameter, die bei der Programmierung jeder Aufgabe in der Plattform für computergestützte Neurorehabilitation ausgewählt werden müssen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Block | Sitzung | Aufgaben der Neurorehabilitationsplattform | Dauer |
| Ich | 1, 3, 6 und 8 | · Versteckte Buchstaben | 7 Minuten für jede der Aufgaben. |
| · Summe der Zahlen | |||
| · Buchstabensuppe | |||
| · Passende Formen finden | |||
| II | 2, 4, 7 und 9 | · Kopieren von Buchstabenmatrizen | |
| · Der kleine Vielfraß | |||
| · Fehlende Nummern finden | |||
| · Texte vergleichen | |||
| III | 5 und 10 | · Textvergleich | |
| · Summe der Zahlen | |||
| · Der kleine Vielfraß | |||
| · Suche nach aufeinanderfolgenden Reizen |
Tabelle 2: Aufgaben, die in jeder der 10 Interventionssitzungen enthalten sind. Alle Aufgaben sind in der computergestützten Neurorehabilitationsplattform enthalten.
| Haben Sie eines der folgenden Empfindungen oder Symptome? | Abstufung des Schweregrads (1–4) | Falls vorhanden: Beziehung zu tDCS? |
| 1-Abwesend | 1-Keine | |
| 2-Mild | 2-Fernbedienung | |
| 3-Mäßig | 3-Möglich | |
| 4-Schwer | 4-Wahrscheinlichkeit | |
| 5-Definitiv | ||
| Kopfschmerz | ||
| Nacken- oder Gebärmutterhalsschmerzen | ||
| Schmerzen auf der Kopfhaut | ||
| Verbrennung der Kopfhaut | ||
| Empfindungen unter der Elektrode (Kribbeln, Juckreiz, Brennen, Schmerzen) | ||
| Hautrötungen | ||
| Taubheit | ||
| Konzentrationsproblem | ||
| Starke Stimmungsschwankungen | ||
| Sonstiges (bitte angeben) | ||
| Zusätzliche Kommentare | ||
Tabelle 3: Fragebogen zu tDCS-Nebenwirkungen. Eine Liste der Nebenwirkungen, die nach der Anwendung der Stimulation auftreten können, wird bereitgestellt. Das Vorhandensein oder Nichtvorhandensein jeder dieser Effekte wird unmittelbar nach der Anwendung der Stimulation aufgezeichnet. Adaption des Fragebogens der Empfindungen im Zusammenhang mit der transkraniellen elektrischen Stimulation39.
5. tDCS-Entfernung
- Sobald das tDCS-Stimulationsprogramm und die computergestützten Neurorehabilitationsaufgaben abgeschlossen sind, schließen Sie die tDCS-Software.
- Trennen Sie das tDCS-Gerät.
- Entfernen Sie das Kabel, das das tDCS mit den Elektroden verbindet.
- Entfernen Sie die Kappe vom Kopf des Patienten.
- Entfernen Sie die Elektroden von der Neoprenkappe.
- Reinigen Sie die Haare des Patienten.
- Entfernen Sie nach dem Entfernen der Neoprenkappe das restliche Gel mit Hilfe eines Papiers/Handtuchs und waschen Sie es mit Wasser.
- Reinigen Sie die tDCS-Neoprenkappe und die Elektrode.
- Waschen Sie die Kappe nach jeder Sitzung mit Wasser, um das restliche Gel zu entfernen, und lassen Sie es trocknen.
- Waschen Sie die Elektroden mit Wasser, vermeiden Sie Reibungen und trocknen Sie sie vorsichtig mit einem trockenen Tuch ab. Verwenden Sie niemals Seife, Alkohol oder andere Produkte zum Reinigen der Elektroden.
6. Neuropsychologische und funktionelle Beurteilung nach der Intervention
- Am Montag, nach Abschluss der Intervention, gehen Sie wie in der Vorevaluation vor und führen Sie die gleichen Evaluationsaufgaben und Fragebögen durch (siehe Abschnitt 3).
Ergebnisse
Primäres Ziel der vorliegenden Studie ist es, ein tDCS-Interventionsprotokoll für eine parallele, randomisierte, dreifach verblindete klinische Studie zu beschreiben. Um die Durchführbarkeit der Intervention zu untersuchen, wurde das Protokoll auf einen einzelnen Teilnehmer angewendet; Die Ergebnisse werden in diesem Artikel gezeigt.
Wir wandten das vollständige Interventionsprotokoll auf einen 57-jährigen Mann mit hohem Bildungsniveau (Journalismus-Abschluss) an, der neun Monate zuvor einen Schlaganfall in den rechten Basalganglien erlitten hatte und alle Einschlusskriterien für die Teilnahme an der Studie erfüllte.
Die Ergebnisse vor und nach der Intervention (siehe Tabelle 4 und Abbildung 8) sind für alle durchgeführten Aufgaben dargestellt. In der Bewertung nach der Intervention wurden bei 6 der 13 gemessenen Variablen quantitative Veränderungen beobachtet, von denen 4 in direktem Zusammenhang mit der Vernachlässigung stehen.
| Veranlagungen | ||
| Vor der Intervention | Nach der Intervention | |
| MMSE-Test | 29 | 29 |
| Glocken Test | 21 | 25* |
| Test zur Stornierung | 24 | 28* |
| Prüfung der Zeichnungen | 12 | 12 |
| Bisektions-Test | 19.95 | 3.47* |
| BTA-Prüfung | 11 | 9 |
| Gesichter Treffer | 11 | 9 |
| Auftritte von Fehlern | 3 | 2* |
| Test mit direkten Ziffern | 11 | 10 |
| Test auf inverse Ziffern | 9 | 8 |
| Motorfrei | 26 | 29* |
| Barthel-Test | 25 | 30* |
| CBS | 20 | 20 |
Tabelle 4: Ergebnisse der Bewertungen vor und nach der Intervention. Die Ergebnisse der neuropsychologischen und funktionellen Diagnostik vor und nach der Intervention werden in Direct Scores dargestellt. *Quantitative Leistungsverbesserungen bei der Bewertung nach der Intervention im Vergleich zum Ausgangswert. **Werte, die weiter von Punktzahl 0 entfernt sind, weisen auf eine schlechtere Leistung und eine größere Vernachlässigung hin.
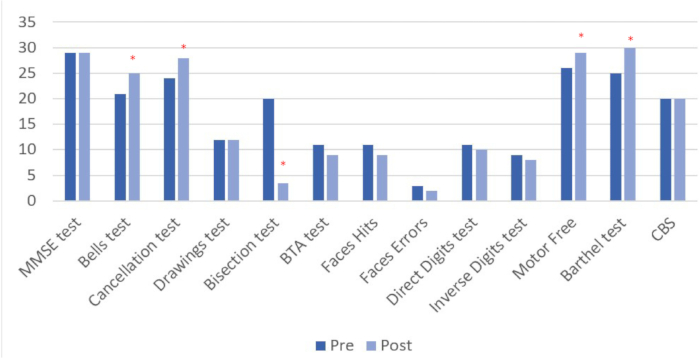
Abbildung 8: Ergebnisse der Bewertung vor und nach der Intervention. Höhere Werte deuten auf eine positive Veränderung hin, außer beim Linienhalbionstest, bei dem die Verbesserung durch niedrigere Ergebnisse dargestellt wird. Die Ergebnisse werden in direkten Ergebnissen angezeigt. *Quantitative Leistungsverbesserungen bei der Bewertung nach der Intervention im Vergleich zum Ausgangswert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die prozentuale Verbesserung zwischen der Beurteilung vor und nach der Behandlung wurde berechnet. Eine klinische Verbesserung wurde in den spezifischen hemispatialen Neglect-Tests beobachtet: Glockentest, Auslöschungstest, Linienhalbierung, visuell-motorischer Wahrnehmungstest und Barthel-Index-Skala. Auf der anderen Seite wurden negative Veränderungen bei anderen Aufmerksamkeitsaufgaben (Fingertest, kurzer Aufmerksamkeitstest, Gesichtstest) beobachtet. Schließlich traten keine Änderungen in der MMSE, der Kopie von Zeichnungen oder der funktionalen Catherine-Bergego-Skala (CBS) auf (siehe Abbildung 9).
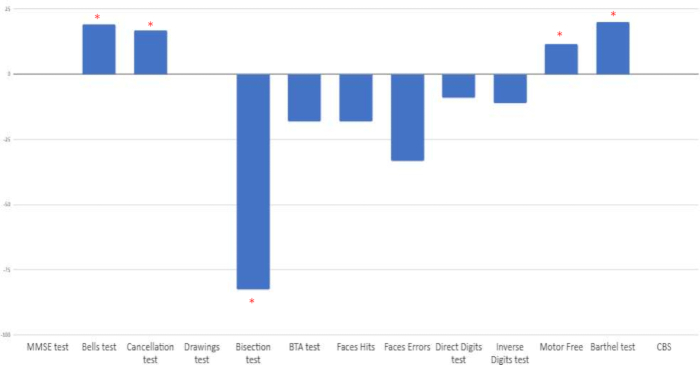
Abbildung 9: Prozentuale Veränderung zwischen der Bewertung zu Studienbeginn und nach der Intervention. Die Ergebnisse werden in Prozent angezeigt. Positive Ergebnisse deuten auf eine positive Veränderung hin, außer beim Linienhalbionstest, bei dem die Verbesserung durch negative Ergebnisse dargestellt wird. *Prozentsatz der positiven Verbesserung beim Vergleich von Bewertungen vor und nach der Intervention. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Studienverfahren wurden in geräumigen Räumen durchgeführt, die für die korrekte Durchführung der Evaluations- und Interventionssitzungen und die Einhaltung von Sicherheits- und Hygienemaßnahmen ausgestattet waren.
Was den Patienten betrifft, so zeigte er in keiner der Vor- und Nachuntersuchungen Müdigkeit, so dass es in keiner von ihnen notwendig war, sich auszuruhen. Die Therapie wurde von der Patientin als unterhaltsam und anregend bewertet, was die Einhaltung der Behandlung und die aktive Zusammenarbeit während des gesamten Eingriffs verbesserte. Daher wird davon ausgegangen, dass das Protokoll eine hohe Durchführbarkeit aufweist, und wir werden die Studie nach dem etablierten Verfahren fortsetzen.
In Bezug auf Beschwerden und Nebenwirkungen trat bei den Teilnehmern keine mittelschweren oder schweren Nebenwirkungen im Zusammenhang mit der Anwendung von tDCS auf.
Diskussion
Hemispatial Neglect ist eine häufige kognitive Folge eines Schlaganfalls, und wenn er anhält, wirkt er sich tendenziell negativ auf die Wirksamkeit des Rehabilitationsprozesses aus. Die Wirksamkeit und Effizienz der verfügbaren Therapieansätze kann durch die Einbeziehung nichtinvasiver Hirnstimulationstechniken in die Neurorehabilitation verbessert werden, wobei nach einem synergistischen Effekt gesucht wird 40,41. Auf diese Weise können wir mit Hilfe der tDCS die Wirksamkeit der konventionellen Intervention steigern und eine bessere Genesung, kürzere Rehabilitationszeiten und bessere funktionelle Ergebnisse bei der Rehabilitation des Schlaganfallpatienten im Vergleich zur konventionellen Intervention in Isolation erzielen. Die Forschung über das Potenzial von tDCS bei neurologischen und psychiatrischen Erkrankungen hat in den letzten zehn Jahren exponentiell zugenommen 42,43,44,45,46,47,48,49.
Darüber hinaus sind die Kosten für tDCS erschwinglich und das Gerät ist tragbar, was es hochgradig skalierbar macht und seine Anwendung sowohl in Ambulanzen als auch in Krankenhäusern mit der erforderlichen Berufsausbildung ermöglicht50.
In vier der dreizehn durchgeführten Tests (Glockentest, Auslöschungstest, Linienhalbierung, visueller motorischer Wahrnehmungstest) haben wir nach der Behandlung eine Verbesserung festgestellt. Die Tests, bei denen wir diese positiven Veränderungen beobachtet haben, hängen mit der Leistung zusammen, die mit hemiräumlichem Neglect verbunden ist. Auf der anderen Seite wurde eine Stabilisierung bei der Durchführung einiger Tests in Bezug auf die allgemeine kognitive Leistungsfähigkeit, Aufmerksamkeitsprozesse und/oder das Arbeitsgedächtnis (MMSE, Zeichnungen, CBS) beobachtet. Bei einigen anderen Aufgaben (BTA, Flächen, direkte und inverse Ziffern) ist eine Verringerung zu beobachten.
In Bezug auf die Funktionsskalen gab es Hinweise auf Verbesserungen, die von der primären Pflegeperson berichtet und anhand der Barthel-Index-Skala bewertet wurden. Die CBS-Funktionsskala, die in direktem Zusammenhang mit den Auswirkungen von Vernachlässigung auf das tägliche Leben steht, wurde ebenfalls verabreicht, und in diesem Fall wurde keine Veränderung festgestellt, die im Vergleich zur vorherigen Bewertung stabil blieb. In dieser Studie fanden wir die Vorteile der kombinierten Behandlung für einige kognitive Bereiche, aber nicht für andere. Diese Ergebnisse stimmen mit der Idee überein, dass die Behandlung für bestimmte Aufmerksamkeitsbereiche vorteilhafter sein könnte 51,52,53,54,55,56,57. Einige Studien zeigen, wie spezifische tDCS-Protokolle dauerhafte Veränderungen der kortikalen Erregbarkeit und Aktivität induzieren58. Um die Aufrechterhaltung der Änderungen über eine Woche hinaus analysieren zu können, wäre es ratsam, nach einem längeren Zeitraum 53,54,55,56,57 eine erneute Bewertung durchzuführen.
Die hochauflösende oder hochauflösende tDCS, die in dieser Studie verwendet wird, ist eine technisch verbesserte Version der tDCS, die es ermöglicht, die Fokalität der Stimulation zu erhöhen, indem ein Ring von Rückkehrelektroden um eine Anode oder eine Kathode verwendet wird, um die kortikale Erregbarkeit auf eine viel fokalere Weise zu erhöhen bzw. zu verringern59. Basierend auf dieser hohen Fokalität und der bisherigen Verträglichkeit und Wirkung der HD-tDCS-Studie von Borckardt et al.60 hat der Einsatz von HD-tDCS in den letzten Jahren zugenommen.
Modellierungsstudien deuten darauf hin, dass diese Elektrodenkonfiguration die höchste Intensität des elektrischen Feldes (EF) unterhalb der Zielelektrode erzeugt, wobei der Hirnstromfluss durch den Radius des 4 x 1-Ringaufbaus begrenzt ist und somit ein größeres elektrisches Feld am ausgewählten Ziel im Vergleich zur herkömmlichen Elektrodenplatzierung 60,61,62 entsteht . Die Rückkehrelektroden tragen zur Isolierung des Zielbereichs bei, was eine gezieltere Hirnstimulation ermöglicht und eine länger anhaltende Wirkung als bei herkömmlichen tDCS63 ermöglicht.
Darüber hinaus hat HD-tDCS laut einigen Studien eine länger anhaltende Wirkung. In letzter Zeit hat die klinische Forschung diesem Protokoll Aufmerksamkeit geschenkt. Unseres Wissens wurden nur sechs Studien mit HD-tDCS bei neurologischen Erkrankungen durchgeführt, drei randomisierte Kontrollstudien, zwei offene Berichte und ein Fallbericht (siehe Review49).
Obwohl es keinen vollständigen Konsens über die anatomischen Bereiche gibt, die mit hemiräumlichem Neglect zusammenhängen, scheint es eine gewisse Übereinstimmung in einigen spezifischen Bereichen zu geben. Der hintere parietale Kortex scheint der Schlüsselbereich der Veränderung 64,65,66 zu sein, und innerhalb dieses Bereichs befinden sich der Gyrus angularis 64,65,67,68,69, der Sulcus intraparietale 64,69,70, der temporoparietale Übergang 69,71 und der Gyrus supramarginalis65,72,73,74.
Angesichts der Tatsache, dass der Vorteil der HD-tDCS im Vergleich zur herkömmlichen tDCS darin besteht, die Präzision des Stimulationsziels zu erhöhen, und basierend auf der Kenntnis einer genauen Lokalisation für das Vorhandensein eines hemiräumlichen Neglects, können wir erwarten, dass die fokale Stimulation im Vergleich zur allgemeineren oder diffuseren Stimulation einen größeren Nutzen bringt. In der Zwischenzeit ist die in neurologischen Studien am häufigsten verwendete Konfiguration 4 x 1 Montage 75,76,77,78,79. In unserer Studie verwendeten wir eine 7 x 1-Konfiguration mit dem Ziel, die Fokalität der Stimulation noch weiter zu erhöhen, da es die erste Studie war, in der diese Montage in der klinischen Rehabilitation von Neglect eingesetzt wurde. Daher müssen weitere Forschungen zu diesem und anderen klinischen Bedingungen durchgeführt werden, um die Überlegenheit oder Wirksamkeit dieser HD-tDCS-Montage gegenüber anderen HD-Montagen und konventionellen tDCS zu bestimmen.
In Bezug auf die Intensität wird in diesem Protokoll 2 mA angewendet, wie in den meisten Studien mit tDCS, unabhängig von der verwendeten Montage oder Konfiguration. Es wäre interessant, das gleiche Protokoll in weiteren Studien mit niedrigeren und höheren Intensitäten zu vergleichen, um die Wirkung verschiedener angewendeter Intensitäten herauszufinden.
Einige nützliche Empfehlungen zur Sicherheit und technischen Fehlerbehebung müssen mit dem aktuellen Protokoll berücksichtigt werden. Bei jedem Patienten, insbesondere aber bei Schlaganfallpatienten, sollten Sicherheitsaspekte gründlich untersucht werden. Obwohl tDCS bei Schlaganfallpatienten sicher und gut verträglich ist80, haben die Patienten und ihre Angehörigen manchmal Zweifel daran. So sollten im Vorfeld verständliche Informationen weitergegeben und mit dem Patienten und den Angehörigen besprochen werden, damit diese das Verfahren verstehen und das Protokoll jederzeit abbrechen können.
Auf der anderen Seite wurde in diesem Protokoll die genaue Lokalisation der Läsion berücksichtigt und aufgezeichnet, da wir bereit sind, die Wirkung des Protokolls auf den hemiräumlichen Neglect nach kortikalen Läsionen (z. B. rechte mittlere Hirnarterie)69 und nach subkortikalen Läsionen (z. B. Basalganglien)81 zu vergleichen. In diesem Zusammenhang ist es von entscheidender Bedeutung, die Wirksamkeit der Technik angesichts der Heterogenität der Läsionsstellen zu bewerten. Insbesondere müssen wir die Unterschiede in der Wirksamkeit zwischen kortikalen und subkortikalen Läsionen analysieren.
In Bezug auf die Schlaganfallphase ist es bei der Anwendung der Stimulation (akut, subakut oder chronisch) wichtig, den Moment zu kennen, in dem der Eingriff am vorteilhaftesten sein kann. In dieser Studie haben wir als Einschlusskriterium 3 bis 12 Monate seit der Verletzung (subakute Phase) verwendet. Eine frühere systematische Übersichtsarbeit konzentrierte sich jedoch auf motorische Aspekte nach einem Schlaganfall, und die Ergebnisse zeigten Verbesserungen in chronischen Phasen, nicht jedoch in der akuten Phase (innerhalb der ersten 3 Tage nach Auftreten der Symptome)82. Weitere Untersuchungen sind notwendig, um die Vorteile von tDCS bei kognitiven Veränderungen nach einem Schlaganfall zu untersuchen und Faktoren zu identifizieren, die ihre optimale Wirksamkeit in verschiedenen Stadien der Genesung vorhersagen.
Der derzeitige Kenntnisstand über die HD-tDCS als Therapieansatz bei neurologischen Erkrankungen unterstützt die Verträglichkeit und klinische Wirksamkeit. Darüber hinaus ist weitere randomisierte kontrollierte Forschung erforderlich, um die optimalen Parameter für jede Krankheit und jeden Patienten herauszufinden und die Wirksamkeit dieser nicht-invasiven Hirnstimulationstechnik bei neurologischen Erkrankungen und darüber hinaus zu ermitteln.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken NeuronUp (www.neuronup.com) für die Unterstützung und selbstlose Mitarbeit in diesem Projekt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 electrode cable | Neuroelectrics | NE017 | |
| Barthel Index | N/A | Mahoney, F. I., Barthel, D. W. Functional evaluation: The Barthel Index. Md State Med J. 14, 61–65 (1965). | |
| Copy of drawings subtest | N/A | https://test-barcelona.com/es/tienda.html | J. Peña Casanova, Programa integrado de exploración neuropsicológica: test Barcelona revisado?: TBR. Barcelona: Masson. |
| Curved Syrenge | Neuroelectrics | NE014 | |
| Electrode Gel | Neuroelectrics | NE016a | |
| Line bisection test | N/A | Schenkenberg, T., Bradford, D. C., Ajax, E. T. Line bisection and unilateral visual neglect in patients with neurologic impairment. Neurology. 30 (5) 509–517 (1980). | |
| Mini-mental state examination (MMSE) | N/A | Folstein, M. F., Folstein, S. E., McHugh, P. R. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 12 (3) 189–198 (1975). | |
| Neoprene headcap | Neuroelectrics | NE019-M | |
| Saline Solution | Neuroelectrics | NE033 | |
| Satrstim Necbox | Neuroelectrics | NE012 | |
| Starstim tES-EEG System | Neuroelectrics | ||
| Teastboard Cable | Neuroelectrics | NE039 | |
| Testboard Head | Neuroelectrics | NE038 | |
| The Bell Test | N/A | https://strokengine.ca/en/assessments/bells-test/ | L. Gauthier, F. Deahault and Y. Joanette, The Bells Test: A quantitative and qualitative test for visual neglect (Vol. 11). |
| The Catherine Bergego Scale | N/A | Azouvi, P. et al. Behavioral assessment of unilateral neglect: study of the psychometric properties of the Catherine Bergego Scale. Arch Phys Med Rehabil. 84 (1) 51–57 (2003). | |
| The motor-free visual perception test (MVPT) | N/A | https://www.wpspublish.com/mvpt-4-motor-free-visual-perception-test-4 | Colarusso, R. P., Hammill, D.D. The Motor Free Visual Perception Test (MVPT-3). Navato, CA: Academic Therapy Publications (2003). |
| USB Bluetooth Dongle | Neuroelectrics | NE031 | |
| USB charging Cable | Neuroelectrics | NE043 | |
| USB Power Adapter & Power Supply Plug | Neuroelectrics | NE013 & NE013a, NE013b, NE013c | |
| USB Stick with Manuals & NIC SW | Neuroelectrics | NE015 |
Referenzen
- Sun, J. -H., Tan, L., Yu, J. -T. Post-stroke cognitive impairment: epidemiology, mechanisms and management. Ann Transl Med. 2 (8), 80(2014).
- Abo, M., et al. comparative study of NEURO versus CIMT in poststroke patients with upper limb hemiparesis: the neuro-verify study. Int J Stroke. 9 (5), 607-612 (2014).
- Mijajlović, M. D., et al. Post-stroke dementia - a comprehensive review. BMC Med. 15 (1), 11(2017).
- Kerkhoff, G., Schenk, T. Rehabilitation of neglect: an update. Neuropsychologia. 50 (6), 1072-1079 (2012).
- Jehkonen, M., et al. Predictors of discharge to home during the first year after right hemisphere stroke. Acta Neurol Scand. 104 (3), 136-141 (2001).
- Buxbaum, L. J., et al. Hemispatial neglect: subtypes, neuroanatomy, and disability. Neurology. 62 (5), 749-756 (2004).
- Nijboer, T. C. W., Kollen, B. J., Kwakkel, G. Time course of visuospatial neglect early after stroke: a longitudinal cohort study. Cortex. 49 (8), 2021-2027 (2013).
- Ringman, J. M., Saver, J. L., Woolson, R. F., Clarke, W. R., Adams, H. P. Frequency, risk factors, anatomy, and course of unilateral neglect in an acute stroke cohort. Neurology. 63 (3), 468-474 (2004).
- Parton, A., Malhotra, P., Husain, M. Hemispatial neglect. J Neurol Neurosurg Psychiatry. 75 (1), 13-21 (2004).
- Stone, S. P., Patel, P., Greenwood, R. J., Halligan, P. W. Measuring visual neglect in acute stroke and predicting its recovery: the visual neglect recovery index. J Neurol Neurosurg Psychiatry. 55 (6), 431(1992).
- Chen, P., Hreha, K., Kong, Y., Barrett, A. M. Impact of spatial neglect on stroke rehabilitation: evidence from the setting of an inpatient rehabilitation facility. Arch Phys Med Rehabil. 96 (8), 1458-1466 (2015).
- Wilkinson, D., Sakel, M., Camp, S. -J., Hammond, L. Patients with hemispatial neglect are more prone to limb spasticity, but this does not prolong their hospital stay. Arch Phys Med Rehabil. 93 (7), 1191-1195 (2012).
- Gammeri, R., Iacono, C., Ricci, R., Salatino, A. Unilateral spatial neglect after stroke: current insights. Neuropsychiatr Dis Treat. 16, 131-152 (2020).
- Muñoz-Marrón, E., Redolar-Ripoll, D., Zulaica-Cardoso, A. New therapeutic approaches in the treatment of neglect: transcranial magnetic stimulation. Rev Neurol. 55 (5), 297-305 (2012).
- Cicerone, K. D., et al. Evidence-based cognitive rehabilitation: systematic review of the literature from 2009 through 2014. Arch Phys Med Rehabil. 100 (8), 1515-1533 (2009).
- Pizzamiglio, L., et al. Cognitive rehabilitation of the hemineglect disorder in chronic patients with unilateral right brain damage. J Clin Exp Neuropsychol. 14 (6), 901-923 (1992).
- Yi, Y., et al. The effect of transcranial direct current stimulation on neglect syndrome in stroke patients. Ann Rehabil Med. 40 (2), 223-229 (2016).
- Fregni, F., Pascual-Leone, A. Technology insight: noninvasive brain stimulation in neurology-perspectives on the therapeutic potential of rTMS and tDCS. Nat Rev Neurol. 3 (7), 383-393 (2007).
- Lefaucheur, J. -P., et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol. 128 (1), 56-92 (2017).
- González-Rodriguez, B., Serradell-Ribé, N., Viejo-Sobera, R., Romero-Muñoz, J. P., Marron, E. M. Transcranial direct current stimulation in neglect rehabilitation after stroke: a systematic review. J Neurol. 269 (12), 6310-6329 (2022).
- Kinsbourne, M. A model for the mechanism of unilateral neglect of space. Trans Am Neurol Assoc. 95, 143-146 (1970).
- Kinsbourne, M. Hemi-neglect and hemisphere rivalry. Adv Neurol. 18, 41-49 (1977).
- Koch, I. Instruction effects in task switching. Psychon Bull Rev. 15 (2), 448-452 (2008).
- Corbetta, M., Kincade, M. J., Lewis, C., Snyder, A. Z., Sapir, A. Neural basis and recovery of spatial attention deficits in spatial neglect. Nat Neurosci. 8 (11), 1603-1610 (2005).
- Hummel, F. C., Cohen, L. G. Noninvasive brain stimulation: a new strategy to improve neurorehabilitation after stroke. Lancet Neurol. 5 (8), 708-712 (2006).
- Miniussi, C., et al. Efficacy of repetitive transcranial magnetic stimulation/transcranial direct current stimulation in cognitive neurorehabitation. Brain Stimul. 1 (4), 326-336 (2008).
- Bornheim, S., Maquet, P., Croisier, J., Crielaard, J., Kaux, J. Motor cortex transcranial direct current stimulation (tDCS) improves acute stroke visuo-spatial neglect: a series of four case reports. Brain Stimul. 11 (2), 459-461 (2018).
- Sunwoo, H., et al. Effects of dual transcranial direct current stimulation on post-stroke unilateral visuospatial neglect. Neurosci Lett. 554, 94-98 (2013).
- Ladavas, E., et al. A-tDCS on the ipsilesional parietal cortex boosts the effects of prism adaptation treatment in neglect. Restor Neurol Neurosci. 33 (5), 647-662 (2015).
- Turgut, N., Miranda, M., Kastrup, A., Eling, P., Hildebrandt, H. tDCS combined with optokinetic drift reduces egocentric neglect in severely impaired post-acute patients. Neuropsychol Rehabil. 28 (4), 515-526 (2018).
- Smit, M., et al. Transcranial direct current stimulation to the parietal cortex in hemispatial neglect: a feasibility study. Neuropsychologia. 74, 152-161 (2015).
- Brem, A. -K., Unterburger, E., Speight, I., Jancke, L. Treatment of visuospatial neglect with biparietal tDCS and cognitive training: a single-case study. Front Syst Neurosci. 8, 180-180 (2014).
- Cappon, D., Jahanshahi, M., Bisiacchi, P. Value and efficacy of transcranial direct current stimulation in the cognitive rehabilitation: a critical review since 2000. Front Neurosci. 10, 157(2016).
- Fan, J., Li, Y., Yang, Y., Qu, Y., Li, S. Efficacy of noninvasive brain stimulation on unilateral neglect after stroke: a systematic review and meta-analysis. Am J Phys Med Rehabil. 97 (4), 261-269 (2018).
- Kashiwagi, F. T., et al. Noninvasive brain stimulations for unilateral spatial neglect after stroke: a systematic review and meta-analysis of randomized and nonrandomized controlled trials. Neural Plast. , (2018).
- Salazar, A. P. S., et al. Noninvasive brain stimulation improves hemispatial neglect after stroke: a systematic review and meta-analysis. Arch Phys Med Rehabil. 99 (2), 355-366 (2018).
- Zebhauser, P. T., Vernet, M., Unterburger, E., Brem, A. -K. Visuospatial neglect-a theory-informed overview of current and emerging strategies and a systematic review on the therapeutic use of noninvasive brain stimulation. Neuropsychol Rev. 29 (4), 397-420 (2019).
- Bikson, M., et al. Safety of transcranial direct current stimulation: evidence based update 2016. Brain Stimul. 9 (5), 641-661 (2016).
- Antal, A., et al. Low intensity transcranial electric stimulation: safety, ethical, legal regulatory and application guidelines. Clin Neurophysiol. 128 (9), 1774-1809 (2017).
- Sathappan, A. V., Luber, B. M., Lisanby, S. H. The dynamic duo: combining noninvasive brain stimulation with cognitive interventions. Prog Neuropsychopharmacol Biol Psychiatry. 89, 347-360 (2019).
- Draaisma, L. R., Wessel, M. J., Hummel, F. C. Noninvasive brain stimulation to enhance cognitive rehabilitation after stroke. Neurosci Lett. 719, 133678(2020).
- David, M. C. M. M., Moraes, A. A., de Costa, M. L., da Franco, C. I. F. Transcranial direct current stimulation in the modulation of neuropathic pain: a systematic review. Neurol Res. 40 (7), 557-565 (2018).
- Dondé, C., et al. Transcranial direct-current stimulation (tDCS) for bipolar depression: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry. 78, 123-131 (2017).
- Gowda, S. M., et al. Efficacy of pre-supplementary motor area transcranial direct current stimulation for treatment resistant obsessive compulsive disorder: a randomized, double blinded, sham controlled trial. Brain Stimul. 12 (4), 922-929 (2019).
- Kang, N., Summers, J. J., Cauraugh, J. H. Transcranial direct current stimulation facilitates motor learning post-stroke: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 87 (4), 345-355 (2016).
- Narayanaswamy, J. C., et al. Successful application of add-on transcranial direct current stimulation (tDCS) for treatment of SSRI resistant OCD. Brain Stimul. 8 (3), 655-657 (2015).
- Osoegawa, C., et al. Noninvasive brain stimulation for negative symptoms in schizophrenia: an updated systematic review and meta-analysis. Schizophr Res. 197, 34-44 (2018).
- Vacas,, et al. Noninvasive brain stimulation for behavioural and psychological symptoms of dementia: a systematic review and meta-analysis. Int J Geriatr Psychiatry. 34 (9), 1336-1345 (2019).
- Parlikar, R., et al. High definition transcranial direct current stimulation (HD-tDCS): a systematic review on the treatment of neuropsychiatric disorders. Asian J Psychiatry. 56, 102542(2021).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: recommendations from an IFCN committee. Clin Neurophysiol. 132 (3), 819-837 (2021).
- Cappa, S. F., et al. EFNS guidelines on cognitive rehabilitation: report of an EFNS task force. Eur J Neurol. 12 (9), 665-680 (2005).
- Sturm, W., Willmes, K., Orgass, B., Hartje, W. Do specific attention deficits need specific training. Neuropsychol Rehabil. 7 (2), 81-103 (1997).
- Verveer, I., Remmerswaal, D., Van der Veen, F. M., Franken, I. H. A. Long-term tDCS effects on neurophysiological measures of cognitive control in tobacco smokers. Biol Psychol. 156, 107962(2020).
- Katz, B., et al. Individual differences and long-term consequences of tDCS-augmented cognitive training. J Cogn Neurosci. 29 (9), 1498-1508 (2017).
- Gu, J., et al. The effect and mechanism of transcranial direct current stimulation on episodic memory in patients with mild cognitive impairment. Front Neurosci. 16, 811403(2022).
- Zhou, Y., et al. Efficacy and safety of transcranial direct current stimulation (tDCS) on cognitive function in chronic schizophrenia with tardive dyskinesia (TD): a randomized, double-blind, sham-controlled, clinical trial. BMC Psychiatry. 23 (1), 623(2023).
- Au, J., et al. Enhancing working memory training with transcranial direct current stimulation. J Cogn Neurosci. 28 (9), 1419-1432 (2016).
- Stagg, C. J., Antal, A., Nitsche, M. A. Physiology of transcranial direct current stimulation. J ECT. 34 (3), 144-152 (2018).
- Da Silva Machado, D. G., et al. Acute effect of high-definition and conventional tDCS on exercise performance and psychophysiological responses in endurance athletes: a randomized controlled trial. Sci Rep. 11, 13911(2021).
- Borckardt, J. J., et al. A pilot study of the tolerability and effects of high-definition transcranial direct current stimulation (HD-tDCS) on pain perception. J Pain. 13 (2), 112-120 (2012).
- Villamar, M. F., et al. Technique and considerations in the use of 4x1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309(2013).
- Effects of electrode configurations and injected current intensity on the electrical field of transcranial direct current stimulation: a simulation study. Mackenbach, C., Tian, R., Yang, Y. Annu Int Conf IEEE Eng Med Biol Soc, , 3517-3520 (2020).
- Bikson, M., Datta, A., Rahman, A., Scaturro, J. Electrode montages for tDCS and weak transcranial electrical stimulation: role of "return" electrode's position and size. Clin Neurophysiol. 121 (12), 1976-1978 (2010).
- Chambers, C. D., Stokes, M. G., Mattingley, J. B. Modality-specific control of strategic spatial attention in parietal cortex. Neuron. 44 (6), 925-930 (2004).
- Chambers, C. D., Payne, J. M., Mattingley, J. B. Parietal disruption impairs reflexive spatial attention within and between sensory modalities. Neuropsychologia. 45 (8), 1715-1724 (2007).
- Chambers, C. D., Mattingley, J. B. Neurodisruption of selective attention: insights and implications. Trends Cogn Sci. 9 (11), 542-550 (2005).
- Rushworth, M. F., Ellison, A., Walsh, V. Complementary localization and lateralization of orienting and motor attention. Nat Neurosci. 4 (6), 656-661 (2001).
- Hillis, A. E., et al. Anatomy of spatial attention: insights from perfusion imaging and hemispatial neglect in acute stroke. J Neurosci. 25 (12), 3161-3167 (2005).
- Mort, D. J., et al. The anatomy of visual neglect. Brain. 126 (9), 1986-1997 (2003).
- Mannan, S. K., et al. Revisiting previously searched locations in visual neglect: role of right parietal and frontal lesions in misjudging old locations as new. J Cogn Neurosci. 17 (2), 340-354 (2005).
- Vallar, G. Extrapersonal visual unilateral spatial neglect and its neuroanatomy. Neuroimage. 14 (1 Pt 2), S52-S58 (2001).
- Oliveri, M., Vallar, G. Parietal versus temporal lobe components in spatial cognition: setting the mid-point of a horizontal line. J Neuropsychol. 3 (2), 201-211 (2009).
- Committeri, G., et al. Neural bases of personal and extrapersonal neglect in humans. Brain. 130 (Pt 2), 431-441 (2007).
- Doricchi, F., Tomaiuolo, F. The anatomy of neglect without hemianopia: a key role for parietal-frontal disconnection. Neuroreport. 14 (17), 2239-2243 (2003).
- Fiori, V., Nitsche, M. A., Cucuzza, G., Caltagirone, C., Marangolo, P. High-definition transcranial direct current stimulation improves verb recovery in aphasic patients depending on current intensity. Neuroscience. 406, 159-166 (2019).
- Karvigh, S. A., Motamedi, M., Arzani, M., Roshan, J. H. N. HD-tDCS in refractory lateral frontal lobe epilepsy patients. Seizure. 47, 74-80 (2017).
- Meiron, O., et al. Antiepileptic effects of a novel noninvasive neuromodulation treatment in a subject with early-onset epileptic encephalopathy: case report with 20 sessions of HD-tDCS intervention. Front Neurosci. 13, (2019).
- Reckow, J., et al. Tolerability and blinding of 4x1 high-definition transcranial direct current stimulation (HD-tDCS) at two and three milliamps. Brain Stimul. 11 (5), 991-997 (2018).
- Motes, M. A., et al. High-definition transcranial direct current stimulation to improve verbal retrieval deficits in chronic traumatic brain injury. J Neurotrauma. 37 (1), 170-177 (2020).
- Russo, C., Souza Carneiro, M. I., Bolognini, N., Fregni, F. Safety review of transcranial direct current stimulation in stroke. Neuromodulation. 20 (3), 215-222 (2017).
- Hochstenbach, J., Van Spaendonck, K. P., Cools, A. R., Horstink, M. W., Mulder, T. Cognitive deficits following stroke in the basal ganglia. Clin Rehabil. 12 (6), 514-520 (1998).
- Marquez, J., Van Vliet, P., McElduff, P., Lagopoulos, J., Parsons, M. Transcranial direct current stimulation (tDCS): does it have merit in stroke rehabilitation? A systematic review. Int J Stroke. 10 (3), 306-316 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten