Method Article
ניסוי אקראי, תלת סמיות ומבוקר מקביל של גירוי זרם ישר טרנס-גולגולתי לשיקום קוגניטיבי לאחר שבץ מוחי
* These authors contributed equally
In This Article
Summary
מחקר זה מציג פרוטוקול חדש לגירוי זרם ישר טרנס-גולגולתי (tDCS) בשילוב עם גירוי קוגניטיבי לטיפול בהזנחה המי-מרחבית לאחר שבץ מוחי. נתונים ראשוניים ממטופל פיילוט מבטיחים את היתכנות ההליך ומצביעים על יעילות פוטנציאלית, ומספקים בסיס לניסוי קליני מקביל, משולש סמיות ומבוקר בעתיד.
Abstract
שבץ מוחי בהמיספרה הימנית גורם לעתים קרובות להזנחה המי-מרחבית, מצב משבית שיכול לעכב משמעותית את תהליך ההחלמה. הנוכחות הכרונית של הזנחה נקשרה לתוצאות גרועות יותר הן בתחום הקוגניטיבי והן בתחום המוטורי. כתוספת להתערבויות נוירופסיכולוגיות קונבנציונליות, גירוי זרם ישר טרנס-גולגולתי (tDCS) - טכניקה לא פולשנית המווסתת את הריגוש העצבי באמצעות זרמים חשמליים בעוצמה נמוכה - זכה לתשומת לב בשל הפוטנציאל שלו לשפר את הפלסטיות של קליפת המוח ולתמוך בשיפור תפקודי אצל אנשים מושפעים.
במחקר זה, אנו מציעים פרוטוקול התערבות משולב שמטרתו להפחית את הסימפטומים של הזנחה המי-מרחבית לאחר שבץ מוחי. הוא מורכב מפרוטוקול tDCS קתודלי בשילוב עם תוכנית שיקום נוירופסיכולוגית ממוחשבת שתוכננה במיוחד לשיקום הזנחה המי-מרחבית.
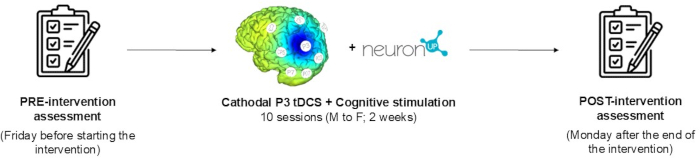
אסטרטגיית הנוירומודולציה היא להפחית את פעילות היתר של חצי הכדור הלא פגוע בהתבסס על מודל היריבות הבין-המיספרית. ההתערבות מורכבת משבועיים, 10 מפגשים (מיום שני עד שישי), 45 דקות כל אחד, של tDCS וגירוי קוגניטיבי קונבנציונלי המופעל בו זמנית. ה- tDCS מיושם על ידי התקן HD- tDCS (HD- tDCS) בעל 8 ערוצים למשך 20 דקות ובעוצמה של 2 mA. הקתודה ממוקמת מעל קליפת המוח הקודקודית האחורית השמאלית (P3 בעקבות מערכת 10/20 למיקום אלקטרודות אלקטרואנצפלוגרמה [EEG]), ואלקטרודות החזרה ממוקמות ב-C3, CP5, CP1, Pz, PO3, PO7 ו-P7. הערכה נוירופסיכולוגית ותפקודית בוצעה בנקודת ההתחלה ולאחר סיום ההתערבות.
המטרה העיקרית של המחקר הנוכחי היא לתאר את הפרוטוקול לתכנון ניסוי מקביל, אקראי ומשולש סמיות. כדי להבטיח את היתכנות הפרוטוקול ואת יעילותו הפוטנציאלית, ניתן תיאור מקיף של הנהלים המיושמים על משתתף פיילוט יחיד.
שילוב אסטרטגיות נוירומודולציה של tDCS בתהליכי שיקום קוגניטיבי עשוי להוביל לקיצור זמני ההתערבות ולשפר את המצב התפקודי ואיכות החיים של המטופלים.
Introduction
שבץ מוחי הוא הגורם השכיח ביותר לנכות בעולם בקרב מבוגרים וגורם המוות השני אחרי מחלת לב איסכמית1. רוב החולים ששרדו שבץ מוחי מפתחים מצבים קליניים הטרוגניים מאוד ודרגות נכות שונות. בין 55% ל-75% מחולי השבץ סובלים ממגבלות מוטוריות הנמשכות 6 חודשים לאחר הפציעה2. בנוסף להשלכות הפיזיות, שינויים קוגניטיביים תכופים מאוד3. ליקויים אלה משפיעים לרעה על ביצוע פעילויות חיי היומיום, ומגבילים את העצמאות התפקודית ואת איכות החיים של חולים וקרובי משפחה 4,5. הזנחה חצי מרחבית היא בין ליקויי הקשב השכיחים ביותר לאחר שבץ מוחי, המתרחשת בכ-25% עד 50% מהמקרים 6,7,8 ועולה עד 80% אצל אנשים עם שבץ מוחי בהמיספרה הימנית 9,10.
הזנחה המי-מרחבית מרמזת על קושי בטיפול בהמיפילד הנגדי לאזור הפגוע, בהיותו חוסר קשב זה אלוצנטרי (השמטת אובייקטים הממוקמים בחצי השמאלי של החלל) או אגוצנטרי (המטופל אינו מטפל בחלקים השמאליים של גופו). מבחינה תפקודית, הזנחה יוצרת קשיים חמורים בעצמאות המטופל, הן בפעילויות בסיסיות (למשל, טיפוח, ביגוד, אכילה וכו') והן בפעילויות אינסטרומנטליות של חיי היומיום (למשל, ניהול כספים, תחבורה ציבורית או הליכה עצמאית). יתר על כן, נוכחותו של שינוי זה נקשרה לזמני אשפוז ושיקום ארוכים יותר, סיכון גבוה יותר לנפילות, התאוששות מוטורית לקויה וסבירות נמוכה יותר לחזור הביתה לאחר השחרור מבית החולים11,12.
מספר אסטרטגיות יושמו לטיפול בהזנחה המי-מרחבית. בתוך גישות שיקום מסורתיות, אנו יכולים להבחין בין גישות מלמעלה למטה ומלמטה למעלה. ההבדל העיקרי ביניהם הוא רמת ההשתתפות הפעילה והמודעות של האדם במשימות. במסגרת גישות אלה, ההליכים הנפוצים ביותר עד כה היו אימון סריקה חזותית והתאמה פריזמטית, בהתאמה. טכניקות שיקום אחרות בהזנחה המי-מרחבית עם מיקום מרכזי בשימוש נרחב, גירוי אופטוקינטי, קלורי ושיווי משקל, רטט צוואר וטיפולים תרופתיים 13,14,15,16. עם זאת, לטיפולים אלה יש כמה מגבלות: משך תוצאותיהם מוגבל מאוד, ויש להם תחולה נמוכה בשלבים החריפים או התת-אקוטיים מכיוון שחומרת החולים בשלבים אלה מפריעה לשיתוף הפעולה שלהם בפעילויות שיבוצעו17.
גירוי זרם ישר טרנס-גולגולתי (tDCS) היא טכניקת נוירומודולציה בטוחה לא פולשנית המסוגלת לשנות את פעילות קליפת המוח על ידי השראת זרם חשמלי חלש למוח המשנה את פעילות קליפת המוח, וניתן להשתמש בה כדי להשלים שיקום נוירופסיכולוגי להזנחה המי-מרחבית. tDCS מווסת הפעלה עצבית ספונטנית בתגובה לקלט מאזורי מוח אחרים. יתר על כן, tDCS גורם לשינויים סינפטיים פלסטיים הדומים לחיזוק לטווח ארוך (LTP) או לדיכאון ארוך טווח (LTD) ואף נמשכים מעבר למשך הגירוי18.
באמצעות tDCS, ניתן לווסת את הפעילות בקליפת המוח על ידי הפעלת זרם חשמלי בעוצמה נמוכה מאוד הזורם מהאנודה לקתודה. tDCS מווסת את פעילות המוח על ידי השפעה על סף פוטנציאל הפעולה, הגדלה או הקטנה שלו, אך מבלי לגרום לפוטנציאל פעולה18. באופן כללי, האנודה גורמת לעלייה בריגוש של אזור המוח עליו היא נמצאת, ואילו הקתודה גורמת לעיכוב קליפת המוח. לטכניקה זו אין רזולוציה מרחבית גבוהה, אך מגבלה זו התגברה על ידי הופעתם של התקני tDCS חדשים הנקראים רב-אתרים או בחדות גבוהה (HD-tDCS). מכשירים אלה מאפשרים תצורות אלקטרודות שונות, כגון יצירת טבעת קתודלית סביב האנודה (או להיפך) על מנת להגביר או להקטין את הריגוש בקליפת המוח באזור מוח מסוים. טבעת הקתודה פועלת באופן דומה לאלקטרודות ההחזרה, ומגבילה את אזור הגירוי; באופן זה מושג גירוי מוקדי יותר. tDCS הוכח כיעיל כגישה טיפולית להתאוששות מוטורית לאחר שבץמוחי 19, ויש כמה ספרות מדעית עם תוצאות מבטיחות בשיקום הזנחה חצי מרחבית20.
ההשערה המקובלת ביותר של הזנחה המי-מרחבית טוענת שניתן להסביר אותה על סמך מודל היריבות בחצי הכדור, שהוצע על ידי קינסבורן ב-197721,22. על פי גישה זו, במצב הבסיסי, שתי ההמיספרות מעכבות זו את זו באופן הדדי; הזנחה חצי מרחבית נגרמת מחוסר איזון ביניהם. לאחר פציעה, חצי הכדור הפגוע אינו מסוגל לעכב ביעילות את פעילות ההמיספרה המשומרת. התוצאה היא היפראקטיביות פתולוגית של ההמיספרה הבריאה עקב היעדר עיכוב המופעל על ידי הפגוע, מה שמפחית עוד יותר את הפעילות העצבית של ההמיספרה המושפעת בגלל העיכוב המוגבר המופעל עליה23. לכן, התפקוד הלקוי העומד בבסיס ההזנחה ההמי-מרחבית נגרם הן על ידי היפואקטיביות של ההמיספרה הפגועה והן על ידי היפראקטיביות של ההמיספרה השלמה24.
עם מודל זה כרקע תיאורטי, מוצעות אסטרטגיות שונות לגירוי מוחי לא פולשני שמטרתן לשפר את תסמיני ההזנחה ההמי-מרחבית. אסטרטגיות אלו מכוונות להפחתת ההיפראקטיביות של ההמיספרה הבריאה, להגביר את הפעילות של ההמיספרה הפגועה, או שילוב של שניהם25,26.
מספר מחקרים הראו את הפוטנציאל של tDCS בהפחתת תסמיני הזנחה המי-מרחבית על ידי יישום אנודלי 17,27,28,29 וקתודל 17,29 tDCS בהמיספרה הפגועה או הלא פגועה, בהתאמה, או שילוב של שניהם 28,30,31,32. למרות תוצאות מבטיחות, יש צורך בראיות אמפיריות נוספות כדי לדעת את הפרמטרים המדויקים של tDCS כדי להשיג תוצאות מיטביות, וזה חיוני כדי לדעת אם tDCS מוקדי יעיל יותר ממונטאז'ים קונבנציונליים של tDCS. למיטב ידיעתנו, כל המחקרים הקודמים פותחו באמצעות tDCS קונבנציונלי, כאשר המחקר הנוכחי הוא הראשון שהשתמש ב-HD-tDCS לשיקום הזנחה המי-מרחבית.
התערבויות המבוססות על גירוי מוחי לא פולשני מהוות גישה קלינית מבטיחה מאוד בהתחשב בתוצאות העדכניות ובתופעות הלוואי המוגבלות על פי מטא-אנליזות וסקירות שונות 33,34,35,36,37. בנוסף, tDCS היא טכניקה בטוחה ביותר, ניידת ובעלות נמוכה, וזו הסיבה שהשימוש בה גדל בראש סדר העדיפויות במסגרות קליניות ומחקריות. כמו כן, ההרכבה הקלה והניידות שלו מאפשרים להשתמש במכשיר בו זמנית עם ביצוע כל פעילות אחרת, כגון פעילויות פיזיות, קוגניטיביות או פונקציונליות. לפיכך, יש צורך במחקרים מבוקרים יותר, עיוורים ואקראיים עם גדלי מדגם גדולים יותר כדי לאמת פרוטוקולי tDCS המשפרים את ההשפעות של גישות התערבות קונבנציונליות.
Protocol
פרויקט זה אושר על ידי ועדת האתיקה של המחקר הקליני של בית החולים 12 de Octubre (ר' Nº CEIm: 19/180), והוא רשום בכתובת www.clinicaltrials.gov (ID: NCT04458974). החוקרים מסכימים לכבד את כל החקיקה הנוכחית המבוססת בנוגע למחקר קליני והגנה על נתונים (הצהרת WMA של הלסינקי, 2004; תקנה (EU) 2016/679 והחוק האורגני 3/2018 בנושא הגנה על נתונים אישיים; חוק 41/2002 על אוטונומיה של המטופל). בהתאם לתקנה (EU) 2016/679 בנושא הגנה על נתונים אישיים, כל מידע שנאסף מהמשתתפים יטופל בסודיות מוחלטת. פרוטוקול tDCS עוקב אחר הנחיות הבטיחות הבינלאומיות עבור tDCS38.
הערה: המטרה העיקרית של המחקר הנוכחי היא לתאר פרוטוקול התערבות tDCS לניסוי קליני מקביל, אקראי, משולש סמיות. כדי להשיג זאת, ניתן תיאור מקיף של ההליכים, והתוצאות של בקשת משתתף פיילוט מוצגות במאמר זה. פרוטוקול ההתערבות מורכב מתוכנית בת 10 מפגשים המשלבת tDCS קתודלי (20 דקות, 2 mA) עם תוכנית שיקום נוירופסיכולוגית ממוחשבת שנועדה לשפר הזנחה המי-מרחבית. הערכות נוירופסיכולוגיות ותפקודיות מבוצעות בנקודת ההתחלה ולאחר סיום ההתערבות. איור 1 מציג את ציר הזמן של הפרוטוקול. האיור מציג את ההערכה הבסיסית, תיאור מפורט של ההתערבות והערכה לאחר ההתערבות של המחקר. השתתפות המטופל הייתה מרצון לאחר שנודע לו על מטרת המחקר וחתם על טופס הסכמה מדעת בכתב. המשתתף רשאי לפרוש מהמחקר בכל עת. המשתתף במחקר זה עומד בכל קריטריוני ההכללה והאי הכללה המפורטים בטבלה 1.
איור 1: ציר הזמן של הפרוטוקול. כל שלבי המחקר מתוארים: הערכה בסיסית, תיאור מפורט של ההתערבות והערכה לאחר ההתערבות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
1. קריטריונים להכללה ואי הכללה
- ודא שמשתתף הפיילוט במחקר זה עומד בקריטריוני ההכללה והאי הכללה הבאים (טבלה 1).
| קריטריונים להכללה: |
| שבץ דימומי או איסכמי בהמיספרה הימנית |
| שבץ מוחי 3 עד 12 חודשים מאז האירוע (ללא קשר אם הם קיבלו שיקום קודם או לא) |
| מגיל 18 עד 89 |
| מחקר הדמיה מוחית |
| היעדר שבץ מוחי קודם |
| יכולת תפקודית המאפשרת למטופל להישאר יושב ופעיל במשך שעה אחת (ציון מדד ברתל גדול מ-5 בפריט ההעברות בין כיסא למיטה; פריט זה יכול לקבל ציון מ-0 עד 15, בהיותו 0 תלוי לחלוטין ו-15 עצמאי לחלוטין). |
| דומיננטיות ידנית ימנית |
| ציוני הזנחה לפחות בשניים מהמבחנים שנערכו להערכת הזנחה חזותית-מרחבית |
| חתימה על הסכמה מדעת של המטופל או האפוטרופוס החוקי שלו |
| קריטריונים לאי הכללה: |
| בעיות דרמטולוגיות (פסוריאזיס, דרמטיטיס בקרקפת או בפנים) |
| נוכחות של שתלים או חלקי מתכת בראש, למעט סתימות. |
| קוצבי לב, משאבות תרופות, ממריצים (וגאליים, מוחיים, דרך העור), שאנטים ונטריקולופריטונאליים או קליפסים של מפרצת. |
| נוכחות של משיכות קודמות |
| מחלה נוירולוגית שאינה שבץ המתוארת בקריטריוני ההכללה |
| ליקוי קוגניטיבי חמור שהוערך באמצעות מבחן המצב הנפשי המיני (MMSE) (Folstein, 1975), למעט מטופלים עם ציונים מתחת ל-24 (הציון של MMSE הוא בין 0 ל-30, הוא 0 ליקוי קוגניטיבי חמור ו-30 ללא ליקוי קוגניטיבי) |
| קשיי שפה משמעותיים שאינם מאפשרים הבנה נכונה של פעילויות או מגבילים מאוד את ההבעה |
| היסטוריה של שימוש באלכוהול או בסמים |
| דיכאון פעיל בינוני או חמור |
| בעיות רפואיות בלתי מבוקרות (פתולוגיות בשלב אקוטי ללא טיפול רפואי או תרופתי עם יעילות מוכחת או פתולוגיות עם סיכון חיים מיידי) |
| הריון או חשד להריון שייבדק בבדיקת הריון בתחילת המחקר במטופלות בגיל הפוריות ובהמלצה לשימוש באמצעי מניעה עד לסיום ההתערבות |
טבלה 1: קריטריונים להכללה ואי הכללה. משתתף הפיילוט במחקר זה עומד בכל קריטריוני ההכללה והאי הכללה המתוארים בטבלה זו.
2. חומרים
הערה: כל החומרים המשמשים בכל שלבי המחקר מתוארים בקפידה.
- ערכת התקני tDCS
- עבור יישום tDCS, השתמש בהתקן HD-tDCS בעל 8 ערוצים ובאלקטרודות המומלצות שלו (ראה איור 2). כדי להקל על הרכבה קלה יותר, הנח בסיס פלסטיק במיקום הרצוי על מכסה הניאופרן (בהתאם למערכת EEG 10/20). לאחר ההצבה, יש למרוח את הג'ל המוליך ולאחר מכן להרכיב את האלקטרודה.
- פלטפורמת שיקום נוירולוגי ממוחשבת
הערה: כדי לבצע את הגירוי הקוגניטיבי, נעשה שימוש בפלטפורמת שיקום נוירולוגי ממוחשבת מקוונת (ראה איור 3). הפלטפורמה מאפשרת עיצוב ויישום של כל מפגש של תוכנית ההתערבות, תוך התאמת הקושי של המשימות בנפרד.- צור משתמש חדש לכל מטופל על ידי לחיצה על ניהול משתמשים והוספת משתמש חדש. שם באמצעות קוד לימוד כדי להתאים אישית את התוכנית הקוגניטיבית באופן אינדיבידואלי.
- לעיצוב המשימות יש לגשת לאזור העבודה/מפגשים/מפגשים דיגיטליים וללחוץ על התאריך בו יתקיים המפגש.
- הוסף את שם ההפעלה, לדוגמה, הפעלה 1. בחר סמל וצבע עבור הפעלה זו ולחץ על הלחצן Create .
- לחצו על הפעילויות כדי לכלול בתוכנית.
- ודא שהמשימות עבור כל מפגש מופיעות בצד שמאל של המסך.
- בכל אחד מהם, תכנת את הפרמטרים הבאים: זמן (7 דקות) והתחל בתוצאה האחרונה (ציין כן רק במפגשים 3-10).
- ציין לשמור.
- חזור על שלבים 2.2.3-2.2.7 לתכנון כל אחד מעשרת המפגשים של תוכנית הגירוי הקוגניטיבי.

איור 2: ערכת התקן tDCS. (1) כובע ניאופרן, (2) התקן tDCS, (3) אלקטרודות, (4) כבלים, (5) אטב אוזן, (6) ג'ל מוליך; (7) מזרק למתן הג'ל המוליך מתחת לאלקטרודות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
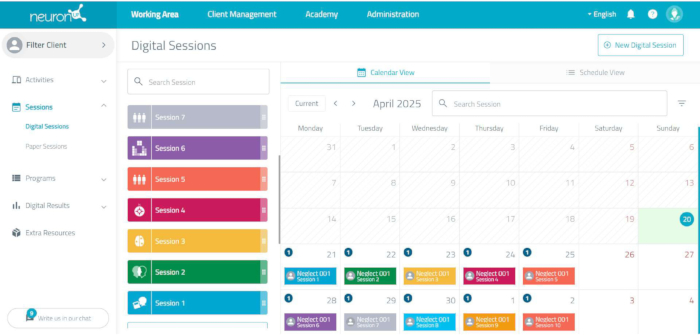
איור 3: תזמון מפגשי פלטפורמת השיקום הנוירולוגי. על ידי לחיצה על כל מפגש, המשימות מוצגות, כולל משך כל משימה ומשך הזמן הכולל של ההפעלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
3. תיאור פרוטוקול ההערכה: הערכה נוירופסיכולוגית ותפקודית לפני התערבות:
הערה: לאחר שהמשתתף חתם על ההסכמה מדעת, מתבצעת הערכה נוירופסיכולוגית ותפקודית. ההערכה מתקיימת ביום שישי שלפני תחילת תוכנית הגירוי ונמשכת 50 דקות. במהלך מפגש זה מוערכים ביצועים קוגניטיביים כלליים, ומנוהלים מבחנים נוירופסיכולוגיים המתמקדים בהערכת תהליכי קשב והזנחה המי-מרחבית, יחד עם סולמות תפקודיים. בפגישת מידע לפני ההערכה הראשונה, המשתתף מקבל את כל הפרטים הדרושים על מטרת המחקר, הנוהל, משך המפגש והשפעות הלוואי האפשריות. הסכמה חתומה מתקבלת לפני המשך ההערכה וההתערבות. המשתתף מקבל גם הודעה על האפשרות לפרוש מהמחקר בכל עת.
- ביצוע בדיקת מצב נפשי מיני (MMSE) (5 דקות)
הערה: סולם מובנה פשוט. הוא מקבל מקסימום 30 נקודות, והפריטים מקובצים ל-5 חלקים המעריכים התמצאות, זיכרון מיידי, קשב וחישוב, זיכרון דחוי, שפה ובנייה. הציונים נעים בין 0-30 נקודות, כאשר נקודת החיתוך היא 24; הציונים מתחת ל-24 מצביעים על ליקוי קוגניטיבי.- הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה. בדוק שהציון הכולל הוא ≥24 נקודות כדי להמשיך.
- ביצוע בדיקת חציית קו (5 דק')
הערה: שמונה עשרה שורות מוצגות בגיליון בגודל A4 המאורגן ב-3 סטים של 6: סט אחד ממוקם בעיקר משמאל לנייר, אחד במרכז הנייר ואחד בעיקר מימין לנייר. המטופלים מתבקשים לסמן את נקודות המרכז של כל קו. הסטייה של סימן המטופלים מהמרכז האמיתי של הקו נמדדת עבור כל שורה וממוצע עבור 18 הקווים.- מקם את הפעילות במרכזו לפני המשתתף, תוך ציון בגיליון את הצד הימני והשמאלי של המשתתף. הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- ביצוע בדיקת פעמונים (5 דקות)
הערה: מכשיר שמטרתו להעריך סריקה חזותית אופקית בנוכחות מסיחי דעת. המשימה כללה זיהוי דמויות בצורת פעמון המסודרות בצורה אקראית למחצה. אלה הוצגו בשבעה עמודים אנכיים, שכל אחד מהם הכיל חמישה פעמונים. לגבי מיקומם על הגיליון, הופיעו שלוש עמודות משמאל, אחת במרכז ושלוש מימין.- מקם את הפעילות במרכזו לפני המשתתף, תוך ציון בגיליון את הצד הימני והשמאלי של המשתתף. הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- ציור תמונה מבחני משנה מניהול המבחן בברצלונה (5 דקות)
הערה: הוא מורכב מעותק של 6 דמויות: עיגול, ריבוע, משולש, צלב, קובייה ובית. זמן הביצוע נשלט. כל נתון מקבל ציון כדלקמן: 3 נקודות עבור רבייה מושלמת, 2 נקודות עבור שינוי בדיד, נקודה אחת עבור שינוי מתון, 0 נקודות עבור שינוי חמור. הציון המקסימלי הוא 18. הוא מתוגמל ב-3, 2 או 1 נקודה, תלוי בזמן שהושקע בביצוע.- מקם את המשימה במרכז לפני המשתתף, תוך הצבעה על התמונות שמופיעות. הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- ביטול מבחני משנה מניהול המבחן בברצלונה (5 דקות)
- מקם את הפעילות במרכזו לפני המשתתף, תוך ציון בגיליון את הצד הימני והשמאלי של המשתתף. הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- טווח ספרות מתן קדימה ואחורה (5 דקות).
- הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- נהל תחילה את משימת הספרה הישירה. שנית, נהל את משימת הספרות ההפוכות לאחר מכן.
- מתן מבחן קשב קצר (BTA) (5 דקות)
- נהל מילולית את החלק הראשון של המשימה (ספור את המספרים המופיעים ברצף). מיד לאחר מכן יש ליישם את החלק השני של הבדיקה (לספור את האותיות המופיעות ברצף)
- אל תאפשר שימוש בתווים או ספירה על אצבעות.
- ביצוע בדיקת פנים (5 דקות)
- הצג את גיליון בדיקת הפנים. הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- הפעל את שעון העצר וסיים את המשימה לאחר 3 דקות. ספרו את מספר הגירויים המסומנים כהלכה.
- ביצוע מבחן תפיסה חזותית ללא מנוע (MVPT-4) (15 דקות)
הערה: מבחן הברירה המרובה בן 36 האלמנטים מעריך 5 תת-ממדים של הזנחה חזותית-מרחבית: אפליה חזותית, אפליה תחתונה, קשר מרחבי, סגירה חזותית וזיכרון חזותי. פרמטרים שונים משמשים לכימות התנהגות התגובה השמאלית (התנהגות תגובה שמאלה/ימינה, ציון ברוטו, ביצועים שמאל/ימין וזמן עיבוד התפיסה החזותית). הציונים לתגובות בצד שמאל נעים בין 0 ל-21, כאשר ערכים נמוכים יותר מצביעים על הזנחה חזותית מרחבית חמורה יותר.- הנח את מחברת שיעורי הבית לפני המטופל. הסבירו למשתתף את המבחן ובקשו ממנו לעקוב אחר הוראות הבדיקה.
- מאזניים פונקציונליים
הערה: ערכו ראיונות עם מטופלים ובני משפחה/מטפלים כדי לדעת את מצבו התפקודי של המטופל ואת השפעת ההזנחה על פעילויות חיי היומיום.- נהל את סולם מדד ברתל (5 דקות) לבן המשפחה או למטפל העיקרי ורשום את התשובות בגיליון התשובות.
הערה: מדד ברתל מודד את יכולתו של אדם לבצע עשר פעילויות בסיסיות בחיי היומיום, ומקבל אומדן כמותי של מידת העצמאות שלו. - יש לתת את סולם קתרין ברגו (הלמ"ס) (5 דקות) לבן המשפחה או למטפל העיקרי ולרשום את התשובות בגיליון התשובות.
הערה: שאלון זה מסתמך על התבוננות ישירה בביצועי המטופל ב-10 מצבים מדומים קלינית בחיים האמיתיים, כולל משימות כמו טיפוח, הלבשה ושימוש בכיסא גלגלים. הערכת המטופל מושווה לזו של בן משפחה / מטפל עיקרי. שאלון זה מניב ציון בין 0 ל-30, כאשר ציונים גבוהים יותר משקפים חומרה רבה יותר של הזנחה חזותית-מרחבית. .
- נהל את סולם מדד ברתל (5 דקות) לבן המשפחה או למטפל העיקרי ורשום את התשובות בגיליון התשובות.
4. תיאור פרוטוקול ההתערבות
- תצורת התקן התערבות
הערה: הגדר את הפרמטרים של גירוי HD-tDCS בתוכנה. ימים לפני תחילת ההתערבות, יש לתכנת את המכשיר עם הפרמטרים שיש ליישם בהתערבות, כלומר, משך זמן, עוצמה, קוטביות, מצב (פעיל לעומת דמה), מונטאז', סוג האלקטרודות, אתר הגירוי, מיקומי האלקטרודות המוחזרות ואחוז ההחזרה החשמלית לכל אחת מהן (ראה נקודה 5). בדוק שלמכשיר יש מספיק סוללה כדי להשלים את ההפעלה כולה.- פתח את התוכנה, בחר עורך פרוטוקולים ולאחר מכן הוסף פרוטוקול חדש.
- הזן את שם הפרוטוקול. הגדר את משך הרמפה: שלבים: (שמאל).
- אשר את הרמפה ואת זמן הגירוי הכולל. ציין עלייה: 30 ורמפ-דאון: 30.
- בסעיף משך הגירוי הכולל, ציין 20 דקות. הגדר את הגדרות הגירוי והאלקטרודה: עיצוב (מימין).
- הגדר את הקוטביות של הגירוי בקתודה. הגדר כל אלקטרודה באופן עצמאי. התחל עם האלקטרודה הפעילה, P3.
- בחר אלקטרודה P3 וגרור אותה לתיבה מימין. בחר גירוי וקתודה. בחר 2000 μA.
- בחר וגרור שמאלה, רווח את שאר האלקטרודות אחת אחת. במקרים אלה, כולן אלקטרודות חוזרות ועושות את אותה פעולה, מה שמציין את אחוז ההחזרה בכל אלקטרודה.
הערה: חשוב לציין שסכום אחוז ההחזרה חייב להסתכם עד 100. במחקר זה, אחוזי ההחזרה היו CP1, PO3, PO7, P7, CP5, C3: 10% ו-PZ: 40% (ראה איור 4 ואיור 5). מונטאז' זה נועד להפחית את פעילות היתר הפתולוגית של קליפת המוח הקודקודית האחורית בחצי הכדור הנגדי לנגע. - לחץ על כפתור סיום לאחר השלמת כל השלבים.
- הערכה לפני התערבות המטופל
- הערכת מדינה כללית.
- לפני ואחרי כל מפגש tDCS, העריכו את המצב הכללי על ידי שאילת השאלות הבאות: האם אתם מרגישים טוב? יש לך כאב ראש? האם יש לך כאבי צוואר? האם שתיתם אלכוהול אתמול או היום? האם השתמשת בסמים אתמול או היום? האם צרכתם קפה, תה או שוקולד ב-5 השעות האחרונות? האם ישנת טוב אתמול בלילה? מתי בפעם האחרונה אכלתם בשעות?
- העריכו את הסולמות האנלוגיים החזותיים (VAS) לעייפות ומצב רוח.
- העריכו את רמת העייפות הנפשית ומצב הרוח באמצעות שני VAS בניהול עצמי. בתגובה לשאלות האלה, בקשו מהמשתתפים לתת ציון בין 1 ל-10, תוך התייחסות לאופן שבו הם מרגישים לגבי השאלות: עד כמה אתם עייפים כרגע?, כאשר 1 פירושו לא עייף כלל, 10 פירושו עייף מאוד, ואיך מצב הרוח שלכם כרגע?, כאשר 1 פירושו עצוב מאוד ו-10 פירושו שמח מאוד.
- הערכת מדינה כללית.
- מונטאז' tDCS בחדות גבוהה
- לפני שתתחילו להרכיב את התקן ה-tDCS, ודאו שכל החומרים הדרושים זמינים ושלמכשיר ה-tDCS יש מספיק סוללה כדי לבצע את סשן הגירוי.
- החלק התחתון מפלסטיק של מיקום האלקטרודה
- בחר במכסה הניאופרן את המיקומים הבאים: הנח את אלקטרודת הקתודה הפעילה ב-P3; מקם את האלקטרודות החוזרות ב-C3, CP5, CP1, Pz, PO3, PO7 ו-P7 (ראה איור 5 ואיור 6).
- הניחו את החלק התחתון של האלקטרודה בכל אחד מהאזורים שנבחרו בכובע. שים את הכובע על ראשו של המשתתף, והתאם את Cz על סמך המדידות שנלקחו בעבר.
- מיקום כובע ניאופרן tDCS
- הושיבו את המשתתף בתנוחה נוחה בכיסא.
- חבשו את כובע הניאופרן (ראו איור 6), ובחרו את הגודל המתאים ביותר לראש הנבדק. הימנע מבחירת כובע גדול מכיוון שהוא חייב להיות הדוק לראש. כוונן את המכסה עם סרט הראש עד שהוא יתאים היטב לראש.
- אתר את נקודת ה-Cz ואת אזורי הגירוי של הפרוטוקול.
- מדוד את המרחק בין nasion ל-inion ובין הנקודות הקדם-אוזניות, באמצעות מטר. אתר את נקודת Cz בנקודת האמצע של שני המיקומים.
- מיקום ג'ל אלקטרו-מוליך
- הפרד את השיער הממוקם מתחת לאלקטרודה ממקום הגירוי. הקפידו על מגע טוב בין האלקטרודה לעור; השתמש בחפץ מוארך המאפשר להסיר את השיער מתוך האלקטרודות מבלי לשנות את מיקום הכובע שנמדד בעבר.
- ודא שהקרקפת יבשה ללא כל הכנה נוספת. הסר סיכות שיער או אלמנטים מתכתיים אחרים (סרטי ראש, סורגים וכו').
- לעולם אל תנקה את העור עם אלכוהול מכיוון שהוא עלול לגרום לשחיקה עם tDCS.
- הכניסו, באמצעות מזרק עם קצה פלסטיק סופי, כמות מספקת של ג'ל מוליך חשמלי בבסיס כל אלקטרודה.
זהירות: ניתן להשתמש רק בג'ל מוליך חשמלי; לעולם אל תשתמש במים או בתמיסת מלח באלקטרודה מסוג זה מכיוון שהיא עלולה לגרום לשחיקה. - הסר כמה שיותר שיער בעזרת קצה הפלסטיק של המזרק.
- בדיקת עכבה
הערה: כפתור בדיקת העכבה מודד את העכבה של כל הערוצים הפעילים והחוזרים לפני הגירוי. יש להשתמש בו לפני התחלת פרוטוקול גירוי כלשהו. רמות העכבה מוצגות כפסים מקודדים בצבע מתחת לכל סמל ערוץ גירוי, כאשר ירוק מציין ערכים מקובלים. תוכנית הגירוי יכולה להתחיל רק לאחר שכל הערוצים מראים ירוק. במהלך הגירוי, העכבה מנוטרת בכל שנייה, ואם אלקטרודה כלשהי עולה על 20 קילוואט בכל רגע, הפרוטוקול מופסק אוטומטית.- הפעל את המכשיר. פתח את תוכנת ההתקן tDCS במחשב.
- בחר את החיבור המשמש להתקן. בחר באפשרות סריקה למכשיר.
- בחר בדוק עכבה.
- אם כל האלקטרודות מופיעות בירוק, לחץ על כפתור ההפעלה ותוכנית הגירוי תתחיל.
- אם, לאחר השלמת בדיקת העכבה, אלקטרודה כלשהי נראית אדומה, מרחו שוב ג'ל על אותה אלקטרודה, הסירו שיער ובדקו שוב את העכבה עד שכל האלקטרודות יישארו ירוקות.
- פלטפורמת שיקום נוירולוגי ממוחשבת
הערה: תכנן את 10 מפגשי ההתערבות מראש על פלטפורמת השיקום הנוירולוגי והכן את הפלטפורמה לכך (ראה סעיף 2.2). כל מפגש מורכב מארבע משימות, כל אחת נמשכת 7 דקות. המשימות הכלולות בכל מפגש מוצגות בטבלה 2. בעת תזמון כל מפגש, יש צורך לבחור בין הפרמטרים של כל משימה: משך הזמן של כל משימה: 7 דקות, משך המפגש הכולל (28 דקות), שפה, כולל הערכת משתמש לאחר כל פעילות, כולל אישור על סיום כל פעילות בסוף כל משימה, והיעדר כפתור רציף בכל משימה, מכיוון שמשימות חייבות להיעשות ברצף אחת אחרי השנייה (איור 7).- גישה לפלטפורמת השיקום הנוירולוגי הממוחשבת.
- גש למפגש שתוכנן מראש (ראה שלב 2.2) ולחץ על כפתור התחל. הציגו ארבע פעילויות גירוי שונות של 7 דקות כל אחת ברצף.
הערה: מפגש הגירוי הקוגניטיבי נמשך בסך הכל 30 דקות. לאחר זמן הסימולציה הכולל (30 דקות), הפעילויות נפסקות. גירוי קוגניטיבי ממשיך עוד 5 דקות לאחר סיום גירוי ה-tDCS.
- תוכנית גירוי tDCS (20 דקות)
- הפעל את תחילת גירוי tDCS על ידי לחיצה על כפתור ההפעלה בתוכנת הבקרה tDCS 4 דקות ו-20 שניות לאחר תחילת משימת השיקום הנוירולוגי הממוחשב.
- לאחר 30 שניות של רמפה עולה, הגירוי הפעיל או הדמה מתחילים. הפעילו גירוי tDCS (20 דקות) במקביל למשימת השיקום הנוירולוגי הממוחשב. לאחר 20 דקות מתחילה רמפת ירידה ונמשכת 30 שניות. לאחר זמן זה, גירוי tDCS מפסיק.
- הערכת מטופל לאחר התערבות.
- שאלון תופעות לוואי.
- החל התאמה של שאלון התחושות הקשורות לגירוי חשמלי טרנס-גולגולתי39 (טבלה 3) עם 9 שאלות על נוכחות של תסמינים שונים כגון כאבי ראש, צריבה בקרקפת, או תחושת גירוד או עקצוץ מתחת לאלקטרודות.
- בכל פריט, דרג את חומרת הסימפטום בסולם של 1-4 ואת הקשר שלו עם tDCS בסולם של 1-5 (ראה טבלה 3).
- סולמות אנלוגיים חזותיים לעייפות ומצב רוח
- יש לתת את אותו סולם ששימש לפני מפגש הגירוי כדי להעריך את העייפות ומצב הרוח לאחר ההתערבות (ראה שלב 4.2.2).
- שאלון תופעות לוואי.
איור 4: מונטאז' HD-tDCS מייצג. הצבע הכחול מראה את מיקום האלקטרודות בעקבות מערכת 10-20 הבינלאומית למיקום אלקטרודות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
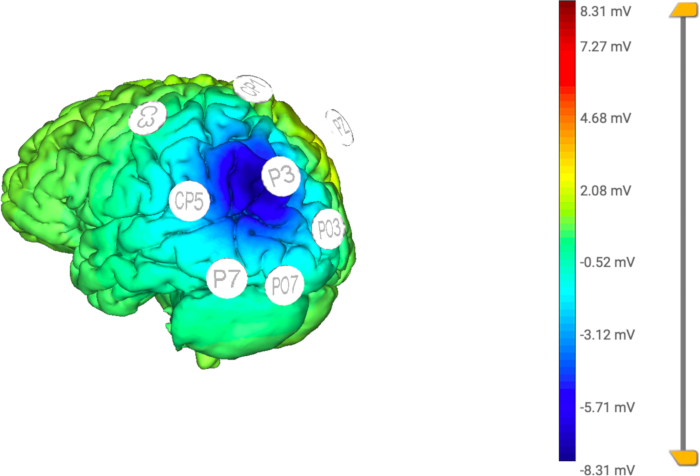
איור 5: מודל חישובי של ה-HD-tDCS המיושם. התפלגות הזרם החשמלי ממוקדת באלקטרודה המרכזית (הפעילה) (P3), ומגבילה את הגירוי לאזור מסוים על ידי אלקטרודות ההחזרה (C3, CP5, CP1, Pz, PO3, PO7, P7). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: כובע ניאופרן לגירוי HD-tDCS. במכסה יש חורים להצבת אלקטרודות בהתאם למערכת הסיווג 10/20 עבור EEG. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: תזמון משימות. פרמטרים שיש לבחור בעת תכנות כל משימה בפלטפורמת השיקום הנוירולוגי הממוחשב. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| חסימה | הפעלה | משימות פלטפורמת שיקום נוירולוגי | משך |
| אני | 1, 3, 6 ו-8 | · אותיות נסתרות | 7 דקות כל אחת מהמשימות. |
| · סכום מספרים | |||
| · מרק אותיות | |||
| · חיפוש צורות תואמות | |||
| השני | 2, 4, 7 ו-9 | · העתקת מטריצות מכתבים | |
| · הזאב הקטן | |||
| · מציאת מספרים חסרים | |||
| · השוואת טקסטים | |||
| השלישי | 5 ו-10 | · השוואת טקסט | |
| · סכום מספרים | |||
| · הגרגרן הקטן | |||
| · חיפוש גירויים עוקבים |
טבלה 2: המשימות הכלולות בכל אחד מ-10 מפגשי ההתערבות. כל המשימות כלולות בפלטפורמת השיקום הנוירולוגי הממוחשב.
| האם יש לך אחת מהתחושות או התסמינים הבאים? | דירוג חומרה (1-4) | אם קיים: מערכת יחסים עם tDCS? |
| 1-נעדר | 1-אף אחד | |
| 2-עדין | 2-שלט רחוק | |
| 3-בינוני | 3-אפשרי | |
| 4-חמור | 4-סביר | |
| 5-סופי | ||
| כאב ראש | ||
| כאבי צוואר או צוואר הרחם | ||
| כאבי קרקפת | ||
| צריבה בקרקפת | ||
| תחושות מתחת לאלקטרודה (עקצוץ, גירוד, צריבה, כאב) | ||
| אדמומיות בעור | ||
| קהות | ||
| בעיית ריכוז | ||
| שינויים חדים במצב הרוח | ||
| אחרים (פרט) | ||
| הערות נוספות | ||
טבלה 3: שאלון תופעות לוואי tDCS. ניתנת רשימה של תופעות לוואי שעלולות להופיע לאחר יישום הגירוי. הנוכחות או ההיעדרות של כל אחת מההשפעות הללו נרשמת מיד לאחר יישום הגירוי. התאמת שאלון התחושות הקשורות לגירוי חשמלי טרנס-גולגולתי39.
5. הסרת tDCS
- לאחר שתוכנית הגירוי tDCS ומשימות השיקום הנוירולוגי הממוחשבות הסתיימו, סגרו את תוכנת tDCS.
- נתק את התקן ה-tDCS.
- הסר את הכבל המחבר את ה-tDCS עם האלקטרודות.
- הסר את הכובע מראשו של המטופל.
- הסר את האלקטרודות מכובע הניאופרן.
- נקה את שיער המטופל.
- לאחר הסרת מכסה הניאופרן, הסר את הג'ל שנותר בעזרת נייר/מגבת ושטוף במים.
- נקה את מכסה הניאופרן והאלקטרודה.
- שטפו את הפקק במים כדי להסיר את הג'ל שנותר לאחר כל מפגש ותנו לו להתייבש.
- שטפו את האלקטרודות במים, הימנעו משפשוף שלהן וייבשו אותן בעדינות עם מטלית יבשה. לעולם אל תשתמש בסבון, אלכוהול או מוצרים אחרים לניקוי האלקטרודות.
6. הערכה נוירופסיכולוגית ותפקודית לאחר התערבות
- ביום שני, לאחר השלמת ההתערבות, יש לבצע את אותו נוהל כמו בהערכה המוקדמת, ולבצע את אותן משימות הערכה ושאלונים (ראה סעיף 3).
תוצאות
המטרה העיקרית של המחקר הנוכחי היא לתאר פרוטוקול התערבות tDCS לניסוי קליני מקביל, אקראי ומשולש סמיות. כדי לחקור את היתכנות ההתערבות, הפרוטוקול יושם על משתתף יחיד; התוצאות מוצגות במאמר זה.
יישמנו את פרוטוקול ההתערבות המלא על גבר בן 57 בעל רמת השכלה גבוהה (תואר בעיתונות) שסבל משבץ מוחי בגרעיני הבסיס הימניים תשעה חודשים קודם לכן ועמד בכל קריטריוני ההכללה להשתתפות במחקר.
התוצאות לפני ואחרי ההתערבות (ראה טבלה 4 ואיור 8) מוצגות עבור כל המשימות שניתנו. בהערכה שלאחר ההתערבות נצפו שינויים כמותיים ב-6 מתוך 13 המשתנים שנמדדו, 4 מהם קשורים ישירות להזנחה.
| הערכות | ||
| התערבות מקדימה | לאחר התערבות | |
| מבחן MMSE | 29 | 29 |
| מבחן פעמונים | 21 | 25* |
| בדיקת ביטול | 24 | 28* |
| מבחן רישומים | 12 | 12 |
| בדיקת חצייה | 19.95 | 3.47* |
| מבחן BTA | 11 | 9 |
| פרצופים להיטים | 11 | 9 |
| מתמודד עם שגיאות | 3 | 2* |
| מבחן ספרות ישירות | 11 | 10 |
| מבחן ספרות הפוכות | 9 | 8 |
| ללא מנוע | 26 | 29* |
| מבחן ברתל | 25 | 30* |
| סי.בי.אס | 20 | 20 |
טבלה 4: תוצאות הערכות לפני ואחרי התערבות. תוצאות ההערכה הנוירופסיכולוגית והתפקודית לפני ואחרי ההתערבות מוצגות בציונים ישירים. *שיפורים כמותיים בביצועים בהערכה לאחר התערבות בהשוואה לנקודת ההתחלה. **ערכים רחוקים יותר מציון 0 מצביעים על ביצועים גרועים יותר והזנחה גדולה יותר.
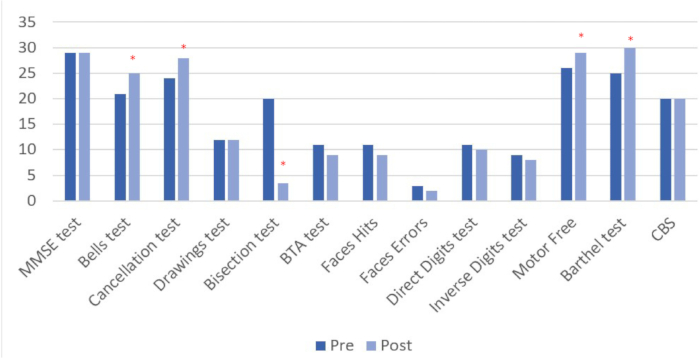
איור 8: תוצאות הערכה לפני ואחרי ההתערבות. ערכים גבוהים יותר מצביעים על שינוי חיובי, למעט במבחן חתך הקו, שבו השיפור מיוצג על ידי ציונים נמוכים יותר. התוצאות מוצגות בציונים ישירים. *שיפורים כמותיים בביצועים בהערכה לאחר התערבות בהשוואה לנקודת ההתחלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
חושב אחוז השיפור בין ההערכה לפני ואחרי הטיפול. שיפור קליני נצפה במבחני ההזנחה ההמי-מרחבית הספציפיים: מבחן פעמונים, מבחן ביטול, חציית קו, מבחן תפיסה נטולת מוטוריקה חזותית וסולם מדד ברטל. מצד שני, נצפו שינויים שליליים במטלות קשב אחרות (מבחן ספרות, מבחן קשב קצר, מבחן פנים). לבסוף, לא הופיעו שינויים ב-MMSE, בעותק של שרטוטים או בסולם קתרין ברגו הפונקציונלי (CBS) (ראה איור 9).
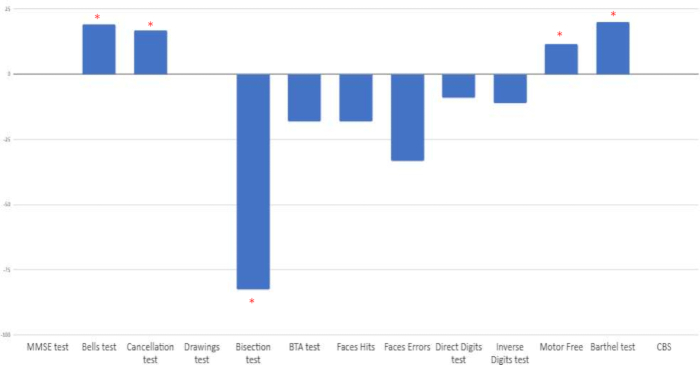
איור 9: אחוז השינוי בין ההערכה הבסיסית להערכה שלאחר ההתערבות. התוצאות מוצגות באחוזים. ציונים חיוביים מצביעים על שינוי חיובי, למעט במבחן חציית הקווים, שבו השיפור מיוצג על ידי ציונים שליליים. *אחוז השיפור החיובי כאשר משווים דירוגים לפני ואחרי התערבות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
הליכי המחקר בוצעו בחדרים מרווחים המצוידים לביצוע נכון של מפגשי ההערכה וההתערבות ועמידה באמצעי בטיחות והיגיינה.
באשר למטופל, הוא לא הפגין עייפות באף אחת מהפגישות שלפני ואחרי ההערכה, ולכן לא היה צורך לנוח באף אחת מהן. הטיפול הוערך על ידי המטופל כמשעשע ומגרה, מה ששיפר את ההיענות לטיפול ושיתוף פעולה פעיל לאורך כל ההליך. לכן, נחשב כי לפרוטוקול תהיה היתכנות גבוהה, ואנו נמשיך במחקר בהתאם לנוהל שנקבע.
מבחינת אי נוחות ותופעות לוואי, המשתתף לא חווה תופעות לוואי בינוניות או חמורות הקשורות ליישום tDCS.
Discussion
הזנחה חצי מרחבית היא תוצאה קוגניטיבית שכיחה של שבץ מוחי, וכאשר היא נמשכת, היא נוטה להשפיע לרעה על יעילות תהליך השיקום. ניתן לשפר את היעילות והיעילות של הגישות הטיפוליות הזמינות על ידי הכללת טכניקות גירוי מוחי לא פולשניות בשיקום נוירולוגי, בחיפוש אחר אפקט סינרגטי 40,41. כך, באמצעות tDCS, אנו יכולים להגביר את היעילות של התערבות קונבנציונלית, להשיג התאוששות רבה יותר, זמני שיקום קצרים יותר ותוצאות תפקודיות טובות יותר בשיקום חולה השבץ בהשוואה להתערבות קונבנציונלית בבידוד. המחקר על הפוטנציאל של tDCS בהפרעות נוירולוגיות ופסיכיאטריות גדל באופן אקספוננציאלי בעשור האחרון 42,43,44,45,46,47,48,49.
בנוסף, העלות של tDCS משתלמת, והמכשיר נייד, מה שהופך אותו לניתן להרחבה ביותר, ומאפשר את יישומו הן במרפאות חוץ והן בבתי חולים, עם ההכשרה המקצועית הנדרשת50.
מצאנו שיפור לאחר הטיפול בארבע מתוך שלוש עשרה הבדיקות שנערכו (מבחן פעמונים, מבחן ביטול, חציית קו, מבחן תפיסה נטולת מוטוריקה חזותית). הבדיקות בהן צפינו בשינויים חיוביים אלה קשורות לביצועים הקשורים להזנחה חצי מרחבית. מצד שני, נצפה ייצוב בביצוע כמה מבחנים הקשורים לביצועים קוגניטיביים כלליים, תהליכי קשב ו/או זיכרון עבודה (MMSE, ציורים, CBS). נצפתה ירידה בביצוע של כמה משימות אחרות (BTA, פנים, ספרות ישירות והפוכות).
לגבי סולמות תפקודיים, היו עדויות לשיפור, שדווחו על ידי המטפל העיקרי והוערכו על ידי סולם מדד ברטל. כמו כן נערך סולם התפקוד של הלמ"ס, הקשור ישירות להשפעת ההזנחה על חיי היומיום, ובמקרה זה לא ניכח שינוי ונותר יציב ביחס להערכה הקודמת. במחקר זה, מצאנו את היתרונות של הטיפול המשולב עבור תחומים קוגניטיביים מסוימים אך לא עבור אחרים. ממצאים אלה עולים בקנה אחד עם הרעיון שהטיפול יכול להיות מועיל יותר לתחומי קשב מסוימים 51,52,53,54,55,56,57. כמה מחקרים מראים כיצד פרוטוקולי tDCS ספציפיים גורמים לשינויים מתמשכים בריגוש ובפעילות קליפת המוח58. על מנת להיות מסוגל לנתח את תחזוקת השינויים מעבר לשבוע, מומלץ לבצע הערכה חדשה לאחר פרק זמן ארוך יותר 53,54,55,56,57.
tDCS בחדות גבוהה או ברזולוציה גבוהה, ששימשה במחקר זה, היא גרסה משופרת מבחינה טכנית של tDCS המאפשרת להגדיל את מוקד הגירוי על ידי שימוש בטבעת של אלקטרודות חוזרות סביב אנודה או קתודה כדי להגדיל או להקטין, בהתאמה, את הריגוש בקליפת המוח בצורה הרבה יותר מוקדית59. בהתבסס על המוקד הגבוה הזה והסבילות וההשפעות הקודמות של מחקר HD-tDCS על ידי Borckardt et al.60, השימוש ב-HD-tDCS גדל בשנים האחרונות.
מחקרי מודלים מצביעים על כך שתצורת אלקטרודה זו מייצרת את עוצמת השדה החשמלי (EF) הגבוהה ביותר מתחת לאלקטרודת המטרה, כאשר זרימת זרם המוח מוגבלת על ידי רדיוס מערך הטבעת 4X1 ולכן, שדה חשמלי גדול יותר במטרה שנבחרה בהשוואה למיקום אלקטרודות קונבנציונאלי 60,61,62 . האלקטרודות החוזרות תורמות לבידוד האזור הממוקד, ומאפשרות גירוי מוחי ממוקד יותר ומייצרות השפעות ארוכות טווח מאשר tDCS63 קונבנציונלי.
בנוסף, על פי כמה מחקרים, ל-HD-tDCS יש השפעות ארוכות טווח. לאחרונה, המחקר הקליני שם לב לפרוטוקול זה. למיטב ידיעתנו, רק שישה מחקרים נערכו עם HD-tDCS במחלות נוירולוגיות, שלושה ניסויי ביקורת אקראיים, שני דוחות תווית פתוחה ודוח מקרה אחד (עיין בסקירה49).
למרות שאין הסכמה מוחלטת על האזורים האנטומיים הקשורים להזנחה המי-מרחבית, נראה שיש הסכמה מסוימת על כמה תחומים ספציפיים. נראה כי קליפת המוח הקודקודית האחורית היא אזור המפתח של השינוי 64,65,66, ובתוך אזור זה, הפיתול הזוויתי 64,65,67,68,69, החריץ התוך-קודקודי 64,69,70, הצומת הטמפורופאריאטלי 69,71 והפיתול העל-שולי65,72,73,74.
בהתחשב בכך שהתועלת של HD-tDCS בהשוואה ל-tDCS קונבנציונאלי היא הגדלת הדיוק במטרת הגירוי ובהתבסס על הידע של מיקום מדויק לנוכחות הזנחה חצי מרחבית, אנו יכולים לצפות להשיג יתרונות גדולים יותר מגירוי מוקדי בהשוואה לגירוי כללי או מפוזר יותר. בינתיים, התצורה הנפוצה ביותר במחקרי נוירולוגיה היא מונטאז' 4 x 1 75,76,77,78,79. במחקר שלנו, השתמשנו בתצורת 7 x 1 במטרה להגדיל את מוקד הגירוי עוד יותר, והיה המחקר הראשון שהשתמש במונטאז' זה בשיקום קליני של הזנחה. לכן, יש לערוך מחקר נוסף במצבים קליניים אלה ובמצבים קליניים אחרים כדי לקבוע את העליונות או היעילות של מונטאז' HD-tDCS זה על פני מונטאז' HD אחר ו-tDCS קונבנציונלי.
לגבי עוצמה, 2 mA מיושם בפרוטוקול זה, כמו ברוב המחקרים עם tDCS, לא משנה באיזה מונטאז' או תצורה משתמשים. יהיה מעניין להשוות את אותו פרוטוקול עם עוצמות נמוכות וגבוהות יותר במחקרים נוספים כדי להבין את ההשפעה של עוצמות יישום שונות.
יש לקחת בחשבון כמה המלצות שימושיות לגבי בטיחות ופתרון בעיות טכני עם הפרוטוקול הנוכחי. בכל מטופל, אך במיוחד בחולי שבץ מוחי, יש להעריך היטב את נושאי הבטיחות. למרות ש-tDCS בחולי שבץ הוא בטוח ונסבל היטב80, לחולים ולבני משפחותיהם יש לפעמים ספקות לגביו. לפיכך, יש למסור מידע מובן מראש ולדון בו עם המטופל וקרוביו, כדי לוודא שהם מבינים את ההליך ויכולים לנטוש את הפרוטוקול מתי שהם רוצים.
מצד שני, בפרוטוקול זה, המיקום המדויק של הנגע נלקח בחשבון ונרשם מכיוון שאנו מוכנים להשוות את השפעת הפרוטוקול על הזנחה המי-מרחבית לאחר נגעים בקליפת המוח (למשל, עורק מוח אמצעי ימני)69 ולאחר נגעים תת-קורטיקליים (למשל, גרעיני בסיס)81. בהקשר זה, חשוב להעריך את יעילות הטכניקה לאור ההטרוגניות במיקומי הנגעים. באופן ספציפי, עלינו לנתח את השינויים ביעילות הנוגעים לנגעים בקליפת המוח לעומת נגעים תת-קורטיקליים.
לגבי שלב השבץ המוחי, בעת הפעלת הגירוי (חריף, תת חריף או כרוני), חשוב לדעת את הרגע בו ההתערבות יכולה להועיל ביותר. במחקר זה, השתמשנו כקריטריון הכללה 3 עד 12 חודשים מאז הפציעה (שלב תת-חריף). עם זאת, סקירה שיטתית קודמת התמקדה בהיבטים מוטוריים לאחר שבץ מוחי, והתוצאות הראו שיפורים בשלבים כרוניים אך לא בשלב החריף (במהלך 3 הימים הראשונים מהופעת התסמינים)82. יש צורך בחקירה נוספת כדי לחקור את היתרונות של tDCS על שינויים קוגניטיביים לאחר שבץ מוחי ולזהות גורמים המנבאים את יעילותו האופטימלית בשלבי החלמה שונים.
הידע הנוכחי על HD-tDCS כגישה טיפולית במחלות נוירולוגיות תומך בסבילות וביעילות הקלינית שלו. חוץ מזה, יש צורך במחקר אקראי מבוקר נוסף כדי להבין את הפרמטרים האופטימליים בכל מחלה ובכל חולה על מנת לבסס את היעילות של טכניקת גירוי מוחי לא פולשנית זו בהפרעות נוירולוגיות ומעבר להן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים ל-NeuronUp (www.neuronup.com) על תמיכתה ושיתוף הפעולה חסר האנוכיות שלה בפרויקט הזה.
Materials
| Name | Company | Catalog Number | Comments |
| 10 electrode cable | Neuroelectrics | NE017 | |
| Barthel Index | N/A | Mahoney, F. I., Barthel, D. W. Functional evaluation: The Barthel Index. Md State Med J. 14, 61–65 (1965). | |
| Copy of drawings subtest | N/A | https://test-barcelona.com/es/tienda.html | J. Peña Casanova, Programa integrado de exploración neuropsicológica: test Barcelona revisado?: TBR. Barcelona: Masson. |
| Curved Syrenge | Neuroelectrics | NE014 | |
| Electrode Gel | Neuroelectrics | NE016a | |
| Line bisection test | N/A | Schenkenberg, T., Bradford, D. C., Ajax, E. T. Line bisection and unilateral visual neglect in patients with neurologic impairment. Neurology. 30 (5) 509–517 (1980). | |
| Mini-mental state examination (MMSE) | N/A | Folstein, M. F., Folstein, S. E., McHugh, P. R. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 12 (3) 189–198 (1975). | |
| Neoprene headcap | Neuroelectrics | NE019-M | |
| Saline Solution | Neuroelectrics | NE033 | |
| Satrstim Necbox | Neuroelectrics | NE012 | |
| Starstim tES-EEG System | Neuroelectrics | ||
| Teastboard Cable | Neuroelectrics | NE039 | |
| Testboard Head | Neuroelectrics | NE038 | |
| The Bell Test | N/A | https://strokengine.ca/en/assessments/bells-test/ | L. Gauthier, F. Deahault and Y. Joanette, The Bells Test: A quantitative and qualitative test for visual neglect (Vol. 11). |
| The Catherine Bergego Scale | N/A | Azouvi, P. et al. Behavioral assessment of unilateral neglect: study of the psychometric properties of the Catherine Bergego Scale. Arch Phys Med Rehabil. 84 (1) 51–57 (2003). | |
| The motor-free visual perception test (MVPT) | N/A | https://www.wpspublish.com/mvpt-4-motor-free-visual-perception-test-4 | Colarusso, R. P., Hammill, D.D. The Motor Free Visual Perception Test (MVPT-3). Navato, CA: Academic Therapy Publications (2003). |
| USB Bluetooth Dongle | Neuroelectrics | NE031 | |
| USB charging Cable | Neuroelectrics | NE043 | |
| USB Power Adapter & Power Supply Plug | Neuroelectrics | NE013 & NE013a, NE013b, NE013c | |
| USB Stick with Manuals & NIC SW | Neuroelectrics | NE015 |
References
- Sun, J. -H., Tan, L., Yu, J. -T. Post-stroke cognitive impairment: epidemiology, mechanisms and management. Ann Transl Med. 2 (8), 80(2014).
- Abo, M., et al. comparative study of NEURO versus CIMT in poststroke patients with upper limb hemiparesis: the neuro-verify study. Int J Stroke. 9 (5), 607-612 (2014).
- Mijajlović, M. D., et al. Post-stroke dementia - a comprehensive review. BMC Med. 15 (1), 11(2017).
- Kerkhoff, G., Schenk, T. Rehabilitation of neglect: an update. Neuropsychologia. 50 (6), 1072-1079 (2012).
- Jehkonen, M., et al. Predictors of discharge to home during the first year after right hemisphere stroke. Acta Neurol Scand. 104 (3), 136-141 (2001).
- Buxbaum, L. J., et al. Hemispatial neglect: subtypes, neuroanatomy, and disability. Neurology. 62 (5), 749-756 (2004).
- Nijboer, T. C. W., Kollen, B. J., Kwakkel, G. Time course of visuospatial neglect early after stroke: a longitudinal cohort study. Cortex. 49 (8), 2021-2027 (2013).
- Ringman, J. M., Saver, J. L., Woolson, R. F., Clarke, W. R., Adams, H. P. Frequency, risk factors, anatomy, and course of unilateral neglect in an acute stroke cohort. Neurology. 63 (3), 468-474 (2004).
- Parton, A., Malhotra, P., Husain, M. Hemispatial neglect. J Neurol Neurosurg Psychiatry. 75 (1), 13-21 (2004).
- Stone, S. P., Patel, P., Greenwood, R. J., Halligan, P. W. Measuring visual neglect in acute stroke and predicting its recovery: the visual neglect recovery index. J Neurol Neurosurg Psychiatry. 55 (6), 431(1992).
- Chen, P., Hreha, K., Kong, Y., Barrett, A. M. Impact of spatial neglect on stroke rehabilitation: evidence from the setting of an inpatient rehabilitation facility. Arch Phys Med Rehabil. 96 (8), 1458-1466 (2015).
- Wilkinson, D., Sakel, M., Camp, S. -J., Hammond, L. Patients with hemispatial neglect are more prone to limb spasticity, but this does not prolong their hospital stay. Arch Phys Med Rehabil. 93 (7), 1191-1195 (2012).
- Gammeri, R., Iacono, C., Ricci, R., Salatino, A. Unilateral spatial neglect after stroke: current insights. Neuropsychiatr Dis Treat. 16, 131-152 (2020).
- Muñoz-Marrón, E., Redolar-Ripoll, D., Zulaica-Cardoso, A. New therapeutic approaches in the treatment of neglect: transcranial magnetic stimulation. Rev Neurol. 55 (5), 297-305 (2012).
- Cicerone, K. D., et al. Evidence-based cognitive rehabilitation: systematic review of the literature from 2009 through 2014. Arch Phys Med Rehabil. 100 (8), 1515-1533 (2009).
- Pizzamiglio, L., et al. Cognitive rehabilitation of the hemineglect disorder in chronic patients with unilateral right brain damage. J Clin Exp Neuropsychol. 14 (6), 901-923 (1992).
- Yi, Y., et al. The effect of transcranial direct current stimulation on neglect syndrome in stroke patients. Ann Rehabil Med. 40 (2), 223-229 (2016).
- Fregni, F., Pascual-Leone, A. Technology insight: noninvasive brain stimulation in neurology-perspectives on the therapeutic potential of rTMS and tDCS. Nat Rev Neurol. 3 (7), 383-393 (2007).
- Lefaucheur, J. -P., et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol. 128 (1), 56-92 (2017).
- González-Rodriguez, B., Serradell-Ribé, N., Viejo-Sobera, R., Romero-Muñoz, J. P., Marron, E. M. Transcranial direct current stimulation in neglect rehabilitation after stroke: a systematic review. J Neurol. 269 (12), 6310-6329 (2022).
- Kinsbourne, M. A model for the mechanism of unilateral neglect of space. Trans Am Neurol Assoc. 95, 143-146 (1970).
- Kinsbourne, M. Hemi-neglect and hemisphere rivalry. Adv Neurol. 18, 41-49 (1977).
- Koch, I. Instruction effects in task switching. Psychon Bull Rev. 15 (2), 448-452 (2008).
- Corbetta, M., Kincade, M. J., Lewis, C., Snyder, A. Z., Sapir, A. Neural basis and recovery of spatial attention deficits in spatial neglect. Nat Neurosci. 8 (11), 1603-1610 (2005).
- Hummel, F. C., Cohen, L. G. Noninvasive brain stimulation: a new strategy to improve neurorehabilitation after stroke. Lancet Neurol. 5 (8), 708-712 (2006).
- Miniussi, C., et al. Efficacy of repetitive transcranial magnetic stimulation/transcranial direct current stimulation in cognitive neurorehabitation. Brain Stimul. 1 (4), 326-336 (2008).
- Bornheim, S., Maquet, P., Croisier, J., Crielaard, J., Kaux, J. Motor cortex transcranial direct current stimulation (tDCS) improves acute stroke visuo-spatial neglect: a series of four case reports. Brain Stimul. 11 (2), 459-461 (2018).
- Sunwoo, H., et al. Effects of dual transcranial direct current stimulation on post-stroke unilateral visuospatial neglect. Neurosci Lett. 554, 94-98 (2013).
- Ladavas, E., et al. A-tDCS on the ipsilesional parietal cortex boosts the effects of prism adaptation treatment in neglect. Restor Neurol Neurosci. 33 (5), 647-662 (2015).
- Turgut, N., Miranda, M., Kastrup, A., Eling, P., Hildebrandt, H. tDCS combined with optokinetic drift reduces egocentric neglect in severely impaired post-acute patients. Neuropsychol Rehabil. 28 (4), 515-526 (2018).
- Smit, M., et al. Transcranial direct current stimulation to the parietal cortex in hemispatial neglect: a feasibility study. Neuropsychologia. 74, 152-161 (2015).
- Brem, A. -K., Unterburger, E., Speight, I., Jancke, L. Treatment of visuospatial neglect with biparietal tDCS and cognitive training: a single-case study. Front Syst Neurosci. 8, 180-180 (2014).
- Cappon, D., Jahanshahi, M., Bisiacchi, P. Value and efficacy of transcranial direct current stimulation in the cognitive rehabilitation: a critical review since 2000. Front Neurosci. 10, 157(2016).
- Fan, J., Li, Y., Yang, Y., Qu, Y., Li, S. Efficacy of noninvasive brain stimulation on unilateral neglect after stroke: a systematic review and meta-analysis. Am J Phys Med Rehabil. 97 (4), 261-269 (2018).
- Kashiwagi, F. T., et al. Noninvasive brain stimulations for unilateral spatial neglect after stroke: a systematic review and meta-analysis of randomized and nonrandomized controlled trials. Neural Plast. , (2018).
- Salazar, A. P. S., et al. Noninvasive brain stimulation improves hemispatial neglect after stroke: a systematic review and meta-analysis. Arch Phys Med Rehabil. 99 (2), 355-366 (2018).
- Zebhauser, P. T., Vernet, M., Unterburger, E., Brem, A. -K. Visuospatial neglect-a theory-informed overview of current and emerging strategies and a systematic review on the therapeutic use of noninvasive brain stimulation. Neuropsychol Rev. 29 (4), 397-420 (2019).
- Bikson, M., et al. Safety of transcranial direct current stimulation: evidence based update 2016. Brain Stimul. 9 (5), 641-661 (2016).
- Antal, A., et al. Low intensity transcranial electric stimulation: safety, ethical, legal regulatory and application guidelines. Clin Neurophysiol. 128 (9), 1774-1809 (2017).
- Sathappan, A. V., Luber, B. M., Lisanby, S. H. The dynamic duo: combining noninvasive brain stimulation with cognitive interventions. Prog Neuropsychopharmacol Biol Psychiatry. 89, 347-360 (2019).
- Draaisma, L. R., Wessel, M. J., Hummel, F. C. Noninvasive brain stimulation to enhance cognitive rehabilitation after stroke. Neurosci Lett. 719, 133678(2020).
- David, M. C. M. M., Moraes, A. A., de Costa, M. L., da Franco, C. I. F. Transcranial direct current stimulation in the modulation of neuropathic pain: a systematic review. Neurol Res. 40 (7), 557-565 (2018).
- Dondé, C., et al. Transcranial direct-current stimulation (tDCS) for bipolar depression: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry. 78, 123-131 (2017).
- Gowda, S. M., et al. Efficacy of pre-supplementary motor area transcranial direct current stimulation for treatment resistant obsessive compulsive disorder: a randomized, double blinded, sham controlled trial. Brain Stimul. 12 (4), 922-929 (2019).
- Kang, N., Summers, J. J., Cauraugh, J. H. Transcranial direct current stimulation facilitates motor learning post-stroke: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 87 (4), 345-355 (2016).
- Narayanaswamy, J. C., et al. Successful application of add-on transcranial direct current stimulation (tDCS) for treatment of SSRI resistant OCD. Brain Stimul. 8 (3), 655-657 (2015).
- Osoegawa, C., et al. Noninvasive brain stimulation for negative symptoms in schizophrenia: an updated systematic review and meta-analysis. Schizophr Res. 197, 34-44 (2018).
- Vacas,, et al. Noninvasive brain stimulation for behavioural and psychological symptoms of dementia: a systematic review and meta-analysis. Int J Geriatr Psychiatry. 34 (9), 1336-1345 (2019).
- Parlikar, R., et al. High definition transcranial direct current stimulation (HD-tDCS): a systematic review on the treatment of neuropsychiatric disorders. Asian J Psychiatry. 56, 102542(2021).
- Fried, P. J., et al. Training in the practice of noninvasive brain stimulation: recommendations from an IFCN committee. Clin Neurophysiol. 132 (3), 819-837 (2021).
- Cappa, S. F., et al. EFNS guidelines on cognitive rehabilitation: report of an EFNS task force. Eur J Neurol. 12 (9), 665-680 (2005).
- Sturm, W., Willmes, K., Orgass, B., Hartje, W. Do specific attention deficits need specific training. Neuropsychol Rehabil. 7 (2), 81-103 (1997).
- Verveer, I., Remmerswaal, D., Van der Veen, F. M., Franken, I. H. A. Long-term tDCS effects on neurophysiological measures of cognitive control in tobacco smokers. Biol Psychol. 156, 107962(2020).
- Katz, B., et al. Individual differences and long-term consequences of tDCS-augmented cognitive training. J Cogn Neurosci. 29 (9), 1498-1508 (2017).
- Gu, J., et al. The effect and mechanism of transcranial direct current stimulation on episodic memory in patients with mild cognitive impairment. Front Neurosci. 16, 811403(2022).
- Zhou, Y., et al. Efficacy and safety of transcranial direct current stimulation (tDCS) on cognitive function in chronic schizophrenia with tardive dyskinesia (TD): a randomized, double-blind, sham-controlled, clinical trial. BMC Psychiatry. 23 (1), 623(2023).
- Au, J., et al. Enhancing working memory training with transcranial direct current stimulation. J Cogn Neurosci. 28 (9), 1419-1432 (2016).
- Stagg, C. J., Antal, A., Nitsche, M. A. Physiology of transcranial direct current stimulation. J ECT. 34 (3), 144-152 (2018).
- Da Silva Machado, D. G., et al. Acute effect of high-definition and conventional tDCS on exercise performance and psychophysiological responses in endurance athletes: a randomized controlled trial. Sci Rep. 11, 13911(2021).
- Borckardt, J. J., et al. A pilot study of the tolerability and effects of high-definition transcranial direct current stimulation (HD-tDCS) on pain perception. J Pain. 13 (2), 112-120 (2012).
- Villamar, M. F., et al. Technique and considerations in the use of 4x1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309(2013).
- Effects of electrode configurations and injected current intensity on the electrical field of transcranial direct current stimulation: a simulation study. Mackenbach, C., Tian, R., Yang, Y. Annu Int Conf IEEE Eng Med Biol Soc, , 3517-3520 (2020).
- Bikson, M., Datta, A., Rahman, A., Scaturro, J. Electrode montages for tDCS and weak transcranial electrical stimulation: role of "return" electrode's position and size. Clin Neurophysiol. 121 (12), 1976-1978 (2010).
- Chambers, C. D., Stokes, M. G., Mattingley, J. B. Modality-specific control of strategic spatial attention in parietal cortex. Neuron. 44 (6), 925-930 (2004).
- Chambers, C. D., Payne, J. M., Mattingley, J. B. Parietal disruption impairs reflexive spatial attention within and between sensory modalities. Neuropsychologia. 45 (8), 1715-1724 (2007).
- Chambers, C. D., Mattingley, J. B. Neurodisruption of selective attention: insights and implications. Trends Cogn Sci. 9 (11), 542-550 (2005).
- Rushworth, M. F., Ellison, A., Walsh, V. Complementary localization and lateralization of orienting and motor attention. Nat Neurosci. 4 (6), 656-661 (2001).
- Hillis, A. E., et al. Anatomy of spatial attention: insights from perfusion imaging and hemispatial neglect in acute stroke. J Neurosci. 25 (12), 3161-3167 (2005).
- Mort, D. J., et al. The anatomy of visual neglect. Brain. 126 (9), 1986-1997 (2003).
- Mannan, S. K., et al. Revisiting previously searched locations in visual neglect: role of right parietal and frontal lesions in misjudging old locations as new. J Cogn Neurosci. 17 (2), 340-354 (2005).
- Vallar, G. Extrapersonal visual unilateral spatial neglect and its neuroanatomy. Neuroimage. 14 (1 Pt 2), S52-S58 (2001).
- Oliveri, M., Vallar, G. Parietal versus temporal lobe components in spatial cognition: setting the mid-point of a horizontal line. J Neuropsychol. 3 (2), 201-211 (2009).
- Committeri, G., et al. Neural bases of personal and extrapersonal neglect in humans. Brain. 130 (Pt 2), 431-441 (2007).
- Doricchi, F., Tomaiuolo, F. The anatomy of neglect without hemianopia: a key role for parietal-frontal disconnection. Neuroreport. 14 (17), 2239-2243 (2003).
- Fiori, V., Nitsche, M. A., Cucuzza, G., Caltagirone, C., Marangolo, P. High-definition transcranial direct current stimulation improves verb recovery in aphasic patients depending on current intensity. Neuroscience. 406, 159-166 (2019).
- Karvigh, S. A., Motamedi, M., Arzani, M., Roshan, J. H. N. HD-tDCS in refractory lateral frontal lobe epilepsy patients. Seizure. 47, 74-80 (2017).
- Meiron, O., et al. Antiepileptic effects of a novel noninvasive neuromodulation treatment in a subject with early-onset epileptic encephalopathy: case report with 20 sessions of HD-tDCS intervention. Front Neurosci. 13, (2019).
- Reckow, J., et al. Tolerability and blinding of 4x1 high-definition transcranial direct current stimulation (HD-tDCS) at two and three milliamps. Brain Stimul. 11 (5), 991-997 (2018).
- Motes, M. A., et al. High-definition transcranial direct current stimulation to improve verbal retrieval deficits in chronic traumatic brain injury. J Neurotrauma. 37 (1), 170-177 (2020).
- Russo, C., Souza Carneiro, M. I., Bolognini, N., Fregni, F. Safety review of transcranial direct current stimulation in stroke. Neuromodulation. 20 (3), 215-222 (2017).
- Hochstenbach, J., Van Spaendonck, K. P., Cools, A. R., Horstink, M. W., Mulder, T. Cognitive deficits following stroke in the basal ganglia. Clin Rehabil. 12 (6), 514-520 (1998).
- Marquez, J., Van Vliet, P., McElduff, P., Lagopoulos, J., Parsons, M. Transcranial direct current stimulation (tDCS): does it have merit in stroke rehabilitation? A systematic review. Int J Stroke. 10 (3), 306-316 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved