È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fabbricazione ed etichettatura di microbolle con traccianti fluorescenti e radioattivi
In questo articolo
Riepilogo
Questo protocollo delinea la fabbricazione di microbolle lipidiche e un metodo di radiomarcatura a microbolle monouso compatibile con un'efficienza di marcatura del >95% senza purificazione che preserva le proprietà fisico-chimiche delle microbolle. Questo metodo è efficace in diverse formulazioni di microbolle lipidiche e può essere personalizzato per generare microbolle radioattive e/o fluorescenti.
Abstract
Le microbolle sono particelle riempite di gas con gusci lipidici che si sono evolute da agenti di contrasto a ultrasuoni vascolari in rivoluzionarie piattaforme per la terapia del cancro. Se combinati con gli ultrasuoni focalizzati terapeutici (FUS), possono superare in modo sicuro e locale le barriere fisiologiche (ad esempio, la barriera emato-encefalica), somministrare farmaci a tumori altrimenti inaccessibili (ad esempio, glioblastoma e cancro al pancreas) e trattare malattie neurodegenerative. L'arsenale terapeutico delle microbolle-FUS sta avanzando in nuove direzioni, tra cui la radioterapia combinata sinergica, l'imaging multimodale e il caricamento e la somministrazione di farmaci all-in-one da gusci di microbolle.
La marcatura delle microbolle con radiotraccianti è la chiave per stabilire queste capacità teranostiche ampliate. Tuttavia, le attuali strategie di radiomarcatura delle microbolle si basano su metodologie di purificazione note per perturbare le proprietà fisico-chimiche delle microbolle, utilizzare radioisotopi a vita breve e non sempre producono una chelazione stabile. Collettivamente, questo crea ambiguità riguardo all'accuratezza della radioimaging a microbolle e all'efficienza della somministrazione di radioisotopi tumorali.
Questo protocollo descrive una nuova metodologia di marcatura delle microbolle one-pot, priva di purificazione, che preserva le proprietà fisico-chimiche delle microbolle raggiungendo un'efficienza di chelazione dei radioisotopi del >95%. È versatile e può essere applicato con successo in formulazioni di microbolle personalizzate e commerciali con diversa lunghezza della catena lipidica acilica, carica e composizione di chelante/sonda (porfirina, DTPA, DiI). Può essere applicato in modo adattivo durante la fabbricazione di microbolle da zero e su formulazioni di microbolle preconfezionate con personalizzazione modulare delle proprietà di fluorescenza e fluorescenza/radioattività multimodale. Di conseguenza, questo metodo flessibile consente la produzione di microbolle multimodali su misura e tracciabili (radio, fluorescenti o radio/fluorescenti attive) utili per far progredire le applicazioni meccanicistiche, di imaging e terapeutiche di microbolle-FUS.
Introduzione
Le microbolle sono agenti teranostici supramolecolari di dimensioni micron con un nucleo gassoso stabilizzato da una proteina, un polimero o, nella maggior parte dei casi, un guscio lipidico (Figura 1A). Quando iniettate nel flusso sanguigno, le microbolle mantengono interfacce gas/liquido rilevabili dagli ultrasuoni per periodi di tempo di pochi minuti prima della dissoluzione dei loro nuclei di gas 1,2. Di conseguenza, il primo uso clinico delle microbolle è stato come agenti di contrasto per l'imaging a ultrasuoni in tempo reale3. L'invenzione degli ultrasuoni focalizzati terapeutici (FUS) ha ampliato le utilità cliniche delle microbolle. Quando stimolate da FUS a bassa frequenza, le microbolle oscillano e generano forze meccaniche mirate e regolabili che vanno dalla permeabilizzazione vascolare transitoria all'ablazione del tessuto focale 4,5. Di conseguenza, negli ultimi 20 anni, la microbolla-FUS è stata esplorata per l'apertura della barriera emato-encefalica (BBB), la somministrazione di farmaci per tumori (ad es. cancro metastatico al pancreas, al cervello e al fegato) e la somministrazione di sonde di imaging, la terapia delle malattie neurodegenerative e l'ablazione del cancro 6,7,8,9,10,11.
L'arsenale teranostico delle microbolle continua ad avanzare in nuove ed entusiasmanti direzioni. Le applicazioni convenzionali di somministrazione di microbolle-FUS si basano sulla co-somministrazione di carichi terapeutici o di imaging insieme a microbolle commerciali. C'è un crescente interesse nel migliorare le capacità di erogazione di microbolle-FUS comprendendo le interazioni tra guscio di microbolle e biologiche, esplorando formulazioni di microbolle non commerciali su misura e generando microbolle teranostiche all-in-one con carico caricato direttamente sul guscio di microbolle 12,13,14. Infatti, circa il 40% degli studi sulla somministrazione di farmaci con microbolle lipidiche fa uso di tali microbolle caricate con guscio15. Oltre all'imaging e alla somministrazione di farmaci, la microbolla-FUS si è dimostrata promettente anche nel migliorare la radioterapia del cancro16 e nell'attivare gli effetti antineoplastici di agenti altrimenti benigni caricati con guscio attraverso la terapia sonodinamica17,18.
Queste direzioni convenzionali ed estese nelle applicazioni del cancro con microbolle possono essere avanzate in modo più strategico etichettando i gusci delle microbolle con traccianti radioattivi. Nell'ambito delle microbolle all-in-one caricate con carico, tale radiomarcatura 1) facilita la valutazione quantitativa gold standard della biodistribuzione on e off-target di questi gusci di microbolle caricati, 2) ricava relazioni farmacocinetiche struttura-attività che informano la selezione ottimale delle composizioni delle microbolle per massimizzare la consegna on-target e 3) guida l'applicazione strategica e appropriata guidata da immagini e la pianificazione del trattamento (ad esempio, tipi di bersagli tissutali, Dosimetria, selezione dei farmaci per mitigare i problemi di sicurezza fuori bersaglio, utilità rispetto ai paradigmi di co-trattamento convenzionali) di sistemi all-in-one caricati con carico15,19. In una fase preclinica, una tale comprensione del destino della conchiglia delle microbolle può anche illuminare meccanismi d'azione più ampi delle microbolle-FUS. Ad esempio, è stato dimostrato che il trasferimento di lipidi dai gusci delle microbolle alle cellule bersaglio influenza la sonoporazione abilitata da FUS12,20. La comprensione e l'ottimizzazione di tale trasferimento possono quindi informare le terapie precliniche e cliniche con microbolle-FUS in cui è implicata la sonoporazione (trasfezione in vitro, somministrazione di farmaci, ablazione tumorale, sensibilizzazione alle radiazioni e terapia sonodinamica 20,21,22,23,24,25). Le doppie strutture a ultrasuoni e radioimmagini consentirebbero inoltre l'apertura dei vasi FUS e il monitoraggio del trattamento (ad esempio, la cinetica di apertura della BEE) da un singolo agente piuttosto che dai tradizionali progetti a doppio agente26. Allo stesso modo, la radiomarcatura con microbolle lipidiche potrebbe fungere da alternativa all-in-one all-in-one a microbolle-FUS/radioterapia a microbolle-FUS + piattaforme di co-somministrazione radiofarmaceutica27.
La fragilità delle microbolle è una sfida non banale per tale etichettatura. Tutte le strategie di radiomarcatura esistenti sono limitate da metodologie di purificazione note per perturbare la stabilità e le dimensioni delle microbolle, mentre alcune presentano anche una radiomarcatura inefficace e instabile 28,29,30,31,32. I requisiti di purificazione portano anche a protocolli più lunghi. In combinazione con l'uso di radioisotopi a vita breve (ad esempio, 18F t1/2 1.8 h,28,29 99mTc t1/2 6 h,3268Ga t1/2 1 h31), ciò crea inefficienze legate al decadimento dei radioisotopi e limita i tempi di radioimaging e pianificazione del trattamento. Collettivamente, queste limitazioni rischiano l'acquisizione di radioimmagini abbreviate e non rappresentative, dati farmacocinetici imprecisi e un'inefficiente somministrazione di radioisotopi tumorali.
In questo rapporto, queste limitazioni vengono superate sfruttando le capacità di chelazione dei metalli forti e stabili della porfirina. Le porfirine sono macromolecole organiche eterocicliche con un anello planare altamente coniugato e un sito di coordinazione centrale che può ospitare una varietà di metalli. Ciò include radioisotopi a vita più lunga come il rame-64 (t1/2 12,7 h), un radiofarmaco con tomografia a emissione di positroni (PET) e la fattibilità del conteggio dei γ33. Quando coniugate a una spina dorsale lipidica, le porfirine possono essere facilmente incorporate in strutture supramolecolari e successivamente marcate con rame-64 con velocità, alta efficienza chelante e stabilità sierica, mantenendo le proprietà delle particelle madri non marcate 33,34. Inoltre, le porfirine sono fluorescenti attive con auto-estinzione modulare in nano e microparticelle che viene ripristinata dopo la rottura delle particelle; una lettura complementare alla PET e al conteggio dei γ che facilita l'analisi del destino sia della massa che del microscopico del guscio (Figura 1A)15.
Utilizzando il lipide porfirina come chelante, queste proprietà sono state sfruttate per generare una nuova metodologia di radiomarcatura a microbolle one-pot, priva di purificazione (Figura 1B, C) che supera i limiti associati ai metodi di radiomarcatura a microbolle esistenti. Questo protocollo raggiunge un'efficienza di chelazione del rame-64 del >95%, non richiede la purificazione post-marcatura e preserva le proprietà fisico-chimiche delle microbolle. Può essere facilmente integrato nella fabbricazione "da zero" di microbolle lipidiche prima della loro attivazione (Figura 1B). È versatile e può essere applicato con successo in formulazioni di microbolle personalizzate e commerciali con diverse lunghezze della catena lipidica acilica (da C16 a C22), carica (neutra e anionica) e composizioni di porfirina-lipidi (1 mol%, 10 mol%, 30 mol%), generando microbolle con attività sia radio che di fluorescenza. La sua adattabilità può estendersi anche oltre la porfirina. Il protocollo one-pot può essere modificato per utilizzare chelanti alternativi disponibili in commercio (ad esempio, dietilentriammina pentaacetato (DTPA)-lipidi) e fluorofori (ad esempio, DiI). Può anche essere modificato per etichettare formulazioni di microbolle preconfezionate attraverso un approccio "spiking". Di conseguenza, questo metodo consente la produzione di microbolle su misura, tracciabili (radio, fluorescenti o dual radio/fluorescent active) utili per far progredire le applicazioni meccanicistiche, di imaging e terapeutiche di microbolle-FUS. Il protocollo seguente delinea la fabbricazione di microbolle lipidiche, l'applicazione del protocollo di radiomarcatura one-pot, la radiomarcatura richiesta e la caratterizzazione delle proprietà fisico-chimiche e le potenziali modifiche.
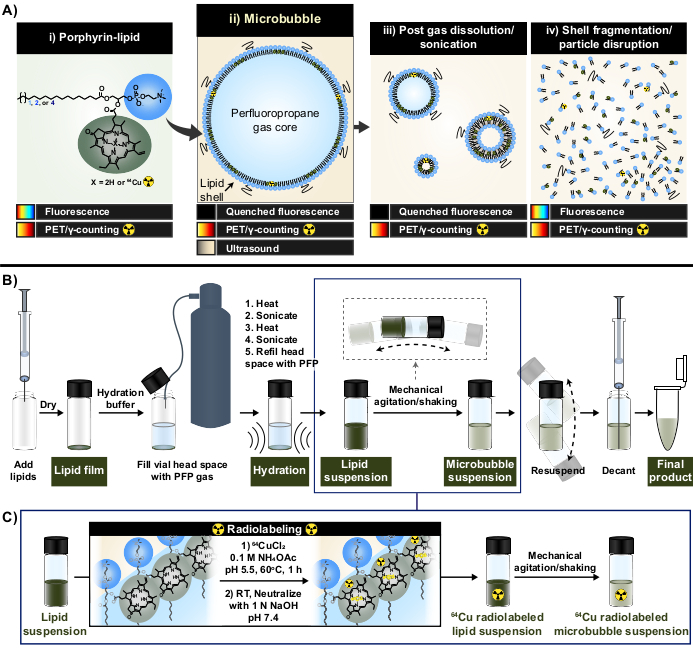
Figura 1: Fabbricazione di microbolle e protocollo di radiomarcatura. (A) Il porfirina-lipide, sotto forma di pirofeoforbide-a-lipide, funge da chelante multimodale all'interno di questo protocollo. Come monomero chelato a rame-64 (i), ha capacità di PET e di imaging. La sua fluorescenza viene spenta sotto forma di particelle (microbolle (ii) e la loro nanoprogenie post-dissoluzione (iii)) e non spenta con disgregazione particellare (iv). (B) protocollo di idratazione/attivazione del film lipidico descritto in questo rapporto per generare microbolle lipidiche dal basso e (C) integrazione della radiomarcatura one-pot tra la formazione di sospensioni lipidiche e l'attivazione di microbolle. Questa figura è stata adattata con il permesso di Rajora et al.15. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
1. Preparazioni di reattivi
- Preparare un tampone in acetato di ammonio (0,1 M, pH 5,5)
- Utilizzando una bilancia analitica, pesare 770,8 mg di acetato di ammonio su una carta da pesare. Trasferire la quantità pesata in un becher di vetro pulito da 250 ml.
- Aggiungere 90 mL di acqua bidistillata (ddH2O), misurata tramite una pipetta graduata, nel becher. Aggiungere una barra di agitazione e posizionare il becher su una piastra di agitazione magnetica per sciogliere l'acetato di ammonio. Mescolate ad una velocità tale da creare un leggero vortice ma senza schizzi di soluzione.
- Tarare un pHmetro secondo le istruzioni dello strumento utilizzando gli standard di pH 4 e 7. Una volta calibrata, inserire la sonda di pH nel tampone acetato di ammonio.
- Aggiungere 104 μl di acido acetico alla soluzione, mescolare per sciogliere e misurare il pH.
NOTA: A questo punto il pH dovrebbe essere vicino a 5,5. - Regolare il pH del tampone aggiungendo 10 N di idrossido di sodio (o acido cloridrico se il tampone diventa troppo basico) con incrementi di 5-10 μl utilizzando una micropipetta. Mescolare, misurare il pH e ripetere se necessario. Prendere nota del volume di base/acido aggiunto.
- Aggiungere un volume sufficiente di ddH2O per creare un totale di 100 mL di tampone.
NOTA: Ad esempio, se durante l'aggiustamento del pH sono stati utilizzati 45 μL di idrossido di sodio 10 N, 9,851 mL di ddH2O verrebbero aggiunti al becher (100 mL [volume target]- 90 mL [passo 1.1.2] - 0,104 mL [passo 1.1.4] - 0,045 mL [passo 1.1.5] = 9,851 mL). - Mescolare accuratamente il tampone un'ultima volta prima di trasferirlo in un contenitore con coperchio.
- Pulire il pHmetro secondo le istruzioni dello strumento.
ATTENZIONE: L'idrossido di sodio acquoso concentrato e l'acido cloridrico possono causare reazioni cutanee e devono essere maneggiati con i guanti.
- Preparare il tampone di idratazione (PGG)
- Aspirare la soluzione salina tamponata con fosfato (PBS) in una siringa e dotare l'estremità di un filtro per siringa in polietersulfone con pori da 0,2 μm. Filtrare il PBS in una provetta da centrifuga di plastica pulita con coperchio.
NOTA: È possibile utilizzare filtri per siringhe con pori da 0,2 μm di materiali di membrana alternativi (ad esempio, fluoruro di polivinilidene) purché la membrana sia compatibile con PBS e acetato di ammonio. - Combinare PBS filtrato, glicole propilenico e glicerolo tramite micropipetta in un rapporto volumetrico 8:1:1 per ottenere il tampone di idratazione (noto anche come PGG). Quando si aggiungono glicole propilenico e glicerolo, aspirare e rimuovere eventuali goccioline residue di glicole propilenico o glicerolo dalla superficie del puntale della pipetta prima di pipettare lentamente il reagente nel PBS. Una chiara torbidità viscosa simile a una corda sarà osservata nel PBS.
NOTA: Si consiglia di utilizzare una micropipetta p1000 per aggiungere prima il PBS a una provetta da centrifuga, seguito da glicole propilenico e glicerolo, poiché gli ultimi due reagenti sono viscosi. Pertanto, devono essere aspirati lentamente tramite la micropipetta fino a quando non si nota più il movimento del fluido nella punta della pipetta e in modo tale che non venga assorbita aria quando la punta della pipetta viene rimossa dal reagente. I puntali per micropipette con marcature volumetriche dovrebbero essere idealmente utilizzati per scegliere volumi di reagenti che si allineano con tali marcature (ad esempio, producendo PGG da 1 mL o 5 mL e utilizzando rispettivamente la marcatura da 0,1 mL o 0,5 mL sul puntale della micropipetta per visualizzare l'aspirazione completa di glicole propilenico e glicerolo). Quando si pulisce la superficie del puntale della micropipetta, non strofinare l'apertura del puntale, ma solo lateralmente. - Pipettare su e giù con la punta della pipetta nella soluzione fino a quando i reagenti non sono stati disciolti in modo omogeneo. Fare attenzione a non introdurre bolle d'aria nella soluzione.
- Per garantire ulteriormente una miscela completa del tampone di idratazione, tappare la provetta da centrifuga e ruotare lentamente su e giù. Non vortice.
- Centrifugare la provetta a una temperatura inferiore a 1000 x g per 20-30 s (temperatura minima 4 °C, RT massima) per rimuovere le bolle d'aria non osservabili.
- Aspirare la soluzione salina tamponata con fosfato (PBS) in una siringa e dotare l'estremità di un filtro per siringa in polietersulfone con pori da 0,2 μm. Filtrare il PBS in una provetta da centrifuga di plastica pulita con coperchio.
- Preparare il tampone di idratazione/radiomarcatura (AA-PGG)
- Filtro per siringa 0,1 M, tampone acetato di ammonio pH 5,5 (dal passaggio 1.1) e PBS in provette separate come indicato al passaggio 1.2.1.
- Combinare il tampone acetato di ammonio filtrato, il PBS filtrato, il glicole propilenico e il glicerolo tramite una micropipetta p1000 in una provetta da centrifuga in un tampone acetato di ammonio 5:3:1:1: PBS: glicole propilenico: rapporto volumetrico del glicerolo nell'ordine elencato. Seguire le istruzioni di aspirazione, miscelazione e centrifugazione come nei passaggi 1.2.2-1.2.5 per produrre AA-PGG.
- Eluente istantaneo per cromatografia su strato sottile (iTLC)
- Pesare fino a 0,1 g di acido etilendiamminotetraacetico (EDTA) e trasferire in un flaconcino tappato. Sciogliere in ddH2O in modo tale da ottenere una soluzione al 2% p/v di EDTA (ad esempio, per 50 mg di EDTA, aggiungere 2,5 mL di ddH2O).
- Combinare la soluzione di EDTA al 2% p/v con il tampone acetato di ammonio della fase 1.1 in un rapporto 9:1 v/v (soluzione di EDTA al 90%, tampone acetato di ammonio al 10%). Tappare e conservare l'eluente iTLC risultante.
2. Formazione di film lipidici
NOTA: Questa procedura delinea la formazione di un film lipidico con composizioni che imitano la microbolla commerciale, Definity®, con porfirina-lipide che sostituisce il lipide ospite e costituisce il 30 mol% del lipide totale. Tuttavia, il protocollo di radiomarcatura può essere applicato a diverse formulazioni lipidiche (lunghezze delle catene C16, C18, C22, carica neutra o anionica, composizione molare porfirina-lipidica variabile). È allegato un foglio di calcolo supplementare (file supplementare 1) che fornisce calcoli, composizioni, masse e volumi di magazzino per le formulazioni descritte e altre formulazioni. Tutti i lipidi sono disponibili in commercio ad eccezione del porfirina-lipide, pirofeoforbide-a-lipide (piro-lipide), la cui sintesi è stata precedentemente descritta in dettaglio35,36.
- Utilizzando il file supplementare 1, determinare la massa totale necessaria per ciascun lipide in base al numero di film richiesti.
- Pesare una fiala di vetro vuota da 0,5 dram su una bilancia analitica.
NOTA: La polvere interferisce con la corretta formazione di microbolle. Pertanto, soffiare aria pressurizzata nella fiala per rimuovere polvere/particolato se conservata senza tappo. - Pesare l'1,2-dipalmitoil-sn-glicero-3-fosfocolina (DPPC) su carta da pesare.
NOTA: La massa pesata deve essere ottenuta dal passaggio 2.1 più altri 0,5-1 mg per tenere conto di eventuali perdite durante la manipolazione del campione nelle fasi successive. - Trasferire il DPPC nel flaconcino di vetro pesato e ripesare per determinare la massa lipidica nel flaconcino. Questo processo consente un più facile trasferimento dei lipidi alla fiala di vetro, una riduzione della perdita/fuoriuscita di polvere lipidica e una misurazione più accurata della massa lipidica.
- Ripetere i passaggi da 2.2 a 2.4 con gli altri lipidi: 1,2-dipalmitoil-sn-glicero-3-fosfoetanolammina-N-[metossi(polietilenglicole)-5000] (DPPE-mPEG), 1,2-dipalmitoil-sn-glicero-3-fosfato (DPPA) e C16 piro-lipide.
NOTA: Se il piro-lipide non è disponibile in una forma di polvere pesabile, ma piuttosto come film o aliquota di quantità sconosciuta, può essere disciolto in cloroformio per formare uno stock la cui concentrazione può essere calcolata attraverso misure di assorbanza UV-Vis in metanolo utilizzando la legge di Beer-Lambert come descritto in precedenza35. - Preparare i seguenti solventi organici e soluzioni in provette di vetro utilizzando micropipette o siringhe di vetro: 1) cloroformio, 2) cloroformio 9:1 v/v: metanolo e 3) cloroformio 65:35:8: metanolo: ddH2O. Per quest'ultimo, pipettare i componenti e mescolarli nel seguente ordine: ddH2O, metanolo, quindi cloroformio.
ATTENZIONE: Il metanolo e il cloroformio sono pericolosi per la salute, infiammabili e volatili. Indossare una protezione per gli occhi, guanti e un camice da laboratorio e utilizzare una cappa aspirante. - Utilizzare il file supplementare 1 per calcolare il volume di solvente/soluzione organica necessaria per produrre scorte lipidiche e selezionare siringhe di vetro di volumi appropriati.
NOTA: Questo volume dovrebbe fornire concentrazioni di stock che corrispondano a volumi di aliquote stock di 15-100 μl per film che possono essere facilmente misurati utilizzando siringhe da microlitri di vetro da 25-100 μl. - Sciacquare tre volte le siringhe di vetro con cloroformio. Pompare lo stantuffo avanti e indietro per asciugare la siringa.
- Misurare e aggiungere il solvente/le soluzioni organiche tramite la siringa di vetro pulita alle singole fiale di lipidi secondo i calcoli del foglio di calcolo al passaggio 2.7 per formare scorte lipidiche. Sciogliere il piro-lipide in cloroformio (a meno che non sia già disciolto come da nota al punto 2.5), DPPC e DPPE-mPEG in cloroformio 9:1 v/v: metanolo e DPPA in cloroformio 65:35:8:metanolo:ddH2O. Se si utilizza la stessa siringa di vetro per tutte le aggiunte, sciacquare e asciugare tra ogni lipide.
NOTA: Se la formulazione scelta non contiene DPPA o la sua variante di lunghezza della catena C18, il piro-lipide, il lipide PC ospite e il lipide PEG possono essere disciolti in cloroformio. - Tappare le fiale e il vortice.
- Aggiungere i volumi calcolati di soluzioni lipidiche stock a un nuovo flaconcino di vetro da 0,5 dram (flaconcino di pellicola) tramite una siringa da microlitri di vetro. Per il primo stock lipidico, inserire la punta dell'ago nella parte inferiore centrale del flaconcino e immergerlo lentamente per evitare schizzi sulle pareti del flaconcino. Per le aggiunte successive, posizionare la punta dell'ago direttamente sopra il livello del liquido e toccare il lato del flaconcino per rimuovere eventuali gocce finali in modo da non esporre l'ago al liquido sottostante.
NOTA: Sciacquare e asciugare la siringa di vetro tra le aggiunte di lipidi quando si verifica una contaminazione. Se si realizzano più pellicole, tappare sia la pellicola che le fiale di scorta tra le aggiunte per ridurre al minimo l'evaporazione del solvente. - Agitare delicatamente il flaconcino manualmente in posizione verticale per miscelare il contenuto. Evitare di spruzzare qualsiasi soluzione sulle pareti del flaconcino.
- Aprire il tappo (conservare il tappo) e inserire una linea di azoto nello spazio di testa del flaconcino. Regolare il flusso di azoto in modo da causare un leggero disturbo visibile sulla superficie del liquido, ma senza incanalare o spruzzare.
- Agitare la fiala subito dopo aver inserito la linea di azoto. Iniziare a bassa velocità sufficiente a formare un imbuto con il solvente che sale non più di 1 cm dal fondo del flaconcino. Evitare schizzi di solvente. Man mano che il solvente evapora, aumentare la velocità del vortice lentamente e senza pause, mantenendo l'altezza del solvente fino a quando tutto il liquido evapora. Il risultato sarà un film sottile rivestito sul terzo inferiore del flaconcino.
- Mettere la fiala in un essiccatore sottovuoto e continuare ad asciugare la pellicola sotto vuoto per 8-72 ore. Coprire il flaconcino (tranne l'apertura) o l'essiccatore con un foglio di alluminio.
NOTA: Il protocollo può essere messo in pausa qui. I passaggi successivi possono essere eseguiti dopo l'essiccazione del film, oppure i film possono essere conservati sotto argon, sigillati con Parafilm, in un congelatore a -20 °C per un massimo di 1 mese e più a lungo se mantenuti asciutti.
3. Idratazione del film lipidico
NOTA: Se le microbolle vengono utilizzate in vitro o in vivo, utilizzare puntali, tubi, siringhe e aghi per micropipette sterili per i passaggi da 3.3 a 5.4, se non diversamente specificato.
- Rimuovere la pellicola dall'aspirapolvere o, se conservata nel congelatore, lasciarla riscaldare a RT.
- Riempire un becher da 250 ml con acqua e riscaldare l'acqua a 70-80 °C.
- Riscaldare un sonicatore a bagnomaria a 69 °C.
- Micropipetta da 1 mL di AA-PGG (passaggio 1.3) lungo i bordi del flaconcino di film lipidico per evitare la formazione di bolle.
NOTA: Quando si fabbricano microbolle di controllo non chelate o solo fluorescenti, utilizzare PGG (passaggio 1.2) invece di AA-PGG. - Coprire parzialmente l'apertura del flaconcino con un tappo, lasciando spazio sufficiente per inserire una linea di perfluoropropano (PFP). Far scorrere il PFP nello spazio di testa del flaconcino per 20 s sopra il liquido, in modo che il liquido sia visibilmente disturbato ma non schizzi . Non far fluire il PFP direttamente nella sospensione. Tappare la fiala.
NOTA: Se il flusso è adeguato in termini di forza e tempo, la fiala inizierà a raffreddarsi al tatto. - Immergere la metà inferiore del flaconcino nel bagnomaria a 70-80 °C per 1 minuto. Quindi, sonicare per almeno 30 s nel bagnosonicatore a 69 °C o fino a quando il film lipidico si disperde in modo omogeneo nell'AA-PGG. Evitare la creazione di bolle o l'attivazione prematura della formazione di microbolle (l'attivazione prematura apparirà come aree lattiginose/torbide nella sospensione lipidica). Pulire la superficie del flaconcino quando necessario per discernere meglio se rimangono lipidi non sospesi.
NOTA: Se il film lipidico non si idrata entro 1 minuto dalla sonicazione, riscaldare nuovamente nel bagno a 70-80 °C e risonicare. - Una volta che il film lipidico è sospeso in modo omogeneo, riscaldare un'ultima volta per 1 minuto e sonicare per altri 30 s.
- Pulire la fiala e lasciarla raffreddare passivamente a RT (~5-10 min).
- Riempire lo spazio di testa del flaconcino con PFP come indicato al punto 3.5, chiudere e sigillare i bordi del tappo con Parafilm.
NOTA: Il protocollo può essere messo in pausa qui e ripreso dopo non oltre 8 ore.
4. Radiomarcatura
NOTA: Per il controllo non chelato o le microbolle solo fluorescenti, passare alla Sezione 5 del protocollo.
ATTENZIONE: Eseguire i passaggi 4.4-4.6 di questo protocollo in un laboratorio radioattivo, se non diversamente specificato. 64La CuCl2 è un pericolo radiologico con un rischio di tossicità multisistemica attraverso l'esposizione, l'inalazione o l'ingestione della pelle. Quando possibile, maneggiarlo in una cappa aspirante indirettamente utilizzando una pinza con punta in gomma. Indossare un camice protettivo, un dosimetro personale ad anello e badge e un doppio guanto durante la manipolazione. Assicurarsi che 64CuCl2 sia gestito attraverso una schermatura in piombo da 2 pollici. Se necessario, trasportarlo in un contenitore rivestito di piombo. Proteggere i contenitori dei rifiuti e condurre un'indagine operativa per verificare la presenza di contaminanti dopo l'uso.
- Preparare un bagnomaria a 60 °C in un becher di vetro o in una grande capsula di cristallizzazione contenente un'ancoretta magnetica. Utilizzare una piastra calda/di agitazione a temperatura controllata dotata di una sonda termica inserita nell'acqua, impostata per mescolare a una velocità che produce un imbuto debole ma visibile.
- Trasferire un flaconcino sigillato contenente 64CuCl2 in 0,1 N HCl a un calibratore di dose tramite una pinza con punta in gomma.
NOTA: Quando si ordina 64CuCl2, richiedere che venga sciolto in 5-20 μL di 0,1 N HCl. Un volume inferiore è fondamentale per preservare la resa delle microbolle. - Annotare l'attività del rame-64 misurata sul calibratore di dose e il tempo. Rimuovere il flaconcino con una pinza e metterlo in un contenitore con piombo.
- Dividere l'attività rilevata per il volume riportato per il 64CuCl2 per ottenere un valore di MBq·mL-1 .
- Stappare la sospensione lipidica dal passaggio 3.9 e fissarla in un portafiala.
- Stappare il flaconcino da 64CuCl2 e fissarlo con una pinza.
- Micropipettare un volume della soluzione da 64CuCl2 corrispondente a 40-250 MBq di attività e trasferirlo nella sospensione lipidica. Assicurarsi che il puntale della pipetta sia immerso nella sospensione. Immergere e quindi pipettare su e giù per trasferire completamente il 64CuCl2.
NOTA: La quantità di 64CuCl2 aggiunta dipenderà dall'applicazione prevista per le microbolle radiomarcate e dalla sensibilità del calibratore di dose. Per la PET longitudinale (fino a 48 ore dopo l'iniezione) e il prelievo di sangue in vivo nei topi, si raccomandano rispettivamente un minimo di 220 MBq e 50 MBq. - Tappare sia la sospensione lipidica che i flaconcini da 64CuCl2 .
- Utilizzando una pinza piatta con punta in gomma, ruotare manualmente la sospensione lipidica radioattiva su e giù almeno 5 volte per miscelare delicatamente il 64CuCl2 attraverso la sospensione. Evitare di agitare o far cadere la fiala ed evitare la formazione di bolle.
- Con il lato destro rivolto verso l'alto, muovere delicatamente il tappo della fiala mantenendo la sospensione stabilizzata. Questo aiuterà il liquido intrappolato nel tappo a gravitare sul fondo del flaconcino. Aprire parzialmente con cautela il flaconcino e inserire un tubo PFP da 18 G dotato di ago. Riempire lo spazio di testa del flaconcino con PFP per 20 s come indicato al punto 3.5. Tappare il flaconcino e sigillare con Parafilm.
- Misurare l'attività del flaconcino su un calibratore di dose e annotare il tempo.
NOTA: Se un'attività adeguata non è stata trasferita al flaconcino, ripetere i passaggi 4.5-4.11, aggiungendo un volume aggiuntivo appropriato di 64CuCl2. - Posizionare la fiala in un supporto per fiala di schiuma e spingerla in modo che la metà inferiore della fiala sia esposta al calore. Mettere il supporto nel bagnomaria a 60 °C e scaldare per 1 ora.
- Mentre segue la reazione chelante, preparare le piastre iTLC. Indossando guanti nuovi, tagliare la carta per cromatografia in microfibra di vetro in strisce di 1 cm x 8 cm. Scaldare le strisce in un forno per l'essiccazione del vetro a 80 °C.
NOTA: Questo passaggio può essere eseguito in un laboratorio non radioattivo. - Dopo 1 ora, rimuovere il flaconcino al punto 4.12 dal fuoco e pulire i bordi con un fazzoletto.
- Ruotare manualmente la fiala su e giù con una pinza con punta in gomma per ricondensare l'eventuale condensa sulle pareti della fiala nella sospensione lipidica.
- Con il flaconcino in posizione verticale, muovere il tappo mentre si stabilizza il tubo. Rimuovere il Parafilm e strofinare intorno al tappo per rimuovere l'acqua del bagno intrappolata.
- Aprire con cautela il flaconcino e aspirare 1-2 μL della sospensione lipidica. Individuare la sospensione a 1 cm dal centro inferiore di una striscia iTLC e richiudere la fiala. Lascia asciugare la macchia.
NOTA: Idealmente, per certezza, dovrebbero essere individuati almeno 2 iTLC per miscela di reazione e sviluppati per sospensione lipidica radiomarcata. - Micropipettare 200 μl dell'eluente iTLC (preparato al punto 1.4) sul fondo di una provetta da 10 mL. Riporre la provetta in un contenitore di piombo. Aggiungere l'iTLC maculato al tubo e lasciare che la striscia si sviluppi fino a quando l'eluente si trova a circa 1 cm dal bordo superiore della striscia.
- Rimuovere le strisce iTLC sviluppate utilizzando una pinza. Tenere la striscia verticalmente e tagliarla in tre su provette di plastica rotonde da 5 mL compatibili con γ banco e tappo a pressione in modo che ogni terzo striscia cada direttamente in un terzo individuale. Inserire i tappi a pressione nelle tre provette.
- Misurare le provette contenenti strisce e una provetta di controllo vuota/tappata su un contatore di γ per l'attività del rame-64 e registrare i conteggi al minuto (cpm) associati. Sottrarre l'attività della provetta di controllo dalle altre letture per correggere l'attività in background.
NOTA: Le letture corrette per il terzo inferiore della striscia (pezzo 1) sono associate a particelle di rame-64 chelate in sospensione lipidica. La sezione centrale (pezzo 2) contiene una striscia di chelati liberi di rame-64 e 64Cu-pirolipidi in forma non supramolecolare. La sezione superiore (pezzo 3) contiene prevalentemente rame-64 libero. - Calcola la purezza radiochimica tramite l'equazione 1.
 (Equazione 1)
(Equazione 1)
NOTA: se il cpm per il pezzo 1 sembra irragionevolmente basso (ad esempio, inferiore o equivalente ai pezzi 2 o 3) o se le letture sono superiori alla soglia non lineare/di saturazione del contatore γ, individuare un volume inferiore o un'aliquota diluita (1-2 μL) della sospensione radiomarcata per iTLC. - Assicurarsi che la purezza radiochimica ottenuta da entrambe le strisce iTLC per sospensione lipidica sia ≥ 94% per continuare. In caso contrario, continuare a riscaldare la sospensione lipidica a 60 °C e monitorare la chelazione a intervalli di 30 minuti tramite iTLC.
- Stappare il flaconcino di sospensione lipidica radiomarcata e la micropipetta da 8,89 μl di 1 N NaOH nella sospensione, pipettando su e giù per trasferire completamente la base e neutralizzare la sospensione. Tappare la fiala, ruotarla manualmente con una pinza per capovolgerla/capovolgerla, quindi picchiettare delicatamente il tappo della fiala.
- Riempire lo spazio di testa con PFP come al punto 4.10, tappare e sigillare con Parafilm.
5. Attivazione e isolamento delle microbolle
- Attivare la sospensione lipidica tramite un agitatore meccanico per fiale per 45 s a 4530 giri/min per generare una sospensione di microbolle lattiginose. Lasciare raffreddare passivamente la fiala a RT per circa 10 minuti. La sospensione lattiginosa risultante si separerà in due strati nel tempo.
NOTA: Il contenuto della fiala dovrebbe apparire lattiginoso dopo l'attivazione. Una sospensione più chiara dopo l'attivazione è indicativa di un'attivazione non riuscita, i cui fattori saranno discussi nelle sezioni successive. - Una volta a RT, capovolgere/capovolgere delicatamente la fiala per risospendere la sospensione di microbolle. Posizionare la fiala su una superficie piana e attendere 2 minuti prima della decantazione per ottenere la popolazione di microbolle desiderata come segue:
- Dotare una siringa di plastica da 1 ml di un ago da 18 G e sfiatare la siringa/ago aspirando e facendo entrare e uscire l'aria. Al segno dei 2 minuti, stappare rapidamente la fiala, rompendo il sigillo Parafilm con un solo movimento.
- Aspirare 400-550 μl dal fondo della fiala (popolazione target di microbolle), evitando l'aspirazione dello strato schiumoso superiore di popolazioni di microbolle indesiderate più grandi.
NOTA: Se necessario, inclinare il flaconcino su un lato per raccogliere i volumi terminali nella siringa per evitare di aspirare lo strato schiumoso/più leggero.
- Pulire accuratamente i bordi dell'ago per rimuovere eventuali contaminanti schiumosi e trasferire la sospensione di microbolle isolata in una provetta per microcentrifuga. Tappare delicatamente (non aprire o chiudere bruscamente il tappo). Questa è la sospensione di lavoro finale delle microbolle radiomarcate.
- Misurare l'attività del prodotto finale a microbolle sul calibratore di dose e annotare il tempo. Dividere questo valore per il volume di sospensione decantato al punto 5.2 per ottenere un valore MBq·mL-1 per calcolare i volumi di iniezione in base all'applicazione di interesse.
NOTA: Le microbolle radiomarcate sono ora pronte per l'uso. La sezione 6 può essere eseguita fino a 24 ore dopo. Per informazioni su come queste microbolle radiomarcate possono essere iniettate e tracciate in vivo attraverso l'imaging multimodale (ultrasuoni, PET, fluorescenza), fare riferimento a Rajora et al.15.
6. Convalida dell'efficienza della radiomarcatura
- Risospendere la sospensione di microbolle mediante pipettaggio delicato o inversione del flaconcino.
NOTA: Non vorticare mai un prodotto funzionante a microbolle. Il vortice destabilizza le sospensioni di microbolle. - Aggiungere 10-200 μl della sospensione radiomarcata a un'unità filtrante centrifuga da 0,5 mL con cut-off molecolare (MWCO) da 30.000 mL. Se si utilizzano volumi <200 μl, aggiungere ddH2O all'unità filtrante per ottenere un volume totale di 200 μl. Alloggiare l'unità filtro in una provetta da microcentrifuga compatibile e in un tappo.
NOTA: Si raccomanda di condurre un test di radiomarcatura prima e separatamente da qualsiasi uso applicato in vitro o in vivo di microbolle radiomarcate per garantire il corretto completamento del protocollo. In questo caso, in questa fase potrebbe essere utilizzato un volume maggiore (ad esempio, 200 μL). Quando il protocollo viene successivamente utilizzato per una sessione di trattamento, preparare prima i volumi di trattamento/iniezioni, quindi condurre la sezione 6 con la sospensione di microbolle radiomarcata rimanente il prima possibile. - Centrifugare per 10 minuti a 12.000 x g a RT.
NOTA: la microcentrifuga deve essere circondata da una schermatura in piombo. - Tagliare il collegamento tra la provetta della microcentrifuga e il suo tappo con le forbici.
- Mettere il tappo in un flaconcino di scintillazione da 20 ml etichettato "caps". Trasferire l'unità filtro in una nuova provetta per microcentrifuga (provetta 2).
- Inserire la prima provetta da microcentrifuga con infranatante in una fiala a scintillazione da 20 mL etichettata come "provetta 1". Aggiungere 200 μl di ddH2O all'unità filtro nella provetta 2.
- Centrifugare l'unità filtro nella provetta 2 a 12.000 x g a RT.
- Ripetere i passaggi 6.4 e 6.5. Aggiungere il tappo della provetta 2 alla fiala di scintillazione "caps" che ospita il tappo della provetta 1. Posizionare la provetta 2 in una nuova fiala di scintillazione da 20 mL.
- Tagliare il tappo della terza provetta per microcentrifuga e inserirlo nel flaconcino "tappi" come al punto 6.4. Trasferire l'unità filtrante in una nuova fiala di scintillazione da 20 mL etichettata come "unità", assicurandosi che l'infranatante rimanga nella provetta 3 e non venga trasferito nella fiala "unità". Se si notano gocce sui bordi dell'unità filtro, rimetterla nel tubo 3, chiudere e far girare verso il basso per 10 s. Posizionare la provetta 3 in una nuova fiala di vetro scintillante da 20 mL.
- Tappare le 5 fiale di scintillazione (provetta 1, provetta 2, provetta 3, tappi e unità). Preparare una fiala di scintillazione vuota e tappata da 20 mL come controllo in bianco.
- Misurare le sei fiale di scintillazione su un contatore di γ per l'attività del rame-64. Sottrarre l'attività della fiala vuota da quella delle altre fiale. Calcolare l'efficienza di radiomarcatura/chelazione utilizzando l'equazione 2.
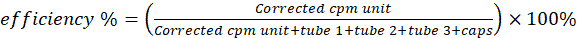 (Equazione 2)
(Equazione 2)
NOTA: Se il cpm dell'unità è irragionevolmente basso (es, inferiore o equivalente alle provette) o se le letture sono superiori alla soglia non lineare/di saturazione del contatore γ, conservare le fiale di scintillazione in contenitori di piombo per un massimo di 4 giorni per consentire il decadimento dell'attività fino a quando i valori non sono inferiori alla soglia e rimisurare.
7. Caratterizzazione fisico-chimica delle microbolle
NOTA: A meno che un laboratorio non disponga di apparecchiature designate per l'elaborazione di campioni radioattivi, la caratterizzazione fisico-chimica a microbolle deve essere condotta utilizzando campioni non radioattivi, "freddi" chelati con rame. Questa etichettatura "a freddo" facilita la valutazione della resa delle microbolle, che è fondamentale per valutare la dose di microbolle utilizzate per l'applicazione prevista. Inoltre, consente il confronto con microbolle di controllo non chelate per garantire che il processo di radiomarcatura non perturbi le proprietà delle microbolle. Questa marcatura "a freddo" e la caratterizzazione fisico-chimica associata dovrebbero avvenire prima dell'applicazione della microbolla radiomarcata e possono essere utilizzate come feedback se sono necessarie modifiche alla radiomarcatura (vedi Discussione).
- Etichettatura "a freddo" con microbolle di rame
- Utilizzando il volume della soluzione di 64CuCl2 aggiunto alla sospensione lipidica al passaggio 4.7, la composizione della percentuale molare di porfirina all'interno dei film lipidici e l'attività specifica riscontrata nella scheda prodotto di 64CuCl2 , calcolare il rapporto molare approssimativo metallo:porfirina raggiunto durante la marcatura radioattiva. Esempi di calcoli sono disponibili nel file supplementare 1.
- Seguire le sezioni 1-3 del protocollo corrente.
- Preparare una soluzione di 0,1 mg·mL-1 CuCl2 in 0,1 N HCl.
- Micropipettare il volume appropriato di questa soluzione di CuCl2 nella sospensione lipidica calcolata dal punto 7.1.1 e tappare il flaconcino.
- Ruotare la fiala per miscelare il CuCl2 nella sospensione lipidica, riempire lo spazio di testa con PFP, sigillare e riscaldare come indicato nei passaggi 4.9, 4.10 e 4.12. Le pinze di gomma non sono necessarie per la manipolazione delle fiale.
- Dopo 1 ora, togliere la fiala dal fuoco e asciugare l'esterno. Lasciare raffreddare la fiala fino a RT.
- Neutralizzare la sospensione lipidica, mescolare, riempire lo spazio di testa con PFP e sigillare come indicato nei passaggi 4.23 e 4.24.
- Attivare la sospensione di microbolle e decantare per ottenere un prodotto funzionante come per i passaggi 5.1-5.3.
- Dimensionamento delle microbolle
NOTA: Il dimensionamento delle microbolle deve essere effettuato immediatamente dopo l'attivazione. Se si valuta la stabilità della sospensione di lavoro, ripetere la preparazione del campione e le misurazioni a intervalli di 30 minuti. Tipicamente, una finestra di 1-2 ore è rappresentativa dell'intervallo di tempo in cui la sospensione di lavoro a microbolle verrebbe utilizzata/somministrata dopo l'attivazione. Lo scopo delle misurazioni di stabilità è quello di garantire che le dimensioni e la resa delle microbolle siano mantenute in questo lasso di tempo, in modo che tutti i trattamenti somministrati dalla soluzione di lavoro contengano popolazioni di microbolle simili.- Accendere il contatore di coltri (CC) e impostare i seguenti parametri utilizzando lo strumento Modifica SOP : apertura 30 μm, intervallo dimensionale 0,6-18 μm, corrente di apertura 400-600 μA, guadagno del preamplificatore 4-8, 400 bin, lavaggio prima e dopo ogni corsa, analisi volumetrica, volume del campione 5 μL.
- Filtrare l'elettrolita CC attraverso un'unità di filtrazione sottovuoto con media da 0,2 μm. Riempire il contenitore dell'elettrolita e un contenitore separato per la preparazione del campione.
- Misurazione di base: riempire una cuvetta monouso da 10 ml con elettrolita filtrato da 10 ml ed eseguire una misurazione di base. Assicurati che i conteggi siano inferiori a 400. In caso contrario, lavare lo strumento.
- Misurazione del campione
- Aggiungere 10 ml di elettrolita filtrato a una nuova cuvetta. Risospendere la sospensione a microbolle invertendo/invertendo manualmente. Micropipetta a 5 μl dal centro inferiore del flaconcino. Pulire i bordi della punta della pipetta (tranne l'apertura) e immergere il campione direttamente nell'elettrolita preparato.
- Pipettare su e giù per trasferire completamente la sospensione. Utilizzare la punta della pipetta per far roteare delicatamente l'elettrolita fino a quando i "ciuffi" di sospensione di microbolle non si disperdono.
- Misurare il campione sul CC (due cicli per analita).
NOTA: Un volume di campione di microbolle di 5 μL è in genere appropriato per campioni contenenti concentrazioni di 1-5 x 109 microbolle·mL-1 . Potrebbe essere necessario regolare questo volume del campione a seconda della configurazione specifica dello strumento CC e se la resa delle microbolle del campione non rientra nell'intervallo sopra indicato.
- Imaging confocale
NOTA: Condurre l'imaging confocale immediatamente dopo il dimensionamento delle microbolle ed entro il periodo di stabilità delle microbolle mantenuto come indicato nella nota al punto 7.2.- Risospendere la sospensione di microbolle e trasferire 1-5 μL al centro di un vetrino da microscopio in vetro. Posizionare con cura un vetrino coprioggetti sulla gocciolina di sospensione a microbolle, evitando l'intrappolamento di bolle d'aria. La sospensione si diffonderà sotto il vetrino coprioggetto.
- Immagine delle microbolle con un ingrandimento di 60x con un obiettivo a immersione in olio. Ottenere immagini in campo chiaro e sotto eccitazione di 633 nm/emissione di 640-765 nm. Sovrapponi le immagini in campo chiaro e in fluorescenza.
NOTA: Il segnale di fluorescenza dovrebbe sovrapporsi al guscio di tutte le particelle visibili quando la sonda è incorporata in modo omogeneo all'interno del guscio della microbolla.
- Spettrofluorimetria
NOTA: Le misure spettrofluorimetriche possono essere condotte entro 24 ore dall'attivazione delle microbolle.- Preparare l'1% di Triton X-100 come descritto in precedenza35.
- Accendere lo spettrofluorimetro 15-30 minuti prima della prima misurazione.
- Misura gli spettri di fluorescenza dell'1% di Triton X-100 utilizzando un'eccitazione di 410 nm e un intervallo di emissione di 600-800 nm in una cuvetta di quarzo. Selezionare l'opzione per normalizzare il segnale in base al segnale del rivelatore di riferimento (spesso indicato come S1/R1).
NOTA: Triton X-100 bolle facilmente quando pipettato. Pertanto, durante il trasferimento in una cuvetta, immergersi solo fino al primo arresto della micropipetta. - Sciacquare la cuvetta con metanolo e asciugarla con aria pressurizzata tra un campione e l'altro.
- Trasferire 6 mL di Triton X-100 all'1% in una provetta da centrifuga da 15 mL. Risospendere la sospensione di microbolle e aspirare 1 μl tramite micropipetta. Pulire i bordi del puntale della pipetta, ad eccezione dell'apertura, e trasferire il campione nel Triton X-100 all'1% preparato, pipettando verso l'alto e verso il basso per completare il trasferimento. Agitare la soluzione e trasferirla in una cuvetta di quarzo.
NOTA: Regolare il rapporto del campione: 1% Triton X-100 in base alla sensibilità dello strumento e alla soglia di saturazione non lineare. - Misurare questo campione utilizzando i parametri del passaggio 7.4.3. Questa misura corrisponde alle particelle "disgregate".
- Ripetere i passaggi 7.4.3-7.4.6 utilizzando PBS. Questa misura corrisponde a particelle "intatte".
- Correggi al basale gli spettri del campione interrotti e intatti utilizzando rispettivamente le misurazioni Triton X-100 e PBS all'1%.
- Calcolare l'efficienza di quenching (QE) tramite l'equazione 3 utilizzando il segnale di fluorescenza integrato corretto per la linea di base del campione intatto in PBS (FPBS) e in Triton X-100 all'1% (FTx):
 (Equazione 3)
(Equazione 3)
- Spettroscopia UV-Vis
NOTA: Le misure di spettroscopia possono essere condotte fino a 72 ore dopo l'attivazione delle microbolle.- Sonicare un'aliquota della sospensione di microbolle in una provetta da microcentrifuga utilizzando un sonicatore a bagno a RT fino a quando la sospensione è trasparente. Ciò riduce gli effetti di dispersione durante la spettroscopia.
- Accendere lo spettrofotometro 10 minuti prima della prima misurazione. Selezionare un intervallo di scansione di 0,25 nm e un intervallo di acquisizione di 200-800 nm. Abilita la sottrazione della linea di base.
- Utilizzare una cuvetta di quarzo lunga 1 cm per le misurazioni. Sciacquare la cuvetta con metanolo tra una misurazione e l'altra e asciugarla con aria pressurizzata.
- Ottenere una misurazione di base del metanolo.
- Agitare la sospensione di microbolle sonicata e trasparente e trasferire 10-50 μl in una provetta per microcentrifuga contenente 200-1000 μl di metanolo. Assicurarsi che il volume di metanolo sia misurato e aggiunto alla provetta tramite una siringa da microlitri di vetro pulita. Vortex la soluzione per ottenere un campione "interrotto".
NOTA: La diluizione del campione dipenderà dall'efficienza di caricamento della porfirina e dalla composizione della % molare. Una diluizione 20x è appropriata per una composizione di microbolle pirolipidiche al 30% mol. - Raccogli lo spettro UV-Vis.
- Ripetere i passaggi da 7.5.4 a 7.5.6 utilizzando PBS anziché metanolo.
NOTA: Una micropipetta può essere utilizzata per misurare i volumi di PBS al posto di una siringa da microlitri di vetro.
8. Modifiche al protocollo
- Chelante alternativo
- Preparare film lipidici come indicato nella sezione 2, sostituendo il piro-lipide con un chelante alternativo di rame coniugato con lipidi (ad esempio, acido 1,2-dipalmitoil-sn-glicero-3-fosfoetanolammina-N-dietilentriamminapentaacetico (sale di ammonio), d'ora in poi denominato DTPA-lipide). Utilizzare il file supplementare 1 per calcolare la massa e i volumi di magazzino richiesti.
NOTA: È probabile che sia necessario testare varie composizioni molari di un chelante alternativo per determinare il limite superiore oltre il quale non è possibile generare microbolle stabili con rese elevate. - Seguire le sezioni da 3 a 6 per generare e caratterizzare le microbolle radiomarcate.
- Seguire i passaggi da 7.1 a 7.3 per caratterizzare le microbolle chelate con rame "fredde". Per valutare la morfologia delle particelle è necessaria solo l'acquisizione di immagini al microscopio confocale in campo chiaro. Se il chelante alternativo è fluorescente, eseguire la microscopia confocale con le lunghezze d'onda di eccitazione ed emissione associate oltre ai passaggi 7.4 e 7.5.
- Preparare film lipidici come indicato nella sezione 2, sostituendo il piro-lipide con un chelante alternativo di rame coniugato con lipidi (ad esempio, acido 1,2-dipalmitoil-sn-glicero-3-fosfoetanolammina-N-dietilentriamminapentaacetico (sale di ammonio), d'ora in poi denominato DTPA-lipide). Utilizzare il file supplementare 1 per calcolare la massa e i volumi di magazzino richiesti.
- Fluoroforo alternativo
- Preparare film lipidici come indicato nella sezione 2, sostituendo il piro-lipide con un fluoroforo alternativo coniugato o intercalante lipidico (ad es. DiI). Utilizzare il file supplementare 1 per calcolare la massa e i volumi di magazzino richiesti.
NOTA: È probabile che sia necessario testare varie composizioni molari di un fluoroforo alternativo per determinare il limite superiore oltre il quale non è possibile generare microbolle stabili con rese elevate. - Seguire la sezione 3 utilizzando PGG invece di AA-PGG.
- Completa i passaggi da 5.1 a 5.3 e i passaggi da 7.2 a 7.5.
- Preparare film lipidici come indicato nella sezione 2, sostituendo il piro-lipide con un fluoroforo alternativo coniugato o intercalante lipidico (ad es. DiI). Utilizzare il file supplementare 1 per calcolare la massa e i volumi di magazzino richiesti.
- Approccio "spiking": etichettatura di sospensioni lipidiche preformate a microbolle
- Generare un film di porfirina-lipidico come da sezione 2, utilizzando solo piro-lipidi senza altri costituenti lipidici. Fare riferimento al File Supplementare 1 per le quantità di pirolipidi.
- Idratare il film pirolipidico come indicato nella sezione 3 utilizzando 100-200 μL di AA-PGG (o PGG se non è richiesta la radiomarcatura) invece di 1 mL di tampone di idratazione.
- Trasferire l'intera sospensione pirolipidica in una sospensione di microbolle lipidiche preconfezionata.
- Riempire lo spazio di testa con PFP, riscaldare e sonicare la sospensione e sigillare sotto PFP come indicato nei passaggi da 3.4 a 3.9. Monitorare la dispersione della sospensione di pirolipidi nella sospensione di microbolle lipidiche preconfezionata ed eseguire cicli di calore/sonicazione fino alla completa dispersione.
NOTA: Se si utilizza una fiala commerciale a microbolle sigillata con setto, la sospensione pirolipidica può essere introdotta nella fiala attraverso una siringa/ago senza riempire lo spazio di testa della fiala con PFP. - Eseguire la marcatura radio (vedere il passaggio 8.3.5.1 di seguito), l'attivazione, l'isolamento (vedere la NOTA di seguito) e la relativa caratterizzazione secondo le sezioni da 4 a 7.
- Un approccio alternativo consiste nel radiomarcare prima la sospensione pirolipidica idrata, monitorare la purezza radiochimica del >94%, neutralizzare con 1 N NaOH (modificare il volume in base al volume AA-PGG utilizzato per idratare il film pirolipidico) e quindi introdurre la sospensione pirolipidica radiomarcata nella sospensione lipidica a microbolle prefabbricata come indicato al punto 8.3.3.
NOTA: Questo approccio modificato dovrebbe essere utilizzato per generare microbolle radiomarcate fluorescenti o multimodali solo se seguito da un processo di isolamento che rimuove le vescicole multilamellari submicroniche create durante l'idratazione lipidica ma non incorporate nelle microbolle. Vedi Discussione per ulteriori dettagli.
- Un approccio alternativo consiste nel radiomarcare prima la sospensione pirolipidica idrata, monitorare la purezza radiochimica del >94%, neutralizzare con 1 N NaOH (modificare il volume in base al volume AA-PGG utilizzato per idratare il film pirolipidico) e quindi introdurre la sospensione pirolipidica radiomarcata nella sospensione lipidica a microbolle prefabbricata come indicato al punto 8.3.3.
Risultati
I principali risultati quantificabili nella fabbricazione di microbolle radiomarcate sono la purezza radiochimica e l'efficienza della radiomarcatura. Questo protocollo utilizza rispettivamente iTLC e una procedura centrifuga convalidata per caratterizzare ciascuno. La Figura 2A mostra che la purezza radiochimica media e l'efficienza del ≥95% sono state raggiunte attraverso formulazioni commerciali che imitano le microbolle in cui il lipide ospite è stato...
Discussione
L'attuale protocollo di radiomarcatura con microbolle lipidiche raggiunge una purezza radiochimica del >95%, un'efficienza di chelazione del >95% e il mantenimento delle proprietà fisico-chimiche delle microbolle senza richiedere alcuna purificazione post-marcatura. Questi risultati rappresentano progressi precedentemente non raggiunti per i protocolli di etichettatura esistenti. La mancanza di passaggi di purificazione consente un uso più rapido dei radioisotopi (in questo caso, il ra...
Divulgazioni
Gli autori non segnalano conflitti di interesse.
Riconoscimenti
Ringraziamo Deborah Scollard e Teesha Komal (University Health Network Spatio-Temporal Targeting and Amplification of Radiation Response (STTARR) program, Toronto, Ontario) per i loro servizi tecnici e la loro guida. Ringraziamo anche Mark Zheng e il Dr. Alex Dhaliwal per la loro assistenza tecnica durante la microscopia confocale e l'Advanced Optical Microscopy Facility (Toronto, Ontario) per aver fornito le apparecchiature associate. Riconosciamo le nostre fonti di finanziamento: il Canadian Institutes of Health Research, il Terry Fox Research Institute, il Natural Sciences and Engineering Research Council of Canada, la Canada Foundation for Innovation, la Princess Margaret Cancer Foundation, il Canada Research Chairs Program, il McLaughlin Centre, il Vanier Scholarship Program, l'Ontario Graduate Student Scholarship Program, Prostate Cancer Canada e la Peterborough K. M. Hunter Charitable Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Riferimenti
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon