Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fabrication et marquage de microbulles à l’aide de traceurs fluorescents et radioactifs
Dans cet article
Résumé
Ce protocole décrit la fabrication de microbulles lipidiques et une méthode compatible de radiomarquage des microbulles en un seul pot avec une efficacité de marquage de >95 % sans purification qui préserve les propriétés physicochimiques des microbulles. Cette méthode est efficace sur diverses formulations de microbulles lipidiques et peut être adaptée pour générer des microbulles radioactives et/ou fluorescentes.
Résumé
Les microbulles sont des particules remplies de gaz à enveloppe lipidique qui sont passées d’agents de contraste à ultrasons vasculaires à des plateformes révolutionnaires de traitement du cancer. Lorsqu’ils sont associés à des ultrasons focalisés thérapeutiques (FUS), ils peuvent surmonter en toute sécurité et localement les barrières physiologiques (par exemple, la barrière hémato-encéphalique), administrer des médicaments à des cancers autrement inaccessibles (par exemple, le glioblastome et le cancer du pancréas) et traiter les maladies neurodégénératives. L’arsenal thérapeutique de la microbulles-FUS progresse dans de nouvelles directions, notamment la radiothérapie combinée synergique, l’imagerie multimodale et le chargement et l’administration de médicaments tout-en-un à partir de coquilles de microbulles.
Le marquage des microbulles avec des radiotraceurs est essentiel pour établir ces capacités théranostiques élargies. Cependant, les stratégies existantes de radiomarquage des microbulles reposent sur des méthodologies de purification connues pour perturber les propriétés physicochimiques des microbulles, utiliser des radio-isotopes à courte durée de vie et ne pas toujours produire une chélation stable. Collectivement, cela crée une ambiguïté quant à la précision de la radioimagerie des microbulles et à l’efficacité de l’administration des radio-isotopes tumoraux.
Ce protocole décrit une nouvelle méthodologie de marquage des microbulles en un seul pot, sans purification, qui préserve les propriétés physicochimiques des microbulles tout en atteignant une efficacité de chélation des radio-isotopes de >95 %. Il est polyvalent et peut être appliqué avec succès dans des formulations de microbulles personnalisées et commerciales avec différentes longueurs de chaîne lipidique acyle, charge et composition chélateur/sonde (porphyrine, DTPA, DiI). Il peut être appliqué de manière adaptative lors de la fabrication de microbulles broyées et à des formulations de microbulles préfabriquées avec une personnalisation modulaire de la fluorescence et des propriétés multimodales de fluorescence/radioactive. En conséquence, cette méthode flexible permet de produire des microbulles multimodales sur mesure et traçables (radio, fluorescentes ou radio/fluorescentes actives) qui sont utiles pour faire progresser les applications mécanistes, d’imagerie et thérapeutiques des microbulles-FUS.
Introduction
Les microbulles sont des agents théranostiques supramoléculaires de la taille d’un micron avec un noyau gazeux stabilisé par une protéine, un polymère ou, dans la plupart des cas, une enveloppe lipidique (Figure 1A). Lorsqu’elles sont injectées dans la circulation sanguine, les microbulles maintiennent des interfaces gaz/liquide qui sont détectables par ultrasons pendant des périodes de quelques minutes avant la dissolution de leurs noyaux de gaz 1,2. Par conséquent, la première utilisation clinique des microbulles a été celle des agents de contraste d’imagerie par ultrasons en temps réel3. L’invention des ultrasons focalisés thérapeutiques (FUS) a élargi les possibilités cliniques des microbulles. Lorsqu’elles sont stimulées par des FUS à basse fréquence, les microbulles oscillent et génèrent des forces mécaniques ciblées et réglables allant de la perméabilisation vasculaire transitoire à l’ablation des tissus focaux 4,5. En conséquence, au cours des 20 dernières années, la microbulle-FUS a été explorée pour l’ouverture de la barrière hémato-encéphalique (BHE), l’administration de médicaments tumoraux (par exemple, le cancer métastatique du pancréas, du cerveau et du foie), la thérapie des maladies neurodégénératives et l’ablation du cancer 6,7,8,9,10,11.
L’arsenal théranostique de microbulles continue de progresser dans de nouvelles directions passionnantes. Les applications conventionnelles d’administration de microbulles FUS reposent sur la co-administration de cargaisons thérapeutiques ou d’imagerie avec des microbulles commerciales. On s’intéresse de plus en plus à l’amélioration des capacités d’administration de microbulles et de FUS en comprenant les interactions entre la coquille des microbulles et les interactions biologiques, en explorant des formulations de microbulles non commerciales sur mesure et en générant des microbulles théranostiques tout-en-un avec une cargaison chargée directement sur la coquille de microbulles 12,13,14. En fait, environ 40 % des études sur l’administration de médicaments à base de microbulles lipidiques utilisent de telles microbulles chargées en coquille15. Au-delà de l’imagerie et de l’administration de médicaments, la microbulle-FUS s’est également révélée prometteuse pour améliorer la radiothérapie du cancer16 et activer les effets antinéoplasiques d’agents chargés en coquille autrement bénins grâce à la thérapie sonodynamique17,18.
Ces directions conventionnelles et élargies dans les applications du cancer des microbulles peuvent être avancées de manière plus stratégique en marquant les coquilles de microbulles avec des traceurs radioactifs. Dans le domaine des microbulles chargées de fret tout-en-un, un tel radiomarquage 1) facilite l’évaluation quantitative de référence de la biodistribution sur et hors cible de ces coquilles de microbulles chargées, 2) déduit des relations structure-activité pharmacocinétiques qui permettent de sélectionner de manière optimale les compositions de microbulles afin de maximiser l’administration sur la cible, et 3) guide la planification stratégique et appropriée de l’application et du traitement guidée par l’image (par exemple, les types de cibles tissulaires, dosimétrie, sélection de médicaments pour atténuer les problèmes de sécurité hors cible, utilité par rapport aux paradigmes de co-traitement conventionnels) des systèmes tout-en-un chargés de marchandises15,19. À un stade préclinique, une telle compréhension du devenir de la coquille des microbulles peut également éclairer des mécanismes d’action plus larges entre les microbulles et le FUS. Par exemple, il a été démontré que le transfert de lipides des coquilles de microbulles vers les cellules cibles influence la sonoporation activée par FUS12,20. La compréhension et l’optimisation d’un tel transfert peuvent donc éclairer les thérapies précliniques et cliniques de microbulles FUS dans lesquelles la sonoporation est impliquée (transfection in vitro, administration de médicaments, ablation tumorale, sensibilisation aux radiations et thérapie sonodynamique 20,21,22,23,24,25). Des installations doubles d’échographie et de radioimagerie permettraient également de surveiller l’ouverture des vaisseaux FUS et le traitement (p. ex., cinétique d’ouverture de la BHE) à partir d’un seul agent plutôt que de conceptions conventionnelles à deux agents26. Dans le même ordre d’idées, le radiomarquage par microbulles lipidiques pourrait servir d’alternative tout-en-un à agent unique microbulles-FUS/radiothérapie aux plateformes de co-administration microbulles-FUS + radiopharmaceutiques27.
La fragilité des microbulles est un défi non négligeable à un tel étiquetage. Toutes les stratégies de radiomarquage existantes sont limitées par des méthodologies de purification connues pour perturber la stabilité et la taille des microbulles, tandis que certaines présentent également un radiomarquage inefficace et instable 28,29,30,31,32. Les exigences de purification entraînent également des protocoles plus longs. Combiné à l’utilisation de radio-isotopes à courte durée de vie (p. ex., 18F t1/2 1,8 h, 28,29 99mTc t1/2 6 h, 3268Ga t1/2 1 h31), cela crée des inefficacités liées à la désintégration des radio-isotopes et limite les délais de planification de la radioimagerie et du traitement. Collectivement, ces limitations risquent d’entraîner l’acquisition d’une radioimagerie raccourcie et non représentative, de données pharmacocinétiques inexactes et d’une administration inefficace de radio-isotopes tumoraux.
Dans ce rapport, ces limites sont surmontées en exploitant les capacités de chélation des métaux solides et stables de la porphyrine. Les porphyrines sont des macromolécules organiques hétérocycliques avec un anneau planaire hautement conjugué et un site de coordination central qui peut accueillir une variété de métaux. Cela comprend des radio-isotopes à vie plus longue tels que le cuivre-64 (t1/2 12,7 h), un produit radiopharmaceutique avec tomographie par émission de positons (TEP) et les faisabilités de comptage de γ33. Lorsqu’elles sont conjuguées à un squelette lipidique, les porphyrines peuvent être facilement incorporées dans des structures supramoléculaires et ensuite marquées avec du cuivre-64 avec une vitesse, une efficacité de chélation élevée et une stabilité sérique, tout en conservant les propriétés des particules mères non marquées33,34. De plus, les porphyrines sont actives par fluorescence avec une auto-extinction modulaire dans les nanoparticules et les microparticules qui est restaurée lors de la rupture des particules ; une lecture complémentaire à la TEP et au comptage γ qui facilite l’analyse du destin de la coquille en vrac et microscopique (Figure 1A)15.
En utilisant la porphyrine-lipide comme chélateur, ces propriétés ont été exploitées pour générer une nouvelle méthodologie de radiomarquage des microbulles en un seul pot, sans purification (Figure 1B, C) qui surmonte les limites associées aux méthodes existantes de radiomarquage des microbulles. Ce protocole atteint une efficacité de chélation de >95 % du cuivre 64, ne nécessite pas de purification post-marquage et préserve les propriétés physicochimiques des microbulles. Il peut être facilement intégré dans la fabrication « bée » de microbulles lipidiques avant leur activation (Figure 1B). Il est polyvalent et peut être appliqué avec succès dans des formulations de microbulles personnalisées et commerciales avec différentes longueurs de chaîne lipidique acyle (C16 à C22), charge (neutre et anionique) et compositions porphyrine-lipide (1 % mol, 10 % mol, 30 %), générant des microbulles avec une activité radio et de fluorescence. Sa capacité d’adaptation peut également s’étendre au-delà de la porphyrine. Le protocole à un seul pot peut être modifié pour utiliser d’autres chélateurs disponibles dans le commerce (p. ex., le pentaacétate de diéthylènetriamine [DTPA)-lipide]) et des fluorophores (p. ex., DiI). Il peut également être modifié pour étiqueter des formulations de microbulles préfabriquées grâce à une approche de « dopage ». En conséquence, cette méthode permet de produire des microbulles sur mesure et traçables (radio, fluorescentes ou double radio/fluorescente actives) utiles pour faire progresser les applications mécanistes, d’imagerie et thérapeutiques des microbulles-FUS. Le protocole ci-dessous décrit la fabrication de microbulles lipidiques, l’application du protocole de radiomarquage à un pot, le radiomarquage requis et la caractérisation des propriétés physicochimiques, ainsi que les modifications potentielles.
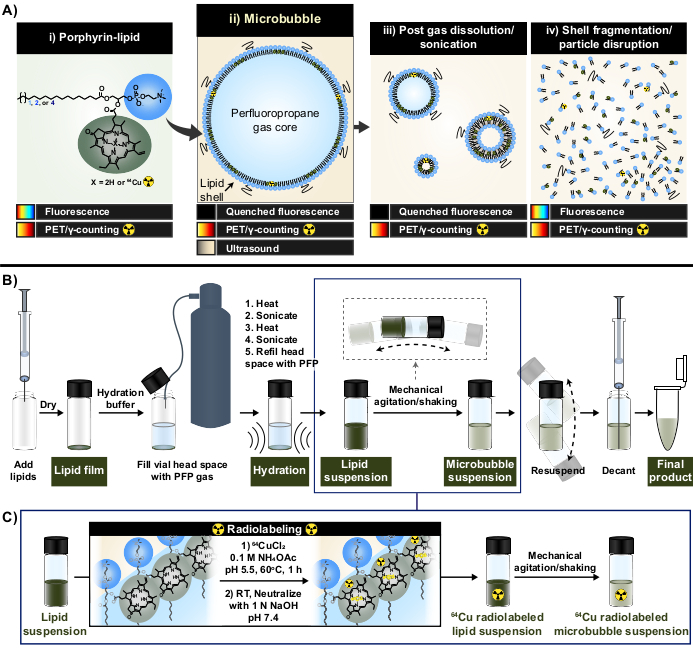
Figure 1 : Protocole de fabrication de microbulles et de radiomarquage. (A) La porphyrine-lipide, sous forme de pyrophéophorbide-a-lipide, sert de chélateur multimodal dans ce protocole. En tant que monomère chélaté en cuivre-64 (i), il a des capacités de TEP et d’imagerie. Sa fluorescence est éteinte sous forme de particules (microbulles (ii) et leur nanodescendance post-dissolution (iii)) et non éteinte avec perturbation des particules (iv). (B) Protocole d’hydratation/activation du film lipidique décrit dans le présent rapport pour générer des microbulles lipidiques à partir du sol et (C) intégration du radiomarquage à un seul pot entre la formation de suspension lipidique et l’activation des microbulles. Cette figure a été adaptée avec la permission de Rajora et al.15. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
1. Préparations de réactifs
- Préparez un tampon d’acétate d’ammonium (0,1 M, pH 5,5)
- À l’aide d’une balance d’analyse, peser 770,8 mg d’acétate d’ammonium sur un papier de pesée. Transférez la quantité pesée dans un bécher en verre propre de 250 ml.
- Ajouter 90 mL d’eau distillée double (jjH2O), mesurée à l’aide d’une pipette graduée, dans le bécher. Ajoutez une barre d’agitation et placez le bécher sur une plaque d’agitation magnétique pour dissoudre l’acétate d’ammonium. Remuez à une vitesse qui crée un léger vortex mais sans éclaboussures de solution.
- Étalonnez un pH-mètre selon les instructions de l’instrument en utilisant des normes de pH 4 et 7. Une fois calibré, insérez la sonde de pH dans le tampon d’acétate d’ammonium.
- Ajoutez 104 μL d’acide acétique à la solution, remuez pour dissoudre et mesurez le pH.
REMARQUE : Le pH doit être proche de 5,5 à ce stade. - Ajustez le pH du tampon en ajoutant 10 N d’hydroxyde de sodium (ou d’acide chlorhydrique si le tampon devient trop basique) par incréments de 5 à 10 μL à l’aide d’une micropipette. Remuez, mesurez le pH et répétez si nécessaire. Notez le volume de base/acide ajouté.
- Ajoutez suffisamment de volume de jjdH2O pour créer un total de 100 mL de tampon.
REMARQUE : Par exemple, si 45 μL d’hydroxyde de sodium 10 N ont été utilisés lors de l’ajustement du pH, 9,851 mL de ddH2O seraient ajoutés au bécher (100 mL [volume cible] - 90 mL [étape 1.1.2] - 0,104 mL [étape 1.1.4] - 0,045 mL [étape 1.1.5] = 9,851 mL). - Remuez soigneusement la mémoire tampon une dernière fois avant de la transférer dans un récipient de stockage à couvercle.
- Nettoyez le pH-mètre selon les instructions de l’instrument.
ATTENTION : L’hydroxyde de sodium aqueux concentré et l’acide chlorhydrique peuvent provoquer des réactions cutanées et doivent être manipulés avec des gants.
- Préparer le tampon d’hydratation (PGG)
- Aspirez une solution saline tamponnée au phosphate (PBS) dans une seringue et équipez l’extrémité d’un filtre de seringue en polyéthersulfone de 0,2 μm de taille de pore. Filtrez le PBS dans un tube à centrifuger en plastique propre et à couvercle.
REMARQUE : Des filtres à seringue à pores de 0,2 μm de matériaux membranaires alternatifs (par exemple, fluorure de polyvinylidène) peuvent être utilisés tant que la membrane est compatible avec le PBS et l’acétate d’ammonium. - Combinez du PBS filtré, du propylène glycol et du glycérol à l’aide d’une micropipette dans un rapport volumétrique de 8:1:1 pour former le tampon d’hydratation (également appelé PGG). Lors de l’ajout de propylène glycol et de glycérol, aspirez et essuyez toutes les gouttelettes résiduelles de propylène glycol ou de glycérol de la surface de la pointe de la pipette avant de pipeter lentement le réactif dans le PBS. Une turbidité visqueuse claire comme une corde sera observée dans le PBS.
REMARQUE : Il est recommandé d’utiliser une micropipette p1000 pour ajouter d’abord du PBS dans un tube à centrifuger, puis du propylène glycol et du glycérol, car ces deux derniers réactifs sont visqueux. En tant que tels, ils doivent être aspirés lentement via la micropipette jusqu’à ce qu’il n’y ait plus de mouvement de fluide dans la pointe de la pipette et de sorte qu’aucun air ne soit absorbé lorsque la pointe de la pipette est retirée du réactif. Idéalement, les pointes de micropipette avec des marques volumétriques doivent être utilisées pour choisir des volumes de réactifs qui s’alignent avec ces marques (par exemple, en produisant 1 mL ou 5 mL de PGG, et en utilisant respectivement le repère de 0,1 mL ou 0,5 mL sur la pointe de la micropipette pour visualiser l’aspiration complète du propylène glycol et du glycérol). Lorsque vous essuyez la surface de la pointe de la micropipette, n’essuyez pas l’ouverture de la pointe, mais uniquement les côtés. - Pipeter de haut en bas avec la pointe de la pipette dans la solution jusqu’à ce que les réactifs soient dissous de manière homogène. Veillez à ne pas introduire de bulles d’air dans la solution.
- Pour assurer un mélange complet du tampon d’hydratation, bouchez le tube de centrifugation et tournez-le lentement de haut en bas. Ne faites pas de vortex.
- Faites tourner le tube à moins de 1000 x g pendant 20 à 30 s (température minimale de 4 °C, RT maximum) pour éliminer les bulles d’air non observables.
- Aspirez une solution saline tamponnée au phosphate (PBS) dans une seringue et équipez l’extrémité d’un filtre de seringue en polyéthersulfone de 0,2 μm de taille de pore. Filtrez le PBS dans un tube à centrifuger en plastique propre et à couvercle.
- Préparation du tampon d’hydratation/radiomarquage (AA-PGG)
- Filtre à seringue 0,1 M, tampon en acétate d’ammonium pH 5,5 (à partir de l’étape 1.1) et PBS dans des tubes séparés conformément à l’étape 1.2.1.
- Combinez un tampon d’acétate d’ammonium filtré, du PBS filtré, du propylène glycol et du glycérol à l’aide d’une micropipette p1000 dans un tube à centrifuger dans un tampon d’acétate d’ammonium 5:3:1:1 : PBS : propylène glycol : rapport volumétrique de glycérol dans l’ordre indiqué. Suivez les instructions d’aspiration, de mélange et de centrifugation selon les étapes 1.2.2 à 1.2.5 pour fabriquer de l’AA-PGG.
- Éluant instantané par chromatographie sur couche mince (iTLC)
- Peser jusqu’à 0,1 g d’acide éthylènediaminetétraacétique (EDTA) et transférer dans un flacon bouché. Dissoudre dans le jdH2O de manière à obtenir une solution p/v à 2 % d’EDTA (par exemple, pour 50 mg d’EDTA, ajouter 2,5 mL de ddH2O).
- Combinez la solution d’EDTA à 2 % p/v avec le tampon d’acétate d’ammonium de l’étape 1.1 dans un rapport v/v de 9:1 (solution d’EDTA à 90 %, tampon d’acétate d’ammonium à 10 %). Fermez et stockez l’éluant iTLC résultant.
2. Formation de films lipidiques
REMARQUE : Cette procédure décrit la formation d’un film lipidique avec des compositions imitant la microbulle commerciale, Definity®, avec un lipide de porphyrine substituant le lipide de l’hôte et constituant 30 % molaire du lipide total. Cependant, le protocole de radiomarquage peut être appliqué à diverses formulations lipidiques (longueurs de chaîne en C16, C18, C22, charge neutre ou anionique, compositions molaires porphyrine-lipidique variables). Vous trouverez ci-joint une feuille de calcul supplémentaire (fichier supplémentaire 1) qui fournit les calculs, les compositions, les masses et les volumes de base pour la formulation décrite et d’autres formulations. Tous les lipides sont disponibles dans le commerce, à l’exception de la porphyrine-lipide, le pyrophéophorbide-a-lipide (pyro-lipide), dont la synthèse a déjà été décrite en détail35,36.
- À l’aide du fichier supplémentaire 1, déterminez la masse totale nécessaire pour chaque lipide en fonction du nombre de films requis.
- Pesez un flacon en verre vide de 0,5 dram sur une balance analytique.
REMARQUE : La poussière interfère avec la formation réussie de microbulles. Ainsi, soufflez de l’air sous pression dans le flacon pour éliminer toute poussière/particule s’il est stocké sans bouchon. - Peser la 1,2-dipalmitoyl-sn-glycéro-3-phosphocholine (DPPC) sur du papier pesé.
REMARQUE : La masse pesée doit être obtenue à partir de l’étape 2.1 plus 0,5 à 1 mg supplémentaire pour tenir compte de toute perte lors de la manipulation de l’échantillon dans les étapes ultérieures. - Transférez le DPPC dans le flacon en verre pesé et pesez-le à nouveau pour déterminer la masse lipidique dans le flacon. Ce processus permet un transfert plus facile des lipides vers le flacon en verre, une réduction des pertes/déversements de poudre de lipides et une mesure plus précise de la masse lipidique.
- Répétez les étapes 2.2 à 2.4 avec les autres lipides : 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[méthoxy(polyéthylène glycol)-5000] (DPPE-mPEG), 1,2-dipalmitoyl-sn-glycero-3-phosphate (DPPA) et pyrolipide C16.
REMARQUE : Si le pyrolipide n’est pas disponible sous forme de poudre pesable, mais plutôt sous forme de film ou d’aliquote de quantité inconnue, il peut être dissous dans le chloroforme pour former un stock dont la concentration peut être calculée par des mesures d’absorbance UV-Vis dans le méthanol à l’aide de la loi de Beer-Lambert décrite précédemment35. - Préparez les solvants organiques et les solutions suivants dans des tubes à essai en verre à l’aide de micropipettes ou de seringues en verre : 1) chloroforme, 2) chloroforme 9:1 v/v : méthanol et 3) chloroforme 65:35:8 : méthanol :ddH 2O. Pour le dernier, pipetez les composants et mélangez-les dans l’ordre suivant : jjH2O, méthanol, puis chloroforme.
ATTENTION : Le méthanol et le chloroforme sont dangereux pour la santé, inflammables et volatils. Portez des lunettes de protection, des gants et une blouse de laboratoire, et utilisez une hotte. - Utilisez le fichier supplémentaire 1 pour calculer le volume de solvant/solution organique nécessaire à la fabrication de stocks de lipides et choisir des seringues en verre de volumes appropriés.
REMARQUE : Ce volume doit donner des concentrations de stock qui correspondent à des volumes d’aliquote de stock de 15 à 100 μL par film qui peuvent être facilement mesurés à l’aide de seringues de verre de 25 à 100 μL. - Rincez trois fois les seringues en verre avec du chloroforme. Pompez le piston d’avant en arrière pour sécher la seringue.
- Mesurer et ajouter les solvants/solutions organiques à l’aide de la seringue en verre nettoyé dans les flacons de lipides individuels conformément aux calculs de la feuille de calcul à l’étape 2.7 pour former des stocks de lipides. Dissoudre le pyrolipide dans le chloroforme (à moins qu’il ne soit déjà dissous conformément à la note de l’étape 2.5), le DPPC et le DPPE-mPEG dans le chloroforme 9:1 v/v : méthanol et le DPPA dans le chloroforme 65:35:8 : méthanol :ddH 2O. Si vous utilisez la même seringue en verre pour tous les ajouts, rincez et séchez entre chaque lipide.
REMARQUE : Si la formulation choisie ne contient pas de DPPA ou sa variante de longueur de chaîne C18, le pyrolipide, le lipide PC de l’hôte et le lipide PEG peuvent tous être dissous dans le chloroforme. - Boucher les flacons et vortex.
- Ajoutez des volumes calculés de solutions lipidiques mères dans un nouveau flacon en verre de 0,5 dram (flacon de film) à l’aide d’une seringue en verre d’un microlitre. Pour le premier stock lipidique, insérez la pointe de l’aiguille dans le centre inférieur du flacon et plongez lentement pour éviter d’éclabousser les parois du flacon. Pour les ajouts ultérieurs, placez la pointe de l’aiguille directement au-dessus du niveau de liquide et touchez le côté du flacon pour éliminer les gouttes finales de manière à ne pas exposer l’aiguille au liquide situé en dessous.
REMARQUE : Rincez et séchez la seringue en verre entre les ajouts de lipides en cas de contamination. Si vous fabriquez plusieurs films, bouchez à la fois le film et les flacons de stock entre les ajouts pour minimiser l’évaporation du solvant. - Faites tourner doucement le flacon manuellement en position verticale pour mélanger le contenu. Évitez d’éclabousser les parois du flacon.
- Débouchez (rangez le bouchon) et insérez une ligne d’azote dans l’espace de tête du flacon. Ajustez le débit d’azote de manière à provoquer une légère perturbation visible à la surface du liquide, mais sans entonnoir ni éclaboussures.
- Vortex le flacon immédiatement après avoir inséré la ligne d’azote. Démarrez à une vitesse lente suffisante pour former un entonnoir avec le solvant ne dépassant pas 1 cm du fond du flacon. Évitez les éclaboussures de solvant. Au fur et à mesure que le solvant s’évapore, augmentez la vitesse du vortex lentement et sans pause, en maintenant la hauteur du solvant jusqu’à ce que tout le liquide s’évapore. Le résultat sera une fine pellicule recouverte sur le tiers inférieur du flacon.
- Placez le flacon dans un dessiccateur équipé du vide et continuez à sécher le film sous vide pendant 8 à 72 h. Couvrez le flacon (sauf l’ouverture) ou le dessiccateur avec du papier d’aluminium.
REMARQUE : Le protocole peut être mis en pause ici. Les étapes suivantes peuvent être effectuées après le séchage du film, ou les films peuvent être stockés sous argon, scellés avec du Parafilm, dans un congélateur à -20 °C jusqu’à 1 mois, et plus longtemps s’ils sont conservés au sec.
3. Hydratation du film lipidique
REMARQUE : Si les microbulles sont utilisées in vitro ou in vivo, utilisez des pointes de micropipettes, des tubes, des seringues et des aiguilles stériles pour les étapes 3.3 à 5.4, sauf indication contraire.
- Retirez le film de l’aspirateur ou, s’il est stocké au congélateur, laissez-le se réchauffer à RT.
- Remplissez un bécher de 250 ml d’eau et chauffez l’eau à 70-80 °C.
- Chauffez un sonicateur à bain-marie à 69 °C.
- Micropipette 1 mL d’AA-PGG (étape 1.3) sur les bords du flacon de film lipidique pour éviter la création de bulles.
REMARQUE : Lors de la fabrication de microbulles de contrôle non chélatées ou fluorescentes uniquement, utilisez PGG (étape 1.2) au lieu de AA-PGG. - Couvrez partiellement l’ouverture du flacon avec un bouchon, en laissant suffisamment d’espace pour insérer une conduite de perfluoropropane (PFP). Verser le PFP dans l’espace libre du flacon pendant 20 s au-dessus du liquide, de sorte que le liquide soit visiblement perturbé mais ne laisse pas d’éclaboussures. Ne pas faire couler le PFP directement dans la suspension. Boucher le flacon.
REMARQUE : Si le débit est adéquat en force et en temps, le flacon commencera à refroidir au toucher. - Plongez la moitié inférieure du flacon dans le bain-marie à 70-80 °C pendant 1 min. Ensuite, sonicate pendant au moins 30 s dans le sonicateur à bain à 69 °C ou jusqu’à ce que le film lipidique se disperse de manière homogène dans l’AA-PGG. Évitez de créer des bulles ou d’activer prématurément la formation de microbulles (l’activation prématurée apparaîtra sous forme de zones laiteuses/troubles dans la suspension lipidique). Essuyez la surface du flacon au besoin pour mieux discerner s’il reste des lipides non en suspension.
REMARQUE : Si le film lipidique ne s’hydrate pas dans les 1 minutes suivant la sonication, réchauffez-le dans le bain à 70-80 °C et re-soniquez. - Une fois que le film lipidique est en suspension de manière homogène, chauffer une dernière fois pendant 1 min et sonicer pendant 30 s supplémentaires.
- Essuyez le flacon et laissez-le refroidir passivement à RT (~5-10 min).
- Remplissez l’espace libre du flacon avec du PFP comme indiqué à l’étape 3.5, bouchez et scellez les bords du capuchon avec du Parafilm.
REMARQUE : Le protocole peut être mis en pause ici et repris au plus tard 8 heures.
4. Radiomarquage
REMARQUE : Pour le contrôle non chélaté ou les microbulles fluorescentes uniquement, passez à la section 5 du protocole.
ATTENTION : Effectuez les étapes 4.4 à 4.6 de ce protocole dans un laboratoire radioactif, sauf indication contraire. 64Le CuCl2 est un danger radiologique avec un risque de toxicité multisystémique par exposition cutanée, inhalation ou ingestion. Dans la mesure du possible, manipulez-le dans une hotte indirectement à l’aide d’une pince à embout en caoutchouc. Portez une blouse de laboratoire protectrice, un dosimètre à anneau et à badge personnel et un gant double lors de la manipulation. Assurez-vous que 64CuCl2 sont manipulés à travers un blindage en plomb de 2 pouces. Si nécessaire, transportez-le dans un conteneur gainé de plomb. Protéger les conteneurs à déchets et effectuer une enquête opérationnelle pour détecter toute contamination après utilisation.
- Préparez un bain-marie à 60 °C dans un bécher en verre ou un grand plat de cristallisation contenant une barre d’agitation magnétique. Utilisez une plaque chaude/d’agitation à température contrôlée équipée d’une sonde thermique insérée dans l’eau, réglée pour remuer à un taux qui produit un entonnoir faible mais visible.
- Transférez un flacon scellé contenant 64CuCl2 dans 0,1 N HCl dans un calibrateur de dose à l’aide d’une pince à pointe en caoutchouc.
REMARQUE : Lorsque vous commandez 64CuCl2, demandez qu’il soit dissous dans 5-20 μL de HCl 0,1 N. Un volume plus faible est essentiel pour préserver le rendement des microbulles. - Notez l’activité du cuivre 64 mesurée sur le calibrateur de dose et le temps. Retirez le flacon à l’aide d’une pince et placez-le dans un récipient en plomb.
- Divisez l’activité notée par le volume rapporté pour le 64CuCl2 pour obtenir une valeur MBq·mL-1 .
- Débouchez la suspension lipidique de l’étape 3.9 et fixez-la dans un support de flacon.
- Débouchez le flacon de 64CuCl2 et fixez-le à l’aide d’une pince.
- Micropipette un volume de la solution 64CuCl2 correspondant à 40-250 MBq d’activité et transfert dans la suspension lipidique. Assurez-vous que la pointe de la pipette est immergée dans la suspension. Plongez puis pipetez de haut en bas pour transférer complètement le 64CuCl2.
REMARQUE : La quantité de 64CuCl2 ajoutée dépendra de l’application prévue pour les microbulles radiomarquées et de la sensibilité du calibrateur de dose. Pour la TEP longitudinale (jusqu’à 48 h après l’injection) et le prélèvement sanguin in vivo chez la souris, un minimum de 220 MBq et 50 MBq, respectivement, est recommandé. - Boucher à la fois la suspension lipidique et 64CuCl2 flacons.
- À l’aide d’une pince plate à pointe en caoutchouc, faites pivoter manuellement la suspension lipidique radioactive de haut en bas au moins 5 fois pour mélanger doucement les 64CuCl2 à travers la suspension. Évitez de secouer ou de laisser tomber le flacon et évitez la formation de bulles.
- Lorsqu’il est à l’endroit, agitez doucement le capuchon du flacon tout en maintenant la suspension stabilisée. Cela aidera tout liquide piégé dans le bouchon à graviter vers le fond du flacon. Débouchez partiellement et soigneusement le flacon et insérez une ligne PFP équipée d’une aiguille de 18 G. Remplissez l’espace libre du flacon avec du PFP pendant 20 s comme à l’étape 3.5. Boucher le flacon et le sceller avec du Parafilm.
- Mesurez l’activité du flacon sur un calibrateur de dose et notez l’heure.
REMARQUE : Si l’activité adéquate n’a pas été transférée dans le flacon, répétez les étapes 4.5 à 4.11, en ajoutant un volume supplémentaire approprié de 64CuCl2. - Placez le flacon dans un support de flacon en mousse et poussez-le de manière à ce que la moitié inférieure du flacon soit exposée à la chaleur. Placez le support dans le bain-marie à 60 °C et faites chauffer pendant 1 h.
- Pendant que la réaction de chélation s’ensuit, préparez des plaques iTLC. Tout en portant des gants propres, coupez le papier de chromatographie en microfibre de verre en bandes de 1 cm x 8 cm. Faites chauffer les bandes dans un four de séchage du verre à 80 °C.
REMARQUE : Cette étape peut être effectuée dans un laboratoire non radioactif. - Après 1 h, retirez le flacon du feu à l’étape 4.12 et essuyez les bords avec un mouchoir en papier.
- Faites pivoter le flacon de haut en bas manuellement à l’aide d’une pince à pointe en caoutchouc pour recondenser toute condensation sur les parois du flacon dans la suspension lipidique.
- Avec le flacon en position verticale, actionnez le bouchon tout en stabilisant le tube. Retirez le Parafilm et essuyez autour du capuchon pour éliminer toute eau du bain emprisonnée.
- Débouchez soigneusement le flacon et aspirez 1 à 2 μL de la suspension lipidique. Repérez la suspension à 1 cm du centre inférieur d’une bande iTLC et rebouchez le flacon. Laissez sécher l’endroit.
REMARQUE : Idéalement, un minimum de 2 iTLC devrait être repéré par mélange réactionnel et développé par suspension lipidique radiomarquée pour plus de certitude. - Micropipette de 200 μL de l’éluant iTLC (préparé à l’étape 1.4) dans le fond d’un tube à essai de 10 mL. Rangez le tube à essai dans un récipient en plomb. Ajoutez l’iTLC tacheté dans le tube et laissez la bande se développer jusqu’à ce que l’éluant soit à environ 1 cm du bord supérieur de la bande.
- Retirez les bandes iTLC développées à l’aide d’une pince. Tenez la bande verticalement et coupez-la en trois au-dessus de tubes en plastique ronds de 5 ml compatibles avec les γ et les bouchons à pression, de sorte que chaque tiers de bande tombe directement dans un tiers individuel. Insérez des capuchons poussoirs dans les trois tubes.
- Mesurez l’activité du cuivre 64 sur un compteur de γ et enregistrez le nombre de mètres par minute (cpm) associés. Soustrayez l’activité du tube de contrôle des autres lectures pour corriger l’activité de fond.
REMARQUE : Les lectures corrigées pour le tiers inférieur de la bande (pièce 1) sont associées à des particules de suspension de cuivre-64 chélatées en lipides. La section centrale (pièce 2) contient une traînée de chélates de cuivre-64 libres et de 64Cu-pyro-lipides sous forme non supramoléculaire. La partie supérieure (pièce 3) contient principalement du cuivre-64 libre. - Calculer la pureté radiochimique à l’aide de l’équation 1.
 (Équation 1)
(Équation 1)
REMARQUE : si le cpm de la pièce 1 semble déraisonnablement bas (par exemple, inférieur ou équivalent aux pièces 2 ou 3) ou si les lectures sont supérieures au seuil de non-linéaire/saturation du compteur γ, repérez un volume inférieur ou une aliquote diluée (1-2 μL) de la suspension radiomarquée pour iTLC. - S’assurer que la pureté radiochimique obtenue à partir des deux bandelettes iTLC par suspension lipidique est ≥ 94 % pour continuer. Si ce n’est pas le cas, continuez à chauffer la suspension lipidique à 60 °C et surveillez la chélation à des intervalles de 30 minutes via iTLC.
- Débouchez le flacon de suspension lipidique radiomarquée et la micropipette 8,89 μL de NaOH 1 N dans la suspension, en pipetant de haut en bas pour transférer complètement la base et neutraliser la suspension. Fermez le flacon, tournez-le manuellement avec une pince pour l’inverser/inverser, puis tapotez doucement le capuchon du flacon.
- Remplissez l’espace libre avec du PFP comme à l’étape 4.10, bouchez et scellez avec du Parafilm.
5. Activation et isolation des microbulles
- Activer la suspension lipidique à l’aide d’un agitateur mécanique pendant 45 s à 4530 tr/min pour générer une suspension de microbulles laiteuses. Laissez le flacon refroidir passivement à RT pendant environ 10 min. La suspension laiteuse résultante se séparera en deux couches au fil du temps.
REMARQUE : Le contenu du flacon doit avoir l’air laiteux après l’activation. Une suspension post-activation plus claire est indicative d’une activation infructueuse, dont les facteurs seront discutés dans les sections suivantes. - Une fois à RT, retournez/retournez doucement le flacon pour remettre en suspension la suspension de microbulles. Placez le flacon sur une surface plane et attendez 2 min avant de le décanter pour obtenir la population de microbulles souhaitée comme suit :
- Équipez une seringue en plastique de 1 ml d’une aiguille de 18 G et ventilez la seringue ou l’aiguille en aspirant et en plongeant de l’air vers l’intérieur ou vers l’extérieur. Au bout de 2 minutes, débouchez rapidement le flacon, brisant le sceau du Parafilm d’un seul geste.
- Prélever 400 à 550 μL du bas du flacon (population de microbulles cible), en évitant l’aspiration de la couche mousseuse supérieure de populations de microbulles indésirables plus importantes.
REMARQUE : Si nécessaire, inclinez le flacon d’un côté pour recueillir les volumes finaux dans la seringue afin d’éviter d’aspirer la couche mousseuse/plus légère.
- Essuyez soigneusement les bords de l’aiguille pour éliminer tout contaminant mousseux et transférez la suspension de microbulles isolée dans un tube de microcentrifugation. Capuchon doucement (ne pas ouvrir ou fermer brusquement le capuchon). Il s’agit de la suspension finale de travail des microbulles radiomarquées.
- Mesurez l’activité du produit final à microbulles sur le calibrateur de dose et notez l’heure. Divisez cette valeur par le volume de suspension décanté à l’étape 5.2 pour obtenir une valeur MBq·mL-1 permettant de calculer les volumes d’injection en fonction de l’application d’intérêt.
REMARQUE : Les microbulles radiomarquées sont maintenant prêtes à l’emploi. La section 6 peut être exécutée jusqu’à 24 h plus tard. Pour plus d’informations sur la façon dont ces microbulles radiomarquées peuvent être injectées et suivies in vivo par imagerie multimodale (échographie, TEP, fluorescence), veuillez consulter Rajora et al.15.
6. Validation de l’efficacité du radiomarquage
- Remettez en suspension la suspension de microbulles par pipetage doux ou inversion du flacon.
REMARQUE : Ne jamais vortex un produit de travail à microbulles. Le vortex déstabilise les suspensions de microbulles. - Ajouter 10 à 200 μL de suspension radiomarquée à une unité de filtration centrifuge de 0,5 mL de 30 000 poids moléculaire. Si vous utilisez des volumes < 200 μL, ajoutez du ddH2O à l’unité de filtration pour constituer un volume total de 200 μL. Abritez l’unité de filtration dans un tube de microcentrifugation compatible et un bouchon.
REMARQUE : Il est recommandé d’effectuer un test de radiomarquage avant et séparément de toute utilisation in vitro ou in vivo de microbulles radiomarquées pour garantir la réussite du protocole. Dans ce cas, un volume plus important (par exemple, 200 μL) pourrait être utilisé dans cette étape. Lorsque le protocole est utilisé par la suite pour une séance de traitement, préparez d’abord les volumes/injections de traitement, puis effectuez la section 6 avec la suspension de microbulles radiomarquée restante le plus tôt possible. - Centrifugeuse pendant 10 min à 12 000 x g à RT.
REMARQUE : la microcentrifugeuse doit être entourée d’un blindage en plomb. - Coupez la connexion entre le tube de microcentrifugation et son capuchon avec des ciseaux.
- Placez le bouchon dans un flacon à scintillation de 20 ml étiqueté « bouchons ». Transférez l’unité de filtration dans un nouveau tube de microcentrifugation (tube 2).
- Placez le premier tube de microcentrifugation avec de l’infranatant dans un flacon à scintillation de 20 mL étiqueté « tube 1 ». Ajouter 200 μL ddH2O dans l’unité de filtration du tube 2.
- Centrifuger l’unité de filtration dans le tube 2 à 12 000 x g à RT.
- Répétez les étapes 6.4 et 6.5. Ajouter le bouchon du tube 2 dans le flacon à scintillation « bouchons » abritant le bouchon du tube 1. Placez le tube 2 dans un nouveau flacon à scintillation de 20 ml.
- Coupez le bouchon du troisième tube de microcentrifugation et placez-le dans le flacon « bouchons » conformément à l’étape 6.4. Transférez l’unité de filtration dans un nouveau flacon à scintillation de 20 mL étiqueté « unité », en veillant à ce que l’infranatant reste dans le tube 3 et ne soit pas transféré dans le flacon « unitaire ». Si des gouttes sont observées sur les bords de l’unité de filtration, remettez-la dans le tube 3, bouchonnez et tournez vers le bas pendant 10 s. Placez le tube 3 dans un nouveau flacon à scintillation en verre de 20 ml.
- Bouchez les 5 flacons à scintillation (tube 1, tube 2, tube 3, bouchons et unité). Préparez un flacon à scintillation vide et bouché de 20 mL comme flacon témoin à blanc.
- Mesurez les six flacons à scintillation sur un compteur de γ pour l’activité du cuivre 64. Soustrayez l’activité du flacon vierge de celle des autres flacons. Calculer l’efficacité du radiomarquage/chélation à l’aide de l’équation 2.
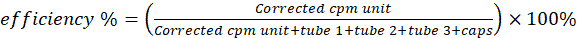 (Équation 2)
(Équation 2)
REMARQUE : Si le cpm de l’unité est déraisonnablement bas (ex, inférieur ou équivalent aux tubes) ou si les lectures sont supérieures au seuil non linéaire/de saturation du compteur γ, stockez les flacons à scintillation dans des récipients en plomb jusqu’à 4 jours pour permettre à l’activité de diminuer jusqu’à ce que les valeurs soient inférieures au seuil et remesurez.
7. Caractérisation physicochimique des microbulles
REMARQUE : À moins qu’un laboratoire ne dispose d’un équipement désigné pour le traitement des échantillons radioactifs, la caractérisation physicochimique des microbulles doit être effectuée à l’aide d’échantillons non radioactifs et « froids » chélatés au cuivre. Cet étiquetage « à froid » facilite l’évaluation du rendement en microbulles, ce qui est essentiel pour évaluer la dose de microbulles utilisée pour l’application prévue. De plus, il permet de comparer avec des microbulles non chélatées de contrôle pour s’assurer que le processus de radiomarquage ne perturbe pas les propriétés des microbulles. Ce marquage « à froid » et la caractérisation physicochimique associée doivent avoir lieu avant l’application de microbulles radiomarquées et peuvent être utilisés comme rétroaction si des modifications au radiomarquage sont nécessaires (voir Discussion).
- Étiquetage « à froid » des microbulles de cuivre
- À l’aide du volume de solution de 64CuCl2 ajouté à la suspension lipidique à l’étape 4.7, de la composition molaire de la porphyrine dans les films lipidiques et de l’activité spécifique trouvée sur la fiche produit 64CuCl2 , calculez le rapport molaire approximatif métal/porphyrine obtenu lors du radiomarquage. Des exemples de calculs se trouvent dans le Fichier supplémentaire 1.
- Respectez les sections 1 à 3 du protocole actuel.
- Préparez une solution de 0,1 mg·mL-1 CuCl2 dans du HCl 0,1 N.
- Injectez à l’étape 7.1.1 le volume approprié de cette solution de CuCl2 dans la suspension lipidique calculée à l’étape 7.1.1 et bouchez le flacon.
- Faites pivoter le flacon pour mélanger le CuCl2 dans la suspension lipidique, remplissez l’espace libre de PFP, scellez et chauffez selon les étapes 4.9, 4.10 et 4.12. Les pinces en caoutchouc ne sont pas nécessaires pour la manipulation des flacons.
- Après 1 h, retirez le flacon du feu et essuyez l’extérieur pour le faire sécher. Laissez le flacon refroidir à RT.
- Neutralisez la suspension lipidique, mélangez, remplissez l’espace libre avec du PFP et scellez selon les étapes 4.23 et 4.24.
- Activez la suspension des microbulles et décantez pour obtenir un produit fonctionnel conformément aux étapes 5.1 à 5.3.
- Dimensionnement des microbulles
REMARQUE : Le dimensionnement des microbulles doit être effectué immédiatement après l’activation. Si vous évaluez la stabilité de la suspension de travail, répétez la préparation de l’échantillon et les mesures à des intervalles de 30 minutes. En règle générale, une fenêtre de 1 à 2 heures est représentative de la période pendant laquelle la suspension de travail à microbulles serait utilisée/administrée après l’activation. L’objectif des mesures de stabilité est de s’assurer que la taille et le rendement des microbulles sont maintenus tout au long de cette période afin que tous les traitements administrés à partir de la solution de travail contiennent des populations de microbulles similaires.- Allumez le compteur de coulters (CC) et définissez les paramètres suivants à l’aide de l’outil Modifier la POS : ouverture de 30 μm, plage de taille de 0,6 à 18 μm, courant d’ouverture de 400 à 600 μA, gain de préampli 4-8, 400 bacs, affleurement avant et après chaque passage, analyse volumétrique, volume d’échantillon de 5 μL.
- Filtrez l’électrolyte CC à travers une unité de filtration sous vide de 0,2 μm. Remplissez le récipient d’électrolyte et un récipient séparé pour la préparation de l’échantillon.
- Mesure de fond : Remplissez une cuvette jetable de 10 ml avec de l’électrolyte filtré de 10 ml et effectuez une mesure de référence. Assurez-vous que le nombre est inférieur à 400. Si ce n’est pas le cas, rincez l’instrument.
- Mesure d’échantillon
- Ajouter 10 ml d’électrolyte filtré dans une nouvelle cuvette. Remettre en suspension la suspension des microbulles en inversant/revenant manuellement. Micropipette à 5 μL du centre inférieur du flacon. Essuyez les bords de la pointe de la pipette (sauf l’ouverture) et plongez l’échantillon directement dans l’électrolyte préparé.
- Pipette de haut en bas pour transférer complètement la suspension. À l’aide de la pointe de la pipette, faites tourner doucement l’électrolyte jusqu’à ce que les « volutes » de suspension de microbulles soient dispersées.
- Mesurez l’échantillon sur le CC (deux passages par analyte).
REMARQUE : Un volume d’échantillon de microbulles de 5 μL convient généralement aux échantillons contenant des concentrations de 1 à 5 x 109 microbulles·mL-1 . Il peut être nécessaire d’ajuster ce volume d’échantillon en fonction de la configuration spécifique de l’instrument CC et si les rendements en microbulles de l’échantillon se situent en dehors de la plage ci-dessus.
- Imagerie confocale
REMARQUE : Effectuez l’imagerie confocale immédiatement après la taille des microbulles et dans le délai de stabilisation des microbulles conservé conformément à la note de l’étape 7.2.- Remettez la suspension de microbulles en suspension et transférez 1 à 5 μL au centre d’une lame de microscope en verre. Placez soigneusement une lamelle sur la gouttelette de suspension à microbulles, en évitant tout piégeage de bulles d’air. La suspension s’étendra sous la lamelle.
- Imagez les microbulles à un grossissement de 60x avec un objectif à immersion dans l’huile. Obtenez des images en fond clair et sous une excitation de 633 nm / une émission de 640-765 nm. Superposez les images en fond clair et en fluorescence.
REMARQUE : Le signal de fluorescence doit chevaucher la coquille de toutes les particules visibles lorsque la sonde est incorporée de manière homogène dans la coquille de la microbulle.
- Spectrofluorométrie
REMARQUE : Les mesures par spectrofluormétrie peuvent être effectuées dans les 24 heures suivant l’activation des microbulles.- Préparez 1 % de Triton X-100 comme décrit précédemment35.
- Allumez le spectrofluorimètre 15 à 30 minutes avant la première mesure.
- Mesurez les spectres de fluorescence de Triton X-100 à 1 % en utilisant une excitation de 410 nm et une plage d’émission de 600 à 800 nm dans une cuvette à quartz. Sélectionnez l’option permettant de normaliser le signal par le signal du détecteur de référence (souvent appelé S1/R1).
REMARQUE : Le Triton X-100 fait facilement des bulles lorsqu’il est pipeté. Ainsi, lors du transfert dans une cuvette, ne plongez que jusqu’à la première butée de la micropipette. - Rincez la cuvette avec du méthanol et séchez-la à l’air comprimé entre les échantillons.
- Transférez 6 ml de Triton X-100 à 1 % dans un tube à centrifuger de 15 ml. Remettre en suspension la suspension de microbulles et aspirer 1 μL à l’aide d’une micropipette. Essuyez les bords de la pointe de la pipette à l’exception de l’ouverture et transférez l’échantillon dans le Triton X-100 à 1 % préparé, en pipetant de haut en bas pour terminer le transfert. Vortex la solution et transférez-la dans une cuvette en quartz.
REMARQUE : Ajustez le rapport de l’échantillon : 1 % Triton X-100 en fonction de la sensibilité de l’instrument et du seuil de saturation non linéaire. - Mesurez cet échantillon à l’aide des paramètres de l’étape 7.4.3. Cette mesure correspond à des particules « perturbées ».
- Répétez les étapes 7.4.3 à 7.4.6 à l’aide de PBS. Cette mesure correspond à des particules « intactes ».
- Corrigez les spectres d’échantillons perturbés et intacts à l’aide de mesures de Triton X-100 à 1 % et de PBS, respectivement.
- Calculer l’efficacité d’extinction (QE) à l’aide de l’équation 3 à l’aide du signal de fluorescence corrigé de référence intégré de l’échantillon intact dans le PBS (FPBS) et dans le Triton X-100 à 1 % (FTx) :
 (Équation 3)
(Équation 3)
- Spectroscopie UV-Vis
REMARQUE : Les mesures par spectroscopie peuvent être effectuées jusqu’à 72 h après l’activation des microbulles.- Soniquer une partie aliquote de la suspension de microbulles dans un tube de microcentrifugation à l’aide d’un sonicateur à bain à RT jusqu’à ce que la suspension soit transparente. Cela réduit les effets de diffusion pendant la spectroscopie.
- Allumez le spectrophotomètre 10 minutes avant la première mesure. Sélectionnez un intervalle de balayage de 0,25 nm et une plage d’acquisition de 200 à 800 nm. Activez la soustraction de la ligne de base.
- Utilisez une cuvette en quartz de 1 cm de longueur de chemin pour les mesures. Rincer la cuvette au méthanol entre les mesures et sécher à l’air comprimé.
- Obtenir une mesure de référence du méthanol.
- Vortex la suspension de microbulles soniquées et transparentes et transfère 10 à 50 μL dans un tube de microcentrifugation contenant 200 à 1000 μL de méthanol. Assurez-vous que le volume de méthanol est mesuré et ajouté au tube à l’aide d’une seringue en verre propre d’un microlitre. Vortex : la solution pour obtenir un échantillon « perturbé ».
REMARQUE : La dilution de l’échantillon dépendra de l’efficacité de la charge de porphyrine et de la composition en % molaire. Une dilution de 20x convient pour une composition de microbulles pyrolipidiques de 30 % molaire. - Collectez le spectre UV-Vis.
- Répétez les étapes 7.5.4 à 7.5.6 en utilisant du PBS au lieu du méthanol.
REMARQUE : Une micropipette peut être utilisée pour mesurer les volumes PBS au lieu d’une seringue en verre d’un microlitre.
8. Modifications au protocole
- Chélateur alternatif
- Préparez des films lipidiques conformément à la section 2, en remplaçant le pyrolipide par un autre chélateur de cuivre conjugué aux lipides (par exemple, l’acide 1,2-dipalmitoyl-sn-glycéro-3-phosphoéthanolamine-N-diéthylènetriaminepentaacétique (sel d’ammonium), ci-après appelé DTPA-lipide). Utilisez le fichier supplémentaire 1 pour calculer la masse et les volumes de stock nécessaires.
REMARQUE : Il est probablement nécessaire de tester diverses compositions molaires d’un chélateur alternatif pour déterminer la limite supérieure au-delà de laquelle des microbulles stables à haut rendement ne peuvent pas être générées. - Suivre les sections 3 à 6 pour générer et caractériser les microbulles radiomarquées.
- Suivez les étapes 7.1 à 7.3 pour caractériser les microbulles « froides » chélatées au cuivre. Seule l’acquisition d’images par microscopie confocale en fond clair est nécessaire pour évaluer la morphologie des particules. Si le chélateur alternatif est fluorescent, effectuer une microscopie confocale avec les longueurs d’onde d’excitation et d’émission associées en plus des étapes 7.4 et 7.5.
- Préparez des films lipidiques conformément à la section 2, en remplaçant le pyrolipide par un autre chélateur de cuivre conjugué aux lipides (par exemple, l’acide 1,2-dipalmitoyl-sn-glycéro-3-phosphoéthanolamine-N-diéthylènetriaminepentaacétique (sel d’ammonium), ci-après appelé DTPA-lipide). Utilisez le fichier supplémentaire 1 pour calculer la masse et les volumes de stock nécessaires.
- Fluorophore alternatif
- Préparez les films lipidiques conformément à la section 2, en remplaçant le pyrolipide par un fluorophore alternatif conjugué aux lipides ou intercalant (par exemple, DiI). Utilisez le fichier supplémentaire 1 pour calculer la masse et les volumes de stock requis.
REMARQUE : Il est probablement nécessaire de tester diverses compositions molaires d’un fluorophore alternatif pour déterminer la limite supérieure au-delà de laquelle des microbulles stables à haut rendement ne peuvent pas être générées. - Suivez la section 3 en utilisant PGG au lieu de AA-PGG.
- Effectuez les étapes 5.1 à 5.3 et 7.2 à 7.5.
- Préparez les films lipidiques conformément à la section 2, en remplaçant le pyrolipide par un fluorophore alternatif conjugué aux lipides ou intercalant (par exemple, DiI). Utilisez le fichier supplémentaire 1 pour calculer la masse et les volumes de stock requis.
- Approche « dopée » : Marquage de suspensions lipidiques de microbulles préformées
- Générer un film lipidique de porphyrine conformément à la section 2, en utilisant uniquement des pyrolipides sans autres constituants lipidiques. Se référer au Fichier Supplémentaire 1 pour les quantités de pyro-lipides.
- Hydrater le film pyrolipidique conformément à la section 3 à l’aide de 100 à 200 μL d’AA-PGG (ou de PGG si le radiomarquage n’est pas nécessaire) au lieu de 1 mL de tampon d’hydratation.
- Transférez l’intégralité de la suspension pyrolipidique dans une suspension de microbulles lipidiques préfabriquée.
- Remplissez l’espace libre avec du PFP, chauffez et sonifiez la suspension et le joint sous PFP comme indiqué aux étapes 3.4 à 3.9. Surveiller la dispersion de la suspension pyrolipidique dans la suspension de microbulles lipidiques préfabriquée et effectuer des cycles de chaleur/sonication jusqu’à ce qu’ils soient complètement dispersés.
REMARQUE : Si vous utilisez un flacon commercial à microbulles scellé par septum, la suspension pyrolipidique peut être introduite dans le flacon à l’aide d’une seringue ou d’une aiguille sans remplir l’espace libre du flacon avec du PFP. - Effectuer le radiomarquage (voir l’étape 8.3.5.1 ci-dessous), l’activation, l’isolement (voir la NOTE ci-dessous) et la caractérisation connexe conformément aux sections 4 à 7.
- Une autre approche consiste à radiomarquer d’abord la suspension pyrolipidique hydratée, à surveiller la pureté radiochimique de >94 %, à neutraliser avec du NaOH 1 N (modifier le volume en fonction du volume AA-PGG utilisé pour hydrater le film pyrolipidique), puis à introduire la suspension pyrolipidique radiomarquée dans la suspension lipidique à microbulles préfabriquée conformément à l’étape 8.3.3.
REMARQUE : Cette approche modifiée ne doit être utilisée pour générer des microbulles radiomarquées fluorescentes ou multimodales que si elle est suivie d’un processus d’isolement qui élimine les vésicules multilamellaires submicroniques créées pendant l’hydratation des lipides mais non incorporées dans les microbulles. Voir la discussion pour plus de détails.
- Une autre approche consiste à radiomarquer d’abord la suspension pyrolipidique hydratée, à surveiller la pureté radiochimique de >94 %, à neutraliser avec du NaOH 1 N (modifier le volume en fonction du volume AA-PGG utilisé pour hydrater le film pyrolipidique), puis à introduire la suspension pyrolipidique radiomarquée dans la suspension lipidique à microbulles préfabriquée conformément à l’étape 8.3.3.
Résultats
Les principaux résultats quantifiables lors de la fabrication de microbulles radiomarquées sont la pureté radiochimique et l’efficacité du radiomarquage. Ce protocole utilise respectivement l’iTLC et une procédure centrifuge validée pour caractériser chacun. La figure 2A montre que des puretés radiochimiques moyennes et des efficacités de ≥95 % ont été obtenues dans des formulations commerciales imitant les microbulles dans lesquelles le lip...
Discussion
Le protocole actuel de radiomarquage des microbulles lipidiques permet d’atteindre une pureté radiochimique de >95 %, une efficacité de chélation de >95 % et la conservation des propriétés physicochimiques des microbulles sans nécessiter de purification post-marquage. Ces réalisations représentent des avancées jusqu’alors inexploitées pour les protocoles d’étiquetage existants. L’absence d’étapes de purification permet une utilisation plus rapide des radio-isotopes ...
Déclarations de divulgation
Les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
Nous remercions Deborah Scollard et Teesha Komal (programme STTARR (University Health Network Spatio-Temporal Targeting and Amplification of Radiation Response), Toronto, Ontario) pour leurs services techniques et leurs conseils. Nous remercions également Mark Zheng et le Dr Alex Dhaliwal pour leur aide technique pendant la microscopie confocale, ainsi que l’installation de microscopie optique avancée (Toronto, Ontario) pour la fourniture de l’équipement connexe. Nous reconnaissons nos sources de financement : les Instituts de recherche en santé du Canada, l’Institut de recherche Terry Fox, le Conseil de recherches en sciences naturelles et en génie du Canada, la Fondation canadienne pour l’innovation, la Fondation du cancer Princess Margaret, le Programme des chaires de recherche du Canada, le Centre McLaughlin, le Programme de bourses Vanier, le Programme de bourses d’études supérieures de l’Ontario, Cancer de la Prostate Canada et la Peterborough K. M. Hunter Charitable Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Références
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon