A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصنيع ووضع العلامات على الفقاعات الدقيقة باستخدام أجهزة التتبع الفلورية والمشعة
In This Article
Summary
يحدد هذا البروتوكول تصنيع الفقاعات الدقيقة الدهنية وطريقة وضع العلامات الراديوية المتوافقة ذات الفقاعات الدقيقة ذات الوعاء الواحد مع كفاءة وضع العلامات الخالية من التنقية >95٪ والتي تحافظ على الخصائص الفيزيائية والكيميائية للفقاعات الدقيقة. هذه الطريقة فعالة عبر تركيبات الفقاعات الدقيقة الدهنية المتنوعة ويمكن تخصيصها لتوليد فقاعات دقيقة مشعة و / أو فلورية.
Abstract
الفقاعات الدقيقة عبارة عن جزيئات مملوءة بالغازات ذات قشرة دهنية تطورت من عوامل تباين الموجات فوق الصوتية للأوعية الدموية إلى منصات ثورية لعلاج السرطان. عند دمجها مع الموجات فوق الصوتية المركزة العلاجية (FUS) ، يمكنها التغلب بأمان ومحلي على الحواجز الفسيولوجية (على سبيل المثال ، الحاجز الدموي الدماغي) ، وتوصيل الأدوية للسرطانات التي يتعذر الوصول إليها (على سبيل المثال ، الورم الأرومي الدبقي وسرطان البنكرياس) ، وعلاج الأمراض التنكسية العصبية. تتقدم الترسانة العلاجية لمتلازمة الفقاعات الدقيقة في اتجاهات جديدة ، بما في ذلك العلاج الإشعاعي المركب التآزري ، والتصوير متعدد الوسائط ، وتحميل الأدوية الكل في واحد وتوصيلها من قذائف الفقاعات الدقيقة.
يعد وضع العلامات على الفقاعات الدقيقة باستخدام أجهزة التتبع الإشعاعي أمرا أساسيا لإنشاء هذه القدرات العلاجية الموسعة. ومع ذلك ، فإن استراتيجيات وضع العلامات الراديوية الحالية للفقاعات الدقيقة تعتمد على منهجيات التنقية المعروفة بإزعاج الخصائص الفيزيائية والكيميائية للفقاعات الدقيقة ، واستخدام النظائر المشعة قصيرة العمر ، ولا تنتج دائما استخلاب مستقر. بشكل جماعي ، يخلق هذا غموضا يحيط بدقة التصوير الإشعاعي بالفقاعات الدقيقة وكفاءة توصيل النظائر المشعة للورم.
يصف هذا البروتوكول منهجية جديدة لوضع العلامات على الفقاعات الدقيقة ذات وعاء واحد وخالية من التنقية تحافظ على الخصائص الفيزيائية والكيميائية للفقاعات الدقيقة مع تحقيق كفاءة استخلاب النظائر المشعة بنسبة >95٪. إنه متعدد الاستخدامات ويمكن تطبيقه بنجاح عبر تركيبات الفقاعات الدقيقة المخصصة والتجارية مع اختلاف طول سلسلة دهون الأسيل ، والشحنة ، وتكوين المخلب / المسبار (البورفيرين ، DTPA ، DiI). يمكن تطبيقه بشكل تكيفي أثناء تصنيع الفقاعات الدقيقة من الأرض وعلى تركيبات الفقاعات الدقيقة مسبقة الصنع مع قابلية التخصيص المعيارية للتألق والخصائص الفلورية / المشعة متعددة الوسائط. وفقا لذلك ، تتيح هذه الطريقة المرنة إنتاج فقاعات دقيقة متعددة الوسائط مصممة خصيصا ويمكن تتبعها (راديو أو فلورسنت أو راديو / فلورسنت نشطة) مفيدة لتطوير تطبيقات FUS الميكانيكية والتصوير والعلاجية.
Introduction
الفقاعات الدقيقة هي عوامل علاج إشعاعي فوق جزيئية بحجم ميكرون مع قلب غاز مثبت بواسطة بروتين أو بوليمر أو ، في معظم الحالات ، قشرة دهنية (الشكل 1 أ). عند حقنها في مجرى الدم ، تحافظ الفقاعات الدقيقة على واجهات الغاز / السائل التي يمكن اكتشافها عن طريق الموجات فوق الصوتية لأطر زمنية طويلة قبل إذابة نوى الغاز1،2. وبالتالي ، كان أول استخدام سريري للفقاعات الدقيقة بمثابة عوامل تباين للتصوير بالموجات فوق الصوتية في الوقت الفعلي3. أدى اختراع الموجات فوق الصوتية المركزة العلاجية (FUS) إلى توسيع المرافق السريرية للفقاعات الدقيقة. عند تحفيزها بواسطة FUS منخفض التردد ، تتأرجح الفقاعات الدقيقة وتولد قوى ميكانيكية مستهدفة وقابلة للضبط تتراوح من نفاذية الأوعية الدموية العابرة إلى استئصال الأنسجة البؤرية4،5. نتيجة لذلك ، على مدى السنوات العشرين الماضية ، تم استكشاف FUS الفقاعي الدقيقة لفتح الحاجز الدموي الدماغي (BBB) ، والورم (على سبيل المثال ، سرطان البنكرياس والدماغ وسرطان الكبد) وتوصيل مسبار التصوير ، وعلاج الأمراض التنكسية العصبية واستئصال السرطان6،7،8،9،10،11.
تستمر ترسانة الفقاعات الدقيقة في التقدم في اتجاهات جديدة ومثيرة. تعتمد تطبيقات توصيل الفقاعات الدقيقة التقليدية على الإدارة المشتركة للبضائع العلاجية أو التصويرية جنبا إلى جنب مع الفقاعات الدقيقة التجارية. هناك اهتمام متزايد بتعزيز قدرات توصيل الفقاعات الدقيقة FUS من خلال فهم التفاعلات البيولوجية / غلاف الفقاعات الدقيقة ، واستكشاف تركيبات الفقاعات الدقيقة غير التجارية المصنوعة حسب الطلب ، وتوليد فقاعات دقيقة علاجية الكل في واحد مع البضائع المحملة مباشرة على غلاف الفقاعات الدقيقة12،13،14. في الواقع ، ما يقرب من 40٪ من دراسات توصيل الأدوية للفقاعات الدقيقة الدهنية تستفيد من هذه الفقاعات الدقيقة المحملةبالقشرة 15. بالإضافة إلى التصوير وتوصيل الأدوية ، أظهر FUS الميكروي أيضا وعدا في تعزيز العلاج الإشعاعي للسرطان16 ، وتنشيط التأثيرات المضادة للأورام للعوامل الحميدة المحملة بالقشرة من خلال العلاج بالموجات الصوتية17،18.
يمكن أن تكون هذه الاتجاهات التقليدية والموسعة في تطبيقات سرطان الفقاعات الدقيقة أكثر تقدما من الناحية الاستراتيجية من خلال وضع العلامات على قذائف الفقاعات الدقيقة بأجهزة تتبع مشعة. في مجال الفقاعات الدقيقة المحملة بالبضائع الكل في واحد ، فإن مثل هذه الملصقات الراديوية 1) تسهل التقييم الكمي القياسي الذهبي للتوزيع الحيوي داخل وخارج الهدف لقذائف الفقاعات الدقيقة المحملة ، 2) تستمد علاقات نشاط البنية والنشاط الدوائية التي تعلم الاختيار الأمثل لتركيبات الفقاعات الدقيقة لزيادة التسليم المستهدف ، و 3) يوجه التطبيق الاستراتيجي والمناسب الموجه بالصور وتخطيط العلاج (على سبيل المثال ، أنواع أهداف الأنسجة ، قياس الجرعات ، اختيار الدواء للتخفيف من مخاوف السلامة خارج الهدف ، المنفعة مقارنة بنماذج المعالجة المشتركة التقليدية) لأنظمة البضائع المحملة الكل في واحد15،19. في مرحلة ما قبل السريرية ، يمكن لمثل هذا الفهم لمصير غلاف الفقاعات الدقيقة أن يضيء أيضا آليات عمل الفقاعات الدقيقة الأوسع نطاقا. على سبيل المثال ، ثبت أن نقل الدهون من قذائف الفقاعات الدقيقة إلى الخلايا المستهدفة يؤثر على التنقيب الصوتي الذي يدعم FUS12،20. وبالتالي ، فإن فهم هذا النقل وتحسينه يمكن أن يعلم علاجات FUS قبل السريرية والسريرية التي يتورط فيها التنقية (في المختبر ، وتوصيل الدواء ، واستئصال الورم ، والحساسية الإشعاعية ، والعلاج بالموجات الصوتية20،21،22،23،24،25). ستمكن مرافق الموجات فوق الصوتية والتصوير الإشعاعي المزدوج أيضا من فتح الأوعية المباشرة ومراقبة المعالجة (على سبيل المثال ، حركية فتح BBB) من عامل واحد بدلا من تصميمات العامل المزدوج التقليدية26. على نفس المنوال ، يمكن أن يكون وضع العلامات الراديوية للفقاعات الدقيقة الدهنية بمثابة بديل للفقاعة الدقيقة أحادية العامل / العلاج الإشعاعي لمنصات التوصيل المشترك للمستحضرات الصيدلانية المشعة+ الفقاعات الدقيقة 27.
تعد هشاشة الفقاعات الدقيقة تحديا لا يفهم لمثل هذه العلامات. جميع استراتيجيات وضع العلامات الراديوية الحالية محدودة بمنهجيات التنقية المعروفة باضطراب استقرار الفقاعات الدقيقة وحجمها ، في حين أن بعضها يتميز أيضا بوضع العلامات الراديوية غير الفعالة وغيرالمستقرة 28،29،30،31،32. تؤدي متطلبات التنقية أيضا إلى بروتوكولات أطول. إلى جانب استخدام النظائر المشعة قصيرة العمر (على سبيل المثال ، 18F t1/2 1.8 h ، 28،29 99mTc t1/2 6 h ، 32 68Ga t1/2 1 h31) ، يؤدي هذا إلى عدم كفاءة تتعلق باضمحلال النظائر المشعة ويقيد التصوير الإشعاعي والأطر الزمنية لتخطيط العلاج. بشكل جماعي ، تخاطر هذه القيود بالحصول على تصوير إشعاعي قصير وغير تمثيلي ، وبيانات الحرائك الدوائية غير الدقيقة ، وتوصيل النظائر المشعة للورم غير فعال.
في هذا التقرير ، يتم التغلب على هذه القيود من خلال الاستفادة من قدرات استخلاب المعادن القوية والمستقرة للبورفيرين. البورفيرينات عبارة عن جزيئات كبيرة عضوية حلقية غير متجانسة ذات حلقة مستوية مترافقة للغاية وموقع تنسيق مركزي يمكنه استيعاب مجموعة متنوعة من المعادن. وهذا يشمل النظائر المشعة طويلة العمر مثل النحاس 64 (ر1/2 12.7 ساعة) ، وصيدلانية مشعة مع التصوير المقطعي بالإصدار البوزيتروني (PET) ، وجزايا عد γ33. عندما يتم تقارنها بالعمود الفقري الدهني ، يمكن دمج البورفيرين بسهولة في الهياكل فوق الجزيئية ثم يتم تصنيفها لاحقا بالنحاس 64 بسرعة وكفاءة استخلاب عالية واستقرار مصل الدم ، مع الحفاظ على خصائص الجسيمات الأم غير المسماة33،34. علاوة على ذلك ، فإن البورفيرين نشط فلورسنت مع التبريد الذاتي المعياري في الجسيمات النانوية والصغرى التي يتم استعادتها عند اضطراب الجسيمات. قراءة تكميلية ل PET والعد γ التي تسهل تحليل مصير القشرة السائبة والمجهرية (الشكل 1 أ) 15.
باستخدام البورفيرين والدهون كمخلب ، تم استغلال هذه الخصائص لإنشاء منهجية جديدة لوضع العلامات الراديوية للفقاعات الدقيقة ذات وعاء واحد وخالية من التنقية (الشكل 1 ب ، ج) تتغلب على القيود المرتبطة بطرق وضع العلامات الإشعاعية للفقاعات الدقيقة الحالية. يحقق هذا البروتوكول كفاءة استخلاب >95٪ من النحاس 64 ، ولا يتطلب تنقية ما بعد وضع العلامات ، ويحافظ على الخصائص الفيزيائية والكيميائية للفقاعات الدقيقة. يمكن دمجها بسهولة في التصنيع "من الألف إلى الأرض" للفقاعات الدقيقة الدهنية قبل تنشيطها (الشكل 1 ب). إنه متعدد الاستخدامات ويمكن تطبيقه بنجاح عبر تركيبات الفقاعات الدقيقة المخصصة والتجارية بطول سلسلة دهون أسيل مختلفة (C16 إلى C22) ، وشحنة (محايدة وأيونية) ، وتركيبات دهون بورفيرين (1 مول ، 10 مول ، 30 مول) ، لتوليد فقاعات دقيقة مع كل من نشاط الراديو والفلورة. يمكن أن تمتد قدرته على التكيف أيضا إلى ما هو أبعد من البورفيرين. يمكن تعديل بروتوكول الوعاء الواحد لاستخدام المخلبات البديلة المتاحة تجاريا (على سبيل المثال ، ثنائي إيثيلين تريامين خماسيتات (DTPA) - الدهون) والفلوروفورات (على سبيل المثال ، DiI). يمكن أيضا تعديله لتسمية تركيبات الفقاعات الدقيقة المعدة مسبقا من خلال نهج "الارتفاع". وفقا لذلك ، تتيح هذه الطريقة إنتاج فقاعات دقيقة مخصصة ويمكن تتبعها (راديو أو فلورسنت أو راديو مزدوج / فلورسنت نشط) مفيدة لتطوير تطبيقات FUS الميكانيكية والتصوير والعلاجية. يحدد البروتوكول أدناه تصنيع الفقاعات الدقيقة الدهنية ، وتطبيق بروتوكول وضع العلامات الإشعاعية ذات الوعاء الواحد ، ووضع العلامات الإشعاعية المطلوبة وتوصيف الخصائص الفيزيائية والكيميائية ، والتعديلات المحتملة.
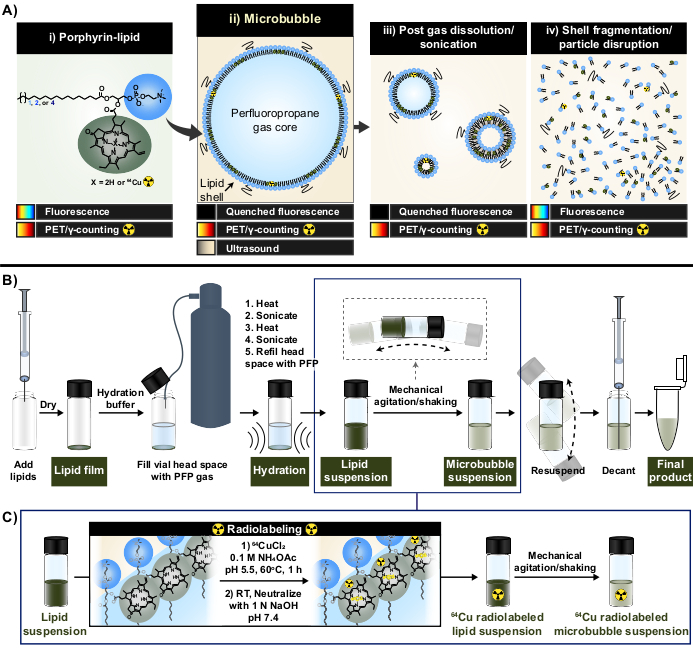
الشكل 1: بروتوكول تصنيع الفقاعات الدقيقة ووضع العلامات الإشعاعية. (أ) يعمل دهون البورفيرين ، في شكل بيروفيوفوربيد - دهون ، كمخلب متعدد الوسائط ضمن هذا البروتوكول. باعتباره مونومر مخلبا إلى النحاس 64 (i) ، فإنه يتمتع بقدرات التصوير المقطعي بالإصدار البوزيتروني والتصوير. يتم إخماد تألقها في شكل جسيمات (الفقاعات الدقيقة (ii) وذريتها النانوية بعد الذوبان (iii)) ويتم إخمادها باضطراب الجسيمات (iv). (ب) بروتوكول ترطيب / تنشيط غشاء الدهون الموصوف في هذا التقرير لتوليد فقاعات دقيقة دهنية من الألف إلى الياء و (ج) تكامل الملصقات الإشعاعية ذات الوعاء الواحد بين تكوين تعليق الدهون وتنشيط الفقاعات الدقيقة. تم تكييف هذا الرقم بإذن من Rajora et al.15. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. مستحضرات الكواشف
- تحضير عازلة أسيتات الأمونيوم (0.1 م ، درجة الحموضة 5.5)
- باستخدام ميزان تحليلي، قم بوزن 770.8 مجم من أسيتات الأمونيوم على ورق وزن. انقل الكمية الموزونة إلى دورق زجاجي نظيف سعة 250 مل.
- أضف 90 مل من الماء المقطر المزدوج (ddH2O) ، المقاسة عبر ماصة متدرجة ، إلى الدرق. أضف قطعة تقليب وضع الدورق على طبق تحريك مغناطيسي لإذابة أسيتات الأمونيوم. يقلب بسرعة تخلق دوامة طفيفة ولكن بدون تناثر المحلول.
- قم بمعايرة مقياس الأس الهيدروجيني وفقا لتعليمات الجهاز باستخدام معايير الأس الهيدروجيني 4 و 7. بمجرد المعايرة ، أدخل مسبار الأس الهيدروجيني في المخزن المؤقت لأسيتات الأمونيوم.
- أضف 104 ميكرولتر من حمض الخليك إلى المحلول ، وحركها حتى تذوب ، وقم بقياس درجة الحموضة.
ملاحظة: يجب أن يكون الرقم الهيدروجيني قريبا من 5.5 في هذه المرحلة. - اضبط الرقم الهيدروجيني للمخزن المؤقت عن طريق إضافة 10 نيوتن هيدروكسيد الصوديوم (أو حمض الهيدروكلوريك إذا أصبح المخزن المؤقت أساسيا جدا) بزيادات تتراوح بين 5 و 10 ميكرولتر باستخدام ماصة دقيقة. يقلب ويقيس درجة الحموضة ويكرر حسب الضرورة. قم بتدوين حجم القاعدة / الحمض المضاف.
- أضف حجما كافيا من ddH2O لإنشاء إجمالي 100 مل من المخزن المؤقت.
ملاحظة: على سبيل المثال ، إذا تم استخدام 45 ميكرولتر من 10 نيوتن هيدروكسيد الصوديوم أثناء تعديل الأس الهيدروجيني ، إضافة 9.851 مل من ddH2O إلى الدورق (100 مل [الحجم المستهدف] - 90 مل [الخطوة 1.1.2] - 0.104 مل [الخطوة 1.1.4] - 0.045 مل [الخطوة 1.1.5] = 9.851 مل). - حرك المخزن المؤقت مرة أخيرة جيدا قبل نقله إلى حاوية تخزين بغطاء.
- قم بتنظيف مقياس الأس الهيدروجيني حسب تعليمات الأداة.
تنبيه: يمكن أن يسبب هيدروكسيد الصوديوم المائي المركز وحمض الهيدروكلوريك تفاعلات جلدية ويجب التعامل معها باستخدام القفازات.
- تحضير عازلة الترطيب (PGG)
- قم بشفط المحلول الملحي المخزن بالفوسفات (PBS) في حقنة وقم بتجهيز النهاية بفلتر حقنة بولي إيثر سلفون بحجم المسام 0.2 ميكرومتر. قم بتصفية PBS في أنبوب طرد مركزي بلاستيكي نظيف بغطاء.
ملاحظة: يمكن استخدام مرشحات حقنة المسام 0.2 ميكرومتر من مواد الأغشية البديلة (على سبيل المثال ، فلوريد البولي فينيلدين) طالما أن الغشاء متوافق مع PBS وخلات الأمونيوم. - اجمع بين PBS المفلترة والبروبيلين جلايكول والجلسرين عبر الماصة الدقيقة بنسبة حجمية 8: 1: 1 لعمل مخزن مؤقت للترطيب (يشار إليه أيضا باسم PGG). عند إضافة البروبيلين غليكول والجلسرين، قم بشفط ومسح أي قطرات متبقية من البروبيلين غليكول أو الجلسرين من سطح طرف الماصة قبل سحب الكاشف ببطء في PBS. سيظهر تعكر لزج واضح يشبه الخيط في PBS.
ملاحظة: يوصى باستخدام ماصة دقيقة p1000 لإضافة PBS أولا إلى أنبوب الطرد المركزي ، متبوعا بالبروبيلين جلايكول والجلسرين ، حيث أن الكاشفين الأخيرين لزج. على هذا النحو، يجب شفاقتها ببطء عبر الماصة الدقيقة حتى تختفي حركة السوائل في طرف الماصة بحيث لا يتم امتصاص الهواء عند إزالة طرف الماصة من الكاشف. يجب استخدام أطراف الماصات الدقيقة ذات العلامات الحجمية بشكل مثالي لاختيار أحجام الكاشف التي تتوافق مع هذه العلامات (على سبيل المثال، صنع 1 مل أو 5 مل PGG، واستخدام علامة 0.1 مل أو 0.5 مل على التوالي على طرف الماصة الدقيقة لتصور الشفط الكامل للبروبيلين غليكول والجلسرين). عند مسح سطح طرف الماصة الدقيقة ، لا تمسح عند فتحة الحافة ، فقط على الجانبين. - الماصة لأعلى ولأسفل مع طرف الماصة في المحلول حتى يتم إذابة الكواشف بشكل متجانس. احرص على عدم إدخال أي فقاعات هواء في المحلول.
- لضمان مزيج كامل من مخزن الترطيب المؤقت ، قم بتغطية أنبوب الطرد المركزي وقم بالتدوير لأعلى ولأسفل ببطء. لا تدوام.
- قم بتدوير الأنبوب بأقل من 1000 × جم لمدة 20-30 ثانية (درجة الحرارة الدنيا 4 درجات مئوية ، الحد الأقصى RT) لإزالة فقاعات الهواء غير المرئية.
- قم بشفط المحلول الملحي المخزن بالفوسفات (PBS) في حقنة وقم بتجهيز النهاية بفلتر حقنة بولي إيثر سلفون بحجم المسام 0.2 ميكرومتر. قم بتصفية PBS في أنبوب طرد مركزي بلاستيكي نظيف بغطاء.
- تحضير المخزن المؤقت للترطيب / الملصقات الراديوية (AA-PGG)
- مرشح الحقنة 0.1 متر ، الرقم الهيدروجيني 5.5 عازلة أسيتات الأمونيوم (من الخطوة 1.1) ، و PBS في أنابيب منفصلة وفقا للخطوة 1.2.1.
- اجمع بين المخزن المؤقت لأسيتات الأمونيوم المصفى ، و PBS المصفى ، والبروبيلين جلايكول ، والجلسرين عبر ماصة دقيقة p1000 في أنبوب طرد مركزي في مخزن مؤقت أسيتات الأمونيوم 5: 3: 1: 1: 1: PBS: البروبيلين جلايكول: النسبة الحجمية للجلسرين بالترتيب المدرج. اتبع تعليمات الشفط والخلط والطرد المركزي وفقا للخطوات 1.2.2-1.2.5 لعمل AA-PGG.
- مادة اللونيات الفورية ذات الطبقة الرقيقة (iTLC)
- يزن ما يصل إلى 0.1 جم من حمض الإيثيلين ديامين تترا أسيتيك (EDTA) وينقل إلى قارورة مغطاة يذوب في ddH2O بحيث يتم صنع محلول 2٪ وزن / حجم من EDTA (على سبيل المثال ، ل 50 مجم من EDTA ، أضف 2.5 مل من ddH2O).
- اجمع بين محلول EDTA بنسبة 2٪ وزن / حجم مع المخزن المؤقت لأسيتات الأمونيوم من الخطوة 1.1 بنسبة 9: 1 فولت / حجم (محلول EDTA 90٪ ، مخزن مؤقت أسيتات الأمونيوم 10٪). قم بتغطية وتخزين مادة iTLC الناتجة.
2. تشكيل أفلام الدهون
ملاحظة: يحدد هذا الإجراء تكوين طبقة دهنية بتركيبات تحاكي الفقاعة الدقيقة التجارية ، Defity® ، مع استبدال الدهون البورفيرين بالدهون المضيفة وتشكل 30 مول٪ من إجمالي الدهون. ومع ذلك ، يمكن تطبيق بروتوكول الوسم الإشعاعي على تركيبات دهنية متنوعة (أطوال سلسلة C16 ، C18 ، C22 ، شحنة محايدة أو أنيونية ، تركيبات مولية مختلفة من البورفيرين والدهون). يتم إرفاق جدول بيانات تكميلي (ملف تكميلي 1) يوفر الحسابات والتراكيب والكتل وأحجام المخزون للصيغ الموصوفة وغيرها. جميع الدهون متوفرة تجاريا باستثناء البورفيرين - الدهون ، بيروفيوفوربيد - الدهون (بيرو ليبيد) ، والتي تم وصف تركيبها سابقا بالتفصيل35،36.
- باستخدام الملف التكميلي 1 ، حدد الكتلة الإجمالية اللازمة لكل دهون بناء على عدد الأفلام المطلوبة.
- قم بوزن قارورة زجاجية فارغة 0.5 دراما على ميزان تحليلي.
ملاحظة: يتداخل الغبار مع تكوين الفقاعات الدقيقة الناجحة. وبالتالي ، قم بنفخ الهواء المضغوط في القارورة لإزالة أي غبار / جسيمات إذا تم تخزينها بدون غطاء. - قم بوزن 1،2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) على ورق الوزن.
ملاحظة: يجب الحصول على الكتلة التي تم وزنها من الخطوة 2.1 بالإضافة إلى 0.5-1 مجم إضافية لحساب أي خسارة أثناء التعامل مع العينة في الخطوات اللاحقة. - انقل DPPC إلى القارورة الزجاجية الموزونة وأعد وزنها لتحديد كتلة الدهون في القارورة. تسمح هذه العملية بنقل الدهون بسهولة إلى القارورة الزجاجية ، وتقليل فقدان / انسكاب مسحوق الدهون ، وقياس أكثر دقة لكتلة الدهون.
- كرر الخطوات من 2.2 إلى 2.4 مع الدهون الأخرى: 1،2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N- [ميثوكسي (بولي إيثيلين جلايكول) -5000] (DPPE-mPEG) ، 1،2-dipalmitoyl-sn-glycero-3-phosphate (DPPA) ، و C16 pyro-lipid.
ملاحظة: إذا لم يكن البيرو ليبيد متوفرا في شكل مسحوق قابل للوزن ولكن كفيلم أو كمية غير معروفة ، فيمكن إذابته في الكلوروفورم لتشكيل مخزون يمكن حساب تركيزه من خلال قياسات امتصاص الأشعة فوق البنفسجية في الميثانول باستخدام قانون بير لامبرت كما هو موضح سابقا35. - قم بإعداد المذيبات والمحاليل العضوية التالية في أنابيب الاختبار الزجاجية باستخدام الماصات الدقيقة أو المحاقن الزجاجية: 1) الكلوروفورم ، 2) 9: 1 v / v chloroform: الميثانول ، و 3) 65: 35: 8 الكلوروفورم: الميثانول: ddH2O. أخيرا ، قم بتقطيع المكونات واخلطها بالترتيب التالي: ddH2O ، الميثانول ، ثم الكلوروفورم.
تنبيه: الميثانول والكلوروفورم من المخاطر الصحية والقابلة للاشتعال والمتطايرة. ارتد واقيا للعين والقفازات ومعطف المختبر واستخدم غطاء الدخان. - استخدم الملف التكميلي 1 لحساب حجم المذيب / المحلول العضوي اللازم لصنع مخزون الدهون واختيار المحاقن الزجاجية ذات الأحجام المناسبة.
ملاحظة: يجب أن ينتج عن هذا الحجم تركيزات مخزون تتوافق مع أحجام مخزون 15-100 ميكرولتر لكل فيلم يمكن قياسها بسهولة باستخدام محاقن ميكرولتر زجاجية 25-100 ميكرولتر. - شطف المحاقن الزجاجية ثلاث مرات مع الكلوروفورم. ضخ المكبس ذهابا وإيابا لتجفيف المحقنة.
- قم بقياس وإضافة المذيبات / المحاليل العضوية عبر المحقنة الزجاجية التي تم تنظيفها إلى قوارير الدهون الفردية وفقا لحسابات جدول البيانات في الخطوة 2.7 لتشكيل مخزون الدهون. قم بإذابة الدهون الحرارية في الكلوروفورم (ما لم يتم إذابته بالفعل وفقا للخطوة 2.5 ملاحظة) ، DPPC و DPPE-mPEG في 9: 1 v / v chloroform: الميثانول و DPPA في 65: 35: 8 الكلوروفورم: الميثانول: ddH2O. في حالة استخدام نفس المحقنة الزجاجية لجميع الإضافات ، اشطفها وجففها بين كل دهون.
ملاحظة: إذا كانت التركيبة المختارة لا تحتوي على DPPA أو متغير طول السلسلة C18 ، فيمكن إذابة كل من الدهون الحرارية ودهون الكمبيوتر المضيف ودهون PEG في الكلوروفورم. - غطاء القوارير والدوامة.
- أضف الأحجام المحسوبة من محاليل الدهون إلى قارورة زجاجية جديدة 0.5 دراما (قارورة فيلم) عبر حقنة زجاجية ميكرولتر. بالنسبة للمخزون الدهني الأول ، أدخل طرف الإبرة في الجزء السفلي الأوسط من القارورة واغمس ببطء لتجنب تناثر جدران القارورة. للإضافات اللاحقة ، ضع طرف الإبرة فوق مستوى السائل مباشرة ولمس جانب القارورة لإزالة أي قطرات نهائية بطريقة لا تعرض الإبرة للسائل أدناه.
ملاحظة: اشطف وجفف المحقنة الزجاجية بين إضافات الدهون عند حدوث التلوث. في حالة صنع أفلام متعددة ، قم بتغطية كل من الفيلم وقوارير المخزون بين الإضافات لتقليل تبخر المذيبات. - قم بتدوير القارورة يدويا برفق في وضع رأسي لخلط المحتويات. تجنب رش أي محلول على جدران القارورة.
- قم بفك الغطاء (قم بتخزين الغطاء) وأدخل خط النيتروجين في فراغ القارورة. اضبط تدفق النيتروجين لإحداث اضطراب مرئي طفيف على سطح السائل ولكن دون أي قمع أو تناثر.
- دوامة القارورة فور إدخال خط النيتروجين. ابدأ بسرعة منخفضة كافية لتشكيل قمع مع مذيب لا يزيد عن 1 سم من قاع القارورة. تجنب رش المذيبات. عندما يتبخر المذيب ، قم بزيادة سرعة الدوامة ببطء ودون توقف ، مع الحفاظ على ارتفاع المذيب حتى يتبخر السائل بالكامل. ستكون النتيجة طبقة رقيقة مطلية عبر الثلث السفلي من القارورة.
- ضع القارورة في مجفف مجهز بالفراغ واستمر في تجفيف الفيلم تحت الفراغ لمدة 8-72 ساعة. قم بتغطية القارورة (باستثناء الفتحة) أو المجفف بورق الألمنيوم.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. يمكن تنفيذ الخطوات التالية بعد تجفيف الفيلم ، أو يمكن تخزين الأفلام تحت الأرجون ، ومختومة ب Parafilm ، في فريزر -20 درجة مئوية لمدة تصل إلى شهر واحد ، ولفترة أطول إذا ظلت جافة.
3. ترطيب فيلم الدهون
ملاحظة: إذا تم استخدام الفقاعات الدقيقة في المختبر أو في الجسم الحي، فاستخدم أطراف الماصات الدقيقة المعقمة والأنابيب والمحاقن والإبر للخطوات من 3.3 إلى 5.4 ما لم ينص على خلاف ذلك.
- قم بإزالة الفيلم من المكنسة الكهربائية أو إذا تم تخزينه في المجمد ، اتركه يسخن إلى RT.
- املأ دورق سعة 250 مل بالماء وقم بتسخين الماء إلى 70-80 درجة مئوية.
- تسخين سونيكاتير حمام مائي إلى 69 درجة مئوية.
- ماصة دقيقة 1 مل من AA-PGG (الخطوة 1.3) أسفل حواف قارورة الطبقة الدهنية لتجنب تكوين الفقاعات.
ملاحظة: عند تصنيع التحكم غير المخلب أو الفقاعات الدقيقة الفلورية فقط، استخدم PGG (الخطوة 1.2) بدلا من AA-PGG. - قم بتغطية فتحة القارورة جزئيا بغطاء ، مع ترك مساحة كافية لإدخال خط المشبع بالفلوروبروبان (PFP). قم بتدفق PFP في مساحة القارورة لمدة 20 ثانية فوق السائل ، بحيث يكون السائل مضطربا بشكل واضح ولكن لا يتناثر. لا تتدفق PFP مباشرة إلى التعليق. غطاء القارورة.
ملاحظة: إذا كان التدفق كافيا في القوة والوقت ، فستبدأ القارورة في التبريد عند لمسها. - اغمر النصف السفلي من القارورة في حمام مائي 70-80 درجة مئوية لمدة 1 دقيقة. ثم, صوتنة لمدة 30 ثانية على الأقل في 69 درجة مئوية حمام سونيكاتير أو حتى ينتشر الفيلم الدهني بشكل متجانس في AA-PGG. تجنب تكوين فقاعات أو تنشيط تكوين الفقاعات الدقيقة قبل الأوان (سيظهر التنشيط المبكر كمناطق حليبية / غائمة في معلق الدهون). امسح سطح القارورة عند الحاجة لتمييز ما إذا كانت هناك أي دهون غير معلقة متبقية.
ملاحظة: إذا لم يتم ترطيب الفيلم الدهني في غضون 1 دقيقة من الصوتنة ، فأعد تسخينه في حمام 70-80 درجة مئوية ، وأعد الصوتنة. - بمجرد تعليق الفيلم الدهني بشكل متجانس ، قم بتسخينه مرة أخيرة لمدة 1 دقيقة وصوتنة لمدة 30 ثانية إضافية.
- امسح القارورة واتركها لتبرد بشكل سلبي إلى RT (~ 5-10 دقائق).
- أعد ملء مساحة رأس القارورة باستخدام PFP وفقا للخطوة 3.5 ، والغطاء ، وأغلق حواف الغطاء باستخدام Parafilm.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا واستئنافه في موعد لا يتجاوز 8 ساعات.
4. وضع العلامات الراديوية
ملاحظة: بالنسبة للتحكم غير المخلب أو الفقاعات الدقيقة الفلورية فقط ، انتقل إلى القسم 5 من البروتوكول.
تنبيه: قم بتنفيذ الخطوات 4.4-4.6 من هذا البروتوكول في مختبر مشع ما لم ينص على خلاف ذلك. 64CuCl2 هو خطر إشعاعي ينطوي على خطر السمية متعددة الأجهزة من خلال التعرض للجلد أو الاستنشاق أو الابتلاع. كلما أمكن ، تعامل معه في غطاء الدخان بشكل غير مباشر باستخدام ملقط مغطى برؤوس مطاطية. ارتد معطف مختبر واقي وخاتم شخصي ومقياس جرعات شارة وقفاز مزدوج عند المناولة. تأكد من التعامل مع 64CuCl2 عبر درع الرصاص مقاس 2 بوصة. عند الضرورة ، قم بنقله في حاوية مغلفة بالرصاص. حماية حاويات النفايات وإجراء مسح تشغيلي للتلوث بعد الاستخدام.
- قم بإعداد حمام مائي بدرجة حرارة 60 درجة مئوية في دورق زجاجي أو طبق بلورة كبير يحتوي على قضيب تحريك مغناطيسي. استخدم صفيحة ساخنة / تقليب يتم التحكم في درجة حرارتها ومجهزة بمسبار حراري يتم إدخاله في الماء ، ويتم ضبطه على التقليب بمعدل ينتج عنه قمع ضعيف ولكنه مرئي.
- انقل قارورة محكمة الغلق تحتوي على 64CuCl2 في 0.1 N HCl إلى معاير الجرعة عبر ملقط مغطى برؤوس مطاطية.
ملاحظة: عند طلب 64CuCl2 ، اطلب إذابته في 5-20 ميكرولتر من 0.1 نيوتن حمض الهيدروكلوريك. يعد الحجم المنخفض أمرا بالغ الأهمية للحفاظ على عائد الفقاعات الدقيقة. - لاحظ نشاط النحاس 64 المقاس على معاير الجرعة والوقت. قم بإزالة القارورة باستخدام الملقط وضعها في وعاء يحتوي على الرصاص.
- اقسم النشاط المذكور على الحجم المبلغ عنه ل 64CuCl2 للحصول على قيمة MBq·mL-1 .
- قم بفك غطاء التعليق الدهني من الخطوة 3.9 وثبته في حامل قارورة.
- قم بفك غطاء قارورة 64CuCl2 وثبتها بالملقط.
- ماصة دقيقة حجم من محلول 64CuCl2 يتوافق مع 40-250 ميجابايت من النشاط ونقلها إلى تعليق الدهون. تأكد من غمر طرف الماصة في التعليق. اغمر ثم قم بالماصة لأعلى ولأسفل لنقل 64CuCl2 بالكامل.
ملاحظة: يعتمد مقدار 64CuCl2 المضاف على التطبيق المقصود للفقاعات الدقيقة ذات العلامات الراديوية وحساسية معاير الجرعة. بالنسبة لأخذ عينات التصوير المقطعي بالإصدار البوزيتروني الطولي (حتى 48 ساعة بعد الحقن) وأخذ عينات الدم في الجسم الحي في الفئران، يوصى بحد أدنى 220 ميغابايت و50 ميغابايت على التوالي. - قم بتغطية كل من تعليق الدهون و 64قارورة CuCl2 .
- باستخدام ملقط مسطح ذو رؤوس مطاطية ، قم بتدوير نظام التعليق الدهني المشع يدويا لأعلى ولأسفل 5 مرات على الأقل لخلط 64CuCl2 برفق من خلال التعليق. تجنب هز القارورة أو إسقاطها وتجنب تكوين الفقاعات.
- عند وضع الجانب الأيمن لأعلى ، قم بتحريك غطاء القارورة برفق مع الحفاظ على ثبات التعليق. سيساعد ذلك أي سائل محاصر في الغطاء على الانجذاب إلى قاع القارورة. قم بفك غطاء القارورة جزئيا بعناية وأدخل خط PFP مجهز بإبرة 18 G. املأ مساحة القارورة ب PFP لمدة 20 ثانية وفقا للخطوة 3.5. قم بتغطية القارورة وختمها ببارافيلم.
- قم بقياس نشاط القارورة على معاير الجرعة ولاحظ الوقت.
ملاحظة: إذا لم يتم نقل النشاط الكافي إلى القارورة ، كرر الخطوات 4.5-4.11 ، مع إضافة حجم إضافي مناسب قدره 64CuCl2. - ضع القارورة في حامل قارورة رغوية وادفعها حتى يتعرض النصف السفلي من القارورة للحرارة. ضع الحامل في حمام مائي مع التحريك 60 درجة مئوية وقم بتسخينه لمدة 1 ساعة.
- أثناء تفاعل الخلب ، قم بإعداد لوحات iTLC. أثناء ارتداء قفازات جديدة ، قم بتقطيع ورق الكروماتوغرافيا الزجاجي المصنوع من الألياف الدقيقة إلى شرائح مقاس 1 سم × 8 سم. سخني الشرائح في فرن تجفيف زجاجي 80 درجة مئوية.
ملاحظة: يمكن تنفيذ هذه الخطوة في مختبر غير مشع. - بعد 1 ساعة ، أخرج القارورة في الخطوة 4.12 من الحرارة وامسح الحواف بالمناديل.
- قم بتدوير القارورة لأعلى ولأسفل يدويا باستخدام ملقط مطاطي لإعادة تكثيف أي تكاثف على جدران القارورة في نظام التعليق الدهني.
- مع وضع القارورة في وضع رأسي ، قم بنفض الغبار على الغطاء أثناء تثبيت الأنبوب. قم بإزالة البارافيلم وامسحه حول الغطاء لإزالة أي ماء حمام عالق.
- قم بفك غطاء القارورة بعناية واستنشق 1-2 ميكرولتر من معلق الدهون. ضع التعليق على بعد 1 سم من الجزء السفلي من منتصف شريط iTLC وأعد تغطية القارورة. دع البقعة تجف.
ملاحظة: من الناحية المثالية، ينبغي رصد ما لا يقل عن 2 iTLCs لكل خليط تفاعل وتطويرها لكل معلق دهني ذي علامات راديوية للتأكد من ذلك. - ماصة دقيقة 200 ميكرولتر من مادة iTLC (المحضرة في الخطوة 1.4) في قاع أنبوب اختبار سعة 10 مل. ضع أنبوب الاختبار في حاوية من الرصاص. أضف iTLC المرقط إلى الأنبوب واترك الشريط يتطور حتى يصبح الشطف حوالي 1 سم من الحافة العلوية للشريط.
- قم بإزالة شرائط iTLC المطورة باستخدام الملقط. أمسك الشريط عموديا وقم بتقطيعه إلى أثلاث على أنابيب بلاستيكية مستديرة متوافقة مع γ عداد وغطاء دفع سعة 5 مل بحيث يقع كل ثلث شريط مباشرة في الثلث الفردي. أدخل أغطية الدفع في الأنابيب الثلاثة.
- قم بقياس الأنابيب المحتوية على الشريط وأنبوب التحكم الفارغ / المغطى على عداد γ لنشاط النحاس 64 وسجل العدد المرتبط بالدقيقة (cpm). اطرح نشاط أنبوب التحكم من القراءات الأخرى لتصحيح نشاط الخلفية.
ملاحظة: ترتبط القراءات المصححة للثلث السفلي من الشريط (القطعة 1) بجزيئات التعليق الدهنية المخلبة من النحاس 64. يحتوي القسم الأوسط (القطعة 2) على خط من مخلبات النحاس الحرة -64 و 64Cu-pyro-lipid في شكل غير فوق جزيئي. يحتوي القسم العلوي (القطعة 3) في الغالب على النحاس الحر 64. - احسب النقاء الكيميائي الإشعاعي عبر المعادلة 1.
 (المعادلة 1)
(المعادلة 1)
ملاحظة: إذا بدت التكلفة لكل ألف ظهور للقطعة 1 منخفضة بشكل غير معقول (على سبيل المثال، أقل أو مكافئة للقطعتين 2 أو 3) أو إذا كانت أي قراءات أعلى من عتبة γ العدادية غير الخطية/التشبع، فقم بتحديد حجم أقل أو كمية مخففة (1-2 ميكرولتر) من المعلق الموسوم بالإشعاع ل iTLC. - تأكد من أن النقاء الكيميائي الإشعاعي الذي تم الحصول عليه من كلا شريطي iTLC لكل معلق دهني ≥ 94٪ للاستمرار. إذا لم يكن الأمر كذلك ، فاستمر في تسخين معلق الدهون عند 60 درجة مئوية ومراقبة الاستخلاب على فترات 30 دقيقة عبر iTLC.
- قم بفك غطاء قارورة التعليق الدهنية ذات العلامات الراديوية والماصة الدقيقة 8.89 ميكرولتر من 1 نيوتن هيدروكسيد الصوديوم في التعليق ، مع سحب العينات لأعلى ولأسفل لنقل القاعدة بالكامل وتحييد التعليق. قم بتغطية القارورة ، وقم بتدويرها يدويا باستخدام ملقط لقلبها / الرجوع إليها ، ثم اضغط برفق على غطاء القارورة.
- املأ مساحة الرأس ب PFP وفقا للخطوة 4.10 ، وقم بالغطاء والختم باستخدام Parafilm.
5. تنشيط الفقاعات الدقيقة والعزل
- قم بتنشيط نظام التعليق الدهني عبر شاكر قارورة ميكانيكي لمدة 45 ثانية عند 4530 دورة في الدقيقة لتوليد تعليق فقاعة صغيرة حليبية. اترك القارورة تبرد بشكل سلبي إلى RT لمدة 10 دقائق تقريبا. سوف ينفصل التعليق اللبني الناتج إلى طبقتين بمرور الوقت.
ملاحظة: يجب أن تبدو محتويات القارورة حليبية بعد التنشيط. ويشير التعليق الأكثر وضوحا بعد التنشيط إلى عدم نجاح التفعيل، وسيتم مناقشة المساهمين فيه في الأقسام اللاحقة. - بمجرد وصولك إلى RT ، قم بقلب / إرجاع القارورة برفق لإعادة تعليق الفقاعات الدقيقة. ضع القارورة على سطح مستو وانتظر دقيقتين قبل الصب للحصول على مجموعة الفقاعات الدقيقة المطلوبة على النحو التالي:
- جهز حقنة بلاستيكية سعة 1 مل بإبرة 18 جم وتنفيس المحقنة / الإبرة عن طريق شفط الهواء وغمره للداخل / الخارج. عند علامة 2 دقيقة ، قم بفك غطاء القارورة بسرعة ، وكسر ختم Parafilm بحركة واحدة.
- ارسم 400-550 ميكرولتر من قاع القارورة (مجموعة الفقاعات الدقيقة المستهدفة) ، وتجنب شفط الطبقة الرغوية العليا لمجموعات الفقاعات الدقيقة الأكبر غير المرغوب فيها.
ملاحظة: إذا لزم الأمر، قم بإمالة القارورة إلى جانب واحد لتجميع الأحجام الطرفية في المحقنة لتجنب شفط الطبقة الرغوية/الأخف وزنا.
- امسح حواف الإبرة بعناية لإزالة أي ملوثات رغوية ونقل تعليق الفقاعات الدقيقة المعزولة إلى أنبوب طرد مركزي دقيق. قم بالغطاء برفق (لا تفتح الغطاء أو يغلقه فجأة). هذا هو تعليق العمل النهائي للفقاعات الدقيقة ذات العلامات الراديوية.
- قم بقياس نشاط منتج الفقاعات الدقيقة النهائي على معاير الجرعة ولاحظ الوقت. اقسم هذه القيمة على حجم المعلق المصبوب، في الخطوة 5.2 للحصول على قيمة MBq·mL-1 لحساب أحجام الحقن اعتمادا على تطبيق الفائدة.
ملاحظة: الفقاعات الدقيقة ذات العلامات الراديوية جاهزة الآن للاستخدام. يمكن تنفيذ القسم 6 حتى 24 ساعة لاحقا. للحصول على معلومات حول كيفية حقن هذه الفقاعات الدقيقة ذات العلامات الراديوية وتتبعها في الجسم الحي من خلال التصوير متعدد الوسائط (الموجات فوق الصوتية ، التصوير المقطعي بالإصدار البوزيتروني ، الفلورة) ، راجع Rajora et al.15.
6. التحقق من كفاءة وضع العلامات الراديوية
- أعد تعليق الفقاعات الدقيقة من خلال سحب العينة اللطيف أو انعكاس القارورة.
ملاحظة: لا تقم أبدا بدوامة منتج يعمل بالفقاعات الدقيقة. الدوامة تزعزع استقرار تعليق الفقاعات الدقيقة. - أضف 10-200 ميكرولتر من المعلق الملصق بالإشعاع إلى وحدة مرشح الطرد المركزي لقطع الوزن الجزيئي 30,000 (MWCO) سعة 0.5 مل. في حالة استخدام وحدات تخزين <200 ميكرولتر، أضف ddH2O إلى وحدة المرشح لتشكيل حجم إجمالي يبلغ 200 ميكرولتر. ضع وحدة المرشح في أنبوب وغطاء متوافقين للطرد المركزي الدقيق.
ملاحظة: يوصى بإجراء اختبار الوسم الإشعاعي قبل وبشكل منفصل عن أي استخدام مطبق في المختبر أو في الجسم الحي للفقاعات الدقيقة ذات العلامات الراديوية لضمان إكمال البروتوكول بنجاح. في هذه الحالة ، يمكن استخدام حجم أكبر (على سبيل المثال ، 200 ميكرولتر) في هذه الخطوة. عندما يتم استخدام البروتوكول لاحقا لجلسة العلاج ، قم بإعداد أحجام العلاج / الحقن أولا ، ثم قم بإجراء القسم 6 مع تعليق الفقاعات الدقيقة المتبقي ذي العلامات الإشعاعية في أقرب وقت ممكن. - جهاز طرد مركزي لمدة 10 دقائق عند 12,000 × جم عند RT.
ملاحظة: يجب أن يكون جهاز الطرد المركزي الدقيق محاطا بدرع من الرصاص. - قطع الاتصال بين أنبوب الطرد المركزي الدقيق وغطاءه بالمقص.
- ضع الغطاء في قارورة تلألؤ سعة 20 مل مكتوب عليها "أغطية". انقل وحدة المرشح إلى أنبوب طرد مركزي دقيق جديد (الأنبوب 2).
- ضع أول أنبوب للطرد المركزي الدقيق مع الأشعة تحت الحمراء في قارورة تلألؤ سعة 20 مل تحمل علامة "الأنبوب 1". أضف 200 ميكرولتر ddH2O إلى وحدة المرشح في الأنبوب 2.
- جهاز الطرد المركزي لوحدة المرشح في الأنبوب 2 عند 12,000 × جم عند RT.
- كرر الخطوتين 6.4 و 6.5. أضف غطاء الأنبوب 2 إلى قارورة التلألؤ "القبعة" التي تؤوي غطاء الأنبوب 1. ضع الأنبوب 2 في قارورة تلألؤ جديدة سعة 20 مل.
- قم بقص غطاء أنبوب الطرد المركزي الدقيق الثالث وضعه في قارورة "الأغطية" وفقا للخطوة 6.4. انقل وحدة الفلتر إلى قارورة تلألؤ جديدة سعة 20 مل تحمل علامة "وحدة" ، مع التأكد من بقاء الأشعة تحت الحمراء في الأنبوب 3 وعدم نقلها إلى قارورة "الوحدة". إذا شوهدت قطرات على حواف وحدة المرشح ، فأعدها إلى الأنبوب 3 ، والغطاء ، وقم بالدوران لأسفل لمدة 10 ثوان. ضع الأنبوب 3 في قارورة زجاجية جديدة سعة 20 مل.
- قم بتغطية قوارير التلألؤ ال 5 (الأنبوب 1 ، الأنبوب 2 ، الأنبوب 3 ، الأغطية والوحدة). قم بإعداد قارورة تلألؤ فارغة ومغطاة بسعة 20 مل كعنصر تحكم فارغ.
- قم بقياس قوارير التلألؤ الستة على عداد γ لنشاط النحاس 64. اطرح نشاط القارورة الفارغة من نشاط القوارير الأخرى. احسب كفاءة وضع العلامات الراديوية / الخلب باستخدام المعادلة 2.
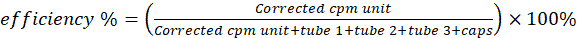 (المعادلة 2)
(المعادلة 2)
ملاحظة: إذا كانت الوحدة تكلفة لكل ألف ظهور منخفضة بشكل غير معقول (على سبيل المثال أو أقل أو ما يعادلها من الأنابيب) أو إذا كانت أي قراءات أعلى من عتبة γ العداد غير الخطي / التشبع ، فقم بتخزين قوارير التلألؤ في حاويات الرصاص لمدة تصل إلى 4 أيام للسماح للنشاط بالاضمحلال حتى تصبح القيم أقل من العتبة وإعادة القياس.
7. التوصيف الفيزيائي الكيميائي Microbubble
ملاحظة: ما لم يكن لدى المختبر معدات مخصصة لمعالجة العينات المشعة، يجب إجراء التوصيف الفيزيائي الكيميائي للفقاعات الدقيقة باستخدام عينات غير مشعة و"باردة" من النحاس المخلب. تسهل هذه الملصقات "الباردة" تقييم إنتاجية الفقاعات الدقيقة ، وهو أمر حيوي لتقييم جرعة الفقاعات الدقيقة المستخدمة في التطبيق المقصود للفرد. بالإضافة إلى ذلك ، فإنه يسمح بالمقارنة مع الفقاعات الدقيقة غير المخلبة للتحكم للتأكد من أن عملية وضع العلامات الراديوية لا تزعج خصائص الفقاعات الدقيقة. يجب أن يحدث هذا التصنيف "البارد" والتوصيف الفيزيائي الكيميائي المرتبط به قبل تطبيق الفقاعات الدقيقة ذات العلامات الراديوية ويمكن استخدامه كتغذية مرتدة إذا كانت هناك حاجة إلى تعديلات على الملصقات الراديوية (انظر المناقشة).
- وضع العلامات على الفقاعات النحاسية الدقيقة "الباردة"
- باستخدام حجم محلول 64CuCl2 المضاف إلى معلق الدهون في الخطوة 4.7 ، تكوين البورفيرين المولار٪ داخل الأغشية الدهنية والنشاط المحدد الموجود في ورقة منتج 64CuCl2 ، احسب النسبة التقريبية للمعادن: البورفيرين المولار التي تم تحقيقها أثناء وضع العلامات الإشعاعية. يمكن العثور على أمثلة على العمليات الحسابية في الملف التكميلي 1.
- اتبع الأقسام 1-3 من البروتوكول الحالي.
- تحضير محلول 0.1 ملليتر -1 CuCl2 في 0.1 نيوتن حمض الهيدروكلوريد.
- الماصة الدقيقة الحجم المناسب لمحلول CuCl2 هذا في معلق الدهون المحسوب من الخطوة 7.1.1 وغطاء القارورة.
- قم بتدوير القارورة لخلط CuCl2 في نظام التعليق الدهني ، واملأ مساحة الرأس ب PFP ، والختم ، والحرارة وفقا للخطوات 4.9 و 4.10 و 4.12. ليست هناك حاجة إلى ملقط مطاطي لمناولة القارورة.
- بعد 1 ساعة ، أخرج القارورة من الحرارة وامسح الجزء الخارجي حتى يجف. دع القارورة تبرد إلى RT.
- قم بتحييد التعليق الدهني ، وامزجه ، واملأ مسافة الرأس ب PFP ، وأغلقه وفقا للخطوتين 4.23 و 4.24.
- قم بتنشيط تعليق الفقاعات الدقيقة والصب للحصول على منتج عامل وفقا للخطوات 5.1-5.3.
- تحجيم الفقاعات الدقيقة
ملاحظة: يجب إجراء تحجيم الفقاعات الدقيقة فور التنشيط. في حالة تقييم ثبات تعليق العمل ، كرر تحضير العينة والقياسات على فترات 30 دقيقة. عادة ما تمثل النافذة 1-2 ساعة الإطار الزمني الذي سيتم خلاله استخدام / إدارة تعليق عمل الفقاعات الدقيقة بعد التنشيط. الهدف من قياسات الاستقرار هو ضمان الحفاظ على حجم الفقاعات الدقيقة والعائد خلال هذا الإطار الزمني بحيث تحتوي جميع العلاجات التي يتم إجراؤها من محلول العمل على مجموعات فقاعات دقيقة مماثلة.- قم بتشغيل عداد Coulter (CC) وقم بتعيين المعلمات التالية باستخدام أداة Edit SOP : فتحة 30 ميكرومتر ، نطاق حجم 0.6-18 ميكرومتر ، تيار فتحة العدسة 400-600 ميكرو أمبير ، كسب مكبر الصوت 4-8 ، 400 صندوق ، تدفق قبل وبعد كل تشغيل ، تحليل حجمي ، حجم عينة 5 ميكرولتر.
- قم بتصفية المنحل بالكهرباء CC من خلال وحدة ترشيح فراغ وسائط 0.2 ميكرومتر. املأ حاوية المنحل بالكهرباء وحاوية منفصلة لتحضير العينة.
- قياس الخلفية: املأ كوفيت سعة 10 مل ب 10 مل بالكهرباء المفلترة سعة 10 مل وقم بإجراء قياس أساسي. تأكد من أن العدد أقل من 400. إذا لم يكن كذلك ، فقم بغسل الأداة.
- قياس العينة
- أضف 10 مل من المنحل بالكهرباء المصفى إلى كوفيت جديد. قم بتعليق تعليق الفقاعات الدقيقة عن طريق العكس / الرجوع يدويا. ماصة دقيقة 5 ميكرولتر من أسفل وسط القارورة. امسح حواف طرف الماصة (باستثناء الفتحة) واغمر العينة مباشرة في المنحل بالكهرباء المجهز.
- الماصة لأعلى ولأسفل لنقل التعليق بالكامل. استخدم طرف الماصة لتدوير المنحل بالكهرباء برفق حتى تتشتت "خصلات" تعليق الفقاعات الدقيقة.
- قم بقياس العينة على CC (جولتان لكل تحليل).
ملاحظة: عادة ما يكون حجم عينة الفقاعات الدقيقة 5 ميكرولتر مناسبا للعينات التي تحتوي على تركيزات 1-5 × 109 ميكرو فقاعة · مل -1 . قد يلزم تعديل حجم العينة هذا اعتمادا على إعداد أداة CC المحدد وإذا كانت عوائد الفقاعات الدقيقة للعينة تقع خارج النطاق أعلاه.
- التصوير متحد البؤر
ملاحظة: قم بإجراء التصوير متحد البؤر مباشرة بعد تحجيم الفقاعات الدقيقة وضمن الإطار الزمني لاستقرار الفقاعات الدقيقة المحتفظ بها وفقا للملاحظة الواردة في الخطوة 7.2.- أعد تعليق الفقاعات الدقيقة وانقل 1-5 ميكرولتر إلى وسط شريحة المجهر الزجاجي. ضع زلة غطاء بعناية فوق قطرة تعليق الفقاعات الدقيقة ، وتجنب أي انحباس لفقاعات الهواء. سوف ينتشر التعليق تحت زلة الغطاء.
- قم بتصوير الفقاعات الدقيقة بتكبير 60x بهدف الغمر بالزيت. احصل على صور في المجال الساطع وأقل من 633 نانومتر من الإثارة / انبعاث 640-765 نانومتر. تراكب الصور الساطعة والفلورة.
ملاحظة: يجب أن تتداخل إشارة التألق عبر غلاف جميع الجسيمات المرئية عندما يتم دمج المسبار بشكل متجانس داخل غلاف الفقاعات الدقيقة.
- قياس الطيف الفلوري
ملاحظة: يمكن إجراء قياسات قياس الطيف الفلوري في غضون 24 ساعة من تنشيط الفقاعات الدقيقة.- تحضير 1٪ Triton X-100 كما هو موضح سابقا35.
- قم بتشغيل مقياس الطيف الفلوري قبل 15-30 دقيقة من القياس الأول.
- قم بقياس أطياف التألق ل 1٪ Triton X-100 باستخدام إثارة 410 نانومتر ونطاق انبعاث 600-800 نانومتر في كوفيت الكوارتز. حدد خيار تطبيع الإشارة بواسطة إشارة الكاشف المرجعي (يشار إليها غالبا باسم S1 / R1).
ملاحظة: يصدر Triton X-100 فقاعات بسهولة عند سحب العينات. على هذا النحو، عند النقل إلى كوفيت، اغرق فقط في أول نقطة توقف دقيقة. - اشطف الكوفيت بالميثانول وجففه بالهواء المضغوط بين العينات.
- انقل 6 مل من 1٪ Triton X-100 إلى أنبوب طرد مركزي سعة 15 مل. أعد تعليق الفقاعات الدقيقة واستنشق 1 ميكرولتر عبر ماصة دقيقة. امسح حواف طرف الماصة باستثناء الفتحة وانقل العينة إلى Triton X-100 المحضر بنسبة 1٪، مع سحب العينة لأعلى ولأسفل لإكمال النقل. دوامة المحلول ونقله إلى كوفيت الكوارتز.
ملاحظة: اضبط نسبة العينة: 1٪ Triton X-100 وفقا لحساسية الجهاز وعتبة التشبع غير الخطية. - قم بقياس هذه العينة باستخدام المعلمات الواردة في الخطوة 7.4.3. يتوافق هذا القياس مع الجسيمات "المعطلة".
- كرر الخطوات 7.4.3-7.4.6 باستخدام PBS. يتوافق هذا القياس مع الجسيمات "السليمة".
- تصحيح خط الأساس لأطياف العينة المعطلة والسليمة باستخدام قياسات Triton X-100 و PBS بنسبة 1٪ ، على التوالي.
- احسب كفاءة التبريد (QE) عبر المعادلة 3 باستخدام إشارة التألق المصححة بخط الأساس المتكاملة للعينة السليمة في PBS (FPBS) وفي 1٪ Triton X-100 (FTx):
 (المعادلة 3)
(المعادلة 3)
- التحليل الطيفي للأشعة فوق البنفسجية والبصرية
ملاحظة: يمكن إجراء قياسات التحليل الطيفي لمدة تصل إلى 72 ساعة بعد تنشيط الفقاعات الدقيقة.- قم بتقطيع التعليق الميكروبي في أنبوب الطرد المركزي الدقيق باستخدام جهاز صوتي للحمام في RT حتى يصبح التعليق شفافا. هذا يقلل من تأثيرات التشتت أثناء التحليل الطيفي.
- قم بتشغيل مقياس الطيف الضوئي قبل 10 دقائق من القياس الأول. حدد فاصل مسح ضوئي يبلغ 0.25 نانومتر ونطاق اكتساب 200-800 نانومتر. تمكين طرح خط الأساس.
- استخدم كوفيت كوارتز بطول مسار 1 سم للقياسات. اشطف الكوفيت بالميثانول بين القياسات وجففها بالهواء المضغوط.
- الحصول على قياس خط الأساس للميثانول.
- دوامة تعليق الفقاعات الدقيقة الشفافة والشفافة ونقل 10-50 ميكرولتر إلى أنبوب طرد مركزي دقيق يحتوي على 200-1000 ميكرولتر من الميثانول. تأكد من قياس حجم الميثانول وإضافته إلى الأنبوب عبر حقنة زجاجية نظيفة من الميكرولتر. دوامة الحل للحصول على عينة "معطلة".
ملاحظة: يعتمد تخفيف العينة على كفاءة تحميل البورفيرين وتكوين النسبة المئوية المولية. التخفيف 20x مناسب لتكوين الفقاعات الدقيقة الدهنية الحرارية بنسبة 30 مول٪ - جمع طيف الأشعة فوق البنفسجية.
- كرر الخطوات من 7.5.4 إلى 7.5.6 باستخدام PBS بدلا من الميثانول.
ملاحظة: يمكن استخدام ماصة دقيقة لقياس أحجام PBS بدلا من حقنة زجاجية ميكرولتر.
8. تعديلات على البروتوكول
- مخلب بديل
- قم بإعداد أغشية دهنية وفقا للقسم 2 ، واستبدل الدهون الحرارية بمخلب نحاسي بديل مترافق بالدهون (على سبيل المثال ، 1،2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ملح الأمونيوم) ، يشار إليه من الآن فصاعدا باسم DTPA-lipid). استخدم الملف التكميلي 1 لحساب حجم الكتلة والمخزون المطلوب.
ملاحظة: من المحتمل أن تكون هناك حاجة إلى اختبار تركيبات مولية مختلفة لمخلب بديل لتحديد الحد الأعلى الذي لا يمكن بعده توليد فقاعات دقيقة مستقرة ذات عوائد عالية. - اتبع الأقسام من 3 إلى 6 لإنشاء وتوصيف الفقاعات الدقيقة ذات العلامات الراديوية.
- اتبع الخطوات من 7.1 إلى 7.3 لتوصيف الفقاعات الدقيقة المخلبة بالنحاس "الباردة". مطلوب فقط الحصول على صورة المجهري متحد البؤر للمجال الساطع لتقييم مورفولوجيا الجسيمات. إذا كان المخلب البديل فلوريا ، فقم بإجراء فحص مجهري متحد البؤر مع الأطوال الموجية للإثارة والانبعاث المرتبطة به بالإضافة إلى الخطوتين 7.4 و 7.5.
- قم بإعداد أغشية دهنية وفقا للقسم 2 ، واستبدل الدهون الحرارية بمخلب نحاسي بديل مترافق بالدهون (على سبيل المثال ، 1،2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ملح الأمونيوم) ، يشار إليه من الآن فصاعدا باسم DTPA-lipid). استخدم الملف التكميلي 1 لحساب حجم الكتلة والمخزون المطلوب.
- الفلوروفور البديل
- قم بإعداد أغشية دهنية وفقا للقسم 2 ، واستبدال الدهون الحرارية بفلوروفور بديل مترافق بالدهون أو متداخل (على سبيل المثال ، DiI). استخدم الملف التكميلي 1 لحساب حجم الكتلة والمخزون المطلوب.
ملاحظة: من المحتمل أن تكون هناك حاجة إلى اختبار تركيبات مولية مختلفة من الفلوروفور البديل لتحديد الحد الأعلى الذي لا يمكن بعده توليد فقاعات دقيقة مستقرة ذات عوائد عالية. - اتبع القسم 3 باستخدام PGG بدلا من AA-PGG.
- أكمل الخطوات من 5.1 إلى 5.3 والخطوات من 7.2 إلى 7.5.
- قم بإعداد أغشية دهنية وفقا للقسم 2 ، واستبدال الدهون الحرارية بفلوروفور بديل مترافق بالدهون أو متداخل (على سبيل المثال ، DiI). استخدم الملف التكميلي 1 لحساب حجم الكتلة والمخزون المطلوب.
- نهج "الارتفاع": وضع العلامات على معلقات الدهون الدقيقة المشكلة مسبقا
- قم بإنشاء طبقة من الدهون البورفيرين وفقا للقسم 2 ، باستخدام الدهون الحرارية فقط مع عدم وجود مكونات دهنية أخرى. راجع الملف التكميلي 1 للحصول على كميات الدهون الحرارية.
- قم بترطيب غشاء البيرو ليبيد وفقا للقسم 3 باستخدام 100-200 ميكرولتر من AA-PGG (أو PGG إذا لم يكن الملصقات الإشعاعية مطلوبا) بدلا من 1 مل من محلول الترطيب.
- انقل نظام التعليق الحراري الحراري بالكامل إلى تعليق الفقاعات الدقيقة الدهنية المصنوع مسبقا.
- املأ مساحة الرأس ب PFP ، وقم بتسخين التعليق والختم تحت PFP وفقا للخطوات من 3.4 إلى 3.9. راقب تشتت تعليق الدهون الحرارية في تعليق الفقاعات الدقيقة الدهنية المعدة مسبقا وقم بإجراء دورات الحرارة / الصوتنة حتى تتشتت تماما.
ملاحظة: في حالة استخدام قارورة صغيرة تجارية محكمة الغلق بالحاجز ، يمكن إدخال تعليق الدهون الحرارية إلى القارورة من خلال حقنة / إبرة دون إعادة ملء مساحة رأس القارورة ب PFP. - إجراء التوسيم الإشعاعي (انظر الخطوة 8.3.5.1 أدناه) ، والتنشيط ، والعزل (انظر الملاحظة أدناه) ، والتوصيف المرتبط به وفقا للأقسام من 4 إلى 7.
- يتمثل النهج البديل أولا في التسمية الراديوية لتعليق الدهون الحرارية المائية ، ومراقبة نقاء الكيمياء الإشعاعي بنسبة >94٪ ، والتحييد باستخدام 1 N NaOH (تعديل الحجم وفقا لحجم AA-PGG المستخدم لترطيب فيلم الدهن الحراري) ، ثم إدخال تعليق الدهون الحرارية المصنف بالإشعاع في تعليق الدهون الفقاعية الدقيقة المعدة مسبقا وفقا للخطوة 8.3.3.
ملاحظة: يجب استخدام هذا النهج المعدل فقط لتوليد فقاعات دقيقة ذات علامات إشعاعية فلورية أو متعددة الوسائط إذا أتبعتها عملية عزل تزيل الحويصلات متعددة الصفائح تحت الميكرون التي تم إنشاؤها أثناء ترطيب الدهون ولكن لا يتم دمجها في الفقاعات الدقيقة. انظر المناقشة لمزيد من التفاصيل.
- يتمثل النهج البديل أولا في التسمية الراديوية لتعليق الدهون الحرارية المائية ، ومراقبة نقاء الكيمياء الإشعاعي بنسبة >94٪ ، والتحييد باستخدام 1 N NaOH (تعديل الحجم وفقا لحجم AA-PGG المستخدم لترطيب فيلم الدهن الحراري) ، ثم إدخال تعليق الدهون الحرارية المصنف بالإشعاع في تعليق الدهون الفقاعية الدقيقة المعدة مسبقا وفقا للخطوة 8.3.3.
النتائج
النتائج الرئيسية القابلة للقياس الكمي عند تصنيع الفقاعات الدقيقة ذات العلامات الراديوية هي النقاء الكيميائي الإشعاعي وكفاءة وضع العلامات الإشعاعية. يستخدم هذا البروتوكول iTLC وإجراء طرد مركزي تم التحقق من صحته ، على التوالي ، لتوصيف كل منهما. يوضح الشكل 2 أ
Discussion
يحقق بروتوكول وضع العلامات الإشعاعية للفقاعات الدقيقة الدهنية الحالية نقاء كيميائيا إشعاعيا بنسبة >95٪ ، وكفاءة استخلاب بنسبة >95٪ ، واحتفاظا بالخصائص الفيزيائية والكيميائية الدقيقة دون الحاجة إلى أي تنقية لاحقة لوضع العلامات. تمثل هذه الإنجازات تطورات لم تتحقق سابقا ل?...
Disclosures
أفاد المؤلفون بعدم وجود تضارب في المصالح.
Acknowledgements
نشكر ديبورا سكولارد وتيشا كومال (برنامج الاستهداف المكاني والزماني لشبكة الصحة الجامعية وتضخيم الاستجابة للإشعاع (STTARR) ، تورنتو ، أونتاريو) على خدماتهما الفنية وإرشاداتهما. كما نشكر مارك تشنغ والدكتور أليكس داليوال على مساعدتهما الفنية أثناء الفحص المجهري متحد البؤر ومرفق الفحص المجهري البصري المتقدم (تورنتو ، أونتاريو) لتوفير المعدات المرتبطة بها. نحن نقر بمصادر التمويل لدينا: المعاهد الكندية للبحوث الصحية ، ومعهد تيري فوكس للأبحاث ، ومجلس أبحاث العلوم الطبيعية والهندسة في كندا ، والمؤسسة الكندية للابتكار ، ومؤسسة الأميرة مارغريت للسرطان ، وبرنامج كراسي الأبحاث الكندية ، ومركز ماكلولين ، وبرنامج فانير للمنح الدراسية ، وبرنامج المنح الدراسية لطلاب الدراسات العليا في أونتاريو ، وسرطان البروستاتا الكندي ، ومؤسسة بيتربورو كيه إم هانتر الخيرية.
Materials
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
References
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved