Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fabricación y etiquetado de microburbujas con trazadores fluorescentes y radiactivos
En este artículo
Resumen
Este protocolo describe la fabricación de microburbujas lipídicas y un método compatible de radioetiquetado de microburbujas de un solo recipiente con una eficiencia de etiquetado del >95% sin purificación que conserva las propiedades fisicoquímicas de las microburbujas. Este método es eficaz en diversas formulaciones de microburbujas lipídicas y puede adaptarse para generar microburbujas radiactivas y/o fluorescentes.
Resumen
Las microburbujas son partículas llenas de gas con cáscara de lípidos que han evolucionado de agentes de contraste de ultrasonido vascular a plataformas revolucionarias de terapia contra el cáncer. Cuando se combinan con el ultrasonido terapéutico focalizado (FUS), pueden superar de manera segura y local las barreras fisiológicas (por ejemplo, la barrera hematoencefálica), administrar medicamentos para cánceres que de otro modo serían inaccesibles (por ejemplo, glioblastoma y cáncer de páncreas) y tratar enfermedades neurodegenerativas. El arsenal terapéutico de las microburbujas-FUS está avanzando en nuevas direcciones, incluyendo la radioterapia combinada sinérgica, la obtención de imágenes multimodales y la carga y administración de fármacos todo en uno a partir de cubiertas de microburbujas.
El marcaje de microburbujas con radiotrazadores es clave para establecer estas capacidades teranósticas ampliadas. Sin embargo, las estrategias existentes de radiomarcaje de microburbujas se basan en metodologías de purificación conocidas por perturbar las propiedades fisicoquímicas de las microburbujas, utilizan radioisótopos de vida corta y no siempre producen una quelación estable. En conjunto, esto crea ambigüedad en torno a la precisión de las imágenes de radioburbujas y la eficiencia de la administración de radioisótopos tumorales.
Este protocolo describe una nueva metodología de etiquetado de microburbujas sin purificación en un solo recipiente que conserva las propiedades fisicoquímicas de las microburbujas al tiempo que logra una eficiencia de quelación de radioisótopos del >95%. Es versátil y se puede aplicar con éxito en formulaciones de microburbujas personalizadas y comerciales con diferentes longitudes de cadena lipídica de acilo, carga y composición de quelante/sonda (porfirina, DTPA, DiI). Se puede aplicar de forma adaptativa durante la fabricación de microburbujas molidas y a formulaciones de microburbujas prefabricadas con personalización modular de fluorescencia y propiedades multimodales de fluorescencia/radiactividad. En consecuencia, este método flexible permite la producción de microburbujas multimodales personalizadas y trazables (radio, fluorescentes o radio/fluorescentes activos) que son útiles para avanzar en aplicaciones mecánicas, de imagen y terapéuticas de microburbujas-FUS.
Introducción
Las microburbujas son agentes teranósticos supramoleculares del tamaño de una micra con un núcleo de gas estabilizado por una proteína, un polímero o, en la mayoría de los casos, una capa lipídica (Figura 1A). Cuando se inyectan en el torrente sanguíneo, las microburbujas mantienen interfaces gas/líquido que son detectables por ultrasonido durante períodos de tiempo de minutos antes de la disolución de sus núcleos de gas 1,2. En consecuencia, el primer uso clínico de las microburbujas fue como agentes de contraste para imágenes de ultrasonido en tiempo real3. La invención del ultrasonido focalizado terapéutico (FUS) amplió las utilidades clínicas de las microburbujas. Cuando son estimuladas por FUS de baja frecuencia, las microburbujas oscilan y generan fuerzas mecánicas específicas y sintonizables que van desde la permeabilización vascular transitoria hasta la ablación focal del tejido 4,5. Como resultado, en los últimos 20 años, se han explorado las microburbujas-FUS para la apertura de la barrera hematoencefálica (BBB), la administración de fármacos y sondas de imagen tumorales (por ejemplo, cáncer metastásico de páncreas, cerebro e hígado), la terapia de enfermedades neurodegenerativas y la ablación del cáncer 6,7,8,9,10,11.
El arsenal teranóstico de microburbujas continúa avanzando en nuevas y emocionantes direcciones. Las aplicaciones convencionales de administración de microburbujas-FUS se basan en la administración conjunta de carga terapéutica o de imagen junto con microburbujas comerciales. Existe un creciente interés en mejorar las capacidades de administración de microburbujas-FUS mediante la comprensión de las interacciones biológicas/carcasa de microburbujas, la exploración de formulaciones de microburbujas no comerciales hechas a medida y la generación de microburbujas teranósticas todo en uno con carga cargada directamente en la carcasa de microburbujas 12,13,14. De hecho, aproximadamente el 40% de los estudios de administración de fármacos con microburbujas lipídicas utilizan este tipo de microburbujas cargadas con cáscara15. Más allá de la obtención de imágenes y la administración de fármacos, la microburbuja-FUS también se ha mostrado prometedora en la mejora de la radioterapia contra el cáncer16 y en la activación de los efectos antineoplásicos de agentes cargados de cáscara que de otro modo serían benignos a través de la terapia sonodinámica17,18.
Estas direcciones convencionales y ampliadas en las aplicaciones de cáncer con microburbujas se pueden avanzar de manera más estratégica mediante el etiquetado de las cáscaras de microburbujas con trazadores radiactivos. En el ámbito de las microburbujas cargadas de carga todo en uno, este radiomarcaje 1) facilita la evaluación cuantitativa de referencia de la biodistribución dentro y fuera del objetivo de estas cubiertas de microburbujas cargadas, 2) deriva relaciones farmacocinéticas estructura-actividad que informan la selección óptima de las composiciones de microburbujas para maximizar la entrega en el objetivo, y 3) guía la aplicación estratégica y apropiada guiada por imágenes y la planificación del tratamiento (por ejemplo, tipos de dianas tisulares, dosimetría, selección de fármacos para mitigar los problemas de seguridad fuera del objetivo, utilidad en comparación con los paradigmas convencionales de cotratamiento) de los sistemas de carga todo en uno15,19. En una etapa preclínica, esta comprensión del destino de la cáscara de las microburbujas también puede iluminar los mecanismos de acción más amplios de las microburbujas-FUS. Por ejemplo, se ha demostrado que la transferencia de lípidos de las microburbujas a las células diana influye en la sonoporación habilitada para FUS12,20. Por lo tanto, la comprensión y optimización de dicha transferencia puede informar las terapias preclínicas y clínicas con microburbujas-FUS en las que está implicada la sonoporación (transfección in vitro, administración de fármacos, ablación tumoral, sensibilización a la radiación y terapia sonodinámica 20,21,22,23,24,25). Las instalaciones duales de ultrasonido y radioimagen también permitirían la apertura de vasos FUS y el seguimiento del tratamiento (por ejemplo, cinética de apertura de BBB) a partir de un solo agente en lugar de los diseños convencionales de doble agente26. En la misma línea, el radiomarcaje de microburbujas lipídicas podría servir como una alternativa todo en uno de microburbujas-FUS/radioterapia a las plataformas de administración conjunta de microburbujas-FUS + radiofármacos27.
La fragilidad de las microburbujas es un desafío nada trivial para este tipo de etiquetado. Todas las estrategias de radiomarcaje existentes están limitadas por metodologías de purificación que se sabe que perturban la estabilidad y el tamaño de las microburbujas, mientras que algunas también presentan un radiomarcaje ineficaz e inestable 28,29,30,31,32. Los requisitos de purificación también conducen a protocolos más largos. En combinación con el uso de radioisótopos de vida corta (por ejemplo, 18F t1/2 1,8 h,28,29 99mTc t1/2 6 h,3268Ga t1/2 1 h31), esto crea ineficiencias relacionadas con la desintegración de los radioisótopos y limita los plazos de planificación de las imágenes radioeléctricas y el tratamiento. En conjunto, estas limitaciones corren el riesgo de adquirir imágenes radiográficas acortadas y no representativas, datos farmacocinéticos inexactos y una administración ineficiente de radioisótopos tumorales.
En este informe, estas limitaciones se superan aprovechando las capacidades de quelación de metales fuertes y estables de la porfirina. Las porfirinas son macromoléculas orgánicas heterocíclicas con un anillo plano altamente conjugado y un sitio de coordinación central que puede acomodar una variedad de metales. Esto incluye radioisótopos de vida más larga como el cobre-64 (t1/2 12,7 h), un radiofármaco con tomografía por emisión de positrones (PET) y factibilidad de conteo de γ33. Cuando se conjugan con una columna vertebral lipídica, las porfirinas pueden incorporarse fácilmente a estructuras supramoleculares y posteriormente marcarse con cobre-64 con velocidad, alta eficiencia de quelación y estabilidad sérica, mientras se mantienen las propiedades de las partículas principales no marcadas33,34. Además, las porfirinas son fluorescentemente activas con autoenfriamiento modular en nano y micropartículas que se restaura tras la ruptura de partículas; una lectura complementaria a la PET y al recuento de γ que facilita el análisis del destino de las conchas tanto a granel como microscópicas (Figura 1A)15.
Mediante el uso de lípidos de porfirina como quelante, estas propiedades se explotaron para generar una nueva metodología de radiomarcaje de microburbujas sin purificación de un solo recipiente (Figura 1B, C) que supera las limitaciones asociadas con los métodos de radiomarcado de microburbujas existentes. Este protocolo logra una eficiencia de quelación de cobre-64 del >95%, no requiere purificación posterior al etiquetado y conserva las propiedades fisicoquímicas de las microburbujas. Puede integrarse fácilmente en la fabricación "desde cero" de microburbujas lipídicas antes de su activación (Figura 1B). Es versátil y se puede aplicar con éxito en formulaciones de microburbujas personalizadas y comerciales con diferentes longitudes de cadena lipídica de acilo (C16 a C22), carga (neutra y aniónica) y composiciones de porfirina-lípidos (1 mol, 10 mol, 30 mol), generando microburbujas con actividad de radio y fluorescencia. Su adaptabilidad también puede extenderse más allá de la porfirina. El protocolo de un solo recipiente se puede modificar para utilizar quelantes alternativos disponibles comercialmente (p. ej., pentaacetato de dietilentriamina (DTPA)-lípidos) y fluoróforos (p. ej., DiI). También se puede modificar para etiquetar formulaciones de microburbujas prefabricadas a través de un enfoque de "spiking". En consecuencia, este método permite la producción de microburbujas personalizadas y trazables (radio, fluorescentes o radio/fluorescentes activos duales) útiles para avanzar en aplicaciones mecánicas, de imagen y terapéuticas de microburbujas-FUS. El protocolo a continuación describe la fabricación de microburbujas lipídicas, la aplicación del protocolo de radiomarcaje de un solo recipiente, el radiomarcaje requerido y la caracterización de propiedades fisicoquímicas, y las posibles modificaciones.
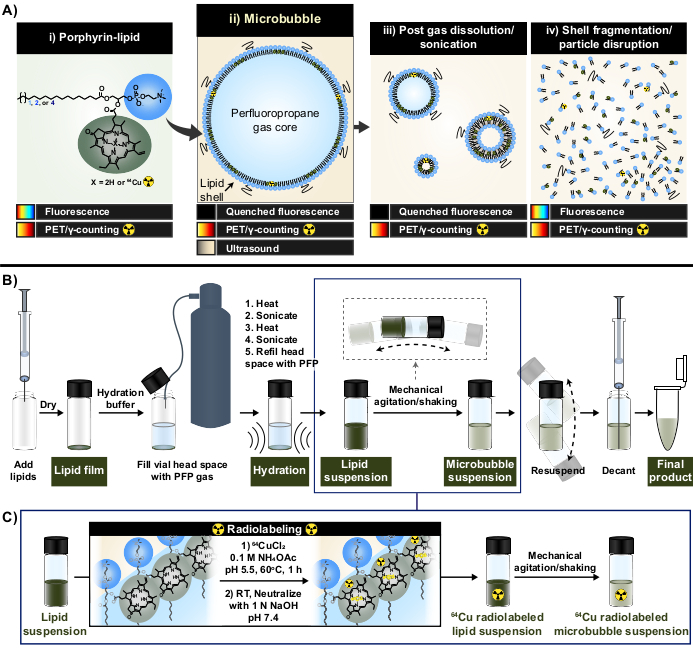
Figura 1: Protocolo de fabricación y radiomarcaje de microburbujas. (A) El lípido de porfirina, en forma de pirofeforbida-a-lípido, sirve como quelante multimodal dentro de este protocolo. Como monómero quelado a cobre-64 (i), tiene capacidades de PET e imágenes. Su fluorescencia se apaga en forma de partículas (microburbujas (ii) y su nanoprogenie posterior a la disolución (iii)) y se apaga con la disrupción de partículas (iv). (B) Protocolo de hidratación/activación de la película lipídica descrito en este informe para generar microburbujas lipídicas desde cero y (C) integración del radiomarcaje de un solo recipiente entre la formación de la suspensión lipídica y la activación de la microburbuja. Esta figura fue adaptada con permiso de Rajora et al.15. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Preparación de reactivos
- Preparar tampón de acetato de amonio (0,1 M, pH 5,5)
- Utilizando una balanza analítica, pese 770,8 mg de acetato de amonio en un papel de pesaje. Transfiera la cantidad pesada a un vaso de precipitados de vidrio limpio de 250 ml.
- Añada 90 ml de agua bidestilada (ddH2O), medida mediante una pipeta graduada, al vaso de precipitados. Agregue una barra de agitación y coloque el vaso de precipitados en una placa de agitación magnética para disolver el acetato de amonio. Revuelva a una velocidad que cree un ligero vórtice pero sin salpicaduras de solución.
- Calibre un medidor de pH de acuerdo con las instrucciones del instrumento utilizando los estándares de pH 4 y 7. Una vez calibrado, inserte la sonda de pH en el tampón de acetato de amonio.
- Agregue 104 μL de ácido acético a la solución, revuelva para disolver y mida el pH.
NOTA: El pH debe estar cerca de 5.5 en este punto. - Ajuste el pH del tampón añadiendo hidróxido de sodio 10 N (o ácido clorhídrico si el tampón se vuelve demasiado básico) en incrementos de 5-10 μL utilizando una micropipeta. Revuelva, mida el pH y repita según sea necesario. Tome nota del volumen de base/ácido añadido.
- Agregue suficiente volumen de ddH2O para crear un total de 100 mL de tampón.
NOTA: Por ejemplo, si se utilizaron 45 μL de hidróxido de sodio 10 N durante el ajuste del pH, se añadirían 9,851 mL deddH2O al vaso de precipitados (100 mL [volumen objetivo]- 90 mL [paso 1.1.2] - 0,104 mL [paso 1.1.4] - 0,045 mL [paso 1.1.5] = 9,851 mL). - Revuelva bien el tampón por última vez antes de transferirlo a un recipiente de almacenamiento con tapa.
- Limpie el medidor de pH según las instrucciones del instrumento.
PRECAUCIÓN: El hidróxido de sodio acuoso concentrado y el ácido clorhídrico pueden causar reacciones cutáneas y deben manipularse con guantes.
- Preparar tampón de hidratación (PGG)
- Aspire solución salina tamponada con fosfato (PBS) en una jeringa y equipe el extremo con un filtro de jeringa de polietersulfona de 0,2 μm de tamaño de poro. Filtre el PBS en un tubo centrífugo de plástico limpio con tapa.
NOTA: Se pueden utilizar filtros de jeringa de poros de 0,2 μm de materiales de membrana alternativos (por ejemplo, fluoruro de polivinilideno) siempre que la membrana sea compatible con PBS y acetato de amonio. - Combine PBS filtrado, propilenglicol y glicerol a través de una micropipeta en una proporción volumétrica de 8:1:1 para crear el tampón de hidratación (también conocido como PGG). Al añadir propilenglicol y glicerol, aspire y limpie las gotas residuales de propilenglicol o glicerol de la superficie de la punta de la pipeta antes de pipetear lentamente el reactivo en el PBS. En el PBS se observará una clara turbidez viscosa similar a una cuerda.
NOTA: Se recomienda utilizar una micropipeta p1000 para añadir primero PBS a un tubo de centrífuga, seguido de propilenglicol y glicerol, ya que los dos últimos reactivos son viscosos. Por lo tanto, deben aspirarse lentamente a través de la micropipeta hasta que ya no se vea movimiento del fluido en la punta de la pipeta y de modo que no se absorba aire cuando se retire la punta de la pipeta del reactivo. Lo ideal es utilizar puntas de micropipeta con marcas volumétricas para elegir volúmenes de reactivos que se alineen con dichas marcas (por ejemplo, haciendo 1 mL o 5 mL de PGG y, respectivamente, utilizando el marcado de 0,1 mL o 0,5 mL en la punta de la micropipeta para visualizar la aspiración completa de propilenglicol y glicerol). Al limpiar la superficie de la punta de la micropipeta, no limpie la abertura de la punta, solo los lados. - Pipetear hacia arriba y hacia abajo con la punta de la pipeta en la solución hasta que los reactivos se hayan disuelto homogéneamente. Tenga cuidado de no introducir burbujas de aire en la solución.
- Para asegurar aún más una mezcla completa del tampón de hidratación, tape el tubo de la centrífuga y gírelo hacia arriba y hacia abajo lentamente. No haga vórtice.
- Girar el tubo a menos de 1000 x g durante 20-30 s (temperatura mínima 4 °C, RT máxima) para eliminar las burbujas de aire inobservables.
- Aspire solución salina tamponada con fosfato (PBS) en una jeringa y equipe el extremo con un filtro de jeringa de polietersulfona de 0,2 μm de tamaño de poro. Filtre el PBS en un tubo centrífugo de plástico limpio con tapa.
- Preparación de tampón de hidratación/radiomarcaje (AA-PGG)
- Filtro de jeringa 0,1 M, tampón de acetato de amonio pH 5,5 (del paso 1.1) y PBS en tubos separados según el paso 1.2.1.
- Combine tampón de acetato de amonio filtrado, PBS filtrado, propilenglicol y glicerol a través de una micropipeta p1000 en un tubo de centrífuga en un tampón de acetato de amonio 5:3:1:1: PBS: propilenglicol: relación volumétrica de glicerol en el orden indicado. Siga las instrucciones de aspiración, mezcla y centrifugación según los pasos 1.2.2-1.2.5 para hacer AA-PGG.
- Eluyente instantáneo de cromatografía en capa fina (iTLC)
- Pesar hasta 0,1 g de ácido etilendiaminotetraacético (EDTA) y transferir a un vial tapado. Disolver en ddH2O de modo que se haga una solución al 2% p/v de EDTA (por ejemplo, para 50 mg de EDTA, añadir 2,5 mL de ddH2O).
- Combine la solución de EDTA al 2 % p/v con el tampón de acetato de amonio del paso 1.1 en una proporción de 9:1 v/v (solución de EDTA al 90 %, tampón de acetato de amonio al 10 %). Tape y almacene el eluyente iTLC resultante.
2. Formación de películas lipídicas
NOTA: Este procedimiento describe la formación de una película lipídica con composiciones que imitan la microburbuja comercial, Definity®, con lípido de porfirina que sustituye al lípido del huésped y constituye el 30 mol% del lípido total. Sin embargo, el protocolo de radiomarcaje se puede aplicar a diversas formulaciones lipídicas (longitudes de cadena C16, C18, C22, carga neutra o aniónica, composiciones molares porfirina-lípido variables). Se adjunta una Hoja de Cálculo Complementaria (Archivo Complementario 1) que proporciona cálculos, composiciones, masas y volúmenes de stock para la formulación descrita y otras. Todos los lípidos están disponibles comercialmente con la excepción del lípido de porfirina, pirofeforbida-a-lípido (pirolípido), cuya síntesis ha sido previamente descrita en detalle35,36.
- Usando el Archivo Suplementario 1, determine la masa total necesaria para cada lípido en función del número de películas requeridas.
- Pese un frasco de vidrio vacío de 0,5 dram en una balanza analítica.
NOTA: El polvo interfiere con la formación exitosa de microburbujas. Por lo tanto, sople aire presurizado en el vial para eliminar el polvo / partículas si se almacena sin tapa. - Pesar 1,2-dipalmitoil-sn-glicero-3-fosfocolina (DPPC) en papel de pesaje.
NOTA: La masa pesada debe obtenerse del paso 2.1 más 0,5-1 mg adicionales para tener en cuenta cualquier pérdida durante la manipulación de la muestra en pasos posteriores. - Transfiera el DPPC al vial de vidrio pesado y vuelva a pesarlo para determinar la masa lipídica en el vial. Este proceso permite una transferencia de lípidos más fácil al vial de vidrio, reduce la pérdida/derrame de polvo lipídico y una medición más precisa de la masa lipídica.
- Repita los pasos 2.2 a 2.4 con los otros lípidos: 1,2-dipalmitoil-sn-glicero-3-fosfoetanolamina-N-[metoxi(polietilenglicol)-5000] (DPPE-mPEG), 1,2-dipalmitoil-sn-glicero-3-fosfato (DPPA) y pirolípido C16.
NOTA: Si el pirolípido no está disponible en forma de polvo pesable, sino más bien como una película o alícuota de cantidad desconocida, puede disolverse en cloroformo para formar un stock cuya concentración se puede calcular a través de mediciones de absorbancia UV-Vis en metanol utilizando la ley de Beer-Lambert como se describió anteriormente35. - Prepare los siguientes solventes orgánicos y soluciones en tubos de ensayo de vidrio usando micropipetas o jeringas de vidrio: 1) cloroformo, 2) cloroformo 9:1 v/v: metanol y 3) cloroformo 65:35:8: metanol:ddH2O. Para la última, pipetear los componentes y mezclarlos en el siguiente orden: ddH2O, metanol, luego cloroformo.
PRECAUCIÓN: El metanol y el cloroformo son peligrosos para la salud, inflamables y volátiles. Use protección para los ojos, guantes y una bata de laboratorio, y use una campana extractora. - Utilice el Archivo Suplementario 1 para calcular el volumen de disolvente/solución orgánica necesario para producir caldos de lípidos y seleccione jeringas de vidrio de volúmenes apropiados.
NOTA: Este volumen debe producir concentraciones de stock que correspondan a volúmenes alícuotas de stock de 15-100 μL por película que se puedan medir fácilmente utilizando jeringas de microlitros de vidrio de 25-100 μL. - Enjuague las jeringas de vidrio tres veces con cloroformo. Bombee el émbolo hacia adelante y hacia atrás para secar la jeringa.
- Mida y añada el disolvente/soluciones orgánicas a través de la jeringa de vidrio limpia a los viales de lípidos individuales según los cálculos de la hoja de cálculo en el paso 2.7 para formar las existencias de lípidos. Disuelva el pirolípido en cloroformo (a menos que ya esté disuelto según la nota del paso 2.5), DPPC y DPPE-mPEG en cloroformo 9:1 v/v metanol y DPPA en cloroformo 65:35:8: metanol:ddH2O. Si usa la misma jeringa de vidrio para todas las adiciones, enjuague y seque entre cada lípido.
NOTA: Si la formulación elegida no contiene DPPA o su variante de longitud de cadena C18, entonces el pirolípido, el lípido PC del huésped y el lípido PEG pueden disolverse en cloroformo. - Tape los viales y el vórtice.
- Añada volúmenes calculados de soluciones lipídicas madre a un nuevo vial de vidrio de 0,5 dram (vial de película) a través de una jeringa de microlitros de vidrio. Para obtener el primer caldo de lípidos, inserte la punta de la aguja en la parte inferior central del vial y sumérjala lentamente para evitar salpicar las paredes del vial. Para adiciones posteriores, coloque la punta de la aguja directamente sobre el nivel de líquido y toque el costado del vial para eliminar las gotas finales de una manera que no exponga la aguja al líquido que se encuentra debajo.
NOTA: Enjuague y seque la jeringa de vidrio entre adiciones de lípidos cuando se produzca contaminación. Si fabrica varias películas, tape tanto la película como los viales de stock entre adiciones para minimizar la evaporación del solvente. - Gire suavemente el vial manualmente en posición vertical para mezclar el contenido. Evite salpicar cualquier solución por las paredes del vial.
- Destape (guarde la tapa) e inserte una línea de nitrógeno en el espacio de cabeza del vial. Ajuste el flujo de nitrógeno para causar una ligera perturbación visible en la superficie del líquido, pero sin canalizaciones ni salpicaduras.
- Agite el vial inmediatamente después de insertar la línea de nitrógeno. Comience a una velocidad baja suficiente para formar un embudo con disolvente que se eleve a no más de 1 cm del fondo del vial. Evite las salpicaduras de disolvente. A medida que el solvente se evapora, aumente la velocidad del vórtice lentamente y sin pausa, manteniendo la altura del solvente hasta que todo el líquido se evapore. El resultado será una película delgada recubierta a través del tercio inferior del vial.
- Coloque el vial en un desecador equipado con vacío y continúe secando la película al vacío durante 8-72 h. Cubra el vial (excepto la abertura) o el desecador con papel de aluminio.
NOTA: El protocolo se puede pausar aquí. Los siguientes pasos se pueden realizar después del secado de la película, o las películas se pueden almacenar bajo argón, selladas con Parafilm, en un congelador de -20 °C hasta por 1 mes, y más tiempo si se mantienen secas.
3. Hidratación de la película lipídica
NOTA: Si las microburbujas se utilizan in vitro o in vivo, utilice puntas de micropipeta, tubos, jeringas y agujas estériles para los pasos 3.3 a 5.4, a menos que se especifique lo contrario.
- Retire la película de la aspiradora o, si está almacenada en el congelador, deje que se caliente hasta RT.
- Llene un vaso de precipitados de 250 ml con agua y caliente el agua a 70-80 °C.
- Calentar un sonicador en baño de agua a 69 °C.
- Micropipeta 1 mL de AA-PGG (paso 1.3) por los bordes del vial de película lipídica para evitar la formación de burbujas.
NOTA: Cuando fabrique microburbujas de control no queladas o solo fluorescentes, use PGG (paso 1.2) en lugar de AA-PGG. - Cubra parcialmente la abertura del vial con una tapa, dejando suficiente espacio para insertar una línea de perfluoropropano (PFP). Fluya PFP en el espacio de cabeza del vial durante 20 s por encima del líquido, de modo que el líquido se altere visiblemente pero no salpique. No fluya PFP directamente en la suspensión. Tape el vial.
NOTA: Si el flujo es adecuado en fuerza y tiempo, el vial comenzará a enfriarse al tacto. - Sumerja la mitad inferior del vial en el baño de agua a 70-80 °C durante 1 min. A continuación, sonicar durante al menos 30 s en el sonicador de baño a 69 °C o hasta que la película lipídica se disperse homogéneamente en el AA-PGG. Evite crear burbujas o activar prematuramente la formación de microburbujas (la activación prematura aparecerá como áreas lechosas/turbias en la suspensión lipídica). Limpie la superficie del vial cuando sea necesario para discernir mejor si quedan lípidos no suspendidos.
NOTA: Si la película lipídica no se hidrata en 1 minuto tras la sonicación, vuelva a calentar en el baño a 70-80 °C y vuelva a sonicate. - Una vez que la película lipídica esté homogéneamente suspendida, calentar por última vez durante 1 minuto y sonicar durante 30 segundos más.
- Limpie el vial y deje que se enfríe pasivamente a RT (~5-10 min).
- Vuelva a llenar el espacio de cabeza del vial con PFP según el paso 3.5, tapón, y selle los bordes de la tapa con Parafilm.
NOTA: El protocolo se puede pausar aquí y reanudar después de no más de 8 h.
4. Radiomarcaje
NOTA: Para el control no quelado o las microburbujas fluorescentes solamente, pase a la Sección 5 del protocolo.
PRECAUCIÓN: Realice los pasos 4.4-4.6 de este protocolo en un laboratorio radiactivo, a menos que se especifique lo contrario. 64El CuCl2 es un peligro radiológico con riesgo de toxicidad multisistémica a través de la exposición, inhalación o ingestión de la piel. Siempre que sea posible, manéjelo en una campana extractora indirectamente con pinzas con punta de goma. Use una bata protectora de laboratorio, un anillo personal y un dosímetro de insignia, y doble guante cuando manipule. Asegúrese de que 64CuCl2 se maneje a través de un blindaje de plomo de 2 pulgadas. Cuando sea necesario, transpórtelo en un contenedor con funda de plomo. Proteja los contenedores de residuos y realice un estudio operativo para detectar la contaminación después de su uso.
- Prepare un baño de agua a 60 °C en un vaso de precipitados de vidrio o en un plato de cristalización grande que contenga una barra de agitación magnética. Utilice una placa caliente/agitadora con temperatura controlada equipada con una sonda térmica insertada en el agua, configurada para agitar a una velocidad que produzca un embudo débil pero visible.
- Transfiera un vial sellado que contenga 64CuCl2 en HCl de 0,1 N a un calibrador de dosis mediante pinzas con punta de goma.
NOTA: Al pedir 64CuCl2, solicite que se disuelva en 5-20 μL de 0,1 N HCl. Un volumen más bajo es fundamental para preservar el rendimiento de las microburbujas. - Observe la actividad de cobre-64 medida en el calibrador de dosis y el tiempo. Retire el vial con pinzas y colóquelo en un recipiente con plomo.
- Divida la actividad observada por el volumen reportado para el 64CuCl2 para obtener un valor de MBq·mL-1 .
- Destape la suspensión lipídica del paso 3.9 y asegúrela en un soporte para viales.
- Destape el vial de 64CuCl2 y asegúrelo con pinzas.
- Micropipeta: un volumen de la solución de 64CuCl2 correspondiente a 40-250 MBq de actividad y transferencia a la suspensión lipídica. Asegúrese de que la punta de la pipeta esté sumergida en la suspensión. Sumerja y luego pipetee hacia arriba y hacia abajo para transferir completamente el 64CuCl2.
NOTA: La cantidad de 64CuCl2 añadida dependerá de la aplicación prevista para las microburbujas radiomarcadas y de la sensibilidad del calibrador de dosis. Para la PET longitudinal (hasta 48 h después de la inyección) y la toma de muestras de sangre in vivo en ratones, se recomienda un mínimo de 220 MBq y 50 MBq, respectivamente. - Tapone tanto la suspensión lipídica como los viales de 64CuCl2 .
- Con pinzas planas con punta de goma, gire manualmente la suspensión de lípidos radiactivos hacia arriba y hacia abajo al menos 5 veces para mezclar suavemente el 64CuCl2 a través de la suspensión. Evite agitar o dejar caer el vial y evite la formación de burbujas.
- Cuando esté boca arriba, agite suavemente la tapa del vial mientras mantiene la suspensión estabilizada. Esto ayudará a que cualquier líquido atrapado en la tapa gravite hacia el fondo del vial. Destape parcialmente el vial con cuidado e inserte una línea PFP equipada con aguja de 18 G. Llene el espacio de cabeza del vial con PFP durante 20 s según el paso 3.5. Tape el vial y selle con Parafilm.
- Mida la actividad del vial en un calibrador de dosis y anote la hora.
NOTA: Si no se transfirió la actividad adecuada al vial, repita los pasos 4.5-4.11, agregando un volumen adicional apropiado de 64CuCl2. - Coloque el vial en un soporte de espuma y empuje para que la mitad inferior del vial quede expuesta al calor. Coloque el soporte en el baño de agua agitador a 60 °C y caliente durante 1 h.
- Mientras se produce la reacción de quelación, prepare las placas de iTLC. Mientras usa guantes nuevos, corte el papel de cromatografía de microfibra de vidrio en tiras de 1 cm x 8 cm. Calentar las tiras en un horno de secado de vidrio a 80 °C.
NOTA: Este paso se puede realizar en un laboratorio no radiactivo. - Después de 1 h, retire el vial en el paso 4.12 del fuego y limpie los bordes con un pañuelo de papel.
- Gire el vial hacia arriba y hacia abajo manualmente con pinzas con punta de goma para recondensar cualquier condensación en las paredes del vial en la suspensión lipídica.
- Con el vial en posición vertical, agite la tapa mientras estabiliza el tubo. Retire el Parafilm y limpie alrededor de la tapa para eliminar el agua de baño atrapada.
- Destape con cuidado el vial y aspire 1-2 μL de la suspensión lipídica. Coloque la suspensión a 1 cm de la parte inferior central de una tira de iTLC y vuelva a tapar el vial. Deja que la mancha se seque.
NOTA: Idealmente, se debe detectar un mínimo de 2 iTLC por mezcla de reacción y desarrollar por suspensión lipídica radiomarcada para mayor certeza. - Micropipetea 200 μL del eluyente iTLC (preparado en el paso 1.4) en el fondo de un tubo de ensayo de 10 mL. Coloque el tubo de ensayo en un recipiente de plomo. Agregue el iTLC manchado al tubo y deje que la tira se desarrolle hasta que el eluyente esté aproximadamente a 1 cm del borde superior de la tira.
- Retire las tiras de iTLC desarrolladas con pinzas. Sostenga la tira verticalmente y córtela en tercios sobre tubos de plástico de 5 ml de base redonda compatibles con γ mostrador y tapa a presión, de modo que cada tercio de la tira caiga directamente en un tercio individual. Inserte las tapas de empuje en los tres tubos.
- Mida los tubos que contienen tiras y un tubo de control vacío/tapado en un contador de γ para la actividad de cobre-64 y registre los conteos por minuto (cpm) asociados. Reste la actividad del tubo de control de las otras lecturas para corregir la actividad de fondo.
NOTA: Las lecturas corregidas para el tercio inferior de la tira (pieza 1) están asociadas con partículas de suspensión de cobre-64 quelatadas a lípidos. La sección media (pieza 2) contiene una veta de quelatos libres de cobre-64 y 64Cu-piro-lípidos en forma no supramolecular. La sección superior (pieza 3) contiene predominantemente cobre-64 libre. - Calcule la pureza radioquímica a través de la ecuación 1.
 (Ecuación 1)
(Ecuación 1)
NOTA: si el cpm para la pieza 1 parece excesivamente bajo (por ejemplo, más bajo o equivalente a las piezas 2 o 3) o si alguna lectura está por encima del umbral no lineal/de saturación del contador de γ, detecte un volumen más bajo o una alícuota diluida (1-2 μL) de la suspensión radiomarcada para iTLC. - Asegúrese de que la pureza radioquímica obtenida de ambas tiras de iTLC por suspensión lipídica esté ≥ del 94% para continuar. De lo contrario, continúe calentando la suspensión lipídica a 60 °C y controle la quelación a intervalos de 30 minutos a través de iTLC.
- Destape el vial de suspensión de lípidos radiomarcados y la micropipeta de 8,89 μL de NaOH 1 N en la suspensión, pipeteando hacia arriba y hacia abajo para transferir completamente la base y neutralizar la suspensión. Tape el vial, gírelo manualmente con pinzas para invertir/revertir y, a continuación, golpee suavemente la tapa del vial.
- Llene el espacio de cabeza con PFP según el paso 4.10, tape y selle con Parafilm.
5. Activación y aislamiento de microburbujas
- Active la suspensión lipídica a través de un agitador mecánico de viales durante 45 s a 4530 rpm para generar una suspensión de microburbujas lechosas. Deje que el vial se enfríe pasivamente a RT durante aproximadamente 10 minutos. La suspensión lechosa resultante se separará en dos capas con el tiempo.
NOTA: El contenido del vial debe verse lechoso después de la activación. Una suspensión más clara después de la activación es indicativa de una activación fallida, cuyos factores contribuyentes se discutirán en secciones posteriores. - Una vez en RT, invierta/revierta suavemente el vial para volver a suspender la suspensión de microburbujas. Coloque el vial sobre una superficie plana y espere 2 minutos antes de la decantación para obtener la población de microburbujas deseada de la siguiente manera:
- Equipe una jeringa de plástico de 1 ml con una aguja de 18 g y ventile la jeringa/aguja aspirando y sumergiendo y exhalando aire. A los 2 minutos, destape rápidamente el vial, rompiendo el sello de Parafilm con un solo movimiento.
- Extraiga 400-550 μL del fondo del vial (población de microburbujas objetivo), evitando la aspiración de la capa superior espumosa de poblaciones de microburbujas no deseadas más grandes.
NOTA: Si es necesario, incline el vial hacia un lado para recoger los volúmenes finales en la jeringa y evitar aspirar la capa espumosa/más ligera.
- Limpie los bordes de la aguja con cuidado para eliminar cualquier contaminante espumoso y transfiera la suspensión de microburbujas aislada a un tubo de microcentrífuga. Tape suavemente (no abra ni cierre bruscamente la tapa). Esta es la suspensión de trabajo final de las microburbujas radiomarcadas.
- Mida la actividad del producto final de microburbujas en el calibrador de dosis y anote la hora. Divida este valor por el volumen de suspensión decantado en el paso 5.2 para obtener un valor de MBq·mL-1 para calcular los volúmenes de inyección en función de la aplicación de interés.
NOTA: Las microburbujas radiomarcadas ya están listas para usar. La sección 6 se puede ejecutar hasta 24 horas después. Para obtener información sobre cómo estas microburbujas radiomarcadas pueden inyectarse y rastrearse in vivo a través de imágenes multimodales (ultrasonido, PET, fluorescencia), consulte Rajora et al.15.
6. Validación de la eficacia del radiomarcaje
- Vuelva a suspender la suspensión de microburbujas mediante un pipeteo suave o una inversión del vial.
NOTA: Nunca haga vórtice a un producto que funcione con microburbujas. El vórtice desestabiliza las suspensiones de microburbujas. - Añada 10-200 μL de la suspensión radiomarcada a una unidad de filtro centrífugo de corte de 30.000 mL de peso molecular (MWCO) de 0.5 mL. Si utiliza volúmenes <200 μL, añada ddH2O a la unidad de filtro para constituir un volumen total de 200 μL. Aloje la unidad de filtro en un tubo y tapa de microcentrífuga compatibles.
NOTA: Se recomienda realizar una prueba de radiomarcaje antes y por separado de cualquier uso aplicado in vitro o in vivo de microburbujas radiomarcadas para garantizar la finalización exitosa del protocolo. En este caso, se podría utilizar un volumen mayor (por ejemplo, 200 μL) en este paso. Cuando el protocolo se utilice posteriormente para una sesión de tratamiento, prepare primero los volúmenes de tratamiento/inyecciones y, a continuación, realice la sección 6 con la suspensión de microburbujas radiomarcadas restante lo antes posible. - Centrífuga durante 10 min a 12.000 x g a RT.
NOTA: la microcentrífuga debe estar rodeada por un blindaje de plomo. - Corta la conexión entre el tubo de la microcentrífuga y su tapa con unas tijeras.
- Coloque la tapa en un vial de centelleo de 20 ml etiquetado como "tapas". Transfiera la unidad de filtro a un nuevo tubo de microcentrífuga (tubo 2).
- Coloque el primer tubo de microcentrífuga con infranadante en un vial de centelleo de 20 ml etiquetado como "tubo 1". Añada 200 μL ddH2O a la unidad de filtro en el tubo 2.
- Centrifugar la unidad de filtro en el tubo 2 a 12.000 x g a RT.
- Repita los pasos 6.4 y 6.5. Agregue el tapón del tubo 2 al vial de centelleo "tapones" que alberga el tapón del tubo 1. Coloque el tubo 2 en un nuevo vial de centelleo de 20 ml.
- Corte la tapa del tercer tubo de microcentrífuga y colóquela en el vial de "tapas" según el paso 6.4. Transfiera la unidad de filtro a un nuevo vial de centelleo de 20 mL etiquetado como "unidad", asegurándose de que el infranadante permanezca en el tubo 3 y no se transfiera al vial "unitario". Si se ven gotas en los bordes de la unidad de filtro, devuélvala al tubo 3, cúbrala y gire hacia abajo durante 10 s. Coloque el tubo 3 en un nuevo vial de centelleo de vidrio de 20 mL.
- Tapar los 5 viales de centelleo (tubo 1, tubo 2, tubo 3, tapones y unidad). Prepare un vial de centelleo de 20 mL vacío y tapado como control en blanco.
- Mida los seis viales de centelleo en un contador de γ para detectar la actividad del cobre-64. Reste la actividad del vial en blanco de la de otros viales. Calcule la eficiencia de radiomarcaje/quelación utilizando la Ecuación 2.
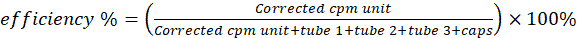 (Ecuación 2)
(Ecuación 2)
NOTA: Si la unidad cpm es irrazonablemente baja (por ejemplo, más baja o equivalente a los tubos) o si alguna lectura está por encima del umbral no lineal/de saturación del γ, almacene los viales de centelleo en recipientes de plomo hasta por 4 días para permitir que la actividad decaiga hasta que los valores estén por debajo del umbral y vuelva a medir.
7. Caracterización fisicoquímica de microburbujas
NOTA: A menos que un laboratorio tenga equipo designado para el procesamiento de muestras radiactivas, la caracterización fisicoquímica de microburbujas debe realizarse utilizando muestras no radiactivas, "frías" queladas con cobre. Este etiquetado "en frío" facilita la evaluación del rendimiento de microburbujas, que es vital para evaluar la dosis de microburbujas utilizada para la aplicación prevista. Además, permite la comparación con microburbujas no queladas de control para garantizar que el proceso de radiomarcaje no perturbe las propiedades de las microburbujas. Este marcaje "frío" y la caracterización fisicoquímica asociada deben realizarse antes de la aplicación de microburbujas radiomarcadas y pueden utilizarse como retroalimentación si se requieren modificaciones en el radiomarcaje (véase la Discusión).
- Etiquetado de microburbujas de cobre "frío"
- Utilizando el volumen de la solución de 64CuCl2 añadido a la suspensión lipídica en el paso 4.7, la composición del porcentaje molar de porfirina dentro de las películas lipídicas y la actividad específica encontrada en la hoja del producto 64CuCl2 , calcule la relación molar aproximada metal:porfirina lograda durante el radiomarcaje. Ejemplos de cálculos se pueden encontrar en el Archivo Complementario 1.
- Siga las secciones 1-3 del protocolo actual.
- Prepare una solución de 0,1 mg·mL-1 de CuCl2 en HCl 0,1 N.
- Micropipetear el volumen adecuado de esta solución de CuCl2 en la suspensión lipídica calculado a partir del paso 7.1.1 y tapar el vial.
- Gire el vial para mezclar el CuCl2 en la suspensión lipídica, llene el espacio de cabeza con PFP, selle y caliente según los pasos 4.9, 4.10 y 4.12. No se necesitan pinzas de goma para la manipulación de viales.
- Después de 1 h, retire el vial del fuego y limpie el exterior para que se seque. Deje que el vial se enfríe a RT.
- Neutralice la suspensión de lípidos, mezcle, llene el espacio de cabeza con PFP y selle según los pasos 4.23 y 4.24.
- Active la suspensión de microburbujas y decante para obtener un producto funcional según los pasos 5.1-5.3.
- Tamaño de microburbujas
NOTA: El dimensionamiento de las microburbujas debe realizarse inmediatamente después de la activación. Si evalúa la estabilidad de la suspensión de trabajo, repita la preparación de la muestra y las mediciones a intervalos de 30 minutos. Por lo general, una ventana de 1-2 h es representativa del período de tiempo durante el cual se usaría/administraría la suspensión de trabajo de microburbujas después de la activación. El objetivo de las mediciones de estabilidad es garantizar que el tamaño y el rendimiento de las microburbujas se mantengan durante este período de tiempo, de modo que todos los tratamientos administrados desde la solución de trabajo contengan poblaciones de microburbujas similares.- Encienda el contador de Coulter (CC) y establezca los siguientes parámetros con la herramienta Editar SOP : apertura de 30 μm, rango de tamaño de 0,6-18 μm, corriente de apertura de 400-600 μA, ganancia de preamplificador de 4-8, 400 bins, enrasado antes y después de cada ejecución, análisis volumétrico, volumen de muestra de 5 μL.
- Filtre el electrolito CC a través de una unidad de filtración al vacío de medios de 0,2 μm. Llene el recipiente de electrolito y un recipiente separado para la preparación de la muestra.
- Medición de fondo: Llene una cubeta desechable de 10 ml con electrolito filtrado de 10 ml y realice una medición de referencia. Asegúrese de que los recuentos estén por debajo de 400. De lo contrario, enjuague el instrumento.
- Medición de muestras
- Agregue 10 ml de electrolito filtrado a una cubeta nueva. Vuelva a suspender la suspensión de microburbujas invirtiendo/revirtiendo manualmente. Micropipeta a 5 μL de la parte inferior central del vial. Limpie los bordes de la punta de la pipeta (excepto la abertura) y sumerja la muestra directamente en el electrolito preparado.
- Pipetea hacia arriba y hacia abajo para transferir completamente la suspensión. Utilice la punta de la pipeta para agitar suavemente el electrolito hasta que se dispersen las "volutas" de la suspensión de microburbujas.
- Mida la muestra en el CC (dos pasadas por analito).
NOTA: Un volumen de muestra de microburbujas de 5 μL suele ser apropiado para muestras que contienen concentraciones de 1-5 x 109 microburbujas·mL-1 . Es posible que sea necesario ajustar este volumen de muestra en función de la configuración específica del instrumento CC y si los rendimientos de microburbujas de la muestra se encuentran fuera del rango anterior.
- Imágenes confocales
NOTA: Realice la obtención de imágenes confocales inmediatamente después del dimensionamiento de las microburbujas y dentro del período de tiempo de la estabilidad de las microburbujas retenida según la nota del paso 7.2.- Vuelva a suspender la suspensión de microburbujas y transfiera 1-5 μL al centro de un portaobjetos de microscopio de vidrio. Coloque un cubreobjetos con cuidado sobre la gota de suspensión de microburbujas, evitando que las burbujas de aire queden atrapadas. La suspensión se extenderá por debajo de la funda.
- Visualice las microburbujas con un aumento de 60x con un objetivo de inmersión en aceite. Obtenga imágenes en campo claro y con una excitación de 633 nm/emisión de 640-765 nm. Superponga las imágenes de campo claro y fluorescencia.
NOTA: La señal de fluorescencia debe superponerse a través de la capa de todas las partículas visibles cuando la sonda se incorpora homogéneamente dentro de la carcasa de microburbujas.
- Espectrofluorometría
NOTA: Las mediciones de espectrofluorometría se pueden realizar dentro de las 24 horas posteriores a la activación de las microburbujas.- Prepare Triton X-100 al 1% como se describió anteriormente35.
- Encienda el espectrofluorómetro 15-30 minutos antes de la primera medición.
- Mida los espectros de fluorescencia de Triton X-100 al 1% utilizando una excitación de 410 nm y un rango de emisión de 600-800 nm en una cubeta de cuarzo. Seleccione la opción para normalizar la señal mediante la señal del detector de referencia (a menudo denominada S1/R1).
NOTA: Triton X-100 burbujea fácilmente cuando se pipetea. Por lo tanto, cuando se transfiera a una cubeta, sumérjalo únicamente en la primera parada de la micropipeta. - Enjuague la cubeta con metanol y séquela con aire presurizado entre muestras.
- Transfiera 6 mL de Triton X-100 al 1% a un tubo de centrífuga de 15 mL. Vuelva a suspender la suspensión de microburbujas y aspire 1 μL mediante una micropipeta. Limpie los bordes de la punta de la pipeta, excepto la abertura, y transfiera la muestra al Triton X-100 al 1% preparado, pipeteando hacia arriba y hacia abajo para completar la transferencia. Agita la solución y transfiérela a una cubeta de cuarzo.
NOTA: Ajuste la proporción de muestra: 1% Triton X-100 de acuerdo con la sensibilidad del instrumento y el umbral de saturación no lineal. - Mida esta muestra utilizando los parámetros del paso 7.4.3. Esta medida corresponde a las partículas "alteradas".
- Repita los pasos 7.4.3-7.4.6 utilizando PBS. Esta medida corresponde a partículas "intactas".
- Corrija la línea de base de los espectros de muestras interrumpidos e intactos utilizando mediciones de Triton X-100 y PBS al 1%, respectivamente.
- Calcule la eficiencia de enfriamiento (QE) a través de la Ecuación 3 utilizando la señal de fluorescencia corregida de línea de base integrada de la muestra intacta en PBS (FPBS) y en Triton X-100 (FTx) al 1%:
 (Ecuación 3)
(Ecuación 3)
- Espectroscopía UV-Vis
NOTA: Las mediciones espectroscópicas se pueden realizar hasta 72 horas después de la activación de las microburbujas.- Sonicar una alícuota de la suspensión de microburbujas en un tubo de microcentrífuga utilizando un sonicador de baño en RT hasta que la suspensión sea transparente. Esto reduce los efectos de dispersión durante la espectroscopia.
- Encienda el espectrofotómetro 10 minutos antes de la primera medición. Seleccione un intervalo de escaneo de 0,25 nm y un rango de adquisición de 200-800 nm. Habilite la sustracción de línea base.
- Utilice una cubeta de cuarzo de 1 cm de longitud para las mediciones. Enjuague la cubeta con metanol entre mediciones y seque con aire a presión.
- Obtener una medición de referencia del metanol.
- Agite la suspensión de microburbujas transparentes sonicadas y transfiera 10-50 μL a un tubo de microcentrífuga que contenga 200-1000 μL de metanol. Asegúrese de medir el volumen de metanol y agregarlo al tubo a través de una jeringa de microlitros de vidrio limpio. Vortex la solución para obtener una muestra "interrumpida".
NOTA: La dilución de la muestra dependerá de la eficiencia de carga de porfirina y de la composición del % molar. Una dilución de 20x es apropiada para una composición de microburbujas pirolipídicas al 30% mol. - Recoge el espectro UV-Vis.
- Repita los pasos 7.5.4 a 7.5.6 utilizando PBS en lugar de metanol.
NOTA: Se puede utilizar una micropipeta para medir los volúmenes de PBS en lugar de una jeringa de microlitros de vidrio.
8. Modificaciones al protocolo
- Quelante alternativo
- Prepare películas lipídicas según la sección 2, sustituyendo el pirolípido por un quelante alternativo de cobre conjugado con lípidos (por ejemplo, ácido 1,2-dipalmitoil-sn-glicero-3-fosfoetanolamina-N-dietilentriaminapentaacético (sal de amonio), denominado en adelante DTPA-lípido). Utilice el Archivo Suplementario 1 para calcular la masa y los volúmenes de stock necesarios.
NOTA: Es probable que sea necesario probar varias composiciones molares de un quelante alternativo para determinar el límite superior más allá del cual no se pueden generar microburbujas estables con altos rendimientos. - Siga las secciones 3 a 6 para generar y caracterizar microburbujas radiomarcadas.
- Siga los pasos 7.1 a 7.3 para caracterizar las microburbujas "frías" queladas con cobre. Solo se requiere la adquisición de imágenes de microscopía confocal de campo claro para evaluar la morfología de las partículas. Si el quelante alternativo es fluorescente, realice una microscopía confocal con longitudes de onda de excitación y emisión asociadas, además de los pasos 7.4 y 7.5.
- Prepare películas lipídicas según la sección 2, sustituyendo el pirolípido por un quelante alternativo de cobre conjugado con lípidos (por ejemplo, ácido 1,2-dipalmitoil-sn-glicero-3-fosfoetanolamina-N-dietilentriaminapentaacético (sal de amonio), denominado en adelante DTPA-lípido). Utilice el Archivo Suplementario 1 para calcular la masa y los volúmenes de stock necesarios.
- Fluoróforo alternativo
- Prepare las películas lipídicas según la sección 2, sustituyendo el pirolípido por un fluoróforo alternativo conjugado con lípidos o intercalado (por ejemplo, DiI). Utilice el Archivo Suplementario 1 para calcular la masa y los volúmenes de existencias necesarios.
NOTA: Es probable que sea necesario probar varias composiciones molares de un fluoróforo alternativo para determinar el límite superior más allá del cual no se pueden generar microburbujas estables con altos rendimientos. - Siga la sección 3 usando PGG en lugar de AA-PGG.
- Complete los pasos 5.1 a 5.3 y los pasos 7.2 a 7.5.
- Prepare las películas lipídicas según la sección 2, sustituyendo el pirolípido por un fluoróforo alternativo conjugado con lípidos o intercalado (por ejemplo, DiI). Utilice el Archivo Suplementario 1 para calcular la masa y los volúmenes de existencias necesarios.
- Enfoque "Spiking": Etiquetado de suspensiones lipídicas de microburbujas preformadas
- Genere una película de porfirina-lípidos según la sección 2, utilizando solo pirolípidos sin otros constituyentes lipídicos. Consulte el Archivo Suplementario 1 para conocer las cantidades de pirolípidos.
- Hidratar la película pirolipídica según la sección 3 utilizando 100-200 μL de AA-PGG (o PGG si no se requiere radiomarcaje) en lugar de 1 mL de tampón de hidratación.
- Transfiera toda la suspensión pirolipídica a una suspensión de microburbujas lipídicas prefabricada.
- Llene el espacio de cabeza con PFP, caliente y sonique la suspensión y el sello debajo de PFP según los pasos 3.4 a 3.9. Controle la dispersión de la suspensión pirolipídica en la suspensión de microburbujas lipídicas prefabricada y realice ciclos de calor/sonicación hasta que se disperse por completo.
NOTA: Si se utiliza un vial comercial de microburbujas sellado con tabique, la suspensión pirolipídica puede introducirse en el vial a través de una jeringa/aguja sin volver a llenar el espacio de cabeza del vial con PFP. - Lleve a cabo el radiomarcaje (consulte el paso 8.3.5.1 a continuación), la activación, el aislamiento (consulte la NOTA a continuación) y la caracterización asociada según las secciones 4 a 7.
- Un enfoque alternativo es primero radiomarcar la suspensión pirolipídica hidratada, controlar el >94% de pureza radioquímica, neutralizar con 1 N NaOH (modificar el volumen de acuerdo con el volumen AA-PGG utilizado para hidratar la película pirolipídica) y luego introducir la suspensión pirolipídica radiomarcada en la suspensión lipídica de microburbujas prefabricada según el paso 8.3.3.
NOTA: Este enfoque modificado solo debe usarse para generar microburbujas fluorescentes o multimodales radiomarcadas si se sigue de un proceso de aislamiento que elimine las vesículas multilaminares submicrónicas creadas durante la hidratación de lípidos pero no incorporadas a las microburbujas. Consulte Discusión para obtener más detalles.
- Un enfoque alternativo es primero radiomarcar la suspensión pirolipídica hidratada, controlar el >94% de pureza radioquímica, neutralizar con 1 N NaOH (modificar el volumen de acuerdo con el volumen AA-PGG utilizado para hidratar la película pirolipídica) y luego introducir la suspensión pirolipídica radiomarcada en la suspensión lipídica de microburbujas prefabricada según el paso 8.3.3.
Resultados
Los principales resultados cuantificables en la fabricación de microburbujas radiomarcadas son la pureza radioquímica y la eficiencia del radiomarcaje. Este protocolo utiliza iTLC y un procedimiento centrífugo validado, respectivamente, para caracterizar cada uno de ellos. La Figura 2A muestra que se lograron purezas radioquímicas promedio y eficiencias de ≥95% en formulaciones comerciales que imitan microburbujas en las que el lípido huésped se sust...
Discusión
El protocolo actual de radiomarcaje de microburbujas lipídicas logra una pureza radioquímica del >95%, una eficiencia de quelación del >95% y la retención de las propiedades fisicoquímicas de las microburbujas sin necesidad de ninguna purificación posterior al etiquetado. Estos logros representan avances nunca antes alcanzados para los protocolos de etiquetado existentes. La falta de pasos de purificación permite un uso más rápido de los radioisótopos (en este caso, el cobre-64...
Divulgaciones
Los autores no reportan conflictos de interés.
Agradecimientos
Agradecemos a Deborah Scollard y Teesha Komal (programa de Focalización Espacio-Temporal y Amplificación de la Respuesta a la Radiación (STTARR) de la Red Universitaria de Salud, Toronto, Ontario) por sus servicios técnicos y orientación. También agradecemos a Mark Zheng y al Dr. Alex Dhaliwal por su asistencia técnica durante la microscopía confocal y a la Instalación de Microscopía Óptica Avanzada (Toronto, Ontario) por proporcionar el equipo asociado. Agradecemos nuestras fuentes de financiamiento: los Institutos Canadienses de Investigación en Salud, el Instituto de Investigación Terry Fox, el Consejo de Investigación de Ciencias Naturales e Ingeniería de Canadá, la Fundación Canadiense para la Innovación, la Fundación Princesa Margarita contra el Cáncer, el Programa de Cátedras de Investigación de Canadá, el Centro McLaughlin, el Programa de Becas Vanier, el Programa de Becas para Estudiantes Graduados de Ontario, Prostate Cancer Canada y la Fundación Benéfica Peterborough K. M. Hunter.
Materiales
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Referencias
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados