Method Article
Dekontamine Balgam Örneklerinde Hedeflenen Yeni Nesil Dizileme için Matris Tabanlı DNA Ekstraksiyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mycobacterium tuberculosis'in aşağı akış hedefli yeni nesil dizilemesi için manyetik boncuk saflaştırması ile birleştirilmiş matris tabanlı bir ekstraksiyon yöntemi kullanarak dekontamine balgamdan DNA ekstraksiyonu için optimize edilmiş bir yöntem sunuyoruz.
Özet
Yeni nesil dizileme (NGS) artık zamanında ve doğru ilaca dirençli tüberküloz (DR-TB) teşhisi için güçlü bir araç olarak kabul edilmektedir. Hedefli NGS (tNGS), ilaç direnci ile ilişkili belirli genlere odaklanarak, haftalar arasında değişen geri dönüş süreleri ile geleneksel kültür tabanlı yöntemlere olan ihtiyacı atlayarak kolaylaştırılmış bir yaklaşım sunar. Dünya Sağlık Örgütü (WHO), özellikle kaynakların sınırlı olduğu ortamlarda tedaviyi yönlendirmek ve tedavi sonuçlarını iyileştirmek için tüberküloz (TB) teşhisini iyileştirmek için değerli bir strateji olarak tNGS'yi önermiştir. DSÖ tarafından önerilen tNGS testleri arasında, hızlı ve kapsamlı ilaç duyarlılık testi, soy belirleme ve suş tiplemesi sağlayan bir yöntem seçtik. Standartlaştırılmış DNA ekstraksiyon yöntemleri mevcut olsa da, bunlar zaman alıcı ve emek yoğun olabilir. Bu zorluğun üstesinden gelmek için, manyetik boncuk saflaştırma ile birlikte basitleştirilmiş, matris tabanlı bir DNA ekstraksiyon protokolünü optimize ettik. Bu yöntem, DNA'nın doğrudan dekontamine edilmiş balgam çökeltilerinden çıkarılması için hızlı ve verimli bir yaklaşım sunar ve hızlı aşağı akış tNGS analizine olanak tanır. Balgam tortusundan DNA ekstraksiyon sürecini düzene sokarak, bu protokol rutin klinik ortamlarda tNGS'nin daha geniş çapta benimsenmesini kolaylaştırabilir, sonuçta hasta sonuçlarının iyileştirilmesine katkıda bulunabilir ve küresel TB kontrol çabalarına katkıda bulunabilir.
Giriş
2023 yılında dünya çapında tahmini 3,7 milyon tüberküloz hastası teşhis edilmedi ve tedavi edilmedi ve bu da tüberkülozun küresel sağlık için oluşturduğu önemli tehdidi vurguladı1. DSÖ, 2023 yılında yaklaşık 400.000 kişinin rifampisine dirençli (RR-TB) veya çoklu ilaca dirençli TB (MDR-TB) geliştirdiğini tahmin etmektedir1. TB ve DR-TB'nin hızlı bir şekilde teşhis edilmesi ve tedavi edilmesi, TB insidansını ve mortalitesini azaltmaya yönelik kilometre taşlarına ve hedeflere ulaşmak için çok önemlidir1.
Konvansiyonel kültür yöntemlerine ve fenotipik ilaç duyarlılık testine (pDST) güvenmek, klinik izolatların ve tedavinin direnç profilinin belirlenmesini geciktirir, geri dönüş süreleri 6-8 haftadır ve karmaşık biyo-muhafaza altyapısı gerektirir. Rutin tanı testleri, DR-TB'nin NGS'si ile kombinasyon halinde, kapsamlı bir ilaç direnç profili sağlayabilir ve ÇİD-TB rejimlerinin kişiselleştirilmesini iyileştirebilirken, aynı zamanda etkili tedavi süresini haftalar veya aylardan günlere indirebilir 2,3,4.
2023 ve 2024'te DSÖ, birinci ve ikinci basamak anti-TB ilaçlarına duyarlılığı hızlı bir şekilde belirlemek için tNGS'nin yeni bir tanı sınıfı olarak kullanılmasını önerdi5. Bu, onu biyogüvenlik seviye 3 (BSL-3) laboratuvarlarında Mycobacterium tuberculosis (MTB) kültürüne ihtiyaç duymadan tedavi kararlarına rehberlik etmek için değerli bir araç haline getirir. Bir tNGS yaklaşımı, dizilemeden önce ilaca direnç kazandıran gen hedeflerini amplifiye etmek için polimeraz zincir reaksiyonu (PCR) kullanan yoğunlaştırılmış bir dizileme şeklidir. Dünya Sağlık Örgütü (WHO) tarafından önerilen tNGS testleri arasında, rifampisin, izoniazid, etambutol, pirazinamid, florokinolonlar, amikasin, streptomisin, linezolid, bedaquilin ve klofazimine direnç tespiti için sınıf bazlı kriterleri karşıladığı bildirilen Deeplex Myc-TB testini seçtik. Bu testi, bu protokol kullanılarak ekstrakte edilen DNA'nın aşağı akış tNGS'si için uygunluğunu değerlendirmek için kullanıyoruz.
Ek olarak, DSÖ, MTB'de ilaç direnci ile ilişkili mutasyonlar kataloğunun 2. baskısını yayınlayarak, ilaç duyarlılığını tahmin etmek ve tedaviye rehberlik etmek için tüm genom dizileme (WGS) ve tNGS'nin kullanımı için bir yol haritası sağlamıştır6. Yakın zamanda yapılan bir sistematik inceleme ve meta-analiz, tNGS'nin, pDST7'ye kıyasla, MTB genomundaki çeşitli direnç veren bölgelerdeki 23 hedefe dayalı olarak, ilaç direncinin tespiti için sırasıyla %94.1 ve %98.1'lik bir duyarlılık ve özgüllüğe sahip olduğunu göstermiştir.
Bununla birlikte, özellikle gerekli iş akışları, altyapı ve ekipmanla ilişkili karmaşıklık ve maliyetler nedeniyle bu yöntemlerin uygulanması zor olmaya devam etmektedir. Kritik bir zorluk, yeterli yüksek kaliteli mikobakteriyel DNA'yı doğrudan dekontamine balgam tortusundan izole etmektir, bu da aşağı akış tNGS uygulamaları için çok önemli bir adımdır. Bunu ele almak için, tNGS için özel olarak tasarlanmış hızlı ve basit bir DNA ekstraksiyon yöntemi sunuyoruz.
Seçilen MTB tNGS testi için standartlaştırılmış DNA ekstraksiyon yöntemi, kurum içi bir manuel ve otomatik protokol8 içerir. Burada basitleştirilmiş, matris tabanlı bir DNA ekstraksiyon protokolünü açıklıyoruz (Şekil 1). Yöntem, metalleri ve proteinleri bağlayarak doğrudan dekontamine balgam çökeltilerinden kaliteli nükleik asit ekstraksiyonuna izin veren InstaGene Matrisini (IGM) kullanır. Bu alternatif, aşağı akış tNGS için daha hızlı bir geri dönüş süresi ve yeterli DNA verimi sağlar. Bu protokol, MTB'de direnç sağlayan varyantların hızlı teşhisi için kaliteli tNGS sağlarken manuel ve otomatik yöntemlerin karmaşıklığının üstesinden gelir. Mikobakteriyoloji alanında tNGS kullanımına olan ilginin artmasıyla birlikte, bu protokol rutin tanı iş akışlarına benimsenmesini kolaylaştırabilir.
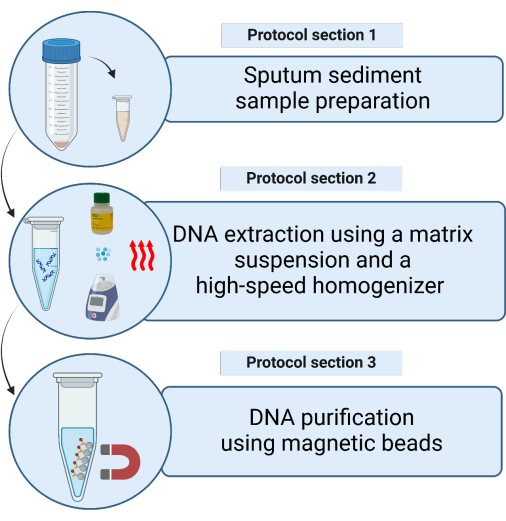
Şekil 1: Bir matris süspansiyonu kullanılarak dekontamine balgam tortusu örneklerinden mikobakteriyel DNA'nın ekstraksiyon yöntemlerinin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Bu araştırma, Stellenbosch Üniversitesi'nde Araştırma Etik Kurulu: Biyolojik ve Çevresel Güvenlik (REC: BES): BES-2024-25384 ve İnsan Araştırmaları Etik Kurulu: N21/09/093 ve N09/11/296 tarafından onaylanmıştır.
1. Balgam tortusu numunesi hazırlama
NOT: Aşağıdaki adımlar, DNA ekstraksiyonundan önce bir biyogüvenlik seviyesi üç (BSL3) laboratuvarında gerçekleştirilmelidir.
- 500 μL-2 mL'yi 1.5 mL veya 2 mL'lik düşük bağlı bir tüpe aktararak daha önce N-asetil-L-sistein (NALC) ve sodyum hidroksit (NaOH) (NALC/NaOH) kullanılarak dekontamine edilmiş balgam tortu örneğinin bir alikotunu hazırlayın.
- Balgam tortu örnekleri içeren tüpleri bir tüp rafına dik olarak yerleştirin ve örnekleri 80 °C'de bir fırına koyun ve mikobakterileri ısıl işlemle etkisiz hale getirmek için 1 saat inkübe edin.
- 1 saat sonra, numunelerin bulunduğu tüp rafını çıkarın, tüp yüzeylerini silin ve bunları biyogüvenlik seviyesi iki (BSL2) laboratuvarına taşınmak üzere uygun bir kaba koyun.
NOT: Daha fazla işlem veya saklamadan önce numunelerin oda sıcaklığına soğumasını bekleyin.
2. Matris süspansiyonu ve yüksek hızlı homojenizatör kullanılarak DNA ekstraksiyonu (Şekil 2)
- Başlamadan önce, 1,5 veya 2 mL vidalı kapaklı tüplere, gevşek kapaklı tüplere ve otoklava (ideal olarak DNA ekstraksiyonundan en az bir gün önce) 2 mm çapında üç cam boncuk ekleyin.
- Matris süspansiyonunu buzdolabından çıkarın ve reaktifi oda sıcaklığına getirmek ve reaktifi karıştırmaya başlamak için manyetik bir karıştırıcıya (reaktif şişesine bir mıknatıs dahildir) yerleştirin.
- Isıtma bloğunu açın ve 56 °C'ye ısıtın (iki ısıtma bloğu varsa, ikincisini 100 °C'ye ısıtın.
NOT: Aşağıdaki adımlar, bir BSL2 tesisindeki bir laboratuvar tezgahında gerçekleştirilebilir: - Isıyla etkisiz hale getirilmiş balgam tortusu örneğini 16.800 × g'da (veya tam hızda) 15 dakika santrifüjleyin. 20-200 μL'lik bir pipet ile süpernatanı nazikçe aspire edin ve atın, böylece peletin bozulmadan kalmasını sağlayın.
- Matris süspansiyonunu hafifçe sallayarak karıştırın (girdap yapmayın) ve peleti yeniden süspanse etmek için 200 μL iyi karıştırılmış matris ekleyin.
- Tam hacmi, 1.5 mm çapında önceden sterilize edilmiş üç cam boncuk içeren 2 mL'lik vidalı kapaklı bir tüpe pipetleyin.
- Numuneleri bir ısıtma bloğuna yerleştirin ve 56 °C'de 15 dakika inkübe edin.
NOT: Numuneyi ısıtma bloğundan çıkardıktan hemen sonra, yalnızca bir ısıtma bloğu mevcutsa, ısıtma bloğunu adım 100'den sonra 2.7 °C'ye ayarlayın. - Hücreleri dağıtmak için 10 saniye boyunca bir girdap kullanarak numuneleri homojenize edin.
- Numuneleri bir ısıtma bloğuna yerleştirin ve 100 °C'de 10 dakika inkübe edin.
- Numuneleri aşağıdaki parametrelere sahip yüksek hızlı bir homojenizatör kullanarak homojenize edin: 4,0 m/s'de 60 s'lik bir döngü.
- 12.000 × g'da 5 dakika santrifüjleyin. 130 μL DNA içeren süpernatanı, peleti bozmadan (hücre kalıntısı olan matris) 1.5 mL'lik düşük bağlayıcı yeni bir tüpe aktarın. Matrisi ve hücre kalıntılarını içeren ilk tüpü atın.
NOT: GÜVENLI DURMA NOKTASI. Duruyorsa, DNA saflaştırmasına devam etmeye hazır olana kadar numuneleri -20 °C'de dondurun. - Manyetik boncuklar kullanarak DNA saflaştırmasına devam edin.
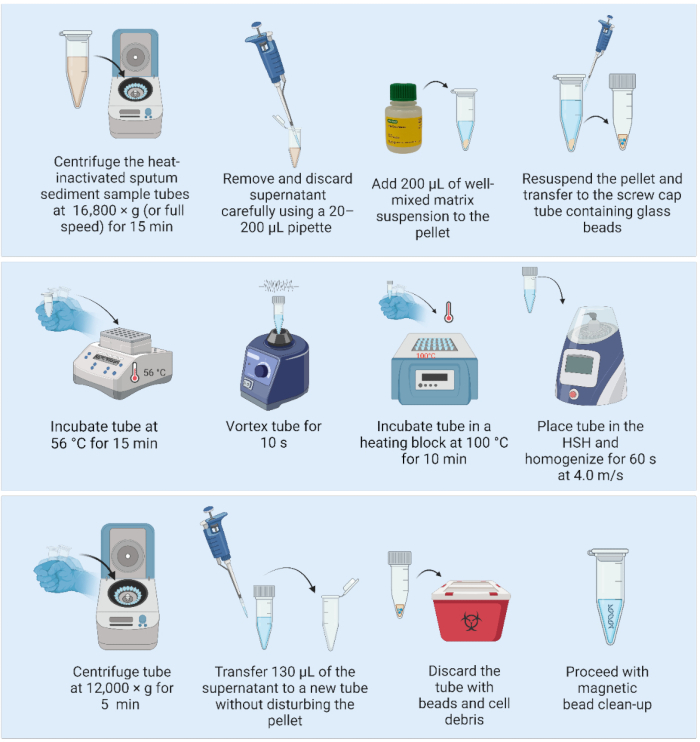
Şekil 2: Yüksek hızlı homojenizatör ile birleştirilmiş matris bazlı DNA ekstraksiyon yöntemi. Kısaltma: HSH = yüksek hızlı homojenizatör. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Manyetik boncuklar kullanarak DNA saflaştırması (Şekil 3)
NOT: DNA saflaştırmasına devam etmeden önce 3.1 ve 3.2 adımlarını uygulayın.
- Manyetik boncukları buzdolabından çıkarın ve dengelemek için kabı 30 dakika oda sıcaklığında bekletin. Alternatif olarak, tüm boncukları yeniden süspanse etmek için manyetik boncuk stok şişesini girdaplayın ve 1.280 μL'lik bir alikotu yeni bir tüpe (21 numunenin saflaştırılması için) aspire edin ve dengelemek için oda sıcaklığına yerleştirin.
- 1,8 mL filtrelenmiş ve sterilize edilmiş suya 7,2 mL saf etil alkol ekleyerek 9 mL'lik bir %80 etanol partisi hazırlayın.
NOT: Aşağıdaki adımlar, bir BSL2 tesisindeki bir laboratuvar tezgahında gerçekleştirilebilir. - Kullanmadan önce boncukların yeniden askıya alındığından emin olmak için manyetik boncuk stok şişesini veya hazırlanan alikotu iyice sarın. Homojen bir süspansiyon sağlamak için her 10 örnekten sonra girdaplamayı tekrarlayın.
- Ekstrakte edilen DNA'ya (130 μL) 1.2x hacim (156 μL) manyetik boncuk ekleyin.
NOT: Daha büyük miktarlarda DNA (kültür) içeren numuneler için, numunenin daha küçük bir alikotu işlenebilir (örn., 50 μL) ve 1.2x hacimde manyetik boncuk ile saflaştırılabilir. - Numuneleri 10 kez pipetleyerek karıştırın. Numuneleri oda sıcaklığında 5 dakika inkübe edin.
- Numuneleri 1.5 mL tüp manyetik rafına 3 dakika veya sıvı berraklaşana kadar yerleştirin. Boncukları rahatsız etmeden süpernatanı dikkatlice aspire edin ve atın.
- Mıknatısın üzerindeki tüplerle 200 μL %80 etanol ekleyin, boncukların bozulmamasını sağlayın ve 30 saniye inkübe edilmesine izin verin.
- Boncukları rahatsız etmeden etanolü dikkatlice aspire edin ve atın.
- Toplam iki yıkama için adım 3.7'yi tekrarlayın.
- İkinci yıkamadan sonra etanolü çıkarın ve atın. 1-10 μL'lik bir pipetle kalan etanolü çıkarın.
- Boncukları 10 dakika veya boncuklar mat bir görünüm elde edene kadar havada kurutmak için tüpleri açık bırakın.
NOT: Boncukların aşırı kurumasına ve çatlamasına izin vermeyin. - Boncuklar mat bir görünüme sahip olduğunda, tüpleri hemen mıknatıstan çıkarın ve her numunedeki boncukların üzerine doğrudan 50 μL nükleaz içermeyen su (NFW) ekleyin. Tüm tüplere NFW ekledikten sonra, her bir numuneyi 10 kez pipetleyerek karıştırın. Tüpün içine yapışmış herhangi bir boncuk olup olmadığını kontrol edin ve gerekirse karıştırma adımını tekrarlayın. Numuneleri oda sıcaklığında 5 dakika inkübe edin.
NOT: Kuluçka süresi 5 dakikadan 10 dakikaya çıkarılabilir, ancak kuluçka süresini 5 dakikanın altına düşürmeyin. - Tüpleri 3 dakika veya sıvı berraklaşana kadar manyetik rafa geri yerleştirin. Manyetik raftaki tüplerle, DNA içeren süpernatanı açıkça işaretlenmiş, steril, düşük bağlayıcı bir tüpe aktarın. Boncukların süpernatana aktarılmadığından emin olun.
NOT: Aktarım sırasında pipet ucunda boncuklar görünüyorsa, süpernatanı 3 dakika daha ayırmak için manyetik raftaki tüpe geri pipetleyin. Boncukları yeni tüpe aktarmayın.
GÜVENLI DURMA NOKTASI. Duruyorsa, NGS'ye uygun bir yöntem kullanarak miktar tayinine ve ardından bir MTB tNGS testi kullanılarak PCR amplifikasyonuna devam etmeye hazır olana kadar numuneleri -20 °C'de dondurun.
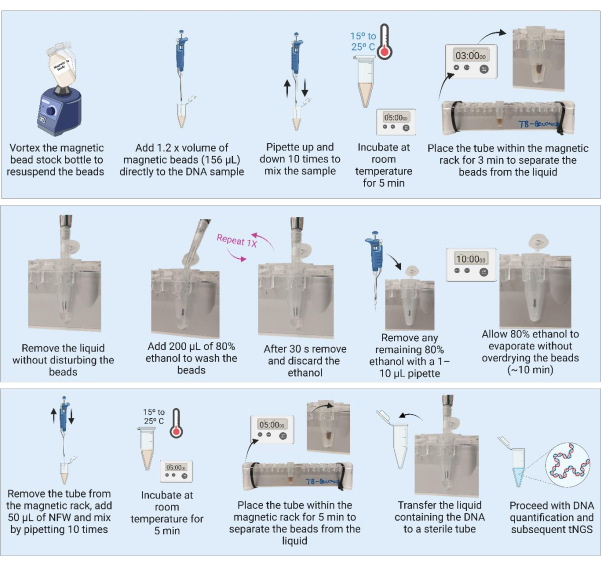
Şekil 3: Manyetik boncuklar kullanılarak DNA saflaştırılması ve konsantrasyonu. Kısaltmalar: NFW = nükleaz içermeyen su; tNGS = hedeflenen yeni nesil dizileme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Örnek açıklama
Mikroskopide en az 165+ bakteri yüküne sahip aside dayanıklı basil (AFB) için pozitif olan toplam 1 balgam tortusu örneği, Ulusal Sağlık Laboratuvarı Hizmetleri (NHLS) Green Point, Cape Town, Güney Afrika tarafından rutin olarak toplandı ve işlendi. DNA, balgam sediment örneklerinden iki farklı hacim [yaklaşık 2 mL (n = 102) ve 500 μL (n = 63)] kullanılarak ekstrakte edildi. Bu karşılaştırma, daha küçük tortu numune hacminin aşağı akış tNGS için yeterli DNA verip veremeyeceğini değerlendirmek için yapılmıştır.
Şekil 4, farklı balgam yayma derecelerinde (1+, 2+ ve 3+) ve balgam tortu hacimlerinde (2 mL ve 500 μL) toplam DNA konsantrasyonunun (ng/μL) bir kutu grafiği karşılaştırmasını göstermektedir. Ekstraksiyon için 500 μL tortu kullanıldığında DNA verimi genellikle genel olarak azalır ve smear dereceleri arasında değişkenlik gösterir. Bu nedenle, en az 2 mL hacme sahip tortu örneklerinden ekstrakte edilen ortalama DNA konsantrasyonları, numunenin AFB'si ile tabakalandırılan 500 μL çökeltiden ekstrakte edilen DNA konsantrasyonundan ortalama olarak daha yüksekti.
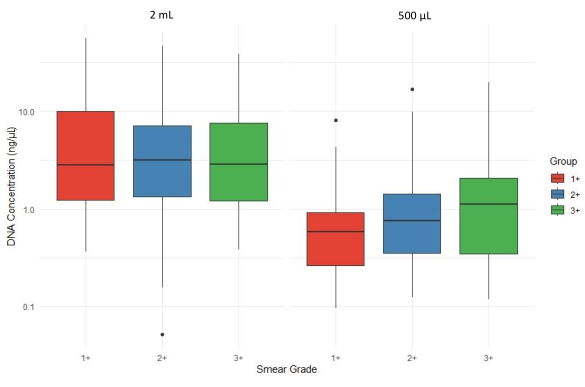
Şekil 4: Balgam tortu hacminin yayma dereceleri boyunca DNA verimi üzerindeki etkisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5, iki farklı giriş hacminden (2 mL ve 500 μL) işlenen farklı yayma derecelerine (1+, 2+ ve 3+) sahip balgam tortu örnekleri için tüm hedeflerin ortalama sıralama okuma sayısını (ortalama kapsama derinliği) gösteren kutu çizimlerini göstermektedir. Aykırı değerler tek tek noktalarla temsil edilir ve y ekseni, kapsamdaki varyasyona uyum sağlamak için logaritmik bir ölçekte görüntülenir. 500 μL'lik çökeltilerden ekstrakte edilen 3+ numune için yüksek çeyrekler arası aralık, daha yüksek bakteri yükleri ile daha fazla değişkenlik olduğunu düşündürür.
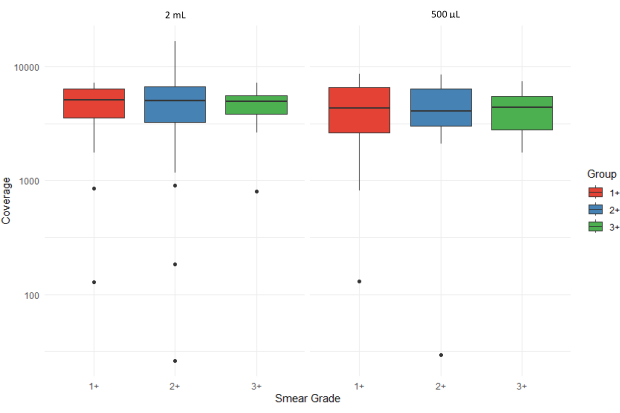
Şekil 5: Smear dereceleri ve numune giriş hacimleri boyunca tüm hedefler için ortalama sıralama okuma sayısının (kapsama derinliği) karşılaştırılması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 6, ilgili web uygulamasının biyoinformatik boru hattı kullanılarak sıralama sonuçlarının kabul edilebilirliğinin değerlendirilmesini göstermektedir. Sıralama kalite puanları +++ (yüksek kabul edilebilir), ++ (kabul edilebilir), + (marjinal olarak kabul edilebilir), - (kabul edilemez) ve ND (belirlenmedi) olarak kategorize edilmiştir. Grafikte bir çubuğun olmaması, söz konusu kategori için hiçbir sonuç elde edilmediğini gösterir. Smear grade 1+, 500 μL giriş hacmi numune seti için smear grade 2+ ve 3+'ya kıyasla daha yüksek oranda kabul edilemez ve ND sonuçları gösterir. 500 μL balgam tortusundan ekstrakte edilen numuneler, 2 mL balgam tortusundan ekstrakte edilen numuneler için 4.810'a kıyasla ortalama 4.316 sıralama kapsama derinliğine sahipti. Bu, balgam tortusundan ekstrakte edilen DNA'nın, giriş hacminden bağımsız olarak aşağı akış tNGS'sini gerçekleştirmek için yeterli olduğunu göstermektedir.
Sekanslama sonucunun kabul edilebilirliğinin dağılımına bağlı olarak, smear derecesi 3+ olan numuneler, 1+ ve 2+ smear dereceli numunelere kıyasla çoğu numune dizisi ++ ve +++ olarak puanlanarak en yüksek başarı oranına sahipti. 500 μL girdi numuneleri için, - ve + kategorilerindeki numunelerin oranı, 2 mL girdi numunelerine kıyasla tüm smear derecelerinde nispeten daha yüksektir. Bu, daha fazla numunenin 500 μL giriş için daha düşük kaliteli, daha az kabul edilebilir kategorilere girdiğini göstermektedir. 2 mL girdi numuneleri için, özellikle smear derecesi 3+ için, daha yüksek kalite, ++ ve +++ kategorilerinde daha yüksek bir numune oranı vardır. Bu, 2 mL girdili numunelerin, 500 μL girdili olanlara kıyasla daha iyi dizileme kalite puanları üretme olasılığının daha yüksek olduğunu göstermektedir.
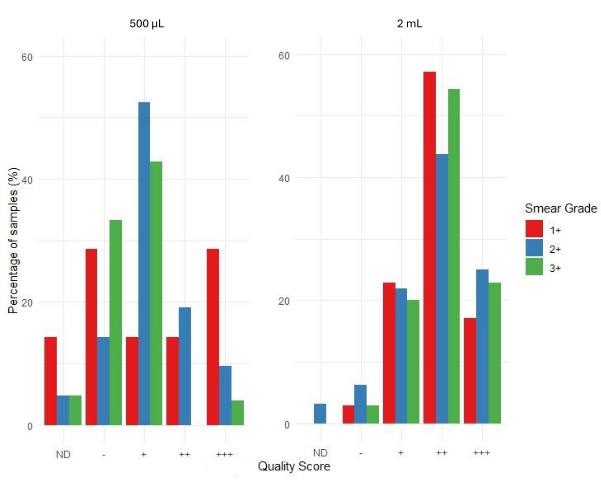
Şekil 6: Kalite puanlarının smear derecesine ve numune giriş hacimlerine göre dağılımı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Yüksek hızlı homojenizatör ile birleştirilmiş matris bazlı ekstraksiyon yönteminin kombinasyonu ilk olarak Shea ve ark.9 tarafından yayınlanmıştır. Bu yöntem, MTBC kültürlerinden ekstrakte edilen DNA'nın WGS'si için geliştirilmiş ve optimize edilmiştir 9,10. Bu yöntemi bir MTB tNGS testi ile kullanım için optimize ettik. 21 numunenin DNA ekstraksiyonu ve saflaştırılması, inkübasyon ve santrifüjleme adımları dahil olmak üzere 4 saat 40 dakikalık birleşik bir geri dönüş süresine sahipti. Açıklanan protokolün güvenilirliği, 1+ ila 3+ arasında değişen smear derecelerine sahip numunelerden DNA ekstraksiyonu için bir boncuk temizleme ile birleştiğinde, ortalama verim (Şekil 4), birleştirilen tüm hedeflerin genel kapsama derinliği (Şekil 5) ve ilgili web uygulaması tarafından belirlenen sıralama sonucu kabul edilebilirlik puanına (Şekil 6) dayalı olarak gösterilmiştir.
Yakın zamanda yapılan bir çalışma, smear derecesi ile DNA konsantrasyonu veya sıralama okuma derinliği arasında tutarlı bir ilişki bulamadı. Yazarlar, numune işleme ve temizleme adımlarındaki değişkenliğin, özellikle kirleticiler verimli bir şekilde uzaklaştırılmadığında, yüksek bulaşma dereceli numunelerde performansı etkileyebileceğini öne sürmüşlerdir. Ek olarak, hedef olmayan DNA'nın MTB DNA11 ile rekabet edebileceği DNA havuzunun karmaşıklığı nedeniyle balgam tortusundan dizileme zor olmaya devam etmektedir. Giriş DNA konsantrasyonu ile dizileme derinliği arasında net bir korelasyon gözlemlememiş olsak da, PCR inhibisyonuna yol açabileceğinden, üreticinin talimatlarına göre hedef PCR'den önce DNA girişinin 100 ng'yi aşmaması gerektiğine dikkat etmek önemlidir. Ek olarak, daha yüksek bakteri yükü, 2+ ve 3+ balgam tortusu örnekleri, insan DNA'sı, hücre kalıntıları ve diğer inhibitörler gibi daha fazla kirletici içerebilir ve bu da PCR amplifikasyonu ve kütüphane hazırlığına müdahale edebilir.
Saflaştırma aşaması aynı zamanda bir konsantrasyon adımı olarak da işlev görür ve tNGS'den önce mikobakteriyel DNA verimini arttırır. Bu yöntem, düşük bakteri yüküne sahip numunelerin işlenmesi için etkilidir ve 500 μL kadar küçük hacimlerde güvenilir performans göstermiştir, bu da onu sınırlı numune hacminin mevcut olduğu rutin ayarlar için uygun hale getirir. Uygulaması, kliniklere takip ziyaretleri ihtiyacını azaltabilir ve böylece takip için hasta kaybı riskini en aza indirebilir. Ek olarak, yöntem basittir ve gelişmiş laboratuvar uzmanlığı gerektirmez, bu da kaynakların sınırlı ortamlara entegrasyonunu daha da destekler.
Ancak protokol ile ilgili bazı noktalara dikkat edilmelidir. Numuneler, 80 °C'de inkübasyondan hemen sonra dondurulmamalı veya soğutulmamalıdır. Isıl işlemden hemen sonra hızlı soğutma, tüpün iç yüzeylerinde yoğuşma oluşmasına neden olarak numunenin seyreltilmesine ve potansiyel olarak aşağı akış DNA ekstraksiyonunu etkilemesine neden olabilir. Ek olarak, ani soğutma, ısıl işlem sırasında tamamen etkisiz hale getirilmemiş olabilecek nükleik asit parçalanmasını veya enzimatik aktiviteyi teşvik ederek numune bozulması riskini artırabilir. Bu hususlar, MTB tespiti için balgam numuneleri işlenirken özellikle önemlidir. Dünya Sağlık Örgütü'nün Ziehl-Neelsen boyama tavsiyelerine göre, 1+ smear derecesi, 100 yağa daldırma alanı başına 10-99 AFB'ye, 2+ en az 50 alanda alan başına 1-10 AFB'ye ve 3+ en az 20 alanda alan başına 10'dan fazla AFB'ye karşılık gelir12.
Bu yöntemin bir sınırlaması, yüksek hızlı bir homojenizatör veya boncuk çırpma cihazı kullanılarak manuel homojenizasyon gerekliliği nedeniyle otomasyon eksikliğidir. Bunu ele almak için devam eden çabalar, daha kısa kuluçka sürelerini, daha düşük kuluçka sıcaklıklarını ve yüksek hızlı homojenizasyona alternatif yaklaşımları test ederek protokolün iyileştirilmesine odaklanmaktadır.
Bu nedenle, yüksek hızlı bir homojenizatör ile birleştirilen bu matris bazlı DNA ekstraksiyon yöntemi, metaller ve proteinler gibi PCR inhibitörlerini aynı anda uzaklaştırırken genomik DNA'yı serbest bırakmak için ısı ve boncuk çırpma kullanan hızlı bir DNA ekstraksiyon tekniğidir.
Açıklamalar
Yazar T. R., UC San Diego ile bir hizmet sözleşmesi aracılığıyla FIND'den finansman desteği alıyor. Yazar TR, ilaca dirençli TB (R01AI176401) için bir tNGS çözümü geliştirmek ve değerlendirmek için NIH'den hibe fonu aldı. Yazar T. R., Verus Diagnostics Inc.'in kurucu ortağı, yönetim kurulu üyesi ve ücretsiz hissedarıdır.
Teşekkürler
Yazarlar, teknik yardım sağladıkları için NHLS - Green Point, Güney Afrika'daki TB laboratuvar ekibine teşekkür eder. Bu çalışma, Ulusal Sağlık Enstitüleri (NIH) ve Yenilikçi Yeni Teşhis Vakfı (FIND), TS ELiOT projesi Hibe Kimliği: R01AI153213, Unitaid Hibe Kimliği: 2019-32-FIND MDR tarafından desteklenmiştir. Figürler BioRender.com kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alternative: Benchmark BeadBlaster 24 | Benchmark Scientific | D2400 | |
| AMPure XP Bead-Based Reagent | Beckman Coulter | A63881 | |
| Autoclaved or sterile glass beads (2 mm) | Sigma-Aldrich | Z273627-1EA | |
| Ethyl alcohol, Pure | Sigma-Aldrich | E7023-500ML | |
| Filter pipette tips (10 µL) | Bio-Smart Scientific | FT-10-R | |
| Filter pipette tips (1000 µL) | Bio-Smart Scientific | FT1000-R | |
| Filter pipette tips (20 µl) | Bio-Smart Scientific | FT20-R | |
| Filter pipette tips (200 µL) | Bio-Smart Scientific | FT200-R | |
| Heating-block ranging from 37 °C to 100 °C | Eppendorf | 5382000031 | |
| High-speed homogenizer (HSM) as FastPrep-24 | MP Biomedicals | 116005500 | |
| Incubator 80 °C | Lasec Group | IBLPDHG-9030A | |
| InstaGene Matrix | Bio-Rad Laboratories Inc. | BBRD7326030 | |
| Low-binding microtubes (1.5 mL or 2 mL) | Eppendorf | EP0030108051-250EA | |
| Magnetic rack for 1.5 – 2 mL tubes | Thermo Fisher Scientific Inc. | 12321D | |
| Magnetic stirrer | Merck | Z671886 | |
| Microcentrifuge | Eppendorf | 5406000046 | |
| Milli-Q IX 7015 Pure Water Purification System | Merck | ZIX7015T0C | |
| Nuclease-free water (NFW), molecular grade | Thermo Fisher Scientific Inc. | AM9937 | |
| Pipettes (P10, P20, P200, and P1000) | Eppendorf | EP3123000918-1EA | |
| Qubit Assay Tubes | Thermo Fisher Scientific Inc. | Q32856 | |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific Inc. | Q33231 | |
| Qubit fluorometer instrument | Thermo Fisher Scientific Inc. | Q33226 | |
| Screw cap tubes (1.5 mL) | Scientific Specialties Inc. | P2TUB056C-0001.5ST | |
| Vortex | Lasec Group | WMBB0L0E0216 |
Referanslar
- Global Tuberculosis Report 2024. Geneva: WHO. , World Health Organization. https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2024 (2024).
- De Araujo, L., et al. Implementation of targeted next-generation sequencing for the diagnosis of drug-resistant tuberculosis in low-resource settings: a programmatic model, challenges, and initial outcomes. Front Public Health. 11, 1204064(2023).
- Murphy, S. G., et al. Direct detection of drug-resistant Mycobacterium tuberculosis using targeted next generation sequencing. Front Public Health. 11, 1206056(2023).
- Kambli, P., et al. Targeted next generation sequencing directly from sputum for comprehensive genetic information on drug resistant Mycobacterium tuberculosis. Tuberculosis. 127, 102051(2021).
- WHO Consolidated Guidelines on Tuberculosis.Module 3: Diagnosis. Rapid diagnostics for tuberculosis detection. Third edition. , World Health Organization. https://iris.who.int/bitstream/handle/10665/376221/9789240089488-eng.pdf?sequence=1 (2024).
- Catalogue of mutations in Mycobacterium tuberculosis. complex and their association with drug resistance. Second edition. , World Health Organization. https://iris.who.int/bitstream/handle/10665/374061/9789240082410-eng.pdf?sequence=1 (2023).
- Schwab, T. C., et al. Targeted next-generation sequencing to diagnose drug-resistant tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis. 24 (10), 1162-1176 (2024).
- Deeplex Myc-TB manual version 5. , GenoScreen. https://acrobat.adobe.com/link/track?uri=urn%3Aaaid%3Ascds%3AUS%3A67c2b53f-c91d-3a73-a6ea-4769e7c8fe57 (2023).
- Shea, J., et al. Comprehensive whole-genome sequencing and reporting of drug resistance profiles on clinical cases of Mycobacterium tuberculosis in New York State. J Clin Microbiol. 55 (6), 1871-1882 (2017).
- Conceição, E. C., et al. Mycobacterium tuberculosis. DNA extraction using InstaGene Matrix and high-speed homogenizer from clinical primary culture. , https://www.protocols.io/view/mycobacterium-tuberculosis-dna-extraction-using-in-dhvs366e (2024).
- Nilgiriwala, K., et al. Genomic sequencing from sputum for tuberculosis disease diagnosis, lineage determination, and drug susceptibility prediction. J Clin Microbiol. 61 (3), e0157822(2023).
- Laboratory Services in Tuberculosis Control Part II: Microscopy. Geneva: WHO. , World Health Organization. https://iris.who.int/bitstream/handle/10665/65942/WHO_TB_98.258_(part2).pdf?sequence=2 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır