Method Article
Axolotl ve Ekokardiyografide Kriyo-yaralanmaya Bağlı Kalp Rejenerasyonu ve Rejeneratif İlerlemeyi Değerlendirmek İçin Tarafsız Kantitatif Histoloji
Bu Makalede
Özet
Burada, aksolotlun ventriküler miyokardına kriyoyaralanmayı indüklemek için bir cerrahi protokol sunuyoruz. Ek olarak, ekokardiyografi ile rejeneratif süreç sırasında enfarktüs fraksiyonunu non-invaziv olarak tahmin etmek için bir protokol ve tarafsız kantitatif histoloji ile eksize edilen kalpte enfarktüs fraksiyonunu hassas bir şekilde ölçmek için bir protokol sunuyoruz.
Özet
Urodele amfibileri, semenderler ve semenderler, ventriküler rezeksiyonu takiben tam miyokardiyal rejenerasyon yapabilen memelilere en yakın filogenetik grubu temsil eder. Rezeksiyon modeli, kardiyak onarımda yer alan süreçler hakkında temel bir bilgi oluşturmuştur. Bununla birlikte, model, doku hasarı, apoptoz, nekroz, fibroz ve hipertrofinin, doku çıkarılmasından ziyade iskemiye bağlı miyokard enfarktüslerinin önemli zararlı sonuçları olduğu klinik durumlarla iyi bir ilişki kurmamaktadır. Öte yandan, kriyoyaralanmaya bağlı miyokard enfarktüsü, iskemiye bağlı miyokard enfarktüsüne daha çok benzer. Burada, bir tetrapod modelinde kardiyak onarımdaki temel mekanizmaları araştırmak için bir araç sağlayan aksolotldaki (Ambystoma mexicanum) kriyoyaralanma prosedürünün ayrıntılı bir tanımını sunuyoruz. Ek olarak, ekokardiyografi ile invaziv olmayan in vivo enfarktüs boyutunu tahmin etmek ve enfarktüs boyutunu ex vivo tarafsız kantitatif histoloji ile hassas bir şekilde ölçmek için kantitatif yöntemler sunuyoruz.
Giriş
İskemik kalp hastalığı, küresel olarak ölümlerin önde gelen bir nedenidir 1,2. İskemiye bağlı miyokard enfarktüsü, kardiyomiyositlerde yaygın hücre ölümüne neden olur3. Hızlı tıbbi müdahale ani ölüm riskini azaltabilse de, insanların geleneksel memeli model hayvanlarla (fare, sıçan, tavşan, domuz vb.) paylaştığı fibrotik tepki, sonuçta kardiyak hipertrofi, aritmiler ve kalp yetmezliğine yol açabilecek skar dokusu oluşumuna neden olur4. Memelilerin aksine, zebra balığı5 ve semender6 gibi bazı amnionik olmayan hayvan modellerinde kardiyak rejenerasyon iyi bilinmektedir. Geleneksel olarak, bu türlerde kısmi ventriküler rezeksiyon veya 5,6,7,8,9,10 sonrasında kardiyak rejenerasyon incelenmiştir. Bununla birlikte, 2011 yılında, üç grup bağımsız olarak zebra balığında kriyoyaralanmaya bağlı bir miyokard enfarktüsü tekniği geliştirdi 11,12,13. Kriyoyaralanma tekniği, zebra balığı kalbi ventrikülünün büyük bir bölümünde nekroz ve apoptoz ile sonuçlanır ve ventriküler rezeksiyona kıyasla iskemik enfarktüsü takiben memeli kalbinin patolojik gelişimini daha yakından modelleyen bir başlangıç fibrotik doku birikimi ile sonuçlanır 11,12,13. Ek olarak, kriyoyaralanmaya bağlı miyokard enfarktüsünün, fare ve domuzda koroner arter ligasyonu ile iskemiye bağlı miyokard enfarktüsü ile metodolojik karşılaştırmaları, kriyoinjury tekniğinin memeli hayvan modellerinde yararlı bir alternatif olduğunu kanıtlamıştır14,15. Zebra balığı kriyoyaralanma modelinde 16,17 yer alan yöntemlerden esinlenerek, rejeneratif yetenekleriyle19 tanınan bir amfibi olan aksolotl18'de benzer bir model geliştirdik ve bu model, doku çıkarılmasından ziyade doku hasarından sonra bu tetrapodda kardiyak onarımda yer alan mekanizmaların araştırılmasına olanak tanır.
Burada, aksolotlda kriyoyaralanmaya bağlı miyokard enfarktüsünün nasıl gerçekleştirileceğine dair ayrıntılı bir protokol sunuyoruz. Sağkalımı, iyileşmeyi ve deneysel tekrarlanabilirliği artıran hızlı ve minimal invaziv önemli adımlara özel önem veriyoruz. Ek olarak, anatomik rejenerasyonu değerlendirmek için uygun teknikler için talimatlar sağlıyoruz in vivo ekokardiyografi ve ex vivo tarafsız stereoloji tabanlı kantitatif histoloji kullanarak.
Aksolotlda kriyoyaralanmaya bağlı miyokard enfarktüsü, bu tetrapodda miyokard rejenerasyonunda rol oynayan temel mekanizmaları araştırmak için uygulanabilir. Aksolotl, ventrikülün en az %45'ini etkileyen kriyoinjuryın neden olduğu miyokard enfarktüsüne toleranslıdır, bu da nispeten durgun yaşam tarzında herhangi bir davranış değişikliği olmaksızın inme hacminde ve kalp debisinde bir azalmaya neden olur, ancak daha ciddi yaralanmalar potansiyel olarak hayvan sağlığının azalmasına yol açacaktır.
Kısacası, kriyoyaralanmayı indüklemek için, anestezi uygulanmış bir aksolotlun göğüs kafesinde ventral bir insizyon yapılır. Ventriküle künt diseksiyon kullanılarak erişilir ve kriyoyaralanmayı indüklemek için 10 saniye boyunca önceden soğutulmuş bir kriyoprob uygulanır. Ventral insizyon dikilir ve hayvan, bilinç yeniden kazanıldıktan sonra herhangi bir davranış değişikliği belirtisi olmadan hızla iyileşir. Kontrol/sahte hayvanlar da benzer muamele görür ancak soğutulmamış bir kriyoprob yaşarlar. Kardiyak performans, daha önce 20 yaşında sağlıklı aksolotl kalplerde ayrıntılı olarak tarif edildiği gibi ekokardiyografi (yüksek frekanslı ultrason sistemleri gerekli,≥20 MHz) kullanılarak izlenebilir ve enfarktüs fraksiyonu, rejeneratif süreç sırasında non-invaziv ve tekrar tekrar tahmin edilebilir. Enfarktüslü kalpler, 3 aylık rejeneratif süreç boyunca herhangi bir zamanda hasat edilebilir, histoloji için kriyoseksiyon yapılabilir ve standart prosedürler (örneğin, eozin ve hematoksilen veya Masson'un trikrom boyama) kullanılarak boyanabilir. Özellikle, Masson'un trikrom boyaması, ventrikülün enfarktüslü ve sağlıklı kısımları arasında net bir ayrım yapılmasını sağlar. Ventrikülün enfarktüs fraksiyonu, daha önce kardiyak çalışmalar için tarif edilen stereolojik teknikler kullanılarak belirlenir21.
Protokol
Bu protokol, tüm kurumsal (Aarhus Üniversitesi) ve ulusal (Danimarka Ulusal Hayvan Deneyleri Müfettişliği protokolü# 2015−15−0201−00615) hayvan bakımı yönetmeliklerine ve yönergelerine uygundur.
1. Kriyoprobun hazırlanması
- 1 mm çapında üç tel bakır teli 10 cm'lik parçalar halinde kesin.
- Bakır telleri tek bir dizeye sarın.
- Bir gaz meşalesi ile bakır telin bir ucunu 2 mm çapında küresel bir uç oluşturacak şekilde eritin.
NOT: Bakır, yüksek bir termal iletkenliğe sahiptir (0 ° C'de 401 W m-1 K-1 ) ve kolayca yönetilebilir sıcaklıklarda (erime noktası 1084.6 ° C) kalıplanabilir, ancak bakır bir yüzey, özellikle kanla temas ederse zamanla paslanma eğilimindedir, bu da termal iletkenliği önemli ölçüde azaltır. Bu nedenle, bakır bazlı bir kriyoprob ara sıra parlatılmalıdır. Kriyoproblar için de kullanılabilecek alternatif daha kararlı metaller gümüş (termal iletkenlik 0 °C'de 428 W m-1 K-1 , erime noktası 961.8 °C) ve altındır (termal iletkenlik 0 °C'de 318 W m-1 K-1 , erime noktası 1064.2 °C). - Pistonu 2 mL'lik bir şırıngadan çıkarın ve yumuşak lastik kafayı çekip çıkarın.
- Bakır ipin küresel olmayan ucunu şırınganın içinden geçirin ve tabancaya bağlayın
- Pistonu şırıngadaki yerine geri koyun (Şekil 1A).
NOT: Kriyoprob kullanımda değilken, piston tamamen geri çekilerek bakır ip korunmalıdır. Kullanım sırasında, bakır ipi soğutma banyosuna maruz bırakmak için piston sonuna kadar itilir.
2. Kriyoyaralanmaya bağlı miyokard enfarktüsü
- Aksolotl'u 200 mg / L benzokain anestezikine batırarak anestezi altına alın. Otuz dakikalık daldırma ~ 2.5 saat tam anestezi sağlayacaktır.
NOT: Benzokain suda çözünmez ve önce 3 mL (200 mg benzokain başına) asetonda çözündürülmeli ve daha sonra su banyosuna eklenmelidir. Benzokaine uzun süre daldırmak iyileşmeyi bozabilir, bu nedenle benzokain süresi dikkatle izlenmelidir. - Aksolotl'u ventral tarafı yukarı bakacak şekilde bir ameliyat kabına yerleştirin (sağ elini kullanan bir cerrah için sola gidin). Göğüs kafesi hariç tüm vücut kısımlarını anestezik solüsyona batırılmış doku mendilleriyle kaplayarak hareketsiz hale getirin (Şekil 1B).
NOT: Hayvanı ıslak mendille sarmak, suda yaşayan bir amfibi için çok önemli olan nemli bir ortam sağlar ve gözlerde veteriner merhemi ihtiyacını ortadan kaldırır. Ameliyat sırasında steriliteyi sağlamak için sonraki adımlarda otoklavlanmış aletler kullanın. - Deride toraksın orta hattına hafifçe doğru ~1 cm'lik uzunlamasına bir kesi yapmak için iridektomi makası kullanın (Şekil 1C).
- Göğüs kuşağının kıkırdak plakalarını serbest bırakmak için forseps kullanın.
NOT: Göğüs kuşağı hassas bir yapıdır ve daha sonraki yara iyileşmesini ve hayvan hareketini ve refahını bozabileceğinden, elemanlarına zarar vermemeye özen gösterilmelidir. - Altta yatan kardiyak yapılara zarar vermeden açıkta kalan perikardı bir kesi ile nazikçe açın. Perikardiyal sıvı dışarı sızmadan önce, bunu künt 2 Gauge iğne taşıyan 1 mL'lik bir şırıngaya aspire edin (Şekil 1D).
- Yara kenarlarını ve kıkırdak plakalarını birbirinden ayrı tutmak için yaraya ayarlanmış bir açıklık (~ 1 cm) olan künt forseps yerleştirin (Şekil 1E).
- Kriyoprobu, bakır tel en az 2 dakika açıkta kalacak şekilde sıvı N2'ye yerleştirin.
NOT: Bakır telin kütlesi çok küçükse (yani çok kısaysa) veya yeterince soğutulursa, istenmeyen bir eksik transmural kriyoyaralanma meydana gelebilir. - Ventrikül yüzeyinde sıvı bulunmadığından emin olmak için açıkta kalan ventrikülü pamuklu çubukla veya sıkıca sarılmış mendillerle nazikçe silin (Şekil 1F).
- -196 °C'ye soğutulmuş kriyoprobu sıvıN2'den çıkarın ve doğrudan açıkta kalan ventriküle uygulayın (Şekil 1H). Ventriküle yapışacaktır. Kriyoprob yerleşimi, diğer kardiyak yapılara zarar vermemek ve hem sağlıklı hem de enfarktüslü miyokard içeren mikroskopi için müteakip enine kesitlere izin vermek için ventrikülün lateral tarafında apekse doğru olmalıdır. 10 saniye sonra önceden toplanan perikardiyal sıvıyı kriyoprob ucuna uygulayın (Şekil 1I). Bu, probu çözecek ve ventrikülden ayrılmaya izin verecektir.
NOT: Kriyoprobu aşırı su içeren bir ventrikül üzerine uygulamak, prob çok hızlı ısıtılırsa eksik kriyoinfarktüs veya ventrikülün tüm yüzeyini kaplayan ince bir su tabakası anında donarsa çok geniş miyokard hasarı ile sonuçlanır. Her iki durum da arzu edilen bir durum değildir. Başarılı bir kriyoyaralanma indüksiyonu durumunda, ventrikül üzerinde küçük kırmızı dairesel bir şişlik görülecektir (Şekil 1J). Sahte hayvanlarla uğraşırken, soğutulmamış bir kriyoprob 10 saniye boyunca benzer şekilde yerleştirilir (Şekil 1G). - Perikard'ı ventrikülün üstüne yerleştirin, yarayı açık tutan forsepsleri çıkarın ve göğüs kuşağının kıkırdak plakalarını yeniden düzenleyin.
NOT: Kardiyak fonksiyonu değerlendirmek için müteakip ekokardiyografi yapılırsa, tüm hava ceplerinin, hatta kıkırdak plakalarının altında oluşmaya eğilimli küçük kabarcıkların bile, görüntüleme artefaktlarını indüklediği için çıkarılması çok önemlidir. Bu kabarcıklar, dokuya hafifçe bastırılarak veya otoklavlanmış amfibi Ringer solüsyonu (6.6 g/L NaCl, 0.15 g/L KCl, 0.15 g/L CaCl2, damıtılmış suda 0.2 g/L NaHCO3 ) eklenerek yara yüzeyine hava kabarcıklarını çözerek çıkarılabilir. - Eriyen iplik (6-0) kullanarak cildi (3-5 dikiş) dikin (Şekil 1K).
- Ameliyat bölgesini yaranın üzerine kaldırılan ıslak mendillerle örtün ve ardından anestezik solüsyonla ıslatın.
- Bir yara epidermisinin ilk oluşumuna izin vermek için ameliyat kabını hayvanla birlikte 2 saat boyunca buzun üzerine yerleştirin ve hayvan steril olmayan su ortamına maruz kalmadan önce yara kenarlarını kapatın.
- Hayvanı akvaryum suyuyla temiz bir kaba aktarın. Hayvan bu zamana kadar bilincini yeniden kazanıyor olmalı. Hayvanı tam bilincini ve koordineli hareketlerini yeniden kazanana kadar gözlemleyin. Ameliyattan sonraki iki gün boyunca beslenmeyi ve su değiştirmeyi bırakın ve rahatsızlıklar yeniden ortaya çıkmadan önce yaranın kapanmasına izin vermek için aksolotl'u kendi akvaryumunda yalnız tutun.
NOT: Bilincini geri kazandıktan sonra, çoğu aksolotl hava yutma arzusuna sahiptir. Bu süreci kolaylaştırmak ve ihtiyaç duyulan hareket miktarını sınırlamak için, ameliyattan kısa bir süre sonra akvaryumdaki su seviyesini ameliyattan 1-2 gün sonra düşürmek faydalı olabilir. Ameliyat sonrası 24 saat boyunca analjezik olarak düşük konsantrasyonda benzokain (20 mg / L) kullanılabilir.
3. Ekokardiyografi ile enfarktüs fraksiyonunun non-invaziv ölçümü
- Aksolotl'u adım 2.1'de anlatıldığı gibi uyuşturun.
- Hayvanı, ventral yüzeyi kaplayan 3-5 mm anestezi solüsyonu içeren küçük bir kaba sırtüstü pozisyonda yerleştirin.
- Ultrason dönüştürücüsünü hayvanın uzun ekseni boyunca torasik bölgenin orta hattının sağına hafifçe yerleştirin.
- Enfarktüs fraksiyonunun iki boyutlu bir tahmini için [IF (ultrason, 2D)], enfarktüs bölgesi ve ventrikül B modunda maksimum görünene kadar dönüştürücüyü çevirin (Şekil 2AD, Ek Materyal 1-2).
- > 50 kare/sn ile ≥3 kardiyak döngü elde edin.
- Karıncığın (CSAv) ve diyastol sonundaki enfarktüs bölgesinin (CSAi) kesit alanını ölçün ve aşağıdaki denklemi kullanarak küresel bir ventrikül şekli ve yarım küre enfarktüs bölgesi şekli varsayarak iki boyutlu enfarktüs fraksiyonunu tahmin edin:
 (1)
(1)
NOT: Ventrikül şeklinin ve kırma bölgesinin geometrik varsayımlarını değerlendirmek için, dönüştürücü kalbin kısa eksen görünümünü görüntülemek için 90° döndürülebilir (Şekil 2EF, Ek Malzeme 3). - Enfarktüs fraksiyonunun üç boyutlu bir tahmini için, ventriküler diyastolün sonunda ventrikülün sadece küçük bir kısmı görünene kadar dönüştürücüyü sola veya sağa konumlandırın.
- 0,5 mm'lik (küçük hayvanlar için, vücut kütlesi ≤ 20 g) veya 1 mm'lik (büyük hayvanlar, vücut kütlesi > 20 g) adımlarla (z), dönüştürücüyü ventrikül boyunca hareket ettirin ve adım/dilim başına en az 3 kardiyak döngü elde edin.
NOT: Makul hassasiyet için 8 – 12 dilim (n) alınmalıdır. - Her dilim (j) için diyastol sonunda CSAv ve CSAi'yi ölçün ve aşağıdaki denklemi kullanarak herhangi bir geometrik ventrikül ve kırılma şekli varsayımı olmadan üç boyutlu enfarktüs fraksiyonunu [IF(ultrason, 3D)] tahmin edin:
 (2)
(2)
NOT: Dittrich ve ark. (2018)20'nin 3. ve 6. bölümlerinde açıklandığı gibi kardiyak fonksiyonu (strok hacmi ve kardiyak debi) geometrik olarak ölçmek için hem iki boyutlu hem de üç boyutlu edinim kullanılabilir. Benzer şekilde, darbeli dalga hızı edinilmiş hız zaman integralleri (Şekil 2G), Dittrich ve ark. (2018)20. bölümde bölüm 3'te açıklandığı gibi kardiyak fonksiyonu ölçmek için de kullanılabilir. - Adım 3.9'da çizilen CSAv ve CSAi'nin ilgi alanlarını, diyastol sonu ve uç sistoldeki ventrikül ve enfarktüs bölgesini üç boyutlu olarak modellemek için dilimler arasında z boşluğu olan ikili maskeler olarak çıkarın (Şekil 2H, Ek Materyal 4).
4. Enfarktüs fraksiyonunu ölçmek için tarafsız kantitatif histoloji
- Adım 2.2 – 2.6'da açıklanan anestezi uygulanmış bir aksolotlun kalbini keşfedin.
- 26 gauge iğne ile donatılmış 1 mL'lik bir şırınga kullanarak, 1000 IU / mL heparinize amfibi Ringer solüsyonunun 5 μL / g vücut kütlesini sinüs venosusun içine yavaşça enjekte edin ve antikoagülanın dolaşımda dağılması için 2 dakika bekleyin.
- Dekapitasyon ve beyin ağrısı ile ötenazi yapın ve önce giriş damarlarını ve ardından çıkış yolunu keserek tüm kalbi eksize edin.
- Kalbi, çıkış yolundan nazikçe kaldırarak amfibi Ringer solüsyonu içeren 60 × 15 mm2'lik bir Petri kabına aktarın.
- Büyütme altında, sinüs venosusunu 100 IU / mL heparinize Ringer solüsyonu ile nazikçe doldurarak kalpte kalan kanı yıkayın.
NOT: Kalbin ön fiksasyonu, kalbin tamponlu formalin veya paraformaldehit ile perfüze edilmesiyle gerçekleştirilebilirken, kesit alma donma sıcaklığında gerçekleştirildiği için bu gerekli değildir. Daha sonra, bölümlerin cam slaytlar üzerine sabitlenmesi gerçekleştirilebilir. Tamamen yıkanmış bir kalp soluk ve beyazımsı görünecek ve kırmızı kan hücresi izi içermeyecektir. Ventrikül ve kulakçık yüzeyinde küçük kan pıhtılarının oluşması muhtemeldir. Sonraki kantitatif histoloji prosedüründe kesinliği etkilemezler. - Kalbi 1 dakika boyunca lekelemek için tüy bırakmayan kağıt mendile aktarın.
- Tek bir damla optimum kesme sıcaklığı bileşiği uygulayarak yeterli boyutta bir kriyo kalıp hazırlayın ve kalbi damlaya aktarın. Kalbi nazikçe dibe doğru sıkın.
- Kriyokalıbı doldurmak için daha optimum kesme sıcaklığı bileşiği uygulayın ve ventrikülün altta kaldığından emin olun. Optimum kesme sıcaklığı bileşiğinin numune içinde dağılmasına izin vermek için kalıbı 5 dakika bekletin.
- Kalıbı, sıvı nitrojen üzerinde yüzen bir pipet ucu kutusundan bir kapağa yerleştirerek dondurun.
NOT: Daha kontrollü bir çıtçıtlı dondurma için, kalpler %10-30 sükroz çözeltisi içinde gece boyunca 1 saat saklanabilir ve sıvı nitrojenle soğutulmuş izopentan (2-metilbütan) kullanılarak çıtçıtlı dondurma yapılabilir. Deneyimlerimize göre, sonuç belirgin bir şekilde farklı değildir. - Kriyokalıbı, kesitlemeden önce en az 1 saat boyunca -18 ila -22 °C'ye ayarlanmış bir kriyostatta temperleyin.
- 10 μm dilim kalınlığında kesit numunesi alın ve 100μm'lik bir levha kalınlığı (t) sağlamak için her 10. dilimi toplayın. Kalbin tamamı bölümlere ayrılana kadar bölümlere ayırmaya devam edin.
NOT: Farklı dilim ve levha kalınlıkları kullanılabilir, ancak dilim toplamanın bıçağın ventriküle değdiği noktada başlaması ve tüm kalbin en az 10-12 eşit aralıklı levha ile bölümlere ayrılması önemlidir. Yinelenen kümeler sağlamak için levha başına birden fazla dilim toplanabilir. - Epikard, miyokard, valfler ve enfarktüs bölgesi arasında net bir ayrım sağlamak için hematoksilen ve eozin veya Masson'un Trikrom için standart protokollerle doku bölümlerini boyayın.
- Aksolotl ventrikülün trabeküle yapısını net bir şekilde ortaya çıkarmak için yeterli büyütmede bir kamera mikroskobu veya slayt tarayıcı kullanarak doku bölümünü sayısallaştırın (Şekil 2I).
- Görüntü yığınını ImageJ'ye (https://imagej.nih.gov/ij/index.html) yükleyin ve hücre sayacı eklentisini (https://imagej.nih.gov/ij/plugins/cell-counter.html) başlatın.
- Çok amaçlı bir ızgara makrosu (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) çalıştırın ve yeterli ızgara yoğunluğuna sahip bir nokta ızgarası oluşturun.
NOT: Izgara yoğunluğu (ızgara alanı) numune boyutuna ve morfolojisine bağlıdır. İstenen bir hassasiyet sağlamak için, ızgara noktalarının ve ilgilenilen yapıların her birinin en az 100-200 kesişimi sağlanmalıdır. - Hücre sayacı eklentisini kullanarak nokta ızgarası ile ilgilenilen yapılar arasındaki kesişimlerin sayısını sayın (Şekil 2I, sağdaki büyütme).
NOT: Hassasiyet açısından, yalnızca artı işaretinin hedef noktasında tam olarak görünen kesişimleri dahil etmek önemlidir. - Aşağıdaki formülü kullanarak önceden tanımlanmış nokta ızgara alanından [Ai(p) ve Av(p)], döşeme kalınlığından ve enfarktüslü miyokard ve toplam ventriküler miyokard ile her levhadaki (Pj) nokta ızgara kesişimlerinin sayısından enfarktüs fraksiyonunu hesaplayın:
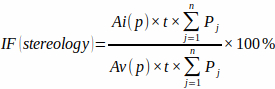 (3)
(3)
Sonuçlar
Vücut kütlesi 11,8 ± 1,3 g ve toplam uzunluğu 11,8 ± 0,5 cm olan aksolotllarda, 2 mm (çaplı) kriyoprob ile gerçekleştirilen kriyoyaralanma prosedürü, enfarktüs bölgesinin tamamen geliştiği yaralanmadan 7 gün sonra ventriküler miyokardın %45,4 ± %14,2'sini kapsayan enfarktüslü bir alanla sonuçlanır [Şekil 2I, sağlıklı kalp ihlali öncesi (üstte) ve ihlalden 7 gün sonra (altta) kesiti karşılaştırın]. Prosedürün ölüm oranı% 2.2'dir (2/90 hayvan). Prosedür, non-invaziv ekokardiyografi ile görselleştirilebilen, ölçülebilen ve modellenebilen iyi tanımlanmış bir yaralanma bölgesi ile sonuçlanır (Şekil 2C-H, Ek materyal 1-4). Başlangıçta, kriyoyaralanmaya bağlı miyokard enfarktüsü, kardiyak fonksiyonu önemli ölçüde etkiler, yaralanma öncesi yaralanmaya göre yaralanmadan 7 gün sonra inme hacmini %62.2'ye ve kardiyak debiyi %73.9'a düşürür ve üç ay boyunca kademeli olarak form ve fonksiyon iyileşmesi sağlar (veriler gösterilmemiştir). Nispeten sakin aksolotlda miyokardiyal kriyoyaralanmayı takiben herhangi bir davranış değişikliği gözlenmemiştir.
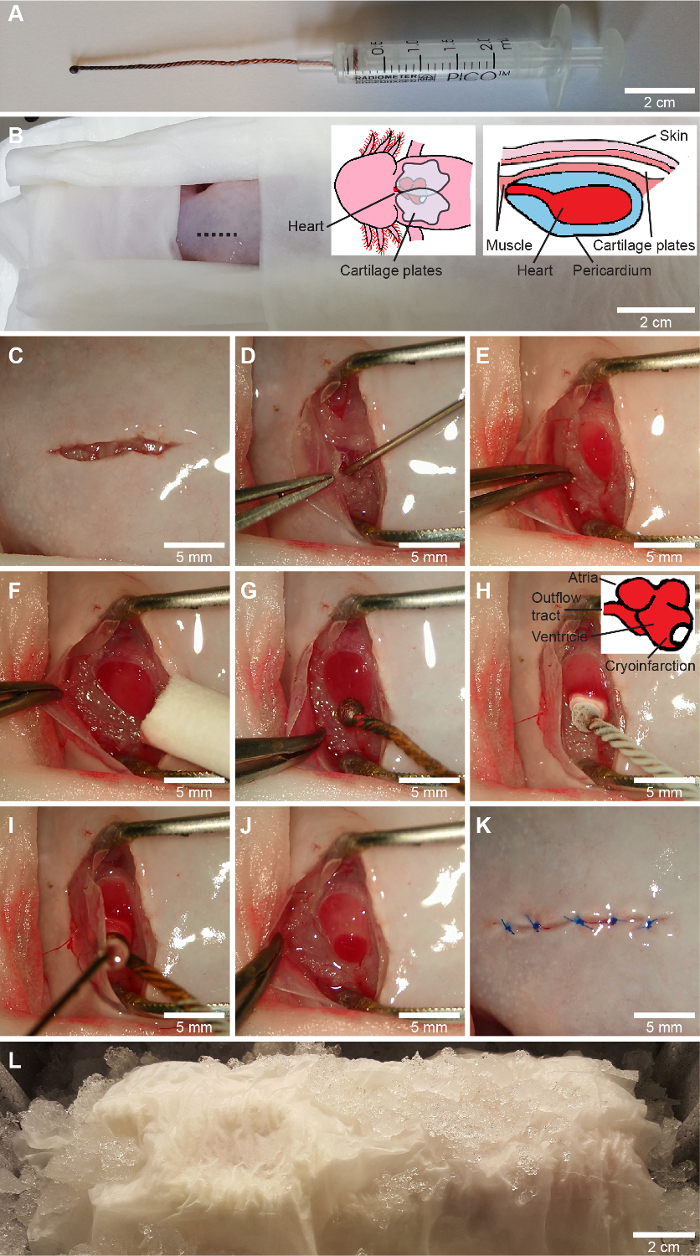
Resim 1: Kriyoinfarktüs prosedürü. A, özel yapım bir kriyoprob, üç bakır telin sarılması, ucun bir küre halinde eritilmesi ve telin 2,5 mL'lik bir şırınganın pistonuna bağlanmasıyla yapılır. BL, kriyoinfarktüs prosedürü. Ameliyat bölgesi dışındaki tüm vücut bölgelerinin ıslak mendil (B) ile kaplanmasını takiben, iridektomi makası (C) ile toraks üzerinde orta hattın hafif sağında (B'de gösterilmiştir) ventral kesi yapılır ve güdük diseksiyonu ile pektoral kuşak serbestleştirilir. Perikard bir insizyonla nazikçe açılır ve perikardiyal sıvı, künt 23 gauge bir iğne (D) kullanılarak 1 mL'lik bir şırıngaya aspire edilir. Karıncık açığa çıkarılır ve önceden tanımlanmış açılma genişliğine (E) sahip forseps ile yara açık tutulur ve karıncık üzerinde kalan sıvı silinir (F). Sahte cerrahi için, soğutulmamış bir kriyoprob (G), sıvı nitrojen (-196 °C) içinde soğutulan kriyoprobun ventrikülün yan duvarına apekse (H) doğru uygulandığı kriyoyaralanma ile aynı şekilde uygulanır. 10 saniye sonra, perikardiyal sıvı, ventrikülden (I) serbest bırakmak için kriyoproba yeniden uygulanır. Bu, açıkça tanımlanmış bir kriyoinjury bölgesi (J) verir. Son olarak, perikard ve göğüs kuşağı kalbin üstüne yatırılır ve cilt eriyen bir dikiş (K) ile dikilir (3-5 dikiş). Hayvan, yara iyileşme sürecini (L) başlatmak için 2 saat buz üzerinde bırakılır. Kranial, BL'de sola doğrudur ve sağ eli baskın olan bir cerrah için hayvanın yönelimini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
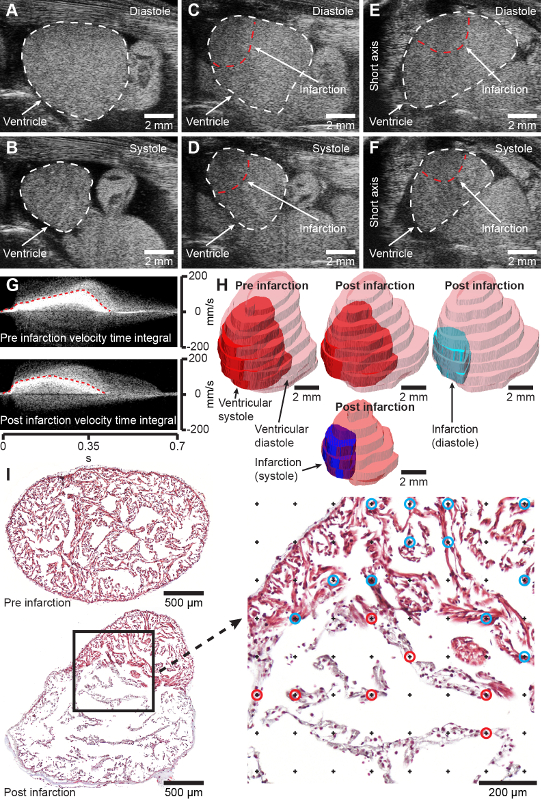
Şekil 2: Beklenen sonuçlar. A ve B, diyastol (A) ve sistolde (B) sağlıklı aksolotl ventrikülün B modu uzun eksen görüntüleri. C ve D, diyastol (C) ve sistolde (D) kriyoinyaralı (yaralanmadan 2 gün sonra) aksolotl ventrikülün B modu uzun eksen görüntüleri. E ve F, diyastol (E) ve sistolde (F) kriyoinjurlu (yaralanmadan 2 gün sonra) aksolotl ventrikülün B modu kısa eksen görüntüleri. G, Nabız dalgası Doppler, enfarktüslü kalp öncesi (üstte) ve 2 günlük sonrası (altta) hız zaman integrallerini elde etti. H, Üç boyutlu ultrason ediniminden enfarktüs öncesi ve 2 günlük enfarktüslü kalbin modellenmesi. Ben, aksolotl ventrikül boyunca temsili transversal histoloji kesitleri, sahte shamdan 4 gün sonra (üstte) ve enfarktüsten 7 gün sonra (altta) Masson Trikrom ile boyanmıştır. Sağdaki büyütme, enfarktüs fraksiyonunun stereolojik ölçümü için nokta ızgarasını gösterir. Mavi ve kırmızı dairelerle işaretlenmiş noktalar, sağlıklı (mavi daireler) ve enfarktüslü (kırmızı daireler) doku ile kesişimi temsil eder. Kranial A-D'de sağa doğru, hayvanlar ise E-F'de sağa doğru, ekokardiyografik görüntülerin geleneksel görüntüsünü temsil ediyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek materyal 1: Uzun eksen, sağlıklı ventrikül enfarktüs öncesi, B-modu (bkz. Şekil 2A-B). Bu videoyu indirmek için lütfen buraya tıklayın.
Ek materyal 2: Uzun eksen, enfarktüslü ventrikül (enfarktüsten 2 gün sonra), B-modu (bkz. Şekil 2C-D). Bu videoyu indirmek için lütfen buraya tıklayın.
Ek materyal 3: Kısa eksen ekseni, enfarktüslü ventrikül (enfarktüsten 2 gün sonra), B-modu (bkz. Şekil 2E-F). Bu videoyu indirmek için lütfen buraya tıklayın.
Ek materyal 4: Şekil 2AH'de görüldüğü gibi aynı kalbin üç boyutlu etkileşimli modelleri ve Enfarktüs öncesi ve sonrası ek materyal 1-3. Etkileşimli PDF dosyasını Adobe Acrobat Reader 9 veya sonraki bir sürümde başlatın. 3D özelliğini etkinleştirmek için modele tıklayın. İmleci kullanarak modeli döndürün, yakınlaştırın ve kaydırın. Ekranın sol tarafında yer alan model ağacında tüm segmentler aktif/pasif hale getirilebilir veya şeffaf hale getirilebilir. Model ağacı, açılabilen birkaç alt katman içeren bir hiyerarşi olarak oluşturulur (+ seçilerek). Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Deneysel varyasyonu en aza indirmek için, kriyoyaralanmanın cerrahi prosedürü steril prosedürleri takip etmeli ve hayvanları spesifik rejeneratif deneyler için kullanmaya çalışmadan önce birkaç hayvan üzerinde cerrahi eğitim yapılmalıdır. Eğitim ile kriyoyaralanma prosedürü, gençlerden (5 g, 7 cm) büyük yetişkinlere (100 g, 25 cm) kadar çok çeşitli aksolotl boyutları ve yaşları üzerinde gerçekleştirilebilir. Kriyoprobun yeterli bir boyuta sahip olması ve aksolotl ventriküle sağlam ve tekrarlanabilir bir kriyoyaralanma sağlamak için yeterince soğutulması çok önemlidir. Çok küçük hayvanlar için (5-8 g, 7-9 cm), kriyoprob daha küçük bir çapla yapılabilir. Kriyoyaralanma protokolünün benzokain ve MS-222 gibi analjezik özelliklere sahip bir anestezik kullanılarak (veya ikincil bir analjezik ajanın ek uygulamasıyla) yapılması zorunlu olsa da, takip ekokardiyografisi, aksolotl22'de benzokain ve MS-222'den daha az kardiyak fonksiyonu etkilediği tanımlanan propofol gibi sadece sınırlı analjezik özelliklere sahip diğer anesteziklerle yapılabilir.
Kriyoyaralanma prosedürü, insanlarda klinik miyokard enfarktüsü vakalarına daha çok benzeyen koroner arter ligasyonu prosedürleriyle aynı şekilde koroner arter tıkanıklığı ile iskemiye bağlı bir miyokard enfarktüsü oluşturmaması açısından sınırlıdır. Bununla birlikte, ligasyona dayalı yöntem, çok az koroner vaskülatür ve çoğunlukla luminal oksijen kaynağı olan trabeküle amfibi kalpte uygulanamaz. Ayrıca, kriyoyaralanmaya bağlı miyokard enfarktüsünün, iskemiye bağlı miyokard enfarktüslerinin patolojik sonuçlarının çoğunu özetlediği tanımlanmıştır14,16. Kriyoyaralanma ile oluşturulan yaralanma bölgesi, kriyoproba yakın dokuya yüksek oranda lokalizedir ve bu, koroner tıkanıklıktan kaynaklanan karmaşık ve dal benzeri bir enfarktüse benzemese de, sağlıklı ve enfarktüslü doku arasındaki sınır bölgesinin kolayca tanınabilmesi ve yeni oluşan kardiyomiyositlerin ilerlemesinin incelenebilmesi nedeniyle deneysel bir ortamda avantajlıdır.
Aksolotl, zebra balığından önemli ölçüde daha büyük bir hayvandır ve üç odacıktan (iki kulakçık, bir ventrikül) oluşan bir kalp ve anatomik olmasa da işlevsel bir kan akışının oksijenli ve oksijensiz akımlarda kan akışının ayrılması da dahil olmak üzere daha karmaşık bir kardiyovasküler sisteme sahiptir23 teleostlarda bulunan iki odacıklı kalp ve seri akış sistemine kıyasla. Zebra balığında daha önce tarif edilen kriyoyaralanma prosedürü, kesilen ventral yüzeyin ameliyat sonrası dikilmesini içermez16,17. Bu, kalbin hayvanın laboratuvar ortamındaki steril olmayan su ortamına gereksiz yere maruz kalmasını önlemek için aksolotlda gereklidir.
Enfarktüs fraksiyonunun çoğu kantitatif ölçümünün orta enfarktüs bölgesindeki histolojik kesit ve bazı durumlarda iki komşu bölüm üzerine çizim alanına dayandığı rejeneratif alanda tarafsız stereolojiye dayalı kantitatif histoloji şu anda yeterince rapor edilmemektedir24. Stereoloji kavramı, daha sağlam ve tarafsız ölçümler sağlamak için herhangi bir model türdeki histolojik incelemelerde uygulanabileceğinden, bu ücretsiz olarak kullanılabilen yöntemin sadece aksolotlda değil, tüm rejeneratif türlerde kalp rejenerasyonunun kantitatif değerlendirmelerine dahil edilmesini öneriyoruz.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Casper Bindzus Foldager, Asger Andersen ve Michael Pedersen'e (tümü Aarhus Üniversitesi Klinik Tıp Bölümü'nde) ve David Gardiner'e (Gelişim ve Hücre Biyolojisi Bölümü, Kaliforniya Üniversitesi, Irvine) aksolotl kriyoyaralanma modelinin ilk geliştirilmesi ve ultrason muayenesinde yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
Referanslar
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -. G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503 (2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089 (2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır