Method Article
Regeneração cardíaca induzida por criolesão no axolote e ecocardiografia e histologia quantitativa imparcial para avaliar a progressão regenerativa
Neste Artigo
Resumo
Aqui apresentamos um protocolo cirúrgico para induzir crioleferimento ao miocárdio ventricular do axolote. Além disso, apresentamos um protocolo para estimar de forma não invasiva a fração de infarto durante o processo regenerativo com ecocardiografia e um protocolo para medir com precisão a fração de infarto no coração excisado com histologia quantitativa imparcial.
Resumo
Os anfíbios urodele, salamandras e tritões, representam o grupo filogenético mais próximo dos mamíferos capazes de realizar a regeneração miocárdica completa após a ressecção ventricular. O modelo de ressecção gerou um conhecimento básico dos processos envolvidos no reparo cardíaco. No entanto, o modelo não se relaciona bem com situações clínicas em que danos teciduais, apoptose, necrose, fibrose e hipertrofia são as principais consequências prejudiciais dos infartos do miocárdio induzidos por isquemia, em vez da remoção do tecido. Por outro lado, o infarto do miocárdio induzido por crioletoma se assemelha mais ao infarto do miocárdio induzido por isquemia. Aqui fornecemos uma descrição detalhada do procedimento de criolesão no axolote (Ambystoma mexicanum), que fornece uma ferramenta para investigar mecanismos básicos no reparo cardíaco em um modelo de tetrápode. Além disso, fornecemos métodos quantitativos para estimar o tamanho do infarto de forma não invasiva in vivo com ecocardiografia e para medir o tamanho do infarto com precisão com histologia quantitativa imparcial ex vivo.
Introdução
A doença isquêmica do coração é uma das principais causas de fatalidades em todo o mundo 1,2. O infarto do miocárdio induzido por isquemia resulta em morte celular generalizada nos cardiomiócitos3. Embora a intervenção médica rápida possa reduzir o risco de morte imediata, a resposta fibrótica resultante que os humanos compartilham com os animais modelo tradicionais de mamíferos (camundongo, rato, coelho, porco, etc.) resulta na formação de tecido cicatricial que pode levar à hipertrofia cardíaca, arritmias e insuficiência cardíaca4. Ao contrário dos mamíferos, a regeneração cardíaca está bem estabelecida em alguns modelos animais não amniônicos, como o peixe-zebra5 e as salamandras6. Tradicionalmente, a regeneração cardíaca tem sido estudada nessas espécies após ressecção ventricular parcial ou pinçamento 5,6,7,8,9,10. No entanto, em 2011, três grupos desenvolveram independentemente uma técnica de infarto do miocárdio induzido por criolesão em peixe-zebra 11,12,13. A técnica de crioleferimento resulta em necrose e apoptose na maior parte do ventrículo cardíaco do peixe-zebra e um acúmulo inicial de tecido fibrótico que modela mais de perto o desenvolvimento patológico do coração de mamíferos após infarto isquêmico em comparação com a ressecção ventricular 11,12,13. Além disso, comparações metodológicas do infarto do miocárdio induzido por criolesão com o infarto do miocárdio induzido por isquemia por ligadura da artéria coronária no camundongo e no porco provaram que a técnica de crioleferimento é uma alternativa útil em modelos animais de mamíferos14,15. Inspirados nos métodos envolvidos no modelo de criolesão do peixe-zebra16,17 desenvolvemos um modelo semelhante no axolote18, um anfíbio conhecido por suas capacidades regenerativas19, que permite a investigação dos mecanismos envolvidos no reparo cardíaco neste tetrápode após dano tecidual em vez de remoção de tecido.
Aqui apresentamos um protocolo detalhado sobre como realizar o infarto do miocárdio induzido por criolesão no axolote. Damos ênfase especial a etapas cruciais rápidas e minimamente invasivas que aumentam a sobrevida, a recuperação e a reprodutibilidade experimental. Além disso, fornecemos instruções para técnicas apropriadas para avaliar a regeneração anatômica in vivo usando ecocardiografia e ex vivo usando histologia quantitativa baseada em estereologia imparcial.
O infarto do miocárdio induzido por criolesão no axolote pode ser aplicado para investigar os mecanismos básicos envolvidos na regeneração miocárdica neste tetrápode. O axolote é tolerante ao infarto do miocárdio induzido por criolesão, que afeta pelo menos 45% do ventrículo, resultando em uma diminuição no volume sistólico e no débito cardíaco sem nenhuma alteração comportamental em seu estilo de vida relativamente lânguido, no entanto, lesões mais graves levarão potencialmente à diminuição da saúde animal.
Em suma, para induzir a criolesão, é feita uma incisão ventral no tórax de um axolote anestesiado. O ventrículo é acessado por meio de dissecção romba e uma criossonda pré-resfriada é aplicada por 10 s para induzir a criolesão. A incisão ventral é suturada e o animal se recupera rapidamente, sem sinais de alterações comportamentais após a recuperação da consciência. Os animais de controlo/simulados recebem tratamento semelhante, mas são submetidos a uma criossonda não arrefecida. O desempenho cardíaco pode ser monitorado por meio de ecocardiografia (são necessários sistemas de ultrassom de alta frequência, ≥20 MHz), conforme descrito exaustivamente em corações saudáveis de axolotes anteriormente20, e a fração de infarto pode ser estimada de forma não invasiva e repetida durante o processo regenerativo. Os corações infartados podem ser colhidos a qualquer momento durante o processo regenerativo de 3 meses, criosseccionados para histologia e corados usando procedimentos padrão (por exemplo, eosina e hematoxilina ou coloração tricrômica de Masson). Em particular, a coloração tricrômica de Masson permite uma distinção clara entre partes infartadas e saudáveis do ventrículo. A fração de infarto do ventrículo é determinada por meio de técnicas estereológicas previamente descritas para estudos cardíacos21.
Protocolo
Este protocolo está em conformidade com todos os regulamentos e diretrizes institucionais (Universidade de Aarhus) e nacionais (protocolo da Inspetoria Nacional de Experimentos com Animais da Dinamarca # 2015−15−0201−00615) de cuidados com animais.
1. Preparação da criossonda
- Corte três fios de fio de cobre com 1 mm de diâmetro em pedaços de 10 cm.
- Enrole os fios de cobre em uma corda.
- Com uma tocha a gás, derreta uma extremidade do fio de cobre para formar uma extremidade esférica com 2 mm de diâmetro.
NOTA: O cobre tem uma alta condutividade térmica (401 W m-1 K-1 a 0 °C) e pode ser moldado em temperaturas facilmente gerenciáveis (ponto de fusão 1084,6 °C), mas uma superfície de cobre tende a corroer com o tempo, especialmente se entrar em contato com o sangue, o que reduz significativamente a condutividade térmica. Assim, uma criossonda à base de cobre deve ser polida ocasionalmente. Metais alternativos mais estáveis que também podem ser usados para criogravias são prata (condutividade térmica 428 W m-1 K-1 a 0 ° C, ponto de fusão 961,8 ° C) e ouro (condutividade térmica 318 W m-1 K-1 a 0 ° C, ponto de fusão 1064,2 ° C). - Remova o pistão de uma seringa de 2 mL e retire a cabeça de borracha macia.
- Insira a extremidade não esférica do fio de cobre através da seringa e amarre-a à pistola
- Coloque o pistão de volta no lugar na seringa (Figura 1A).
NOTA: Quando a criossonda não estiver em uso, a corda de cobre deve ser protegida puxando o pistão totalmente para trás. Quando em uso, o pistão é empurrado totalmente para dentro para expor a corda de cobre ao banho de resfriamento.
2. Infarto do miocárdio induzido por criolesão
- Anestesie o axolote imergindo-o em 200 mg/L de anestésico benzocaína. Trinta minutos de imersão renderão ~ 2,5 h de anestesia completa.
NOTA: A benzocaína é insolúvel em água e deve primeiro ser solubilizada em 3 mL (por 200 mg de benzocaína) de acetona que é posteriormente adicionada ao banho-maria. A imersão prolongada em benzocaína pode prejudicar a recuperação, portanto, o tempo em benzocaína deve ser monitorado cuidadosamente. - Coloque o axolote com o lado ventral para cima em um prato de cirurgia (cabeça para a esquerda para um cirurgião destro). Imobilize envolvendo todas as partes do corpo, exceto o tórax, em lenços umedecidos em solução anestésica (Figura 1B).
NOTA: Envolver o animal em lenços umedecidos garante um ambiente úmido crucial para um anfíbio aquático e elimina a necessidade de pomada veterinária nos olhos. Use instrumentos autoclavados nas etapas subsequentes para garantir a esterilidade durante a cirurgia. - Use uma tesoura de iridectomia para fazer uma incisão longitudinal de ~ 1 cm na pele ligeiramente até a linha média do tórax (Figura 1C).
- Use uma pinça para liberar as placas de cartilagem da cintura peitoral.
NOTA: A cintura peitoral é uma estrutura delicada e deve-se tomar cuidado para não danificar seus elementos, pois isso pode prejudicar a cicatrização posterior de feridas e a locomoção e bem-estar dos animais. - Abra suavemente o pericárdio exposto com uma incisão sem danificar as estruturas cardíacas subjacentes. Antes que o fluido pericárdico vaze, aspire-o para uma seringa de 1 mL carregando uma agulha romba de calibre 2 (Figura 1D).
- Coloque uma pinça romba com uma abertura definida (~ 1 cm) na ferida para manter as bordas da ferida e as placas de cartilagem separadas (Figura 1E).
- Coloque a criossonda no líquido N2 com o fio de cobre exposto por pelo menos 2 minutos.
NOTA: Se a massa do fio de cobre for muito pequena (ou seja, muito curta) ou se for resfriado de forma insuficiente, pode ocorrer uma criolesão transmural indesejável incompleta. - Limpe suavemente o ventrículo exposto com um cotonete ou lenços de tecido firmemente enrolados para garantir que nenhum fluido esteja presente na superfície do ventrículo ( Figura 1F ).
- Remover a criossonda arrefecida a -196 °C do líquido N2 e aplicá-la directamente no ventrículo exposto (figura 1H). Ele se ligará ao ventrículo. A colocação da criossonda deve ser feita no lado lateral do ventrículo em direção ao ápice para evitar danos a outras estruturas cardíacas e permitir cortes transversais subsequentes para microscopia contendo miocárdio saudável e infartado. Após 10 s, aplique o líquido pericárdico previamente coletado na ponta da criossonda (Figura 1I). Isso descongelará a sonda e permitirá o descolamento do ventrículo.
NOTA: A aplicação da criossonda em um ventrículo com água excessiva resulta em crioinfarto incompleto, se a sonda for aquecida muito rapidamente, ou dano miocárdico muito extenso, se uma fina camada de água cobrindo toda a superfície do ventrículo for congelada instantaneamente. Nenhuma das situações é desejável. No caso de uma indução bem-sucedida de criolesão, um pequeno inchaço circular vermelho aparecerá no ventrículo (Figura 1J). Ao manusear animais simulados, uma criosonda não arrefecida é colocada de forma semelhante durante 10 s (figura 1G). - Coloque o pericárdio no topo do ventrículo, remova a pinça que mantinha a ferida aberta e reorganize as placas de cartilagem da cintura peitoral.
NOTA: Se realizar ecocardiografia subsequente para avaliar a função cardíaca, é crucial que todas as bolsas de ar, mesmo bolhas minúsculas que são propensas a ocorrer sob as placas de cartilagem, sejam removidas, pois induzem artefatos de imagem. Essas bolhas podem ser removidas pressionando suavemente o tecido ou adicionando solução de Ringer anfíbio autoclavada (6,6 g/L de NaCl, 0,15 g/L de KCl, 0,15 g/L de CaCl2, 0,2 g/L de NaHCO3 em água destilada) à superfície da ferida para dissolver as bolhas de ar. - Suturar a pele (3-5 pontos) com fio solúvel (6-0) (Figura 1K).
- Cubra a área da cirurgia com lenços umedecidos levantados acima da ferida e depois mergulhe com solução anestésica.
- Coloque a placa de cirurgia com o animal no gelo por 2 h para permitir a formação inicial de uma epiderme da ferida, selando as bordas da ferida antes que o animal seja exposto ao seu ambiente aquático não estéril.
- Transfira o animal para um recipiente limpo com água do aquário. O animal deve estar recuperando a consciência a essa altura. Observe o animal até que ele recupere a consciência plena e os movimentos coordenados. Interrompa a alimentação e a troca de água por dois dias após a cirurgia e mantenha o axolote sozinho em seu próprio aquário para permitir o fechamento da ferida antes que os distúrbios sejam reintroduzidos.
NOTA: Depois de recuperar a consciência, a maioria dos axolotes tem o desejo de engolir ar. Para facilitar esse processo e limitar a quantidade de movimento necessária, pode ser benéfico baixar o nível da água no aquário logo após a cirurgia por 1-2 dias após a cirurgia. Uma baixa concentração de benzocaína (20 mg/L) pode ser usada como analgésico por 24 horas após a cirurgia.
3. Medição não invasiva da fração de infarto com ecocardiografia
- Anestesiar o axolote conforme descrito na etapa 2.1.
- Coloque o animal em decúbito dorsal em um pequeno recipiente com 3-5 mm de solução anestésica cobrindo a superfície ventral.
- Coloque o transdutor de ultrassom ao longo do eixo longo do animal ligeiramente à direita da linha média da região torácica.
- Para uma estimativa bidimensional da fração de infarto [IF(ultrassom, 2D)], translade o transdutor até que a zona de infarto e o ventrículo apareçam máximos no modo B (Figura 2A-D, Material Suplementar 1-2).
- Adquira ≥3 ciclos cardíacos com > 50 quadros/s.
- Meça a área da secção transversal do ventrículo (CSAv) e da zona de infarto (CSAi) no final da diástole e estime a fração de infarto bidimensional assumindo uma forma de ventrículo esférico e uma forma de zona de infarto hemisférica usando a equação:
 (1)
(1)
NOTA: Para avaliar as suposições geométricas da forma do ventrículo e da zona de infração, o transdutor pode ser girado 90° para exibir a visão do eixo curto do coração (Figura 2EF, Material Suplementar 3). - Para uma estimativa tridimensional da fração de infarto, posicione o transdutor à esquerda ou à direita até que apenas uma pequena porção do ventrículo apareça à vista no final da diástole ventricular.
- Em passos (z) de 0,5 mm (para animais pequenos, massa corporal ≤ 20 g) ou 1 mm (animais grandes, massa corporal > 20 g) mova o transdutor através do ventrículo e adquira pelo menos 3 ciclos cardíacos por passo/corte.
NOTA: Para uma precisão razoável, 8 – 12 fatias (n) devem ser adquiridas. - Meça CSAv e CSAi no final da diástole para cada fatia (j) e estime a fração de infarto tridimensional [IF (ultrassom, 3D)] sem quaisquer suposições geométricas do ventrículo e da forma da infração usando a equação:
 (2)
(2)
NOTA: Tanto a aquisição bidimensional quanto a tridimensional podem ser usadas para medir a função cardíaca (volume sistólico e débito cardíaco) geometricamente, conforme descrito nas seções 3 e 6 de Dittrich et al. (2018)20. Da mesma forma, as integrais de tempo de velocidade adquirida pela velocidade de onda pulsada (Figura 2G) também podem ser usadas para medir a função cardíaca, conforme descrito na seção 3 em Dittrich et al. (2018)20. - Extraia as regiões de interesse de CSAv e CSAi desenhados na etapa 3.9 como máscaras binárias com espaçamento z entre fatias para modelar tridimensionalmente a zona de ventrículo e infarto na diástole final e na sístole final (Figura 2H, Material Suplementar 4).
4. Histologia quantitativa imparcial para medir a fração de infarto
- Explore o coração de um axolote anestesiado descrito na etapa 2.2 – 2.6.
- Usando uma seringa de 1 mL equipada com uma agulha de calibre 26, injete lentamente 5 μL/g de massa corporal de 1000 UI/mL de solução de Ringer de anfíbio heparinizada no seio venoso e aguarde 2 minutos para que o anticoagulante se distribua na circulação.
- Eutanasiar por decapitação e biking cerebral e extirpar todo o coração cortando primeiro os vasos de entrada e depois o trato de saída.
- Transferir o coração levantando-o suavemente pela via de saída para uma placa de Petri de 60 × 15 mm2 contendo solução de Ringer para anfíbios.
- Sob ampliação, lave qualquer sangue restante no coração preenchendo suavemente o seio venoso com 100 UI / mL de solução de Ringer heparinizada.
NOTA: Embora a pré-fixação do coração possa ser realizada perfundindo o coração com formalina tamponada ou paraformaldeído, isso não é necessário, pois a secção é realizada a uma temperatura de congelamento. Posteriormente, a fixação das seções em lâminas de vidro pode ser realizada. Um coração totalmente lavado parecerá pálido e esbranquiçado e não conterá vestígios de glóbulos vermelhos. É provável que se formem pequenos coágulos sanguíneos na superfície do ventrículo e dos átrios. Eles não afetam a precisão no procedimento histológico quantitativo subsequente. - Transfira o coração para um lenço de papel sem fiapos para secar por 1 min.
- Prepare um criomold de tamanho adequado aplicando uma única gota de composto de temperatura de corte ideal e transfira o coração para a gota. Aperte o coração suavemente até o fundo.
- Aplique um composto de temperatura de corte mais ideal para encher o criomold e certifique-se de que o ventrículo permaneça no fundo. Deixe o molde por 5 min para permitir que o composto de temperatura de corte ideal seja distribuído na amostra.
- Congele o molde colocando-o em uma tampa de uma caixa de ponta de pipeta flutuando em nitrogênio líquido.
NOTA: Para um congelamento instantâneo mais controlado, os corações podem ser armazenados por 1 h durante a noite em solução de sacarose a 10-30% e o congelamento instantâneo pode ser realizado usando isopentano (2-metilbutano) resfriado com nitrogênio líquido. Em nossa experiência, o resultado final não é marcadamente diferente. - Temperar o criosto num criostato regulado para -18 a -22 °C durante pelo menos 1 h antes de seccionar.
- Corte a amostra com espessura de fatia de 10 μm e colete a cada 10fatias para fornecer uma espessura de laje (t) de 100 μm. Continue seccionando até que todo o coração esteja seccionado.
NOTA: Diferentes espessuras de fatia e placa podem ser usadas, no entanto, é importante que a coleta da fatia comece no ponto exato em que a lâmina toca o ventrículo e que todo o coração seja seccionado com pelo menos 10-12 placas uniformemente espaçadas. Mais de uma fatia por laje pode ser coletada para fornecer conjuntos duplicados. - Manchar seções de tecido com protocolos padrão para hematoxilina e eosina ou tricrômico de Masson para fornecer uma distinção clara entre epicárdio, miocárdio, válvulas e zona de infarto.
- Digitalize a seção de tecidos usando um microscópio de câmera ou scanner de lâminas com ampliação suficiente para revelar claramente a estrutura trabeculada do ventrículo axolote (Figura 2I).
- Carregue a pilha de imagens no ImageJ (https://imagej.nih.gov/ij/index.html) e inicialize o plug-in do contador de células (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Execute uma macro de grade multiuso (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) e gere uma grade de pontos com uma densidade de grade adequada.
NOTA: A densidade da grade (área da grade) depende do tamanho e da morfologia da amostra. Para fornecer uma precisão desejável, pelo menos 100-200 interseções de pontos de grade e cada uma das estruturas de interesse devem ser asseguradas. - Conte o número de interseções entre a grade de pontos e as estruturas de interesse usando o plug-in do contador de células (Figura 2I, ampliação à direita).
NOTA: É importante para a precisão incluir apenas as interseções que aparecem precisamente no ponto de mira da mira. - Calcular a fração de enfarte a partir da área da grelha de pontos predefinida [Ai(p) e Av(p)], a espessura da placa e o número de intersecções da grelha de pontos em cada placa (Pj) com miocárdio enfretado e miocárdio ventricular total utilizando a fórmula:
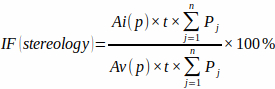 (3)
(3)
Resultados
Em axolotes com massa corporal de 11,8 ± 1,3 g e comprimento total de 11,8 ± 0,5 cm, o procedimento de criolesão realizado com uma criossonda de 2 mm (diâmetro) resulta em uma área infartada cobrindo 45,4 ± 14,2% do miocárdio ventricular 7 dias após a lesão em que a zona de infarto está totalmente desenvolvida [Figura 2I, compare a seção do coração saudável pré-infração (topo) e 7 dias após a infração (abaixo)]. O procedimento tem uma taxa de mortalidade de 2,2% (2/90 animais). O procedimento resulta em uma zona de lesão bem definida que pode ser visualizada, quantificada e modelada com ecocardiografia não invasiva (Figura 2CH, Material suplementar 1-4). Inicialmente, o infarto do miocárdio induzido por criolesão afeta significativamente a função cardíaca, reduzindo o volume sistólico para 62,2% e o débito cardíaco para 73,9% em 7 dias após a lesão em relação à pré-lesão, com uma recuperação gradual da forma e da função ao longo de três meses (dados não mostrados). Nenhuma alteração comportamental após a criolesia miocárdica é observada no axolote relativamente tranquilo.
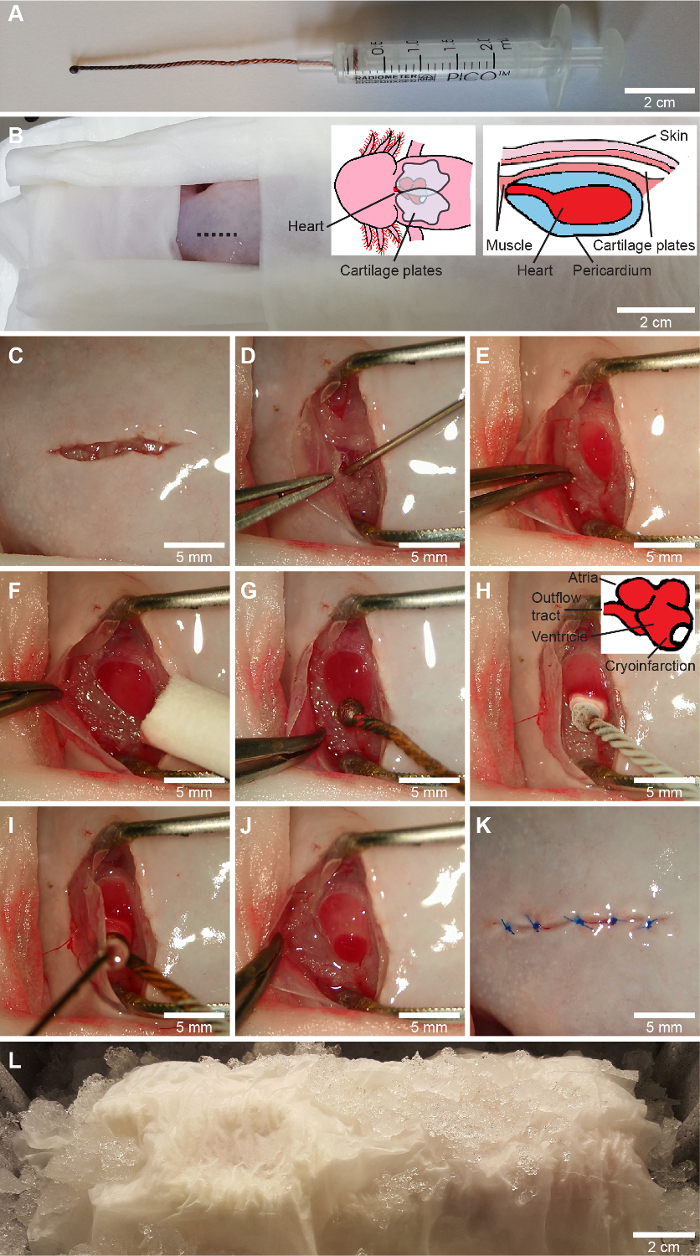
Figura 1: Procedimento de crioinfarto. A, uma criossonda personalizada é feita enrolando três fios de cobre, derretendo a ponta em uma esfera e prendendo o fio ao pistão de uma seringa de 2,5 mL. B-L, o procedimento de crioinfarto. Após o envoltório de todas as partes do corpo, exceto a zona de cirurgia em lenços umedecidos (B), uma incisão ventral no tórax ligeiramente à direita da linha média (mostrada em B) é realizada com tesoura de iridectomia (C), e a cintura peitoral é liberada por dissecção do coto. O pericárdio é aberto suavemente com uma incisão e o líquido pericárdico é aspirado para uma seringa de 1 mL usando uma agulha romba de calibre 23 (D). O ventrículo é exposto e a ferida é mantida aberta com uma pinça com uma largura de abertura predefinida (E) e qualquer fluido remanescente no ventrículo é limpo (F). Para cirurgia simulada, uma criossonda não resfriada (G) é aplicada da mesma forma que para criolesão, na qual a criossonda resfriada em nitrogênio líquido (-196 °C) é aplicada na parede lateral do ventrículo em direção ao ápice (H). Após 10 s, o líquido pericárdico é reaplicado na criossonda para liberá-lo do ventrículo (I). Isso produz uma zona de crioleferimento claramente definida (J). Finalmente, o pericárdio e a cintura peitoral são colocados no topo do coração e a pele é suturada (3-5 pontos) com uma sutura solúvel (K). O animal é deixado no gelo por 2 horas para iniciar o processo de cicatrização da ferida (L). Cranial está voltado para a esquerda em B-L, representando a orientação do animal para um cirurgião com a mão direita dominante. Clique aqui para ver uma versão maior desta figura.
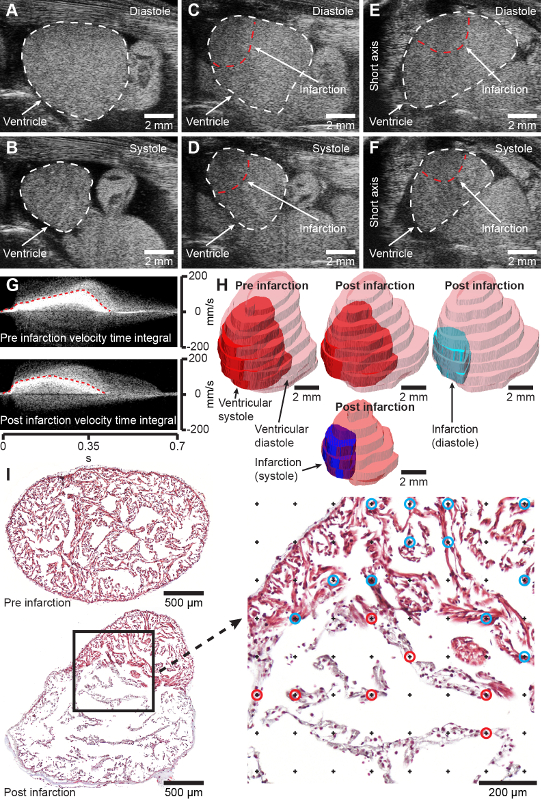
Figura 2: Resultados antecipados. A e B, imagens de eixo longo modo B do ventrículo axolote saudável em diástole (A) e sístole (B). C e D, imagens de eixo longo modo B do ventrículo axolote criolesionado (2 dias após a lesão) em diástole (C) e sístole (D). E e F, imagens de eixo curto modo B do ventrículo axolote criolesionado (2 dias após a lesão) em diástole (E) e sístole (F). G, o Doppler de onda de pulso adquiriu integrais de tempo de velocidade do coração pré (superior) e pós-infartado de 2 dias (inferior). H, Modelagem do coração pré-infarto e pós-infarto de 2 dias a partir da aquisição de ultrassom tridimensional. I, cortes histológicos transversais representativos através do ventrículo axolote 4 dias pós-sham (superior) e 7 dias pós-infarto (inferior) corados com tricrômico de Masson. A ampliação à direita mostra a grade de pontos para medição estereológica da fração de infarto. Os pontos marcados por círculos azuis e vermelhos representam a interseção com tecido saudável (círculos azuis) e infartado (círculos vermelhos). Cranial está para a direita em AD e animais à direita está para a esquerda em EF, que representa a exibição convencional de imagens ecocardiográficas. Clique aqui para ver uma versão maior desta figura.
Material suplementar 1: Eixo longo, pré-infarto do ventrículo saudável, modo B (ver Figura 2AB). Clique aqui para baixar este vídeo.
Material suplementar 2: Eixo longo, ventrículo infartado (2 dias após o infarto), modo B (ver Figura 2C-D). Clique aqui para baixar este vídeo.
Material suplementar 3: Eixo do eixo curto, ventrículo infartado (2 dias após o infarto), modo B (ver Figura 2E-F). Clique aqui para baixar este vídeo.
Material suplementar 4: Modelos interativos tridimensionais do mesmo coração, como visto na Figura 2AH e Material suplementar 1-3 pré e pós-infarto. Inicie o arquivo PDF interativo no Adobe Acrobat Reader 9 ou superior. Clique no modelo para ativar o recurso 3D. Gire, amplie e mova o modelo usando o cursor. Na árvore de modelo do lado esquerdo da tela, todos os segmentos podem ser ativados/desativados ou tornados transparentes. A árvore do modelo é construída como uma hierarquia que contém várias subcamadas que podem ser abertas (selecionando +). Clique aqui para baixar este arquivo.
Discussão
Para minimizar a variação experimental, o procedimento cirúrgico da criolesão deve seguir procedimentos estéreis e o treinamento cirúrgico deve ser realizado em vários animais antes de tentar usar animais para experimentos regenerativos específicos. Com treinamento, o procedimento de criolesão pode ser realizado em uma grande variedade de tamanhos e idades de axolotes, desde juvenis (5 g, 7 cm) até adultos grandes (100 g, 25 cm). É fundamental que a criossonda tenha um tamanho suficiente e seja resfriada adequadamente para fornecer uma criolesão robusta e repetível ao ventrículo do axolote. Para animais muito pequenos (5-8 g, 7-9 cm), a criossonda pode ser construída com um diâmetro menor. Embora seja imperativo que o protocolo de crioleferimento seja realizado com um anestésico com propriedades analgésicas como benzocaína e MS-222 (ou com a aplicação adicional de um agente analgésico secundário), a ecocardiografia de acompanhamento pode ser realizada com outros anestésicos com propriedades analgésicas limitadas, como o propofol, que foi descrito como afetando menos a função cardíaca do que a benzocaína e o MS-222 no axolote22.
O procedimento de criolesão é limitado no sentido de que não produz um infarto do miocárdio induzido por isquemia por oclusão da artéria coronária da mesma maneira que os procedimentos de ligadura da artéria coronária que se assemelham mais aos casos clínicos de infarto do miocárdio em humanos. No entanto, o método baseado em ligadura não é aplicável no coração de anfíbios trabeculados com muito pouca vasculatura coronária e um suprimento de oxigênio principalmente luminal. Além disso, o infarto do miocárdio induzido por crioleferimento tem sido descrito para recapitular a maioria das consequências patológicas dos infartos do miocárdio induzidos por isquemia14,16. A zona de lesão gerada pela criolesão é altamente localizada no tecido próximo à criossonda e, embora não se assemelhe a um infarto complexo e ramificado resultante de bloqueio coronariano, é vantajosa em um ambiente experimental, pois a zona de fronteira entre o tecido saudável e o infartado pode ser facilmente reconhecida e a progressão de cardiomiócitos recém-formados pode ser estudada.
O axolote é um animal consideravelmente maior do que o peixe-zebra com um sistema cardiovascular mais complicado, incluindo um coração que consiste em três câmaras (dois átrios, um ventrículo) e uma separação funcional, embora não anatômica, do fluxo sanguíneo em correntes oxigenadas e desoxigenadas23 em comparação com o coração de duas câmaras e o sistema de fluxo serial encontrado em teleósteos. O procedimento de criolesão descrito anteriormente no peixe-zebra não envolve a sutura pós-operatória da superfície ventral incisada16,17. Isso é necessário no axolote para evitar a exposição desnecessária do coração ao ambiente aquático não estéril no habitat de laboratório do animal.
A histologia quantitativa baseada em estereologia imparcial é atualmente subnotificada no campo regenerativo, no qual a maioria das medições quantitativas da fração de infarto depende da área desenhada na seção histológica na zona média do infarto e, em alguns casos, em duas seções vizinhas24. Uma vez que o conceito de estereologia pode ser aplicado em exames histológicos em qualquer espécie modelo para fornecer medidas mais robustas e imparciais, propomos que este método disponível gratuitamente seja incorporado em avaliações quantitativas da regeneração cardíaca não apenas no axolote, mas em todas as espécies regenerativas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Gostaríamos de agradecer a Casper Bindzus Foldager, Asger Andersen e Michael Pedersen (todos do Departamento de Medicina Clínica da Universidade de Aarhus) e David Gardiner (Departamento de Biologia Celular e do Desenvolvimento, Universidade da Califórnia, Irvine) pela ajuda no desenvolvimento inicial do modelo de criolesão de axolote e exame de ultrassom.
Materiais
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
Referências
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -. G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503 (2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089 (2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados