Method Article
Индуцированная криотравмой регенерация сердца в аксолотле и эхокардиография и несмещенная количественная гистология для оценки регенеративного прогрессирования
В этой статье
Резюме
Здесь мы представляем протокол хирургического вмешательства для индуцирования криоповреждения миокарда желудочков аксолотля. Кроме того, мы представляем протокол для неинвазивной оценки фракции инфаркта во время регенеративного процесса с помощью эхокардиографии и протокол для точного измерения фракции инфаркта в удаленном сердце с несмещенной количественной гистологией.
Аннотация
Амфибии уроделе, саламандры и тритоны, представляют собой филогенетическую группу, наиболее близкую к млекопитающим, способным осуществлять полную регенерацию миокарда после резекции желудочков. Модель резекции позволила получить базовые знания о процессах, связанных с восстановлением сердца. Тем не менее, модель не очень хорошо соотносится с клиническими ситуациями, в которых повреждение тканей, апоптоз, некроз, фиброз и гипертрофия являются ключевыми пагубными последствиями инфаркта миокарда, вызванного ишемией, а не удаления ткани. С другой стороны, инфаркт миокарда, вызванный криотравмой, больше похож на инфаркт миокарда, вызванный ишемией. Здесь мы приводим подробное описание процедуры криотравмы у аксолотля (Ambystoma mexicanum), которая предоставляет инструмент для исследования основных механизмов восстановления сердца в модели четвероногих. Кроме того, мы предлагаем количественные методы для неинвазивной оценки размера инфаркта in vivo с помощью эхокардиографии и для точного измерения размера инфаркта с помощью несмещенной количественной гистологии ex vivo.
Введение
Ишемическая болезнь сердца является одной из основных причин смертельных исходов во всем мире 1,2. Инфаркт миокарда, вызванный ишемией, приводит к широко распространенной гибели клеток кардиомиоцитов3. Хотя быстрое медицинское вмешательство может снизить риск немедленной смерти, последующая фиброзная реакция, которую люди разделяют с традиционными млекопитающими модельными животными (мышь, крысы, кролики, свиньи и т. д.), приводит к образованию рубцовой ткани, что в конечном итоге может привести к сердечной гипертрофии, аритмии и сердечной недостаточности. В отличие от млекопитающих, регенерация сердца хорошо известна у некоторых неамнионных животных моделей, таких как рыбкиданио-5 и саламандры-6. Традиционно у этих видов изучалась регенерация сердца после частичной резекции желудочков или защемления 5,6,7,8,9,10. Тем не менее, в 2011 году три группы независимо друг от друга разработали технику инфаркта миокарда, вызванного криотравмой, у рыбок данио-рерио 11,12,13. Техника криоповреждения приводит к некрозу и апоптозу в значительной части желудочка сердца рыбок данио-рерио и первоначальному накоплению фиброзной ткани, что более точно моделирует патологическое развитие сердца млекопитающих после ишемического инфаркта по сравнению с резекцией желудочков 11,12,13 . Кроме того, методологические сравнения инфаркта миокарда, вызванного криотравмой, с инфарктом миокарда, вызванным ишемией, путем лигирования коронарных артерий у мышей и свиньи доказали, что метод криотравмы является полезной альтернативой на моделях животных млекопитающих14,15. Вдохновленные методами, использованными в модели криотравмы рыбок данио16,17, мы разработали аналогичную модель у аксолотля18, амфибии, известной своими регенеративнымиспособностями19, которая позволяет исследовать механизмы, участвующие в восстановлении сердца у этого четвероногого после повреждения тканей, а не их удаления.
Здесь мы представляем подробный протокол о том, как выполнять инфаркт миокарда, индуцированный криотравмой, в аксолотле. Мы уделяем особое внимание быстрым и минимально инвазивным критически важным этапам, которые повышают выживаемость, восстановление и воспроизводимость экспериментов. Кроме того, мы предоставляем инструкции по соответствующим методам оценки анатомической регенерации in vivo с использованием эхокардиографии и ex vivo с использованием непредвзятой количественной гистологии, основанной на стереологии.
Инфаркт миокарда, вызванный криотравмой, у аксолотля может быть применен для изучения основных механизмов, участвующих в регенерации миокарда у этого четвероногого. Аксолотль толерантн к инфаркту миокарда, вызванному криотравмой, который поражает не менее 45% желудочка, что приводит к уменьшению ударного объема и сердечного выброса без каких-либо поведенческих изменений в его относительно вялом образе жизни, однако более тяжелые травмы потенциально приведут к ухудшению здоровья животных.
Короче говоря, чтобы вызвать криотравму, делается вентральный разрез на грудной клетке аксолотля, находящегося под наркозом. Доступ к желудочку осуществляется с помощью тупой диссекции и на 10 с применяется предварительно охлажденный криозонд для индуцирования криоповреждения. Вентральный разрез зашивается, и животное быстро восстанавливается без признаков поведенческих изменений после того, как приходит в сознание. Контрольные/фиктивные животные получают аналогичное лечение, но испытывают неохлажденный криозонд. Сердечная деятельность может контролироваться с помощью эхокардиографии (необходимы высокочастотные ультразвуковые системы, ≥20 МГц), как исчерпывающе описано на здоровых сердцах аксолотлей ранее20, а фракция инфаркта может быть оценена неинвазивно и многократно в течение регенеративного процесса. Инфарктированное сердце может быть собрано в любое время в течение 3-месячного регенеративного процесса, криосекировано для гистологии и окрашено с использованием стандартных процедур (например, эозина и гематоксилина или трихромного окрашивания Массона). В частности, трихромное окрашивание по Массону позволяет провести четкое различие между инфарктированными и здоровыми частями желудочка. Фракцию инфаркта желудочка определяют с помощью рентгенологических методик, описанных ранее для кардиологических исследований21.
протокол
Этот протокол соответствует всем институциональным (Орхусский университет) и национальным (протокол Датской национальной инспекции по экспериментам на животных # 2015−15−0201−00615) правилам и рекомендациям по уходу за животными.
1. Подготовка криозонда
- Разрежьте три пряди медной проволоки диаметром 1 мм на кусочки по 10 см.
- Сверните медные пряди в одну струну.
- С помощью газовой горелки расплавьте один конец медной струны до образования сферического конца диаметром 2 мм.
ПРИМЕЧАНИЕ: Медь обладает высокой теплопроводностью (401 Вт м-1 K-1 при 0 °C) и может быть отлита при легко контролируемых температурах (температура плавления 1084,6 °C), но медная поверхность имеет тенденцию к коррозии с течением времени, особенно при контакте с кровью, что заметно снижает теплопроводность. Таким образом, криозонд на основе меди необходимо время от времени полировать. Альтернативными более стабильными металлами, которые также могут быть использованы для криозондов, являются серебро (теплопроводность 428 Вт м-1 К-1 при 0 °С, температура плавления 961,8 °С) и золото (теплопроводность 318 Вт м-1 К-1 при 0 °С, температура плавления 1064,2 °С). - Извлеките поршень из шприца объемом 2 мл и снимите мягкую резиновую головку.
- Вставьте несферический конец медной нити через шприц и привяжите его к пистолету
- Установите поршень обратно в шприц (рисунок 1A).
ПРИМЕЧАНИЕ: Когда криозонд не используется, медную нить следует защитить, полностью втянув поршень назад. Во время использования поршень проталкивается до упора, чтобы медная нить подвергалась воздействию охлаждающей ванны.
2. Инфаркт миокарда, вызванный криотравмой
- Обезболите аксолотля, погрузив его в 200 мг/л бензокаинового анестетика. Тридцать минут погружения дадут ~2,5 часа полной анестезии.
ПРИМЕЧАНИЕ: Бензокаин нерастворим в воде и должен быть предварительно растворен в 3 мл (на 200 мг бензокаина) ацетона, который затем добавляется в водяную баню. Длительное погружение в бензокаин может ухудшить выздоровление, поэтому время приема бензокаина следует тщательно контролировать. - Положите аксолотля вентральной стороной вверх на операционную чашку (голова влево для хирурга-правши). Иммобилизуйте, завернув все части тела, кроме грудной клетки, в салфетки, смоченные в растворе анестетика (Рисунок 1B).
ПРИМЕЧАНИЕ: Помещение животного во влажные салфетки обеспечивает влажную среду, необходимую для водной амфибии, и устраняет необходимость в ветеринарной мази для глаз. Используйте автоклавные инструменты на последующих этапах, чтобы обеспечить стерильность во время операции. - С помощью ножниц для иридэктомии сделайте продольный разрез на коже ~1 см немного прямо к средней линии грудной клетки (рисунок 1C).
- С помощью щипцов освободите хрящевые пластины грудного пояса.
ПРИМЕЧАНИЕ: Грудной пояс имеет тонкую структуру, и следует соблюдать осторожность, чтобы не повредить его элементы, так как это может нарушить последующее заживление ран, а также передвижение и благополучие животных. - Аккуратно откройте обнаженный перикард с помощью разреза, не повреждая нижележащие сердечные структуры. Прежде чем перикардиальная жидкость вытечет, аспирируйте ее в шприц объемом 1 мл с тупой иглой 2 калибра (Рисунок 1D).
- Поместите тупые щипцы с установленным отверстием (~1 см) в рану, чтобы края раны и хрящевые пластины были раздвинуты (рисунок 1E).
- Поместите криозонд в жидкость N2 с открытой медной проволокой не менее чем на 2 минуты.
ПРИМЕЧАНИЕ: Если масса медной проволоки слишком мала (т.е. слишком коротка) или если она недостаточно охлаждается, это может привести к нежелательной неполной трансмуральной криотравме. - Аккуратно протрите обнаженный желудочек ватным тампоном или плотно скрученными салфетками, чтобы убедиться в отсутствии жидкости на поверхности желудочка (рисунок 1F).
- Извлеките охлажденный до -196 °C криозонд из жидкости N2 и нанесите его непосредственно на обнаженный желудочек (рисунок 1H). Он будет прикрепляться к желудочку. Размещение криозонда должно быть на боковой стороне желудочка по направлению к верхушке, чтобы избежать повреждения других сердечных структур и обеспечить возможность последующих поперечных срезов для микроскопии, содержащих как здоровый, так и инфарктированный миокард. Через 10 с нанесите ранее собранную перикардиальную жидкость на наконечник криозонда (рисунок 1I). Это разморозит зонд и позволит отсоединиться от желудочка.
ПРИМЕЧАНИЕ: Наложение криозонда на желудочек с избытком воды приводит либо к неполному криоинфаркту, если зонд нагревается слишком быстро, либо к слишком обширному повреждению миокарда, если тонкий слой воды, покрывающий всю поверхность желудочка, мгновенно замерзает. Ни то, ни другое не является желательным. В случае успешной индукции криотравмы на желудочке появится небольшая красная круглая припухлость (рисунок 1J). При работе с фиктивными животными неохлажденный криозонд помещают аналогичным образом на 10 с (рис. 1G). - Поместите перикард поверх желудочка, удалите щипцы, которые удерживали рану открытой, и переставьте хрящевые пластины грудного пояса.
ПРИМЕЧАНИЕ: При проведении последующей эхокардиографии для оценки сердечной функции крайне важно, чтобы все воздушные карманы, даже мельчайшие пузырьки, которые могут возникать под хрящевыми пластинами, были удалены, поскольку они вызывают артефакты визуализации. Эти пузырьки можно удалить, аккуратно надавливая на ткань или добавив на поверхность раны раствор амфибии Рингера (6,6 г/л NaCl, 0,15 г/л KCl, 0,15 г/л CaCl2, 0,2 г/л NaHCO3 в дистиллированной воде) для растворения пузырьков воздуха. - Зашить кожу (3-5 швов) с помощью растворимой нити (6-0) (рисунок 1К).
- Накройте область операции влажными тканевыми салфетками, поднятыми над раной, а затем пропитайте их обезболивающим раствором.
- Поместите операционную чашку с животным на лед на 2 часа, чтобы обеспечить начальное формирование эпидермиса раны, запечатав края раны до того, как животное подвергнется воздействию нестерильной водной среды.
- Переложите животное в чистую емкость с аквариумной водой. Животное к этому времени должно прийти в сознание. Наблюдайте за животным до тех пор, пока оно не придет в полное сознание и не начнет координировать движения. Прекратите кормление и подмену воды в течение двух дней после операции и оставьте аксолотля в одиночестве в его собственном аквариуме, чтобы дать возможность закрыть рану, прежде чем нарушения снова вступят в силу.
ПРИМЕЧАНИЕ: После прихода в сознание у большинства аксолотлей возникает желание глотать воздух. Чтобы облегчить этот процесс и ограничить количество необходимых движений, может быть полезно снизить уровень воды в аквариуме вскоре после операции в течение 1-2 дней после операции. Низкая концентрация бензокаина (20 мг/л) может быть использована в качестве анальгетика в течение 24 ч после операции.
3. Неинвазивное измерение фракции инфаркта с помощью эхокардиографии
- Обезболите аксолотля, как описано в шаге 2.1.
- Поместите животное в лежачем положении в небольшую емкость с 3-5 мм раствором анестезии, покрывающую вентральную поверхность.
- Расположите ультразвуковой датчик вдоль длинной оси животного немного правее средней линии грудного отдела.
- Для двумерной оценки фракции инфаркта [IF(УЗИ, 2D)] перемещайте датчик до тех пор, пока зона инфаркта и желудочек не станут максимальными в B-режиме (рис. 2A-D, дополнительный материал 1-2).
- Получите ≥3 сердечных цикла со скоростью > 50 кадров в секунду.
- Измерьте площадь поперечного сечения желудочка (CSAv) и зоны инфаркта (CSAi) в конце диастолы и оцените двумерную фракцию инфаркта, предположив форму сферического желудочка и форму зоны полусферического инфаркта с использованием уравнения:
 (1)
(1)
ПРИМЕЧАНИЕ: Для оценки геометрических предположений формы желудочка и зоны инфаркта датчик можно повернуть на 90°, чтобы отобразить вид сердца по короткой оси (Рисунок 2E-F, Дополнительный материал 3). - Для трехмерной оценки фракции инфаркта расположите датчик слева или справа до тех пор, пока в конце желудочковой диастолы не появится только небольшая часть желудочка.
- С шагом (z) 0,5 мм (для мелких животных, масса тела ≤ 20 г) или 1 мм (крупные животные, масса тела > 20 г) переместите датчик через желудочек и получите не менее 3 сердечных циклов за шаг/срез.
ПРИМЕЧАНИЕ: Для обеспечения достаточной точности необходимо получить 8–12 срезов (n). - Измерьте CSAv и CSAi в конце диастолы для каждого среза (j) и оцените трехмерную фракцию инфаркта [IF(ultrasound, 3D)] без каких-либо геометрических предположений о форме желудочка и инфаркта с помощью уравнения:
 (2)
(2)
ПРИМЕЧАНИЕ: Как двумерный, так и трехмерный сбор данных могут быть использованы для геометрического измерения сердечной функции (ударного объема и сердечного выброса), как описано в разделах 3 и 6 Dittrich et al. (2018)20. Аналогичным образом, интегралы скорости импульсной волны, приобретенные по времени скорости (рис. 2G), также могут быть использованы для измерения сердечной функции, как описано в разделе 3 в Dittrich et al. (2018)20. - Извлеките интересующие области нарисованных CSAv и CSAi на шаге 3.9 в виде бинарных масок с расстоянием по z между срезами для трехмерного моделирования желудочка и зоны инфаркта на конце диастолы и конце систолы (рисунок 2H, дополнительный материал 4).
4. Несмещенная количественная гистология для измерения фракции инфаркта
- Исследуйте сердце аксолотля, находящегося под наркозом, описанное в шагах 2.2 – 2.6.
- С помощью шприца объемом 1 мл, оснащенного иглой 26 калибра, медленно введите 5 мкл/г массы тела 1000 МЕ/мл раствора гепарибии Рингера в венозный синус и подождите 2 мин, чтобы антикоагулянт распределился в кровотоке.
- Усыпьте путем обезглавливания и усыпления мозга и исрежьте все сердце, сначала перерезав сосуды притока, а затем тракт оттока.
- Перенесите сердце, осторожно подняв его за выходной тракт, в чашку Петри 60 × 15мм2 , содержащую раствор амфибии Рингера.
- Под увеличением промойте оставшуюся кровь в сердце, осторожно заполнив венозный пазух 100 МЕ/мл гепаринизированного раствора Рингера.
ПРИМЕЧАНИЕ: Хотя предварительная фиксация сердца может быть проведена путем перфузии сердца буферным формалином или параформальдегидом, в этом нет необходимости, так как секционирование проводится при температуре замерзания. В дальнейшем может быть выполнена фиксация секций на стеклянных предметных стеклах. Полностью вымытое сердце будет казаться бледным и белесым и не будет содержать следов эритроцитов. Вероятны небольшие сгустки крови на поверхности желудочков и предсердий. Они не влияют на точность при последующей количественной гистологической процедуре. - Переложите сердце на безворсовую папиросную бумагу и промокните на 1 минуту.
- Приготовьте криомолд соответствующего размера, нанеся одну каплю состава оптимальной температуры резки, и перенесите сердце в каплю. Аккуратно сожмите сердечко до дна.
- Нанесите более оптимальную температуру резки состава, чтобы заполнить криомолд и убедиться, что желудочек остается на дне. Оставьте форму на 5 минут, чтобы оптимальный температурный состав распределился в образце.
- Застегните форму, поместив ее на крышку от коробки с наконечником для пипетки, плавающей на жидком азоте.
ПРИМЕЧАНИЕ: Для более контролируемой внезапной заморозки сердца можно хранить в течение 1 часа на ночь в 10-30% растворе сахарозы, а внезапную заморозку можно проводить с использованием жидкого изопентана, охлаждаемого азотом (2-метилбутан). По нашему опыту, конечный результат не сильно отличается. - Перед разделкой криомолд закалить в криостате, установленном при температуре от -18 до -22 °C, не менее чем на 1 ч.
- Разрез пробы на толщину среза 10 мкм и отбираем каждый10-й срез для получения плиты толщиной (т) 100 мкм. Продолжайте секцию до тех пор, пока не будет разделено все сердце.
ПРИМЕЧАНИЕ: Можно использовать срезы и плиты разной толщины, однако важно, чтобы сбор среза начинался в том самом месте, где лезвие соприкасается с желудочком, и чтобы все сердце было разделено не менее чем 10-12 равномерно расположенными плитами. Для создания дубликатов можно собрать более одного среза на плиту. - Окрашивайте срезы тканей стандартными протоколами для гематоксилина и эозина или трихрома Массона, чтобы обеспечить четкое различие между эпикардом, миокардом, клапанами и зоной инфаркта.
- Оцифруйте срез тканей с помощью камерного микроскопа или сканера предметного стекла при достаточном увеличении, чтобы четко выявить трабекулированную структуру желудочка аксолотля (рисунок 2I).
- Загрузите стек изображений в ImageJ (https://imagej.nih.gov/ij/index.html) и инициализируйте плагин счетчика ячеек (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Запустите многоцелевой макрос сетки (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) и сгенерируйте сетку точек с достаточной плотностью сетки.
ПРИМЕЧАНИЕ: Плотность сетки (площадь сетки) зависит от размера и морфологии выборки. Для обеспечения желаемой точности должно быть обеспечено не менее 100-200 пересечений точек сетки и каждой из интересующих структур. - Подсчитайте количество пересечений между сеткой точек и интересующими структурами с помощью плагина счетчика ячеек (Рисунок 2I, увеличение справа).
ПРИМЕЧАНИЕ: Для точности важно учитывать только те пересечения, которые появляются точно в точке прицеливания прицела. - Рассчитайте фракцию инфаркта по заранее заданной точечной сетке [Ai(p) и Av(p)], толщину плиты и количество пересечений точечной сетки на каждой плите (Pj) с инфарктным миокардом и общим миокардом желудочков по формуле:
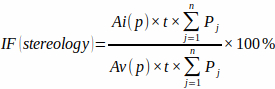 (3)
(3)
Результаты
У аксолотлей с массой тела 11,8 ± 1,3 г и общей длиной 11,8 ± 0,5 см процедура криотравмы, выполненная с помощью криозонда диаметром 2 мм, приводит к образованию инфарктной области, охватывающей 45,4 ± 14,2% миокарда желудочков, в которой зона инфаркта полностью развита [Рисунок 2I, сравните срез до инфаркта здорового сердца (вверху) и через 7 дней после инфаркта (внизу)]. Смертность от процедуры составляет 2,2% (2 из 90 животных). В результате процедуры создается четко определенная зона повреждения, которую можно визуализировать, количественно оценить и смоделировать с помощью неинвазивной эхокардиографии (Рисунок 2C-H, Дополнительный материал 1-4). Первоначально инфаркт миокарда, вызванный криотравмой, значительно влияет на сердечную функцию, уменьшая ударный объем до 62,2% и сердечный выброс до 73,9% через 7 дней после травмы по сравнению с предтравмой с постепенным восстановлением формы и функции в течение трех месяцев (данные не показаны). Никаких поведенческих изменений после криоповреждения миокарда у относительно спокойного аксолотля не наблюдается.
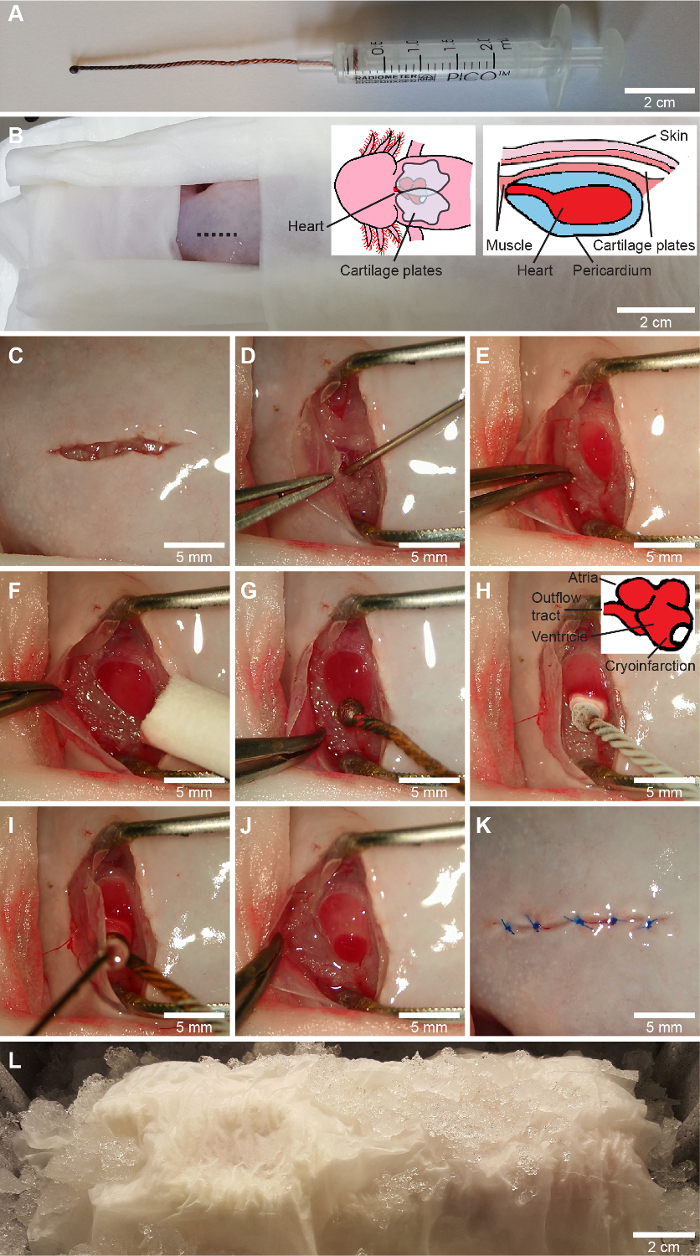
Рисунок 1: Процедура криоинфаркта. О, изготовленный на заказ криозонд изготавливается путем намотки трех медных проводов, расплавления наконечника в сферу и прикрепления провода к поршню шприца объемом 2,5 мл. B-L, процедура криоинфаркта. После того, как все части тела, кроме зоны операции, были покрыты влажными тканевыми салфетками (В), с помощью иридэктомических ножниц (В) выполняется вентральный разрез на грудной клетке немного правее средней линии (показано на рисунке В), а грудной пояс освобождается путем рассечения культи. Перикард осторожно вскрывают с помощью разреза, и жидкость перикарда отсасывают в шприц объемом 1 мл с помощью тупой иглы 23 калибра (D). Желудочек обнажается, и рана остается открытой с помощью щипцов с заданной шириной отверстия (E), а оставшаяся жидкость на желудочке вытирается (F). При фиктивной хирургии неохлаждаемый криозонд (G) применяется так же, как и при криотравме, при которой криозонд, охлажденный в жидком азоте (-196 °C), прикладывается к боковой стенке желудочка по направлению к вершине (H). Через 10 с перикардиальную жидкость повторно наносят на криозонд, чтобы выпустить ее из желудочка (I). В результате образуется четко очерченная зона криоповреждения (J). Наконец, перикард и грудной пояс ложатся поверх сердца, а кожа зашивается (3-5 швов) растворимым швом (К). Животное оставляют на льду на 2 часа, чтобы запустить процесс заживления раны (L). Череп находится слева на B-L, представляя ориентацию животного для хирурга с доминирующей правой рукой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
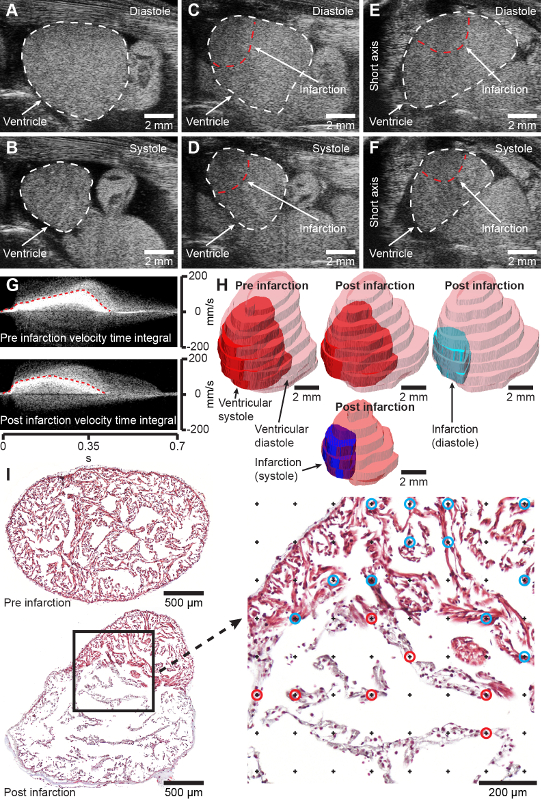
Рисунок 2: Ожидаемые результаты. A и B, B-режим изображения длинных осей здорового желудочка аксолотля в диастоле (A) и систоле (B). C и D, B-режим изображения длинной оси криоповрежденного (через 2 дня после травмы) желудочка аксолотля в диастоле (C) и систоле (D). E и F, B-режим изображения короткой оси криоповрежденного (через 2 дня после травмы) желудочка аксолотля в диастоле (E) и систоле (F). G, Допплерография пульсовой волны получила интегралы скорости и времени до (вверху) и через 2 дня после инфаркта сердца (внизу). H, Моделирование предынфарктного и 2-дневного постинфарктного сердца с помощью трехмерного ультразвукового исследования. I, репрезентативные поперечные гистологические срезы через желудочек аксолотля через 4 дня после симуляции (вверху) и через 7 дней после инфаркта (внизу), окрашенные трихромом Массона. Увеличение справа показывает сетку точек для стереологического измерения фракции инфаркта. Точки, отмеченные синими и красными кругами, обозначают пересечение со здоровыми (синие круги) и инфарктными (красными кругами) тканями. Череп находится справа в A-D , а животные справа — влево в E-F, что представляет собой традиционное отображение эхокардиографических изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный материал 1: Длинная ось, здоровый желудочек до инфаркта, В-режим (см. Рисунок 2А-В). Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный материал 2: Длинная ось, инфарктный желудочек (через 2 дня после инфаркта), B-режим (см. рисунок 2C-D). Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный материал 3: Ось короткой оси, инфарктный желудочек (через 2 дня после инфаркта), В-режим (см. рисунок 2E-F). Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный материал 4: Трехмерные интерактивные модели того же сердца, как показано на рисунке 2A-H и в дополнительном материале 1-3 до и после инфаркта. Запустите интерактивный PDF-файл в Adobe Acrobat Reader 9 или более поздней версии. Щелкните модель, чтобы активировать функцию 3D. Поворачивайте, масштабируйте и панорамируйте модель с помощью курсора. В дереве моделей в левой части экрана все сегменты можно активировать/деактивировать или сделать прозрачными. Дерево модели строится в виде иерархии, содержащей несколько подслоев, которые можно открыть (выбрав +). Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Чтобы свести к минимуму экспериментальную вариативность, хирургическая процедура криотравмы должна следовать стерильным процедурам, а хирургическая подготовка должна проводиться на нескольких животных перед попыткой использования животных для конкретных регенеративных экспериментов. После тренировки процедура криотравмы может проводиться на аксолотлях разного размера и возраста, от молодых (5 г, 7 см) до крупных взрослых (100 г, 25 см). Крайне важно, чтобы криозонд имел достаточный размер и был достаточно охлажден для обеспечения надежного и воспроизводимого криоповреждения желудочка аксолотля. Для очень мелких животных (5-8 г, 7-9 см) криозонд может быть изготовлен с меньшим диаметром. В то время как протокол криотравмы должен проводиться с использованием анестетика с обезболивающими свойствами, такого как бензокаин и MS-222 (или с дополнительным применением вторичного анальгетического средства), последующая эхокардиография может быть проведена с использованием других анестетиков с ограниченными обезболивающими свойствами, таких как пропофол, который, как было описано, влияет на сердечную функцию меньше, чем бензокаин и MS-222 в аксолотле22.
Процедура криотравмы ограничена в том смысле, что она не вызывает индуцированный ишемией инфаркт миокарда путем окклюзии коронарных артерий таким же образом, как процедуры лигирования коронарных артерий, которые больше напоминают клинические случаи инфаркта миокарда у человека. Тем не менее, метод, основанный на лигировании, неприменим для сердца амфибий с трабекуляцией с очень малой коронарной сосудистой сетью и преимущественно люминальным снабжением кислородом. Кроме того, был описан инфаркт миокарда, вызванный криотравмой, который повторяет большинство патологических последствий инфарктов миокарда, вызванных ишемией 14,16. Зона повреждения, образованная криотравмой, сильно локализована в ткани в непосредственной близости от криозонда, и, хотя это не похоже на сложный и ветвистый инфаркт, возникающий в результате коронарной блокады, это является преимуществом в экспериментальных условиях, поскольку пограничная зона между здоровой и инфарктированной тканью может быть легко распознана, а также может быть изучена прогрессия новообразованных кардиомиоцитов.
Аксолотль является значительно более крупным животным, чем данио-рерио, с более сложной сердечно-сосудистой системой, включающей сердце, состоящее из трех камер (два предсердия, один желудочек) и функциональное, хотя и не анатомическое, разделение кровотока в насыщенных кислородом и дезоксигенированных токах23 по сравнению с двухкамерным сердцем и серийной системой кровотока, обнаруженными у костистых рыб. Процедура криотравмы, ранее описанная у рыбок данио, не включает в себя послеоперационное наложение швов на разрезанную вентральную поверхность16,17. Это необходимо у аксолотля, чтобы избежать ненужного воздействия на сердце нестерильной водной среды в лабораторной среде обитания животного.
Несмещенная стереологическая количественная гистология в настоящее время недооценена в регенеративной области, в которой большинство количественных измерений фракции инфаркта полагается на область, основанную на гистологическом срезе в средней зоне инфаркта, а в некоторых случаях и на двух соседних участках24. Поскольку концепция стереологии может быть применена при гистологических исследованиях у любых модельных видов для получения более надежных и непредвзятых измерений, мы предлагаем, чтобы этот свободно доступный метод был включен в количественные оценки регенерации сердца не только у аксолотлей, но и у всех регенеративных видов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Выражаем благодарность Касперу Биндзусу Фолдагеру, Асгеру Андерсену и Майклу Педерсену (все они работают на факультете клинической медицины Орхусского университета) и Дэвиду Гардинеру (факультет биологии развития и клеточной биологии, Калифорнийский университет в Ирвайне) за помощь в первоначальной разработке модели криотравмы аксолотля и ультразвуковом исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
Ссылки
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -. G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503 (2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089 (2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены