Method Article
La regeneración cardíaca inducida por criolesión en el ajolote y la ecocardiografía y la histología cuantitativa no sesgada para evaluar la progresión regenerativa
En este artículo
Resumen
Aquí presentamos un protocolo quirúrgico para inducir criolesión al miocardio ventricular del ajolote. Además, presentamos un protocolo para estimar de forma no invasiva la fracción de infarto durante el proceso regenerativo con ecocardiografía y un protocolo para medir con precisión la fracción de infarto en el corazón extirpado con histología cuantitativa no sesgada.
Resumen
Los anfibios urodelos, salamandras y tritones, representan el grupo filogenético más cercano a los mamíferos capaz de realizar una regeneración miocárdica completa tras la resección ventricular. El modelo de resección ha generado un conocimiento básico de los procesos implicados en la reparación cardíaca. Sin embargo, el modelo no se relaciona bien con situaciones clínicas en las que el daño tisular, la apoptosis, la necrosis, la fibrosis y la hipertrofia son consecuencias perjudiciales clave de los infartos de miocardio inducidos por isquemia en lugar de la extirpación de tejido. Por otro lado, el infarto de miocardio inducido por criolesión se asemeja más al infarto de miocardio inducido por isquemia. Aquí proporcionamos una descripción detallada del procedimiento de criolesión en el ajolote (Ambystoma mexicanum), que proporciona una herramienta para investigar los mecanismos básicos de la reparación cardíaca en un modelo de tetrápodo. Además, proporcionamos métodos cuantitativos para estimar el tamaño del infarto de forma no invasiva in vivo con ecocardiografía y para medir el tamaño del infarto con precisión con histología cuantitativa insesgada ex vivo.
Introducción
La cardiopatía isquémica es una de las principales causas de muerte en todo el mundo 1,2. El infarto de miocardio inducido por isquemia provoca la muerte celular generalizada de los cardiomiocitos3. Aunque una intervención médica rápida puede reducir el riesgo de muerte inmediata, la respuesta fibrótica resultante que los humanos comparten con los animales modelo de mamíferos tradicionales (ratón, rata, conejo, cerdo, etc.) da lugar a la formación de tejido cicatricial que, en última instancia, puede conducir a hipertrofia cardíaca, arritmiase insuficiencia cardíaca. A diferencia de los mamíferos, la regeneración cardíaca está bien establecida en algunos modelos animales no amniónicos como el pez cebra5 y las salamandras6. Tradicionalmente, la regeneración cardíaca se ha estudiado en estas especies después de la resección ventricular parcial o pinzamiento 5,6,7,8,9,10. Sin embargo, en 2011, tres grupos desarrollaron de forma independiente una técnica de infarto de miocardio inducido por criolesión en pez cebra 11,12,13. La técnica de criolesión produce necrosis y apoptosis en una parte importante del ventrículo cardíaco del pez cebra y una acumulación inicial de tejido fibrótico que modela más de cerca el desarrollo patológico del corazón de mamífero después de un infarto isquémico en comparación con la resección ventricular 11,12,13 . Además, las comparaciones metodológicas del infarto de miocardio inducido por criolesión con el infarto de miocardio inducido por isquemia por ligadura de arterias coronarias en el ratón y el cerdo han demostrado que la técnica de criolesión es una alternativa útil en modelos animales de mamíferos14,15. Inspirados en los métodos implicados en el modelo de criolesión del pez cebra16,17 hemos desarrollado un modelo similar en el ajolote18, un anfibio reconocido por sus capacidades regenerativas19, que permite investigar los mecanismos implicados en la reparación cardíaca en este tetrápodo después del daño tisular más que la extracción de tejido.
Aquí presentamos un protocolo detallado sobre cómo realizar el infarto de miocardio inducido por criolesión en el ajolote. Ponemos especial énfasis en pasos cruciales rápidos y mínimamente invasivos que aumentan la supervivencia, la recuperación y la reproducibilidad experimental. Además, proporcionamos instrucciones sobre las técnicas apropiadas para evaluar la regeneración anatómica in vivo mediante ecocardiografía y ex vivo utilizando histología cuantitativa basada en estereoología imparcial.
El infarto de miocardio inducido por criolesión en el ajolote se puede aplicar para investigar los mecanismos básicos implicados en la regeneración del miocardio en este tetrápodo. El ajolote es tolerante al infarto de miocardio inducido por criolesión, que afecta al menos al 45% del ventrículo, lo que resulta en una disminución del volumen sistólico y del gasto cardíaco sin ningún cambio de comportamiento en su estilo de vida relativamente lánguido, sin embargo, las lesiones más graves pueden conducir a una disminución de la salud animal.
En resumen, para inducir la criolesión, se realiza una incisión ventral en el tórax de un ajolote anestesiado. Se accede al ventrículo mediante disección roma y se aplica una criosonda preenfriada durante 10 s para inducir la criolesión. Se sutura la incisión ventral y el animal se recupera rápidamente sin signos de cambios de comportamiento después de recuperar la conciencia. Los animales de control/simulados reciben un tratamiento similar, pero experimentan una criosonda no refrigerada. El rendimiento cardíaco se puede monitorizar mediante ecocardiografía (se necesitan sistemas de ultrasonido de alta frecuencia, ≥20 MHz) como se ha descrito exhaustivamente en corazones de ajolotes sanos previamente20, y la fracción de infarto se puede estimar de forma no invasiva y repetida durante el proceso regenerativo. Los corazones infartados se pueden recolectar en cualquier momento durante el proceso regenerativo de 3 meses, crioseccionar para histología y teñir utilizando procedimientos estándar (por ejemplo, eosina y hematoxilina o tinción tricrómica de Masson). En particular, la tinción tricrómica de Masson permite una clara distinción entre las partes infartadas y sanas del ventrículo. La fracción de infarto del ventrículo se determina mediante técnicas estereológicas previamente descritas para estudios cardíacos21.
Protocolo
Este protocolo cumple con todas las regulaciones y directrices institucionales (Universidad de Aarhus) y nacionales (Inspección Nacional de Experimentos con Animales de Dinamarca protocolo # 2015-15-0201-00615) y nacionales.
1. Preparación de la criosonda
- Corta tres hebras de alambre de cobre de 1 mm de diámetro en trozos de 10 cm.
- Enrolle las hebras de cobre en una cuerda.
- Con un soplete de gas, derrita un extremo de la cuerda de cobre para formar un extremo esférico de 2 mm de diámetro.
NOTA: El cobre tiene una alta conductividad térmica (401 W m-1 K-1 a 0 °C) y se puede moldear a temperaturas fácilmente manejables (punto de fusión 1084,6 °C), pero una superficie de cobre tiende a corroerse con el tiempo, especialmente si entra en contacto con la sangre, lo que reduce notablemente la conductividad térmica. Por lo tanto, una criosonda a base de cobre debe pulirse de vez en cuando. Los metales alternativos más estables que también se pueden utilizar para las criosondas son la plata (conductividad térmica 428 W m-1 K-1 a 0 °C, punto de fusión 961,8 °C) y el oro (conductividad térmica 318 W m-1 K-1 a 0 °C, punto de fusión 1064,2 °C). - Retire el pistón de una jeringa de 2 ml y retire la cabeza de goma blanda.
- Inserte el extremo no esférico de la cuerda de cobre a través de la jeringa y átelo a la pistola
- Vuelva a colocar el pistón en su lugar en la jeringa (Figura 1A).
NOTA: Cuando la sonda criogénica no está en uso, la cuerda de cobre debe protegerse tirando del pistón completamente hacia atrás. Cuando está en uso, el pistón se empuja completamente hacia adentro para exponer la cuerda de cobre al baño de enfriamiento.
2. Infarto de miocardio inducido por criolesión
- Anestesiar el ajolote sumergiéndolo en 200 mg/L de anestésico benzocaína. Treinta minutos de inmersión producirán ~2,5 h de anestesia completa.
NOTA: La benzocaína es insoluble en agua y primero debe solubilizarse en acetona de 3 mL (por 200 mg de benzocaína) que posteriormente se agrega al baño de agua. La inmersión prolongada en benzocaína puede afectar la recuperación, por lo tanto, el tiempo en benzocaína debe controlarse cuidadosamente. - Coloque el ajolote con el lado ventral hacia arriba en una placa de cirugía (diríjase a la izquierda para un cirujano diestro). Inmovilizar envolviendo todas las partes del cuerpo, excepto el tórax, en toallitas desechables empapadas en solución anestésica (Figura 1B).
NOTA: Envolver al animal en toallitas húmedas asegura un ambiente húmedo crucial para un anfibio acuático y elimina la necesidad de ungüento veterinario en los ojos. Utilice instrumentos esterilizados en autoclave en los pasos posteriores para garantizar la esterilidad durante la cirugía. - Use tijeras de iridectomía para hacer una incisión longitudinal de ~ 1 cm en la piel ligeramente a la derecha de la línea media del tórax (Figura 1C).
- Use pinzas para liberar las placas de cartílago de la cintura pectoral.
NOTA: La cintura pectoral es una estructura delicada y se debe tener cuidado de no dañar sus elementos, ya que esto puede perjudicar la cicatrización posterior de las heridas y la locomoción y el bienestar de los animales. - Abra suavemente el pericardio expuesto con una incisión sin dañar las estructuras cardíacas subyacentes. Antes de que el líquido pericárdico se escape, aspire esto en una jeringa de 1 mL que lleve una aguja roma de calibre 2 (Figura 1D).
- Coloque pinzas romas con una abertura fija (~1 cm) en la herida para mantener separados los bordes de la herida y las placas de cartílago (Figura 1E).
- Coloque la criosonda en líquido N2 con el alambre de cobre expuesto durante al menos 2 minutos.
NOTA: Si la masa del alambre de cobre es demasiado pequeña (es decir, es demasiado corta) o si se enfría lo suficiente, puede producirse una criolesión transmural incompleta indeseable. - Limpie suavemente el ventrículo expuesto con un hisopo de algodón o toallitas desechables bien enrolladas para asegurarse de que no haya líquido en la superficie del ventrículo (Figura 1F).
- Retire la criosonda enfriada a -196 °C del líquido N2 y aplíquela directamente sobre el ventrículo expuesto (Figura 1H). Se adherirá al ventrículo. La colocación de la criosonda debe ser en el lado lateral del ventrículo hacia el ápice para evitar daños a otras estructuras cardíacas y permitir secciones transversales posteriores para la microscopía que contenga miocardio sano e infartado. Después de 10 s, aplique el líquido pericárdico previamente recolectado a la punta de la criosonda (Figura 1I). Esto descongelará la sonda y permitirá el desprendimiento del ventrículo.
NOTA: La aplicación de la criosonda en un ventrículo con exceso de agua da como resultado un crioinfarto incompleto, si la sonda se calienta demasiado rápido, o un daño miocárdico demasiado extenso, si una capa delgada de agua que cubre toda la superficie del ventrículo se congela instantáneamente. Ninguna de las dos situaciones es deseable. En el caso de una inducción exitosa de la criolesión, aparecerá una pequeña hinchazón circular roja en el ventrículo (Figura 1J). Cuando se manipulan animales simulados, se coloca una criosonda no refrigerada de manera similar durante 10 s (Figura 1G). - Coloque el pericardio encima del ventrículo, retire las pinzas que mantenían abierta la herida y reorganice las placas de cartílago de la cintura pectoral.
NOTA: Si se realiza una ecocardiografía posterior para evaluar la función cardíaca, es crucial que se eliminen todas las bolsas de aire, incluso las burbujas diminutas que son propensas a ocurrir debajo de las placas de cartílago, ya que inducen artefactos de imagen. Estas burbujas pueden eliminarse presionando suavemente el tejido o añadiendo solución de Ringer para anfibios esterilizada en autoclave (6,6 g/L de NaCl, 0,15 g/L de KCl, 0,15 g/L de CaCl2, 0,2 g/L de NaHCO3 en agua destilada) a la superficie de la herida para disolver las burbujas de aire. - Suturar la piel (3-5 puntos) con hilo soluble (6-0) (Figura 1K).
- Cubra el área de la cirugía con toallitas húmedas levantadas por encima de la herida y luego empapéjelas con solución anestésica.
- Coloque la placa de cirugía con el animal en hielo durante 2 h para permitir la formación inicial de una epidermis de la herida, sellando los bordes de la herida antes de que el animal se exponga a su entorno acuático no estéril.
- Transfiera al animal a un recipiente limpio con agua del acuario. El animal debería estar recuperando la conciencia en este momento. Observe al animal hasta que haya recuperado la plena conciencia y los movimientos coordinados. Deje de alimentarlo y de cambiarlo durante dos días después de la cirugía y mantenga al ajolote solo en su propio acuario para permitir el cierre de la herida antes de que se reintroduzcan las perturbaciones.
NOTA: Después de recuperar la conciencia, la mayoría de los ajolotes tienen el deseo de tragar aire. Para facilitar este proceso y limitar la cantidad de movimiento necesario, puede ser beneficioso bajar el nivel del agua en el acuario poco después de la cirugía durante 1-2 días después de la cirugía. Una baja concentración de benzocaína (20 mg/L) puede utilizarse como analgésico durante 24 h después de la cirugía.
3. Medición no invasiva de la fracción de infarto con ecocardiografía
- Anestesiar al ajolote como se describe en el paso 2.1.
- Coloque al animal en posición supina en un recipiente pequeño con 3-5 mm de solución anestésica que cubra la superficie ventral.
- Coloque el transductor de ultrasonido a lo largo del eje longitudinal del animal ligeramente a la derecha de la línea media de la región torácica.
- Para una estimación bidimensional de la fracción de infarto [FI (ultrasonido, 2D)], traslade el transductor hasta que la zona de infarto y el ventrículo aparezcan máximos en el modo B (Figura 2A-D, Material complementario 1-2).
- Adquiere ≥3 ciclos cardíacos con > 50 fotogramas/s.
- Mida el área de la sección transversal del ventrículo (CSAv) y de la zona de infarto (CSAi) al final de la diástole y estime la fracción de infarto bidimensional asumiendo una forma de ventrículo esférico y una forma de zona de infarto hemisférica utilizando la ecuación:
 (1)
(1)
NOTA: Para evaluar las suposiciones geométricas de la forma del ventrículo y la zona de infracción, el transductor se puede girar 90° para mostrar la vista del eje corto del corazón (Figura 2E-F, Material Suplementario 3). - Para una estimación tridimensional de la fracción de infarto, coloque el transductor a la izquierda o a la derecha hasta que solo una pequeña porción del ventrículo aparezca a la vista al final de la diástole ventricular.
- En pasos (z) de 0,5 mm (para animales pequeños, masa corporal ≤ 20 g) o 1 mm (animales grandes, masa corporal > 20 g) mueva el transductor a través del ventrículo y adquiera al menos 3 ciclos cardíacos por paso/corte.
NOTA: Para una precisión razonable, se deben adquirir de 8 a 12 rebanadas (n). - Mida CSAv y CSAi al final de la diástole para cada corte (j) y estime la fracción tridimensional de infarto [IF (ultrasonido, 3D)] sin ninguna suposición geométrica de ventrículo y forma de infracción usando la ecuación:
 (2)
(2)
NOTA: Tanto la adquisición bidimensional como la tridimensional se pueden utilizar para medir la función cardíaca (volumen sistólico y gasto cardíaco) geométricamente, como se describe en las secciones 3 y 6 de Dittrich et al. (2018)20. Del mismo modo, las integrales de tiempo de velocidad adquirida por la velocidad de onda pulsada (Figura 2G) también se pueden utilizar para medir la función cardíaca, como se describe en la sección 3 de Dittrich et al. (2018)20. - Extraiga las regiones de interés de CSAv y CSAi dibujadas en el paso 3.9 como máscaras binarias con espaciado z entre cortes para modelar tridimensionalmente el ventrículo y la zona de infarto al final de la diástole y la sístole final (Figura 2H, Material complementario 4).
4. Histología cuantitativa insesgada para medir la fracción de infarto
- Explora el corazón de un ajolote anestesiado descrito en los pasos 2.2 – 2.6.
- Usando una jeringa de 1 mL equipada con una aguja de calibre 26, inyecte lentamente 5 μL/g de masa corporal de 1000 UI/mL de solución de Ringer de anfibio heparinizado en el seno venoso y espere 2 min para que el anticoagulante se distribuya en la circulación.
- Aplicar la eutanasia por decapitación y extirpar todo el corazón cortando primero los vasos de entrada y luego el tracto de salida.
- Transfiera el corazón levantándolo suavemente por el tracto de salida a una placa de Petri de 60 × 15 mm2 que contenga solución de Ringer para anfibios.
- Bajo aumento, lave cualquier resto de sangre en el corazón llenando suavemente el seno venoso con 100 UI/mL de solución de Ringer heparinizada.
NOTA: Si bien la prefijación del corazón se puede realizar perfundiendo el corazón con formol tamponado o paraformaldehído, esto no es necesario, ya que el corte se lleva a cabo a una temperatura de congelación. Posteriormente, se puede realizar la fijación de las secciones en portaobjetos de vidrio. Un corazón completamente lavado se verá pálido y blanquecino y no contendrá rastros de glóbulos rojos. Es probable que se formen pequeños coágulos de sangre en la superficie del ventrículo y las aurículas. No afectan a la precisión en el procedimiento histológico cuantitativo posterior. - Transfiera el corazón a papel de seda sin pelusa para secar durante 1 min.
- Prepare un criommould de tamaño adecuado aplicando una sola gota de compuesto de temperatura de corte óptima y transfiera el corazón a la gota. Aprieta el corazón suavemente hasta el fondo.
- Aplique un compuesto de temperatura de corte más óptima para llenar el criomold y asegúrese de que el ventrículo permanezca en la parte inferior. Deje el molde durante 5 minutos para que el compuesto de temperatura de corte óptima se distribuya en la muestra.
- Congele el molde colocándolo en una tapa de una caja de puntas de pipeta que flota sobre nitrógeno líquido.
NOTA: Para una congelación instantánea más controlada, los corazones se pueden almacenar durante 1 hora durante la noche en una solución de sacarosa al 10-30% y la congelación instantánea se puede realizar utilizando isopentano (2-metilbutano) enfriado por nitrógeno líquido. En nuestra experiencia, el resultado final no es marcadamente diferente. - Templar el criomolde en un criostato ajustado a -18 a -22 °C durante al menos 1 h antes de cortar.
- Corte la muestra con un espesor de corte de 10 μm y recoja cada 10 rebanadas para proporcionar un espesor de losa (t) de 100 μm. Continúe seccionando hasta que se corte todo el corazón.
NOTA: Se pueden usar diferentes espesores de rebanadas y losas, sin embargo, es importante que la recolección de rebanadas comience en el mismo punto en que la cuchilla toca el ventrículo y que todo el corazón esté seccionado con al menos 10-12 losas espaciadas uniformemente. Se puede recolectar más de una rebanada por losa para proporcionar conjuntos duplicados. - Tiña las secciones de tejido con protocolos estándar para hematoxilina y eosina o tricrómico de Masson para proporcionar una distinción clara entre epicardio, miocardio, válvulas y zona de infarto.
- Digitalizar la sección de tejidos utilizando una cámara, microscopio o escáner de portaobjetos con un aumento suficiente para revelar claramente la estructura trabeculada del ventrículo del ajolote (Figura 2I).
- Cargue la pila de imágenes en ImageJ (https://imagej.nih.gov/ij/index.html) e inicialice el complemento de contador de celdas (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Ejecute una macro de cuadrícula multipropósito (https://imagej.nih.gov/ij/macros/Multipurpose_grid.txt) y genere una cuadrícula de puntos con una densidad de cuadrícula adecuada.
NOTA: La densidad de la cuadrícula (área de la cuadrícula) depende del tamaño y la morfología de la muestra. Para proporcionar una precisión deseable, se deben garantizar al menos 100-200 intersecciones de puntos de la cuadrícula y cada una de las estructuras de interés. - Cuente el número de intersecciones entre la cuadrícula de puntos y las estructuras de interés utilizando el complemento de contador de celdas (Figura 2I, aumento a la derecha).
NOTA: Es importante para la precisión incluir solo aquellas intersecciones que aparecen precisamente en el punto de mira de la cruz. - Calcule la fracción de infarto a partir del área de cuadrícula de puntos predefinida [Ai(p) y Av(p)], el espesor de la losa y el número de intersecciones de la cuadrícula de puntos en cada losa (Pj) con miocardio infartado y miocardio ventricular total usando la fórmula:
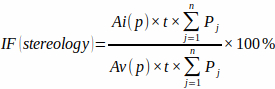 (3)
(3)
Resultados
En ajolotes con una masa corporal de 11,8 ± 1,3 g y una longitud total de 11,8 ± 0,5 cm, el procedimiento de criolesión realizado con una criosonda de 2 mm (diámetro) da como resultado un área infartada que cubre el 45,4 ± el 14,2% del miocardio ventricular a los 7 días después de la lesión en la que la zona del infarto está completamente desarrollada [Figura 2I, compare la sección de corazón sano antes de la infracción (arriba) y 7 días después de la infracción (abajo)]. El procedimiento tiene una tasa de mortalidad del 2,2% (2/90 animales). El procedimiento da como resultado una zona de lesión bien definida que se puede visualizar, cuantificar y modelar con ecocardiografía no invasiva (Figura 2C-H, material complementario 1-4). Inicialmente, el infarto de miocardio inducido por criolesión afecta significativamente la función cardíaca, reduciendo el volumen sistólico al 62,2% y el gasto cardíaco al 73,9% a los 7 días después de la lesión en relación con la lesión anterior con una recuperación gradual de la forma y la función a lo largo de tres meses (datos no mostrados). No se observan cambios de comportamiento después de una criolesión miocárdica en el ajolote relativamente tranquilo.
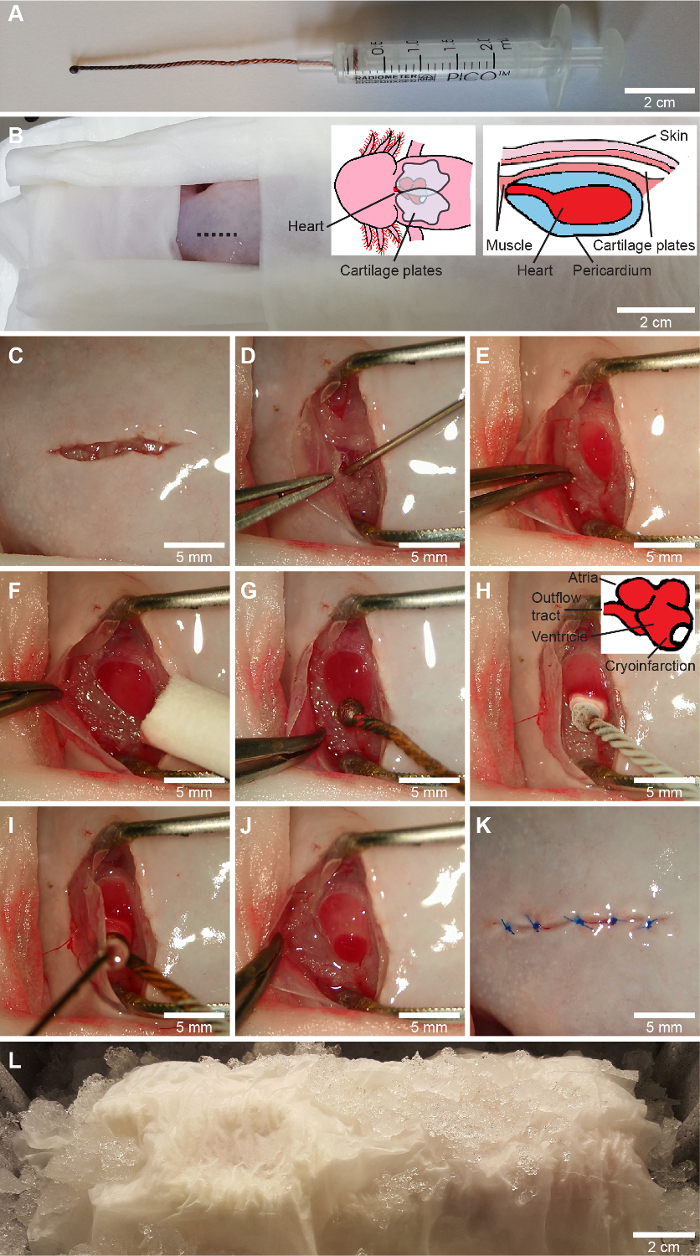
Figura 1: Procedimiento de crioinfarto. A, una criosonda hecha a medida se fabrica enrollando tres cables de cobre, derritiendo la punta en una esfera y conectando el cable al pistón de una jeringa de 2,5 ml. B-L, el procedimiento de crioinfarto. Después de la colocación de todas las partes del cuerpo, excepto la zona de cirugía, en toallitas de tejido húmedo (B), se realiza una incisión ventral en el tórax ligeramente a la derecha de la línea media (que se muestra en B) con tijeras de iridectomía (C), y la cintura pectoral se libera mediante disección del muñón. El pericardio se abre suavemente con una incisión y el líquido pericárdico se aspira en una jeringa de 1 ml con una aguja roma de calibre 23 (D). Se expone el ventrículo y se mantiene abierta la herida con pinzas con un ancho de apertura predefinido (E) y se limpia cualquier líquido restante en el ventrículo (F). Para la cirugía simulada se aplica una criosonda no enfriada (G) de la misma manera que para la criolesión, en la que la criosonda enfriada en nitrógeno líquido (-196 °C) se aplica a la pared lateral del ventrículo hacia el ápice (H). Después de 10 s, el líquido pericárdico se vuelve a aplicar a la criosonda para liberarlo del ventrículo (I). Esto produce una zona de criolesión claramente definida (J). Finalmente, se colocan el pericardio y la cintura pectoral sobre el corazón y se sutura la piel (3-5 puntos) con una sutura soluble (K). El animal se deja en hielo durante 2 horas para iniciar el proceso de cicatrización de la herida (L). El cráneo está hacia la izquierda en B-L, representando la orientación del animal para un cirujano con una mano derecha dominante. Haga clic aquí para ver una versión más grande de esta figura.
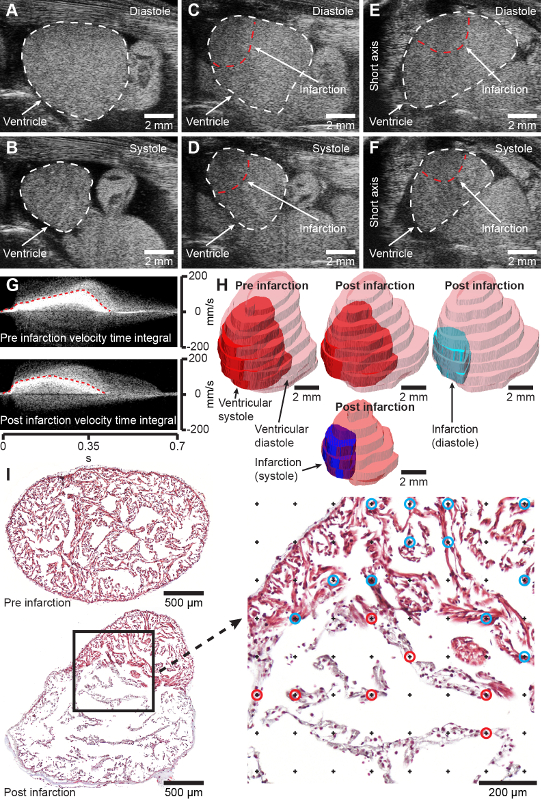
Figura 2: Resultados previstos. A y B, imágenes de eje largo en modo B de ventrículo ajolote sano en diástole (A) y sístole (B). C y D, imágenes de eje largo en modo B de ventrículo de ajolote criolesionado (2 días después de la lesión) en diástole (C) y sístole (D). E y F, imágenes de eje corto en modo B del ventrículo del ajolote criolesionado (2 días después de la lesión) en diástole (E) y sístole (F). G, Doppler de onda de pulso adquirida integrales de tiempo de velocidad del corazón pre (arriba) y postinfartado de 2 días (abajo). H, Modelado del corazón pre infarto y postinfartado a los 2 días a partir de la adquisición de ultrasonido tridimensional. I, cortes histológicos transversales representativos a través del ventrículo del ajolote 4 días después del simulacro (arriba) y 7 días después del infarto (abajo) teñidos con tricrómico de Masson. El aumento de la derecha muestra la cuadrícula de puntos para la medición estereológica de la fracción de infarto. Los puntos marcados con círculos azules y rojos representan la intersección con tejido sano (círculos azules) e infartado (círculos rojos). El cráneo está hacia la derecha en A-D y la derecha de los animales está hacia la izquierda en E-F, lo que representa la visualización convencional de imágenes ecocardiográficas. Haga clic aquí para ver una versión más grande de esta figura.
Material complementario 1: Eje largo, ventrículo sano preinfarto, modo B (ver Figura 2A-B). Haga clic aquí para descargar este video.
Material complementario 2: Eje largo, ventrículo infartado (2 días después del infarto), modo B (ver Figura 2C-D). Haga clic aquí para descargar este video.
Material complementario 3: Eje corto, ventrículo infartado (2 días después del infarto), modo B (ver Figura 2E-F). Haga clic aquí para descargar este video.
Material complementario 4: Modelos interactivos tridimensionales del mismo corazón como se ve en la Figura 2A-H y material complementario 1-3 pre y post-infarto. Inicie el archivo PDF interactivo en Adobe Acrobat Reader 9 o superior. Haga clic en el modelo para activar la función 3D. Gire, amplíe y desplácese por el modelo con el cursor. En el árbol del modelo, en el lado izquierdo de la pantalla, todos los segmentos se pueden activar/desactivar o hacer transparentes. El árbol del modelo se construye como una jerarquía que contiene varias subcapas que se pueden abrir (seleccionando +). Haga clic aquí para descargar este archivo.
Discusión
Para minimizar la variación experimental, el procedimiento quirúrgico de la criolesión debe seguir procedimientos estériles y el entrenamiento quirúrgico debe realizarse en varios animales antes de intentar utilizar animales para experimentos regenerativos específicos. Con entrenamiento, el procedimiento de criolesión se puede llevar a cabo en una amplia gama de tamaños y edades de ajolotes, desde juveniles (5 g, 7 cm) hasta adultos grandes (100 g, 25 cm). Es fundamental que la criosonda tenga un tamaño suficiente y se enfríe adecuadamente para proporcionar una criolesión robusta y repetible al ventrículo del ajolote. Para animales muy pequeños (5-8 g, 7-9 cm), la criosonda se puede construir con un diámetro más pequeño. Si bien es imperativo que el protocolo de criolesión se lleve a cabo utilizando un anestésico con propiedades analgésicas como benzocaína y MS-222 (o con la aplicación adicional de un agente analgésico secundario), la ecocardiografía de seguimiento se puede realizar con otros anestésicos con propiedades analgésicas limitadas, como el propofol, que se ha descrito que afecta la función cardíaca menos que la benzocaína y el MS-222 en el ajolote22.
El procedimiento de criolesión es limitado en el sentido de que no produce un infarto de miocardio inducido por isquemia por oclusión de la arteria coronaria de la misma manera que los procedimientos de ligadura de la arteria coronaria que se asemejan más a los casos clínicos de infarto de miocardio en humanos. Sin embargo, el método basado en la ligadura no es aplicable en el corazón de anfibios trabeculados con muy poca vasculatura coronaria y un suministro de oxígeno mayoritariamente luminal. Además, se ha descrito que el infarto de miocardio inducido por criolesión recapitula la mayoría de las consecuencias patológicas de los infartos de miocardio inducidos por isquemia14,16. La zona de lesión generada por la criolesión está muy localizada en el tejido en las proximidades de la criosonda y, aunque no se asemeja a un infarto complejo y ramificado resultante de la obstrucción coronaria, es ventajosa en un entorno experimental, ya que se puede reconocer fácilmente la zona fronteriza entre el tejido sano y el infartado, y se puede estudiar la progresión de los cardiomiocitos recién formados.
El ajolote es un animal considerablemente más grande que el pez cebra con un sistema cardiovascular más complicado, incluyendo un corazón que consta de tres cámaras (dos aurículas, un ventrículo) y una separación funcional, aunque no anatómica, del flujo sanguíneo en corrientes oxigenadas y desoxigenadas23 en comparación con el corazón de dos cámaras y el sistema de flujo en serie que se encuentran en los teleósteos. El procedimiento de criolesión descrito anteriormente en el pez cebra no implica la sutura postoperatoria de la superficie ventral incisa16,17. Esto es necesario en el ajolote para evitar la exposición innecesaria del corazón al ambiente acuático no estéril en el hábitat de laboratorio del animal.
La histología cuantitativa no sesgada basada en la estereología está actualmente infradescrita en el campo regenerativo, en el que la mayoría de las mediciones cuantitativas de la fracción de infarto se basan en el área, basándose en la sección histológica en la zona de infarto medio y, en algunos casos, en dos secciones vecinas24. Dado que el concepto de estereología se puede aplicar en los exámenes histológicos de cualquier especie modelo para proporcionar mediciones más robustas e imparciales, proponemos que este método disponible libremente debe incorporarse en las evaluaciones cuantitativas de la regeneración del corazón no solo en el ajolote, sino en todas las especies regenerativas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Deseamos agradecer a Casper Bindzus Foldager, Asger Andersen y Michael Pedersen (todos en el Departamento de Medicina Clínica de la Universidad de Aarhus) y David Gardiner (Departamento de Biología Celular y del Desarrollo de la Universidad de California, Irvine) por su ayuda en el desarrollo inicial del modelo de criolesión de ajolote y el examen de ultrasonido.
Materiales
| Name | Company | Catalog Number | Comments |
| S&T Scissor SAS-15 | S&T AG - Microsurgical Instruments | Iridectomy scissors | |
| Vevo 2100 | Fujifilm, VisualSonics | High frequency ultrasound scanner |
Referencias
- Forouzanfar, M. H., et al. Assessing the global burden of ischemic heart disease, part 2: analytic methods and estimates of the global epidemiology of ischemic heart disease in 2010. Global Heart. 7, 331-342 (2012).
- Go, A. S., et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129, 399-410 (2014).
- Murry, C. E., Reinecke, H., Pabon, L. M. Regeneration gaps: observations on stem cells and cardiac repair. Journal of the American College of Cardiology. 47, 1777-1785 (2006).
- Laflamme, M. A. Heart regeneration. Nature. 473, 326-335 (2011).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298, 2188-2190 (2002).
- Oberpriller, J. O., Oberpriller, J. C. Response of the adult newt ventricle to injury. Journal of Experimental Zoology. 187, 249-260 (1974).
- Cano-Martínez, A., et al. Functional and structural regeneration in the axolotl heart (Ambystoma mexicanum) after partial ventricular amputation. Archivos de Cardiología de México. 80, 79-86 (2010).
- Witman, N., Murtuza, B., Davis, B., Arner, A., Morrison, J. I. Recapitulation of developmental cardiogenesis governs the morphological and functional regeneration of adult newt hearts following injury. Developmental Biology. 354, 67-76 (2011).
- Mercer, S. E., Odelberg, S. J., Simon, H. -. G. A dynamic spatiotemporal extracellular matrix facilitates epicardial-mediated vertebrate heart regeneration. Developmental Biology. 382, 457-469 (2013).
- Piatkowski, T., Mühlfeld, C., Borchardt, T., Braun, T. Reconstruction of the myocardium in regenerating newt hearts is preceded by transient deposition of extracellular matrix components. Stem Cells and Development. 22, 1921-1931 (2013).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11 (21), (2011).
- González-Rosa, J. M., Martín, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138, 1663-1674 (2011).
- Schabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS ONE. 6 (4), 18503 (2011).
- Van den Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. The American Journal of Physiology: Heart and Circulatory Physiology. 289, 1291-1300 (2005).
- Yang, Y., et al. Characterization of cryoinjury-induced infarction with manganese-and gadolinium-enhanced MRI and optical spectroscopy in pig hearts. Magnetic Resonance Imaging. 28, 753-766 (2010).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nature Protocols. 7, 782-788 (2012).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Lauridsen, H., Pedersen, M. Rebuilding a heart: complete regeneration after myocardial infarction in the axolotl. The Federation of American Societies for Experimental Biology Journal. 28 (1), (2014).
- McCusker, C., Gardiner, D. M. The axolotl model for regeneration and aging research: a mini-review. Gerontology. 57, 565-571 (2011).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D Echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments. (141), e57089 (2018).
- Mühlfeld, C., Nyengaard, J. R., Mayhew, T. M. A review of state-of-the-art stereology for better quantitative 3D morphology in cardiac research. Cardiovascular Pathology. 19, 65-82 (2010).
- Thygesen, M. M., Rasmussen, M. M., Madsen, J. G., Pedersen, M., Lauridsen, H. Propofol (2,6-diisopropylphenol) is an applicable immersion anesthetic in the axolotl with potential uses in hemodynamic and neurophysiological experiments. Regeneration (Oxf.). 4, 124-131 (2017).
- Malvin, G. M., Heisler, N. Blood flow patterns in the salamander, Ambystoma tigrinum, before, during and after metamorphosis. Journal of Experimental Biology. 137, 53-74 (1988).
- Juul-Belling, H., Hofmeister, W., Andersen, D. C. A systematic exposition of methods used for quantification of heart regeneration after apex resection in zebrafish. Cells. 9, 548 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados