Method Article
Введение летучих анестетиков личинкам данио-рерио для наблюдения за поведением
В этой статье
Резюме
Этот протокол представляет собой доступный метод создания газонепроницаемой среды для введения летучих анестетиков личинкам данио-рерио для поведенческих экспериментов.
Аннотация
В этом исследовании описан уникальный метод введения летучих анестетиков, таких как изофлуран и севофлуран, личинкам рыбок данио во время поведенческих экспериментов. В то время как рыбки данио обладают многочисленными преимуществами в качестве модели позвоночных организмов, включая сложное поведение, генетическую податливость, прозрачные эмбрионы и быстрое развитие, их использование в изучении летучих анестетиков было ограничено. Для введения летучих анестетиков часто требуются сложные или громоздкие аппараты, которые могут быть недоступны, что создает препятствия для фармакологического изучения летучих анестетиков в водных модельных организмах. Этот метод представляет собой простую технику с использованием клейких силиконовых листов для создания газонепроницаемого уплотнения на стеклянных 96-луночных пластинах. Валидация проводилась путем оценки спонтанного движения, которая не показала существенных различий между закрытыми и открытыми скважинами в течение 90-минутного периода. Кроме того, концентрация анестетика оставалась стабильной с течением времени, что было измерено с помощью ВЭЖХ. Репрезентативные результаты включают экспериментальное определение медианных значений эффективной концентрации (EC50) для севофлурана. Данное исследование обеспечивает простой и доступный подход к фармакологическим экспериментам с использованием летучих анестетиков, который может быть легко адаптирован для изучения других летучих веществ и экспериментальных конечных точек.
Введение
Модели неводных животных (черви, мухи, грызуны, кролики, приматы и т. д.) исторически были моделями, наиболее часто используемыми для изучения анестезиологической фармакологии. У каждого из этих видов летучие анестетики (вводимые путем вдыхания газа) являются гораздо менее сложными, чем внутривенное введение анестетиков (вводимое либо внутривенно, либо внутрибрюшинным путем)1. В дополнение к технической проблеме, связанной с простым введением внутривенных препаратов, достижение устойчивого состояния анестезии гораздо проще с летучими агентами, чем с внутривеннымиагентами.
Введение внутривенных анестетиков личинкам водных видов может быть достигнуто путем диффузии из окружающей их водной среды 3,4 и, таким образом, больше похоже на введение летучих анестетиков для неводных видов. В течение многих лет головастики (Xenopus laevis) были моделью выбора для изучения анестетиков из-за простоты введения лекарств и устойчивой фармакокинетики, достигаемой простым добавлением анестетика в воду искусственного пруда 5,6. Тем не менее, существует относительно небольшое количество примеров изучения летучих анестетиков в этой модели из-за требований к газонепроницаемым аппаратам, которые часто специально сконструированы и могут быть громоздкимив использовании.
В последние годы рыбки данио стали предпочтительной моделью для изучения внутривенных анестетиков из-за той же простоты введения лекарств в дополнение к другим преимуществам, таким как их хорошо описанное сложное поведение и доступность коммерческих единиц для наблюдения за этимповедением. Во многих недавних исследованиях использовались такие коммерчески доступные наблюдательные устройства для скрининга нейроактивных соединений, включая анестетики, с использованием 96-луночных и 24-луночных планшетов для количественной оценки поведения личинок данио-рерио 4,10,11,12,13,14,15 . Личичиночные стадии особенно хорошо подходят для фармакологических исследований из-за их способности оценивать многие поведенческие реакции, их небольшого размера, высокой пропускной способности и хорошо охарактеризованных нейронных цепей 9,16,17. Тем не менее, одним из существенных ограничений в этих исследованиях анестетиков в модели рыбок данио является относительная сложность введения летучих анестетиков. Это ограничение привело к скудным примерам сравнения летучих и внутривенных препаратов 4,15,18. Возможность легко изучать и сравнивать оба класса анестетиков на одной животной модели добавляет важный инструмент, облегчающий изучение анестезиологической фармакологии во всех классах.
Традиционно, для изучения внутривенных анестетиков у водных организмов требовалось специализированное, часто индивидуальное, оборудование, которое может быть сложным в использовании или может быть недостаточно газонепроницаемым, чтобы предотвратить потерю анестетика на протяжении всего эксперимента. Описанная здесь процедура представляет собой легкодоступный альтернативный способ изготовления газонепроницаемого уплотнения в стеклянной камере, пригодного для наблюдения за поведением личинок рыбок данио рерио с помощью коммерческого наблюдательного устройства (см. Таблицу материалов).
протокол
Все эксперименты с рыбками данио проводились в соответствии с протоколами использования животных, утвержденными Институциональным комитетом по уходу за животными и их использованию (IACUC). Взрослые рыбки данио содержались в водном комплексе Университета Пенсильвании под надзором Университетского лабораторного управления животных (ULAR). Тюбингенские длинноплавниковые рыбки дикого типа были выведены в домашних условиях для всех экспериментов и содержались в стандартных условиях содержания с 13/11-часовым циклом свет/темнота до тех пор, пока они не достигали 5 дней после оплодотворения (dpf). Эксперименты проводились с использованием биологических репликатов, при этом кладки получались от отдельных брачных пар для обеспечения адекватного биологического разнообразия. Подробная информация о реагентах и оборудовании, использованных в данном исследовании, приведена в Таблице материалов.
1. Изготовление клеевых силиконовых листов
ПРИМЕЧАНИЕ: Эквиваленты этого материала (силиконовый лист плюс клей) могут быть получены в коммерческих целях, но часто с большей стоимостью и меньшей доступностью.
- Разложите силиконовый лист толщиной 0,5 мм на чистой ровной поверхности.
- Осмотрите листы на наличие складок и по возможности избегайте их.
ПРИМЕЧАНИЕ: Силиконовые листы со складками могут не прилипать к ленте должным образом, что может привести к недостаточной герметизации лунок и/или плохой визуализации рыбок данио. - Очистите листы 70% спиртом, чтобы удалить масло или мусор, и дайте им высохнуть.
- С помощью аппликатора, например, кисти, нанесите тонкий ровный слой адгезивной грунтовки на силиконовый лист. Чтобы избежать чрезмерного нанесения, работайте небольшими секциями, так как промотор клея быстро высыхает (схватывается за 1-5 с).
ПРИМЕЧАНИЕ: Без этого промотора адгезии лента не будет адекватно прилегать к силиконовому листу. - После нанесения клеевого промотора совместите ленту с двойным покрытием с силиконовым листом бумажной подложкой вверх.
- Постепенно наклейте ленту на силикон с помощью валика, чтобы разгладить поверхность и удалить пузырьки воздуха (после первоначального нанесения работа силиконовой стороной вверх поможет визуализировать и удалить пузырьки воздуха).
- Дайте промотору клея полностью застыть в течение 24 часов на ровной поверхности.
- Нарежьте клейкий силикон на полоски шириной не менее 10 мм (диаметр лунки 7,5 мм плюс перекрытие с каждой стороны).
ПРИМЕЧАНИЕ: При использовании каждого второго ряда луночной пластины более широкий перепад полос не окажет негативного влияния на скважины в соседних рядах, что может не только облегчить нанесение, но и быть необходимым для достижения герметизации по всей окружности лунки.- Убедитесь, что полосы достаточно длинные, чтобы покрыть по крайней мере ширину одного ряда луночной пластины.
ПРИМЕЧАНИЕ: При использовании луночного планшета, который не является 96-луночным, например, 24-луночного или 48-луночного планшета, размеры полос могут быть отрегулированы или обрезаны в соответствии с конкретными размерами планшета, обеспечивая надлежащее покрытие независимо от размера планшета.
- Убедитесь, что полосы достаточно длинные, чтобы покрыть по крайней мере ширину одного ряда луночной пластины.
2. Приготовление растворов
ПРИМЕЧАНИЕ: Все исходные и тестовые растворы летучих анестетиков были изготовлены непосредственно перед экспериментом во избежание потери концентрации летучих соединений.
- Для каждого раствора (исходного или рабочего раствора) добавьте объем нелетучего растворителя (вода для эмбрионов Е3, ДМСО и т. д.) в пробирку для ВЭЖХ или сцинтилляции, чтобы при сочетании с окончательным разбавлением летучего анестетика общий объем достаточно заполнил флакон, оставив минимальное свободное пространство (см. рисунок 1А).
- Добавьте летучий анестетик с помощью газонепроницаемого шприца Hamilton и быстро закройте флакон.
ПРИМЕЧАНИЕ: Стоковые растворы во флаконах с септумными крышками могут использоваться для облегчения дальнейшего разведения путем переноса раствора газонепроницаемыми шприцами. - Затем смешайте флаконы (вортекс, ультразвук) по мере необходимости и временно храните их, пока готовятся тарелки с рыбками данио.
3. Постановка поведенческого эксперимента
ПРИМЕЧАНИЕ: Этот этап протокола может потребовать некоторой практики. Рекомендуется работать без рыбы или растворов, содержащих драгоценный материал, до тех пор, пока не освоится с техникой.
- Перенесите по одной личинке данио рерио (5 dpf) в каждый второй ряд стеклянной 96-луночной пластины.
ПРИМЕЧАНИЕ: Если оставить каждый второй ряд пустым, это снижает вероятность загрязнения соседних скважин в результате перелива, поскольку скважины герметизируются на шаге 3.4. - Аккуратно удалите раствор Е3 из каждой лунки. Это можно делать по одному ряду за раз или на всей плите, если она способна работать быстро.
ПРИМЕЧАНИЕ: Время, в течение которого личинки находились вне раствора, было сведено к минимуму для снижения потенциального стресса. Альтернативные методы могут быть использованы на основе различных экспериментальных потребностей, включая только частичное удаление раствора перед добавлением лекарственного раствора для минимизации стресса. Протокол должен быть адаптирован к потребностям эксперимента, включая время уравновешивания, предоставленное животным для компенсации любого потенциального стресса, эффективность смешивания растворов и точность концентраций раствора, содержащего лекарственное средство, если не весь Е3 удаляется до добавления рабочего раствора. - Затем с помощью переводной пипетки заполните каждую лунку в ряду экспериментальным раствором. Следите за тем, чтобы не появились пузырьки. Переполните каждую лунку (рисунок 1В).
- С помощью клеевых силиконовых полосок, изготовленных на шаге 1, быстро прижмите полоску вниз (Рисунок 1C). Это помогает предотвратить образование пузырьков и удерживает рыбу от перелива в соседние скважины.
- Плотно надавите на верхнюю часть пластины, чтобы убедиться, что каждая лунка запечатана.
- Повторяйте шаги 2-5 до тех пор, пока раствор не будет заменен и лунки для каждого второго ряда пластины лунки не будут запечатаны (рисунок 1D).
- Аккуратно переверните пластину и осмотрите на наличие пузырьков воздуха.
ПРИМЕЧАНИЕ: Наличие пузырьков воздуха будет мешать визуализации движения рыбок данио. - Поместите пластину в блок наблюдения за поведением (силиконовым клеем вниз) и проведите поведенческий эксперимент (подробнее см. раздел «Результаты»).
Результаты
Сравнение с традиционными наблюдениями за скважинами
Чтобы оценить, оказывает ли адгезивное уплотнение какое-либо влияние на спонтанное движение, было проведено сравнение контрольной группы в открытых и герметичных лунках. Как видно на рисунке 2А, статистически значимой разницы в движении между этими группами не наблюдалось в течение стандартной продолжительности ~30 минут, используемой в экспериментах, описанных в этой статье. Признавая, что другие экспериментальные парадигмы могут нуждаться в более длительном экспериментальном воздействии, был проведен двухчасовой временной курс, не выявивший статистической разницы в движении до отметки 2 часа (см. рисунок 2B). Более длительная продолжительность эксперимента, вероятно, приведет к еще большей разнице в движениях. В предыдущих исследованиях количественно оценивалось неблагоприятное влияние гипоксиина поведение при плавании, что в конечном итоге поставило под угрозу достоверность экспериментальных результатов. Таким образом, предполагается, что гипоксия и/или образованиеCO2 являются наиболее вероятными причинами этого отклонения в SM по сравнению с контролем на открытых скважинах. К сожалению, газонепроницаемое уплотнение, предотвращающее потерю летучего анестетика из закрытого колодца, также предотвращает диффузию других газов в закрытый раствор или из него. Это, конечно, означает ограниченную диффузию CO2 и кислорода, поскольку они соответственно производятся и потребляются рыбой. Это является важным ограничением в отношении продолжительности эксперимента, возможного при использовании этого метода. Также важно отметить, что со временем в ранее свободных от пузырьков лунках начинают образовываться небольшие пузырьки, предположительно из-за обмена веществ. Однако во время тестирования эти пузыри не препятствовали отслеживанию данио-рерио программным обеспечением. Эксперименты продолжительностью до 1,5 ч (плюс время равновесия), по-видимому, не оказывают существенного влияния на отслеживание SM этих диких рыбок данио, но рыбы, которые демонстрируют больше движений или имеют другие повышенные метаболические потребности, могут не подходить для экспериментов такой продолжительности.
Концентрация летучих анестетиков с течением времени
Чтобы обеспечить постоянную концентрацию летучего анестетика с течением времени, лунки без рыбок данио использовали для измерения временного хода концентрации анестетика, определенного с помощью ВЭЖХ. В каждую лунку добавляли один и тот же раствор, а концентрацию севофлурана или изофлурана измеряли каждые 15 мин в течение 3 ч (каждое измерение из другой лунки, в отличие от повторных измерений из той же лунки). Как видно на рисунке 3, практически ни один анестетик не терялся в течение всего периода времени с севофлураном (давление пара 197 мм рт.ст. при 25 °С), который имеет более низкое давление пара, чем изофлуран (давление пара 238 мм рт.ст. при 25 °С), который показал потерю 4% через 3 ч. Ни один из летучих анестетиков не показал заметной потери в интервале от 30 до 60 минут, что типично для многих поведенческих экспериментов.
Эффективность севофлурана у личинок рыбок данио
Этот метод был использован для измерения активности летучих анестетиков у рыбок данио15 и может превосходить другие методологии, использовавшиеся ранее4. Медиана эффективной концентрации (EC50) для севофлурана по измерениям спонтанного движения (SM) и вызванного движения (EM) показана на рисунке 4. С помощью метода герметичной лунки определяли значения EC50 62 мкМ (95% ДИ: 49-81) для СМ и 126 мкМ (95% ДИ: 81-193) для ЭМ. Значение SM сопоставимо с ранее зарегистрированным значением EC50 в 76 мкМ (95% ДИ: 50-114). Тем не менее, ранее сообщенное значение 240 мкМ (95% ДИ: 169-328) для ЭМ почти в два раза превышает значение, полученное здесь4. Без проведения аналогичного исследования ВЭЖХ по данной методике (вакуумная смазка и стеклянный покровный стекло для создания герметичного уплотнения) нельзя с уверенностью сказать, связана ли эта разница с потерей летучего анестетика с течением времени. Тем не менее, это рациональная гипотеза, особенно с учетом того, что стимул для ЭМ (акустического постукивания) регистрируется в конце времени поведенческого наблюдения. Независимо от метода герметизации скважины, любая потеря концентрации севофлурана будет иметь наибольший эффект в более поздние моменты времени. Конечно, эти различия могут быть связаны с другими основополагающими факторами, такими как генетический фон рыбок данио.
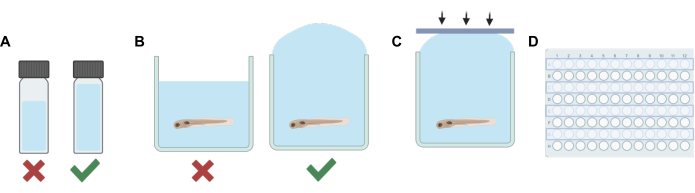
Рисунок 1: Основные процедурные шаги. (A) При работе с летучими растворами планирование разбавления осуществляется таким образом, чтобы свести к минимуму свободное пространство в каждом флаконе. (Б) Переполнение скважин производится при добавлении экспериментальных растворов к растворам, содержащим рыбок данио-рерио, для устранения пузырьков воздуха. (C) Силиконовые клейкие полоски наносятся с одной стороны пластины на другую для предотвращения попадания воздуха. (D) Каждый второй ряд используется для экспериментов по предотвращению загрязнения соседних скважин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
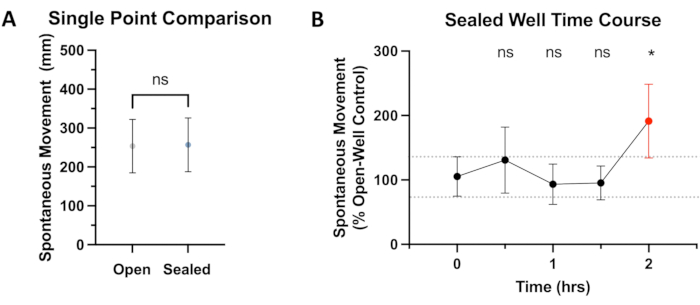
Рисунок 2: Сравнение движения в закрытых и открытых скважинах. (A) Сравнивается общее спонтанное движение от 0 до 4 минут после 15-минутного равновесия в поведенческой единице. Движение рыбок данио-рерио через 5 дней после внесения удобрений (dpf) в открытых лунках (254 мм, 95% ДИ: 185-322) и закрытых лунках (257 мм, 95% ДИ: 186-326) не показывает существенной разницы (P = 0,374). (В) После 15-минутного периода акклиматизации в системе поведения рыбок данио-рерио за рыбами (N ≥ 36) наблюдают за спонтанным движением (общим пройденным расстоянием) в течение 4-минутного периода в начале каждых получаса. Данные отображаются в процентном соотношении (открытые скважины) со статистическими сравнениями (ANOVA) с точностью до 0 часов. При использовании порогового значения P в <0,05 значительная разница в движении между открытыми и закрытыми скважинами наблюдается на отметке 2 часа (P = 0,0139), выделенной красным цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
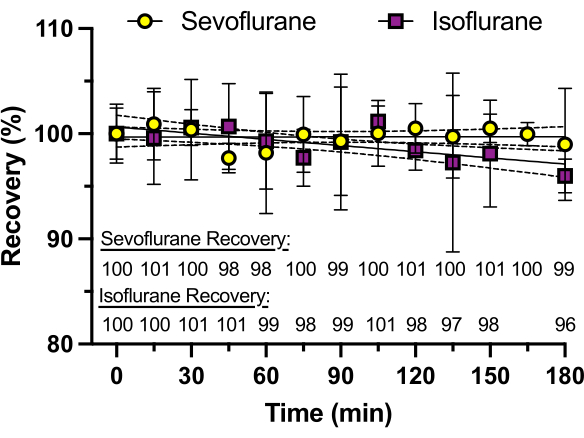
Рисунок 3: Восстановление севофлурана с течением времени. Концентрации севофлурана и изофлурана в стеклянных пластинах с силиконовым адгезивным герметиком определяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) в течение 3 часов. Процент восстановления, рассчитанный как среднее арифметическое трех репликаций, показан в нижней части графика. Изофлуран демонстрирует потерю концентрации до 4% в течение 3 ч, вероятно, из-за более высокого давления пара (238 мм рт.ст. при 25 °C) по сравнению с севофлураном (197 мм рт.ст. при 25 °C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
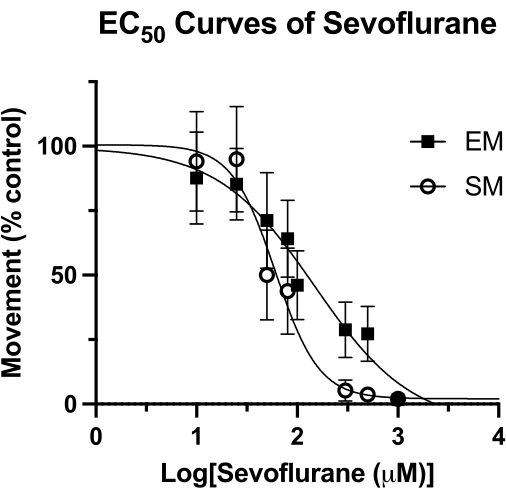
Рисунок 4: Кривые Севофлурана EC50 . Кривая севофлурана EC50 в герметичных лунках определяется на основе спонтанного движения (в течение 4 минут) и вызванного движения (1 секунда после акустического постукивания) рыбок данио-рерио 5 dpf. Движение масштабируется до элементов управления только с помощью ДМСО. Итоговое значение EC50 рассчитывается как 62 мкМ (95% ДИ: 49-81) для спонтанного движения (СМ) и 126 мкМ (95% ДИ: 81-193) для вызванного движения (ЭМ). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этой статье описывается метод легкого введения летучих анестетиков, таких как севофлуран, личинкам рыбок данио, который был использован для количественной оценки активности летучих анестетиков у рыб дикого типа. Несмотря на то, что этот метод концептуально прост, может потребоваться практика, чтобы обеспечить адекватно герметизированный, свободный от пузырьков ряд скважин за короткий промежуток времени, чтобы свести к минимуму потери летучих агентов. Поскольку этот метод предназначен для летучих соединений, он требует не только тщательного нанесения силиконового клея на пластину лунки, но и тщательного приготовления экспериментальных растворов для оптимизации точности концентраций летучих соединений.
Захват воздуха может препятствовать точной визуализации и отслеживанию. В дополнение к практике герметизации, решающее значение имеет тщательное заполнение и осмотр каждой скважины, поскольку любые пузырьки, присутствующие до герметизации, вряд ли будут удалены в процессе герметизации. Переполнение колодцев также помогает предотвратить попадание воздуха в каждую скважину. Однако слишком большой перелив может привести к непреднамеренному переносу рыбы в соседние скважины. Если это произошло, постарайтесь перелить меньше. Сведение к минимуму избыточного переполнения не только поможет непреднамеренному переносу рыбы в соседние скважины, но и может повысить эффективность клея, используемого для герметизации, в присутствии большого количества избыточного раствора. Несмотря на то, что клей был специально выбран отчасти из-за его способности прилипать к влажным поверхностям, начиная с чистой и сухой пластины, никакие другие вещества не препятствуют адгезии, тем самым улучшая общую целостность экспериментальной установки. Если пузырьки все еще сохраняются, несмотря на отсутствие пузырьков задолго до нанесения клея, оптимизацию переполнения и технику нанесения силиконового клея, это может быть связано с использованием слишком узких клейких полос. Недостаточно широкие полосы могут либо не герметизироваться, либо герметизироваться недостаточно, чтобы предотвратить попадание воздуха во время или после процесса нанесения. Еще одной потенциальной ошибкой при использовании этого метода является качество герметизации, производимой адгезивными силиконовыми полосками, что может быть вызвано складками на силиконе, недостаточной герметизацией клея (недостаточная грунтовка для клея, время отверждения или очистка поверхностей перед нанесением силикона). Несмотря на то, что клей сам по себе, по-видимому, обеспечивает достаточно плотное уплотнение, без силикона в качестве защитной основы сам по себе клей может не обеспечить достаточную водостойкость для защиты от циркулирующей водяной бани в течение всего эксперимента.
Стеклянные пластины хорошо подходят для этого применения, так как, в отличие от многихпластиковых пластин, они совместимы с гидрофобными веществами, такими как летучие анестетики, их поверхность плоская (в отличие от типичных пластиковых колодцев), что обеспечивает адгезию силиконовой полосы, и имеют прозрачное дно (в отличие от тефлона и некоторых пластиковых пластин). Пластины с кварцевыми лунками могут обеспечить повышенную оптическую прозрачность для экспериментов, где требуется визуализация с более высоким разрешением. Все представленные здесь примеры данных были получены в 96-луночных стеклянных планшетах, а другие подобные планшеты коммерчески доступны в более крупных форматах лунок, но они не тестировались авторами. Большее количество растворов в большой лунке может увеличить потенциальную продолжительность эксперимента с использованием этого метода из-за большей доступности кислорода, а также может облегчить эксперименты со старыми рыбками данио, но модификация эксперимента таким образом потребует дальнейшей проверки. Другие модификации этой методики включают применение этой методики к другим поведенческим парадигмам (например, к стимулам, таким как свет)21, различным генетическим моделям, другим типам фармакологических исследований (например, совместное введение лекарств) и, возможно, даже к адаптации к визуализирующим исследованиям.
Этот метод обеспечивает простой и доступный способ введения летучих соединений рыбкам данио с целью поведенческого наблюдения. Рыбки данио становятся все более популярной моделью для изучения анестетиков, в частности внутривенных (IV) анестетиков (пропофол, этомидат, кетамин и т.д.). Отчасти это связано с простотой введения препарата, но также существуют меньшие фармакокинетические соображения по сравнению с введением внутривенных анестетиков неводным животным моделям (червям, мухам, грызунам, людям и т. д.), которые требуют контролируемых по мишени инфузионных моделей для стационарного введения2. Это сравнимо с введением летучих агентов этим животным, которое так же просто, как посадить животное в коробку и заставить его вдыхать вещество, смешанное с кислородом/воздухом. Введение летучих веществ водным животным (данио-рерио, головастикам) является более сложным, так как требует герметичной водной среды. Эта разница имеет тенденцию разделять использование определенных животных моделей для определенных анестетиков, но с помощью представленного здесь метода оба класса анестетиков могут быть легко доставлены в одну и ту же животную модель. Возможность легко сравнивать различные экспериментальные парадигмы в одной модели, несмотря на разрозненные способы администрирования. Это также может быть адаптировано для использования летучих анестетиков таким образом, чтобы использовать другие сильные стороны рыбок данио, включая их генетическую податливость, быстрое развитие и прозрачные эмбрионы, которые облегчают наблюдение за физиологическими реакциями в режиме реального времени. Понимание влияния летучих анестетиков, таких как изофлуран и севофлуран, на рыбок данио может улучшить понимание механизмов их действия и побочных эффектов. Эта новая методология обеспечивает надежную основу для исследования летучих анестетиков у рыбок данио.
Раскрытие информации
У авторов нет никаких противоречий для раскрытия.
Благодарности
Эта работа была профинансирована Фондом образования и исследований в области анестезиологии (FAER). Рисунок 1 создан в BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
Ссылки
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены