Method Article
إعطاء التخدير المتطاير ليرقات الزرد للملاحظة السلوكية
In This Article
Summary
يقدم هذا البروتوكول طريقة يمكن الوصول إليها لخلق بيئة محكمة الغلق للغاز لإدارة التخدير المتطاير ليرقات أسماك الزرد للتجارب السلوكية.
Abstract
تصف هذه الدراسة طريقة فريدة لإعطاء التخدير المتطاير ، مثل الأيزوفلوران والسيفوفلوران ، ليرقات الزرد أثناء التجارب السلوكية. في حين أن أسماك الزرد تقدم العديد من المزايا ككائن حي نموذجي للفقاريات - بما في ذلك السلوكيات المعقدة ، وقابلية التتبع الجيني ، والأجنة الشفافة ، والتطور السريع - فإن استخدامها في دراسة التخدير المتطاير كان محدودا. غالبا ما يتطلب إعطاء التخدير المتطاير أجهزة معقدة أو مرهقة قد لا يمكن الوصول إليها على نطاق واسع ، مما يخلق حواجز أمام الدراسة الدوائية لأدوية التخدير المتطاير في الكائنات الحية النموذجية المائية. تقدم هذه الطريقة تقنية مباشرة باستخدام صفائح سيليكون لاصقة لإنشاء ختم محكم للغاز على ألواح زجاجية مكونة من 96 بئرا. تم إجراء التحقق من الصحة من خلال تقييم الحركة العفوية ، والتي لم تظهر فروق ذات دلالة إحصائية بين الآبار المختومة والمفتوحة على مدى فترة 90 دقيقة. بالإضافة إلى ذلك ، ظل تركيز التخدير مستقرا بمرور الوقت ، كما تم قياسه بواسطة HPLC. تشمل النتائج التمثيلية التحديد التجريبي لقيم التركيز الفعال المتوسط (EC50) للسيفوفلوران. توفر هذه الدراسة نهجا بسيطا ويمكن الوصول إليه للتجارب الدوائية باستخدام التخدير المتطاير ، والتي يمكن تكييفها بسهولة لدراسة العوامل المتطايرة الأخرى ونقاط النهاية التجريبية.
Introduction
كانت النماذج الحيوانية غير المائية (الديدان والذباب والقوارض والأرانب والرئيسيات وما إلى ذلك) تاريخيا هي النماذج الأكثر استخداما لدراسة علم الأدوية المخدر. في كل نوع من هذه الأنواع ، تكون التخدير المتطاير (التي تعطى عن طريق استنشاق الغازات) أقل صعوبة بكثير من إعطاء التخدير الوريدي (الذي يتم إعطاؤه إما عن طريق الوريد أو داخل الصفاق)1. بالإضافة إلى التحدي التقني المتمثل في إعطاء الأدوية الوريدية ببساطة ، فإن تحقيق حالة ثابتة من التخدير أسهل بكثير مع العوامل المتطايرة من العوامل الوريدية2.
يمكن إعطاء التخدير الوريدي للأنواع المائية اليرقاتية عن طريق الانتشار من الوسط المائي المحيطبها 3،4 ، وبالتالي فهو أقرب إلى إعطاء التخدير المتطاير للأنواع غير المائية. لسنوات عديدة ، كانت الضفادع الصغيرة (Xenopus laevis) هي النموذج المفضل لدراسة التخدير نظرا لسهولة إعطاء الدواء والحركية الدوائية المستقرة التي تم تحقيقها عن طريق إضافة الحمام البسيط للمخدر إلى مياه البركة الاصطناعية5،6. ومع ذلك ، هناك أمثلة قليلة نسبيا على دراسة التخدير المتطاير في هذا النموذج نظرا لمتطلبات الأجهزة محكمة الغلق التي غالبا ما تكون مصممة لهذا الغرض ويمكن أن تكون مرهقة لاستخدام7،8.
في السنوات الأخيرة ، أصبحت أسماك الزرد نموذجا مفضلا لدراسة التخدير الوريدي بسبب نفس سهولة إعطاء الدواء بالإضافة إلى مزايا أخرى مثل سلوكياتها المعقدة الموصوفة جيدا وتوافر الوحدات التجارية لمراقبة هذهالسلوكيات 9. استخدمت العديد من الدراسات الحديثة وحدات المراقبة المتاحة تجاريا لفحص المركبات النشطة عصبيا ، بما في ذلك التخدير ، باستخدام تنسيقات 96 بئرا و 24 بئرا لقياس سلوك يرقات الزرد4،10،11،12،13،14،15. تعتبر مراحل اليرقات مناسبة بشكل خاص لدراسات علم الأدوية نظرا لقدرتها على تقييم العديد من الاستجابات السلوكية ، وصغر حجمها ، وتوافقها العالي مع الإنتاجية ، والدوائر العصبية المميزةجيدا 9،16،17. ومع ذلك ، فإن أحد القيود المهمة في هذه الدراسات حول التخدير في نموذج الزرد هو الصعوبة النسبية في إعطاء التخدير المتطاير. أدى هذا القيد إلى أمثلة ضئيلة للمقارنة بين العوامل المتطايرة والوريدية4،15،18. تضيف القدرة على دراسة ومقارنة فئتي التخدير بسهولة في نموذج حيواني واحد أداة مهمة لتسهيل دراسة علم الأدوية المخدر في جميع الفصول.
تقليديا ، تتطلب دراسة التخدير الوريدي في الأنواع المائية معدات متخصصة ، وغالبا ما تكون مخصصة ، قد يصعب استخدامها أو قد لا تكون محكمة الغلق بما يكفي لمنع فقدان المخدر طوال مدة التجربة. يقدم الإجراء الموصوف هنا وسيلة بديلة يسهل الوصول إليها لإنتاج مانع تسرب للغاز في غرفة زجاجية مناسبة لمراقبة سلوك يرقات الزرد باستخدام وحدة مراقبة تجارية (انظر جدول المواد).
Protocol
تم إجراء جميع تجارب أسماك الزرد وفقا لبروتوكولات استخدام المعتمدة من قبل اللجنة المؤسسية لرعاية واستخدامه (IACUC). تم الاحتفاظ بأسماك الزرد البالغة في المنشأة المائية بجامعة بنسلفانيا تحت إشراف مختبر الموارد الحيوانية بالجامعة (ULAR). تم تربية أسماك الزرد البرية طويلة الزعانف في Tübingen في المنزل لجميع التجارب وتم الحفاظ عليها في ظل ظروف التربية القياسية مع دورة ضوء / ظلام 13/11 ساعة حتى وصلت إلى 5 أيام بعد الإخصاب (dpf). أجريت التجارب باستخدام التكرارات البيولوجية ، مع براثن مشتقة من أزواج تزاوج متميزة لضمان التنوع البيولوجي الكافي. تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. تصنيع صفائح السيليكون اللاصقة
ملاحظة: يمكن الحصول على مكافئات هذه المادة (لوح السيليكون بالإضافة إلى المادة اللاصقة) من مصادر تجارية، ولكن غالبا بتكلفة أكبر وتوافر أقل.
- ضع لوح السيليكون 0.5 مم على سطح نظيف ومستو.
- افحص الأوراق بحثا عن أي تجاعيد وتجنبها عندما يكون ذلك ممكنا.
ملاحظة: قد لا تلتصق صفائح السيليكون ذات التجاعيد بشكل كاف بالشريط وقد تؤدي إلى عدم كفاية إغلاق الآبار و / أو ضعف تصور أسماك الزرد. - نظف الملاءات بالكحول بنسبة 70٪ لإزالة أي زيت أو بقايا واتركها تجف.
- باستخدام قضيب ، مثل فرشاة الرسم ، ضع طبقة رقيقة ومتساوية من التمهيدي اللاصق على لوح السيليكون. لتجنب الإفراط في التطبيق ، اعمل في أقسام أصغر حيث يجف المحرك اللاصق بسرعة (يضبط في 1-5 ثوان).
ملاحظة: بدون محرك الالتصاق هذا ، لن يلتصق الشريط بشكل كاف بصفة السيليكون. - بمجرد تطبيق المحرك اللاصق ، قم بمحاذاة الشريط المطلي المزدوج مع لوح السيليكون بحيث يكون دعامة الورق متجها لأعلى.
- ضع الشريط تدريجيا على السيليكون باستخدام أسطوانة لتنعيم السطح وإزالة فقاعات الهواء (بعد التطبيق الأولي ، سيساعد العمل على جانب السيليكون لأعلى في تصور فقاعات الهواء وإزالتها).
- اسمح للمروج اللاصق بالشفاء الكامل لمدة 24 ساعة على سطح مستو.
- قطع السيليكون اللاصق إلى شرائح بعرض 10 مم على الأقل (قطر البئر 7.5 مم بالإضافة إلى التداخل على كل جانب).
ملاحظة: عند استخدام كل صف آخر من لوحة البئر ، لن يؤثر التباين الأوسع في الشرائط سلبا على الآبار في الصفوف المجاورة ، مما قد لا يجعل التطبيق أسهل فحسب ، بل سيكون ضروريا أيضا لتحقيق ختم حول محيط البئر بالكامل.- تأكد من أن الشرائط طويلة بما يكفي لتغطية عرض صف واحد على الأقل من لوحة البئر.
ملاحظة: إذا كنت تستخدم لوحة بئر ليست 96 بئرا ، مثل صفيحة 24 بئرا أو 48 بئرا ، فيمكن تعديل أحجام الشريط أو قصها لتناسب الأبعاد المحددة للوحة ، مما يضمن التغطية المناسبة بغض النظر عن حجم اللوحة.
- تأكد من أن الشرائط طويلة بما يكفي لتغطية عرض صف واحد على الأقل من لوحة البئر.
2. إعداد الحلول
ملاحظة: تم إجراء جميع محاليل المخزون والمقايسة لأدوية التخدير المتطايرة قبل التجربة مباشرة لتجنب فقدان تركيز المركبات المتطايرة.
- لكل محلول (مخزون أو محلول عمل) ، أضف حجما من المذيبات غير المتطايرة (ماء الجنين E3 ، DMSO ، إلخ) إلى قنينة HPLC أو قارورة تلألؤ عند دمجها مع التخفيف النهائي للتخدير المتطاير ، فإن الحجم الكلي سيملأ القارورة بشكل كاف مع ترك الحد الأدنى من المساحة (انظر الشكل 1 أ).
- أضف مخدرا متطارا باستخدام حقنة هاميلتون محكمة الغلق للغاز وأغلق القارورة بسرعة.
ملاحظة: يمكن استخدام محاليل المخزون في قوارير ذات أغطية حاجز لتسهيل المزيد من التخفيفات عن طريق نقل المحلول باستخدام محاقن محكمة الغلق للغاز. - ثم امزج القوارير (الدوامة ، الصوتنة) حسب الحاجة وقم بتخزينها مؤقتا أثناء تحضير أطباق سمك الزرد.
3. إعداد التجربة السلوكية
ملاحظة: قد تستغرق هذه الخطوة من البروتوكول بعض الممارسة. يوصى بالعمل بدون أسماك أو محاليل تحتوي على مواد ثمينة حتى تشعر بالراحة مع هذه التقنية.
- انقل يرقات واحدة من سمكة الزرد (5 dpf) إلى كل صف آخر من اللوحة الزجاجية المكونة من 96 بئر.
ملاحظة: يسمح ترك كل صف آخر فارغا بتقليل احتمالية تلوث الآبار المجاورة من الامتداد غير المباشر حيث يتم إغلاق الآبار في الخطوة 3.4. - قم بإزالة محلول E3 بعناية من كل بئر. يمكن القيام بذلك صفا واحدا في كل مرة أو على اللوحة بأكملها إذا كان قادرا على العمل بسرعة.
ملاحظة: تم تقليل المدة التي خرجت فيها اليرقات من المحلول لتقليل الإجهاد المحتمل. يمكن استخدام الإجراءات البديلة بناء على الاحتياجات التجريبية المختلفة ، بما في ذلك الإزالة الجزئية للمحلول فقط قبل إضافة المحلول المحتوي على الدواء لتقليل الإجهاد. يجب تكييف البروتوكول ليناسب احتياجات التجربة ، بما في ذلك وقت التوازن الممنوح للحيوانات للتعويض عن أي إجهاد محتمل ، وكفاءة خلط المحلول ، ودقة تركيزات المحلول المحتوي على الدواء ، إن لم تتم إزالة كل E3 قبل إضافة محلول العمل. - بعد ذلك ، استخدم ماصة نقل لملء كل بئر في الصف بالمحلول التجريبي. احرص على عدم إدخال الفقاعات. املأ كل بئر أكثر من اللازم (الشكل 1 ب).
- باستخدام شرائط السيليكون اللاصقة المصنوعة في الخطوة 1 ، اضغط على الشريط لأسفل بسرعة (الشكل 1C). يساعد ذلك على منع تكوين الفقاعات ويمنع الأسماك من الفيضان في الآبار المجاورة.
- اضغط بقوة على الجزء العلوي من اللوحة للتأكد من إغلاق كل بئر.
- كرر الخطوات من 2 إلى 5 حتى يتم تبادل المحلول ويتم إغلاق الآبار لكل صف آخر من لوحة البئر (الشكل 1 د).
- اقلب اللوحة برفق وافحص فقاعات الهواء.
ملاحظة: سيؤدي وجود فقاعات الهواء إلى حجب تصور حركة سمك الزرد. - ضع اللوحة في وحدة مراقبة السلوك (الجانب اللاصق من السيليكون لأسفل) وقم بإجراء التجربة السلوكية (انظر قسم النتائج للحصول على التفاصيل).
النتائج
مقارنة بمراقبة البئر المفتوحة التقليدية
من أجل تقييم ما إذا كان للختم اللاصق أي تأثير على الحركة التلقائية ، تم إجراء مقارنة بين الضوابط في الآبار المفتوحة مقابل الآبار المختومة. كما هو موضح في الشكل 2 أ ، لم يلاحظ أي فرق ذي دلالة إحصائية في الحركة بين هذه المجموعات لمدة ~ 30 دقيقة القياسية المستخدمة في التجارب الموضحة في هذه المقالة. إدراكا منه أن النماذج التجريبية الأخرى قد تحتاج إلى تعرض تجريبي أطول ، تم تنفيذ دورة زمنية مدتها ساعتان ، ولم تكشف عن أي اختلاف إحصائي في الحركة حتى علامة 2 ساعة (انظر الشكل 2 ب). من المحتمل أن تؤدي المدة التجريبية الأطول إلى تفاضل أكبر في الحركة. حددت الدراسات السابقة التأثير السلبي لنقص الأكسجة على سلوك السباحة19 ، مما أدى في النهاية إلى تعريض سلامة النتائج التجريبية للخطر. وبالتالي ، يفترض أن نقص الأكسجة و / أو إنتاج ثاني أكسيد الكربون2 هما الأسباب الأكثر احتمالا لهذا الانحراف في SM مقارنة بضوابط الآبار المفتوحة. لسوء الحظ ، فإن الختم المحكم للغاز الذي يمنع فقدان التخدير المتطاير من البئر المغلق يمنع أيضا انتشار الغازات الأخرى داخل أو خارج المحلول المغلق. هذا ، بالطبع ، يعني الانتشار المقيد لثاني أكسيد الكربون2 والأكسجين حيث يتم إنتاجهما واستهلاكهما من قبل الأسماك على التوالي. هذا قيد مهم فيما يتعلق بطول التجربة الممكنة بهذه الطريقة. من المهم أيضا ملاحظة أنه مع مرور الوقت ، تبدأ الفقاعات الصغيرة في التكون في الآبار الخالية من الفقاعات سابقا ، ويفترض أن يكون ذلك بسبب التمثيل الغذائي. ومع ذلك ، أثناء الاختبار ، لم تعيق هذه الفقاعات تتبع الزرد بواسطة البرنامج. يبدو أن التجارب التي تصل إلى 1.5 ساعة (بالإضافة إلى وقت التوازن) ليس لها تأثير كبير على تتبع SM لأسماك الزرد البرية ، لكن الأسماك التي تظهر المزيد من الحركة أو لديها متطلبات أيضية متزايدة أخرى قد لا تكون مناسبة للتجارب بهذا الطول.
تركيز التخدير المتطاير بمرور الوقت
لضمان تركيز ثابت للتخدير المتطاير بمرور الوقت ، تم استخدام الآبار التي لا تحتوي على أسماك الزرد لقياس المسار الزمني لتركيز التخدير على النحو الذي يحدده HPLC. تمت إضافة نفس المحلول إلى كل بئر ، وتم قياس تركيز سيفوفلوران أو الأيزوفلوران كل 15 دقيقة لمدة 3 ساعات (كل قياس من بئر مختلف ، على عكس تكرار القياسات من نفس البئر). كما يتضح من الشكل 3 ، لم يتم فقد أي مخدر تقريبا طوال المسار الزمني مع سيفوفلوران (ضغط بخار 197 مم زئبق عند 25 درجة مئوية) ، والذي يحتوي على ضغط بخار أقل من الأيزوفلوران (ضغط بخار 238 مم زئبق عند 25 درجة مئوية) والذي أظهر خسارة بنسبة 4٪ عند 3 ساعات. لم يظهر أي من التخدير المتطاير خسارة ملحوظة في الفترة من 30 دقيقة إلى 60 دقيقة ، وهو أمر نموذجي للعديد من التجارب السلوكية.
فاعلية سيفوفلوران في يرقات الزرد
تم استخدام هذه التقنية لقياس فاعلية التخدير المتطاير في الزرد15 ، وقد تكون متفوقة على المنهجيات الأخرى المستخدمةسابقا 4. يظهر متوسط التركيز الفعال (EC50) للسيفوفلوران من خلال مقاييس الحركة التلقائية (SM) والحركة المستحثة (EM) في الشكل 4. باستخدام تقنية البئر المختومة ، تم تحديد قيم EC50 البالغة 62 ميكرومتر (95٪ CI: 49-81) ل SM ، و 126 ميكرومتر (95٪ CI: 81-193) ل EM. قيمة SM قابلة للمقارنة مع EC50 المبلغ عنها سابقا من 76 ميكرومتر (95٪ CI: 50-114). ومع ذلك ، فإن القيمة المبلغ عنها سابقا وهي 240 ميكرومتر (فاصل الثقة 95٪: 169-328) ل EM تقارب ضعف القيمة التي تم الحصول عليها هنا4. بدون إجراء دراسة HPLC مماثلة لهذه المنهجية (الشحوم المفرغة وغطاء الزجاج لإنشاء ختم محكم الغلق) ، لا يمكن القول على وجه اليقين ما إذا كان هذا الاختلاف ناتجا عن فقدان التخدير المتطاير بمرور الوقت. ومع ذلك ، فهي فرضية عقلانية ، خاصة بالنظر إلى أن حافز EM (النقر الصوتي) يتم تسجيله في نهاية وقت الملاحظة السلوكية. بغض النظر عن طريقة إغلاق البئر ، فإن أي فقدان لتركيز سيفوفلوران سيكون له التأثير الأكبر في نقاط زمنية لاحقة. بالطبع ، قد تكون هذه الاختلافات بسبب عوامل أساسية أخرى ، مثل الخلفية الجينية لسمك الزرد.
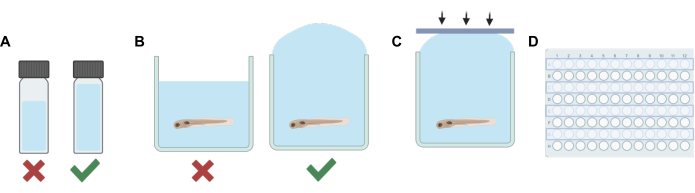
الشكل 1: الخطوات الإجرائية الرئيسية. (أ) عند العمل مع المحاليل المتطايرة ، يتم تخطيط التخفيف لتقليل مسافة الرأس في كل قارورة. (ب) يتم الإفراط في ملء الآبار عند إضافة المحاليل التجريبية إلى تلك التي تحتوي على أسماك الزرد للتخلص من فقاعات الهواء. (ج) يتم تطبيق شرائط لاصقة من السيليكون من جانب واحد من اللوحة إلى الجانب الآخر لمنع انحباس الهواء. (د) يستخدم كل صف آخر للتجارب لمنع تلوث الآبار المجاورة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
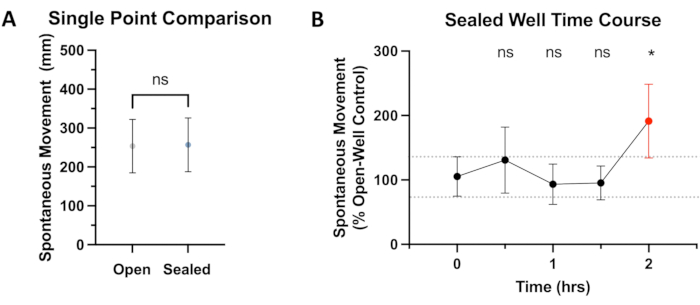
الشكل 2: مقارنة الحركة في الآبار المغلقة مقابل الآبار المفتوحة. (أ) تتم مقارنة الحركة التلقائية الكلية من 0 دقيقة إلى 4 دقائق بعد التوازن لمدة 15 دقيقة في الوحدة السلوكية. حركة أسماك الزرد بعد 5 أيام من الإخصاب (dpf) في الآبار المفتوحة (254 مم، مجال الموثوقية 95٪: 185-322) والآبار المغلقة (257 مم، مجال الموثوقية 95٪: 186-326) لا تظهر فرقا معنويا (P = 0.374). (ب) بعد فترة تأقلم مدتها 15 دقيقة في نظام سلوك أسماك الزرد ، لوحظت الأسماك (N ≥ 36) للحركة التلقائية (المسافة الإجمالية المقطوعة) على مدى 4 دقائق في بداية كل نصف ساعة. يتم عرض البيانات كنسبة مئوية للتحكم (الآبار المفتوحة) ، مع إجراء مقارنات إحصائية (ANOVA) إلى النقطة الزمنية 0-ساعة. باستخدام عتبة قيمة P البالغة <0.05 ، لوحظ اختلاف كبير في الحركة بين الآبار المفتوحة والمختومة عند علامة 2 ساعة (P = 0.0139) ، مظللة باللون الأحمر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
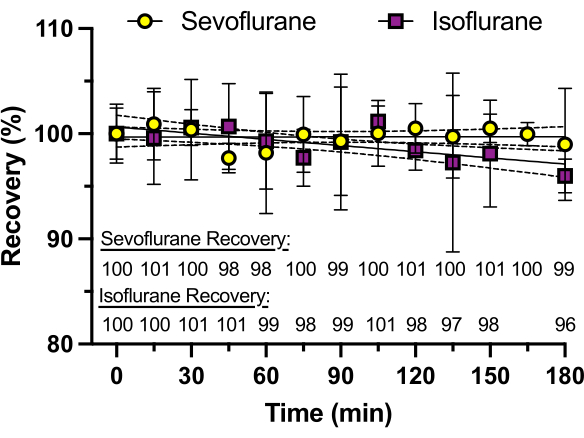
الشكل 3: استعادة سيفوفلوران بمرور الوقت. يتم تحديد تركيزات سيفوفلوران والأيزوفلوران في ألواح الآبار الزجاجية المختومة بمادة لاصقة من السيليكون بواسطة كروماتوغرافيا سائلة عالية الأداء (HPLC) على مدى 3 ساعات. تظهر النسبة المئوية للاسترداد ، محسوبة كمتوسط ثلاث تكرارات ، في الجزء السفلي من الرسم البياني. يظهر الأيزوفلوران خسارة تصل إلى 4٪ في التركيز عند 3 ساعات ، ويرجع ذلك على الأرجح إلى ارتفاع ضغط البخار (238 مم زئبق عند 25 درجة مئوية) مقارنة بالسيفوفلوران (197 مم زئبق عند 25 درجة مئوية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
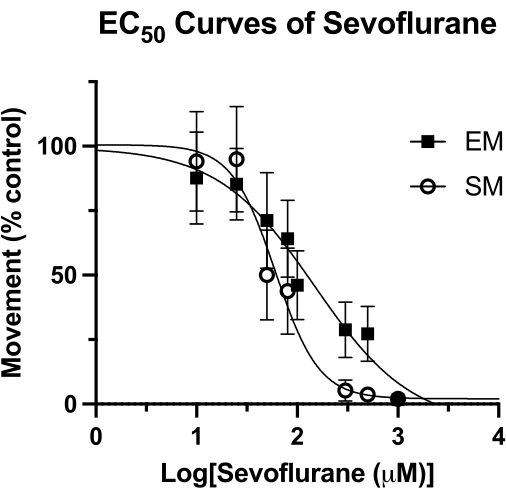
الشكل 4: منحنيات Sevoflurane EC50 . يتم تحديد منحنى سيفوفلوران EC50 في الآبار المختومة بناء على الحركة التلقائية (على مدى 4 دقائق) ، والحركة المستحثة (فترة ثانية واحدة بعد النقر الصوتي) ل 5 dpf من أسماك الزرد. يتم تغيير حجم الحركة إلى عناصر تحكم DMSO فقط. يتم حساب قيمة EC50 النهائية على أنها 62 ميكرومتر (فاصل الثقة 95٪: 49-81) للحركة العفوية (SM) و 126 ميكرومتر (95٪ CI: 81-193) للحركة المستحثة (EM). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توضح هذه المقالة طريقة لإعطاء التخدير المتطاير بسهولة ، مثل سيفوفلوران ، لسمك الزرد اليرقي ، والذي تم استخدامه لتحديد فعالية التخدير المتطاير في الأسماك البرية. على الرغم من أن هذه التقنية بسيطة من الناحية المفاهيمية ، إلا أنها قد تتطلب ممارسة لضمان صف من الآبار مغلق بشكل كاف وخالي من الفقاعات في إطار زمني قصير لتقليل فقدان العوامل المتطايرة. نظرا لأن هذه الطريقة مخصصة للمركبات المتطايرة ، فإنها لا تتطلب فقط تطبيقا دقيقا لمادة لاصقة السيليكون على لوحة البئر ولكن أيضا إعدادا دقيقا للحلول التجريبية لتحسين دقة تركيزات المركبات المتطايرة.
يمكن أن يؤدي احتباس الهواء إلى منع التصور والتتبع الدقيقين. بالإضافة إلى ممارسة الختم ، يعد الملء والفحص الدقيق لكل بئر أمرا بالغ الأهمية حيث من غير المرجح إزالة أي فقاعات موجودة قبل الختم أثناء عملية الختم. يساعد الإفراط في ملء الآبار أيضا على منع احتباس الهواء في كل بئر. ومع ذلك ، فإن الكثير من الملء الزائد يمكن أن يؤدي إلى النقل غير المقصود للأسماك إلى الآبار المجاورة. إذا حدث هذا ، فحاول الإفراط في ملء كمية أقل. لن يساعد تقليل الملء الزائد على النقل غير المقصود للأسماك إلى الآبار المجاورة فحسب ، بل قد يعزز فعالية المادة اللاصقة المستخدمة في الختم في وجود كميات كبيرة من المحلول الزائد. على الرغم من أن المادة اللاصقة قد تم اختيارها على وجه التحديد جزئيا لقدرتها على الالتصاق بالأسطح الرطبة ، إلا أن البدء بلوحة نظيفة وجافة يضمن عدم تداخل أي مواد أخرى مع الالتصاق ، وبالتالي تحسين السلامة العامة للإعداد التجريبي. إذا استمرت الفقاعات على الرغم من عدم وجود فقاعات قبل تطبيق المادة اللاصقة ، وتحسين الملء الزائد ، وتقنية تطبيق لاصق السيليكون ، فقد يكون ذلك بسبب استخدام شرائط لاصقة ضيقة جدا. قد لا تغلق الشرائط غير العريضة بما فيه الكفاية أو تغلق بشكل غير كاف لمنع دخول الهواء أثناء عملية التطبيق أو بعدها. إدخال آخر محتمل للخطأ في هذه التقنية هو جودة الختم الذي تنتجه شرائط السيليكون اللاصقة ، والتي يمكن أن تكون ناجمة عن التجاعيد في السيليكون ، أو عدم كفاية الختم للمادة اللاصقة (عدم كفاية التمهيدي اللاصق ، أو وقت المعالجة ، أو تنظيف الأسطح قبل تطبيق السيليكون). على الرغم من أن المادة اللاصقة نفسها تبدو وكأنها توفر ختما محكما بدرجة كافية ، بدون السيليكون كدعم وقائي ، إلا أن المادة اللاصقة وحدها قد تفشل في توفير مقاومة كافية للماء للحماية من الحمام المائي المتداول طوال مدة التجربة.
تعتبر الألواح الزجاجية مناسبة تماما لهذا التطبيق ، على عكس العديد من المواد البلاستيكية20 ، فهي متوافقة مع المواد الكارهة للماء مثل التخدير المتطاير ، وسطحها مسطح (على عكس ألواح الآبار البلاستيكية النموذجية) ، مما يسمح بالتصاق شريط السيليكون ، ولها قيعان شفافة (على عكس التفلون وبعض الألواح البلاستيكية). قد توفر ألواح آبار الكوارتز وضوحا بصريا متزايدا للتجارب التي يكون فيها التصوير عالي الدقة مبررا. تم الحصول على جميع البيانات النموذجية المعروضة هنا في ألواح زجاجية مكونة من 96 بئرا ، وتتوفر ألواح أخرى مماثلة تجاريا بتنسيقات آبار أكبر ، ولكن لم يتم اختبارها من قبل المؤلفين. قد يؤدي المزيد من الحلول في بئر أكبر إلى زيادة المدة المحتملة للتجربة باستخدام هذه التقنية بسبب زيادة توافر الأكسجين وقد يسهل أيضا التجارب على أسماك الزرد القديمة ، لكن تعديل التجربة بهذه الطريقة سيتطلب مزيدا من التحقق من الصحة. تشمل التعديلات الأخرى لهذه التقنية تطبيق هذه التقنية على النماذج السلوكية الأخرى (على سبيل المثال ، المحفزات مثل الضوء) 21 ، والنماذج الجينية المختلفة ، وأنواع أخرى من الدراسات الدوائية (على سبيل المثال ، الإدارة المشتركة للأدوية) ، وربما حتى التكيف مع دراسات التصوير.
توفر هذه الطريقة طريقة بسيطة ويمكن الوصول إليها لإدارة المركبات المتطايرة لأسماك الزرد لغرض الملاحظة السلوكية. يعتبر الزرد نموذجا شائعا بشكل متزايد لدراسة التخدير ، ولا سيما التخدير الوريدي (الوريدي) (بروبوفول ، إيتوميدات ، الكيتامين ، إلخ). ويرجع ذلك جزئيا إلى سهولة إعطاء الدواء ، ولكن هناك أيضا اعتبارات منخفضة للحركية الدوائية مقارنة بإعطاء التخدير الوريدي لنماذج غير المائية (الديدان والذباب والقوارض والبشر وما إلى ذلك) التي تتطلب نماذج تسريب يتم التحكم فيها عن طريق الهدف للإدارة في الحالةالمستقرة 2. هذا يمكن مقارنته بإعطاء العوامل المتطايرة في هذه ، وهو أمر بسيط مثل وضع في صندوق وجعله يتنفس في العامل الممزوج بالأكسجين / الهواء. يعد إعطاء العوامل المتطايرة للحيوانات المائية (الزرد ، الضفادع الصغيرة) أكثر تعقيدا لأنه يتطلب بيئة مائية محكمة الغلق. يميل هذا التفاضل إلى تقسيم استخدام نماذج حيوانية معينة لبعض التخدير ، ولكن بالطريقة المعروضة هنا ، يمكن توصيل كلتا الفئتين من التخدير بسهولة إلى نفس النموذج الحيواني. القدرة على مقارنة النماذج التجريبية المختلفة بسهولة في نموذج واحد على الرغم من اختلاف طرق الإدارة. يمكن تكييف هذا أيضا لاستخدام التخدير المتطاير بطريقة تستخدم نقاط القوة الأخرى لأسماك الزرد ، بما في ذلك قابليتها للتتبع الجيني ، وتطورها السريع ، والأجنة الشفافة ، مما يسهل المراقبة في الوقت الفعلي للاستجابات الفسيولوجية. يمكن أن يؤدي فهم تأثير التخدير المتطاير ، مثل الأيزوفلوران والسيفوفلوران ، في أسماك الزرد إلى تعزيز فهم آليات عملها وآثارها الجانبية. توفر هذه المنهجية الجديدة إطارا قويا للتحقيق في التخدير المتطاير في أسماك الزرد.
Disclosures
ليس لدى المؤلفين أي تعارض للإفصاح عنه.
Acknowledgements
تم تمويل هذا العمل من قبل مؤسسة تعليم وأبحاث التخدير (FAER). تم إنشاء الشكل 1 في BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
References
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved