Method Article
Administração de anestésicos voláteis a larvas de peixe-zebra para observação comportamental
Neste Artigo
Resumo
Este protocolo apresenta um método acessível para criar um ambiente à prova de gás para administrar anestésicos voláteis a larvas de peixe-zebra para experimentos comportamentais.
Resumo
Este estudo descreve um método único para administrar anestésicos voláteis, como isoflurano e sevoflurano, a larvas de peixe-zebra durante experimentos comportamentais. Embora o peixe-zebra ofereça inúmeras vantagens como organismo modelo de vertebrado - incluindo comportamentos complexos, tratabilidade genética, embriões transparentes e desenvolvimento rápido - seu uso no estudo de anestésicos voláteis tem sido limitado. A administração de anestésicos voláteis geralmente requer aparelhos complexos ou pesados que podem não ser amplamente acessíveis, criando barreiras ao estudo farmacológico de anestésicos voláteis em organismos modelo aquosos. Este método apresenta uma técnica simples usando folhas adesivas de silicone para criar uma vedação à prova de gás em placas de vidro de 96 poços. A validação foi realizada por meio da avaliação do movimento espontâneo, que não mostrou diferenças significativas entre poços selados e abertos em um período de 90 minutos. Além disso, a concentração do anestésico permaneceu estável ao longo do tempo, medida por HPLC. Os resultados representativos incluem a determinação experimental dos valores médios da concentração efetiva (EC50) para o sevoflurano. Este estudo fornece uma abordagem simples e acessível para experimentos farmacológicos usando anestésicos voláteis, que podem ser facilmente adaptados para estudar outros agentes voláteis e desfechos experimentais.
Introdução
Modelos animais não aquáticos (vermes, moscas, roedores, coelhos, primatas, etc.) têm sido historicamente os modelos mais comumente usados para estudar a farmacologia anestésica. Em cada uma dessas espécies, os anestésicos voláteis (administrados por inalação de gás) são muito menos desafiadores do que a administração de anestésicos intravenosos (administrados por via intravenosa ou intraperitoneal)1. Além do desafio técnico de simplesmente administrar os medicamentos intravenosos, alcançar um estado estacionário de anestesia é muito mais fácil com agentes voláteis do que com agentes intravenosos2.
A administração de anestésicos intravenosos a larvas de espécies aquáticas pode ser obtida por difusão de seu meio aquoso circundante 3,4 e, portanto, é mais semelhante à administração de anestésicos voláteis para espécies não aquosas. Por muitos anos, os girinos (Xenopus laevis) foram o modelo de escolha para o estudo de anestésicos devido à facilidade de administração de drogas e farmacocinética em estado estacionário alcançada pela simples adição do anestésico em banho à água artificial da lagoa 5,6. No entanto, existem relativamente poucos exemplos do estudo de anestésicos voláteis neste modelo devido à necessidade de aparelhos estanques ao gás que geralmente são construídos especificamente e podem ser complicados de usar 7,8.
Nos últimos anos, o peixe-zebra tornou-se um modelo preferencial para o estudo de anestésicos intravenosos devido à mesma facilidade de administração de medicamentos, além de outras vantagens, como seus comportamentos complexos bem descritos e disponibilidade de unidades comerciais para observar esses comportamentos9. Muitos estudos recentes empregaram essas unidades de observação disponíveis comercialmente para rastrear compostos neuroativos, incluindo anestésicos, usando formatos de placas de 96 e 24 poços para quantificar o comportamento das larvas de peixe-zebra 4,10,11,12,13,14,15 . Os estágios larvais são particularmente adequados para estudos de farmacologia devido à sua capacidade de avaliar muitas respostas comportamentais, seu tamanho pequeno, alta compatibilidade de rendimento e circuitos neurais bem caracterizados 9,16,17. No entanto, uma limitação significativa nesses estudos de anestésicos no modelo de peixe-zebra é a relativa dificuldade em administrar anestésicos voláteis. Essa limitação levou a poucos exemplos de comparação entre agentes voláteis e intravenosos 4,15,18. Ser capaz de estudar e comparar facilmente as duas classes de anestésicos em um único modelo animal adiciona uma ferramenta importante para facilitar o estudo da farmacologia anestésica em todas as classes.
Tradicionalmente, o estudo de anestésicos intravenosos em uma espécie aquática requer equipamentos especializados, muitas vezes personalizados, que podem ser difíceis de usar ou podem não ser suficientemente estanques ao gás para evitar a perda do anestésico durante o experimento. O procedimento descrito aqui apresenta um meio alternativo facilmente acessível de produzir uma vedação à prova de gás em uma câmara de vidro que é adequada para observação do comportamento das larvas de peixe-zebra usando uma unidade de observação comercial (ver Tabela de Materiais).
Protocolo
Todos os experimentos com peixe-zebra foram conduzidos de acordo com os protocolos de uso de animais aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC). Os peixes-zebra adultos foram mantidos nas instalações aquáticas da Universidade da Pensilvânia sob a supervisão do University Laboratory Animal Resources (ULAR). O peixe-zebra selvagem de barbatana longa de Tübingen foi criado internamente para todos os experimentos e mantido em condições padrão de criação com um ciclo claro/escuro de 13/11 h até atingir 5 dias após a fertilização (dpf). Os experimentos foram conduzidos usando repetições biológicas, com ninhadas derivadas de pares de acasalamento distintos para garantir a diversidade biológica adequada. Os detalhes dos reagentes e equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Fabricação de folhas adesivas de silicone
NOTA: Equivalentes deste material (folha de silicone mais adesivo) podem ser adquiridos comercialmente, mas muitas vezes com maior custo e menor disponibilidade.
- Disponha a folha de silicone de 0,5 mm em uma superfície limpa e plana.
- Inspecione as folhas quanto a vincos e evite-os quando possível.
NOTA: Folhas de silicone com vincos podem não aderir adequadamente à fita e podem resultar em vedação inadequada dos poços e/ou má visualização do peixe-zebra. - Limpe as folhas com álcool 70% para remover qualquer óleo ou detritos e deixe-os secar.
- Usando um aplicador, como um pincel, aplique uma camada fina e uniforme de primer adesivo na folha de silicone. Para evitar a aplicação excessiva, trabalhe em seções menores, pois o promotor adesivo seca rapidamente (endurece em 1-5 s).
NOTA: Sem este promotor de adesão, a fita não aderirá adequadamente à folha de silicone. - Assim que o promotor de adesivo for aplicado, alinhe a fita dupla face com a folha de silicone com o suporte de papel voltado para cima.
- Aplique gradualmente a fita no silicone usando um rolo para alisar a superfície e remover as bolhas de ar (após a aplicação inicial, trabalhar com o lado do silicone para cima ajudará na visualização e remoção das bolhas de ar).
- Deixe o promotor adesivo curar completamente por 24 h em uma superfície plana.
- Corte o silicone adesivo em tiras de pelo menos 10 mm de largura (7,5 mm de diâmetro do poço mais sobreposição de cada lado).
NOTA: Ao usar todas as outras fileiras da placa do poço, uma variação maior nas tiras não afetará negativamente os poços nas fileiras adjacentes, o que pode não apenas facilitar a aplicação, mas também ser necessário para obter uma vedação em toda a circunferência do poço.- Certifique-se de que as tiras sejam longas o suficiente para cobrir pelo menos a largura de uma fileira da placa do poço.
NOTA: Se estiver usando uma placa de poço que não seja de 96 poços, como uma placa de 24 ou 48 poços, os tamanhos das tiras podem ser ajustados ou cortados para se adequar às dimensões específicas da placa, garantindo a cobertura adequada, independentemente do tamanho da placa.
- Certifique-se de que as tiras sejam longas o suficiente para cobrir pelo menos a largura de uma fileira da placa do poço.
2. Preparação de soluções
NOTA: Todas as soluções de estoque e ensaio de anestésicos voláteis foram feitas logo antes do experimento para evitar a perda da concentração de compostos voláteis.
- Para cada solução (estoque ou solução de trabalho), adicione um volume de solvente não volátil (água embrionária E3, DMSO, etc.) a um frasco para HPLC ou cintilação que, quando combinado com a diluição final do anestésico volátil, o volume total preencherá suficientemente o frasco, deixando um espaço mínimo (ver Figura 1A).
- Adicione anestésico volátil com uma seringa à prova de gás Hamilton e feche rapidamente o frasco.
NOTA: As soluções de estoque em frascos para injetáveis com tampas de septo podem ser usadas para facilitar diluições adicionais por meio da transferência de solução com seringas estanques ao gás. - Em seguida, misture os frascos (vórtice, sonicação) conforme necessário e armazene-os temporariamente enquanto prepara os pratos de peixe-zebra.
3. Configuração do experimento comportamental
NOTA: Esta etapa do protocolo pode exigir alguma prática. Recomenda-se trabalhar sem peixes ou soluções contendo material precioso até se sentir confortável com a técnica.
- Transfira uma larva de peixe-zebra (5 dpf) para cada duas fileiras da placa de vidro de 96 poços.
NOTA: Deixar todas as outras linhas vazias permite reduzir o potencial de contaminação dos poços adjacentes por transbordamento, pois os poços são selados na etapa 3.4. - Remova cuidadosamente a solução E3 de cada poço. Isso pode ser feito uma linha de cada vez ou em toda a placa, se for capaz de trabalhar rapidamente.
NOTA: A duração durante a qual as larvas ficaram fora da solução foi minimizada para reduzir o estresse potencial. Procedimentos alternativos podem ser usados com base em diferentes necessidades experimentais, incluindo apenas a remoção parcial da solução antes da adição da solução contendo o medicamento para minimizar o estresse. O protocolo deve ser adaptado para atender às necessidades do experimento, incluindo o tempo de equilíbrio dado aos animais para compensar qualquer estresse potencial, eficiência de mistura da solução e precisão das concentrações de uma solução contendo medicamento, se nem todo o E3 for removido antes da adição da solução de trabalho. - Em seguida, use uma pipeta de transferência para encher cada poço na linha com a solução experimental. Tome cuidado para não introduzir bolhas. Encha demais cada poço (Figura 1B).
- Usando as tiras adesivas de silicone feitas na etapa 1, pressione a tira para baixo rapidamente (Figura 1C). Isso ajuda a evitar a formação de bolhas e evita que os peixes transbordem para os poços adjacentes.
- Pressione firmemente a parte superior da placa para garantir que cada poço esteja selado.
- Repita as etapas 2 a 5 até que a solução seja trocada e os poços para todas as outras fileiras da placa do poço sejam selados (Figura 1D).
- Vire suavemente a placa e verifique se há bolhas de ar.
NOTA: A presença de bolhas de ar obscurecerá a visualização do movimento do peixe-zebra. - Coloque a placa na unidade de observação do comportamento (lado adesivo de silicone para baixo) e execute o experimento comportamental (consulte a seção Resultados para obter detalhes).
Resultados
Comparação com a observação tradicional de poço aberto
Para avaliar se o selamento adesivo tem algum efeito sobre o movimento espontâneo, foi feita uma comparação entre os controles em poços abertos e selados. Como visto na Figura 2A, nenhuma diferença estatisticamente significativa no movimento foi observada entre esses grupos para a duração padrão de ~ 30 minutos usada nos experimentos descritos neste artigo. Reconhecendo que outros paradigmas experimentais podem precisar de uma exposição experimental mais longa, um curso de tempo de 2 horas foi realizado, não revelando nenhuma diferença estatística no movimento até a marca de 2 horas (ver Figura 2B). Uma duração experimental mais longa provavelmente resultaria em um diferencial ainda maior no movimento. Estudos anteriores quantificaram o efeito adverso da hipóxia no comportamento de natação19, comprometendo a integridade dos resultados experimentais. Assim, hipotetiza-se que a hipóxia e/ou a produção de CO2 são as causas mais prováveis desse desvio no SM em comparação com os controles de poço aberto. Infelizmente, a vedação estanque ao gás que evita a perda de anestésico volátil do poço fechado também impede a difusão de outros gases para dentro ou para fora da solução fechada. Isso, é claro, significa difusão restrita de CO2 e oxigênio conforme são produzidos e consumidos respectivamente pelos peixes. Esta é uma limitação importante no que diz respeito à duração do experimento possível com este método. Também é importante notar que, com o tempo, pequenas bolhas começam a se formar em poços anteriormente livres de bolhas, presumivelmente devido ao metabolismo. No entanto, durante os testes, essas bolhas não impediram o rastreamento do peixe-zebra pelo software. Experimentos de até 1,5 h (mais o tempo de equilíbrio) parecem não ter efeito significativo no rastreamento de SM desses peixes-zebra do tipo selvagem, mas peixes que exibem mais movimento ou têm outras demandas metabólicas aumentadas podem não ser adequados para experimentos desse comprimento.
Concentração de anestésico volátil ao longo do tempo
Para garantir uma concentração consistente de anestésico volátil ao longo do tempo, poços sem peixe-zebra foram usados para medir um curso de tempo de concentração de anestésico conforme determinado por HPLC. A mesma solução foi adicionada a cada poço, e a concentração de sevoflurano ou isoflurano foi medida a cada 15 min por 3 h (cada medição de um poço diferente, em oposição a medições repetidas do mesmo poço). Como pode ser visto na Figura 3, praticamente nenhum anestésico foi perdido ao longo do tempo com o sevoflurano (pressão de vapor de 197 mmHg a 25 °C), que tem uma pressão de vapor menor do que o isoflurano (pressão de vapor de 238 mmHg a 25 °C), que mostrou uma perda de 4% em 3 h. Nenhum dos anestésicos voláteis apresentou perda apreciável no intervalo de 30 minutos a 60 minutos, o que é típico de muitos experimentos comportamentais.
Potência do sevoflurano em larvas de peixe-zebra
Essa técnica tem sido utilizada para medir a potência de anestésicos voláteis em peixe-zebra15 e pode ser superior a outras metodologias utilizadas anteriormente4. A concentração efetiva mediana (EC50) para o sevoflurano por medidas de movimento espontâneo (SM) e movimento provocado (EM) é mostrada na Figura 4. Com a técnica de poço selado, foram determinados os valores de EC50 de 62 μM (IC 95%: 49-81) para SM e 126 μM (IC 95%: 81-193) para EM. O valor SM é comparável ao EC50 relatado anteriormente de 76 μM (IC 95%: 50-114). No entanto, o valor relatado anteriormente de 240 μM (IC 95%: 169-328) para EM é quase o dobro do valor obtido aqui4. Sem realizar um estudo de HPLC semelhante desta metodologia (graxa a vácuo e uma lamínula de vidro para criar uma vedação hermética), não se pode dizer com certeza se essa diferença se deve a uma perda de anestésico volátil ao longo do tempo. No entanto, é uma hipótese racional, especialmente considerando que o estímulo para EM (tapado acústico) é registrado no final do tempo de observação comportamental. Independentemente do método de vedação do poço, qualquer perda de concentração de sevoflurano teria o maior efeito em momentos posteriores. Claro, essas diferenças podem ser devidas a outros fatores subjacentes, como o histórico genético do peixe-zebra.
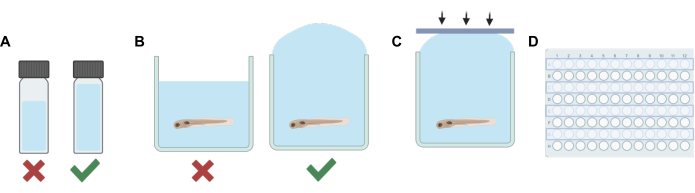
Figura 1: Principais etapas processuais. (A) Ao trabalhar com soluções voláteis, o planejamento de diluição é feito para minimizar o espaço livre em cada frasco. (B) O enchimento excessivo de poços é realizado ao adicionar soluções experimentais àquelas que contêm peixe-zebra para eliminar bolhas de ar. (C) Tiras adesivas de silicone são aplicadas de um lado a outro da placa para evitar o aprisionamento de ar. (D) Todas as outras linhas são usadas para experimentos para evitar a contaminação de poços adjacentes. Clique aqui para ver uma versão maior desta figura.
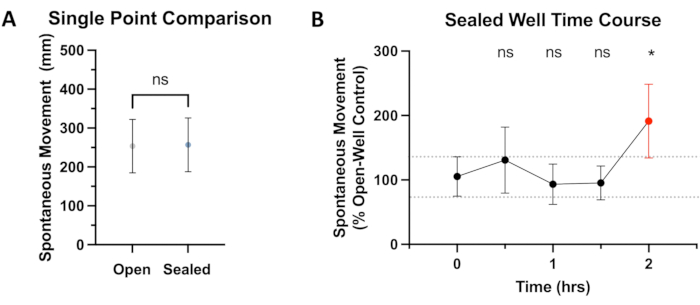
Figura 2: Comparação do movimento em poços selados versus abertos. (A) O movimento espontâneo total de 0 min a 4 min após um equilíbrio de 15 min na unidade comportamental é comparado. O movimento do peixe-zebra 5 dias pós-fertilização (dpf) em poços abertos (254 mm, IC 95%: 185-322) e poços selados (257 mm, IC 95%: 186-326) não mostra uma diferença significativa (P = 0,374). (B) Após um período de aclimatação de 15 minutos no sistema de comportamento do peixe-zebra, os peixes (N ≥ 36) são observados quanto ao movimento espontâneo (distância total percorrida) durante um período de 4 minutos no início de cada meia hora. Os dados são mostrados como controle percentual (poços abertos), com comparações estatísticas (ANOVA) feitas para o ponto de tempo de 0 h. Usando um limite de valor P de <0,05, uma diferença significativa no movimento entre poços abertos e selados é observada na marca de 2 horas (P = 0,0139), destacada em vermelho. Clique aqui para ver uma versão maior desta figura.
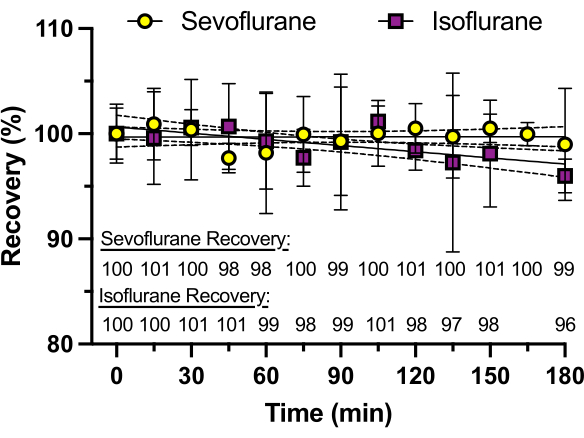
Figura 3: Recuperação do sevoflurano ao longo do tempo. As concentrações de sevoflurano e isoflurano em placas de vidro seladas com adesivo de silicone são determinadas por cromatografia líquida de alta eficiência (HPLC) durante um período de 3 horas. A porcentagem de recuperação, calculada como a média de três repetições, é mostrada na parte inferior do gráfico. O isoflurano apresenta uma perda de concentração de até 4% em 3 h, provavelmente devido à sua maior pressão de vapor (238 mmHg a 25 °C) em comparação com o sevoflurano (197 mmHg a 25 °C). Clique aqui para ver uma versão maior desta figura.
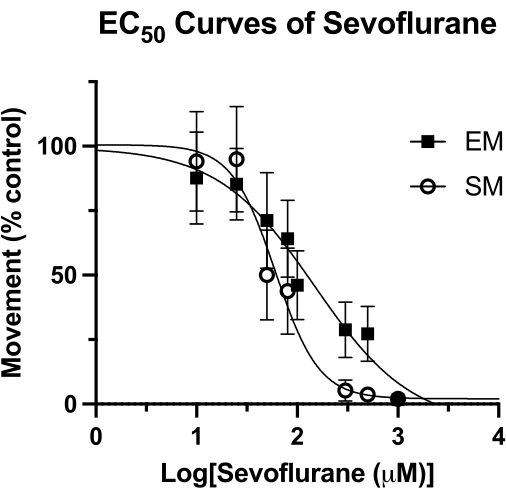
Figura 4: Curvas EC50 do sevoflurano. Uma curva EC50 de sevoflurano em poços selados é determinada com base no movimento espontâneo (durante um período de 4 minutos) e no movimento provocado (período de 1 segundo após uma batida acústica) de peixe-zebra de 5 dpf. O movimento é dimensionado para controles somente DMSO. O valor final de EC50 é calculado como 62 μM (IC 95%: 49-81) para movimento espontâneo (SM) e 126 μM (IC 95%: 81-193) para movimento provocado (EM). Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo descreve um método para administrar prontamente anestésicos voláteis, como o sevoflurano, a larvas de peixe-zebra, que foi usado para quantificar a potência do anestésico volátil em peixes selvagens. Embora essa técnica seja conceitualmente simples, pode ser necessária prática para garantir uma linha de poços adequadamente vedada e sem bolhas em um curto espaço de tempo para minimizar a perda de agentes voláteis. Como esse método se destina a compostos voláteis, ele requer não apenas a aplicação cuidadosa do adesivo de silicone na placa do poço, mas também a preparação cuidadosa de soluções experimentais para otimizar a precisão das concentrações de compostos voláteis.
O aprisionamento de ar pode inibir a visualização e o rastreamento precisos. Além da prática de vedação, o enchimento e a inspeção cuidadosos de cada poço são essenciais, pois é improvável que quaisquer bolhas presentes antes da vedação sejam removidas durante o processo de vedação. O enchimento excessivo de poços também ajuda a evitar o aprisionamento de ar em cada poço. No entanto, o excesso de enchimento pode levar à transferência não intencional de peixes para poços adjacentes. Se isso acontecer, tente encher menos demais. Minimizar o excesso de enchimento não apenas ajudará na transferência não intencional de peixes para poços adjacentes, mas também poderá aumentar a eficácia do adesivo usado para selar na presença de grandes quantidades de excesso de solução. Embora o adesivo tenha sido escolhido especificamente em parte por sua capacidade de aderir a superfícies molhadas, começar com uma placa limpa e seca garante que nenhuma outra substância interfira na adesão, melhorando assim a integridade geral da configuração experimental. Se as bolhas ainda persistirem apesar da falta de bolhas bem antes da aplicação do adesivo, otimização do enchimento excessivo e técnica de aplicação de adesivo de silicone, isso pode ser devido ao uso de tiras adesivas muito estreitas. As tiras que não são largas o suficiente podem não selar ou vedar inadequadamente para evitar que o ar seja introduzido durante ou após o processo de aplicação. Outra possível introdução de erro com esta técnica é a qualidade da vedação produzida pelas tiras adesivas de silicone, que pode ser causada por vincos no silicone, vedação inadequada do adesivo (primer adesivo insuficiente, tempo de cura ou limpeza das superfícies antes da aplicação do silicone). Embora o adesivo em si pareça fornecer uma vedação suficientemente firme, sem o silicone como suporte protetor, o adesivo sozinho pode falhar em fornecer resistência à água adequada para proteger contra o banho-maria circulante durante o experimento.
As placas de vidro são adequadas para esta aplicação, pois, ao contrário de muitos plásticos20, são compatíveis com substâncias hidrofóbicas como anestésicos voláteis, sua superfície é plana (ao contrário das placas de poço de plástico típicas), permitindo a adesão da tira de silicone e têm fundo transparente (ao contrário do Teflon e de algumas placas de plástico). As placas de poços de quartzo podem fornecer maior clareza óptica para experimentos em que imagens de alta resolução são necessárias. Todos os dados de exemplo apresentados aqui foram obtidos em placas de vidro de 96 poços, e outras placas semelhantes estão disponíveis comercialmente em formatos de poços maiores, mas não foram testados pelos autores. Mais soluções em um poço maior podem aumentar a duração potencial de um experimento com essa técnica devido à maior disponibilidade de oxigênio e também podem facilitar experimentos com peixes-zebra mais velhos, mas a modificação de um experimento dessa maneira exigiria validação adicional. Outras modificações dessa técnica incluem a aplicação dessa técnica a outros paradigmas comportamentais (por exemplo, estímulos como a luz)21, vários modelos genéticos, outros tipos de estudos farmacológicos (por exemplo, coadministração de medicamentos) e talvez até adaptação para estudos de imagem.
Este método fornece um método simples e acessível para a administração de compostos voláteis ao peixe-zebra para fins de observação comportamental. O peixe-zebra é um modelo cada vez mais popular para o estudo de anestésicos, em particular anestésicos intravenosos (IV) (propofol, etomidato, cetamina, etc.). Isso se deve em parte à facilidade de administração de medicamentos, mas também há considerações farmacocinéticas reduzidas em comparação com a administração de anestésicos IV a modelos animais não aquáticos (vermes, moscas, roedores, humanos, etc.) que requerem modelos de infusão controlados por alvo para administração em estado estacionário2. Isso é comparável à administração de agentes voláteis nesses animais, que é tão simples quanto colocar o animal em uma caixa e fazê-lo respirar o agente misturado com oxigênio / ar. A administração de agentes voláteis a animais aquáticos (peixe-zebra, girinos) é mais complicada, pois requer um ambiente aquoso selado. Esse diferencial tende a dividir o uso de certos modelos animais para certos anestésicos, mas com o método aqui apresentado, ambas as classes de anestésicos podem ser prontamente administradas ao mesmo modelo animal. Ser capaz de comparar facilmente vários paradigmas experimentais em um único modelo, apesar das diferentes vias de administração. Isso também pode ser adaptado para o uso de anestésicos voláteis de uma forma que utilize os outros pontos fortes do peixe-zebra, incluindo sua tratabilidade genética, desenvolvimento rápido e embriões transparentes, que facilitam a observação em tempo real das respostas fisiológicas. Compreender o impacto de anestésicos voláteis, como isoflurano e sevoflurano, no peixe-zebra pode melhorar a compreensão de seus mecanismos de ação e efeitos colaterais. Esta nova metodologia fornece uma estrutura robusta para a investigação de anestésicos voláteis em peixe-zebra.
Divulgações
Os autores não têm conflitos a divulgar.
Agradecimentos
Este trabalho foi financiado pela Fundação para Educação e Pesquisa em Anestesia (FAER). A Figura 1 é criada em BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
Referências
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados