Method Article
Administration d’anesthésiques volatils à des larves de poisson-zèbre pour l’observation comportementale
Dans cet article
Résumé
Ce protocole présente une méthode accessible pour créer un environnement étanche aux gaz afin d’administrer des anesthésiques volatils aux larves de poisson-zèbre pour des expériences comportementales.
Résumé
Cette étude décrit une méthode unique d’administration d’anesthésiques volatils, tels que l’isoflurane et le sévoflurane, aux larves de poisson-zèbre au cours d’expériences comportementales. Bien que le poisson-zèbre offre de nombreux avantages en tant qu’organisme modèle de vertébré - y compris des comportements complexes, une traçabilité génétique, des embryons transparents et un développement rapide - leur utilisation dans l’étude des anesthésiques volatils a été limitée. L’administration d’anesthésiques volatils nécessite souvent des appareils complexes ou encombrants qui peuvent ne pas être largement accessibles, créant des obstacles à l’étude pharmacologique des anesthésiques volatils dans des organismes modèles aqueux. Cette méthode présente une technique simple utilisant des feuilles de silicone adhésives pour créer un joint étanche au gaz sur des plaques de verre à 96 puits. La validation a été effectuée par l’évaluation du mouvement spontané, qui n’a montré aucune différence significative entre les puits scellés et ouverts sur une période de 90 minutes. De plus, la concentration de l’anesthésique est restée stable au fil du temps, telle que mesurée par HPLC. Les résultats représentatifs comprennent la détermination expérimentale des valeurs de concentration efficace médiane (EC50) pour le sévoflurane. Cette étude fournit une approche simple et accessible pour les expériences pharmacologiques utilisant des anesthésiques volatils, qui peut être facilement adaptée pour étudier d’autres agents volatils et paramètres expérimentaux.
Introduction
Les modèles d’animaux non aquatiques (vers, mouches, rongeurs, lapins, primates, etc.) ont toujours été les modèles les plus couramment utilisés pour étudier la pharmacologie anesthésique. Chez chacune de ces espèces, les anesthésiques volatils (administrés par inhalation de gaz) sont beaucoup moins difficiles que l’administration d’anesthésiques intraveineux (administrés par voie intraveineuse ou intrapéritonéale)1. En plus du défi technique que représente la simple administration des médicaments par voie intraveineuse, il est beaucoup plus facile d’obtenir un état d’anesthésie stable avec des agents volatils qu’avec des agents intraveineux2.
L’administration d’anesthésiques par voie intraveineuse aux espèces aquatiques larvaires peut être réalisée par diffusion à partir du milieu aqueux environnant 3,4, et s’apparente donc davantage à l’administration d’anesthésiques volatils pour les espèces non aqueuses. Pendant de nombreuses années, les têtards (Xenopus laevis) ont été le modèle de choix pour l’étude des anesthésiques en raison de la facilité d’administration des médicaments et de la pharmacocinétique à l’état d’équilibre obtenue par simple ajout de l’anesthésique dans un bain à l’eau de leur étang artificiel 5,6. Cependant, il y a relativement peu d’exemples d’étude des anesthésiques volatils dans ce modèle en raison de la nécessité d’appareils étanches aux gaz qui sont souvent spécialement conçus et peuvent être lourds à utiliser 7,8.
Ces dernières années, le poisson-zèbre est devenu un modèle privilégié pour l’étude des anesthésiques intraveineux en raison de la même facilité d’administration des médicaments en plus d’autres avantages tels que leurs comportements complexes bien décrits et la disponibilité d’unités commerciales pour observer ces comportements9. De nombreuses études récentes ont utilisé de telles unités d’observation disponibles dans le commerce pour dépister les composés neuroactifs, y compris les anesthésiques, en utilisant des formats de plaques à 96 puits et à 24 puits pour quantifier le comportement des larves de poisson-zèbre 4,10,11,12,13,14,15 . Les stades larvaires sont particulièrement bien adaptés aux études pharmacologiques en raison de leur capacité à évaluer de nombreuses réponses comportementales, de leur petite taille, de leur compatibilité à haut débit et de leurs circuits neuronaux bien caractérisés 9,16,17. Cependant, une limitation importante de ces études sur les anesthésiques dans le modèle du poisson-zèbre est la difficulté relative d’administrer des anesthésiques volatils. Cette limitation a conduit à de rares exemples de comparaison entre les agents volatils et intraveineux 4,15,18. La possibilité d’étudier et de comparer facilement les deux classes d’anesthésiques dans un seul modèle animal ajoute un outil important pour faciliter l’étude de la pharmacologie anesthésique dans toutes les classes.
Traditionnellement, l’étude des anesthésiques intraveineux chez une espèce aquatique nécessite un équipement spécialisé, souvent personnalisé, qui peut être difficile à utiliser ou ne pas être suffisamment étanche aux gaz pour empêcher la perte de l’anesthésique pendant la durée de l’expérience. La procédure décrite ici présente un moyen alternatif facilement accessible de produire un joint étanche aux gaz dans une chambre en verre qui convient à l’observation du comportement des larves de poisson-zèbre à l’aide d’une unité d’observation commerciale (voir le tableau des matériaux).
Protocole
Toutes les expériences sur le poisson-zèbre ont été menées conformément aux protocoles d’utilisation des animaux approuvés par l’Institutional Animal Care and Use Committee (IACUC). Les poissons-zèbres adultes ont été maintenus dans l’installation aquatique de l’Université de Pennsylvanie sous la supervision de l’University Laboratory Animal Resources (ULAR). Les poissons-zèbres sauvages à longues nageoires de Tübingen ont été élevés en interne pour toutes les expériences et maintenus dans des conditions d’élevage standard avec un cycle lumière/obscurité de 13/11 h jusqu’à ce qu’ils atteignent 5 jours après la fécondation (dpf). Les expériences ont été menées à l’aide de réplicats biologiques, avec des couvées dérivées de couples d’accouplement distincts pour assurer une diversité biologique adéquate. Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Fabrication de feuilles de silicone adhésives
REMARQUE : Les équivalents de ce matériau (feuille de silicone et adhésif) peuvent être d’origine commerciale, mais souvent à un coût plus élevé et une disponibilité moindre.
- Disposez la feuille de silicone de 0,5 mm sur une surface propre et plane.
- Inspectez les feuilles pour détecter tout pli et évitez-les dans la mesure du possible.
REMARQUE : Les feuilles de silicone avec des plis peuvent ne pas adhérer adéquatement au ruban et peuvent entraîner une étanchéité inadéquate des puits et/ou une mauvaise visualisation du poisson-zèbre. - Nettoyez les feuilles avec de l’alcool à 70 % pour enlever l’huile ou les débris et laissez-les sécher.
- À l’aide d’un applicateur, tel qu’un pinceau, appliquez une couche mince et uniforme d’apprêt adhésif sur la feuille de silicone. Pour éviter une application excessive, travaillez par sections plus petites car le promoteur de colle sèche rapidement (durcit en 1 à 5 s).
REMARQUE : Sans ce promoteur d’adhérence, le ruban n’adhérera pas correctement à la feuille de silicone. - Une fois le promoteur d’adhésif appliqué, alignez le ruban adhésif double face avec la feuille de silicone avec le support en papier vers le haut.
- Appliquez progressivement le ruban sur le silicone à l’aide d’un rouleau pour lisser la surface et éliminer les bulles d’air (après l’application initiale, le travail du côté silicone vers le haut aidera à visualiser et à éliminer les bulles d’air).
- Laisser le promoteur de l’adhésif durcir complètement pendant 24 h sur une surface plane.
- Coupez le silicone adhésif en bandes d’au moins 10 mm de large (7,5 mm de diamètre de puits plus chevauchement de chaque côté).
REMARQUE : Lorsque vous utilisez une rangée sur deux de la plaque de puits, une plus grande variance des bandes n’aura pas d’impact négatif sur les puits des rangées adjacentes, ce qui peut non seulement faciliter l’application, mais aussi être nécessaire pour obtenir une étanchéité sur toute la circonférence du puits.- Assurez-vous que les bandes sont suffisamment longues pour couvrir au moins la largeur d’une rangée de la plaque de puits.
REMARQUE : Si vous utilisez une plaque de puits qui n’est pas de 96 puits, telle qu’une plaque de 24 puits ou de 48 puits, les tailles de bande peuvent être ajustées ou coupées pour s’adapter aux dimensions spécifiques de la plaque, assurant ainsi une couverture appropriée quelle que soit la taille de la plaque.
- Assurez-vous que les bandes sont suffisamment longues pour couvrir au moins la largeur d’une rangée de la plaque de puits.
2. Préparation des solutions
REMARQUE : Toutes les solutions mères et d’essai d’anesthésiques volatils ont été préparées juste avant l’expérience pour éviter la perte de concentration des composés volatils.
- Pour chaque solution (mère ou solution de travail), ajoutez un volume de solvant non volatil (eau d’embryon E3, DMSO, etc.) à un flacon HPLC ou à scintillation qui, combiné à la dilution finale de l’anesthésique volatil, remplira suffisamment le flacon en laissant un espace libre minimal (voir Figure 1A).
- Ajoutez un anesthésique volatil à l’aide d’une seringue étanche au gaz Hamilton et scellez rapidement le flacon.
REMARQUE : Des solutions mères dans des flacons avec des couvercles de septum peuvent être utilisées pour faciliter les dilutions ultérieures via le transfert de la solution avec des seringues étanches aux gaz. - Ensuite, mélangez les flacons (vortex, sonication) au besoin et stockez-les temporairement pendant la préparation des assiettes de poisson-zèbre.
3. Mise en place de l’expérience comportementale
REMARQUE : Cette étape du protocole peut demander un peu de pratique. Il est recommandé de travailler sans poissons ou solutions contenant des matériaux précieux jusqu’à ce qu’ils soient à l’aise avec la technique.
- Transférez une larve de poisson-zèbre (5 dpf) dans toutes les autres rangées de la plaque de verre à 96 puits.
REMARQUE : Le fait de laisser une rangée sur deux vide permet de réduire le risque de contamination des puits adjacents par débordement, car les puits sont scellés à l’étape 3.4. - Retirez délicatement la solution E3 de chaque puits. Cela peut être fait une rangée à la fois ou sur toute la plaque s’il est capable de travailler rapidement.
REMARQUE : La durée pendant laquelle les larves sont sorties de la solution a été réduite au minimum afin de réduire le stress potentiel. D’autres procédures peuvent être utilisées en fonction de différents besoins expérimentaux, y compris l’élimination partielle de la solution avant l’ajout de la solution contenant le médicament pour minimiser le stress. Le protocole doit être adapté pour répondre aux besoins de l’expérience, y compris le temps d’équilibrage accordé aux animaux pour compenser tout stress potentiel, l’efficacité du mélange de la solution et la précision des concentrations d’une solution contenant du médicament, si la totalité de l’E3 n’est pas éliminée avant l’ajout de la solution de travail. - Ensuite, utilisez une pipette de transfert pour remplir chaque puits de la rangée avec la solution expérimentale. Veillez à ne pas introduire de bulles. Remplissez trop chaque puits (figure 1B).
- À l’aide des bandes de silicone adhésives fabriquées à l’étape 1, appuyez rapidement sur la bande vers le bas (Figure 1C). Cela permet d’éviter la formation de bulles et d’empêcher les poissons de déborder dans les puits adjacents.
- Appuyez fermement sur le dessus de la plaque pour vous assurer que chaque puits est scellé.
- Répétez les étapes 2 à 5 jusqu’à ce que la solution soit remplacée et que les puits de chaque rangée sur deux de la plaque de puits soient scellés (figure 1D).
- Retournez doucement la plaque et vérifiez qu’il n’y a pas de bulles d’air.
REMARQUE : La présence de bulles d’air obscurcira la visualisation du mouvement du poisson-zèbre. - Placez la plaque dans l’unité d’observation du comportement (adhésif silicone vers le bas) et effectuez l’expérience comportementale (voir la section Résultats pour plus de détails).
Résultats
Comparaison avec l’observation traditionnelle en puits ouverts
Afin d’évaluer si l’étanchéité adhésive a un effet sur les mouvements spontanés, une comparaison a été faite entre les témoins dans les puits ouverts et les puits scellés. Comme le montre la figure 2A, aucune différence statistiquement significative dans le mouvement n’a été observée entre ces groupes pour la durée standard de ~30 minutes utilisée dans les expériences décrites dans cet article. Reconnaissant que d’autres paradigmes expérimentaux pourraient nécessiter une exposition expérimentale plus longue, un parcours temporel de 2 heures a été effectué, ne révélant aucune différence statistique de mouvement jusqu’à la marque des 2 heures (voir la figure 2B). Une durée expérimentale plus longue entraînerait probablement une différence de mouvement encore plus grande. Des études antérieures ont quantifié l’effet néfaste de l’hypoxie sur le comportement denage19, compromettant finalement l’intégrité des résultats expérimentaux. Ainsi, on suppose que l’hypoxie et/ou la production de CO2 sont les causes les plus probables de cet écart de MS par rapport aux témoins à ciel ouvert. Malheureusement, le joint étanche aux gaz qui empêche la perte d’anesthésique volatil du puits fermé empêche également la diffusion d’autres gaz dans ou hors de la solution fermée. Cela signifie bien sûr une diffusion limitée duCO2 et de l’oxygène car ils sont respectivement produits et consommés par les poissons. Il s’agit d’une limitation importante par rapport à la durée d’expérimentation possible avec cette méthode. Il est également important de noter qu’avec le temps, de petites bulles commencent à se former dans des puits auparavant sans bulles, probablement en raison du métabolisme. Cependant, lors des tests, ces bulles n’ont pas entravé le suivi du poisson-zèbre par le logiciel. Les expériences allant jusqu’à 1,5 h (plus le temps d’équilibre) ne semblent pas avoir d’effet significatif sur le suivi MS de ces poissons-zèbres de type sauvage, mais les poissons qui présentent plus de mouvement ou qui ont d’autres exigences métaboliques accrues peuvent ne pas convenir à des expériences de cette durée.
Concentration d’anesthésiques volatils dans le temps
Pour assurer une concentration constante d’anesthésique volatil au fil du temps, des puits sans poisson-zèbre ont été utilisés pour mesurer l’évolution temporelle de la concentration d’anesthésique déterminée par HPLC. La même solution a été ajoutée à chaque puits, et la concentration de sévoflurane ou d’isoflurane a été mesurée toutes les 15 minutes pendant 3 h (chaque mesure provenant d’un puits différent, par opposition aux mesures répétées du même puits). Comme on peut le voir sur la figure 3, pratiquement aucun anesthésique n’a été perdu tout au long de la période avec le sévoflurane (pression de vapeur de 197 mmHg à 25 °C), qui a une pression de vapeur plus basse que l’isoflurane (pression de vapeur de 238 mmHg à 25 °C) qui a montré une perte de 4 % à 3 h. Aucun des deux anesthésiques volatils n’a montré de perte appréciable dans l’intervalle de 30 à 60 minutes, ce qui est typique de nombreuses expériences comportementales.
Puissance du sévoflurane chez les larves de poisson-zèbre
Cette technique a été utilisée pour mesurer la puissance des anesthésiques volatils chez le poisson-zèbre15, et peut être supérieure à d’autres méthodologies précédemment utilisées4. La concentration efficace médiane (EC50) pour le sévoflurane par les mesures du mouvement spontané (MS) et du mouvement provoqué (EM) est illustrée à la figure 4. Avec la technique du puits scellé, des valeurs de EC50 de 62 μM (IC à 95 % : 49-81) pour le SM et de 126 μM (IC à 95 % : 81-193) pour l’EM ont été déterminées. La valeur MS est comparable à la CE50 de 76 μM précédemment rapportée (IC à 95 % : 50-114). Cependant, la valeur précédemment rapportée de 240 μM (IC à 95 % : 169-328) pour EM est près du double de la valeur obtenue ici4. Sans effectuer une étude HPLC similaire de cette méthodologie (graisse sous vide et lamelle en verre pour créer un joint étanche à l’air), on ne peut pas dire avec certitude si cette différence est due à une perte d’anesthésique volatil au fil du temps. Cependant, il s’agit d’une hypothèse rationnelle, d’autant plus que le stimulus pour EM (tapage acoustique) est enregistré à la fin du temps d’observation comportementale. Quelle que soit la méthode de scellement du puits, toute perte de concentration de sévoflurane aurait le plus grand effet à des moments ultérieurs. Bien sûr, ces différences pourraient être dues à d’autres facteurs sous-jacents, tels que le patrimoine génétique du poisson-zèbre.
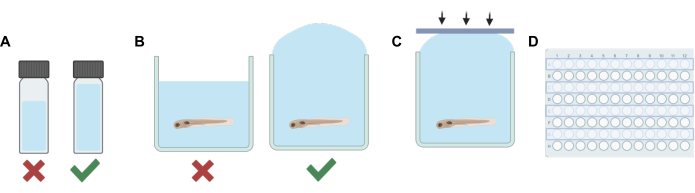
Figure 1 : Principales étapes de la procédure. (A) Lorsque l’on travaille avec des solutions volatiles, la planification de la dilution est effectuée de manière à minimiser l’espace libre dans chaque flacon. (B) Le remplissage excessif des puits est effectué lors de l’ajout de solutions expérimentales à celles contenant du poisson-zèbre pour éliminer les bulles d’air. (C) Des bandes adhésives en silicone sont appliquées d’un côté à l’autre de la plaque pour éviter le piégeage de l’air. (D) Une rangée sur deux est utilisée pour des expériences visant à prévenir la contamination des puits adjacents. Veuillez cliquer ici pour voir une version agrandie de cette figure.
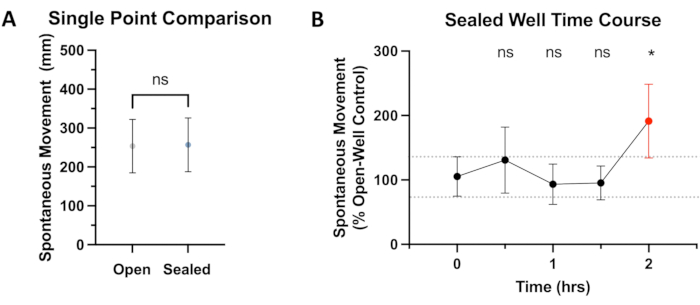
Figure 2 : Comparaison du mouvement dans les puits scellés et ouverts. (A) Le mouvement spontané total de 0 min à 4 min après une équilibration de 15 minutes dans l’unité comportementale est comparé. Le déplacement du poisson-zèbre 5 jours après la fécondation (dpf) dans les puits ouverts (254 mm, IC à 95 % : 185-322) et les puits scellés (257 mm, IC à 95 % : 186-326) ne montre pas de différence significative (P = 0,374). (B) Après une période d’acclimatation de 15 minutes dans le système comportemental du poisson-zèbre, les poissons (N ≥ 36) sont observés pour un mouvement spontané (distance totale parcourue) sur une période de 4 minutes au début de chaque demi-heure. Les données sont présentées sous forme de pourcentage de contrôle (puits ouverts), avec des comparaisons statistiques (ANOVA) effectuées jusqu’au point temporel 0-h. À l’aide d’un seuil de valeur P de <0,05, une différence significative de mouvement entre les puits ouverts et scellés est observée à la marque des 2 h (P = 0,0139), surlignée en rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
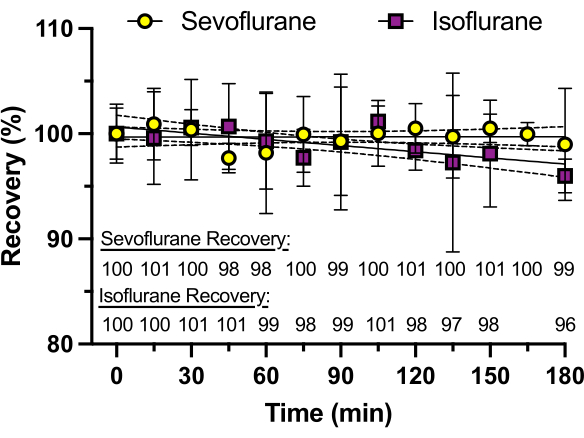
Figure 3 : Récupération du sévoflurane au fil du temps. Les concentrations de sévoflurane et d’isoflurane dans les plaques de verre scellées par un adhésif silicone sont déterminées par chromatographie liquide à haute performance (HPLC) sur une période de 3 heures. Le pourcentage de récupération, calculé comme la moyenne de trois répétitions, est illustré dans la partie inférieure du graphique. L’isoflurane présente une perte de concentration allant jusqu’à 4 % à 3 h, probablement en raison de sa pression de vapeur plus élevée (238 mmHg à 25 °C) que celle du sévoflurane (197 mmHg à 25 °C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
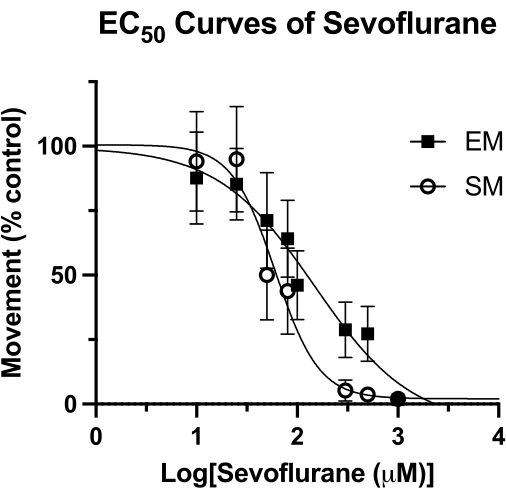
Figure 4 : Courbes du sévoflurane EC50. Une courbe EC50 du sévoflurane dans les puits scellés est déterminée sur la base du mouvement spontané (sur une période de 4 minutes) et du mouvement provoqué (1 seconde après un tapotement acoustique) de 5 dpf de poisson-zèbre. Le mouvement est adapté aux commandes DMSO uniquement. La valeur finale de la CE50 est calculée comme suit : 62 μM (IC à 95 % : 49-81) pour le mouvement spontané (SM) et 126 μM (IC à 95 % : 81-193) pour le mouvement provoqué (EM). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article décrit une méthode permettant d’administrer facilement des anesthésiques volatils, comme le sévoflurane, aux larves de poisson-zèbre, qui a été utilisée pour quantifier le pouvoir anesthésique volatil chez les poissons de type sauvage. Bien que cette technique soit simple sur le plan conceptuel, il faut de la pratique pour assurer une rangée de puits correctement scellée et sans bulles dans un court laps de temps afin de minimiser la perte d’agents volatils. Étant donné que cette méthode est destinée aux composés volatils, elle nécessite non seulement une application soigneuse de l’adhésif silicone sur la plaque de puits, mais également une préparation minutieuse des solutions expérimentales pour optimiser la précision des concentrations de composés volatils.
Le piégeage de l’air peut empêcher une visualisation et un suivi précis. En plus de la pratique du scellement, le remplissage et l’inspection soigneux de chaque puits sont essentiels, car il est peu probable que les bulles présentes avant le scellement soient éliminées pendant le processus de scellement. Le remplissage excessif des puits permet également d’éviter l’emprisonnement de l’air dans chaque puits. Cependant, un débordement trop important peut entraîner le transfert involontaire de poissons dans les puits adjacents. Si cela se produit, essayez de moins remplir. Réduire au minimum le débordement excessif facilitera non seulement le transfert involontaire de poissons vers les puits adjacents, mais pourrait également améliorer l’efficacité de l’adhésif utilisé pour sceller en présence de grandes quantités d’excès de solution. Bien que l’adhésif ait été spécifiquement choisi en partie pour sa capacité à adhérer aux surfaces humides, commencer par une plaque propre et sèche garantit qu’aucune autre substance n’interfère avec l’adhérence, améliorant ainsi l’intégrité globale du dispositif expérimental. Si les bulles persistent malgré l’absence de bulles bien avant l’application de l’adhésif, l’optimisation du surremplissage et la technique d’application de l’adhésif silicone, cela peut être dû à l’utilisation de bandes adhésives trop étroites. Les bandes qui ne sont pas assez larges peuvent ne pas être scellées ou être mal scellées pour empêcher l’introduction d’air pendant ou après le processus d’application. Une autre introduction potentielle d’erreur avec cette technique est la qualité de l’étanchéité produite par les bandes de silicone adhésives, qui peut être causée par des plis dans le silicone, une étanchéité inadéquate de l’adhésif (apprêt adhésif insuffisant, temps de durcissement ou nettoyage des surfaces avant l’application du silicone). Bien que l’adhésif lui-même semble fournir un joint suffisamment étanche, sans le silicone comme support protecteur, l’adhésif seul peut ne pas fournir une résistance à l’eau adéquate pour protéger contre le bain d’eau en circulation pendant la durée d’une expérience.
Les plaques de verre sont bien adaptées à cette application car, contrairement à de nombreux plastiques20, elles sont compatibles avec les substances hydrophobes comme les anesthésiques volatils, leur surface est plate (contrairement aux plaques en plastique typiques), permettant l’adhérence de la bande de silicone, et ont des fonds transparents (contrairement au téflon et à certaines plaques en plastique). Les plaques de puits de quartz peuvent offrir une clarté optique accrue pour les expériences où une imagerie à plus haute résolution est justifiée. Tous les exemples de données présentés ici ont été obtenus dans des plaques de verre à 96 puits, et d’autres plaques similaires sont disponibles dans le commerce dans des formats de puits plus grands, mais celles-ci n’ont pas été testées par les auteurs. Un plus grand nombre de solutions dans un puits plus grand peut augmenter la durée potentielle d’une expérience avec cette technique en raison d’une plus grande disponibilité de l’oxygène et peut également faciliter les expériences avec des poissons-zèbres plus anciens, mais la modification d’une expérience de cette manière nécessiterait une validation supplémentaire. D’autres modifications de cette technique incluent l’application de cette technique à d’autres paradigmes comportementaux (par exemple, des stimuli tels que la lumière)21, divers modèles génétiques, d’autres types d’études pharmacologiques (par exemple, l’administration concomitante de médicaments), et peut-être même l’adaptation pour des études d’imagerie.
Cette méthode fournit une méthode simple et accessible pour l’administration de composés volatils au poisson-zèbre à des fins d’observation comportementale. Le poisson-zèbre est un modèle de plus en plus populaire pour l’étude des anesthésiques, en particulier des anesthésiques intraveineux (IV) (propofol, étomidate, kétamine, etc.). Cela s’explique en partie par la facilité d’administration des médicaments, mais il y a aussi des considérations pharmacocinétiques réduites par rapport à l’administration d’anesthésiques IV à des modèles animaux non aquatiques (vers, mouches, rongeurs, humains, etc.) qui nécessitent des modèles de perfusion contrôlés par cible pour une administration à l’état d’équilibre2. Ceci est comparable à l’administration d’agents volatils chez ces animaux, ce qui est aussi simple que de mettre l’animal dans une boîte et de lui faire respirer l’agent mélangé à de l’oxygène et de l’air. L’administration d’agents volatils aux animaux aquatiques (poissons-zèbres, têtards) est plus compliquée puisqu’elle nécessite un environnement aqueux scellé. Cette différence tend à diviser l’utilisation de certains modèles animaux pour certains anesthésiques, mais avec la méthode présentée ici, les deux classes d’anesthésiques peuvent être facilement administrées au même modèle animal. Être capable de comparer facilement divers paradigmes expérimentaux dans un seul modèle malgré des voies d’administration disparates. Cela pourrait également être adapté à l’utilisation d’anesthésiques volatils d’une manière qui utilise les autres forces du poisson-zèbre, y compris leur traçabilité génétique, leur développement rapide et leurs embryons transparents, qui facilitent l’observation en temps réel des réponses physiologiques. Comprendre l’impact des anesthésiques volatils, tels que l’isoflurane et le sévoflurane, chez le poisson-zèbre peut améliorer la compréhension de leurs mécanismes d’action et de leurs effets secondaires. Cette nouvelle méthodologie fournit un cadre solide pour l’étude des anesthésiques volatils chez le poisson-zèbre.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été financé par la Fondation pour l’enseignement et la recherche en anesthésie (FAER). La figure 1 est créée en BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
Références
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon